Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Indikationer
Translarna är avsett för behandling av Duchennes muskeldystrofi, som orsakas av en nonsensmutation i dystrofingenen, hos rörliga patienter 2 år och äldre (se avsnitt Farmakodynamik).
Närvaron av en nonsensmutation i dystrofingenen ska fastställas genom genetisk testning (se avsnitt Varningar och försiktighet).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Samtidig användning av intravenösa aminoglykosider (se avsnitt Varningar och försiktighet och Interaktioner).
Dosering
Behandling med Translarna ska endast sättas in av specialistläkare med erfarenhet av behandling av Duchenne och Beckers muskeldystrofi.
Dosering
Ataluren ska administreras oralt varje dag i 3 doser.
Den första dosen ska tas på morgonen, den andra dosen mitt på dagen och den tredje dosen på kvällen. Rekommenderade doseringsintervall är 6 timmar mellan doserna på morgonen och mitt på dagen, 6 timmar mellan doserna mitt på dagen och kvällen, och 12 timmar mellan dosen på kvällen och den första dosen nästa dag.
Den rekommenderade dosen är 10 mg/kg kroppsvikt på morgonen, 10 mg/kg kroppsvikt mitt på dagen, och 20 mg/kg kroppsvikt på kvällen (för en total daglig dos på 40 mg/kg kroppsvikt).
Translarna är tillgängligt som dospåsar på 125 mg, 250 mg eller 1 000 mg. Tabellen nedan ger information om vilken styrka på dospåsen/-påsarna som ska användas för att förbereda den rekommenderade dosen enligt kroppsviktsintervall.
|
Viktintervall (kg) |
Antal dospåsar |
|||||||||
|
Morgon |
Lunch |
Kväll |
||||||||
|
125 mg dospåsar |
250 mg dospåsar |
1 000 mg dospåsar |
125 mg dospåsar |
250 mg dospåsar |
1 000 mg dospåsar |
125 mg dospåsar |
250 mg dospåsar |
1 000 mg dospåsar |
||
|
12 |
14 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
0 |
|
15 |
16 |
1 |
0 |
0 |
1 |
0 |
0 |
1 |
1 |
0 |
|
17 |
20 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
|
21 |
23 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
1 |
0 |
|
24 |
26 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
2 |
0 |
|
27 |
31 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
|
32 |
35 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
2 |
0 |
|
36 |
39 |
1 |
1 |
0 |
1 |
1 |
0 |
0 |
3 |
0 |
|
40 |
44 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
3 |
0 |
|
45 |
46 |
0 |
2 |
0 |
0 |
2 |
0 |
1 |
3 |
0 |
|
47 |
55 |
0 |
2 |
0 |
0 |
2 |
0 |
0 |
0 |
1 |
|
56 |
62 |
0 |
2 |
0 |
0 |
2 |
0 |
0 |
1 |
1 |
|
63 |
69 |
0 |
3 |
0 |
0 |
3 |
0 |
0 |
1 |
1 |
|
70 |
78 |
0 |
3 |
0 |
0 |
3 |
0 |
0 |
2 |
1 |
|
79 |
86 |
0 |
3 |
0 |
0 |
3 |
0 |
0 |
3 |
1 |
|
87 |
93 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
3 |
1 |
|
94 |
105 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
2 |
|
106 |
111 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
2 |
|
112 |
118 |
0 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
2 |
|
119 |
125 |
0 |
1 |
1 |
0 |
1 |
1 |
0 |
2 |
2 |
Fördröjd eller missad dos
Vid en fördröjning av administreringen av ataluren på mindre än 3 timmar efter doserna på morgonen eller mitt på dagen, eller mindre än 6 timmar efter kvällsdosen, ska dosen tas utan några förändringar av efterföljande doseringsschema. Vid en fördröjning på mer än 3 timmar efter doserna på morgonen eller mitt på dagen, eller mer än 6 timmar efter kvällsdosen, ska dosen inte tas, och patienterna ska fortsätta sitt vanliga doseringsschema. Patienterna ska inte ta en dubbel eller extra dos om en dos missas. Det är viktigt att administrera korrekt dos. Ökning av dosen över den rekommenderade dosen kan eventuellt associeras med minskad effekt.
Särskilda populationer
Äldre
Säkerheten och effekten av ataluren för patienter 65 år och äldre har ännu inte fastställts (se avsnitt Farmakokinetik).
Nedsatt njurfunktion
Ingen dosjustering är nödvändig till patienter med lätt till måttligt nedsatt njurfunktion. Behandling av patienter med gravt nedsatt njurfunktion (eGFR < 30 ml/min) eller kronisk njursvikt rekommenderas inte (se avsnitt Varningar och försiktighet och Farmakokinetik).
Nedsatt leverfunktion
Ingen dosjustering är nödvändig till patienter med lätt, måttligt eller gravt nedsatt leverfunktion (se avsnitt Farmakokinetik).
Pediatrisk population
Pediatriska patienter med en kroppsvikt ≥ 12 kg behandlas enligt doseringsrekommendationerna enligt viktintervall (se ovanstående doseringstabell). Rekommenderad dos är densamma för alla åldersintervall, dvs. 10 mg/kg kroppsvikt på morgonen, 10 mg/kg kroppsvikt mitt på dagen och 20 mg/kg kroppsvikt på kvällen (med en total daglig dos på 40 mg/kg kroppsvikt).
Säkerheten och effekten av Translarna för barn <12 kg och från 6 månader till 2 år har ännu inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Translarna ska administreras oralt efter det blandats till en suspension i vätska eller i halvfast mat. Dospåsarna bör endast öppnas när dosen ska beredas. Hela innehållet i varje dospåse bör blandas med minst 30 ml vätska (vatten, mjölk, fruktjuice), eller 3 matskedar halvfast mat (yoghurt eller äppelmos). Den beredda dosen ska blandas väl före administrering. Mängden vätska eller halvfast mat kan ökas baserat på patientens preferens. Patienterna ska ta hela dosen.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Patienter som inte har en nonsensmutation
Patienterna måste ha en med genetisk testning fastställd nonsensmutation i dystrofingenen som en del av sitt underliggande sjukdomstillstånd. Patienter som inte har en nonsensmutation ska inte ta ataluren.
Nedsatt njurfunktion
En ökad atalurenexponering och ökad mängd atalurenmetabolit har rapporterats hos patienter med gravt nedsatt njurfunktion (eGFR < 30 ml/min). Metabolitens toxicitet är inte känd. Högre atalurenexponering associerades med potentiell minskad effekt. Patienter med gravt nedsatt njurfunktion eller kronisk njursvikt ska därför endast behandlas med ataluren om den förväntade kliniska nyttan överväger den potentiella risken, och ska övervakas noggrant med avseende på eventuell metabolittoxicitet och minskad effekt. En lägre atalurendos ska övervägas.
Behandling ska inte sättas in hos tidigare obehandlade patienter med eGFR < 30 ml/min (se avsnitt Dosering och Farmakokinetik).
Förändringar i lipidprofilen
På grund av rapporter om förändringar i lipidprofilen (ökade triglycerider och kolesterol) för vissa patienter i kliniska prövningar, rekommenderas att totalt kolesterol, LDL, HDL och triglycerider övervakas på årlig basis hos nmDMD-patienter (nonsensmutation Duchennes muskeldystrofi) som får ataluren, eller oftare enligt behov baserat på patientens kliniska tillstånd.
Hypertension vid samtidig systemisk kortikosteroidbehandling
Eftersom det i kliniska prövningar rapporterades hypertension för vissa patienter vid samtidig användning av systemiska kortikosteroider, rekommenderas att vilande systoliskt och diastoliskt blodtryck mäts var sjätte månad hos nmDMD-patienter som får ataluren samtidigt med kortikosterioder, eller oftare enligt behov, baserat på patientens kliniska tillstånd.
Övervakning av njurfunktion
Eftersom små ökningar av genomsnittligt serumkreatinin, blodureakväve (BUN), och cystatin C observerades i kontrollerade studier av nmDMD, rekommenderas att serumkreatinin, BUN, och cystatin C mäts var sjätte till var tolfte månad hos nmDMD-patienter som får ataluren, eller oftare enligt behov, baserat på patientens kliniska tillstånd.
Potentiella interaktioner med andra läkemedel
Försiktighet ska iakttas när ataluren samadministreras med läkemedel som är inducerare av UGT1A9, eller substrat för OAT1 eller OAT3 (se avsnitt Interaktioner).
Aminoglykosider
Aminoglykosider har visats minska genomläsningsaktiviteten hos ataluren in vitro. Dessutom visade sig ataluren öka nefrotoxiciteten hos intravenösa aminoglykosider. Samadministrering av dessa läkemedel med ataluren ska undvikas (se avsnitt Kontraindikationer). Eftersom den mekanism genom vilken ataluren ökar nefrotoxicitet av intravenösa aminoglykosider inte är känd, rekommenderas inte samtidig användning av andra nefrotoxiska läkemedel med ataluren. Om detta är oundvikligt (t.ex. vancomycin för behandling av MRSA) rekommenderas noggrann övervakning av njurfunktionen (se avsnitt Interaktioner)
Interaktioner
Aminoglykosider
Ataluren ska inte samadministreras med intravenösa aminoglykosider, baserat på fall av nedsatt njurfunktion som observerats i en klinisk prövning med patienter med nmCF (se avsnitt Kontraindikationer).
Förhöjning av serumkreatinin inträffade hos flera nmCF-patienter som behandlades med ataluren och intravenösa aminoglykosider tillsammans med andra antibiotika för exacerbationer av cystisk fibros. Förhöjningen av serumkreatinin försvann i alla fallen vid utsättning av den intravenösa aminoglykosiden, och antingen fortsatt behandling med eller avbrytande av Translarna. Dessa fynd talar för att samadministrering av Translarna och intravenösa aminoglykosider kan förstärka den nefrotoxiska effekten av aminoglykosiderna. Om behandling med intravenösa aminoglykosider är nödvändig ska därför behandlingen med Translarna stoppas och kan återupptas 2 dagar efter att administrering av aminoglykosiden har avslutats. Effekten av samadministrering av ataluren med andra nefrotoxiska läkemedel är inte känd.
Dehydrering kan vara en bidragande orsak i vissa av dessa fall. Patienter ska bibehålla adekvat hydrering medan de tar ataluren (se avsnitt Varningar och försiktighet).
Effekt av andra läkemedel på atalurens farmakokinetik
Baserat på in vitro-studier, är ataluren ett substrat av UGT1A9. Samadministrering med rifampicin, en stark inducerare av metabola enzymer inkluderande UGT1A9, sänkte atalurenexponering med 29 %. Betydelsen av dessa fynd för människa är okänd. Försiktighet ska iakttas när ataluren samadministreras med läkemedel som är inducerare av UGT1A9 (t.ex. rifampicin).
Effekt av ataluren på farmakokinetiken för andra läkemedel
Baserat på in vitro-studier, har ataluren potential att hämma UGT1A9, organisk anjontransportör 1 (OAT1), organisk anjontransportör 3 (OAT3) och organisk anjontransporterande polypeptid 1B3 (OATP1B3). Samadministrering av ataluren med mykofenolatmofetil till friska försökspersoner påverkade inte exponeringen av dess aktiva metabolit, mykofenolsyra (ett substrat för UGT1A). Ingen dosjustering är nödvändig vid samadministrering av ataluren med läkemedel som är substrat för UGT1A9.
I en klinisk studie för att utvärdera atalurens potential att hämma OATP1B3:s transportsystem med hjälp av en enkel 80 mg dos telmisartan, ett in vitro, selektivt substrat för OATP1B3, ökade ataluren exponeringen för telmisartan med 28 %. Denna effekt anses inte vara kliniskt relevant. Emellertid, denna effekstorlek kan vara större för 40 mg dosen av telmisartan. Därför ska försiktighet iakttas när ataluren samadministreras med läkemedel som är substrat för OAT1 eller OATP1B3 på grund av risken för ökad koncentration av dessa läkemedel (t.ex. oseltamivir, aciklovir, kaptopril, furosemid, bumetanid, valsartan, pravastatin, rosuvastatin, atorvastatin, pitavastatin).
Försiktighet ska iakttas när ataluren samadministreras med OAT3-substrat (t.ex. ciprofloxacin), särskilt OAT3-substrat med smalt terapeutiskt fönster. I en klinisk studie var graden av exponering för ciprofloxacin 32 % högre i närvaro av ataluren. I en separat klinisk studie var graden av exponering för adefovir 60 % högre i närvaro av ataluren. Försiktighet ska iakttas när ataluren samadministreras med adefovir.
Baserat på in vitro-studierna, förväntas ataluren inte vara en hämmare av varken p-gp-medierad transport eller cytokrom P450-medierad metabolism. På liknande sätt förväntas inte ataluren in vivo vara inducerare av cytokrom P450-isoenzymer.
Samadministrering av kortikosteroider (deflazakort, prednison, eller prednisolon) med ataluren påverkade inte koncentrationerna av ataluren i plasma. Ingen kliniskt relevant förändring i plasmakoncentrationerna av kortikosteroider sågs vid samadministrering av ataluren. Dessa data indikerar ingen uppenbar läkemedelsinteraktion mellan kortikosteroider och ataluren och inga dosjusteringar krävs.
Läkemedel som påverkar p-glykoproteintransportören
In vitro är ataluren inte ett substrat för p-glykoproteintransportören. Farmakokinetiken för ataluren påverkas troligen inte av läkemedel som hämmar p-glykoproteintransportören.
Graviditet
Det finns inte tillräckliga uppgifter om användning av ataluren hos gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter endast vid doser som resulterade i moderstoxicitet (se avsnitt Prekliniska uppgifter).
Som en försiktighetsåtgärd rekommenderas att man undviker användning av ataluren under graviditet.
Amning
Det är okänt om ataluren/metaboliter utsöndras i bröstmjölken. Tillgängliga
farmakodynamiska/toxikologiska djurdata har visat att metaboliter från ataluren utsöndras i mjölk (se avsnitt Prekliniska uppgifter). En risk för det ammade nyfödda barnet/spädbarnet kan inte uteslutas.
Amning ska avbrytas under behandling med ataluren.
Fertilitet
Icke-kliniska data baserat på en standardstudie av han- och honfertilitet hos råttor avslöjade ingen risk för människor (se avsnitt Prekliniska uppgifter).
Trafik
Effekten av ataluren på förmågan att köra bil, att cykla eller att använda maskiner har inte testats. Patienter som upplever yrsel ska iaktta försiktighet när de kör bil, cyklar eller använder maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerhetsprofilen för ataluren är baserad på sammanslagna data från två randomiserade, dubbelblinda, 48-veckors placebokontrollerade studier av sammanlagt 232 manliga patienter med Duchennes muskeldystrofi (nmDMD), orsakat av en nonsensmutation, som behandlats vid den rekommenderade dosen på 40 mg/kg/dag (10, 10, 20 mg/kg, n = 172) eller vid en dos på 80 mg/kg/dag
(20, 20, 40 mg/kg; n = 60), jämfört med placebobehandlade patienter (n = 172).
De vanligaste biverkningarna i de två placebokontrollerade studierna var kräkningar, diarré, illamående, huvudvärk, smärta i övre buken och väderspänningar, där alla förekom hos ≥ 5 % av alla ataluren-behandlade patienter. I båda studierna avbröt 1/232 (0,43 %) patienter som behandlades med ataluren på grund av biverkningen förstoppning och 1/172 (0,58 %) placebopatienter avbröt behandlingen på grund av biverkningen, sjukdomsprogression (förlust av rörlighet).
En öppen studie genomfördes med patienter i åldern 2‑5 år (n = 14) för att utvärdera farmakokinetik och säkerhet för ataluren. En högre frekvens av sjukdomskänsla (7,1 %), pyrexi (42,9 %), öroninfektion (28,6 %) och utslag (21,4 %) rapporterades hos patienter i åldern 2‑5 år jämfört med patienter i åldern 5 år och äldre. Dessa tillstånd rapporterades emellertid oftare hos yngre barn i allmänhet. Säkerhetsdata efter 28 veckors behandling visade en liknande säkerhetsprofil för ataluren hos patienter i åldern 2‑5 år jämfört med patienter i åldern 5 år och äldre.
Biverkningarna var generellt lindriga eller måttliga i svårighetsgrad och inga allvarliga behandlingsrelaterade allvarliga biverkningar rapporterades bland ataluren-behandlade patienter i dessa två studier.
Tabellerad lista över biverkningar
De biverkningar som rapporterats hos patienter med nmDMD behandlade med den rekommenderade dagliga dosen på 40 mg/kg/dag ataluren i de två placebokontrollerade studierna visas i Tabell 1. Biverkningar som rapporterats hos
> 1 patient i 40 mg/kg/dag-gruppen, vid en större frekvens än placebogruppen, presenteras enligt MedDRA klassificering av organsystem, föredragen term samt frekvens. Frekvensgrupperingarna definieras enligt följande överenskommelse: mycket vanliga (≥ 1/10) och vanliga (≥ 1/100, < 1/10).
Tabell 1. Biverkningar som rapporterats hos > 1 ataluren-behandlade patienter med nmDMD, vid en större frekvens än placebo i de två placebokontrollerade studierna (sammanslagen analys)
|
Klassificering av organsystem |
Mycket vanliga |
Vanliga |
Ingen känd frekvens |
|---|---|---|---|
|
Metabolism och nutrition |
Minskad aptit, hypertriglyceridemi |
Förändring i lipidprofilen (ökade triglycerider och kolesterol) |
|
|
Centrala och perifera nervsystemet |
|
Huvudvärk | |
|
Blodkärl |
Hypertoni | ||
|
Andningsvägar, bröstkorg och mediastinum |
Hosta, epistaxis | ||
|
Magtarmkanalen |
Kräkningar |
Illamående, smärta i övre buken, väderspänningar, magbesvär, förstoppning | |
|
Hud och subkutan vävnad |
Erytem/utslag | ||
|
Muskuloskeletala systemet och bindväv |
Smärta i extremitet, muskuloskeletal bröstsmärta | ||
|
Njurar och urinvägar |
Hematuri, enuresis |
Förändring av njurfunktionstester (ökat kreatinin, blodureakväve, cystatin C) |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Pyrexi, viktminskning |
I en 48-veckors öppen förlängningsstudie av patienter med nmDMD som var rörliga eller icke-rörliga påvisades en liknande säkerhetsprofil. Data över långtidssäkerhet är inte tillgängliga.
Beskrivning av utvalda biverkningar (laboratorieavvikelser)
Serumlipider
En ökning av lipider, dvs. kolesterol och triglycerider, i serum observerades. Det har förekommit fall där denna ökning till onormalt höga värden har observerats redan efter 4 veckor.
Njurfunktionstester
Under de randomiserade, placebokontrollerade studierna, observerades små ökningar i genomsnittlig serumkreatinin, (BUN) och cystatin C. Värdena tenderade att stabiliseras tidigt i studien och ökade inte ytterligare med fortsatt behandling.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Friska försökspersoner, som fick en enda oral dos av 200 mg/kg ataluren, upplevde övergående, låggradiga symptom på huvudvärk, illamående, kräkningar och diarré. Inga allvarliga biverkningsreaktioner observerades hos dessa försökspersoner. I händelse av en misstänkt överdos, ska stödjande medicinsk vård sättas in, inklusive råd från en läkare samt noggrann observation av patientens kliniska tillstånd.
Farmakodynamik
Verkningsmekanism
En nonsensmutation i DNA resulterar i en prematur stoppkodon inom ett mRNA. Denna prematura stoppkodon i mRNA orsakar sjukdom genom att avbryta translationen innan ett protein av full längd har genererats. Ataluren möjliggör ribosomal genomläsning av mRNA som innehåller en sådan prematur stoppkodon, vilket resulterar i framställning av ett protein av full längd.
Farmakodynamisk effekt
Icke-kliniska in vitro-studier av nonsensmutation med cellulära analyser och fisklarver som odlats i en atalurenlösning, visade att ataluren möjliggjorde ribosomal genomläsning med ett klockformat (upp och nedvänd U-form) koncentrations-responsförhållande. Man antar att in vivo dosreponsförhållandet också kan vara klockformat, men in vivo-data var för begränsad för att bekräfta denna hypotes i en musmodell av nmDMD och hos människor.
Icke-kliniska in vitro-studier talar för att kontinuerlig exponering för ataluren kan vara viktig för att maximera aktiviteten och att effekterna av den aktiva substansen på ribosomal genomläsning av prematura stoppkodoner upphävs kort efter utsättning av ataluren.
Klinisk effekt och säkerhet
Effekten och säkerheten av Translarna bedömdes i två randomiserade, dubbelblinda, placebokontrollerade prövningar med nmDMD. Det primära effektmåttet i båda prövningarna var förändring av 6 minuters gångsträcka (6MWD) vid Vecka 48. Andra effektmått, som inkluderades i båda prövningarna, var tid till ihållande 10 % försämring av 6MWD, ändring i tid för att springa/gå 10 meter vid Vecka 48, ändring i tid för att gå uppför 4 trappor vid Vecka 48 och ändring i tid för att gå nedför 4 trappor vid Vecka 48. Patienterna måste ha dokumenterad bekräftelse av närvaro av en nonsensmutation i dystrofingenen, som fastställts med gensekvensering.
Studie 1 utvärderade 174 manliga patienter, från 5 till 20 år. Alla patienter var tvungna att kunna gå ≥ 75 meter utan behov av hjälpmedel under ett 6 minuters gångtest (6MWT) vid screening. Majoriteten av patienterna i alla behandlingsgrupper var kaukasiska (90 %). Patienterna randomiserades i ett förhållande på 1:1:1 och fick ataluren eller placebo 3 gånger per dag (morgonen, mitt på dagen och kvällen), där 57 fick ataluren 40 mg/kg/dag (10, 10, 20 mg/kg), 60 fick ataluren 80 mg/kg/dag
(20, 20, 40 mg/kg), och 57 fick placebo.
I Studie 1 visade en post hoc-analys av det primära effektmåttet att från baslinjen till vecka 48, hade patienter som fått ataluren 40 mg/kg/dag en 12,9 meter genomsnittlig minskning av 6MWD, och patienter som fick placebo hade en 44,1 meter genomsnittlig minskning av 6MWD (Figur 1). Sålunda var den genomsnittliga förändringen 31,3 meter bättre i ataluren 40 mg/kg/dag-armen än i placeboarmen
(p = 0,056) i observerad 6MWD från baslinjen till vecka 48. I en statistisk modellskattning var den genomsnittliga förändringen 31,7 meter (justerat p=0,0367). Ingen skillnad förekom mellan ataluren 80 mg/kg/dag och placebo.
Dessa resultat indikerar att ataluren 40 mg/kg/dag fördröjer förlusten av gångförmåga hos nmDMD-patienter.
Figur 1. Genomsnittlig förändring i 6-minuters gångtestet (Studie 1)
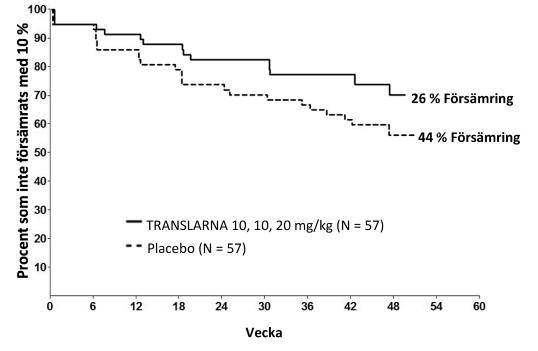
En post-hoc-analys av tiden till ihållande 10 % försämring av 6MWD, visade att 26 % av patienterna i ataluren 40 mg/kg-armen hade framskridit vid vecka 48, jämfört med 44 % i placebogruppen (p = 0,0652) (Figur 2). Det förekom ingen skillnad mellan ataluren 80 mg/kg/dag och placebo. Dessa resultat indikerar att färre patienter som fick ataluren 40 mg/kg/dag försämrades i 6MWD över 48 veckor.
Figur 2. Kaplan-Meier-kurva av tid till ihållande 10 % försämring av 6MWD (Studie 1)
I tidtagna funktionstester (TFT), tester av tid att springa/gå 10 meter, tid att gå uppför 4 trappor, och tid att gå nedför 4 trappor, visade ataluren-behandlade patienter mindre ökning av den tid det tar att springa/gå 10 meter, gå uppför 4 trappor och gå nedför 4 steg, vilket indikerar långsammare nmDMD-progression jämfört med placebo.
Den genomsnittliga förändringen i tidtagna funktionstester från baslinjen till vecka 48 var bättre i ataluren 40 mg/kg/dag-armen än placebo i tid för att springa/gå 10 meter (bättre med 1,5 sekunder), tid att gå uppför 4 trappor (bättre med 2,4 sekunder), och tid att gå nedför 4 trappor (bättre med 1,6 sekunder), Figur 3.
Figur 3. Genomsnittlig förändring i tidtagna funktionstester (Studie 1)
6MWD-resultat hos patienter med en 6MWD < 350 meter vid baslinjen
Hos patienter med en 6MWD som var < 350 meter vid baslinjen var den genomsnittliga förändringen 68 meter bättre i ataluren 40 mg/kg/dag-armen än i placeboarmen (p = 0,0053) i observerad 6MWD från baslinjen till vecka 48.
Hos dessa patienter var den genomsnittliga förändringen i tidtagna funktionstester från baslinjen till vecka 48 bättre i ataluren 40 mg/kg/dag-armen än placebo i tid för att springa/gå 10 meter (bättre med 3,5 sekunder), tid att gå uppför 4 trappor (bättre med 6,4 sekunder), och tid att gå nedför 4 trappor (bättre med 5,0 sekunder).
Studie 2 utvärderade 230 manliga patienter, från 7 till 14 år. Alla patienter var tvungna att kunna gå ≥ 150 meter och mindre än 80 % av förutspått max utan behov av hjälpmedel under ett 6MWT vid screening. Majoriteten av patienterna i båda behandlingsgrupper var kaukasiska (76%). Patienterna randomiserades i förhållandet 1:1 och fick ataluren 40 mg/kg/dag (n = 115) eller placebo (n = 115) 3 gånger per dag (morgonen, mitt på dagen och kvällen).
Ataluren-behandlade patienter upplevde klinisk nytta mätt som numeriskt gynnsamma skillnader jämfört med placebo över de primära och sekundära effektmåtten. Eftersom det primära effektmåttet (förändring av 6MWD från baslinjen till Vecka 48) inte uppnådde statistisk signifikans (p ≤ 0,05), bör alla andra p-värden betraktas som nominella.
I ITT-populationen var skillnaden mellan ataluren- och placebogrupperna i genomsnittlig förändring av observerad 6MWD från baslinjen till Vecka 48 15,4 meter bättre i ataluren 40 mg/kg/dag-gruppen än i placebogruppen. I en statistisk modellskattning var den genomsnittliga förändringen 13,0 meter (p = 0,213), Figur 4. Separationen mellan ataluren och placebo bibehålls från Vecka 16 till slutet av studien.
Figur 4. Genomsnittlig förändring i 6 minuters gångsträcka (Studie 2)
Över 48 veckor visade ataluren-behandlade patienter mindre försämring i muskelfunktion, vilket framgår av mindre ökningar i tid att springa/gå 10 meter, gå uppför 4 trappsteg och gå nedför 4 trappsteg i den ataluren-behandlade gruppen jämfört med placebo. De skillnader som gynnar ataluren jämfört med placebo i genomsnittliga förändringar i tidtagna funktionstester vid Vecka 48 i ITT-populationen nådde tröskelvärdet för en kliniskt betydelsefull skillnad (ändringar ca 1 till 1,5 sekunder).
Den genomsnittliga förändringen i tidtagna funktionstester från baslinjen till vecka 48 var bättre i ataluren 40 mg/kg/dag-armen än placebo i observerad tid för att springa/gå 10 meter (bättre med 1,2 sekunder, p = 0,117), tid att gå uppför 4 trappor (bättre med 1,8 sekunder, p = 0,058), och tid att gå nedför 4 trappor (bättre med 1,8 sekunder, p = 0,012), Figur 5.
Figur 5. Genomsnittlig förändring i tidtagna funktionstester (Studie 2)
Tid till 10 % försämring i 6MWD definierades som den sista gången som 6MWD inte var 10 % sämre än vid baslinjen. I ITT-populationen var riskförhållandet för ataluren jämfört med placebo 0,75 (p = 0,160), som representerar en 25 % minskning av risken för 10 % försämring i 6MWD.
Pediatrisk population
Säkerhet, farmakokinetik och explorativ effekt för Translarna bedömdes i en öppen studie med barn mellan 2 och 5 år med nmDMD. Effekten för Translarna hos barn i åldern 2‑5 år har fastställts med extrapolering från patienter > 5 år.
I det kliniska programmet som undersökte effekten och säkerheten av monoterapeutisk behandling med ataluren hos patienter med cystisk fibros orsakad av nonsensmutation observerades ingen statistiskt signifikant effekt i de primära och viktiga sekundära kliniska utfallsmåtten (ppFEV1 och frekvens av försämrad lungfunktion) hos vuxna och barn sex år gamla eller äldre.
En öppen explorativ studie (studie 045) genomfördes på 20 patienter med Duchennes muskeldystrofi med nonsensmutation (nmDMD) i åldern 2 till 7 år för att utforska kvantitativa nivåer av dystrofin i muskelvävnad före och efter 40 veckors behandling med ataluren. Dystrofin mättes med elektrokemiluminiscens (ECL) och immunhistokemiska (IHC) analyser. Från varje patient togs tre nålbiopsier från gastrocnemius och tibialis anterior vid baslinjen och vid avslutad behandling. Studie 045 inkluderade även bedömning av funktionella resultat (d.v.s. den reviderade gångbedömningen North Star Ambulatory Assessment [rNSAA] och funktionstester på tid [Timed Function Test, TFTs]).
Vid baslinjen var medianvärdet för dystrofinnivåer uppmätt med ECL 0,42 % av normalvärdet (intervall 0,00 % till 41,85 %). Vid studiens slut var medianvärdet för dystrofinnivå 0,33 % av normalvärdet (intervall 0,04 % till 48,55 %).
För IHC var medianandelen positiva fibrer vid baslinjen 73 % (intervall 0,42 % till 99,6 %). Vid studiens slut var medianandelen positiva fibrer 66 % (intervall 0,51 % till 99,77 %).
Vid studiens slut var den genomsnittliga (medianvärdet) försämringen från baslinjen på rNSAA-skalan 0,1 (1,0) poäng i totala poäng och den genomsnittliga (medianvärdet) förändringen från baslinjen för tiden för att resa sig från liggande till stående, springa eller gå 10 meter, gå uppför fyra trappor och gå nedför fyra trappor var ‑1,56 (‑0,6), ‑0,41 (‑0,35), ‑1,09 (‑0,5) respektive ‑2,43 (‑0,7) sekunder.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för ataluren för två grupper av den pediatriska populationen, från födelsen till yngre än 28 dagar och spädbarn från 28 dagar till yngre än 6 månader, för nmDMD som definieras i gällande Paediatric Investigation Plan (PIP), för godkänd indikation (information om pediatrisk användning finns i avsnitt Dosering).
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för ataluren för gruppen av den pediatriska populationen med åldern 6 månader till yngre än 2 år för nmDMD som definieras i gällande Paediatric Investigation Plan (PIP), för godkänd indikation (information om pediatrisk användning finns i avsnitt Dosering).
Detta läkemedel har fått ett ”villkorat godkännande för försäljning”. Detta innebär att det ska komma fler uppgifter om läkemedlet.
Europeiska läkemedelsmyndigheten går igenom ny information om detta läkemedel minst varje år och uppdaterar denna produktresumé när så behövs.
Farmakokinetik
Administrering av ataluren på kroppsviktjusterad basis (mg/kg) resulterade i liknande steady-state exponeringar (AUC) bland barn och ungdomar med nmDMD över ett brett intervall av kroppsvikter. Även om ataluren är praktiskt taget olöslig i vatten, absorberas det lätt efter oral administrering som en suspension.
Allmänna egenskaper för ataluren efter administrering
Absorption
Topplasmanivåer av ataluren uppnås ca 1,5 timmar efter dosering hos patienter som fick läkemedlet inom 30 minuter efter en måltid. Baserat på återvinning av radioaktivitet i urin i en enkeldosstudie av radiomärkt ataluren, uppskattas den orala biotillgängligheten av ataluren att vara ≥ 55 %. Koncentrationer av ataluren i plasma vid steady state ökar proportionellt med ökande dos. Koncentrationer i plasma vid steady state är dosproportionella för atalurendoser mellan 10 och 50 mg/kg, och ingen ackumulering observeras efter upprepad dosering.
Distribution
In vitro är ataluren till 99,6 % bundet till humana plasmaproteiner och bindningen är oberoende av plasmakoncentration. Ataluren distribueras inte till röda blodkroppar.
Metabolism
Ataluren metaboliseras genom konjugering via uridindifosfatglukuronosyltransferas- (UGT) enzymer, huvudsakligen UGT1A9 i lever, tarmar och njurar.
In vivo var den enda metaboliten som detekterades i plasma efter oral administrering av radiomärkt ataluren ataluren-O-1β-acylglukuronid; exponering för denna metabolit hos människor var ca 8 % av plasma-AUC av ataluren.
Eliminering
Halveringstiden för ataluren i plasma varierar från 2 till 6 timmar och påverkas varken av dos eller av upprepad administrering. Elimineringen av ataluren är troligen beroende av glukuronidering av ataluren i lever och renal, följt av renal och hepatisk utsöndring av den resulterande glukuronidmetaboliten.
Efter en enkel oral dos av radiomärkt ataluren, återvanns ca hälften av den administrerade radioaktiva dosen från avföringen, och resten återvanns från urinen. I urinen utgör oförändrad ataluren och acylglukuronidmetaboliten < 1 % respektive 49 % av den administrerade dosen.
Linjäritet/icke-linjäritet
Plasmakoncentrationer vid steady state är dosproportionella för atalurendoser mellan 10 och 50 mg/kg, och ingen ackumulering observeras efter upprepad dosering. Baserat på data från friska försökspersoner är den relativa biotillgängligheten hos ataluren ca 40 % lägre vid steady-state än efter den initiala dosen. Minskningen av den relativa biotillgängligheten uppskattas börja ca 60 timmar efter den första dosen. Steady-state etableras efter ca två veckor av daglig dosering tre gånger per dag.
Egenskaper i specifika grupper av försökspersoner eller patienter
Ålder
Baserat på data från försökspersoner mellan 2 och 57 år finns ingen uppenbar effekt av ålder på atalurenexponering i plasma. Åldersjusterad dosering krävs inte.
Farmakokinetik för ataluren har utvärderats i studie PTC124-GD-030 under 4 veckor. Koncentrationer av ataluren i plasma hos patienter från 2 år till yngre än 5 år överensstämde med dem som påvisades hos patienter äldre än 5 år som fick regimen 10/10/20 mg/kg dos.
Kön
Kvinnor studerades inte i nmDMD kliniska prövningar. I andra populationer förekom emellertid inga uppenbara effekter av kön på atalurenexponering i plasma.
Etniskt ursprung
Det är inte troligt att farmakokinetiken för ataluren påverkas signifikant av UGT1A9-polymorfismer i en kaukasisk population. På grund av det låga antalet andra raser som inkluderas i de kliniska studierna, kan inga slutsatser dras om effekten av UGT1A9 i andra etniska grupper.
Nedsatt njurfunktion
Ingen dosjustering är nödvändig till patienter med lätt till måttligt nedsatt njurfunktion.
I en farmakokinetisk studie på patienter med olika grader av njurfunktionsnedsättning ändrades atalurenexponering i plasma med -13 %, 27 % och 61 % i gruppen med lätt, måttligt respektive gravt nedsatt njurfunktion och med 46 % i gruppen med kronisk njursvikt jämfört med gruppen med normal njurfunktion efter administrering av en engångsdos. Dessutom har en 3 till 8 gånger högre mängd atalurenmetabolit rapporterats hos patienter med gravt nedsatt njurfunktion (eGFR < 30 ml/min). Efter upprepad dosering förväntas ökningen av ataluren och atalurenmetaboliten vara högre hos patienter med gravt nedsatt njurfunktion och kronisk njursvikt jämfört med patienter med normal njurfunktion vid steady state. Patienter med gravt nedsatt njurfunktion (eGFR < 30 ml/min) eller kronisk njursvikt ska behandlas med ataluren endast om den förväntade kliniska nyttan överstiger den potentiella risken (se avsnitt Dosering och Varningar och försiktighet).
Nedsatt leverfunktion
Baserat på en farmakokinetisk utvärdering utförd på grupper med antingen lätt, måttligt eller gravt nedsatt leverfunktion jämfört med en kontrollgrupp med friska försökspersoner är ingen dosjustering nödvändig för patienter med leverfunktionsnedsättning av någon grad. Inga uppenbara skillnader i total atalurenexponering observerades mellan grupperna med lätt eller svårt nedsatt leverfunktion och kontrollgruppen. En ungefär 40 % minskning i genomsnittlig total atalurenexponering sågs i gruppen med måttligt nedsatt leverfunktion jämfört med kontrollgruppen, troligen på grund av det lägre deltagarantalet och variabilitet.
Icke-rörliga
Det fanns inga uppenbara skillnader i varken steady state relativ biotillgänglighet eller uppenbar clearance på grund av förlust av rörlighet. Ingen doseringsjustering behövs för patienter som blir icke-rörliga.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi och gentoxicitet visade inte några särskilda risker för människa.
En standarduppsättning reproduktionstoxicitetsstudier var tillgängliga. Inga effekter på manlig och kvinnlig fertilitet observerades, men effekter av tidig juvenil behandling på fertilitet under mogen ålder undersöktes inte. Hos råttor och kaniner påträffades embryo-fetal toxicitet (t.ex. ökning av tidig resorption, förlust efter implantation, minskat antal levande foster) och tecken på fördröjd utveckling (ökat antal skelletvariationer) i närvaro av moderstoxicitet. Exponering vid nivån där inga biverkningar observerats (no observed adverse effect level, NOAEL) var liknande (kanin) eller 4 gånger (råtta) den systemiska exponeringen hos människor (40 mg/kg/dag). Placentaöverföring av radiomärkt ataluren påvisades i råttor. Vid en enkel testad, relativt låg modersdos på 30 mg/kg, var koncentrationen av radioaktivitet hos fostret ≤ 27 % av koncentrationen hos modern. I den pre-/postnatala utvecklingstoxicitetsstudien av råttor, observerades signifikant moderstoxicitet såväl som effekter på avkommans kroppsvikt och utveckling av rörlig aktivitet vid en exponering på ca 5 gånger human exponering. Moderns systemiska exponering vid NOEL-nivån för neonatal toxicitet, var ca 3 gånger den humana exponeringen. Vid en enkel, relativt låg modersdos på 30 mg/kg radiomärkt ataluren, var den högsta uppmätta koncentrationen av radioaktivitet i råttmjölk 37 % av koncentrationen i plasma hos modern. Närvaro av radioaktivitet i plasma hos ungarna bekräftade absorption från mjölken.
Njurtoxicitet (nefros i den distala nefronen) inträffade i upprepade orala dosstudier på möss vid systemisk exponering motsvarande 0,3 gånger steady state AUC hos patienter som administrerats Translarna på morgonen, mitt på dagen och kvällen i respektive dåser på 10, 10, 20 mg/kg och högre.
I en 26-veckors transgen musmodell för karcinogenicitet, påträffades inga belägg för karcinogenicitet. I en 2-årig karcinogenicitetsstudie av råttor, påträffades ett fall av hibernom. Dessutom påträffades, vid en exponering som var mycket högre än hos patienter, en ökning av (sällsynta) tumörer i urinblåsan. Signifikans av tumörer i urinblåsan för människor anses inte trolig.
En av två 26-veckors upprepade dosstudier på råttor, som initierades hos 4–5 veckor gamla råttor, visade en dosrelaterad ökning av förekomst av malignt hibernom, en sällsynt tumör hos råttor. Dessutom påträffades ett fall av malignt hibernom vid den högsta dosen i en 2-årig karcinogenicitetsstudie på råttor. Bakgrundsförekomst av denna tumörtyp hos råttor, såväl som hos människor, är mycket låg, och mekanismen som orsakat dessa tumörer i råttstudierna (inklusive dess relation till atalurenbehandling) är okänd. Signifikansen för människor är inte känd.
En 1-årig studie på 10–12 veckor gamla hundar, påvisade fynd i binjuren (fokal inflammation och degenerering i de glukokortikoidproducerande regionerna i binjurebarken) och en lindrig försvagning av kortisolproduktionen efter exogen stimulering med adrenokortikotropiskt hormon. Dessa fynd sågs hos hundar vid systemisk exponering motsvarande 0,8 gånger steady state AUC hos patienter som administrerats Translarna på morgonen, mitt på dagen och kvällen i respektive doser på 40 mg/kg/dag och högre. I en distribueringsstudie på råttor observerades en hög koncentration av ataluren i binjurarna.
Förutom de ovannämnda effekterna påträffades flera andra lindriga biverkningar i de upprepade dosstudierna; speciellt minskad ökning av kroppsvikt, matintag och ökad levervikt, utan ett histologiskt korrelat och av oklar klinisk signifikans. Studier på råttor och hundar visade även förändringar i plasmalipider (kolesterol och triglycerider), som talar för förändringar i fettmetabolismen.
Inga ogynnsamma fynd, inklusive i binjuren, observerades i en 3 månader lång studie av nyfödda hundar (1 vecka gamla) följt av en 3 månader lång återhämtningsperiod upp till systemisk steady state-exponering motsvarande steady state AUC hos patienter. I förstudier på nyfödda hundar (1 vecka gamla) tolererades hos vissa djur inte initial systemisk exponering motsvarande 5-10 gånger steady state-AUC hos patienterna.
Innehåll
Kvalitativ och kvantitativ sammansättning
Translarna 125 mg granulat för oral suspension
Varje dospåse innehåller 125 mg ataluren.
Translarna 250 mg granulat för oral suspension.
Varje dospåse innehåller 250 mg ataluren.
Translarna 1 000 mg granulat för oral suspension
Varje dospåse innehåller 1000 mg ataluren.
Förteckning över hjälpämnen
Polydextros (E1200)
Makrogol
Poloxamer
Mannitol (E421)
Krospovidon
Hydroxyetylcellulosa
Artificiell vaniljsmak: maltodextrin, artificiella smakämnen och propylenglykol.
Kiseldioxid, kolloidal vattenfri (E551)
Magnesiumstearat
Blandbarhet
Ej relevant
Hållbarhet, förvaring och hantering
Hållbarhet
4 år
Varje beredd dos ska helst administreras omedelbart efter beredning. Den beredda dosen ska kasseras om den inte konsumeras inom 24 timmar efter beredning om den förvaras i kylskåp (2–8 °C), eller inom 3 timmar vid rumstemperatur (15–30 °C).
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förvaringsanvisningar för läkemedlet efter spädning finns i avsnitt Hållbarhet.
Särskilda anvisningar för destruktion och övrig hantering
Dospåsarna ska endast öppnas vid tidpunkten för dosberedning. Hela innehållet i varje dospåse ska blandas med minst 30 ml vätska (vatten, mjölk, fruktjuice), eller 3 matskedar halvfast mat (yoghurt eller äppelmos). Den beredda dosen ska blandas väl före administrering. Mängden vätska eller halvfast mat kan ökas baserat på patientens preferens.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Granulat för oral suspension.
Vitt till benvitt granulat.



