Indikationer
JEVTANA i kombination med prednison eller prednisolon är indicerat för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer som tidigare behandlats med docetaxelinnehållande behandling (se avsnitt Farmakodynamik).
Kontraindikationer
-
Överkänslighet mot cabazitaxel, mot andra taxaner, mot polysorbat 80 eller mot något av hjälpämnena som anges i avsnitt Innehåll.
-
Neutrofilantal lägre än 1500/mm3.
-
Gravt nedsatt leverfunktion (totalt bilirubin >3 × ULN).
-
Samtidig vaccination med vaccin mot gula febern (se avsnitt Interaktioner).
Dosering
Användningen av JEVTANA bör begränsas till enheter specialiserade på behandling med cytostatika och bör endast administreras under överinseende av legitimerad läkare med särskild erfarenhet av kemoterapi hos cancerpatienter. Hjälpmedel och utrustning för behandling av allvarliga överkänslighetsreaktioner som hypotension och bronkospasm måste finnas tillgänglig (se avsnitt Varningar och försiktighet).
Premedicinering
Rekommenderad premedicinering ska ges senast 30 minuter före varje administration av JEVTANA med följande intravenösa läkemedel för att minska risken och allvarlighetsgraden av överkänslighet:
-
antihistamin (dexklorfeniramin 5 mg eller difenhydramin 25 mg eller liknande)
-
kortikosteroid (dexametason 8 mg eller liknande), och
-
H2-antagonist (ranitidin eller liknande) (se avsnitt Varningar och försiktighet).
Antiemetisk profylax rekommenderas och kan ges peroralt eller intravenöst efter behov.
Under hela behandlingen ska adekvat hydrering av patienten säkerställas för att förebygga komplikationer som njursvikt.
Dosering
Den rekommenderade dosen av JEVTANA är 25 mg/m2 administrerat som en 1-timmes intravenös infusion var tredje vecka i kombination med oralt givet prednison eller prednisolon 10 mg dagligen under hela behandlingen.
Dosjustering
Dosjustering bör göras om patienten erfar följande biverkningar (gradering enligt ”Common Terminology Criteria” för biverkningar [CTCAE 4.0]):
|
Biverkningar |
Dosjustering |
|---|---|
|
Förlängd grad ≥3 neutropeni (mer än en vecka) trots adekvat behandling inklusive G-CSF |
Avvakta behandling tills neutrofilvärdet är >1500 celler/mm3, reducera sedan dosen av cabazitaxel från 25 mg/m2 till 20 mg/m2 |
|
Febril neutropeni eller neutropen infektion |
Avvakta behandling tills förbättring eller total symptomregress och tills neutrofilvärdet är >1500 celler/mm3, reducera sedan dosen av cabazitaxel från 25 mg/m2 till 20 mg/m2 |
|
Grad ≥3 diarré eller ihållande diarré trots adekvat behandling, inklusive vätske- och elektrolytersättning |
Avvakta behandling tills förbättring eller total symptomregress, reducera sedan dosen av cabazitaxel från 25 mg/m2 till 20 mg/m2 |
|
Grad ≥2 perifer neuropati |
Avvakta behandling tills förbättring, reducera sedan dosen av cabazitaxel från 25 mg/m2 till 20 mg/m2 |
Om någon av dessa biverkningar kvarstår hos patient vid dosen 20 mg/m2 kan ytterligare dosreduktion till 15 mg/ m2 eller avslutande av behandling övervägas. Det finns begränsad mängd data avseende patienter som fått lägre dos än 20 mg/m2.
Särskilda patientgrupper
Patienter med leverfunktionsnedsättning
Cabazitaxel metaboliseras främst via levern. Dosen av cabazitaxel ska minskas till 20 mg/m2 hos patienter med lätt nedsatt leverfunktion (totalt bilirubin >1 till ≤1,5 gånger det övre normalvärdet (ULN) eller aspartataminotransferas (ASAT) >1,5 gånger det övre normalvärdet (ULN). Administrering av cabazitaxel ska ges med försiktighet till patienter med lätt nedsatt leverfunktion och övervakas noggrant med avseende på säkerhet.
Hos patienter med måttlig leverfunktionsnedsättning (totalt bilirubin >1,5 till ≤3,0 gånger ULN), är den högsta tolererbara dosen (MTD) 15 mg/m2. Om behandling planeras för patienter med måttligt nedsatt leverfunktion ska dosen av cabazitaxel inte överskrida 15 mg/m2. Det finns dock endast begränsade effektdata för denna dos. Cabazitaxel ska inte ges till patienter med gravt nedsatt leverfunktion (totalt bilirubin >3 gånger högre än ULN), (se avsnitt Kontraindikationer, Varningar och försiktighet och Farmakokinetik).
Patienter med njurfunktionsnedsättning
Cabazitaxel utsöndras minimalt via njurarna. Ingen dosjustering är nödvändig hos patienter med njurfunktionsnedsättning som inte kräver dialys. Patienter med mycket avancerad njursvikt (kreatininclearance (CLCR<15 ml/min/1,73 m2), ska på grund av deras tillstånd och med den begränsade mängd data som finns tillgänglig behandlas med försiktighet och övervakas noggrant under behandling (se avsnitt Varningar och försiktighet och Farmakokinetik).
Äldre
Ingen dosjustering rekommenderas vid användning av cabazitaxel hos äldre patienter (se också avsnitt Varningar och försiktighet, Biverkningar och Farmakokinetik).
Samtidig användning av andra läkemedel
Samtidig användning av andra läkemedel som är potenta inducerare eller potenta hämmare av CYP3A ska undvikas. Om patienten behöver samtidig administrering av en potent CYP3A hämmare bör en minskning med 25% av cabazitaxeldosen övervägas (se avsnitt Varningar och försiktighet och Interaktioner).
Pediatrisk population
Det finns ingen relevant användning av JEVTANA för en pediatrisk population.
Säkerhet och effekt av JEVTANA hos barn och ungdomar under 18 års ålder har inte fastställts (se avsnitt Farmakodynamik).
Administreringssätt
JEVTANA är för intravenös användning.
För instruktioner om beredning och administrering av läkemedlet, se avsnitt Hållbarhet, förvaring och hantering.
Infusionsbehållare av PVC och infusionsset av polyuretan ska inte användas.
JEVTANA får inte blandas med några andra läkemedel än de som nämns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Överkänslighetsreaktioner
Alla patienter ska premedicineras innan initiering av cabazitaxel-infusion (se avsnitt Dosering).
Patienter ska observeras noga med avseende på överkänslighetsreaktioner, särskilt under första och andra infusionen. Överkänslighetsreaktioner kan uppträda inom några minuter efter att infusionen med cabazitaxel påbörjats, därför ska hjälpmedel och utrustning för behandling av hypotension och bronkospasm finnas tillgänglig. Allvarliga reaktioner som kan inträffa omfattar generella hudutslag/erytem, hypotension och bronkospasm. Allvarliga överkänslighetsreaktioner kräver att man omedelbart avbryter behandlingen med cabazitaxel och sätter in lämplig behandling. Patienter som har utvecklat en överkänslighetsreaktion ska avsluta behandlingen med JEVTANA (se avsnitt Kontraindikationer).
Benmärgssuppression
Benmärgssuppression som manifesterar sig som neutropeni, anemi, trombocytopeni eller pancytopeni kan inträffa. (se ”Risk för neutropeni” och ”Anemi” i avsnitt Varningar och försiktighet nedan).
Risk för neutropeni
Patienter som behandlas med cabazitaxel kan erhålla profylaktisk G-CSF-behandling i enlighet med ”American Society of Clinical Oncology” (ASCO) riktlinjer och/eller i enlighet med rådande riktlinjer på behandlande klinik, för att minska risken för, och hantera neutropena komplikationer (febril neutropeni, förlängd neutropeni eller neutropen infektion). Primärprofylax med G-CSF ska övervägas hos patienter med en hög riskprofil (ålder > 65 år, nedsatt allmäntillstånd, tidigare episoder av febril neutropeni, tidigare strålbehandling, dålig nutritionsstatus eller andra allvarliga sjukdomstillstånd) som ökar risken för komplikationer efter en långvarig neutropeni. Användning av G-CSF har visat sig begränsa förekomsten och svårighetsgraden av neutropeni.
Neutropeni är den vanligast förekommande biverkningen av cabazitaxel (se avsnitt Biverkningar). Veckovis monitorering av komplett blodstatus är väsentlig under cykel 1 och därefter innan varje behandlingscykel så att dosen kan justeras om det behövs.
Dosen ska minskas vid febril neutropeni eller förlängd neutropeni trots korrekt behandling (se avsnitt Dosering).
Patienten kan återgå till behandling endast när neutrofilerna återgått till en nivå av ≥1500/mm3 (se avsnitt Kontraindikationer).
Gastrointestinal påverkan
Symtom som magsmärta och ömhet, feber, långvarig förstoppning, diarré med eller utan neutropeni, kan vara tidiga tecken på allvarlig gastrointestinal toxicitet och ska undersökas och behandlas snabbt.
Senareläggning av cabazitaxelbehandling eller avslutande av behandlingen kan vara nödvändig.
Risk för illamående, kräkning, diarré och uttorkning
Om patienter får diarré efter administrering av cabazitaxel kan de behandlas med vanliga läkemedel mot diarré. Åtgärder ska vidtas för att rehydrera patienten. Diarré kan förekomma mer frekvent hos patienter som fått buk- och bäckenbestrålning innan. Uttorkning är mer vanligt hos patienter från 65 år och uppåt. Lämpliga åtgärder ska vidtas för att rehydrera patienterna samt övervaka och korrigera serumelektrolytnivåerna, främst kalium. Framflyttande av behandling eller dosreduktion kan vara nödvändigt vid diarré grad ≥3 (se avsnitt Dosering). Om patienter blir illamående eller kräks kan de behandlas med vanlig antiemetika.
Risk för allvarliga gastrointestinala reaktioner
Gastrointestinal (GI) blödning och perforation, ileus, kolit, med dödlig utgång, har rapporterats hos patienter som behandlats med cabazitaxel (se avsnitt Biverkningar). Försiktighet rekommenderas vid behandling av patienter som har en förhöjd risk att utveckla gastrointestinala komplikationer: patienter med neutropeni, äldre, samtidig behandling med NSAID, trombocytaggregationshämmande behandling eller antikoagulationsbehandling och patienter med en tidigare anamnes på stålbehandling av bäckenet eller gastrointestinal sjukdom som sår och blödning.
Perifer neuropati
Fall av perifer neuropati, perifer sensorisk neuropati (t ex parestesi, dysestesi) och perifer motorisk neuropati har observerats hos patienter som erhållit cabazitaxel. Patienter som behandlas med cabazitaxel ska rådas att informera sin läkare innan den fortsatta behandlingen om symtom på neuropati såsom smärta, brännande känsla, stickningar, domningar eller svaghet utvecklas. Läkaren ska utvärdera möjlig försämring av neuropatin innan varje behandling. Avvakta med behandlingen tills symtomen förbättrats. Dosen av cabazitaxel bör sänkas från 25 mg/m2 till 20 mg/m2 vid kvarvarande perifer neuropati grad ≥2 (se avsnitt Dosering).
Anemi
Anemi har observerats hos patienter som erhållit cabazitaxel (se avsnitt Biverkningar). Hemoglobin och hematokrit bör kontrolleras innan behandlingen med cabazitaxel samt om patienter uppvisar tecken eller symtom på anemi eller blodförlust. Försiktighet rekommenderas hos patienter med hemoglobin <10 g/dl och nödvändiga åtgärder bör vidtas om kliniskt behov finns.
Risk för njursvikt
Njurpåverkan har rapporterats i samband med sepsis, allvarlig uttorkning p g a diarré, kräkning och obstruktiv uropati. Njursvikt med fall av fatal utgång har observerats. Lämpliga åtgärder ska vidtas för att identifiera orsaken och ge patienten intensivvård om det inträffar.
Tillräcklig vätsketillförsel måste säkerställas under hela behandlingen med cabazitaxel. Patienten ska uppmärksammas på att omedelbart rapportera betydande ändringar av mängden daglig urin. Serumkreatinin ska mätas från start, vid varje räkning av blodceller och närhelst patienten rapporterar om en förändring i urinmängden. Behandling med cabazitaxel ska avslutas i händelse av försämring av njurfunktionen till njursvikt ≥CTCAE 4,0 grad 3.
Andningspåverkan
Interstitiell pneumoni/pneumonit och interstitiell lungsjukdom har rapporterats och kan associeras med dödlig utgång (se avsnitt Biverkningar)
Om nya eller försämrade lungsymtom utvecklas ska patienten noga övervakas, snabbt undersökas och behandlas på lämpligt sätt. Avbrytande av cabazitaxelbehandlingen rekommenderas tills diagnos fastställts. Tidig användning av understödjande åtgärder kan hjälpa till att förbättra tillståndet. Nyttan med att återuppta cabazitaxelbehandlingen måste noga övervägas.
Risk för hjärtarrytmier
Hjärtarrytmier har rapporterats, mest vanligt takykardi och förmaksflimmer (se avsnitt Biverkningar).
Äldre
Det är mer sannolikt att äldre människor (≥65 år) upplever vissa biverkningar inklusive neutropeni och febril neutropeni (se avsnitt Biverkningar).
Patienter med nedsatt leverfunktion
Behandling med JEVTANA är kontraindicerad hos patienter med gravt nedsatt leverfunktion (totalt bilirubin >3 gånger ULN), (se avsnitt Kontraindikationer och Farmakokinetik).
Dosen ska reduceras till patienter med lätt nedsatt leverfunktion (totalt bilirubin >1 till ≤1,5 gånger ULN eller ASAT >1,5 gånger ULN), (se avsnitt Dosering och Farmakokinetik).
Interaktioner
Samtidig behandling med potenta CYP3A hämmare bör undvikas eftersom de kan öka plasmakoncentrationen av cabazitaxel (se avsnitt Dosering och Interaktioner). Om samtidig administrering med en potent CYP3A-hämmare inte kan undvikas, ska en noggrann övervakning vad gäller toxicitet samt en dosreduktion av cabazitaxel övervägas (se avsnitt Dosering och Interaktioner).
Samtidig behandling med potenta CYP3A-inducerare ska undvikas eftersom det kan minska plasmakoncentrationen av cabazitaxel (se avsnitt Dosering och Interaktioner).
Hjälpämnen
Varje injektionsflaska med spädningsvätska innehåller 573 mg alkohol (etanol).Mängden alkohol i en dos av detta läkemedel motsvarar mindre än 11 ml öl eller 5 ml vin. Den lilla mängd alkohol i detta läkemedel kommer inte att ha några märkbara effekter. Särskilda försiktighetsåtgärder måste dock tas i beaktande av högriskgrupper som patienter med leversjukdom, epilepsi och patienter med en historia av alkoholism.
Preventivmetod
Män ska använda preventivmetoder under behandlingen och i 4 månader efter avslutad behandling med cabazitaxel (se avsnitt Graviditet).
Interaktioner
In vitro studier har visat att cabazitaxel främst metaboliseras via CYP3A (80-90%) (se avsnitt Farmakokinetik).
CYP3A hämmare
Upprepad dosering av ketokonazol (400 mg en gång dagligen), en potent CYP3A hämmare,
resulterade i en minskning med 20 % av cabazitaxels clearance motsvarande en ökning med 25% i AUC. Därför ska samtidig användning av potenta CYP3A hämmare (t ex ketokonazol, itrakonazol, klaritromycin, indinavir, nefazodon, nelfinavir, ritonavir, saquinavir, telitromycin, vorikonazol) undvikas eftersom en ökning i plasmakoncentrationen av cabazitaxel kan inträffa (se avsnitt Dosering och Varningar och försiktighet).
Samtidig administrering av aprepitant, en måttlig CYP3A hämmare, hade ingen effekt på cabazitaxels clearance.
CYP3A inducerare
Upprepad administering av rifampicin (600 mg en gång dagligen), en potent CYP3A inducerare, resulterade i en ökning av cabazitaxels clearance med 21 % motsvarande en minskning av AUC med 17%. Därför ska samtidig användning av potenta CYP3A inducerare (t ex fenytoin, karbamazepin, rifampin, rifabutin, rifapentin, fenobarbital) undvikas eftersom en minskning i plasmakoncentrationen av cabazitaxel kan inträffa (se avsnitt Dosering och Varningar och försiktighet)
Vidare ska patienterna avstå från att ta Johannesört.
OATP1B1
Cabaxitaxel har in vitro visat sig hämma transportproteinet OATP1B1, Organic anion transporting peptide. Det finns en möjlig risk för interaktion med OATP1B1 substrat (t ex statiner, valsartan, repaglinid), särskilt under infusionstiden (1 timme) och upp till 20 minuter efter infusionens avslut. Ett tidsintervall på 12 timmar innan infusion och minst tre timmar efter avslutad infusion rekommenderas innan administrering av OATP1B1 substrat.
Vaccinationer
Administrering av levande eller försvagade vacciner till patienter immunosupprimerade genom kemoterapi, kan resultera i fatala infektioner. Vaccination med levande försvagade vacciner ska undvikas hos patienter som får cabazitaxel. Avdödat eller inaktiverat vaccin kan ges men svaret på en sådan vaccinering kan vara försvagat.
Graviditet
Preventivmetod
På grund av den genotoxiska risken med cabazitaxel (se avsnitt Prekliniska uppgifter) ska män använda effektiv preventivmetod under behandlingen och i 4 månader efter avslutad behandling med cabazitaxel.
Graviditet
Det finns ingen information beträffande användningen av cabazitaxel hos gravida kvinnor. Djurstudier har visat reproduktionstoxicitet vid, för modern, toxiska doser (se avsnitt Prekliniska uppgifter) och att cabazitaxel passerar placentabarriären (se avsnitt Prekliniska uppgifter). Som med andra cytotoxiska läkemedel kan cabazitaxel orsaka fosterskador hos gravida kvinnor som exponerats.
Cabazitaxel är inte avsett för användning till kvinnor.
Amning
Tillgängliga farmakokinetiska data från djurstudier har visat att cabazitaxel och dess metaboliter utsöndras i modersmjölk (se avsnitt Prekliniska uppgifter).
Fertilitet
Djurstudier har visat att cabazitaxel påverkar reproduktionssystemet hos hanråttor och hundar utan någon funktionell påverkan på fertiliteten (se avsnitt Prekliniska uppgifter). Med tanke på de farmakologiska effekterna av taxaner, deras genotoxiska potential
genom en aneugen mekanism och klasseffekt på fertilitet i djurstudier kan påverkan på manlig fertilitet inte uteslutas hos människa.
Män som behandlas med cabazitaxel bör söka rådgivning om att spara sperma innan behandling.
Trafik
Cabazitaxel har en måttlig påverkan på förmågan att framföra fordon och använda maskiner eftersom det kan orsaka trötthet och yrsel. Patienter ska rådas till att inte framföra fordon eller använda maskiner om de känner av dessa biverkningar under behandlingen.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerheten vid användning av JEVTANA tillsammans med prednison eller prednisolon har utvärderats i tre randomiserade, öppna, konrollerade studier (TROPIC, PROSELICA och CARD) med totalt 1092 patienter med metastaserande kastrationsresistent prostatacancer som behandlats med 25 mg/m2 cabazitaxel en gång var tredje vecka. Patienterna fick i medeltal 6 till 7 cykler med cabazitaxel.
Incidensen från den poolade analysen av dessa tre studier presenteras nedan och i tabellistan.
De vanligaste biverkningarna vad gäller alla grader var anemi (99,0 %), leukopeni (93,0 %), neutropeni (87,9 %), trombocytopeni (41,1 %), diarré (42,1 %), trötthet (25,0 %) och asteni (15,4 %). De vanligaste grad ≥ 3 biverkningarna förekommande hos minst 5 % av patienterna var neutropeni (73,1 %), leukopeni (59,5 %), anemi (12,0 %), febril neutropeni (8,0 %) och diarré (4,7 %).
Utsättning av läkemedel pga. biverkningar skedde i liknande utsträckning i de tre studierna (18,3 % i TROPIC, 19,5 % i PROSELICA och 19,8 % i CARD) hos patienter som fick cabazitaxel. Den vanligaste biverkningen (> 1,0 %) som ledde till att man slutade med cabazitaxel var hematuri, trötthet och neutropeni.
Lista med biverkningar i tabellformat
Biverkningar är listade i tabell 2 enligt MedDRA-terminologin (organklass och frekvens). Inom varje frekvensgrupp är biverkningar presenterade i fallande ordning efter allvarlighetsgrad. Allvarlighetsgraden hos biverkningarna är graderade enligt CTCAE 4.0 (grad ≥3 = G≥3). Frekvenserna baseras på alla grader och är definierade som: mycket vanliga (≥ 1/10), vanliga (≥ 1/100 till < 1/10); mindre vanliga (≥ 1/1000 till < 1/100); sällsynta (≥ 1/10 000 till < 1/1000); mycket sällsynta (< 1/10 000); ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Organklass |
Biverkningar |
Alla grader n (%) |
Grade >3 n(%) |
||
|---|---|---|---|---|---|
|
|
|
Mycket vanliga |
Vanliga |
Mindre vanliga |
|
|
Infektioner och infestationer |
Neutropen infektion/sepsis* |
|
48 (4,4) |
|
42 (3,8) |
|
Septisk chock |
|
|
10 (0,9) |
10 (0,9) |
|
|
Sepsis |
|
13 (1,2) |
|
13 (1,2) |
|
|
Cellulit |
|
|
8 (0,7) |
3 (0,3) |
|
|
Urinvägsinfektion |
|
103 (9,4) |
|
19 (1,7) |
|
|
Influensa |
|
22 (2,0) |
|
0 |
|
|
Cystit |
|
22 (2,0) |
|
2 (0,2) |
|
|
Övre luftvägsinfektion |
|
23 (2,1) |
|
0 |
|
|
Herpes zoster |
|
14 (1,3) |
|
0 |
|
|
Candidainfektion |
|
11 (1,0) |
|
1 (<0,1) |
|
|
Blodet och lymfsystemet |
Neutropenia* |
950 (87,9) |
|
|
790 (73,1) |
|
Anemi a |
1073 (99,0) |
|
|
130 (12,0) |
|
|
Leukopenia |
1008 (93,0) |
|
|
645 (59,5) |
|
|
Thrombocytopenia |
478 (44,1) |
|
|
44 (4,1) |
|
|
Febril neutropeni |
|
87 (8,0) |
|
87 (8,0) |
|
|
Immunsystemet |
Överkänslighet |
|
|
7 (0,6) |
0 |
|
Metabolism och nutrition |
Minskad aptit |
192 (17,6) |
|
|
11 (1,0) |
|
Dehydrering |
|
27 (2,5) |
|
11 (1,0) |
|
|
Hyperglykemi |
|
11 (1,0) |
|
7 (0,6) |
|
|
Hypokalemi |
|
|
8 (0,7) |
2 (0,2) |
|
|
Psykiska störningar |
Sömnlöshet |
|
45 (4,1) |
|
0 |
|
Ångest |
|
13 (1,2) |
|
0 |
|
|
Konfusion |
|
12 (1,1) |
|
2 (0,2) |
|
|
Centrala och perifera nervsystemet |
Dysgeusi |
|
64 (5,9) |
|
0 |
|
Smakstörning |
|
56 (5,1) |
|
0 |
|
|
Perifer neuropati |
|
40 (3,7) |
|
2 (0,2) |
|
|
Perifer sensorisk neuropati |
|
89 (8,2) |
|
6 (0,5) |
|
|
Polyneuropati |
|
|
9 (0,8) |
2 (0,2) |
|
|
Parestesi |
|
46 (4,2) |
|
0 |
|
|
Hypoestesi |
|
18 (1,6) |
|
1 (< 0,1) |
|
|
Yrsel |
|
63 (5,8) |
|
0 |
|
|
Huvudvärk |
|
56 (5,1) |
|
1 (< 0,1) |
|
|
Letargi |
|
15 (1,4) |
|
1 (< 0,1) |
|
|
Ischias |
|
|
9 (0,8) |
1 (< 0,1) |
|
|
Ögon |
Konjunktivit |
|
11 (1,0) |
|
0 |
|
Ökat tårflöde |
|
22 (2,0) |
|
0 |
|
|
Öron och balansorgan |
Tinnitus |
|
|
7 (0,6) |
0 |
|
Vertigo |
|
15 (1,4) |
|
1 (< 0,1) |
|
|
Hjärtat * |
Förmaksflimmer |
|
14 (1,3) |
|
5 (0,5) |
|
Takykardi |
|
11 (1,0) |
|
1 (< 0,1) |
|
|
Blodkärl |
Hypotension |
|
38 (3,5) |
|
5 (0,5) |
|
Djup ventrombos |
|
12 (1,1) |
|
9 (0,8) |
|
|
Hypertension |
|
29 (2,7) |
|
12 (1,1) |
|
|
Ortostatisk hypotension |
|
|
6 (0,5) |
1 (< 0,1) |
|
|
Rodnad |
|
23 (2,1) |
|
1 (< 0,1) |
|
|
Vallningar |
|
|
9 (0,8) |
0 |
|
|
Andningsvägar, bröstkorg och mediastinum |
Andnöd |
|
97 (8,9) |
|
9 (0,8) |
|
Hosta |
|
79 (7,2) |
|
0 |
|
|
Smärta i munhåla och svalg |
|
26 (2,4) |
|
1 (< 0,1) |
|
|
Pneumoni |
|
26 (2,4) |
|
16 (1,5) |
|
|
Lungemboli |
|
30 (2,7) |
|
23 (2,1) |
|
|
Magtarmkanalen |
Diarré |
460 (42,1) |
|
|
51 (4,7) |
|
Illamående |
347 (31,8) |
|
|
14 (1,3) |
|
|
Kräkning |
207 (19,0) |
|
|
14 (1,3) |
|
|
Förstoppning |
202 (18,5) |
|
|
8 (0,7) |
|
|
Magsmärta |
|
105 (9,6) |
|
15 (1,4) |
|
|
Dyspepsi |
|
53 (4,9) |
|
0 |
|
|
Övre magsmärtor |
|
46 (4,2) |
|
1 (< 0,1) |
|
|
Hemorrojder |
|
22 (2,0) |
|
0 |
|
|
Gastroesofagal refluxsjukdom |
|
26 (2,4) |
|
1 (< 0,1) |
|
|
Rektalblödning |
|
14 (1,3) |
|
4 (0,4) |
|
|
Muntorrhet |
|
19 (1,7) |
|
2 (0,2) |
|
|
Bukspänning |
|
14 (1,3) |
|
1 (< 0,1) |
|
|
Stomatit |
|
46 (4,2) |
|
2 (0,2) |
|
|
Ileus* |
7 (0,6) |
5 (0,5) |
|||
|
Gastrit |
10 (0,9) |
0 |
|||
|
Kolit* |
10 (0,9) |
5 (0,5) |
|||
|
Gastrointestinal perforation |
3 (0,3) |
1 (< 0,1) |
|||
|
Gastrointestinal blödning |
2 (0,2) |
1 (< 0,1) |
|||
|
Hud och subkutan vävnad |
Alopecia |
|
80 (7,3) |
|
0 |
|
Torr hud |
|
23 (2,1) |
|
0 |
|
|
Erytem |
|
|
8 (0,7) |
0 |
|
|
Nagelbesvär |
|
18 (1,6) |
|
0 |
|
|
Muskuloskeletala systemet och bindväv |
Ryggsmärta |
166 (15,2) |
|
|
24 (2,2) |
|
Ledvärk |
|
88 (8,1) |
|
9 (0,8) |
|
|
Smärta i extremiteterna |
|
76 (7,0) |
|
9 (0,8) |
|
|
Muskelspasmer |
|
51 (4,7) |
|
0 |
|
|
Myalgi |
|
40 (3,7) |
|
2 (0,2) |
|
|
Muskuloskeletal bröstsmärta |
|
34 (3,1) |
|
3 (0,3) |
|
|
Muskelsvaghet |
|
31 (2,8) |
|
1 (0,2) |
|
|
Flanksmärta |
|
17 (1,6) |
|
5 (0,5) |
|
|
Njurar och urinvägar |
Akut njursvikt |
|
21 (1,9) |
|
14 (1,3) |
|
Njursvikt |
|
|
8 (0,7) |
6 (0,5) |
|
|
Dysuri |
|
52 (4,8) |
|
0 |
|
|
Renal kolik |
|
14 (1,3) |
|
2 (0,2) |
|
|
Hematuri |
205 (18,8) |
|
|
33 (3,0) |
|
|
Pollakiuri |
|
26 (2,4) |
|
2 (0,2) |
|
|
Hydronefros |
|
25 (2,3) |
|
13 (1,2) |
|
|
Urinretention |
|
36 (3,3) |
|
4 (0,4) |
|
|
Urininkontinens |
|
22 (2,0) |
|
0 |
|
|
Ureteral obstruktion |
|
|
8 (0,7) |
6 (0,5) |
|
|
Reproduktionsorgan och bröstkörtel |
Bäckensmärta |
|
20 (1,8) |
|
5 (0,5) |
|
Allmänna symtom och/eller symtom vid administrationsstället |
Trötthet |
333 (30,5) |
|
|
42 (3,8) |
|
Asteni |
227 (20,8) |
|
|
32 (2,9) |
|
|
Feber |
|
90 (8,2) |
|
5 (0,5) |
|
|
Perifert ödem |
|
96 (8,8) |
|
2 (0,2) |
|
|
Slemhinne-inflammation |
|
23 (2,1) |
|
1 (< 0,1) |
|
|
Smärta |
|
36 (3,3) |
|
7 (0,6) |
|
|
Bröstsmärta |
|
11 (1,0) |
|
2 (0,2) |
|
|
Ödem |
|
|
8 (0,7) |
1 (< 0,1) |
|
|
Frossa |
|
12 (1,1) |
|
0 |
|
|
Sjukdomskänsla |
|
21 (1,9) |
|
0 |
|
|
Undersökningar |
Viktminskning |
|
81 (7,4) |
|
0 |
|
Ökade nivåer aspartatamino-transferas |
|
13 (1,2) |
|
1 (< 0,1) |
|
|
Transaminas-stegring |
|
|
7 (0,6) |
1 (< 0,1) |
|
|
a baserat på laboratorievärden * se avsnitt nedan för mer information |
|||||
Beskrivning av utvalda biverkningar
Neutropeni och associerade kliniska händelser
Användningen av G-CSF har visat sig minska incidensen och allvarlighetsgraden av neutropeni (se avsnitt Dosering och Varningar och försiktighet).
Incidensen av grad ≥ 3 neutropeni baserad på laboratoriedata varierade mellan 44,7 % till 76,7 % beroende på användning av G-CSF, där användning av G-CSF-profylax gav den lägsta rapporterade incidensen. På samma sätt varierade incidensen av grad ≥ 3 febril neutropeni från 3,2 % till 8,6 %.
Neutropena komplikationer (inklusive febril neutropeni, neutropena infektioner/sepsis och neutropen kolit) vilka i några fall resulterade i dödsfall, rapporterades hos 4,0 % av patienterna när primär G-CSF-profylax användes och hos 12,8 % av övriga patienterna.
Hjärtpåverkan och arytmier
I den poolade analysen rapporterade 5,5 % av patienterna hjärt-kärlhändelser av vilka 1,1 % hade grad ≥ 3 hjärtarytmier. Incidensen för takykardi vid cabazitaxelbehandling var 1,0 %, färre än 0,1 % av dessa händelser var grad ≥ 3. Incidensen för förmaksflimmer var 1,3 %. Hjärtsvikt rapporterades för 2 patienter (0,2 %), ett av dessa fall resulterade i dödlig utgång. Fatalt kammarflimmer rapporterades hos 1 patient (0,3 %), och hjärtstillestånd hos 3 patienter (0,5 %). Ingen av dessa händelser ansågs vara relaterad till cabazitaxel enligt prövaren.
Hematuri
Hematuri (alla grader) observerades hos 18,8 % vid dosen 25 mg/m2 i den poolade analysen (se avsnitt Farmakodynamik). Dokumenterade förväxlingsfaktorer (confounding causes) såsom sjukdomsprogression, instrumentering, infektion eller behandling med antikoagulantia/NSAID/acetylsalicylsyra identifierades i nästan hälften av fallen.
Andra laboratorieavvikelser
I den poolade analysen var incidensen av grad ≥ 3 anemi samt ökade nivåer ASAT, ALAT och bilirubin baserat på laboratorieavvikelser 12,0 %, 1,3 %, 1,0 % respektive 0,5 %.
Gastrointestinal påverkan
Kolit (inklusive enterokolit och neutropen enterokolit) och gastrit har observerats. Gastrointestinal blödning, gastrointestinal perforation och ileus (intestinal obstruktion) har också rapporterats (se avsnitt Varningar och försiktighet).
Andningspåverkan
Fall av interstitiell pneumoni/pneumonit och interstitiell lungsjukdom, ibland fatal, har rapporterts med okänd frekvens (kan inte beräknas från tillgängliga data) (se avsnitt Varningar och försiktighet).
Påverkan på njurar och urinvägar
Strålningsinducerad cystit (”radiation recall fenomen”) inklusive hemorragisk cystit, rapporterades som mindre vanliga biverkningar.
Pediatrisk population
(Se avsnitt Dosering)
Speciella patientgrupper
Äldre
Av de 1092 patienter som behandlades med cabazitaxel 25 mg/m2 i prostatacancerstudierna var 755 patienter 65 år eller äldre inklusive 238 patienter som var äldre än 75 år. Följande icke-hematologiska biverkningar rapporterades med en frekvens ≥ 5 % högre hos patienter 65 år eller äldre jämfört med yngre patienter: trötthet (33,5 % jämfört med 23,7 %), asteni (23,7 % jämfört med 14,2 %), förstoppning (20,4 % jämfört med 14,2 %) och dyspné (10,3 % jämfört med 5,6 %). Neutropeni (90,9 % jämfört med 81,2 %) och trombocytopeni (48,8 % jämfört med 36,1 %) var också 5 % högre hos patienter 65 år eller äldre jämfört med yngre patienter. Grad ≥ 3 neutropeni och febril neutropeni rapporterades med de största skillnaderna mellan båda åldersgrupperna (14 % respektive 4 % högre frekvens hos patienter ≥ 65 år jämfört med patienter < 65 år) (se avsnitt Dosering och Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen känd antidot till cabazitaxel. Förväntade komplikationer vid överdos torde vara försämring av biverkningarna som benmärgssuppression och gastrointestinal påverkan. I fall av överdos ska patienten behandlas på en specialiserad enhet och övervakas noggrant. Patienterna bör erhålla terapeutiskt G-CSF så snart som möjligt efter att överdoseringen upptäckts. Övriga adekvata symtomatiska åtgärder bör initieras.
Farmakodynamik
Verkningsmekanism
Cabazitaxel är ett antineoplastiskt ämne som verkar genom att lösa upp det mikrotubulära nätverket i cellerna. Cabazitaxel binder sig till tubulin och gynnar hopsättande av tubulin i mikorotubuli medan det samtidigt hämmar dess demontering. Detta leder till stabilisering av mikrotubuli vilket resulterar i en hämning av cellfunktioner i mitos- och interfas.
Farmakodynamisk effekt
Cabazitaxel har demonstrerat ett brett spektrum av antitumorala effekter mot avancerade humana tumörer transplanterade till möss. Cabazitaxel är aktivt hos docetaxelkänsliga tumörer. Dessutom har cabazitaxel visat aktivitet i tumörmodeller som är okänsliga för kemoterapi, inklusive docetaxel.
Klinisk effekt och säkerhet
Effekten och säkerheten med JEVTANA i kombination med prednison eller prednisolon har utvärderats i en randomiserad öppen, internationell multicenter fas III-studie (EFC6193) hos patienter med kastrationsresistent metastatisk prostatacancer som tidigare behandlats med docetaxel.
Total överlevnad (overall survival, OS), var den primära endpointen för effekt i studien.
Sekundära endpoints inkluderade progressionsfri överlevnad (progression free survival, PFS) [definierad som tid från randomisering till tumörprogression, progression av prostata specifikt antigen (PSA) och tilltagande smärta eller död oavsett anledning, beroende på vad som inträffar först], tumörsvarsfrekvens (tumour response rate) baserat på ”Response Evaluation Criteria in Solid Tumours” (RECIST), PSA-progression (definierad som ≥25% ökning eller >50% av vardera PSA non-responders eller responders), PSA-svar (minskning av PSA-nivåer i serum med åtminstone 50%), smärtprogression[utredd genom användandet av PPI-skalan (Present Pain Intensity), från McGill-Melzack frågeformulär och Analgesic Score (AS)] och smärtsvar (definierat som en 2 poängs större reduktion från median baslinjen i PPI-skalan med ingen samtidig ökning i AS eller reduktion på ≥50% av användning av analgetika från baselinemedelvärde men ingen samtidig ökning av smärtan).
Totalt 755 patienter randomiserades till att få antingen JEVTANA 25 mg/m2 intravenöst var tredje vecka i maximalt 10 cykler tillsammans med peroralt prednison eller prednisolon 10 mg dagligen (n=378) eller att erhålla mitoxantron 12 mg/m2 intravenöst var tredje vecka under maximalt 10 cykler tillsammans med peroralt prednison eller prednisolon 10 mg dagligen (n=377).
Denna studie inkluderade patienter över 18 år med metastatisk kastrationsresistent prostatacancer antingen mätbar via RECIST-kriterierna eller icke mätbar sjukdom med ökande PSA nivåer eller framträdande av nya lesioner och med utförandestatus 0 till 2 enligt ”Eastern Cooperative Oncology Group” (ECOG) Patienterna skulle ha neutrofiler >1500/mm3, blodplättar >100 000/mm3, hemoglobin >10 g/dl, kreatinin <1,5 x ULN, totalbilirubin <1 x ULN samt ASAT och ALAT <1,5 x ULN.
Patienter med en anamnes på hjärtsvikt eller hjärtinfarkt under de senaste 6 månaderna eller patienter med okontrollerad hjärtarytmi, angina pectoris och/eller hypertension, var inte inkluderade i studien.
Demografi, inklusive ålder, ras och ECOG utförandestatus (0 till 2) var balanserad mellan behandlingsarmarna. I JEVTANA-gruppen var medelvärdet för ålder 68 år (46-92) och rasfördelningen var 83,9 % kaukasier, 6,9 % asiater/orientaler, 5,3 % svarta och 4 % övriga.
Medianantalet cykler var 6 i JEVTANA-gruppen och 4 i mitoxantron-gruppen. Antalet patienter som fullföljde studiebehandlingen (10 cykler) var 29,4 % JEVTANA-gruppen jämfört med 13,5 % i jämförelsegruppen.
Total överlevnad var signifikant längre med JEVTANA jämfört med mitoxantron (15,1 månader jämfört med 12,7) med en 30 %-ig reduktion i risk för död jämfört med mitoxantron (se tabell 3 och figur 1).
En subgrupp med 59 patienter fick en kumulativ dos av docetaxel på <225 mg/m2 innan (29 patienter i JEVTANA-armen, 30 patienter i mitoxantron-armen). Det sågs ingen signifikant skillnad i total överlevnad i denna grupp av patienter (HR (95 % CI) 0,96 (0,49-1,86)).
|
JEVTANA + prednison n=378 |
mitoxantron + prednison n=377 |
|
|---|---|---|
|
Total överlevnad | ||
|
Antal patienter med dödsfall (%) |
234 (61,9 %) |
279 (74 %) |
|
Median överlevnad (månader) (95 % CI) |
15,1 (14,1-16,3) |
12,7 (11,6-13,7) |
|
Hazard ratio (HR)1 (95 % CI) |
0,70 (0,59-0,83) |
|
|
p-värde |
<0,0001 |
|
|
1HR uppskattat genom användandet av Cox modell; ett hazard ratio på mindre än 1 ger fördel till JEVTANA |
||
Det fanns en förbättring i PFS i JEVTANA-armen jämfört med mitoxantron-armen, 2,8 (2,4-3,0) månader jämfört med 1,4 (1,4-1,7), HR (95% CI) 0,74 (0,64-0,86), p<0,0001.
Det fanns en signifikant högre tumörsvarsfrekvens; 14,4% (95% CI: 9,6-19,3) hos patienter i JEVTANA-armen jämfört med 4,4% (95% CI:1,6-7,2) för patienterna i mitoxantron-armen, p=0,0005.
Sekundära endpoints med avseende på PSA var positiva i JEVTANA-armen. Det fanns en mediantid till progression för PSA på 6,4 månader (95% CI:5,1-7,3) för patienter i JEVTANA-armen jämfört med 3,1 månader (95% CI:2,2-4,4) i mitoxantron-armen, HR 0,75 månader (95%CI:0,63-0,90), p=0,0010. PSA-svar sågs hos 39,2% av patienterna i JEVTANA-armen (95% CI:33,9-44,5) jämfört med 17,8% av patienterna som fick mitoxantron (95%CI: 13,7-22,0), p=0,0002.
Det fanns ingen statistisk skillnad mellan behandlingsarmarna vad gäller smärtprogression och smärtsvar.
I en likvärdig (non-inferiority) multicenter, multinationell, randomiserad öppen fas III studie (EFC11785), behandlades 1200 patienter med metastaserad kastrationsresistent prostatacancer som tidigare behandlats med docetaxelinnehållande behandling. De randomiserades till att få antingen cabazitaxel 25 mg/m2 (n=602) eller 20 mg/m2 (n=598) . Total överlevnad (OS) var den primära effekt endpointen.
Studien uppnådde sitt primära mål att visa på likvärdighet (non-inferiority) med cabazitaxel 20 mg/m2 i jämförelse med 25 mg/m2 (se tabell 4). En statistiskt signifikant högre procentandel (p<0,001) av patienterna visade ett PSA-svar i gruppen med 25 mg/m2 (42,9%) jämfört med gruppen 20 mg/m2 (29,5%). En statistisk signifikant högre risk för PSA progression hos patienter med dosen 20 mg/m2 jämfört med 25 mg/m2 observerades. (HR 1,195; 95% CI: 1,025-1,393). Det var ingen statistisk skillnad avseende de andra sekundära endpoints (progressionsfri överlevnad (PFS), tumör och smärtrespons, tumör och smärt progression och fyra underkategorier av FACT-P).
|
|
|
CBZ20+PRED n=598 |
CBZ25+PRED n=602 |
|
Total överlevnad |
|
|
|
|
Antal dödsfall, n (%) |
|
497 (83,1 %) |
501 (83,2%) |
|
Median överlevnad (95% CI) (månader) |
|
13,4 (12,19 till 14,88) |
14.5 (13,47 till 15,28) |
|
Hazard Ratioa |
|
|
|
|
|
versus CBZ25+PRED |
1,024 |
- |
|
|
1-sidig 98,89% UCI |
1,184 |
- |
|
|
1-sidig 95% LCI |
0,922 |
- |
CBZ20=Cabazitaxel 20 mg/m2, CBZ25=Cabazitaxel 25 mg/m2, PRED=Prednison/Prednisolon
CI=konfidensintervall, LCI=nedre gräns i konfidensintervallet, UCI= övre gräns i konfidensintervallet
a Hazard ratio uppskattat genom användandet av ”Cox Proportional Hazards regression modell”. Ett hazard ratio < 1 indikerar en lägre risk med Cabazitaxel 20 mg/m2 jämfört med 25 mg/m2.
Säkerhetsprofilen för cabazitaxel med dosen 25 mg/m2 observerades i studie EFC11785 var kvalitativt och kvantitativt liknande den som sågs i studie EFC6193. Studie EFC11785 visade en bättre säkerhetsprofil för cabazitaxel med dosen 20 mg/m2.
|
|
CBZ20+PRED n=580 |
CBZ25+PRED n=595 |
|
Median antal cykler/ median behandlingstid |
6/ 18 veckor |
7/ 21 veckor |
|
Antal patienter med dosreduktion
|
Från 20 till 15 mg/m2: 58 (10.0%)
|
Från 25 till 20 mg/m2: 128 (21,5%)
|
|
Alla grader av biverkningara (%) |
|
|
|
Diarré |
30,7 |
39,8 |
|
Illamående |
24,5 |
32,1 |
|
Fatigue |
24,7 |
27,1 |
|
Hematuri |
14,1 |
20,8 |
|
Asteni |
15,3 |
19,7 |
|
Minskad aptit |
13,1 |
18,5 |
|
Kräkningar |
14,5 |
18,2 |
|
Förstoppning |
17,6 |
18,0 |
|
Ryggsmärta |
11,0 |
13,9 |
|
Klinisk neutropeni |
3,1 |
10,9 |
|
Urinvägsinfektion |
6,9 |
10,8 |
|
Perifer sensorisk neuropati |
6,6 |
10,6 |
|
Dysgeusi |
7,1 |
10,6 |
|
Grad ≥ 3 biverkningarb (%) |
|
|
|
Klinisk neutropeni |
2,4 |
9,6 |
|
Febril neutropeni |
2,1 |
9,2 |
|
Haematologiska avvikelserc (%) |
|
|
|
Grad ≥ 3 neutropeni |
41,8 |
73,3 |
|
Grad ≥ 3 anaemi |
9,9 |
13,7 |
|
Grad ≥ 3 trombocytopeni |
2,6 |
4,2 |
CBZ20=Cabazitaxel 20 mg/m2, CBZ25=Cabazitaxel 25 mg/m2, PRED=Prednison/Prednisolon
a All grader biverkningar med en incidens högre än 10%
b Grad ≥ 3 biverkningar med en incidens högre än 5%
c Baserat på laboratorievärden
I en prospektiv, multinationell, randomiserad, aktivt kontrollerad och öppen fas IV-studie (LPS14201/CARD-studie) randomiserades 255 patienter med metastatisk kastrationsresistent prostatacancer (mCRPC), som tidigare behandlats i valfri ordning med en docetaxelbehandling och med ett AR-riktat läkemedel (abirateron eller enzalutamid, med sjukdomsprogression inom 12 månader efter behandlingsstart) till att få antingen JEVTANA 25 mg/m2 var tredje vecka plus prednison/prednisolon 10 mg dagligen (n = 129) eller AR-riktade läkemedel (abirateron 1000 mg en gång dagligen plus prednison/prednisolon 5 mg två gånger dagligen eller enzalutamid 160 mg en gång dagligen) (n = 126). Radiologiskt verifierad progressionsfri överlevnad (rPFS) som definierats av Prostatacancer Working Group-2 (PCWG2) var den primära slutpunkten. Sekundära slutpunkter inkluderade total överlevnad, progressionsfri överlevnad, PSA-respons och tumörrespons.
Demografi och sjukdomsegenskaper balanserades mellan behandlingsarmarna. Vid baslinjen var den totala medianåldern 70 år, 95 % av patienterna hade en ECOG PS på 0 till 1 och medianvärdet av Gleasonsumman var 8. Sextioen procent (61 %) av patienterna behandlades tidigare med ett AR-riktat medel efter att tidigare behandlats med docetaxel.
Studien nådde sin primära slutpunkt: rPFS var signifikant längre med JEVTANA jämfört med AR-riktat läkemedel (8,0 månader respektive 3,7 månader), med en 46 % reduktion av risken för radiografisk progression jämfört med AR-riktat läkemedel (se tabell 6 och figur 2).
Tabell 6 – Effekt av JEVTANA i CARD-studien vid behandling av patienter med metastatisk kastrationsresistent prostatacancer (’intent-to-treat’ analys) - Radiologiskt verifierad progressionsfri överlevnad (rPES).
|
|
JEVTANA +prednison/prednisolon +G-CSF n=129 |
AR-riktat läkemedel; Abirateron + prednison/prednisolon eller Enzalumatid n=126 |
|---|---|---|
|
Antal händelser vid slutdatumet (%) |
95 (73,6 %) |
101 (80,2 %) |
|
Medianvärde rPFS (månader) (95 % KI) |
8,0 (5,7 till 9,2) |
3,7 (2,8 till 5,1) |
|
Riskförhållande (HR) (95 % KI) |
0,54 (0,40 till 0,73) |
|
|
p-värde1 |
< 0,0001 |
|
|
1stratifierat log-rank-test, signifikanströskel = 0,05 |
||
Bild 2 - Primär slutpunkt: Kaplan-Meier-diagram över radiologiskt verifierad PFS (ITT-population)
Planerade undergruppsanalyser för rPFS baserat på stratifieringsfaktorer vid randomisering gav ett riskförhållande på 0,61 (95 % KI: 0,39 till 0,96) hos patienter som fick ett tidigare AR-riktat läkemedel före docetaxel och ett riskförhållande på 0,48 (95 % KI: 0,32 till 0,70) hos patienter som fick ett tidigare AR-riktat läkemedel efter docetaxel.
JEVTANA var statistiskt överlägsen de AR-riktade komparatorerna för var och en av de alfa-skyddade viktiga sekundära slutpunkterna inklusive total överlevnad (13,6 månader för JEVTANA-armen jämfört med 11,0 månader för AR-riktade läkemedelsarmen, HR 0,64, 95 % KI: 0,46 till 0,89; p = 0,008), progressionsfri överlevnad (4,4 månader för JEVTANA-armen kontra 2,7 månader för AR-riktade läkemedelsarmen, HR 0,52; 95 % KI: 0,40 till 0,68), bekräftat PSA-svar (36,3 % för JEVTANA-armen kontra 14,3 % för AR-riktade läkemedelsarmen, p = 0,0003) och bästa tumörsvar (36,5 % för JEVTANA-armen kontra 11,5 % för AR-riktade läkemedelsarmen, p = 0,004).
Säkerhetsprofilen för JEVTANA 25 mg/m2 observerad i CARD-studien var likvärdig med den som observerades i TROPIC- och PROSELICA-studier (se avsnitt Biverkningar). Förekomsten av grad ≥ 3 biverkningar var 53,2 % i JEVTANA-armen jämfört med 46,0 % i den AR-riktade läkemedelsarmen. Förekomsten av grad ≥ 3 allvarliga biverkningar var 31,7 % i JEVTANA-armen jämfört med 37,1 % i AR-riktade läkemedelsarmen. Förekomsten av patienter som permanent avbröt studiebehandlingen på grund av biverkningar var 19,8 % i JEVTANA-armen jämfört med 8,1 % i AR-riktade läkemedelsarmen. Förekomsten av patienter som hade en biverkning som ledde till dödlig utgång var 5,6 % i JEVTANA-armen jämfört med 10,5 % i den AR-riktade läkemedelsarmen.
Pediatrisk population
Europeiska läkemedelsmyndigheten har tagit bort kravet att skicka in studieresultat för JEVTANA för alla grupper av den pediatriska populationen för indikationen prostatacancer (se avsnitt Dosering) för information angående pediatrisk användning).
JEVTANA utvärderades i en öppen multicenter fas 1/2 studie med totalt 39 pediatriska patienter (i åldrarna 4 till 18 år i fas 1 delen och mellan 3 till 16 år i fas 2 delen av studien). I fas 2 visade inte cabazitaxel någon effekt som monoterapi i dosen 30 mg/m2 hos den pediatriska populationen med återkommande eller refraktärt diffusa infiltrerade pontinegliom” (DIPG) och höggradigt gliom (HGG).
Farmakokinetik
En populationskinetisk analys utfördes hos 170 patienter inkluderande patienter med avancerade solida tumörer (n=69), metastatisk bröstcancer (n=34) och metastatisk prostatacancer (n=67). Dessa patienter erhöll cabazitaxel i doser mellan 10 och 30 mg/m2 veckovis eller var tredje vecka.
Absorption
Efter 1 timmes intravenös infusion med 25 mg/m2 cabazitaxel hos patienter med metastatisk prostatacancer (n=67), var Cmax 226 ng/ml (variationskoefficient (CV): 107%) och nåddes i slutet av 1-timmes infusionen (Tmax). Medelvärdet för AUC var 991 ng*h/ml (CV: 34%).
Ingen större avvikelse i dosproportionaliteten observerades från 10 till 30 mg/m2 hos patienter med avancerade solida tumörer (n=126).
Distribution
Distributionsvolymen (Vss) var 4870 l (2640 l/m2 för en patient med en median kroppsyta på 1,84 m2) vid steady state.
In vitro är bindningen av cabazitaxel till humana serumproteiner 89-92% och var inte mättnadsbar upp till 50,000 ng/ml, vilket täcker den maximala koncentrationen man sett i kliniska studier. Cabazitaxel binds främst till humant serumalbumin (82%) och lipoproteiner (87,9% för HDL, 69,8% för LDL och 55,8% för VLDL). Blod-till-plasma koncentrationsförhållandet i humant blod in vitro sträckte sig från 0,90 till 0,99 vilket indikerar att cabazitaxel var likvärdigt distribuerat mellan blod och plasma.
Biotransformation
Cabazitaxel metaboliseras framför allt i levern (>95%), främst via CYP3A isoenzymer (80%-90%). Cabazitaxel är det ämne som främst cirkulerar i humanplasma. Sju metaboliter har detekterats i plasma (varav 3 aktiva metabiliter som härrör från O-demetylering), varav den främsta svarar för 5% av exponeringen. Omkring 20 metaboliter av cabazitaxel utsöndras genom urin och avföring.
Grundat på in vitro studier är den potentiella risken för inhibering genom cabazitaxel, vid kliniskt relevanta koncentrationer, möjlig hos läkemedel som främst är substrat för CYP3A. En klinisk studie har dock visat att cabazitaxel (25 mg/m2 administrerat som en 1-timmes infusion) inte påverkade plasmanivåerna av midazolam, ett testsubstrat för CYP3A. Vid terapeutiska doser förväntas inte att samtidig administrering med CYP3A-substrat och cabazitaxel har någon klinisk påverkan.
Det finns ingen potentiell risk för inhibering av läkemedel som är substrat för andra CYP enzymer (1A2, 2B6, 2C9, 2C8, 2C19, 2E1 och 2D6) och ingen möjlig risk för att cabazitaxel inducerar läkemedel som är substrat av CYP1A, CYP2C9 och CYP3A. Cabazitaxel hindrade inte den huvudsakliga biotransformationsvägen av warfarin till 7-hydroxiwarfarin in vitro, vilken medieras via CYP2C9. Ingen farmakokinetisk interaktion mellan cabazitaxel och warfarin förväntas in vivo.
In vitro hämmade cabazitaxel inte Multidrog-Resistenta Proteiner (MRP): MRP1 och MRP2 eller Organiska Katjon transportörer (OCT1). Cabazitaxel hämmade transporten av P-glykoproteiner (PgP) (digoxin, vinblastin), Bröstcancer-Resistenta- Proteiner (BCRP) (metotrexate) och Organiska Anjon Transport Polypeptider (OATP1B3) (CCK8) vid koncentrationer på minst 15 gånger mer än vad man sett i kliniska försök. Den inhiberade transporten av OATP1B1 (östradiol-17β-glukuronid) vid koncentrationer endast 5 gånger mer än vad man sett i kliniska försök. Risken för interaktion med substrat med MRP, OCT1, PgP, BCRP och OATP1B3 är därför osannolik in vivo med dosen 25 mg/m2. Risken för interaktion med OATP1B1 transportörer är möjlig, särskilt under infusionstiden (1 timme) och upp till 20 minuter efter infusionen (se avsnitt Interaktioner).
Eliminering
Efter 1 timmes intravenös infusion med 14C-märkt cabazitaxel vid dosen 25 mg/m2 hos patienter var ungefär 80% av den administrerade dosen eliminerad inom 2 veckor. Cabazitaxel utsöndras främst i avföringen som flertalet metaboliter (76% av dosen); medan renal utsöndring av cabazitaxel och metaboliter står för mindre än 4% av dosen (2,3% som oförändrad medicinsk produkt i urinen).
Cabazitaxel har hög plasmaclearance på 48,5 l/h (26,4 l/h/m2 hos en patient med en median kroppsyta på 1,84 m2) och en lång terminal halveringstid på 95 timmar.
Speciella patientgrupper
Äldre patienter
I populationsfarmakokinetiska analyser hos 70 patienter 65 år eller äldre (57 st från 65 till 75 och 13 patienter över 75) observerades ingen ålderseffekt på cabazitaxels farmakokinetik.
Barn
Säkerhet och effekt har inte utvärderats hos barn och ungdomar under 18 års ålder.
Leverfunktionsnedsättning
Cabazitaxel elimineras främst genom levermetabolism.
I en studie på 43 cancerpatienter med nedsatt leverfunktion sågs ingen påverkan av lätt
(totalt bilirubin >1 till ≤1,5 gånger det övre normalvärdet ULN eller ASAT >1,5 gånger ULN) eller måttligt (totalt bilirubin >1,5 till ≤3,0 gånger det övre normalvärdet ULN) nedsatt leverfunktion vad gäller cabazitaxels farmakokinetik. Den högsta tolererade dosen (MTD) var 20 respektive 15 mg/m2.
Hos 3 patienter med gravt nedsatt leverfunktion (totalt bilirubin >3 ULN), observerades en minskning av clearance på 39 % jämfört med patienter med en lätt nedsatt leverfunktion, vilket tyder på en påverkan på cabazitaxels farmakokinetik på grund av nedsatt leverfunktion. Den högsta tolererade dosen (MTD) hos patienter med gravt nedsatt leverfunktion har inte fastställts.
Cabazitaxeldosen ska, grundat på säkerhetsdata och tolererbarhet, reduceras hos patienter med lätt nedsatt leverfunktion, (se avsnitt Dosering och Varningar och försiktighet). JEVTANA är kontraindicerat hos patienter med gravt nedsatt leverfunktion.
Njurfunktionsnedsättning
Cabazitaxel elimineras minimalt via njurarna (2,3% av dosen). En populations-farmakokinetisk analys hos 170 patienter, som inkluderade 14 patienter med måttlig renal funktionsnedsättning (kreatininclearance mellan 30 till 50 ml/min) och 59 patienter med mild njurfunktionsnedsättning (kreatininclearance mellan 50 till 80 ml/min) visade att mild till måttlig njurfunktionsnedsättning inte hade någon betydelsefull påverkan på cabazitaxels farmakokinetik.
Detta bekräftades av en dedikerad jämförande farmakokinetisk studie på patienter med solid cancer med normal njurfunktion (8 patienter), måttlig (8 patienter) och allvarlig njurfunktionsnedsättning (9 patienter) som fått flera cykler med cabazitaxel som enskild intravenös infusion upp till 25 mg/m2
Prekliniska uppgifter
Biverkningar som inte noterats i kliniska studier men sågs hos hundar efter singeldoser, administrering av dos var 5:e dag samt veckovis administrering på lägre nivåer än vid klinisk användning och med möjlig relevans till klinisk användning var arteriolär/periarteriolär nekros i levern, gallvägshyperplasi och/eller hepatocellulär nekros (se avsnitt Dosering).
Biverkningar som inte noterats i kliniska studier men sågs hos råttor under toxcitetsstudier vid exponering med upprepade doser vid högre nivåer än den kliniska exponeringen och med möjlig relevans till klinisk användning var ögonpåverkan karaktäriserad av subkapsulär linsfiber- svullnad/degeneration. Dessa effekter var partiellt reversibla efter 8 veckor.
Karcinogenicitetsstudier har inte utförts med cabazitaxel.
Cabazitaxel inducerar inte mutationer i Ames test (bacterial reverese mutation). I ett in vitro test i humana lymfocyter (ingen inducering av strukturella kromosomala aberrationer men ökat antal polyploida celler) sågs ingen klastogen aktivitet och cabazitaxel inducerade en ökning av mikronuklein i ett in vivo test hos råttor. Dessa genotoxiska fynd (genom en aneugen mekanism) grundar sig på den farmakologiska aktiviteten av ämnet (inhibering av tubulindepolymerisation).
Cabazitaxel påverkade inte parningsförmågan eller fertiliteten hos behandlade hanråttor. I toxicitetsstudier med upprepad dosering observerades degenerering av sädesblåsor och atrofi av tubuli seminiferi i testiklarna hos råttor och hos hundar observerades testikulär degeneration (minimal epitelial cellnekros i bitestikeln). Exponeringen hos djur var lika eller lägre än hos människa som fick kliniskt signifikanta doser av cabazitaxel.
Cabazitaxel inducerade embryofetal toxicitet hos honråttor som behandlats intravenöst en gång dagligen från graviditetsdag 6 till 17. Detta var förenat med maternell toxicitet och bestod av fosterdöd, och minskad fostervikt förknippad med en fördröjning av skelettossifikationen. Exponeringen hos djur var lägre än den som ses hos människa vid kliniskt relevanta doser av cabazitaxel. Cabaxitaxel passerade placentabarriären hos råtta.
Hos råttor utsöndras upp till 1,5% av den administrerade dosen cabazitaxel med dess metaboliter över 24 timmar, via modersmjölk.
Miljöriskbedömning
Resultat av riskbedömningsstudier med avseende på miljön indikerar att JEVTANA inte orsakar någon signifikant risk på vattenmiljön (se avsnitt Hållbarhet, förvaring och hantering angående avfall av oanvänt läkemedel).
Innehåll
Kvalitativ och kvantitativ sammansättning
En ml av koncentratet innehåller 40 mg cabazitaxel.
En injektionsflaska med 1,5 ml (nominell volym) koncentrat innehåller 60 mg cabazitaxel.
Efter den första spädningen med all spädningsvätska innehåller varje ml lösning 10 mg cabazitaxel.
Observera: Både JEVTANA 60 mg/1,5 ml injektionsflaska med koncentrat (fyllnadsvolym: 73,2 mg cabazitaxel/1,83 ml) och injektionsflaskan med spädningsvätska (fyllnadsvolym: 5,67 ml) innehåller en överfyllnad för att kompensera för vätskeförluster under beredning. Denna överfyllnad försäkrar att man efter spädning med HELA innehållet av den medföljande spädningsvätskan, erhåller en lösning som innehåller 10 mg/ml cabazitaxel.
Hjälpämnen med känd effekt
En injektionsflaska med spädningsvätska innehåller 573,3 mg 96%-ig etanol.
Förteckning över hjälpämnen
Koncentrat
Polysorbat 80
Citronsyra
Spädningsvätska
Etanol 96%
Vatten för injektionsvätskor
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns under avsnitt Hållbarhet, förvaring och hantering. Använd inte infusionsbehållare av PVC eller infusionsset med polyuretan för beredning och administration av infusionslösningen.
Miljöpåverkan
Kabazitaxel
Miljörisk:
Användning av cabazitaxel har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Cabazitaxel är potentiellt persistent.
Bioackumulering:
Cabazitaxel har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (µg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R)
PEC = 1.07*10-5 µg/L
Where:
A = 0.0778 kg (total sold amount API in Sweden year 2022, data from IQVIA)
R = 0% removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation)
P = number of inhabitants in Sweden = 10*106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Ref I).
D = factor of dilution of waste water by surface water flow = 10 (ECHA default) (Ref I).
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae (Pseudokirchneriella subcapitata):
EC50 72 h (biomass): 92 μg/L
NOEC 72 h (biomass): 43 μg/L
EC50 72 h (growth inhibition): 130 μg/L
NOEC 72 h (growth inhibition): 64 μg/L
(Protocol: OECD 201)
(Ref II)
Crustacean (Daphnia magna):
EC50 21 days (reproduction): >20 μg/L
NOEC 21 days (survival): 20 μg/l
NOEC 21 days (reproduction): 8.9 μg/L
(Protocol: OECD 211)
(Ref III)
Fish (Pimephales promelas):
NOEC 32 days (survival and growth rate): 110 μg/L
(Protocol: OECD 210)
(Ref IV)
Other ecotoxicity data:
PNEC = 0.89 µg/L
The PNEC (μg/L) = lowest EC50/10 was calculated using results from the most sensitive chronic toxicity endpoint and an assessment factor of 10 (long-term results from at least three species of the base set), to add a safety margin to the toxicity endpoint. The most sensitive species was Daphnia magna for which the NOEC 21 days was 8.9 μg/L.
Environmental Risk Classification (PEC/PNEC ratio)
PEC/PNEC= 1.07*10-5/0.89 = 1.2*10-5
PEC/PNEC ≤ 0.1 which justifies the phrase “Use of cabazitaxel has been considered to result in insignificant environmental risk”.
Degradation
Biotic degradation
Ready degradability:
Test showed 17.76 % degradation in 28 days (guideline OECD 301B)
(Ref V)
Justification of chosen degradation phrase:
Cabazitaxel fails to pass the criteria for ready biodegradability which justifies the phrase “Cabazitaxel is potentially persistent”.
Bioaccumulation
Partitioning coefficient:
Log Pow = 3.78 at pH 7 (guideline OECD 107) (Ref VI)
Justification of chosen bioaccumulation phrase:
Since log Pow < 4 at pH 7, cabazitaxel has low potential for bioaccumulation.
Excretion (metabolism)
Cabazitaxel is excreted to 2.3 % as parent compound and to 76 % as metabolites (Ref VII). Metabolites identified are around 20 (Ref VIII). The pharmacological activity of the metabolites is not known.
References
-
ECHA, European Chemicals Agency, 2008 Guidance on information requirements and chemical safety assessment.
-
Sanofi, internal report: 72-hour acute toxicity test with freshwater green alga, Pseudokirchneriella subcapitata. OECD 201. Report # 13570.6174, March 2010.
-
Sanofi, internal report: Full life-cycle toxicity test with water fleas, Daphnia magna under flow-through conditions. OECD 211. Report # 13570.6177, March 2010.
-
Sanofi, internal report: Early life-stage toxicity test with fathead minnow, Pimephales promelas. OECD 210. Report # 13570.6176, March 2010.
-
Sanofi, internal report: Determination of the biodegradability of a test substance. OECD 301B. Report # 13570.6173, March 2010.
-
Sanofi, internal report: Determinating the partition coefficient (n-Octanol/Water) by the flask-shaking method. OECD 107. Report # 13570.6170, March 2010.
-
Nightingale G, Ryu J. 2012. Cabazitaxel (Jevtana) A novel agent for metastatic castration-resistant prostate cancer. Drug Forecast. 37: 440-448.
-
Jevtana (Cabazitaxel) Injection, prescribing information. Bridgewater, N.J.: Sanofi; Jun, 2010. Available at: http://products.sanofi.us/jevtana/jevtana.html. Accessed February 25, 2014.
Hållbarhet, förvaring och hantering
Hållbarhet
Oöppnad injektionsflaska
3 år
Efter öppnandet
Injektionsflaskorna med koncentrat och spädningsvätska ska användas omedelbart. Om det inte används på en gång är förvaringstid och förvaringsförhållanden användarens ansvar.
Efter den första spädningen av koncentrat med spädningsvätskan
Kemisk och fysikalisk stabilitet har visats för 1 timme vid omgivande temperatur (15-30 °C).
Ur en mikrobiologisk synvinkel ska blandningen användas omedelbart. Om den inte används på en gång är förvaringsförhållanden och förvaringstid användarens ansvar och bör inte överstiga 24 timmar vid 2-8 °C såvida inte spädningen utförts under kontrollerade och validerade aseptiska former.
Efter final spädning i infusionspåsen/-flaskan
Kemisk och fysikalisk stabilitet av infusionslösningen har visats under 8 timmar vid omgivande temperatur (inkluderat 1 timmes infusionstid) och i 48 timmar under kylbetingelser (inkluderat 1 timmes infusionstid).
Ur mikrobiologisk synvinkel ska infusionen användas omedelbart. Om den inte används på en gång är förvaringsförhållanden och förvaringstid användarens ansvar och bör inte överstiga 24 timmar vid 2-8 °C såvida inte spädningen utförts under kontrollerade och validerade aseptiska former.
Särskilda förvaringsanvisningar
Förvaras vid högst 30°C.
Förvaras i skydd mot kyla.
Särskilda anvisningar för destruktion
JEVTANA ska endast beredas och administreras av personal tränad på att hantera cytotoxiska ämnen.
Gravid personal ska inte hantera läkemedlet. Som för alla antineoplastiska ämnen ska försiktighet iakttas vid hantering och beredning av JEVTANA lösningar. Man ska tänka på användningen av säkerhetsutrustning, skyddsåtgärder för personal (t ex handskar) och beredningsanvisningar. Om JEVTANA under något steg av hanteringen skulle komma i kontakt med huden, tvätta omedelbart och noggrant med tvål och vatten. Om det kommer i kontakt med slemhinnor, skölj omedelbart och noggrant med rikliga mängder vatten.
Späd alltid ut koncentratet till infusionslösning med hela mängden medföljande spädningsvätska innan det tillsätts till en infusionslösning.
Läs HELA detta avsnitt noga innan blandning och spädning. JEVTANA behöver TVÅ spädningar innan administrering. Följ beredningsanvisningarna bifogade nedan.
Observera: Både JEVTANA 60 mg/1,5 ml injektionsflaska med koncentrat (fyllnadsvolym: 73,2 mg cabazitaxel/1,83 ml) och injektionsflaskan med spädningsvätskan (fyllnadsvolym: 5,67 ml) innehåller en överfyllnad för att kompensera för vätskeförluster under beredning. Denna överfyllnad försäkrar att man efter spädning med HELA innehållet av den medföljande spädningsvätskan, erhåller en lösning som innehåller 10 mg/ml cabazitaxel.
Följande spädningsprocess i 2 steg måste utföras aseptiskt för att bereda infusionslösningen.
Steg 1: Den första spädningen av koncentrat till infusionsvätska, lösning med den medföljande spädningsvätskan.
|
Steg 1.1 Inspektera injektionsflaskan med koncentrat och den medföljande spädningsvätskan. Lösningen med koncentrat och spädningsvätskan ska vara klar. | 
|
|
Steg 1.2 Använd en spruta med en nål fastsatt och dra aseptiskt upp hela innehållet av den medföljande spädningsvätskan genom att delvis vända flaskan. | 
|
|
Steg 1.3 Injicera hela innehållet i motsvarande injektionsflaska med koncentrat. För att begränsa skumbildning så mycket som möjligt när man injicerar spädningsvätskan, rikta nålen mot insidan av väggen och injicera långsamt. När den är beredd innehåller den färdiga lösningen cabazitaxel 10 mg/ml . | 
|
|
Steg 1.4 Ta bort sprutan och nålen och blanda försiktigt manuellt genom att vända flaskan upprepade gånger till man får en klar och homogen lösning. Det tar cirka 45 sekunder. | 
|
|
Steg 1.5 Låt lösningen stå i ungefär 5 minuter och kontrollera sedan att lösningen är klar och homogen. Det är normalt att skummet kvarstår efter denna tidsperiod. | 
|
|
Detta resulterar i en lösning med koncentrat och spädningsvätska innehållande 10 mg/ml med cabazitaxel (med åtminstone 6 ml användbar volym). Den andra spädningen bör göras omedelbart (inom 1 timme) såsom beskrivs i steg 2. Mer än en injektionsflaska med lösningen innehållande koncentrat och spädningsvätska kan behövas för att ge den förskrivna dosen. |
|
|
Steg 2: Den andra (finala) spädningen till infusionsvätska, lösning |
|
|
Steg 2.1 Dra aseptiskt upp den mängd som behövs av den blandade lösningen med koncentrat och spädningsvätska (10 mg/ml med cabazitaxel), med en graderad spruta med en nål fastsatt. Som ett exempel, en dos på 45 mg JEVTANA kräver 4,5 ml av blandningen med koncentrat och spädningsvätska som är beredd enligt Steg 1. Eftersom skum kan finnas kvar på injektionsflaskans vägg efter beredningen enligt Steg 1 så är det att föredra att hålla sprutnålen i mitten när man drar upp innehållet. | 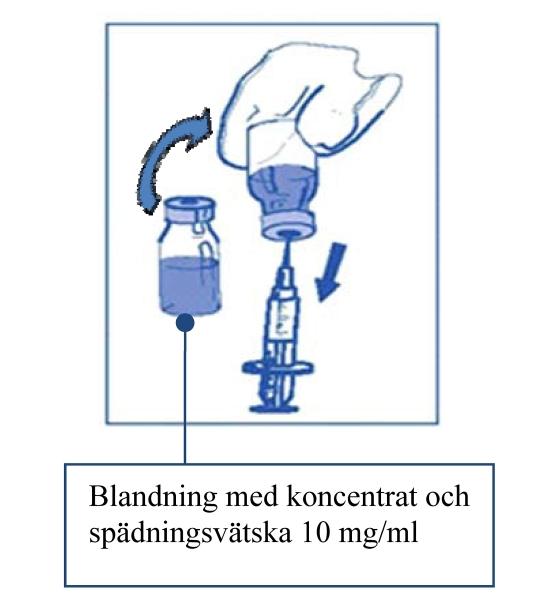
|
|
Steg 2.2 Injicera lösningen i en steril PVC-fri behållare med antingen 5 % glukoslösning eller natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning. Koncentrationen av infusionslösningen ska vara mellan 0,10 mg/ml och 0,26 mg/ml | 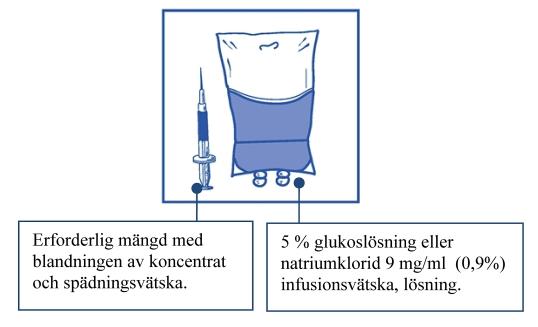
|
|
Steg 2.3 Tag bort sprutan och blanda innehållet i infusionspåsen eller flaskan manuellt genom en roterande rörelse. | 
|
|
Steg 2.4 Som med alla parenterala produkter ska den färdiga infusionslösningen inspekteras visuellt innan användning. Eftersom infusionslösningen är övermättad kan den kristalliseras över tiden. I dessa fall ska lösningen inte användas och ska kasseras. | 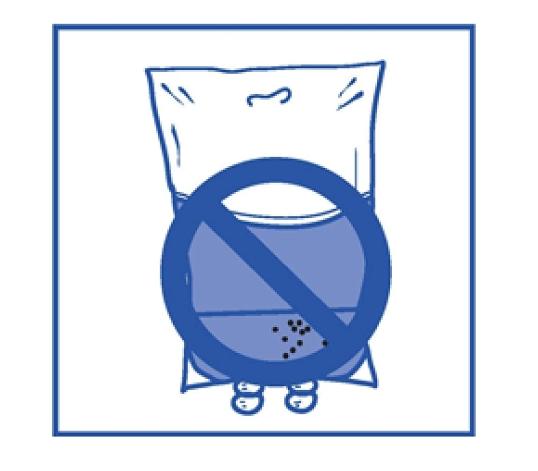
|
Ett filter med 0,22 mikrometer nominell porstorlek (kan också refereras till 0,2 mikrometer) rekommenderas under administrering.
Använd inte infusionsbehållare av PVC eller infusionsset med polyuretan för beredning och administration av JEVTANA.
JEVTANA får inte blandas med några andra läkemedel än de nämnda.
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar
Egenskaper hos läkemedelsformen
Koncentrat och vätska till infusionsvätska, lösning (sterilt koncentrat).
Koncentratet är en klar, gul till brungul oljig lösning.
Spädningsvätskan är en klar och färglös lösning.
Förpackningsinformation
Koncentrat och vätska till infusionsvätska, lösning 60 mg
Koncentrat: klar, gul till brungul oljig lösning. Spädningsvätska: klar och färglös lösning.
1 styck injektionsflaska (fri prissättning), EF
Följande produkter har även parallelldistribuerade förpackningar:
Koncentrat och vätska till infusionsvätska, lösning 60 mg





