Indikationer
Numeta G19E är indicerat för parenteral nutrition till barn över 2 år och ungdomar 16-18 år när oral eller enteral nutrition är omöjlig, otillräcklig eller kontraindicerad.
Kontraindikationer
De allmänna kontraindikationerna för administrering av Numeta G19E som en aktiverad tvåkammarpåse för intravenös infusion är följande:
-
Överkänslighet mot ägg, soja eller jordnötsprotein eller mot någon av de aktiva substanserna, hjälpämnena som anges i avsnitt Innehåll eller behållarens beståndsdelar
-
Medfödd störning i aminosyrametabolismen
-
Patologiskt förhöjda plasmakoncentrationer av natrium, kalium, magnesium, kalcium och/eller fosfor
-
Allvarlig hyperglykemi
Tillsats av lipider (administrering av Numeta G19E som en aktiverad trekammarpåse) är kontraindicerad i följande kliniska situationer:
-
Allvarlig hyperlipidemi eller svåra störningar av lipidmetabolismen som karaktäriseras av hypertriglyceridemi
Dosering
Dosering
Doseringen beror på energiförbrukningen, på patientens vikt, ålder, kliniska status samt förmåga att metabolisera innehållsämnena i Numeta G19E, liksom på extra energi- eller proteintillskott som administreras oralt/enteralt. Total sammansättning av elektrolyter och makronäringsämnen beror på antalet aktiverade kamrar (se avsnitt 2).
Den maximala dagliga dosen bör ej överskridas. På grund av flerkammarpåsens fasta komposition, kan patientens totala nutritionsbehov inte alltid tillgodoses. Vid vissa kliniska situationer kan patienten behöva doser av näringsämnen som inte täcks av den fasta sammansättningen i påsen.
Högsta rekommenderade infusionshastighet per timme och volym per dag beror på sammansättningen. Den maximala dagliga dosen baseras på den av dessa gränser som nås först. Riktlinjerna för högsta rekommenderade infusionshastighet per timme och volym per dag är:
|
Aktiverad tvåkammarpåse (775 ml) |
Aktiverad trekammarpåse (1000 ml) |
|
|---|---|---|
|
Maximal infusionshastighet i ml/kg/tim |
4,7 |
4,6 |
|
vilket motsvarar: | ||
|
Aminosyror g/kg/tim |
0,14a |
0,11 |
|
Glukos g/kg/tim |
1,17 |
0,89 |
|
Lipider i g/kg/tim |
0 |
0,13a |
|
Total mängd i ml/kg/dygn |
64,8 |
83,6 |
|
vilket motsvarar: | ||
|
Aminosyror i g/kg/dygn |
1,9 |
1,9 |
|
Glukos i g/kg/dygn |
16,0a |
16,0a |
|
Lipider i g/kg/dygn |
0 |
2,3 |
aBegränsande parameter enligt ESPEN/ESPGHAN-riktlinjerna
Administreringssätt
För anvisningar om beredning och hantering av infusionsvätskan/emulsionen, se avsnitt Hållbarhet, förvaring och hantering.
Lösning (i påsar och infusionsaggregatet) ska skyddas mot ljus ända från blandning t.o.m. administrering av infusionen (se avsnitt Varningar och försiktighet och Hållbarhet, förvaring och hantering).
Användning av ett filter med storleken 1,2 mikrometer rekommenderas vid administrering av Numeta G19E.
På grund av dess höga osmolaritet kan ospädd Numeta G19E endast administreras via en central ven. Tillräcklig spädning av Numeta G19E med vatten för injektionsvätskor minskar emellertid osmolariteten och möjliggör perifer infusion. Formeln nedan anger hur spädning påverkar osmolariteten i påsarna:
Tabellen nedan visar exempel på osmolaritet för aktiverad trekammarpåse efter tillsats av vatten för injektionsvätskor:
|
Aminosyror, glukos och lipider (aktiverad trekammarpåse) |
|
|---|---|
|
Initial volym i påsen (ml) |
1000 |
|
Initial osmolaritet (mOsm/l, ca.) |
1460 |
|
Tillsatt vattenmängd (ml) |
1000 |
|
Slutlig volym efter tillsatser (ml) |
2000 |
|
Osmolaritet efter tillsatser (mOsm/l, ca.) |
730 |
Flödeshastigheten ökas gradvis under den första timmen. Vid avbrytande av behandling med Numeta G19E bör flödeshastigheten minskas gradvis under den sista timmen. Administreringshastigheten ska anpassas med hänsyn till doseringen, den dagliga tillförda volymen och infusionens varaktighet, se avsnitt Överdosering.
Samma påse får inte aktiveras, hänga uppe och infunderas längre än 24 timmar. Cyklisk infusion ska ges enligt patientens metaboliska tolerans.
Behandling med parenteral nutrition kan fortsätta så länge som patientens kliniska tillstånd kräver det.
Denna produkt innehåller elektrolyter och kan kompletteras med kommersiella elektrolytberedningar enligt läkares bedömning och patientens kliniska behov, se avsnitt Hållbarhet, förvaring och hantering.
Vitaminer och spårämnen kan tillsättas enligt läkares bedömning och patientens kliniska behov, se avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Infusionen måste avbrytas omedelbart om några tecken eller symtom på allergisk reaktion (som feber, svettningar, frossa, huvudvärk, hudutslag eller dyspné) utvecklas.
Numeta G19E innehåller glukos framställd av majsstärkelse. Numeta G19E ska användas med försiktighet till patienter med känd allergi mot majs eller majsprodukter.
Hos alla patienter oavsett ålder (inklusvie vuxna) får ceftriaxon inte blandas med eller administreras tillsammans med kalciuminnehållande intravenösa lösningar inklusive Numeta G19E, inte ens via olika infusionsslangar eller på olika infusionsställen, på grund av risken för utfällning av ceftriaxonkalciumsalt.
Hos patienter äldre än 28 dagar kan dock ceftriaxon och kalciuminnehållande lösningar administreras sekventiellt efter varandra om infusionsslangar på olika ställen används, eller om infusionsslangarna byts ut, eller spolas noggrant med fysiologisk koksaltslösning mellan infusionerna, för att undvika utfällning.
Pulmonära vaskulära utfällningar som kan orsaka lungemboli och andningssvårigheter har rapporterats hos patienter som får parenteral nutrition. I vissa fall med fatala utfall. Överdriven tillsats av kalcium och fosfat ökar risken för utfällning av kalciumfosfat (se avsnitt Blandbarhet). Misstänkta utfällningar i blodomloppet har också rapporterats.
Utöver inspektion av lösningen, ska även infusionsaggregatet och katetern kontrolleras avseende utfällningar med jämna mellanrum.
Vid tecken på andningssvårigheter ska infusionen avbrytas och medicinsk utvärdering påbörjas.
Inga tillsatser får göras till påsen utan att först kontrollera kompatibiliteten, eftersom bildandet av utfällningar eller destabilisering av lipidemulsionen kan leda till vaskulär ocklusion, se avsnitt Blandbarhet och Hållbarhet, förvaring och hantering.
Infektion och sepsis kan uppstå på grund av användandet av intravenösa katetrar för administrering av parenterala formuleringar eller dåligt underhåll av katetrar. Immunosuppressiva effekter av sjukdom eller läkemedel kan främja infektion och sepsis. Noggrann övervakning av symtom och laboratorievärden för feber/frossa, leukocytos, tekniska komplikationer rörande aggregatet och hyperglykemi kan bidra till tidig upptäckt av infektioner. Patienter som behöver parenteral nutrition är ofta predisponerade för infektiösa komplikationer på grund av undernäring och/eller underliggande sjukdomstillstånd. Förekomsten av septiska komplikationer kan minskas genom ökad noggrannhet med aseptisk teknik vid kateterplacering, underhåll samt aseptisk teknik vid beredningen av nutritionsberedningar.
Fettöverbelastningssyndrom har rapporterats för andra parenterala nutritionsläkemedel. Nedsatt eller begränsad förmåga att metabolisera lipiderna i Numeta G19E kan leda till ”fettöverbelastningssyndrom” (se avsnitten Biverkningar och Överdosering).
Nutrition till svårt undernärda patienter kan leda till nutritionssyndrom som kännetecknas av intracellulära balansförändringar av kalium, fosfor och magnesium eftersom patienten blir anabol. Tiaminbrist och vätskeretention kan också utvecklas. Det rekommenderas att parenteral nutrition inleds försiktigt och sakta med noggrann övervakning av vätskor, elektrolyter, spårämnen och vitaminer.
Numeta G19E får endast administreras via en central ven, om inte lämplig spädning har gjorts (se avsnitt Dosering). När tillsatser görs till beredningen måste blandningens slutliga osmolaritet beräknas före administrering genom en perifer ven för att undvika venirritation eller vävnadsskada för den händelse att extravasering av lösningen skulle ske. Administrering av Numeta G19E i en perifer ven har lett till extravasering med mjukdelsskada och hudnekros som följd.
Seriekoppla inte påsarna, risk finns att gasemboli kan uppstå på grund av möjliga luftrester i den primära påsen.
Lipider, vitaminer, extra elektrolyter och spårämnen bör ges efter behov.
VARNING
Tillsätt inte andra läkemedel eller substanser till någon av påsens sektioner eller till den färdigberedda lösningen/emulsionen utan att först kontrollera deras kompatibilitet och stabiliteten hos den slutliga beredningen (särskilt lipidemulsionens stabilitet) (se avsnitt Blandbarhet och Hållbarhet, förvaring och hantering). Numeta G19E ska skyddas mot ljus från blandning t.o.m. administrering av infusionen (se avsnitt Hållbarhet, förvaring och hantering).
Övervaka rutinmässigt vatten- och elektrolytbalans, serumosmolaritet, serumtriglycerider, syra-basbalans, blodglukos, lever- och njurfunktion samt blodvärden, inklusive blodplättar och koaguleringsparametrar under hela behandlingen.
Vid instabila förhållanden (till exempel efter svåra posttraumatiska tillstånd, obehandlad diabetes mellitus, akutfasen av cirkulatorisk chock, akut myokardiell infarkt, svår metabolisk acidos, svår sepsis och hyperosmolärt koma) ska tillförseln av Numeta G19E övervakas och justeras efter patientens kliniska behov.
Hjärta/Kärl
Används med försiktighet hos patienter med lungödem eller hjärtsvikt. Vätskestatusen ska övervakas noga.
Njurar
Används med försiktighet hos patienter med njursvikt. Vätske- och elektrolytstatus ska noga övervakas hos dessa patienter.
Allvarliga rubbningar i elektrolyt- och vätskebalans, svår vätskeöverbelastning och svåra ämnesomsättningsrubbningar ska korrigeras innan infusionen startas.
Lever/Magtarmkanalen
Används med försiktighet hos patienter med svår leverinsufficiens, inklusive kolestas eller förhöjda leverenzymvärden. Leverfunktionsparametrarna ska övervakas noga.
Hormoner/Ämnesomsättning
Metaboliska komplikationer kan inträffa om näringsintaget inte anpassas efter patientens behov eller om förmågan att metabolisera något nutritionsämne inte utvärderats tillräckligt. Oönskade metabola effekter kan uppstå till följd av inadekvat eller överdriven näringstillförsel eller olämplig sammansättning av en blandning för en viss patients behov.
Serumtriglyceridkoncentrationer och kroppens förmåga att metabolisera lipider måste kontrolleras regelbundet. Om en störning i lipidmetabolismen misstänks rekommenderas övervakning av serumtriglycerider efter kliniska behov.
I händelse av hyperglykemi måste infusionshastigheten av Numeta G19E justeras och/eller insulin administreras, se avsnitt Överdosering.
Blod
Används med försiktighet hos patienter med allvarliga blodkoaguleringsstörningar. Blodvärdena och koagulationsparametrarna ska övervakas noga.
Interaktioner
Inga farmakodynamiska interaktionsstudier har utförts med Numeta G19E.
Numeta G19E får inte administreras tillsammans med blod genom samma infusionsaggregat på grund av risken för pseudoagglutination.
Hos alla patienter oavsett ålder (inklusive vuxna), får ceftriaxon inte blandas med eller administreras tillsammans med intravenösa lösningar som innehåller kalcium, inklusive Numeta G19E, inte ens via olika infusionsslangar eller på olika infusionsställen, på grund av risken för utfällning av ceftriaxonkalciumsalt (se avsnitt Varningar och försiktighet).
Hos patienter äldre än 28 dagar kan dock ceftriaxon och kalciuminnehållande lösningar administreras sekventiellt efter varandra om infusionsslangar på olika ställen används, eller om infusionsslangarna byts ut, eller spolas noggrant med fysiologisk koksaltslösning mellan infusionerna, för att undvika utfällning.
Oliv- och sojaolja har ett naturligt innehåll av vitamin K1 som kan motverka den antikoagulerande effekten av kumarin (eller kumarinderivat, inklusive warfarin).
På grund av innehållet av kalium i Numeta G19E måste särskild försiktighet vidtas för patienter som samtidigt behandlas med kaliumsparande diuretika (amilorid, spironolakton, triamteren) eller ACE-hämmare, angiotensin II-receptorantagonister, eller de immunosuppressiva läkemedlen takrolimus och cyklosporin på grund av risken för hyperkalemi.
Lipiderna i denna emulsion kan störa resultaten från vissa laboratorietester (till exempel bilirubin, laktatdehydrogenas, syremättnad, blodhemoglobin) om blodprovet är taget innan lipiderna har eliminerats. Lipider elimineras i allmänhet efter 5 till 6 timmar om inga ytterligare lipider ges.
Se även avsnitt Blandbarhet.
Graviditet
Data från behandling av gravida kvinnor med Numeta G19E saknas. Läkare ska noggrant överväga de potentiella riskerna och fördelarna för varje enskild patient innan Numeta G19E ordineras.
Amning
Data från behandling av ammande kvinnor med Numeta G19E saknas. Läkare ska noggrant överväga de potentiella riskerna och fördelarna för varje enskild patient innan Numeta G19E ordineras.
Trafik
Ej relevant.
Biverkningar
Biverkningar.1 Biverkningar vid kliniska prövningar och erfarenheter efter att produkten kommit ut på marknaden
Säkerheten och administreringen av Numeta utvärderades i en fas III-studie. 159 pediatriska patienter ingick i studien och behandlades med Numeta.
Sammanslagna data vid kliniska prövningar och erfarenheterna efter att produkten kommit ut på marknaden antyder att följande biverkningar står i relation till Numeta:
|
Biverkningar vid klinisk prövningoch enligt erfarenheter efter att produkten kommit ut på marknaden |
||
|---|---|---|
|
Organklass (SOC) |
Godkänd MedDRA-term |
Frekvensb |
|
METABOLISM OCH NUTRITION |
Hypofosfatemia Hyperglykemia Hyperkalcemia Hypertriglyceridemia Hyperlipidemi Hyponatremia |
Vanliga Vanliga Vanliga Vanliga Mindre vanliga Vanliga |
|
LEVER OCH GALLVÄGAR |
Kolestas |
Mindre vanliga |
|
HUD OCH SUBKUTAN VÄVNAD |
Hudnekrosc |
Ingen känd frekvens |
|
Mjukdelsskadac |
Ingen känd frekvens |
|
|
ALLMÄNNA SYMTOM OCH/ELLER SYMTOM VID ADMINSTRERINGSSTÄLLET |
Extravaseringc |
Ingen känd frekvens |
a Blodprover togs under infusionen (ej på fastande mage).
b Frekvensen delas in i följande kategorier: Mycket vanliga (≥1/10), Vanliga (≥1/100, <1/10), Mindre vanliga (≥1/1 000, <1/100), Sällsynta (≥1/10 000, <1/1 000), Mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
c Dessa biverkningar har endast rapporterats för Numeta G13E och G16E som administrerats perifert och i otillräcklig spädning (se avsnitt Varningar och försiktighet).
Följande biverkningar har rapporterats med andra parenterala nutritionslösningar:
Fettöverbelastningssyndrom: Kan orsakas av felaktig administrering (t ex överdos och/eller högre infusionshastighet än rekommenderat, se avsnitt Överdosering). Tecken och symtom kan dock uppstå även om läkemedlet administreras enligt instruktionerna. Begränsad eller nedsatt förmåga att metabolisera lipiderna i Numeta G19E åtföljt av förlängd plasmaclearance kan leda till ett "fettöverbelastningssyndrom". Syndromet är förenat med en plötslig försämring av patientens kliniska tillstånd och karaktäriseras av symtom såsom hyperlipidemi, feber, fettinfiltration i levern (hepatomegali), försämrad leverfunktion, anemi, leukopeni, trombocytopeni, koagulationsrubbningar, akut andnöd, metabolisk acidos och manifestationer från centrala nervsystemet (t ex koma). Syndromet är oftast reversibelt när infusionen av lipidemulsionen avbryts.
Pulmonära vaskulära utfällningar (lungemboli och andningssvårigheter), se avsnitt Varningar och försiktighet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Vid felaktig administrering (överdos och/eller högre infusionshastighet än den rekommenderade) kan illamående, kräkningar, frossa, elektrolytrubbningar och tecken på hypervolemi och acidos inträffa och kan ha till dödliga konsekvenser. I sådana fall måste infusionen avbrytas omedelbart. Ytterligare åtgärder kan vara indikerade om det är medicinskt lämpligt.
Hyperglykemi, glukosuri och hyperosmolärt syndrom kan utvecklas om glukosinfusionshastigheten överskrider clearance.
En överdos eller nedsatt eller begränsad förmåga att metabolisera lipider kan leda till ett fettöverbelastningssyndrom vars verkningar oftast är reversibla efter att infusionen av lipidemulsionen har avbrutits, se avsnitt Biverkningar. Hos nyfödda och spädbarn har fettöverbelastningssyndrom associerats med metabolisk acidos och andnöd.
Det finns ingen särskild antidot vid överdos. Akutåtgärderna bör vara allmänna stödjande åtgärder med särskild uppmärksamhet på de respiratoriska och kardiovaskulära systemen. I vissa allvarliga fall kan hemodialys, hemofiltration eller hemodiafiltration bli nödvändigt. Allvarliga fall av fettöverbelastningssyndrom behandlade med utbytestransfusion har rapporterats i litteraturen.
Täta biokemiska kontroller är nödvändigt och särskilda avvikelser bör behandlas på lämpligt sätt.
Farmakodynamik
Numeta G19E´s innehåll av kväve (20 aminosyror i L-serien, inklusive 8 essentiella aminosyror) och energi (glukos och triglycerider) gör det möjligt att upprätthålla rätt kväve-/energibalans. Kväve och energi krävs för normal funktion hos alla celler i kroppen och är viktiga för proteinsyntes, tillväxt, sårläkning, immunsystemets funktion, muskelfunktion och många andra cellulära aktiviteter.
Dessutom innehåller blandningen elektrolyter.
Aminosyraprofilen är följande:
-
essentiella aminosyror/aminosyror totalt: 47,5%
-
aminosyror med sidokedjor/aminosyror totalt: 24,0%
Lipidemulsionen i Numeta G19E är en blandning av raffinerad olivolja och raffinerad sojaolja (förhållande cirka 80/20) med följande relativa fördelning av fettsyror:
-
15 % mättade fettsyror (SFA)
-
65 % enkelomättade fettsyror (MUFA)
-
20 % fleromättade fettsyror (PUFA)
Kvoten fosfolipid/triglycerid är 0,06. Det måttliga innehållet av essentiella fettsyror (EFA) förbättrar statusen för de essentiella fettsyrornas övre derivat och korrigerar bristen på EFA.
Olivolja innehåller signifikanta mängder alfa-tokoferol som i kombination med ett måttligt PUFA-intag bidrar till att förbättra E-vitaminstatusen och är betydelsefullt för att begränsa lipidperoxidationen.
Kolhydratkällan är glukos. Glukos är en av kroppens primära energikällor.
Farmakokinetik
Innehållsämnena i emulsionen för infusion (aminosyror, elektrolyter, glukos, lipider) distribueras, metaboliseras och elimineras på samma sätt som om de administrerats separat. Denna produkt ges intravenöst och är därmed 100 % biologiskt tillgänglig. Innehållsämnena distribueras till och metaboliseras av samtliga celler i kroppen.
Prekliniska uppgifter
Prekliniska studier gjorda på de ingående komponenterna i trekammarpåsen har inte visat några ytterligare risker utöver dem redan nämnda i andra avsnitt i produktresumén.
Djurstudier med Numeta G19E (två- eller trekammarpåse kombination) har inte utförts.
Innehåll
Kvalitativ och kvantitativ sammansättning
Detta läkemedel tillhandahålls i en påse med tre kamrar. Varje påse innehåller en steril, icke-pyrogen kombination av en glukoslösning, en pediatrisk aminosyralösning med elektrolyter samt en lipidemulsion enligt beskrivningen nedan.
|
Påsens storlek |
50 g/100 ml glukoslösning |
5,9 g/100 ml aminosyralösning med elektrolyter |
12,5 g/100 ml lipidemulsion |
|---|---|---|---|
|
1000 ml |
383 ml |
392 ml |
225 ml |
Om lipidadministrering inte är önskvärd ger påsens utformning möjlighet att endast öppna den icke-permanenta förslutningen mellan aminosyrakammaren med elektrolyter och glukoskammaren och låta förslutningen mellan aminosyrekammaren och lipidkammaren vara intakt. Innehållet i påsen kan därefter infunderas med eller utan lipider. Produktens sammansättning efter blandning av två (aminosyror och glukos, 2-kammarpåse, 775 ml lösning) eller tre (aminosyror, glukos och lipid, 3-kammarpåse, 1000 ml emulsion) kamrar framgår av följande tabell.
|
Sammansättning |
||
|---|---|---|
|
Aktiva ämnen |
Aktiverad tvåkammarpåse (775 ml) |
Aktiverad trekammarpåse (1000 ml) |
|
Aminosyrakammaren | ||
|
Alanin |
1,83 g |
1,83 g |
|
Arginin |
1,92 g |
1,92 g |
|
Asparaginsyra |
1,37 g |
1,37 g |
|
Cystein |
0,43 g |
0,43 g |
|
Glutaminsyra |
2,29 g |
2,29 g |
|
Glycin |
0,91 g |
0,91 g |
|
Histidin |
0,87 g |
0,87 g |
|
Isoleucin |
1,53 g |
1,53 g |
|
Leucin |
2,29 g |
2,29 g |
|
Lysinmonohydrat (motsvarar lysin) |
2,82 g (2,51 g) |
2,82 g (2,51 g) |
|
Metionin |
0,55 g |
0,55 g |
|
Ornitinhydroklorid (motsvarar ornitin) |
0,73 g (0,57 g) |
0,73 g (0,57 g) |
|
Fenylalanin |
0,96 g |
0,96 g |
|
Prolin |
0,69 g |
0,69 g |
|
Serin |
0,91 g |
0,91 g |
|
Taurin |
0,14 g |
0,14 g |
|
Treonin |
0,85 g |
0,85 g |
|
Tryptofan |
0,46 g |
0,46 g |
|
Tyrosin |
0,18 g |
0,18 g |
|
Valin |
1,74 g |
1,74 g |
|
Natriumklorid |
1,79 g |
1,79 g |
|
Kaliumacetat |
3,14 g |
3,14 g |
|
Kalciumkloriddihydrat |
0,56 g |
0,56 g |
|
Magnesiumacetattetrahydrat |
0,55 g |
0,55 g |
|
Natriumglycerofosfat, hydratiserat |
2,21 g |
2,21 g |
|
Glukoskammaren | ||
|
Glukosmonohydrat (motsvarar vattenfri glukos) |
210,65 g (191,50 g) |
210,65 g (191,50 g) |
|
Lipidkammaren | ||
|
Raffinerad olivolja (ca. 80 %) + Raffinerad sojaolja (ca. 20 %) |
- |
28,1 g |
Den färdigberedda lösningen/emulsionen består av följande:
|
Sammansättning |
||||
|---|---|---|---|---|
|
Aktiverad tvåkammarpåse |
Aktiverad trekammarpåse |
|||
|
Per volymenhet (ml) |
775 |
100 |
1000 |
100 |
|
Kväve (g) |
3,5 |
0,45 |
3,5 |
0,35 |
|
Aminosyror (g) |
23,0 |
3,0 |
23,0 |
2,3 |
|
Glukos (g) |
192 |
24,7 |
192 |
19,2 |
|
Lipider (g) |
0 |
0 |
28,1 |
2,8 |
|
Energi | ||||
|
Kalorier totalt (kcal) |
858 |
111 |
1139 |
114 |
|
Icke-proteinkalorier (kcal) |
766 |
99 |
1047 |
105 |
|
Glukoskalorier (kcal) |
766 |
99 |
766 |
77 |
|
Lipidkalorier (kcal)a |
0 |
0 |
281 |
28 |
|
Icke-proteinkalorier/kväve (kcal/g N) |
220 |
220 |
301 |
301 |
|
Lipidkalorier/icke-proteinkalorier (g/100 ml) |
Inte tillämpligt |
Inte tillämpligt |
27 |
27 |
|
Lipidkalorier/kalorier totalt (g/100 ml) |
Inte tillämpligt |
Inte tillämpligt |
25 |
25 |
|
Elektrolyter | ||||
|
Natrium (mmol) |
45,1 |
5,8 |
45,8 |
4,6 |
|
Kalium (mmol) |
32,0 |
4,1 |
32,0 |
3,2 |
|
Magnesium (mmol) |
2,6 |
0,33 |
2,6 |
0,26 |
|
Kalcium (mmol) |
3,8 |
0,50 |
3,8 |
0,38 |
|
Fosfat (mmol)b |
7,2 |
0,93 |
9,4 |
0,93 |
|
Acetat (mmol) |
37,1 |
4,8 |
37,1 |
3,71 |
|
Malat (mmol) |
8,8 |
1,1 |
8,8 |
0,88 |
|
Klorid (mmol) |
42,6 |
5,5 |
42,6 |
4,3 |
|
pH (ca.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolaritet, ca. (mOsm/l) |
1835 |
1835 |
1460 |
1460 |
aInkluderar kalorier från äggfosfolipider för injektion.
bInkluderar fosfat som kommer från lipidemulsionens äggfosfolipidkomponent för injektion.
Förteckning över hjälpämnen
|
Hjälpämnen |
Aminosyrakammaren |
Glukoskammaren |
Lipidkammaren |
|---|---|---|---|
|
L-äppelsyraa |
X |
- |
- |
|
Saltsyraa |
- |
X |
- |
|
Äggfosfolipider för injektion |
- |
- |
X |
|
Glycerol |
- |
- |
X |
|
Natriumoleat |
- |
- |
X |
|
Natriumhydroxida |
- |
- |
X |
|
Vatten för injektionsvätskor |
X |
X |
X |
aför pH justering
Blandbarhet
Om blandbarhetsstudier saknas ska detta läkemedel inte blandas med andra läkemedel, se avsnitt Hållbarhet, förvaring och hantering.
Som alla parenterala näringsblandningar måste kalcium- och fosfatkvoten beaktas. Överdriven tillsats av kalcium och fosfat, speciellt i form av mineralsalter, kan leda till att kalciumfosfatutfällningar bildas.
Hos alla patienter oavsett ålder, får ceftriaxon inte blandas med eller administreras tillsammans med intravenösa lösningar som innehåller kalcium, inklusive Numeta G19E, inte ens via olika infusionsslangar eller på olika infusionsställen, på grund av risken för utfällning av ceftriaxonkalciumsalt.
På grund av risken för utfällning, får Numeta G19E inte administreras genom samma infusionsslang med ampicillin, fosfenytoin eller furosemid.
Numeta G19E får inte administreras tillsammans med blod genom samma infusionsaggregat, se avsnitt Interaktioner.
Numeta G19E innehåller kalciumjoner vilket kan medföra risk för utfällning i citrat-antikoagulerat blod-eller blodkomponenter.
Miljöpåverkan
Alanin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Arginin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Asparaginsyra
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
L-cystein
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Fenylalanin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Glukosmonohydrat
Miljörisk:
Användning av kolhydrater bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Glutaminsyra
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Glycin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Histidin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Isoleucin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Kalciumkloriddihydrat
Miljörisk:
Användning av elektrolyter bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Kaliumacetat
Miljörisk:
Användning av elektrolyter bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Leucin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Magnesiumacetattetrahydrat
Miljörisk:
Användning av elektrolyter bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Metionin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Natriumglycerofosfat, hydratiserat
Miljörisk:
Användning av elektrolyter bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Natriumklorid
Miljörisk:
Användning av elektrolyter bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Olivolja, raffinerad
Miljörisk:
Användning av lipider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Ornitin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Prolin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Serin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Sojaolja, raffinerad
Miljörisk:
Användning av lipider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Taurin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Treonin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Tryptofan
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Tyrosin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Valin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år
Hållbarhet efter beredning
Det rekommenderas att produkten används omedelbart efter att de icke-permanenta förslutningarna mellan de två eller tre kamrarna har öppnats. Den färdigberedda emulsionen har dock påvisats vara stabil i maximalt 7 dagar vid 2 °C till 8 °C följt av maximalt 48 timmar vid högst 30 °C.
Hållbarhet efter tillsatser (elektrolyter, spårämnen, vitaminer, vatten)
För specifika tillsatsblandningar har stabilitet påvisats hos Numeta G19E i 7 dagar vid 2 °C till 8 °C följt av 48 timmar vid högst 30 °C.
Från mikrobiologisk synvinkel ska blandningen användas omedelbart. Om den inte används omedelbart, ligger ansvaret för lagringstid och lagringsförhållanden före användning på användaren. Lagringstiden bör normalt inte överstiga 24 timmar vid 2 °C till 8 oC, såvida inte beredning/spädning/tillsats skett enligt kontrollerade och validerade aseptiska förhållanden.
Se även avsnitt Dosering och avsnitt Särskilda anvisningar för destruktion och övrig hantering nedan.
Särskilda förvaringsanvisningar
Får ej frysas.
Förvaras i ytterpåsen.
Särskilda anvisningar för destruktion
Endast för engångsbruk.
Använd inte om påsen är skadad.
Kontrollera att påsen och de icke-permanenta förslutningarna är oskadade.
Använd endast om lösningen i aminosyrakammaren och lösningen i glukoskammaren är klara, färglösa eller lätt gulfärgade, praktiskt taget fria från synliga partiklar och om lipidemulsionen är en homogen vätska med mjölkliknande utseende.
Användning av ett filter med storleken 1,2 mikrometer rekommenderas vid administrering av Numeta G19E.
Innan du öppnar ytterpåsen, kontrollera färgen på syreindikatorn.
-
Jämför den med referensfärgen som finns tryckt bredvid OK-symbolen på indikatorns etikett.
-
Använd inte produkten om syreindikatorns färg inte överensstämmer med referensfärgen som finns tryckt bredvid OK-symbolen.
I figur 1 och 2 illustreras hur den skyddande ytterpåsen avlägsnas. Kasta ytterpåsen, syreindikatorn och syreabsorberaren.
Figur 1
Figur 2
Beredning av den blandade emulsionen:
-
Kontrollera att produkten är rumstempererad när de icke-permanenta förslutningarna bryts.
-
Placera påsen på en plan ren yta.
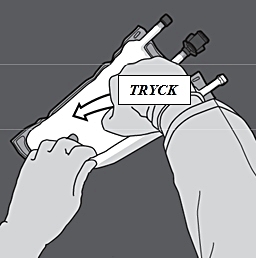
Aktivering av trekammarpåse (brytningen av de två icke-permanenta förslutningarna)
Steg 1: Börja rulla påsen från D-hängarsidan.
Steg 2: Tryck tills förslutningen öppnas.
Steg 3: Byt sedan riktning genom att rulla påsen mot D-hängaren. Fortsätt tills förslutningen är helt öppen. Fortsätt på samma sätt för att öppna den andra förslutningen.
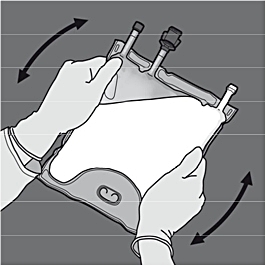
Steg 4: Vänd på påsen minst tre gånger för att blanda innehållet ordentligt. Blandningens utseende efter beredning är en mjölkliknande emulsion.
Steg 5: Avlägsna skyddslocket från administreringsporten och för in IV-infusionsaggregatet.
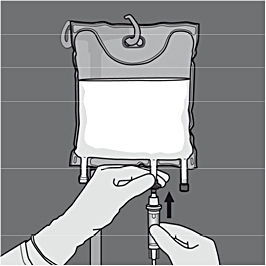
Aktivering av tvåkammarpåse (brytning av den icke-permanenta förslutningen mellan kamrarna med aminosyror och glukos).
Steg 1: För att endast öppna förslutningen mellan aminosyrakammaren och glukoskammaren börjar du rulla påsen från D-hängarhörnet på den förslutning som skiljer aminosyrakammaren och glukoskammaren från varandra.
Tryck för att öppna förslutningen mellan glukoskammaren och aminosyrakammaren.
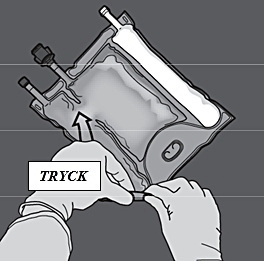
Steg 2: Vänd påsen så att du har kammaren med lipidemulsion närmast dig och rulla påsen, samtidigt som du skyddar kammaren med lipidemulsionen med händerna.
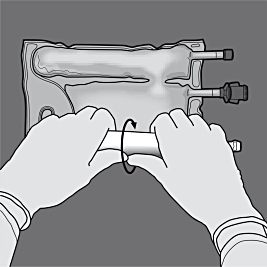
Steg 3: Tryck genom att rulla påsen med ena handen mot portarna.
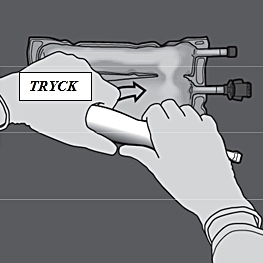
Steg 4: Ändra sedan riktning genom att rulla påsen mot D-hängaren och trycka på den med den andra handen. Fortsätt tills förslutningen mellan aminosyrakammaren och glukoskammaren har öppnats helt.
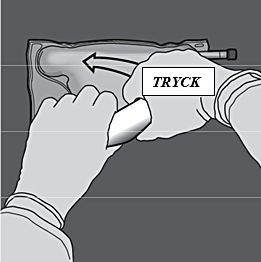 x
x
Steg 5: Vänd på påsen minst tre gånger för att blanda innehållet ordentligt. Efter beredning ska blandningen vara klar, färglös eller svagt gul.
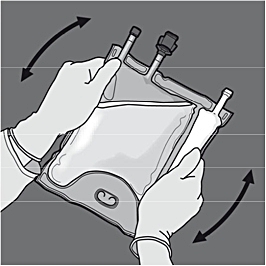
Steg 6: Avlägsna skyddslocket från administreringsporten och för in IV- infusionsaggregatet.
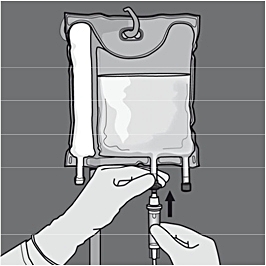
Tillsatser: Skydda mot ljus ända från tillsättningen i påsen av tillsatserna t.o.m. administrering av infusionen, då tillsatserna utgörs av spårämnen och vitaminer. Exponering för omgivande ljus genererar peroxider och andra nedbrytningsprodukter vilka kan reduceras om produkten är skyddad mot ljus.
Kompatibla tillsatser kan göras via injektionsport i den färdigberedda blandningen (efter att de icke-permanenta förslutningarna har öppnats och innehållet i de två eller tre kamrarna har blandats).
Vitaminer kan också tillsättas i glukoskammaren innan blandningen har beretts (innan de icke-permanenta förslutningarna har öppnats och innan lösningarna och emulsionen har blandats).
Kompatibilitetstabellen 1–6 nedan anger hurdana kommersiellt tillgängliga spårämneslösningar (identifierade som SÄ1, SÄ2 och SÄ4), vitaminer (vitaminlyofilisat, identifierade som V1 och V2) och elektrolyter kan tilläggas i nämnda kvantiteter.
1. Kompatibilitet med SÄ4, V1 och V2
Tabell 1: Kompatibilitet när tre kamrar är öppnad (“3 i 1”) med eller utan spädning med vatten
|
Per 1000 ml (3 i 1 tillägg med lipider) |
|||||||
|
|
Blandning utan utspädning |
Blandning med utspädning |
|||||
|
Tillsatser |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
|
Natrium (mmol) |
45,8 |
105 |
151 |
45,8 |
105 |
151 |
|
|
Kalium (mmol) |
32,0 |
118 |
150 |
32,0 |
118 |
150 |
|
|
Magnesium (mmol) |
2,6 |
7,8 |
10,4 |
2,6 |
7,8 |
10,4 |
|
|
Kalcium (mmol) |
3,8 |
20,5 |
24,3 |
3,8 |
20,5 |
24,3 |
|
|
Fosfat* (mmol) |
9,4 |
14,6 |
24,0 |
9,4 |
14,6 |
24,0 |
|
|
Spårämnen och vitaminer |
- |
34 ml SÄ4 + 3,4 injektions-flaskor V1 +
|
34 ml SÄ4 + 3,4 injektions-flaskor V1 +
|
- |
34 ml SÄ4 + 3,4 injektions-flaskor V1 +
|
34 ml SÄ4 + 3,4 injektions-flaskor V1 +
|
|
|
Vatten för injektionsvätskor |
- |
- |
- |
- |
1450 ml |
1450 ml |
|
* Organiskt fosfat
Tabell 2: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
|
Per 775 ml (2 i 1 tillägg utan lipider) |
||||
|
Mängd som ingår |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
|
Mängd som ingår |
45,1 |
32,0 |
77,1 |
|
|
Mängd som ingår |
32,0 |
45,6 |
77,6 |
|
|
Mängd som ingår |
2,6 |
5,2 |
7,8 |
|
|
Mängd som ingår |
3,8 |
19,4 |
23,2 |
|
|
Mängd som ingår |
7,2 |
16,0 |
23,2 |
|
|
Mängd som ingår |
- |
10 ml SÄ4 + 1 injektiosflaska V1 |
10 ml SÄ4 + 1 injektiosflaska V1 |
|
* Organiskt fosfat
2. Kompatibilitet med SÄ1-, V1- och V2
Tabell 3: Kompatibilitet när tre kamrar är öppnad (“3 i 1”)
|
Per 1000 ml (3 i 1 tillägg med lipider) |
|||
|
Tillsatser |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
Natrium (mmol) |
45,8 |
0 |
45,8 |
|
Kalium (mmol) |
32,0 |
0 |
32,0 |
|
Magnesium (mmol) |
2,6 |
0 |
2,6 |
|
Kalcium (mmol) |
3,8 |
6,4 |
10,2 |
|
Fosfat* (mmol) |
9,4 |
0 |
9,4 |
|
Spårämnen och vitaminer |
- |
15 ml SÄ1
|
15 ml SÄ1
|
* Organiskt fosfat
Tabell 4: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
|
Per 775 ml (2 i 1 tillägg utan lipider) |
|||
|
Tillsatser |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
Natrium (mmol) |
45,1 |
32,0 |
77,1 |
|
Kalium (mmol) |
32,0 |
45,6 |
77,6 |
|
Magnesium (mmol) |
2,6 |
5,2 |
7,8 |
|
Kalcium (mmol) |
3,8 |
19,4 |
23,2 |
|
Fosfat* (mmol) |
7,2 |
16,0 |
23,2 |
|
Spårämnen och vitaminer |
- |
10 ml SÄ1 + 1 injektionsflaska V1 |
10 ml SÄ1 + 1 injektionsflaska V1 |
* Organiskt fosfat
3. Kompatibilitet med SÄ2-, V1- och V2
Tabell 5: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
|
Per 775 ml (2 i 1 tillägg utan lipider) |
|||
|
Tillsatser |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
Natrium (mmol) |
45,1 |
32,0 |
77,1 |
|
Kalium (mmol) |
32,0 |
45,6 |
77,6 |
|
Magnesium (mmol) |
2,6 |
5,2 |
7,8 |
|
Kalcium (mmol) |
3,8 |
19,4 |
23,2 |
|
Fosfat* (mmol) |
7,2 |
16,0 |
23,2 |
|
Spårämnen och vitaminer |
- |
15 ml SÄ2 + 1 injektionsflaska V1 |
15 ml SÄ2 + 1 injektionsflaska V1 |
* Organiskt fosfat
Tabell 6: Kompatibilitet när tre kamrar är öppnad (“3 i 1”)
|
Per 1000 ml (3 i 1 tillägg med lipider) |
|||
|
Tillsatser |
Mängd som ingår |
Maximal ytterligare tillsats |
Maximal total mängd |
|
Natrium (mmol) |
45,8 |
0 |
45,8 |
|
Kalium (mmol) |
32,0 |
0 |
32,0 |
|
Magnesium (mmol) |
2,6 |
0 |
2,6 |
|
Kalcium (mmol) |
3,8 |
6,4 |
10,2 |
|
Fosfat* (mmol) |
9,4 |
0 |
9,4 |
|
Spårämnen och vitaminer |
- |
15 ml SÄ2
|
15 ml SÄ2 + 1 injektionsflaska V1 + 10 ml V2 |
* Organiskt fosfat
Sammansättning av de kommersiella vitaminberedningar och spårämnesberedningar som används illustreras i tabellerna 7 och 8.
Tabell 7: Sammansättning av de kommersiella spårämnesberedningar (SÄ) som används
|
Sammansättning per 10 ml |
SÄ1 |
SÄ2 |
SÄ4 |
|
Järn |
- |
8,9 mikromol eller 0,5 mg |
- |
|
Zink |
38,2 mikromol eller 2,5 mg |
15,3 mikromol eller 1 mg |
15,3 mikromol eller 1 mg |
|
Selen |
0,253 mikromol eller 0,02 mg |
0,6 mikromol eller 0,05 mg |
0,253 mikromol eller 0,02 mg |
|
Koppar |
3,15 mikromol eller 0,2 mg |
4,7 mikromol eller 0,3 mg |
3,15 mikromol eller 0,2 mg |
|
Jod |
0,0788 mikromol eller 0,01 mg |
0,4 mikromol eller 0,05 mg |
0,079 mikromol eller 0,01 mg |
|
Fluor |
30 mikromol eller 0,57 mg |
26,3 mikromol eller 0,5 mg |
- |
|
Molybden |
- |
0,5 mikromol eller 0,05 mg |
- |
|
Mangan |
0,182 mikromol eller 0,01 mg |
1,8 mikromol eller 0,1 mg |
0,091 mikromol eller 0,005 mg |
|
Krom |
- |
0,4 mikromol eller 0,02 mg |
- |
|
Kobolt |
- |
2,5 mikromol eller 0,15 mg |
- |
Tabell 8: Sammansättning av de kommersiella vitaminberedningar (V1 och V2) som används
|
Sammansättning per flaska |
V1 |
V2 |
|
Vitamin B1 |
2,5 mg |
- |
|
Vitamin B2 |
3,6 mg |
- |
|
Nikotinamid |
40 mg |
- |
|
Vitamin B6 |
4,0 mg |
- |
|
Pantotensyra |
15,0 mg |
- |
|
Biotin |
60 mikrog |
- |
|
Folsyra |
400 mikrog |
- |
|
Vitamin B12 |
5,0 mikrog |
- |
|
Vitamin C |
100 mg |
- |
|
Vitamin A |
- |
2300 IE |
|
Vitamin D |
- |
400 IE |
|
Vitamin E |
- |
7 IE |
|
Vitamin K |
- |
200 mikrog |
Göra en tillsats:
-
Aseptiska förhållanden måste iakttas.
-
Förbered påsens injektionsport.
-
Punktera injektionsporten och injicera tillsatserna med en kanyl eller ett hjälpmedel för beredning innehållande en kanyl.
-
Blanda innehållet i påsen och tillsatserna.
Förbereda infusionen:
-
Aseptiska förhållanden måste iakttas.
-
Häng upp påsen.
-
Avlägsna plastskyddet från administreringsporten.
-
För in infusionsaggregatets spike ordentligt i administreringsporten.
Administrering av infusionen:
-
Administrera produkten först efter att de icke-permanenta förslutningarna mellan de två eller tre kamrarna har öppnats och innehållet i de två eller tre kamrarna har blandats.
-
Se till att den slutliga aktiverade trekammarpåse-emulsionen för infusion inte visar några tecken på fasseparation eller att den slutliga tvåkammarpåse-lösningen för infusion inte innehåller synliga partiklar.
-
Efter att påsen öppnats måste innehållet användas genast och får aldrig sparas för en senare infusion
-
Det rekommenderas att innehållet används omedelbart efter att de icke-permanenta förslutningarna mellan de tre kamrarna har öppnats. Innehållet ska inte sparas för senare infusioner.
-
Anslut inte delvis förbrukade påsar.
-
Seriekoppla inte påsarna. Risk finns att luftemboli kan uppstå på grund av kvarvarande luft i den primära påsen.
-
Ej använt läkemedel, avfall och allt använt engångsmaterial ska kasseras.





