Indikationer
Behandling och profylax mot blödning hos patienter med hemofili A (medfödd faktor VIII-brist).
Nuwiq kan användas för alla åldersgrupper.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Behandling ska ske under överinseende av läkare med erfarenhet av behandling av hemofili.
Övervakning av behandlingen
Under behandlingens gång rekommenderas bestämning av faktor VIII-nivåerna till den dos som ska administreras och till frekvensen av upprepade infusioner. Enskilda patienter kan svara olika på faktor VIII och uppvisa olika halveringstider och recovery. Doser som baseras på kroppsvikt kan behöva justeras för under- och överviktiga patienter. Speciellt vid större kirurgiska ingrepp är en noggrann övervakning av substitutionsbehandlingen nödvändig med avseende på koagulationsanalys (faktor VIII-aktivitet i plasma).
Vid användning av aPTT enstegs koagulationsanalys in vitro av aPTT för bestämning av faktor VIII-aktivitet i blodprover från patienter kan resultaten för faktor VIII‑aktivitet i plasma påverkas signifikant både av typen av aPTT-reagens och av den referensstandard som används i analysen. Det kan också förekomma signifikanta avvikelser mellan analysresultat som erhålls med en aPTT-baserad enstegs koagulationsanalys och den kromogena analysen enligt Europafamrakopén (Ph. Eur.). Detta är betydelsefullt framför allt vid byte av laboratorium och/eller reagens som används i analysen.
Dosering
Dosen och substitutionsbehandlingens längd beror på svårighetsgraden av faktor VIII-bristen, på blödningens lokalisering och omfattning, samt på patientens kliniska tillstånd.
Antalet faktor VIII-enheter som administreras uttrycks i internationella enheter (IE), i enlighet med den rådande WHO-koncentratstandarden för faktor VIII-produkter. Faktor VIII-aktivitet i plasma uttrycks antingen som en procentandel (relaterad till normal humanplasma) eller hellre i internationella enheter (relaterade till en internationell standard för faktor VIII i plasma).
En internationell enhet (IE) av faktor VIII-aktivitet motsvarar mängden faktor VIII i en ml normal humanplasma.
Behandling vid behov
Beräkningen av den erforderliga dosen av faktor VIII baseras på det empiriska fyndet att 1 internationell enhet (IE) faktor VIII per kg kroppsvikt ökar aktiviteten av faktor VIII med ungefär 2 % av normal aktivitet eller 2 IE/dl. Den erforderliga dosen bestäms med följande formel:
Mängden som ska administreras och frekvensen för administrering ska alltid justeras efter den kliniska effekten i det enskilda fallet.
Vid följande blödningsepisoder, ska faktor VIII-aktiviteten inte understiga den givna plasmaaktivitetsnivån (i % av normal eller IE/dl) under motsvarande period. Följande tabell kan användas som vägledning för dosering vid blödningsepisoder och kirurgiska ingrepp.
|
Blödningens svårighetsgrad/typ av kirurgiskt ingrepp |
Erforderlig faktor VIII-nivå (%) (IE/dl) |
Dosfrekvens (timmar)/behandlingens längd (dagar) |
|---|---|---|
|
Blödning | ||
|
Tidig hemartros, muskelblödning eller blödning i munhåla |
20–40 |
Upprepas var 12:e till 24:e timme under minst 1 dag, tills blödningsepisoden (upplevd smärta) upphört eller tills läkning uppnåtts. |
|
Mer omfattande hemartros, muskelblödning eller hematom |
30–60 |
Upprepa infusionen var 12:e till 24:e timme under 3 till 4 dagar eller längre tills smärtan och den akuta funktionsnedsättningen har upphört. |
|
Livshotande blödningar |
60–100 |
Upprepa infusionen var 8:e till 24:e timme tills det kritiska tillståndet är övervunnet |
|
Kirurgi | ||
|
Mindre kirurgiska ingrepp inklusive tandutdragning |
30–60 |
Var 24:e timme under minst 1 dag, tills läkning uppnåtts. |
|
Större kirurgiska ingrepp |
80–100 (pre- och postoperativt) |
Upprepa infusionen var 8–24 timme tills adekvat sårläkning uppnåtts. Därefter behandling under ytterligare minst 7 dagar för att upprätthålla en faktor VIII-aktivitet på 30–60 % (IE/dl). |
Profylax
Vid långtidsprofylax mot blödning hos patienter med svår hemofili A, är de vanliga doserna 20 till 40 IE faktor VIII per kg kroppsvikt med doseringsintervall om 2 till 3 dagar. Regimen kan justeras beroende på patientens respons.
I vissa fall kan kortare dosintervall eller högre doser behövas, speciellt hos yngre patienter.
Pediatrisk population
Doseringen är densamma för vuxna och barn men kortare dosintervall eller högre doser kan behövas för barn. Tillgänglig information finns i avsnitt Biverkningar, Farmakodynamik och Farmakokinetik.
Administreringssätt
Nuwiq är avsett för intravenös användning.
Injektionshastigheten bör inte överstiga 4 ml per minut.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet
Som för alla intravenösa proteinläkemedel kan allergiska överkänslighetsreaktioner förekomma. Nuwiq innehåller spår av andra humana värdcellsproteiner än faktor VIII. Om symtom på överkänslighet uppträder bör patienten rådas att omedelbart avbryta användning av läkemedlet och kontakta sin läkare. Patienter ska informeras om tidiga tecken på överkänslighetsreaktioner inklusive nässelutslag, generaliserad urtikaria, tryck över bröstet, väsande andning, hypotoni och anafylaxi.
Vid chock ska medicinsk standardbehandling för chock tillämpas.
Inhibitorer
Utveckling av neutraliserande antikroppar (inhibitorer) mot faktor VIII är en känd komplikation vid behandling av patienter med hemofili A. Dessa inhibitorer är vanligtvis IgG-immunglobuliner riktade mot den prokoagulerande effekten hos faktor VIII, och kvantifieras i Bethesda-enheter (BE) per ml plasma med den modifierade testmetoden. Risken att utveckla inhibitorer är relaterad till sjukdomens allvarlighetsgrad samt exposering för faktor VIII, där risken är störst inom de 50 första exponeringsdagarna, men fortsätter genom hela livet även om risken är ovanlig.
Fall av återkommande inhibitorer (låg titer) har observerats efter byte från en faktor VIII produkt till en annan hos tidigare behandlade patienter med mer än 100 exponeringsdagar och med inhibitorutveckling i anamnesen. Därför rekommenderas att alla patienter noga övervakas med avseende på förekomst av inhibitorer när man byter till en annan produkt.
Hur kliniskt relevant utvecklingen av inhibitorer är beror på inhibitorernas titer, där låg titer, som förekommer övergående eller är konsekvent låg, utgör en lägre risk för otillräckligt kliniskt svar än hög titer.
I allmänhet bör alla patienter som behandlas med koagulationsfaktor VIII-produkter följas noggrant med avseende på utveckling av inhibitorer genom lämpliga kliniska observationer och laboratorietester. Om förväntade faktor VIII nivåer i plasma inte uppnås, eller om blödningar inte kontrolleras trots adekvat dos, bör test för faktor VIII inhibitorer utföras. Hos patienter med höga halter av inhibitorer är faktor VIII behandlingen eventuellt inte effektiv och andra behandlingsalternativ bör därför övervägas. Behandling av sådana patienter ska ske under överinseende av läkare med erfarenhet av hemofili och faktor VIII inhibitorer.
Kardiovaskulära händelser
Hos patienter med föreliggande kardiovaskulära riskfaktorer kan substitutionsbehandling med FVIII öka den kardiovaskulära risken.
Kateterrelaterade komplikationer
Om det krävs en central venkateter (CVK), bör risken för CVK-relaterade komplikationer inklusive lokala infektioner, bakteriemi och trombos vid kateterstället övervägas.
Pediatrisk population
Varningar och försiktighet som anges gäller för både barn, ungdomar och vuxna.
Hjälpämnesrelaterade överväganden (natriuminnehåll)
Detta läkemedel innehåller 18,4 mg natrium per injektionsflaska, motsvarande 0,92 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
Interaktioner
Inga interaktionsstudier har utförts med Nuwiq.
Graviditet
Inga reproduktionsstudier på djur har utförts med faktor VIII.
Baserat på den låga förekomsten av hemofili A hos kvinnor saknas erfarenhet av användning av faktor VIII under graviditet och amning. Därför ska faktor VIII endast användas vid en tydlig indikation under graviditet och amning.
Amning
Baserat på den låga förekomsten av hemofili A hos kvinnor saknas erfarenhet av användning av faktor VIII under amning. Därför ska Nuwiq endast användas vid en tydlig indikation under amning.
Fertilitet
Inga reproduktionsstudier på djur har utförts med faktor VIII.
Det finns inga tillgängliga fertilitetsdata.
Trafik
Nuwiq har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Överkänslighet eller allergiska reaktioner (som kan inkludera angioödem, brännande och stickande känsla vid injektionsstället, frossa, blodvallningar, huvudvärk, nässelutslag, hypotoni, letargi, illamående, hudutslag, rastlöshet, takykardi, tryck över bröstet, stickningar, urtikaria inklusive generaliserad urtikaria, kräkningar, väsande andning) har sällan observerats med FVIII-preparat och kan i vissa fall utvecklas till svår anafylaxi (inklusive chock).
Neutraliserande antikroppar (inhibitorer) kan utvecklas hos patienter med hemofili A som behandlas med faktor VIII, inklusive Nuwiq. Om sådana inhibitorer utvecklas visar sig detta som ett tillstånd med otillräckligt kliniskt svar. Om detta inträffar är rekommendationen att kontakta ett specialistcenter för hemofili.
Biverkningar i tabellform
Tabell 1 nedan presenteras enligt MedDRA:s klassificering av organsystem (SOC och Preferred Term Level).
Frekvenserna är baserade på rapporter från kliniska prövningar med totalt 355 unika försökspersoner med svår hemofili A, av vilka 247 var tidigare behandlade patienter (PTP) och 108 var tidigare obehandlade patienter (PUP).
Frekvenserna har utvärderats enligt följande konvention: mycket vanliga (≥ 1/10); vanliga (≥ 1/100 till < 1/10); mindre vanliga (≥ 1/1 000 till < 1/100); sällsynta (≥ 1/10 000 till < 1/1 000); mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Inom varje frekvensgruppering presenteras biverkningarna i fallande svårighetsgrad.
|
MedDRA-klassificering
|
Biverkningar |
Frekvens |
|---|---|---|
|
Blodet och
|
Anemi
Blödningsanemi |
Mindre vanliga*
Mycket vanliga (PUP)# Mindre vanliga* |
|
Immunsystemet |
Överkänslighet |
Vanliga* |
|
Centrala och perifera nervsystemet |
Yrsel Huvudvärk Parestesi |
Mindre vanliga* Mindre vanliga* Mindre vanliga* |
|
Öron och balansorgan |
Yrsel |
Mindre vanliga* |
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné |
Mindre vanliga* |
|
Magtarmkanalen |
Muntorrhet |
Mindre vanliga* |
|
Muskuloskeletala systemet
|
Ryggsmärta |
Mindre vanliga* |
|
Allmänna symtom och/eller symtom vid
|
Feber Bröstsmärta Inflammation vid injektionsstället Smärta vid injektionsstället Obehagskänsla |
Vanliga* Mindre vanliga*
Mindre vanliga* Mindre vanliga* |
|
Undersökningar |
Positiv för icke-neutraliserande antikropp (hos tidigare behandlade patienter) |
Mindre vanliga* |
|
* Beräknat som antalet patienter med biverkningar per totala antalet (355) studiepatienter, av vilka 247 var tidigare behandlade och 108 tidigare obehandlade patienter. # Frekvensen baseras på studier med alla FVIII-produkter, vilka inkluderade patienter med svår hemofili A. PTP = previously treated patients = patienter som har behandlats tidigare, PUP = previously untreated patients = patienter som inte har behandlats tidigare |
||
Beskrivning av valda biverkningar
En icke-neutraliserande anti-faktor VIII-antikropp detekterades hos en vuxen patient (se tabell 1). Provet testades vid åtta utspädningar av centrallaboratoriet. Resultatet var bara positivt vid utspädningsfaktor 1 och antikroppstitern var mycket låg. Inhibitorisk aktivitet, enligt mätning med det modifierade Bethesda-testet, detekterades inte hos denna patient. Klinisk effekt och in vivo-recovery för Nuwiq påverkades inte hos denna patient.
Pediatrisk population
Biverkningarnas frekvens, typ, och svårighetsgrad hos barn antas vara samma som för vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Inga fall av överdosering har rapporterats.
Farmakodynamik
Faktor VIII/von Willebrand-faktorkomplexet består av två molekyler (faktor VIII och von Willebrand-faktor) med olika fysiologiska funktioner. Vid infusion i en patient med hemofili, binder faktor VIII till von Willebrand-faktorn i patientens cirkulation. Aktiverad faktor VIII agerar som kofaktor för aktiverad faktor IX, och accelererar omvandlingen av faktor X till aktiverad faktor X. Aktiverad faktor X omvandlar protrombin till trombin. Trombin omvandlar sedan fibrinogen till fibrin och ett koagel kan bildas. Hemofili A är en könsbunden ärftlig störning av blodkoaguleringen på grund av minskade nivåer av faktor VIII:C och ger rikliga blödningar i leder, muskler eller inre organ, antingen spontant eller som en följd av olycksfall eller kirurgiska ingrepp. Genom substitutionsbehandling kan plasmanivåerna av faktor VIII höjas och därmed tillfälligt möjliggöra en korrigering av faktor VIII-bristen och en korrigering av blödningstendensen.
Vuxen- och ungdomspopulation 12 - 65 år
Profylax
I en klinisk studie med 32 vuxna patienter med svår hemofili A, var medianvärdet för konsumtionen av Nuwiq vid profylax 468,7 IE/kg/månad.
Blödningsbehandling
Mediandosen för behandling av genombrottsblödningar var 33,0 IE/kg hos dessa patienter som behandlades med profylax. I en annan klinisk studie behandlades 22 vuxna patienter vid behov. Totalt behandlades 986 blödningar med en mediandos på 30,9 IE/kg. Generellt krävde mindre blödningar en något lägre dos, och svårare blödningar krävde upp till tre gånger av mediandosen.
Individualiserad profylax
Individualiserad farmakokinetiskt baserad profylax utvärderades hos 66 vuxna, tidigare behandlade patienter med svår hemofili A. Efter en 1-3 månaders standardprofylaxfas (dosering varannan dag eller 3 gånger per vecka) bytte 44 (67 %) patienter till en doseringsregim baserad på deras farmakokinetiska utvärdering och 40 genomgick en 6 månader lång profylax enligt tilldelat doserings- och behandlingsschema. Av dessa patienter behandlades 34 (85 %) två gånger i veckan eller mindre. Hos 33 (82,5 %) patienter förekom inga blödningar och 36 (90,0 %) patienter hade inga spontana blödningar. Genomsnittlig årlig blödningsfrekvens ± SD var 1,2 ± 3,9 och genomsnittlig dos ± SD var 52,2 ± 12,2 IE/kg per injektion och 99,7 ± 25,6 IE/kg per vecka.
Observera att årlig blödningsfrekvens (ABR – Annualised Bleeding Rate) inte kan jämföras mellan olika faktorkoncentrat och mellan olika kliniska studier.
Pediatrisk population
Data har erhållits från 29 tidigare behandlade barn mellan 2 och 5 års ålder, 31 barn mellan 6 och 12 års ålder och en ungdom på 14 år. Mediandosen per profylaktisk infusion var 37,8 IE/kg. 20 patienter använde mediandoser på mer än 45 IE/kg. Medianvärdet för konsumtionen av Nuwiq vid profylax var 521,9 IE/kg/månad. En högre mediandos av Nuwiq krävdes för att behandla blödningar hos barn (43,9 IE/kg) än hos vuxna (33,0 IE/kg), och en högre mediandos krävdes för att behandla måttliga till större blödningar än mindre blödningar (78,2 IE/kg jämfört med 41,7 IE/kg). Yngre barn krävde generellt högre mediandoser (6–12 år: 43,9 IE/kg; 2–5 år: 52,6 IE/kg). Dessa data bekräftades av en långvarig uppföljning av 49 av dessa barn som behandlades i ytterligare en medianperiod på cirka 30 månader (från 9,5 till 52 månader). Under denna period förekom inga spontana blödningar hos 45 % av barnen.
Data från 108 tidigare obehandlade patienter med svår hemofili A (<1 % FVIII:C) erhölls i en prospektiv, öppen klinisk studie. Hos flertalet patienter inleddes profylaktisk behandling efter debut av den första blödningsepisoden som krävde behandling.
Farmakokinetik
Vuxen population
|
Farmakokinetisk parameter |
Kromogen substratanalys |
|
|---|---|---|
|
Medelvärde ± SD |
Medianvärde (intervall) |
|
|
AUC (hr*IE/ml) |
22,6 ± 8,0 |
22,3 (8,4 – 38,1) |
|
T1/2 (hr) |
14,7 ± 10,4 |
12,5 (5,4 – 55,6) |
|
IVR (%/IE/kg) |
2,5 ± 0,4 |
2,5 (1,7 – 3,2) |
|
CL (ml/hr/kg) |
3,0 ± 1,2 |
2,7 (1,5-6,4) |
AUC = Area under the curve (FVIII:C), T1/2 = Terminal half-life,
IVR = Incremental in vivo-recovery, CL = Clearance, SD = standard deviation
|
Farmakokinetisk parameter |
Kromogen substratanalys |
|
|---|---|---|
|
Medelvärde ± SD |
Medianvärde (intervall) |
|
|
AUC (hr*IE/ml) |
13,2 ± 3,4 |
12,8 (7,8 – 19,1) |
|
T1/2 (hr) |
10,0 ± 1,9 |
9,9 (7,6 – 14,1) |
|
IVR (%/IE/kg) |
1,9 ± 0,4 |
1,9 (1,2 – 2,6) |
|
CL (ml/hr/kg) |
4,3 ± 1,2 |
4,2 (2,8 - 6,9) |
AUC = Area under the curve (FVIII:C), T1/2 = Terminal half-life,
IVR = Incremental in vivo-recovery, CL = Clearance, SD = standard deviation
|
Farmakokinetisk parameter |
Kromogen substratanalys |
|
|---|---|---|
|
Medelvärde ± SD |
Medianvärde (intervall) |
|
|
AUC (hr*IE/ml) |
11,7 ± 5,3 |
10,5 (4,9 – 23,8) |
|
T1/2 (hr) |
9,5 ± 3,3 |
8,2 (4,3 – 17,3) |
|
IVR (%/IE/kg) |
1,9 ± 0,3 |
1,8 (1,5 – 2,4) |
|
CL (ml/hr/kg) |
5,4 ± 2,4 |
5,1 ( 2,3 – 10,9) |
AUC = Area under the curve (FVIII:C), T1/2 = Terminal half-life,
IVR = Incremental in vivo-recovery, CL = Clearance, SD = standard deviation
Pediatrisk population
Som känt från litteraturen var in vivo-recovery lägre och halveringstiden kortare hos små barn än hos vuxna och clearance var högre, vilket delvis kan bero på den kända större plasmavolymen per kilogram kroppsvikt hos yngre patienter.
Viktjusterade subgrupper
|
Farmakokinetisk parameter |
Samtliga (n=20) |
Normalvikt (n=14) |
Pre-adipös (n=4) |
Adipös (n=2) |
|---|---|---|---|---|
|
Kromogen substratanalys Medelvärde ± SD |
||||
|
AUC (hr*IE/ml) |
22,6 ± 8,0 |
20,4 ± 6,9 |
24,9 ± 8,9 |
33,5 ± 6,5 |
|
T1/2 (hr) |
14,7 ± 10,4 |
14,7 ± 12,1 |
13,4 ± 5,9 |
17,2 ± 4,8 |
|
IVR (%/IE/kg) |
2,5 ± 0,4 |
2,4 ± 0,4 |
2,7 ± 0,4 |
2,8 ± 0,3 |
|
CL (ml/hr/kg) |
3,0 ± 1,2 |
3,2 ± 1,3 |
2,6 ± 1,0 |
1,8 ± 0,4 |
|
Kromogen substratanalys Medianvärde (intervall) |
||||
|
AUC (hr*IE/ml) |
22,3 (8,4 – 38,1) |
21,2 (8,4 – 32,6) |
23,3 (17,4 – 35,5) |
33,5 (28,9 – 38,1) |
|
T1/2 (hr) |
12,5 (5,4 – 55,6) |
12,3 (5,4 – 55,6) |
11,2 (9,3 – 22,0) |
17,2 (13,8 – 20,6) |
|
IVR (%/IE/kg) |
2,5 (1,7 – 3,2) |
2,4 (1,7 – 3,1) |
2,8 (2,3 – 3,2) |
2,8 (2,6 – 3,0) |
|
CL (ml/hr/kg) |
2,7 (1,5 – 6,4) |
2,8 (1,7 – 6,4) |
2,5 (1,6 – 3,7) |
1,8 (1,5 – 2,0) |
Normalvikt: BMI 18,5–25 kg/m2, pre-adipös: BMI 25–30 kg/m2, adipös: BMI > 30 kg/m2, SD = standard deviation
Prekliniska uppgifter
I prekliniska studier användes Nuwiq för att säkert och effektivt återställa hemostasen hos hundar med hemofili. Toxikologiska studier visade att lokal intravenös administrering och systemisk exponering tolererades väl hos försöksdjur (råttor och cynomolgus-apor).
Specifika studier med långvarig upprepad administrering med avseende på reproduktionstoxicitet, kronisk toxicitet och karcinogenicitet genomfördes inte med Nuwiq på grund av immunsvaret mot heterologa proteiner hos alla icke-humana däggdjur.
Inga studier genomfördes med avseende på Nuwiqs mutagena potential.
Ex vivo-utvärderingar med en kommersiell analys för att kvantifiera T-cellssvaret på proteinbehandling indikerar en låg risk för immunogenicitet.
Innehåll
Kvalitativ och kvantitativ sammansättning
Nuwiq 250 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 250 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 250 IE omkring 100 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 500 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 500 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 500 IE omkring 200 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 1000 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 1000 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 1000 IE omkring 400 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 1500 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 1500 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 1500 IE omkring 600 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 2000 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 2000 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 2000 IE omkring 800 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 2500 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 2500 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 2500 IE omkring 1000 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 3000 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 3000 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 3000 IE omkring 1200 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Nuwiq 4000 IE pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller nominellt 2000 IE rekombinant human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Efter beredning innehåller Nuwiq 4000 IE omkring 1600 IE/ml human koagulationsfaktor VIII (rDNA), simoctocog alfa.
Styrkan (IE) bestäms med Europeiska farmakopéns kromogena substratanalys. Den specifika aktiviteten för Nuwiq är ungefär 9500 IE/mg protein.
Simoctocog alfa (human koagulationsfaktor VIII (rDNA)), är ett renat protein med 1 440 aminosyror. Aminosyrasekvensen är jämförbar med den form av faktor VIII som består av 90 + 80 kDa från human faktor VIII (dvs utan B-domän). Nuwiq produceras med rekombinant DNA-teknik i genetiskt modifierade humana embryonala njurceller, (HEK) 293F-celler. Inget material från djur eller människa läggs till under tillverkningsprocessen eller till det slutliga läkemedlet.
Hjälpämne med känd effekt
En ml rekonstituerad lösning innehåller 7,35 mg natrium (18,4 mg natrium per injektionsflaska).
Förteckning över hjälpämnen
Pulver
Sackaros
Natriumklorid
Kalciumkloriddihydrat
Argininhydroklorid
Natriumcitratdihydrat
Poloxamer 188
Vätska
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Endast de bifogade injektionshjälpmedlen ska användas eftersom utebliven behandlingseffekt kan förekomma på grund av att human koagulationsfaktor VIII kan adsorberas på invändiga ytor på viss injektionsutrustning.
Miljöpåverkan
Simoktokog alfa
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
Oöppnad injektionsflaska
2 år
Under hållbarhetstiden kan produkten förvaras i rumstemperatur (vid högst 25 °C) i upp till 1 månad. När läkemedlet tagits ut från kylskåpet får det inte sättas tillbaka igen. Datumet då läkemedlet börjar förvaras vid rumstemperatur bör noteras på ytterkartongen. Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Efter beredning
Efter beredning har kemisk och fysikalisk stabilitet visats för 24 timmar vid förvaring i rumstemperatur.
Ur mikrobiologisk synvinkel bör produkten användas omedelbart efter beredningen. Om den inte används omedelbart ansvarar användaren för förvaringstider vid användning och förhållanden före användning.
Den beredda lösningen förvaras i rumstemperatur. Förvaras ej i kylskåp efter beredning.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C – 8 °C).
Får ej frysas.
Förvara injektionsflaskan i originalförpackningen. Ljuskänsligt.
Anvisningar för förvaring i rumstemperatur och förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet, förvaring och hantering.
Särskilda anvisningar för destruktion
Pulvret ska enbart beredas med den bifogade vätskan (2,5 ml vatten för injektionsvätskor) med användning av det bifogade injektionshjälpmedlet. Injektionsflaskan ska roteras försiktigt tills allt pulver lösts upp. Efter beredningen ska lösningen dras upp i injektionssprutan igen.
Före administrering ska det beredda läkemedlet okulärbesiktigas med avseende på partiklar och missfärgning. Det beredda läkemedlet är en klar, färglös vätska, som är fri från främmande partiklar och har ett pH på 6,5 till 7,5. Använd inte lösningar som är grumliga eller har fällningar.
Anvisningar för beredning och administrering
-
Den förfyllda sprutan med vätska (vatten för injektionsvätskor) och pulvret i den slutna injektionsflaskan ska uppnå rumstemperatur. Du kan göra detta genom att hålla dem i din hand tills de känns lika varma som dina händer. Värm inte injektionsflaskan eller den förfyllda sprutan på något annat sätt. Denna temperatur ska upprätthållas under beredningen.
-
Avlägsna snäpplocket i plast från injektionsflaskan med pulver för att exponera de centrala delarna av gummiproppen. Avlägsna inte den grå proppen eller metallringen runt toppen av injektionsflaskan.
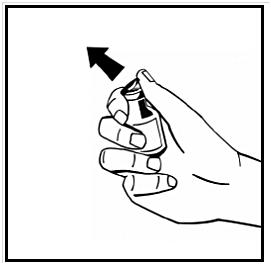
-
Torka av toppen på injektionsflaskan med en alkoholservett. Låt alkoholen torka.
-
Dra av pappersskyddet från adapterförpackningen. Avlägsna inte adaptern från förpackningen.
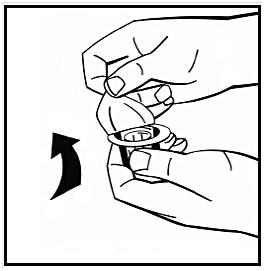
5. Placera injektionsflaskan med pulver på en jämn yta och håll i den. Ta adapterförpackningen och placera adaptern över gummiproppens centrum på injektionsflaskan med pulver. Tryck ned adapterförpackningen hårt tills adapterspetsen går igenom gummiproppen. När detta sker klickar adaptern ned om injektionsflaskan.
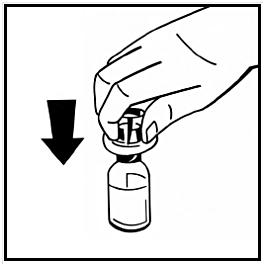
6. Dra av pappersskyddet från den förfyllda sprutans förpackning. Håll kolvstången i änden och rör inte vid skaftet. Fäst den gängade änden av kolvstången i injektionssprutans kolv. Vrid kolvstången medurs tills det känns ett lätt motstånd.
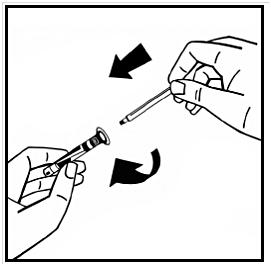
7. Bryt av den manipuleringssäkra plastspetsen från injektionssprutan med vätska genom att bryta lockets perforering. Rör inte vid lockets insida eller injektionssprutans spets. Förslut den fyllda injektionssprutan med den manipuleringssäkra plastspetsen för förvaring om lösningen inte ska användas omedelbart.
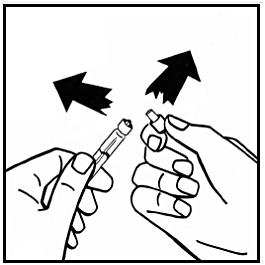
8. Avlägsna adapterförpackningen och kassera den.
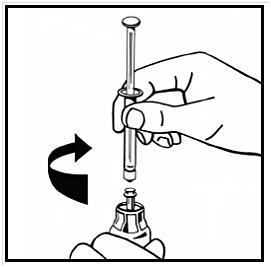
9. Anslut injektionssprutan med vätska till injektionsflaskans adapter ordentligt genom att vrida medurs tills det känns ett motstånd.
10. Injicera långsamt all vätska i injektionsflaskan med pulver genom att pressa ned kolvstången.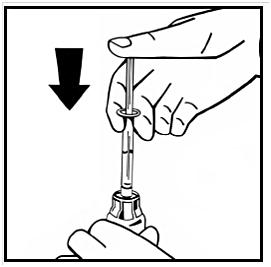
11. Lös upp pulvret utan att avlägsna injektionssprutan genom att försiktigt röra eller snurra injektionsflaskan några gånger. Skaka inte. Vänta tills pulvret upplöses fullständigt.
12. Kontrollera den slutliga lösningen visuellt med avseende på partiklar före administrering. Lösningen ska vara klar och färglös, så gott som fri från synliga partiklar. Använd inte lösningar som är grumliga eller har fällningar.
13. Vänd injektionsflaskan fäst till injektionssprutan upp och ned, och dra långsamt in den slutliga lösningen i injektionssprutan. Säkerställ att injektionsflaskans hela innehåll överförs till injektionssprutan.
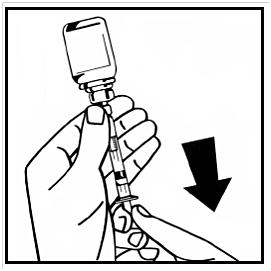
14. Lossa den fyllda injektionssprutan från adaptern med injektionsflaskan genom att vrida moturs och kassera den tomma injektionsflaskan.
15. Lösningen är nu beredd för omedelbar användning. Kyl inte.
16. Rengör det valda injektionsstället med en medföljande alkoholservett.
17. Fäst det medföljande infusionssetet på injektionssprutan. För in infusionssetets nål i den valda venen. Om du har använt ett stasband för att venen ska bli lättare att se, ska detta lossas innan du börjar injicera lösningen.
Blod får inte komma in i injektionssprutan på grund av risken för bildning av fibrinkoagel.
18. Injicera lösningen i venen med låg hastighet, inte snabbare än 4 ml per minut.
Om du använder mer än en injektionsflaska med pulver för en behandling, kan du använda samma injektionsnål igen. Injektionsflaskans adapter och injektionssprutan är endast avsedda för engångsbruk.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Pulver och vätska till injektionsvätska, lösning.
Pulver: vitt till benvitt smuligt pulver.
Vätska: en klar, färglös vätska.
Förpackningsinformation
Pulver och vätska till injektionsvätska, lösning 250 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 1506:31, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 500 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 2964:38, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 1000 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 5880:50, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 1500 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 8796:63, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 2000 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 11712:75, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 2500 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 14628:88, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 3000 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 17545:-, F, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 4000 IE
Vitt till benvitt smuligt pulver + vatten för injektionsvätskor, en klar färglös vätska
1 styck injektionsflaska och förfylld spruta, 23377:25, F, Övriga förskrivare: tandläkare





