1 LÄKEMEDLETS NAMN
Orfadin 4 mg/ml oral suspension
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
1 ml innehåller 4 mg nitisinon.
Hjälpämnen med känd effekt:
En ml innehåller:
natrium 0,7 mg (0,03 mmol)
glycerol 500 mg
natriumbensoat 1 mg
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Oral suspension.
Vit, något viskös och ogenomskinlig suspension.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Hereditär tyrosinemi typ 1 (HT‑1)
Orfadin är avsett för behandling av vuxna och pediatriska (i alla åldersspann) patienter med bekräftad diagnos på hereditär tyrosinemi typ 1 (HT‑1) i kombination med restriktivt intag av tyrosin och fenylalanin.
Alkaptonuri (AKU)
Orfadin är avsett för behandling av vuxna patienter med alkaptonuri (AKU).
4.2 Dosering och administreringssätt
Dosering
HT‑1:
Behandling med nitisinon ska inledas och övervakas av läkare med erfarenhet av behandling av HT‑1‑patienter.
Behandling av alla genotyper av sjukdomen ska inledas så tidigt som möjligt för att överlevnaden ska öka och komplikationer såsom leversvikt, levercancer och njursjukdom undvikas. Som komplement till nitisinonbehandlingen krävs en fenylalanin- och tyrosinfattig diet som ska övervakas genom kontroll av aminosyror i plasma (se avsnitt 4.4 och 4.8).
Startdos vid HT‑1
Den rekommenderade initiala dagliga dosen i barn- och vuxenpopulationen är 1 mg/kg kroppsvikt administrerat oralt. Dosen nitisinon ska justeras individuellt. Dosering en gång dagligen rekommenderas. På grund av begränsade data för patienter med kroppsvikt <20 kg, rekommenderas emellertid att den totala dygnsdosen delas upp på två dagliga administreringar till denna patientpopulation.
Dosjustering vid HT‑1
Vid regelbunden övervakning är det lämpligt att kontrollera urinsuccinylaceton, ta leverfunktionsprover och kontrollera alfa fetoproteinnivåer (se avsnitt 4.4). Om succinylaceton fortfarande kan spåras i urin en månad efter påbörjad nitisinonbehandling ska dosen nitisinon ökas till 1,5 mg/kg kroppsvikt/dag. En dos på 2 mg/kg kroppsvikt/dag kan behövas baserat på bedömning av alla biokemiska parametrar. Den dosen ska betraktas som den maximala dosen för alla patienter.
Om det biokemiska svaret är tillfredsställande, ska dosen endast justeras efter ökning av kroppsvikt.
Förutom de ovan nämnda testerna kan det vara nödvändigt, vid inledning av behandling, efter byte från dosering två gånger dagligen till en gång dagligen eller om försämring inträffar, att närmare följa alla tillgängliga biokemiska parametrar (dvs. succinylaceton i plasma, 5‑aminolevulinat (ALA) i urin och erytrocytporfobilinogen (PBG)‑syntasaktivitet).
AKU:
Behandling med nitisinon ska inledas och övervakas av läkare med erfarenhet av behandling av AKU‑patienter.
Den rekommenderade dosen för den vuxna AKU-populationen är 10 mg en gång dagligen.
Särskilda populationer
Det finns inga särskilda dosrekommendationer för äldre patienter eller för patienter med njur- eller leverdysfunktion.
Pediatrisk population
HT‑1: Dosrekommendationen i mg/kg kroppsvikt är samma för barn och vuxna.
På grund av begränsade data för patienter med kroppsvikt <20 kg, rekommenderas emellertid att den totala dygnsdosen delas upp på två dagliga administreringar till denna patientpopulation.
AKU: Säkerhet och effekt för Orfadin för barn i åldern 0 till 18 år med AKU har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Suspensionen ges outspädd i patientens mun med en spruta för oral användning. Sprutor på 1 ml, 3 ml och 5 ml medföljer i förpackningen för att mäta upp dosen i ml enligt den föreskrivna doseringen. Sprutorna är graderade i steg på 0,01 ml, 0,1 ml respektive 0,2 ml. I tabellen nedan visas dosomvandlingen (mg/ml) för de tre sprutstorlekarna.
Dosomvandlingstabeller för de tre sprutorna:
|
1 ml spruta för oral användning (0,01 ml‑ gradering) |
Dos Orfadin |
|
|
mg |
ml |
|
|
1,00 |
0,25 |
|
|
1,25 |
0,31 |
|
|
1,50 |
0,38 |
|
|
1,75 |
0,44 |
|
|
2,00 |
0,50 |
|
|
2,25 |
0,56 |
|
|
2,50 |
0,63 |
|
|
2,75 |
0,69 |
|
|
3,00 |
0,75 |
|
|
3,25 |
0,81 |
|
|
3,50 |
0,88 |
|
|
3,75 |
0,94 |
|
|
4,00 |
1,00 |
|
|
3 ml spruta för oral användning (0,1 ml‑ gradering) |
Dos Orfadin |
|
|
mg |
ml |
|
|
4,5 |
1,1 |
|
|
5,0 |
1,3 |
|
|
5,5 |
1,4 |
|
|
6,0 |
1,5 |
|
|
6,5 |
1,6 |
|
|
7,0 |
1,8 |
|
|
7,5 |
1,9 |
|
|
8,0 |
2,0 |
|
|
8,5 |
2,1 |
|
|
9,0 |
2,3 |
|
|
9,5 |
2,4 |
|
|
10,0 |
2,5 |
|
|
10,5 |
2,6 |
|
|
11,0 |
2,8 |
|
|
11,5 |
2,9 |
|
|
12,0 |
3,0 |
|
|
5 ml spruta för oral användning (0,2 ml‑ gradering) |
Dos Orfadin |
|
|
mg |
ml |
|
|
13,0 |
3,2 |
|
|
14,0 |
3,6 |
|
|
15,0 |
3,8 |
|
|
16,0 |
4,0 |
|
|
17,0 |
4,2 |
|
|
18,0 |
4,6 |
|
|
19,0 |
4,8 |
|
|
20,0 |
5,0 |
|
Viktig information om bruksanvisningen:
Återdispergering krävs före varje användning genom kraftig skakning. Före återdispergering kan läkemedlet se ut som en fast kaka med en något opalescent supernatant. Dosen ska dras upp och administreras omedelbart efter återdispergering. Det är viktigt att anvisningarna i avsnitt 6.6 för beredning och administrering följs noggrant för att säkerställa en korrekt dosering.
Det rekommenderas att sjukvårdspersonal informerar patienten eller vårdgivaren hur man använder sprutorna för att säkerställa att korrekt volym administreras och att ordinationen ges i ml.
Orfadin finns även tillgängligt som 2 mg, 5 mg, 10 mg och 20 mg kapslar, om det anses lämpligare för patienten.
Det rekommenderas att den orala suspensionen ges tillsammans med föda, se avsnitt 4.5.
Försiktighetsåtgärder före hantering eller administrering av läkemedlet
Ingen nål, intravenös slang eller annat hjälpmedel för parenteral administrering ska anslutas till sprutan.
Orfadin är endast avsett för oral användning.
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
Mödrar som behandlas med nitisinon får inte amma (se avsnitt 4.6 och 5.3).
4.4 Varningar och försiktighet
Regelbundna kontroller bör göras var 6:e månad. Vid biverkningar rekommenderas tätare kontroller.
Kontroll av tyrosinnivåer i plasma
Det rekommenderas att en ögonundersökning med spaltlampa utförs innan behandlingen med nitisinon inleds och därefter regelbundet minst en gång om året. En patient som uppvisar synbesvär vid behandling med nitisinon ska omedelbart undersökas av oftalmolog.
HT‑1: Det ska fastställas att patienten följer sin diet och tyrosinkoncentrationen i plasma ska mätas. En mer tyrosin- och fenylalaninfattig diet ska tillämpas om tyrosinhalten i plasma är högre än 500 mikromol/l. Det rekommenderas inte att tyrosinkoncentrationen i plasma sänks genom minskning eller utsättande av nitisinon, eftersom den metabola defekten kan leda till försämring av patientens kliniska tillstånd.
AKU: Hos patienter som utvecklar keratopatier ska tyrosinnivån i plasma övervakas. En tyrosin- och fenylalaninfattig diet ska tillämpas för att hålla tyrosinnivån i plasma under 500 mikromol/l. Dessutom ska nitisinon tillfälligt sättas ut och kan sättas in på nytt när symtomen har försvunnit.
Leverkontroll
HT‑1: Leverns funktion ska kontrolleras regelbundet med hjälp av leverfunktionsprover och avbildning av levern. Det rekommenderas också att koncentrationen alfa‑fetoprotein i serum övervakas. En ökning av koncentrationen alfa‑fetoprotein i serum kan vara ett tecken på otillräcklig behandling. Patienter med stigande alfa‑fetoproteinvärden eller tecken på knutor i levern ska alltid undersökas med avseende på levermalignitet.
Övervakning av blodplättar och vita blodkroppar (WBC)
Det rekommenderas att antalet blodplättar och vita blodkroppar kontrolleras regelbundet för både HT‑1- och AKU-patienter, eftersom enstaka fall av reversibel trombocytopeni och leukocytopeni har observerats vid klinisk utvärdering av HT‑1.
Samtidig användning med andra läkemedel
Nitisinon är en måttlig hämmare av CYP 2C9. Nitisinonbehandling kan därför leda till ökade plasmakoncentrationer av samtidigt administrerade läkemedel som främst metaboliseras via CYP 2C9. Nitisinonbehandlade patienter som samtidigt behandlas med läkemedel med ett smalt terapeutiskt fönster som metaboliseras via CYP 2C9, t.ex. warfarin och fenytoin, ska kontrolleras noga. Dosjustering av dessa samtidigt administrerade läkemedel kan behövas (se avsnitt 4.5).
Hjälpämnen med känd effekt:
Glycerol
En ml innehåller 500 mg. En dos på 20 ml oral suspension (10 g glycerol) eller mer kan ge huvudvärk, magbesvär och diarré.
Natrium
En ml innehåller 0,7 mg (0,03 mmol).
Natriumbensoat
En ml innehåller 1 mg. Ökning av bilirubin efter dess bortträngning från albumin, orsakad av bensoesyra och dess salter, kan öka gulsot hos för tidigt födda eller fullgånga barn med gulsot och utvecklas till kärnikterus (deponering av okonjugerat bilirubin i hjärnvävnad). Noggrann övervakning av plasmanivåerna av bilirubin hos den nyfödda patienten är därför av stor vikt. Bilirubinnivåerna ska mätas före behandlingsstart: vid tydligt förhöjda plasmanivåer av bilirubin i plasma, speciellt hos för tidigt födda patienter med riskfaktorer som acidos och låg albuminnivå, bör behandling med en lämplig, viktbaserad del av en Orfadin kapslar övervägas istället för den orala suspensionen tills plasmanivåerna av okonjugerat bilirubin har normaliserats.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Nitisinon metaboliseras in vitro av CYP 3A4 och dosjustering kan därför krävas när nitisinon administreras samtidigt med hämmare eller inducerare av detta enzym.
Baserat på data från en klinisk interaktionsstudie med 80 mg nitisinon vid steady‑state är nitisinon en måttlig hämmare av CYP 2C9 (2,3‑faldig ökning av AUC för tolbutamid) och därför kan nitisinonbehandling leda till ökade plasmakoncentrationer av samtidigt administrerade läkemedel som främst metaboliseras via CYP 2C9 (se avsnitt 4.4).
Nitisinon är en svag inducerare av CYP 2E1 (30 % minskning av AUC för klorzoxazon) och en svag hämmare av OAT1 och OAT3 (1,7‑faldig ökning av AUC för furosemid), men nitisinon hämmade inte CYP 2D6 (se avsnitt 5.2).
Föda påverkar inte biotillgängligheten av oral nitisinonsuspension men intag tillsammans med föda minskar absorptionshastigheten och leder därmed till lägre fluktuationer av serumkoncentrationer inom ett dosintervall. Det rekommenderas därför att den orala suspensionen tas tillsammans med föda, se avsnitt 4.2.
4.6 Fertilitet, graviditet och amning
Graviditet
Det finns inte tillräckliga data från användningen av nitisinon i gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt 5.3). Risken för människa är okänd. Orfadin ska användas under graviditet endast då tillståndet kräver att det är absolut nödvändigt att kvinnan behandlas med nitisinon. Nitisinon passerar placenta hos människa.
Amning
Det är okänt huruvida nitisinon utsöndras i bröstmjölk hos människa. Djurstudier har uppvisat ogynnsamma postnatala effekter via exponering för nitisinon i mjölk. Mödrar som behandlas med nitisinon får därför inte amma eftersom eventuell risk för det ammade barnet inte kan uteslutas (se avsnitt 4.3 och 5.3).
Fertilitet
Det finns inga uppgifter om nitisinon påverkar fertilitet.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Orfadin har mindre effekt på förmågan att framföra fordon och använda maskiner. Biverkningar i ögat (se avsnitt 4.8) kan påverka synen. Om synen påverkas ska patienten inte framföra fordon eller använda maskiner.
4.8 Biverkningar
Sammanfattning av säkerhetsprofil
Genom sitt verkningssätt ökar nitisinon tyrosinnivåer hos alla patienter som behandlas med nitisinon. Ögonrelaterade biverkningar, t.ex. konjunktivit, hornhinneopacitet, keratit, ljuskänslighet och ögonsmärta, förknippade med förhöjda tyrosinnivåer är därför vanliga hos både HT‑1- och AKU‑patienter.Andra vanliga biverkningar i HT‑1-populationen omfattar trombocytopeni, leukocytopeni och granulocytopeni. Dermatitis exfoliativa kan inträffa men det är mindre vanligt.
Lista över biverkningar i tabellform
Biverkningar som anges nedan enligt MedDRA‑klassificering av organsystem och absolut frekvens baseras på uppgifter från kliniska prövningar hos patienter med HT‑1 och AKU och användning vid HT‑1 efter marknadsgodkännande. Frekvensen definieras som mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
MedDRA-klassificering av organsystem |
Frekvens vid HT‑1 |
Frekvens vid AKU1 |
Biverkning |
|
Infektioner och infestationer |
|
Vanliga |
Bronkit, pneumoni |
|
Blodet och lymfsystemet |
Vanliga |
|
Trombocytopeni, leukocytopeni, granulocytopeni |
|
Mindre vanliga |
|
Leukocytos |
|
|
Ögon |
Vanliga |
|
Konjunktivit, hornhinneopacitet, keratit, ljuskänslighet |
|
|
Mycket vanliga2 |
Keratopati |
|
|
Vanliga |
Mycket vanliga2 |
Ögonsmärta |
|
|
Mindre vanliga |
|
Blefarit |
|
|
Hud och subkutan vävnad |
Mindre vanliga |
|
Dermatitis exfoliativa, erytematösa hudutslag |
|
Mindre vanliga |
Vanliga |
Pruritus, hudutslag |
|
|
Undersökningar |
Mycket vanliga |
Mycket vanliga |
Förhöjda tyrosinnivåer |
1Frekvensen är baserad på en klinisk studie av AKU.
2Förhöjda tyrosinnivåer är förknippade med ögonrelaterade biverkningar. Ingen minskning av tyrosin eller fenylalanin i dieten tillämpades hos patienter i AKU-studien.
Beskrivning av utvalda biverkningar
Nitisinonbehandling leder till förhöjda tyrosinnivåer. Förhöjda nivåer av tyrosin har förknippats med ögonrelaterade biverkningar, t.ex. hornhinneopacitet och hyperkeratotiska lesioner hos HT‑1- och AKU‑patienter. Minskning av tyrosin och fenylalanin i dieten bör begränsa toxiciteten som är förknippad med denna typ av tyrosinemi genom att minska tyrosinnivåerna (se avsnitt 4.4).
I kliniska studier av HT‑1 var granulocytopeni endast allvarlig i mindre vanliga fall (<0,5 x 109/l) och inte förknippad med infektioner. Biverkningar som berör MedDRAs organsystem ”blodet och lymfsystemet” försvann vid fortsatt behandling med nitisinon.
Pediatrisk population
Säkerhetsprofilen för HT‑1 är huvudsakligen baserad på den pediatriska populationen eftersom behandling med nitisinon bör påbörjas så snart som diagnosen för hereditär tyrosinemi typ 1 (HT‑1) har fastställts. Uppgifter från klinisk studie och efter marknadsgodkännande påvisar inga indikationer på att säkerhetsprofilen är annorlunda för olika underuppsättningar av den pediatriska populationen eller annorlunda jämfört med säkerhetsprofilen för vuxna patienter.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Oavsiktligt intag av nitisinon av personer som håller normal diet utan begränsning av tyrosin och fenylalanin leder till förhöjda tyrosinnivåer. Förhöjda tyrosinnivåer har förknippats med toxicitet i ögon, hud och nervsystem. Restriktion av tyrosin och fenylalanin i dieten bör begränsa toxiciteten som bedöms uppstå i samband med denna typ av tyrosinemi. Information om specifik behandling vid överdosering saknas.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Övriga medel för matsmältning och ämnesomsättning, Övriga medel för matsmältning och ämnesomsättning, ATC kod: A16AX04.
Verkningsmekanism
Nitisinon är en kompetitiv hämmare av 4‑hydroxifenylpyruvatdioxygenas, det andra steget i tyrosinmetabolismen. Genom hämning av tyrosinets normala katabolism hos patienter med HT‑1 och AKU förhindrar nitisinon ansamling av skadliga metaboliter nedströms för 4‑hydroxifenylpyruvatdioxygenas.
Den biokemiska defekten vid HT‑1 är en brist på fumarylacetoacetathydrolas som är det slutliga enzymet i tyrosinets katabolism. Nitisinon förhindrar ansamling av de toxiska intermediaten maleylacetoacetat och fumarylacetoacetat. Dessa intermediat omvandlas annars till de toxiska metaboliterna succinylaceton och succinylacetoacetat. Succinylaceton hämmar porfyrinsyntesen vilket leder till ackumulering av 5‑aminolevulinat.
Den biokemiska defekten vid AKU är en brist på homogentisat-1,2 dioxygenas, det tredje enzymet i tyrosinets katabolism. Nitisinon förhindrar ansamling av den skadliga metaboliten homogentisinsyra (HGA) vilket annars leder till okronos i leder och brosk och därmed utveckling av sjukdomens kliniska manifestationer.
Farmakodynamisk effekt
Hos patienter med HT‑1 leder nitisinonbehandling till normaliserad porfyrinmetabolism med normal erytrocyt‑porfobilinogensyntasaktivitet och 5‑aminolevulinat i urin, minskad urinutsöndring av succinylaceton, ökad tyrosinkoncentration i plasma och ökad urinutsöndring av fenolsyror. Data från en klinisk prövning visar att hos fler än 90% av patienterna normaliserades succinylaceton i urin under den första behandlingsveckan. Succinylaceton ska inte kunna detekteras i urin eller plasma när nitisinondosen har justerats korrekt.
Hos patienter med AKU minskar nitisinonbehandling ansamling av HGA. Tillgängliga data från en klinisk studie visar en 99,7 % minskning av HGA i urin och en 98,8 % minskning av HGA i serum efter nitisinonbehandling jämfört med obehandlade kontrollpatienter efter 12 månaders behandling.
Klinisk effekt och säkerhet vid HT‑1
Den kliniska studien var öppen och okontrollerad. Doseringsfrekvensen i studien var två gånger dagligen. Sannolikhet för överlevnad efter 2, 4 och 6 års behandling med nitisinon sammanfattas i nedanstående tabell.
|
NTBC‑studie (N=250) |
|||
|
Ålder vid behandlingsstart |
2 år |
4 år |
6 år |
|
≤ 2 månader |
93 % |
93 % |
93 % |
|
≤ 6 månader |
93 % |
93 % |
93 % |
|
> 6 månader |
96 % |
95 % |
95 % |
|
Totalt |
94 % |
94 % |
94 % |
Data från en studie som använts som en historisk kontroll (van Spronsen et al., 1994) visade följande överlevnadssannolikhet.
|
Ålder för debut av symtom |
1 år |
2 år |
|
< 2 månader |
38 % |
29 % |
|
> 2–6 månader |
74 % |
74 % |
|
> 6 månader |
96 % |
96 % |
Behandling med nitisinon visade sig också leda till minskad risk för utveckling av hepatocellulärt karcinom i jämförelse med historiska data om behandling med enbart dietrestriktioner. Tidigt inledande av behandlingen resulterade i ytterligare minskad risk för utveckling av hepatocellulärt karcinom (HCC).
Sannolikheten år 2, 4 och 6 för ingen förekomst av HCC under nitisinonbehandling för patienter i åldern 24 månader eller yngre i början av behandlingen och för patienter äldre än 24 månader i början av behandlingen visas i nedanstående tabell:
|
NTBC‑studie (N=250) |
|||||||
|
|
Antal patienter vid |
Sannolikhet för ingen HCC (95 % konfidensintervall) vid |
|||||
|
start |
2 år |
4 år |
6 år |
2 år |
4 år |
6 år |
|
|
Alla patienter |
250 |
155 |
86 |
15 |
98 %
|
94 %
|
91 %
|
|
Startålder≤ 24 månader |
193 |
114 |
61 |
8 |
99 %
|
99 %
|
99 %
|
|
Startålder > 24 månader |
57 |
41 |
25 |
8 |
92 %
|
82 %
|
75 %
|
I en internationell undersökning av patienter med HT‑1 som endast fick behandling med kostrestriktioner, sågs att HCC hade diagnostiserats hos 18 % av alla patienter i åldern 2 år och äldre.
En studie utfördes med 19 patienter med HT-1 för att utvärdera farmakokinetik, effekt och säkerhet vid dosering en gång dagligen jämfört med två gånger dagligen. Inga kliniskt betydelsefulla skillnader i biverkningar eller andra säkerhetsbedömningar mellan dosering en gång dagligen och två gånger dagligen förekom. Ingen patient hade spårbara nivåer av succinylaceton (SA) i slutet av perioden med behandling en gång dagligen. Studien indikerar att administrering en gång dagligen är säkert och har effekt hos patienter i alla åldrar. Data är dock begränsade hos patienter med kroppsvikt <20 kg.
Klinisk effekt och säkerhet vid AKU
Effekt och säkerhet för 10 mg nitisinon en gång dagligen för behandling av vuxna patienter med AKU har demonstrerats i en randomiserad, utvärderarblindad, 48‑månaders parallellgruppsstudie med en icke-behandlad kontrollgrupp hos 138 patienter (69 behandlade med nitisinon). Det primära effektmåttet var effekten på HGA-nivåer i urin. En 99,7 % minskning efter nitisinonbehandling jämfört med obehandlade kontrollpatienter sågs efter 12 månader. Behandling med nitisinon visades ha en statistiskt signifikant positiv effekt på cAKUSSI, ögonpigmentering, öronpigmentering, osteopeni i höften och antal spinala regioner med smärta jämfört med den obehandlade kontrollen. cAKUSSI är en sammansatt poäng omfattande ögon- och öronpigmentering, njur- och prostatastenar, aortastenos, osteopeni, benfrakturer, sen-/ligament-/muskelrupturer, kyfos, skolios, ledplastik och andra manifestationer av AKU. De sänkta HGA-nivåerna hos nitisinonbehandlade patienter resulterade därmed i en nedsatt okronotisk process och färre kliniska manifestationer vilket stödjer en reducerad sjukdomsprogression.
Okulära händelser såsom keratopati och ögonsmärta, infektioner, huvudvärk och viktökning rapporterades med en högre incidens hos nitisinonbehandlade jämfört med obehandlade patienter. Keratopati ledde till tillfällig eller permanent utsättning hos 14 % av nitisinonbehandlade patienter men var reversibel efter utsättning av nitisinon.
Det finns inga data tillgängliga för patienter > 70 år.
5.2 Farmakokinetiska egenskaper
Formella studier av absorption, distribution, metabolism och eliminering har inte utförts med nitisinon. Efter administrering av en enkeldos nitisinonkapslar (1 mg/kg kroppsvikt) till 10 friska, manliga försökspersoner var nitisinons terminala halveringstid (medianvärde) i plasma 54 timmar (intervall från 39 till 86 timmar). En farmakokinetisk populationsanalys har utförts på en grupp med 207 HT‑1‑patienter. Clearance och halveringstid fastställdes till 0,0956 l/kg kroppsvikt/dag respektive 52,1 timmar.
Studier in vitro med användning av levermikrosomer från människa och cDNA‑uttryckta P450‑enzymer har uppvisat begränsad CYP 3A4‑medierad metabolism.
Baserat på data från en klinisk interaktionsstudie med 80 mg nitisinon vid steady‑state orsakade nitisinon en 2,3‑faldig ökning av AUC∞ för CYP 2C9‑substratet tolbutamid, vilket tyder på en måttlig hämning av CYP 2C9. Nitisinon orsakade en minskning av AUC∞ för klorzoxazon med cirka 30 %, vilket tyder på en svag induktion av CYP 2E1. Nitisinon hämmar inte CYP 2D6 eftersom AUC∞ för metoprolol inte påverkades av administrering av nitisinon. AUC∞ för furosemid ökade 1,7‑faldigt, vilket tyder på en svag hämning av OAT1/OAT3 (se avsnitt 4.4 och 4.5).
Baserat på studier in vitro väntar man sig inte att nitisinon hämmar metabolism medierad av CYP 1A2, 2C19 eller 3A4 eller inducerar CYP 1A2, 2B6 eller 3A4/5. Nitisinon förväntas inte hämma transport medierad av P‑gp, BCRP eller OCT2. Den plasmakoncentration av nitisinon som uppnås vid klinisk användning förväntas inte hämma transport medierad av OATP1B1, OATP1B3.
5.3 Prekliniska säkerhetsuppgifter
Nitisinon har uppvisat embryo fetal toxicitet hos mus och kanin vid kliniskt relevanta dosnivåer. Hos kanin framkallade nitisinon en dosrelaterad ökning av missbildningar (navelbråck och gastrochisis) vid en dos 2,5 gånger högre än den rekommenderade, maximala dosen för människa (2 mg/kg kroppsvikt/dag).
Vid en studie av pre- och postnatal utveckling av mus uppvisades statistiskt signifikant minskad överlevnad och tillväxt av avkomman under avvänjningsperioden vid exponeringsnivåer på 125 respektive 25 gånger högre än den rekommenderade, maximala dosen för människa, med en trend mot negativ effekt för avkommans överlevnad som börjar vid en dos på 5 mg/kg/dag. Hos råtta ledde exponering via mjölk till minskad medelvikt och hornhinnelesioner hos avkomman.
Ingen mutagen men svag klastogen aktivitet observerades vid studier in vitro. Inga belägg för genotoxicitet in vivo (mikrokärntest på mus och oplanerad DNA syntestest på muslever) uppvisades. Nitisinon uppvisade ingen karcinogen potential i en 26 veckor lång karcinogenicitetsstudie i genetiskt modifierade möss (TgrasH2).
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Hydroxypropylmetylcellulosa
Glycerol
Polysorbat 80
Natriumbensoat (E211)
Citronsyramonohydrat
Natriumcitrat
Jordgubbsarom (konstgjord)
Renat vatten
6.2 Inkompatibiliteter
Ej relevant.
6.3 Hållbarhet
3 år.
Efter öppnandet är stabiliteten för användning en enda period om 2 månader vid temperatur upp till 25 °C, efter vilken produkten måste kasseras.
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 ºC - 8 ºC). Får ej frysas.
Förvaras upprätt.
Förvaringsanvisningar för läkemedlet efter öppnande finns i avsnitt 6.3.
6.5 Förpackningstyp och innehåll
100 ml brun glasflaska (typ III) med ett vitt barnskyddande skruvlock av HDPE med förseglings- och manipuleringsskydd. Varje flaska innehåller 90 ml oral suspension.
Varje förpackning innehåller en LDPE flaska, en flaskadapter och tre doseringssprutor för oral användning av polypropen (PP) (1 ml, 3 ml och 5 ml).
6.6 Särskilda anvisningar för destruktion och övrig hantering
Återdispergering krävs före varje användning genom kraftig skakning. Före återdispergering kan läkemedlet se ut som en fast kaka med en något opalescent supernatant. Dosen ska dras upp och administreras omedelbart efter återdispergering. Det är viktigt att anvisningarna i för beredning och administrering följs noggrant för att säkerställa en korrekt dosering.
Tre sprutor (1 ml, 3 ml och 5 ml) tillhandahålls för att noggrant mäta upp den föreskrivna dosen. Det rekommenderas att sjukvårdspersonal informerar patienten eller vårdgivaren hur man använder sprutorna för att säkerställa att korrekt volym administreras.
Hur man förbereder en ny flaska av läkemedel för användning första gången:
Flaskan ska skakas kraftigt innan man tar den första dosen eftersom långvarig förvaring medför att partiklarna bildar en fast kaka på botten av flaskan.
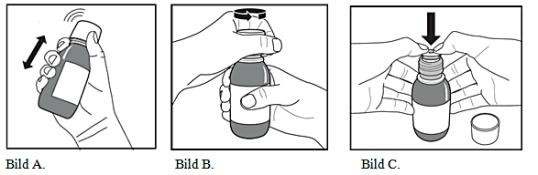
-
Flaskan ska tas ut från kylskåpet och datumet när flaskan togs ut från kylskåpet ska antecknas på flaskans etikett.
-
Flaskan ska skakas kraftigt i minst 20 sekunder tills den fasta kakan i botten på flaskan är helt dispergerad (bild A).
-
Det barnskyddande skruvlocket ska avlägsnas genom att tryckas ned ordentligt och vridas moturs (bild B).
-
Den öppna flaskan ska placeras upprätt på ett bord och plastadaptern tryckas in ordentligt i flaskhalsen så långt det går (bild C). Flaskan ska stängas med det barnskyddande skruvlocket.
För efterföljande dosering, se anvisningarna nedan: ‘Hur man förbereder en dos av läkemedel’
Hur man förbereder en dos av läkemedel
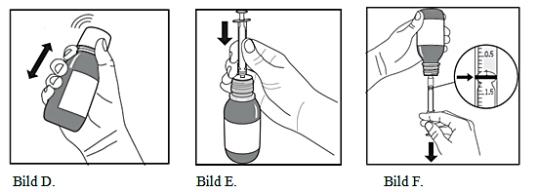
-
Flaskan ska skakas kraftigt i minst 5 sekunder (bild D).
-
Därefter ska flaskan öppnas omedelbart genom att det barnskyddande skruvlocket avlägsnas.
-
Kolven i sprutan ska tryckas ned helt.
-
Flaskan ska hållas i upprätt position och sprutan föras in ordentligt i adapterns hål överst på flaskan (bild E).
-
Flaskan ska försiktigt vändas upp och ned med sprutan på plats (bild F).
-
För att dra upp den föreskrivna dosen (ml) ska kolven dras ned långsamt tills den övre kanten av den svarta ringen är exakt i nivå med linjen som markerar dosen (bild F). Om eventuella luftbubblor observeras i den fyllda sprutan ska kolven tryckas upp tills luftbubblorna tryckts ut. Därefter ska kolven dras ned på nytt tills den övre kanten av den svarta ringen är exakt i nivå med linjen som markerar dosen.
-
Flaskan ska vändas i upprätt position på nytt och sprutan tas ut från flaskan genom att försiktigt vrida ut den ur flaskan.
-
Dosen ska administreras i munnen omedelbart (utan spädning) för att undvika att läkemedlet stelnar i sprutan. Sprutan ska tömmas långsamt för att möjliggöra sväljning. Snabb uttryckning av läkemedlet kan orsaka kvävning.
-
Det barnskyddande skruvlocket ska sättas tillbaka direkt efter användning. Flaskadaptern ska inte avlägsnas.
-
Flaskan kan förvaras i temperatur upp till 25 °C eller i kylskåp.
Rengöring
Sprutan ska rengöras omedelbart med vatten. Sprutcylindern och kolven ska separeras och båda ska sköljas med vatten. Överskott av vatten ska skakas av och den demonterade sprutan ska lämnas att torka fram till montering på nytt för nästa doseringstillfälle.
Destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Swedish Orphan Biovitrum International AB
SE-112 76 Stockholm
Sverige
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
EU/1/04/303/005
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 21 februari 2005
Förnyat godkännande: 19 januari 2010
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
13/04/2023. Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu/.




