1 LÄKEMEDLETS NAMN
SonoVue, 8 µL/mL, pulver och vätska till injektionsvätska, dispersion
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Varje mL av dispersionen innehåller 8 µL mikrobubblor av svavelhexafluorid motsvarande 45 mikrogram.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Pulver och vätska till injektionsvätska, dispersion.
Vitt pulver
Klar, färglös lösning
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Endast avsett för diagnostik.
SonoVue används vid ultraljudsundersökningar för att förstärka ekogenicitet av blodet eller av vätskan i urinvägarna vilket ger ökad kontrastverkan.
SonoVue bör endast användas när ultraljudsundersökning utan kontrastmedel inte är konklusiva.
Ekokardiografi
SonoVue är ett transpulmonellt ekokardiografiskt kontrastmedel som används hos vuxna patienter med misstänkt eller fastställd kardiovaskulär sjukdom för att ge kontrasteffekt i kamrarna och för endokarddetektion.
Makrovaskulär dopplerundersökning
SonoVue förbättrar möjligheten att upptäcka eller utesluta patologiska förändringar i hjärnans kärl, karotider eller perifera artärer hos vuxna patienter genom att förstärka signalamplituden.
SonoVue förbättrar kvaliteten på doppleranalysen och varaktigheten av kliniskt betydelsefulla signalförstärkningen vid undersökning av vena porta hos vuxna patienter.
Mikrovaskulär dopplerundersökning
SonoVue förbättrar visualiseringen av vaskulariseringen av lever-och bröstförändringar vid dopplerundersökning hos vuxna patienter, vilket medför mer specifik karakterisering.
Ultraljud av urinvägarna
SonoVue är indicerat för ultraljud av utsöndringsvägarna hos pediatriska patienter, från nyfödd till 18 år, för att detektera vesikoureteral reflux. För begränsning i tolkningen av ett negativt ultraljud av urinvägarna, se avsnitt 4.4 och 5.1.
4.2 Dosering och administreringssätt
Denna produkt skall endast användas av läkare med erfarenhet av diagnostiska ultraljudsundersökningar.
Akututrustning och personal utbildad för dess användning måste finnas tillgänglig.
Dosering
Intravenös användning
Rekommenderade doser av SonoVue hos vuxna är:
-
B-mode ekokardiografi av kamrarna i vila eller under stresstest: 2 mL.
-
Dopplerscanning av blodkärl: 2,4 mL.
Under en undersökning kan en andra injektion med den rekommenderade dosen ges om läkaren bedömer detta nödvändigt.
Äldre
Doseringsrekommendationen för intravenös administrering är densamma till äldre.
Barn
-
Säkerhet och effekt av SonoVue har ej fastställts hos patienter under 18 år för intravenös administrering eller för användning vid ekokardiografi och dopplerskanning av blodkärl.
Intravesikal användning
-
Till barn är den rekommenderade dosen SonoVue 1 mL.
Administreringssätt
Anvisningar om rekonstitution av läkemedlet före administrering finns i avsnitt 6.6.
Intravenös användning
SonoVue skall administreras omedelbart genom injicering i en perifer ven. Varje injektion skall följas av en genomspolning med 5 mL natriumkloridlösning 9 mg/mL (0,9%).
Intravesikal användning
Efter insätttning av steril 6F-8F urinkateter i urinblåsan under sterila förhållanden töms urinblåsan på urin och fylls sedan med saltlösning (vanlig steril 0,9% natriumkloridlösning) till ungefär en tredjedel eller hälften av den uppskattade totalvolymen [(ålder i år + 2) x 30] mL. Sedan administreras SonoVue genom urinkatetern. Administrering av SonoVue följs av att hela urinblåsan fylls med saltlösning tills patienten känner ett behov att urinera eller tills första tecken på baktryck av infusionen fås. Ultraljud av urinblåsan och njurarna utförs under fyllning och tömning av urinblåsan. Efter första tömningen kan urinblåsan genast återfyllas med saltlösning för en andra cykel av tömning och skanning utan ett behov av en andra SonoVue-administrering. Ett lågt mekaniskt index (≤ 0,4) rekommenderas vid skanning av urinblåsa, urinledare och njurar vid ultraljud av urinvägarna med kontrastmedel.
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
Intravenös användning av SonoVue är kontraindicerat till patienter som har höger-vänstershunt, allvarlig pulmonell hypertension (lungartärtryck >90 mmHg), okontrollerad hypertoni och till patienter med RDS.
SonoVue får inte ges i kombination med dobutamin till patienter med tillstånd som visar på kardiovaskulär instabilitet där dobutamin är kontraindicerat.
4.4 Varningar och försiktighet
Överkänslighetsreaktioner
Allvarliga överkänslighetsreaktioner har observerats under eller kort efter administrering av SonoVue hos patienter utan tidigare exponering för produkter innehållande mikrobubblor av svavelhexafluorid, inklusive patienter med tidigare överkänslighetsreaktioner för makrogol, även känt som polyetylenglykol (PEG) (se avsnitt 4.8).
SonoVue innehåller PEG (se avsnitt 6.1). Det kan finnas en ökad risk för allvarliga reaktioner hos patienter med tidigare känd överkänslighetsreaktion för PEG. Alla patienter bör hållas under noga medicinsk övervakning under och minst 30 minuter efter administrering av SonoVue, för att övervaka risken för allvarliga överkänslighetsreaktioner (se avsnitt 4.2).
Iaktta försiktighet vid behandling av anafylaxi med adrenalin hos patienter som använder beta-blockerare eftersom effekten kan bli otillräcklig eller förorsaka oönskade alfa-adrenerga och vagotoniska effekter (hypertoni, brakykardi). Intravenös användning
Patienter med instabil kardiopulmonell status
Övervakning med EKG skall göras hos högriskpatienter då kliniskt indicerat och noga medicinsk övervakning rekommenderas.
Extrem försiktighet ska vidtas vid övervägandet att administreras SonoVue till patienter med nyligen inträffat akut koronarsyndrom eller kliniskt instabil ischemisk hjärtsjukdom, inkluderande hjärtinfarkt som är pågående eller under utveckling, typisk viloangina inom de senaste 7 dagarna, påtaglig försämring av hjärtsymptom de senaste 7 dagarna, nyligen genomförd kranskärlsbehandling eller andra faktorer som indikerar klinisk instabilitet (t.ex. nyligen tillkommen försämring av EKG, laboratorie eller kliniska fynd), akut hjärtsvikt, klass III/IV hjärtsvikt, allvarliga rytmstörningar eftersom allergiliknande och/eller vasodilatatoriska reaktioner kan leda till livshotande tillstånd hos dessa patienter. SonoVue ska endast administreras till dessa patienter efter att en noggrann risk- nytta bedömning har gjorts och vitala funktioner ska noga övervakas under och efter administrering.
Det bör starkt betonas att stressekokardiografi inte bara kan efterlikna en ischemisk episod, utan också orsaka förutsägbara, dosberoende kardiovaskulära effekter (t ex ökad hjärtfrekvens, blodtryck och ventrikulär ektopisk aktivitet för dobutamin, eller minska blodtrycket för adenosin och dipyridamol) och även oförutsägbara överkänslighetsreaktioner. Därför måste patienter, om SonoVue skall användas i samband med stressekokardiografi, ha ett stabilt tillstånd vilket verifieras av frånvaro av bröstsmärta eller EKG-förändring under de två föregående dagarna. Dessutom skall EKG och blodtryck övervakas under SonoVue-förstärkt ekokardiografisk undersökning med farmakologiskt stresstest (t.ex. dobutamin).
Andra samtidiga sjukdomar
Försiktighet skall iakttas när produkten ges till patienter med akut endokardit, inopererad klaff, akut systemisk inflammation och/eller sepsis, hyperkoagulativt tillstånd och/eller nyligen diagnostiserad tromboemboli, och njur-eller leversjukdom i slutstadiet eftersom antalet patienter med dessa tillstånd som exponerades för SonoVue i de kliniska studierna var begränsade.
Tolkning av ultraljud av urinvägarna under tömning och begränsningar i dess användning
Falskt negativa fall kan uppträda vid ultraljud med SonoVue under tömning och har inte klargjorts (se avsnitt 5.1).
Teknisk rekommendation
I djurstudier avslöjade användande av kontrastmedel för ultraljud biologiska biverkningar (t.ex. skada på endotelceller, kapillärruptur) genom interaktion med ultraljudsstrålen. Även om biologiska biverkningar inte har rapporterats hos människa, rekommenderas bruket av ett lågt mekaniskt index.
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, d.v.s. är i det närmaste ”natriumfri”.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Inga interaktionsstudier har utförts.
4.6 Fertilitet, graviditet och amning
Graviditet
Data saknas från användning till gravida kvinnor. Djurstudier tyder inte på några skadliga effekter vad gäller graviditet, embryo- eller fosterutveckling, förlossning eller postnatal utveckling (se avsnitt 5.3 Prekliniska säkerhetsuppgifter).
Som en försiktighetsåtgärd, är det att föredra att undvika användning av SonoVue under graviditeten.
Amning
Det är inte känt om svavelhexafluorid passerar över i modersmjölk. Men baserat på dess snabba eliminering från kroppen via utandningsluften, anses det att amningen kan återupptas två till tre timmar efter administrering av SonoVue.
Fertilitet
Inga kliniska data finns tillgängliga. Djurstudier tyder inte på skadliga effekter på fertiliteten.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
SonoVue har ingen eller försumbar på förmågan att framföra fordon och använda maskiner.
4.8 Biverkningar
Vuxen population - Intravenös användning
Säkerheten av SonoVue efter intravenös administrering har utvärderats hos 4653 vuxna patienter som deltagit i 58 kliniska studier. De oönskade effekterna som har rapporterats med SonoVue efter intravenös administrering var generellt icke allvarliga, övergående och gick över spontant utan kvarstående effekter. I kliniska studier är de mest frekvent rapporterade biverkningarna efter intravenös administrering: huvudvärk, reaktion vid injektionsstället och illamående.
Biverkningarna klassificeras efter organsystem och frekvens, enligt följande konvention:
Mycket vanliga (≥ 1/10), Vanliga (≥ 1/100 till < 1/10), Mindre vanliga (≥ 1/1000 till < 1/100), Sällsynta (≥ 1/10000 till < 1/1000), Mycket sällsynta (< 1/10000), ingen känd frekvens (kan inte beräknas från tillgängliga data)
|
Organsystem |
Biverkningar |
||
|---|---|---|---|
|
Frekvenskategori |
|||
|
Mindre vanliga (≥1/1,000 till <1/100) |
Sällsynta (≥1/10,000 till <1/1000) |
Ingen känd frekvens Kan inte beräknas från tillgängliga data |
|
|
Immunsystemet |
Överkänslighet* | ||
|
Centrala och perifera nervsystemet |
Huvudvärk, parestesi, yrsel, smakförändringar |
Vasovagal reaktion |
|
|
Ögon |
Dimsyn | ||
|
Blodkärl |
Rodnad |
Hypotoni | |
|
Hjärta |
Hjärtinfarkt ** Myokardischemi ** Kounis syndrom*** |
||
|
Magtarmkanalen |
Illamående, Magsmärtor |
Kräkningar |
|
|
Hud och subkutan vävnad |
Utslag |
Klåda | |
|
Muskuloskeletala systemet och bindväv |
Ryggsmärtor | ||
|
Allmänna symptom och/eller symptom vid administrationsstället |
Obehag i bröstet, reaktion vid injektionsstället, värmekänsla |
Bröstsmärtor, smärta, trötthet | |
|
* Fall som tyder på överkänslighet kan vara: hudrodnad, bradykardi, hypotension, dyspné, medvetslöshet, hjärt/kardiorespiratorisktstillestånd, anafylaktisk reaktion, anafylaktisk chock. ** I vissa fall av överkänslighet, rapporterades även myokardischemi och/eller hjärtinfarkt hos patienter med underliggande koronarsjukdom. *** Allergiskt akut koronarsyndrom |
|||
I mycket sällsynta fall, har dödsfall rapporterats med tidsmässig anknytning till användningen av SonoVue. Hos alla dessa patienter fanns en hög underliggande risk för stora hjärtkomplikationer, vilka kan ha lett till dödsfallet.
Pediatrisk population- Intravesikal användning
Säkerheten av SonoVue efter intravesikal administrering är baserat på utvärderingen av publicerad litteratur med en användning av SonoVue hos över 6000 pediatriska patienter (ålder mellan 2 dagar och 18 år). Inga biverkningar var rapporterade.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Eftersom inga fall av överdosering är rapporterade har varken tecken eller symtom vid överdosering identifierats. I en fas-I studie administrerades upp till 52 ml SonoVue till friska frivilliga utan att allvarliga biverkningar rapporterades. Vid överdosering skall patienten övervakas och behandlas symtomatiskt.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Kontrastmedel för ultraljudsundersökningar,
ATC-kod V08DA05
Svavelhexafluorid är en inert, ofarlig gas som har låg vattenlöslighet. I litteraturen finns rapporter om gasens användning vid studier av andningsfysiologi och vid pneumatisk retinopexi. Tillsats av natriumkloridlösning 9 mg/mL (0,9%) till det frystorkade pulvret och den följande kraftiga omskakningen producerar mikrobubblor av svavelhexafluorid. Mikrobubblornas genomsnittliga diameter är ca 2,5 µm varav 90% har en diameter mindre än 6 µm och 99% har en diameter mindre än 11 µm. Varje milliliter av SonoVue innehåller 8 µL mikrobubblor. Reflektionsförmågan beror på mikrobubblornas koncentration och ultraljudets frekvens. Ytan mellan svavelhexafluoridbubblorna och lösningen fungerar som reflektor för ultraljudsvågen och förstärker därmed blodets ekosignaler och ökar kontrasten mellan blodet och de omgivande vävnaderna.
Intravenös användning
Vid rekommenderade doser för intravenös administrering har SonoVue visats ge en markant ökning av signalintensiteten under mer än 2 minuter vid B-mode scanning vid ekokardiografi och under 3-8 minuter vid dopplerscanning av makro- och mikrocirkulation.
Intravesikal användning
För ultraljud av urinvägarna hos pediatriska patienter efter intravesikal administrering, ökar SonoVue signalintensiteten på vätskan i urinrör, urinblåsa, urinledare och njurbäcken och underlättar detektion av reflux av vätska från urinblåsan till urinledarna.
Effekten av SonoVue för detektion/exklusion av vesikoureteral reflux studerades i två publicerade öppna singelcenterstudier. Närvaro eller frånvaro av vesikoureteral reflux med SonoVue-ultraljud jämfördes med radiografisk referensstandard. I en studie inkluderande 183 patienter (366 njur-urinledarenheter), var SonoVue-ultraljud sant positiv hos 89 av 103 enheter med reflux och sant negativ hos 226 av 263 enheter utan reflux. I den andra studien inkluderande 228 patienter (463 njururinledar enheter), var SonoVue-ultraljud sant positiv hos 57 av 71 enheter med reflux och sant negativ hos 302 av 392 enheter utan reflux.
5.2 Farmakokinetiska uppgifter
Den totala mängden svavelhexafluorid som ges vid klinisk dosering är extremt låg (i en dos på 2 mL innehåller mikrobubblorna 16 µl gas). Svavelhexafluorid löses i blodet och försvinner med utandningsluften.
Efter intravenös engångsinjektion av 0,03 eller 0,3 mL SonoVue/kg (cirka 1 respektive 10 gånger maximal klinisk dos) till försökspersoner försvann svavelhexafluoriden snabbt. Den terminala halveringstiden var i genomsnitt 12 minuter (från 2 till 33 minuter). Mer än 80% av given svavelhexafluorid återfanns i utandningsluften inom 2 minuter efter injektion och nästan 100% efter 15 minuter.
Hos patienter med diffus interstitiell lungfibros återfanns i snitt 100% av given dos i utandningsluften och den terminala halveringstiden var densamma som uppmätts hos friska försökspersoner.
5.3 Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, gentoxicitet och reproduktionseffekter visade inte några speciella risker för människa. Tarmsår som observerats i studier med upprepad dosering på råtta är inte relevanta för människa vid normal administrering.
Intravesikal lokaltolerans av SonoVue bedömdes också. En enkeldos-studie och en upprepad dosstudie som båda följdes av en behandlingsfri period genomfördes hos honråttor, där lokal toxicitet utvärderades genom makroskopisk och histopatologisk undersökning av båda njurarna, urinledare, urinblåsa och urinrör. Det påvisades inga försöksrelaterade skador i något av de undersökta organen, särskilt i urinblåsan, i varken enkeldos- eller upprepad dosstudien. Slutsatsen var därför att SonoVue
tolereras väl i urinvägarna hos råtta.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Pulver:
Makrogol 4000
Distearylfosfatidylkolin
Natriumdipalmitylfosfatidylglycerol
Palmitinsyra
Spädningsvätska:
Natriumkloridlösning 9 mg/ml (0,9%), vätska till injektionsvätska.
6.2 Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt 6.6.
6.3 Hållbarhet
2 år.
Efter rekonstitution är den kemiska och fysikaliska hållbarheten 6 timmar. Ur mikrobiologisk synpunkt skall läkemedlet användas omedelbart. Om den inte används omedelbart är förvaringstid och förvaringsförhållanden användarens ansvar.
6.4 Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt 6.3.
6.5 Förpackningstyp och innehåll
Injektionsflaska av färglöst typ I- glas innehållande 25 mg frystorkat pulver i en gas av svavelhexafluorid försluten med en grå butylgummipropp och med en veckad försegling av aluminium med flip-off-skiva. Ett överföringssystem (MiniSpike).
En förfylld spruta av klart typ I glas med 5 ml natriumkloridlösning 9 mg/ml (0,9%), vätska för injektionsvätska.
6.6 Särskilda anvisningar för destruktion och övrig hantering
Undersök produkten innan den används för att kontrollera att behållaren och förslutningen inte har skadats.
SonoVue skall färdigställas innan användning genom att injicera 5 ml natrium-kloridlösning 9 mg/ml (0,9%) till innehållet i injektionsflaskan genom gummimembranet. Injektionsflaskan skall sedan skakas kraftigt i 20 sekunder och därefter dras önskad volym av dispersionen upp i en spruta enligt följande:
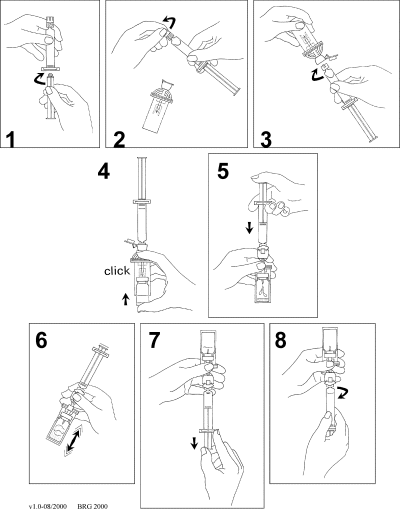
-
Koppla samman kolven med sprutan genom att skruva i den medsols.
-
Öppna MiniSpike förpackningen och ta bort förslutningen på sprutan.
-
Öppna överföringssystemets förslutning och koppla sprutan till överföringssystemet genom att vrida i den medsols.
-
Ta bort glaslocket från injektionsflaskan. Skjut in injektionsflaskan i den genomskinliga muffen på överföringssystemet och tryck fast injektionsflaskan till systemet.
-
Töm sprutans innehåll i injektionsflaskan genom att trycka på kolven.
-
Skaka kraftigt i 20 sekunder för att blanda allt innehåll i injektionsflaskan för att få en vit mjölkig homogen vätska.
-
Vänd systemet upp och ner och dra upp SonoVue försiktigt i sprutan.
-
Skruva loss sprutan från överföringssystemet.
Använd ej om den erhållna vätskan är genomskinlig och/eller fasta partiklar av det frystorkade pulvret kan ses i suspensionen.
SonoVue skall ges omedelbart genom att injiceras i en perifer ven för användning vid ekokardiografi och Dopplerskanning av blodkärl hos vuxna, eller genom intravesikal administrering vid användning för ultraljud av urinvägarna hos pediatriska patienter.
Om SonoVue inte används omedelbart efter rekonstitution skall dispersionen med mikrobubblor skakas igen innan den dras upp i en spruta. Den kemiska och fysikaliska hållbarheten för dispersionen är 6 timmar.
Injektionsflaskan är endast för engångsbruk. Läkemedel ska inte kastas i avloppet. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Bracco International B.V.
Strawinskylaan 3051
NL - 1077 ZX Amsterdam
Nederländerna
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
EU/1/01/177/002
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 26 mars 2001.
Förnyat godkännande: 24 april 2006.
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
2021-06-24
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.





