Indikationer
Oral antikonception.
Vid beslut att förskriva Estrelen ska den enskilda kvinnans riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), och risken för VTE med Estrelen jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Interaktioner och Varningar och försiktighet).
Kontraindikationer
Man ska inte använda kombinerade p-piller vid något av de tillstånd som anges nedan. Om något av tillstånden skulle uppträda för första gången medan man använder kombinerade p-piller ska man omedelbart avsluta behandlingen.
• Överkänslighet mot de aktiva substanserna eller mot något av de hjälpämnen som anges i avsnitt Innehåll.
• Förekomst av eller risk för venös tromboembolism (VTE)
o Venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på (t.ex. djup ventrombos [DVT] eller lungemboli [PE])
o Känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC resistens (inklusive Faktor V Leiden), antitrombin III brist, protein C brist, protein S brist
o Större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet)
o Hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet)
• Förekomst av eller risk för arteriell tromboembolism (ATE)
o Arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
o Cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
o Känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupus antikoagulant)
o Migrän med fokala neurologiska symtom i anamnesen
o Hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
• diabetes mellitus med vaskulära symptom
• allvarlig hypertension
• allvarlig dyslipoproteinemi
• Pågående eller tidigare allvarlig leversjukdom där levervärdena inte återgått till det normala
• Allvarlig njurinsufficiens eller akut njursvikt
• Pågående eller tidigare levertumörer (benigna eller maligna)
• Kända eller misstänkta könshormonsberoende maligniteter (t.ex. i könsorganen eller brösten)
• Odiagnostiserad vaginalblödning
Estrelen är kontraindicerat vid samtidig användning med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, eller läkemedel som innehåller glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir
(se avsnitt Interaktioner).
Dosering
Hur man tar Estrelen
Man ska ta tabletterna varje dag vid ungefär samma tid, vid behov med lite vätska, i den ordning som anges på kartan. Tabletterna ska tas kontinuerligt. Man ska ta en tablett dagligen 28 dagar i följd. Man ska påbörja nästa tablettkarta dagen efter den sista tabletten på föregående tablettkarta tagits. Bortfallsblödningen startar vanligtvis dag 2-3 efter man börjat ta placebotabletterna (sista raden) och upphör eventuellt inte innan nästa tablettkarta påbörjas.
Hur man börjar med Estrelen
• Ingen annan användning av hormonellt antikonceptionsmedel (den senaste månaden)
Kvinnan ska börja ta tabletterna den 1:a dagen i den naturliga cykeln (d.v.s. den första dagen med menstruell blödning).
• Byte från ett kombinerat hormonellt antikonceptionsmedel (kombinerade p-piller, vaginalring eller depotplåster).
Kvinnan ska helst börja med Estrelen dagen efter hon tagit den sista aktiva tabletten (den senaste tabletten innehållande aktiva substanser) på kartan med det tidigare p-pillret, men senast dagen efter det vanliga tablettfria intervallet eller placebointervallet för det tidigare p-pillret. Om man använder en vaginalring eller ett depotplåster ska man helst börja ta Estrelen samma dag denna/detta tas bort, men senast vid tidpunkten för nästa planerade applicering.
• Ändra från en metod med endast gestagen (gestagenpiller, injektion, implantat) eller från ett gestagenutsöndrande intrauterint system (IUS).
Kvinnan kan vilken dag som helst byta från ett gestagenpiller (från ett implantat eller en spiral den dagen det/den tas bort, från en spruta vid tidpunkten för nästa planerade injektion) men bör i alla dessa fall använda en kompletterande barriärmetod under de första 7 dagarna man tar tabletten.
• Efter abort under första trimestern
Kvinnan kan starta direkt, och om hon gör det behöver hon inte använda kompletterande antikonceptionsmedel.
• Efter förlossning eller abort under andra trimestern
Kvinnan bör starta mellan dag 21 och 28 efter förlossning eller abort under andra trimestern. Om hon startar senare bör hon använda en kompletterande barriärmetod under de första 7 dagarna. Om hon redan haft samlag ska graviditet uteslutas innan hon börjar använda kombinerade p-piller eller så ska kvinnan invänta sin första menstruation.
Vad gäller amning se avsnitt Amning.
Åtgärder vid missade tabletter
Man kan bortse från placebotabletterna på den sista (4:e) raden på kartan. Man ska dock slänga dem för att undvika att av misstag förlänga placebotablettfasen. Följande information gäller endast när man missat att ta aktiva tabletter:
Om man tar sin tablett mindre än 24 timmar för sent har skyddet av preventivmedlet inte minskat. Man ska ta tabletten så fort man kommer på det och fortsätta ta följande tabletter vid den tid man brukar.
Om man tar sin tablett mer än 24 timmar för sent innebär det att skyddet av preventivmedlet kan vara reducerat. Följande två grundregler gäller vid glömd tablett:
1. Det rekommenderade tablettuppehållet är 4 dagar men får aldrig överskrida 7 dagar.
2. Man måste ta tabletter utan avbrott i 7 dagar för att hypotalamus-hypofys-ovarie-axeln ska hämmas tillräckligt.
I enlighet med detta kan man ge patienten följande råd i daglig praxis:
• Dag 1-7
Man ska ta den senast glömda tabletten så fort man kommer ihåg det, även om det innebär att man tar två tabletter samtidigt. Man ska sedan fortsätta ta sina tabletter vid den tidpunkt man brukar. Vidare ska man de efterföljande 7 dagarna använda en extra barriärmetod, som t.ex. kondom. Om man haft samlag de föregående 7 dagarna ska man beakta möjligheten att man kan vara gravid. Ju fler tabletter man glömmer och ju närmre de ligger fasen med placebotabletter, desto högre är risken för graviditet.
• Dag 8-14
Man ska ta den senast glömda tabletten så fort man kommer ihåg det, även om det innebär att man tar två tabletter samtidigt. Man ska sedan fortsätta ta sina tabletter vid den tid man brukar. Om man tagit sina tabletter som man ska under de 7 dagar som föregått den glömda tabletten behöver man inte använda extra preventivmedel. Om man dock glömt att ta mer än 1 tablett bör man använda extra skydd i 7 dagar.
• Dag 15-24
Risken för reducerad tillförlitlighet är överhängande p.g.a. den kommande fasen med placebotabletter.
Genom att justera schemat för tablettintag kan man dock fortfarande undvika ett reducerat skydd av preventivmedlet. Om man tillämpar något av de två följande alternativen behöver man inte använda extra skydd, förutsatt att man tagit sina tabletter korrekt under de 7 dagarna före den första glömda tabletten. Om så inte är fallet ska man tillämpa det första av dessa två alternativ och dessutom använda extra skydd de kommande 7 dagarna.
1. Man ska ta den senaste glömda tabletten så fort man kommer ihåg det, även om det innebär att man tar två tabletter samtidigt.
Man fortsätter sedan att ta sina tabletter vid den tid man brukar, tills de aktiva tabletterna är slut. Man hoppar sedan över de 4 placebotabletterna i den sista raden. Sedan börjar man direkt på nästa blisterkarta. Det är inte troligt att man får en bortfallsblödning förrän de aktiva tabletterna på den andra blisterkartan är slut, men det kan hända att man upplever stänk- eller mellanblödningar de dagar man tar tabletter.
2. Man kan även sluta att ta de aktiva tabletterna på den aktuella blisterkartan. Man ska därefter ta placebotabletterna i den sista raden i upp till 4 dagar, inklusive de dagar man glömt ta tabletter, och därefter fortsätta med nästa blisterkarta.
Om man glömt ta tabletter och därefter inte har någon bortfallsblödning under fasen för placebotabletter, ska man beakta möjligheten för graviditet.
Råd vid gastrointestinala besvär
Allvarliga gastrointestinala besvär (t.ex. kräkningar eller diarré) kan innebära att absorptionen inte är fullständig och man bör då använda extra preventivmedel. Om man kräks inom 3-4 timmar efter man tagit en aktiv tablett ska man ta en ny (ersättande) tablett så fort som möjligt. Om möjligt ska man ta den nya tabletten inom 24 timmar efter den tid man brukar ta sin tablett. Om mer än 24 timmar förflutit gäller de anvisningar gällande missade tabletter som finns i avsnitt “Dosering”/ “Åtgärder vid missade tabletter”. Om man inte vill ändra sitt vanliga schema för tablettintag måste man ta den extra tabletten/de extra tabletterna från en annan blisterkarta.
Hur man skjuter upp en bortfallsblödning
För att skjuta upp sin menstruation fortsätter man med en ny blisterkarta Estrelen utan att ta placebotabletterna på den nuvarande blisterkartan. Man kan göra detta så länge man önskar tills de aktiva tabletterna på den andra kartan är slut. Det kan hända att man under denna period upplever stänk- eller mellanblödningar. Man tar sedan Estrelen som vanligt efter fasen med placebotabletter.
Om kvinnan önskar ändra sin menstruation till en annan veckodag än den hon är van vid på sitt nuvarande schema kan hon förkorta den kommande placebotablettfasen med så många dagar hon önskar. Ju kortare intervall desto högre är risken att man inte får någon bortfallsblödning och upplever stänk- eller mellanblödningar under efterföljande blisterkarta (på samma sätt som när man skjuter upp en menstruation).
Ytterligare information om särskilda patientgrupper
Pediatrisk population
Estrelen är endast indicerat efter menarke.
Äldre
Estrelen är inte indicerat efter menopaus.
Patienter med nedsatt leverfunktion
Estrelen är kontraindicerad hos kvinnor med allvarlig leversjukdom, se även avsnitt Kontraindikationer och Farmakodynamik.
Patienter med nedsatt njurfunktion
Estrelen är kontraindicerad hos kvinnor med kraftigt nedsatt njurfunktion eller akut njursvikt, se även avsnitt Kontraindikationer och Farmakodynamik..
Administreringssätt:
Oral användning.
Varningar och försiktighet
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Estrelen diskuteras med kvinnan.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången, ska kvinnan ta kontakt med sin läkare/barnmorska. Läkare/barnmorska ska då besluta om användningen ska avbrytas.
Vid misstänkt eller bekräftad VTE eller ATE, bör användningen av kombinerade p-piller avbrytas. Om behandling med antikoagulantia har startas bör ett adekvat alternativt preventivmedel initieras på grund av teratogenicitet av antikoagulantia (kumariner).
Cirkulationsrubbningar
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke-användning. Produkter som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Det är ännu inte känt hur hög risken är med Estrelen jämfört med dessa produkter med lägre risk. Beslutet att använda en annan produkt än den med den lägsta risken för VTE ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med kombinerade hormonella preventivmedel, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE-risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Man uppskattar1 att av 10 000 kvinnor som använder kombinerade hormonella preventivmedel innehållande drospirenon kommer mellan 9 och 12 kvinnor att utveckla en VTE under ett år; detta kan jämföras med cirka 62 kvinnor som använder kombinerade hormonella preventivmedel som innehåller levonorgestrel.
I båda fallen är antalet VTE-händelser per år färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE kan vara dödligt i 1-2 % av fallen.
Antal VTE-händelser per 10 000 kvinnor under ett år.
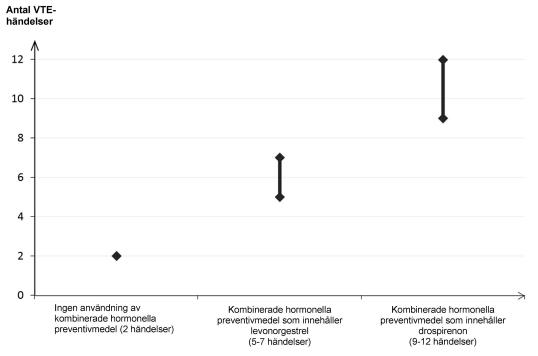
1Dessa förekomster uppskattades från samtliga epidemiologiska studiedata med hjälpav relativa risker för de olikaprodukterna jämfört med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
2Genomsnittsintervallet är på 5-7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en icke-användning på cirka 2,3 till 3,6
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Estrelen är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
|
Riskfaktor |
Kommentar |
|---|---|
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
|
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada Anm: tillfällig immobilisering inklusive flygresor >4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer |
I dessa situationer är det lämpligt att göra ett uppehåll i användningen av p pillret (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. Antitrombotisk behandling bör övervägas om Estrelen inte har satts ut i förväg. |
|
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Andra medicinska tillstånd som förknippas med VTE |
Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecell sjukdom. |
|
Stigande ålder |
Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6 veckorsperioden i puerperiet måste beaktas (för information se avsnitten ”Graviditet och amning” ).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
- unilateral svullnad av ben och/eller fot eller längs en ven i benet
- smärta eller ömhet i benet som bara känns vid stående eller gående
- ökade värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
- plötslig debut av oförklarlig andfåddhet eller snabb andning
- plötslig hosta som kan förknippas med hemoptys
- kraftig bröstsmärta
- kraftig ostadighetskänsla eller yrsel
- snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andfåddhet och hosta) är icke specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästa omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har också visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Estrelen är kontrainidcerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
|
Riskfaktor |
Kommentar |
|---|---|
|
Stigande ålder |
Framför allt hos kvinnor över 35 år |
|
Rökning |
Kvinnor över 35 år bör starkt rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
|
Hypertoni | |
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
|
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Migrän |
En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
|
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser |
Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
- plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
- plötsliga problem med att gå, yrsel, förlorad balans eller koordination
- plötslig förvirring, svårigheter att tala eller förstå
- plötsliga synproblem i ett eller båda ögonen
- plötslig, svår eller långvarig huvudvärk utan känd orsak
- medvetslöshet eller svimning med eller utan anfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
- smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
- obehag som strålar mot ryggen, käken, halsen, armen, magen
- mättnadskänsla, matsmältningsbesvär eller kvävning
- svettning, illamående, kräkningar eller yrsel
- extrem svaghet, ångest eller andfåddhet
- snabba eller oregelbundna hjärtslag.
Tumörer
En ökad risk för livmoderhalscancer hos långtidsanvändare av kombinerade p-piller (>5 år) har rapporterats i vissa epidemiologiska studier, men det finns en kontrovers kring i vilken utsträckning detta fynd kan tillskrivas en kombination av effekterna av sexuellt beteende samt andra faktorer så som det humana papillomviruset (HPV).
En metaanalys av 54 epidemiologiska studier rapporterade att det finns en lätt ökad relativ risk (RR = 1,24) för diagnosticerad bröstcancer hos kvinnor som vid tillfället använde kombinerade p-piller. Den ökade risken försvinner gradvis under 10 år efter att man slutat använda kombinerade p-piller. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år, är det ökade antalet bröstcancerdiagnoser hos kvinnor som för närvarande och nyligen använt kombinerade p-piller liten i förhållande till den allmänna risken för bröstcancer. Dessa studier gav ingen evidens för ett orsakssamband. Den observerade ökade risken kan vara relaterad till en tidigare bröstcancerdiagnos hos användare av kombinerade p-piller, biologiska effekter av kombinerade p-piller eller en kombination av dessa. Bröstcancer som diagnosticerats hos långtidsanvändare tenderar att vara mindre kliniskt framskriden än cancer som diagnosticerats hos kvinnor som aldrig använt kombinerade p-piller.
I sällsynta fall har benigna levertumörer, och i ännu mer sällsynta fall maligna levertumörer, rapporterats hos användare av kombinerade p-piller. I enskilda fall har dessa tumörer lett till livshotande intraabdominala blödningar. En levertumör ska alltid beaktas som differentialdiagnos vid svår smärta i övre delen av buken, vid leverförstoring eller vid tecken på intraabdominal blödning hos kvinnor som tar kombinerade p-piller.
Vid användning av kombinerade p-piller vid högre dos (50 µg etinylestradiol) minskar risken för endometrie- och ovarialcancer. Huruvida detta även gäller för kombinerade p-piller vid lägre dos har ännu inte bekräftats.
Andra tillstånd
Progestinet i Estrelen är en aldosteronantagonist med kaliumsparande egenskaper. I de flesta fall förväntas ingen ökning av kaliumnivåerna. En klinisk studie fann dock att att nivåerna av kalium i serum ökade lite, men inte signifikant, vid intag av drospirenon hos vissa patienter med lindrigt eller måttligt nedsatt njurfunktion som samtidigt använde kaliumsparande läkemedelsprodukter. Man rekommenderas därför att kontrollera kalium i serum vid den första behandlingscykeln vad gäller patienter som lider av njurinsufficiens och att, vad gäller det övre referensintervallet, kontrollera kalium i serum innan behandlingen inleds, i synnerhet vid samtidig användning av kaliumsparande läkemedels. Se även avsnitt Interaktioner.
Kvinnor med hypertriglyceridemi, eller en familjehistoria av hypertriglyceridemia, kan löpa en ökad risk för pankreatit vid användning av kombinerade p-piller.
Även om små blodtrycksförhöjningar har rapporterats hos många kvinnor som tar kombinerade p-piller är kliniskt relevanta förhöjningar sällsynta. Endast i dessa sällsynta fall finns det fog för en omedelbar utsättning av det kombinerade p-pillret. Om man redan lider av hypertension och använder kombinerade p-piller, och konstanta förhöjda blodtrycksvärden eller en signifikant blodtrycksförhöjning inte kan åtgärdas på lämpligt sätt med antihypertensiv behandling, ska man sätta ut det kombinerade p-pillret. När det anses lämpligt kan kombinerade p-piller återinsättas, om normotensiva värden kan erhållas med antihypertensiv behandling.
Följande tillstånd har rapporterats förekomma eller försämras i samband med både graviditet och användning av kombinerade p-piller, men evidensen för en koppling till kombinerade p-piller är inte definitiv: ikterus och/eller prurit relaterad till kolestas; gallstenar; porfyri, systemisk lupus erythematosus; hemolytiskt uremiskt syndrom; Sydenhams korea; herpes gestationis; otosklerosrelaterad hörselnedsättning.
Exogena östrogener kan framkalla eller förvärra symtom av ärftligt och förvärvat angioödem.
Akut eller kronisk störning av leverfunktionen kan kräva att man upphör med kombinerade p-piller tills levervärdena återgår till det normala. Upprepad förekomst av kolestatisk ikterus och/eller kolestasrelaterad prurit som tidigare förekommit vid graviditet eller vid tidigare användning av könshormoner kräver en utsättning av kombinerade p-piller.
Även om kombinerade p-piller kan ha en effekt på den perifera insulinresistensen och glukostoleransen finns det ingen evidens för ett behov av ändrad diabetesbehandling vid användning av kombinerade p-piller vid låg dos (innehållande < 0,05 mg etinylestradiol). Kvinnor med diabetes ska dock noga observeras, särskilt i de tidiga stadierna av användning av kombinerade p-piller.
Förvärrande av epilepsi, Crohns sjukdom och ulcerös kolit har rapporterats i samband med användning av kombinerade p-piller.
Kloasma kan förekomma i vissa fall, i synnerhet hos kvinnor med chloasma gravidarum i anamnesen. Kvinnor som har en tendens till kloasma ska undvika exponering för solen eller ultraviolett strålning när de tar kombinerade p-piller.
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Läkarundersökning/konsultation
Innan användning av Estrelen påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserad på kontraindikationerna (se avsnitt Kontraindikationer) och varningar (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Estrelen jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Reducerad effekt
Effekten av kombinerade p-piller kan reduceras vid t.ex. missade aktiva tabletter (se avsnitt Dosering), gastrointestinala besvär vid intag av aktiva tabletter (se avsnitt Dosering) eller samtidig medicinering (se avsnitt Interaktioner).
Reducerad cykelkontroll
För alla kombinerade p-piller gäller att oregelbundna blödningar (stänk- eller mellanblödningar) kan förekomma, särskilt under de första månaderna av användning. Därför är en bedömning av oregelbundna blödningar endast meningsfull efter ett anpassningsintervall på cirka tre cykler.
Om oregelbundna blödningar kvarstår eller uppstår efter tidigare regelbundna cykler ska icke-hormonella orsaker beaktas och lämpliga diagnostiska åtgärder vidtas för att utesluta malignitet eller graviditet. Dessa kan omfatta skrapning.
Vissa kvinnor har ingen bortfallsblödning under fasen med placebotabletter. Om kombinerade p-piller använts i enlighet med de anvisningar som beskrivs i avsnitt Dosering är det inte troligt att kvinnan är gravid. Om det kombinerade p-pillret dock inte använts i enlighet med dessa anvisningar innan den första uteblivna bortfallsblödningen eller om två bortfallsblödningar uteblivit måste man utesluta graviditet innan behandlingen med kombinerade p-piller fortsätts.
Estrelen innehåller laktos och natrium
Varje rosa tablett av detta läkemedel innehåller 44 mg laktosmonohydrat per tablett, varje vit tablett innehåller 89,5 mg laktosanhydrat.
Patienter med sällsynta hereditära problem med galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption ska inte ta detta läkemedel.
Det här läkemedlet innehåller mindre än 1 mmol natrium (23 mg) per tablett, d v s är näst intill ”natriumfritt”.
Interaktioner
OBS: Förskrivningsinformation om samtidiga läkemedel ska konsulteras i syfte att identifiera möjliga interaktioner.
• Andra läkemedels påverkan på Estrelen.
Interaktion kan förekomma med läkemedel som inducerar mikrosomala enzymer vilket kan leda till bortfallsblödning och/eller utebliven preventiv effekt.
Hantering
Enzyminducering kan observeras redan efter några dagars behandling. Maximal enzyminduktion ses vanligtvis inom några veckor. Efter avslutad behandling kan enzyminduktionen upprätthållas under ca 4 veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel bör temporärt använda en barriärmetod eller annan preventivmetod i tillägg till kombinerade p-piller. Barriärmetoden måste användas under hela tiden för samtidig läkemedelsbehandling och 28 dagar efter avslutad behandling. Om läkemedelsbehandling löper längre än till slutet av tabletterna i p-pillerkarta, ska nästa p-pillerkarta påbörjas direkt efter den föregående utan tablettfritt intervall.
Långtidsbehandling
Hos kvinnor som står på långtidsbehandling med leverenzyminducerande aktiva substanser rekommenderas en annan pålitlig icke-hormonell preventivmetod.
Följande interaktioner har rapporterats i litteraturen.
Substanser som ökar clearance av kombinerade p-piller (minskad effekt av kombinerade p-piller genom enzyminduktion), exempelvis:
Barbiturater, bosentan, karbamazepin, fenytoin, primidon, rifampicin, och HIV-läkemedlen ritonavir, nevirapin och efavirenz och eventuellt även felbamat, griseofulvin, oxkarbazepin, topiramat och produkter som innehåller naturläkemedlet Johannesört (hypericum perforatum).
Ämnen med varierande effekt på clearance av kombinerade p-piller:
Vid samtidig administrering med kombinerade p-piller kan många kombinationer av HIV-proteashämmare och icke-nukleosid omvänt transkriptas-hämmare, inklusive kombinationer med HCV-hämmare, öka eller minska plasmakoncentrationen av östrogen eller progesteron. Nettoeffekten av dessa förändringar kan vara kliniskt relevant i vissa fall.
Därför bör produktinformationen för samtidiga HIV/HCV läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella tillhörande rekommendationer. I tveksamma fall bör ytterligare barriärmetod användas av kvinnor som behandlas med proteashämmare eller icke-nukleosid omvänt transkriptas-hämmare
Substanser som minskar clearance av kombinerade p-piller (enzymhämmare):
Den kliniska relevansen av potentiella interaktioner med enzymhämmare är fortfarande okänd.
Samtidig administrering av starka CYP3A4-hämmare kan öka plasmakoncentrationerna av östrogenet eller gestagenet eller båda.
En multipel dosstudie med drospirenon (3 mg / dag) / etinylestradiol (0,02 mg / dag) visar att samtidig administrering av den starka CYP3A4-hämmaren ketokonazol i 10 dagar ökar AUC (0-24 h) av drospirenon och etinylestradiol 2,7 gånger respektive 1,4 gånger.
När doser med etoricoxib 60-120 mg/dag tas samtidigt med ett kombinationspreparat som innehåller 35 mikrogram etinylestradiol ökar plasmakoncentrationen av etinylestradiol 1,4-1,6 gånger.
• Estrelens påverkan på andra läkemedel
Orala kontraceptionsmedel kan påverka metabolismen för vissa andra aktiva substanser. Därmed kan plasma- och vävnadskoncentrationer öka (t.ex. ciclosporin) eller minska (t.ex. lamotrigin).
Baserat på in vivo-interaktionsstudier på kvinnliga frivilliga försökspersoner som använder omeprazol, simvastatin eller midazolam som markörsubstrat är en kliniskt relevant interaktion av drospirenon vid doser på 3 mg med cytokrom P-450 medierad metabolism hos andra aktiva substanser osannolik.
Kliniska data tyder på att etinylestradiol inhiberar clearance av CYP1A2 substrat som leder till en svag (t ex teofyllin) eller måttlig (t.ex. tizanidin) ökning av deras plasmakoncentration.
• Övriga interaktioner
Hos patienter med njurinsufficiens visade en samtidig användning av drospirenon och ACE-hämmare eller NSAID ingen betydande effekt på kalium i serum. Dock har kombinerad användning av Estrelen och aldosteronantagonister eller kaliumsparande diuretika inte undersökts. I detta fall ska kalium i serum kontrolleras under den första behandlingscykeln. Se även avsnitt Varningar och försiktighet.
• Laboratorietester
Användningen av hormonell kontraception kan påverka resultat av vissa laboratorietester, inklusive biokemiska parametrar för lever, tyroidea, binjure- och njurfunktion, plasmanivåer av protein (transportör), t.ex. kortikosteroidbindande globulin och lipid/lipoproteinfraktioner, parametrar för karbohydratmetabolism och parametrar för koagulation och fibrinolys. Förändringarna är vanligtvis inom normala laboratorieintervaller. Drospirenon orsakar en ökning av aktiviteten hos plasmarenin och plasmaaldosteron inducerad av dess lindriga antimineralkortikoida aktivitet.
• Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt Kontraindikationer).Därför måste användare av Estrelen byta till en alternativ preventivmetod (t.ex. preventivmedel med enbart gestagen eller icke-hormonella metoder) innan behandlingen med denna läkemedelskombination påbörjas. Estrelen kan påbörjas igen 2 veckor efter avslutad behandling med denna läkemedelskombination.
Graviditet
Estrelen är kontraindicerat under graviditet.
Om graviditet inträffar vid bruk av Estrelen ska preparatet omedelbart sättas ut. Omfattande epidemiologiska studier har inte visat en ökad risk för medfödda missbildningar hos barn till kvinnor som använt kombinerade p-piller innan graviditeten och inte heller en teratogen effekt när kombinerat p-piller tagits av misstag under graviditeten.
Djurförsök har visat oönskade effekter vid graviditet och laktation (se avsnitt Prekliniska uppgifter). Baserat på dessa data från djurstudier kan oönskade effekter till följd av de aktiva substansernas hormonella verkan inte uteslutas. Den allmänna erfarenheten av kombinerade p-piller vid graviditet har dock inte givit någon evidens för en faktisk skadlig effekt hos människa.
Tillgängliga data kring användning av Estrelen vid graviditet är för begränsade för att medge slutsatser om negativa effekter av Estrelen på graviditet eller hälsan hos fostret eller den nyfödda. För närvarande finns inga relevanta epidemiologiska data tillgängliga.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Estrelen (se avsnitt Dosering och Varningar och försiktighet).
Amning
Laktationen kan påverkas av kombinerade p-piller eftersom de kan minska mängden och förändra sammansättningen av bröstmjölk. Därför ska man i allmänhet inte rekommendera bruk av kombinerade p-piller innan mamman helt slutat amma sitt barn. Små mängder av kontraceptionsmedlets hormoner och/eller metaboliter utsöndras till bröstmjölken vid användning av kombinerade p-piller. Denna mängd kan påverka barnet.
Fertilitet
Estrelen är indicerat för att förhindra graviditet. För information om hur man återfår sin fertilitet, se avsnitt Farmakodynamik.
Trafik
Inga studier har gjorts på förmågan att framföra fordon och använda maskiner. Ingen inverkan på förmågan att framföra fordon och använda maskiner har observerats hos användare av kombinerade p-piller.
Biverkningar
För allvarliga biverkningar hos användare av kombinerade p-piller, se avsnitt Varningar och försiktighet.
Följande biverkningar har rapporterats vid användning av Estrelen.
Tabellen nedan anger biverkningar enligt MedDRA:s klassificering av organsystem (MedDRA SOCs). Förekomsten baseras på kliniska försöksdata. Den mest lämpliga MedDRA-benämningen används för att beskriva en viss reaktion och dess synonymer och relaterade tillstånd.
Biverkningar som kopplats till användning av Estrelen som oral kontraception eller vid behandling av måttlig acne vulgaris i enlighet med MedDRA:s klassificering av organsystem och MedDRA:s terminologi.
|
Klassificering av organsystem (MedDRA version 9.1 ) |
Vanliga (≥1/100, <1/10) |
Mindre vanliga (≥1/1 000, <1/100) |
Sällsynta (≥1/10 000, <1/1 000) |
ingen känd frekvens (kan inte beräknas från tillgängliga data) |
|---|---|---|---|---|
|
Infektioner och infestationer |
Candidiasis | |||
|
Blodet och lymfsystemet |
Anemi Trombocytemi | |||
|
Immunsystemet |
Allergisk reaktion |
Hypersensitivity Förvärrade symtom av ärftligt eller förvärvat angioödem. |
||
|
Endokrina systemet |
Endokrin sjukdom | |||
|
Metabolism och nutrition |
Ökad aptit Anorexia Hyperkalemi Hyponatremi | |||
|
Psykiska störningar |
Emotionell labilitet |
Depression Oro Somnolens |
Anorgasmi Sömnlöshet | |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Yrsel Parestesi |
Vertigo Tremor | |
|
Ögon |
Konjunktivit Torra ögon Ögonsjukdom | |||
|
Hjärtat |
Takykardi | |||
|
Blodkärl |
Migrän Åderbråck Hypertension |
Flebit Vaskulär sjukdom Epistaxis Syncope Arteriell eller venös tromboembolism | ||
|
Magtarmkanalen |
Illamående |
Buksmärta kräkningar Dyspepsi Flatulens Gastrit Diarré |
Förstorad buk Gastrointestinal sjukdom Gastrointestinal fyllnadskänsla Hiatus hernia Oral candidiasis Konstipation Torr mun | |
|
Lever och gallvägar |
Smärta i gallblåsan Kolecystit | |||
|
Hud och subkutan vävnad |
Acne Prurit Utslag |
Chloasma Eksem Alopeci Dermatitis acneiform Torr hud Erythema nodosum Hypertrichos Hudsjukdom Sträckmärken Kontaktdermatit Fotosensitiv dermatit Hudknutor |
Erythema multiforme |
|
|
Muskuloskeletala systemet och bindväv |
Ryggvärk Värk i extremiteter Muskelkramper | |||
|
Reproduktionsorgan och bröstkörtel |
Bröstsmärta Metrorrhagia* Amenorrhea |
Vaginal candidiasis Smärta i bäcken Bröstförstoring Fibrocystiska bröst Uterin/vaginal blödning* Flytningar från könsorgan Värmevallningar Vaginit Menstruella störningar Dysmenorrhoea Hypomenorrhea Menorrhagia Vaginal torrhet Papanicolaou-test, misstänkt Nedsatt libido |
Dyspareuni Vulvovaginit Postkoital blödning Bortfallsblödning Bröstcysta Brösthyperplasi Bröstneoplasm Cervikal polyp Endometrieatrofi Ovariecysta Livmoderförstoring | |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Asteni Ökade svettningar Ödem (allmänt ödem, perifert ödem, ansiktsödem) |
Allmän sjukdomskänsla | ||
|
Undersökningar |
Viktökning |
Viktnedgång |
* oregelbundna blödningar försvinner oftast vid fortsatt behandling
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Följande allvarliga biverkningar har rapporterats hos kvinnor som använder kombinerade p-piller, vilka diskuteras i avsnitt Varningar och försiktighet:
• Venös tromboembolism;
• Arteriell tromboembolism;
• Hypertension;
• Levertumörer;
• Förekomst av eller förvärrande av tillstånd för vilka koppling till kombinerade p-piller inte klarlagts: Crohns sjukdom, ulcerös kolit, epilepsi, uterint myom, porfyri, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom; Sydenhams korea; herpes gestationis; kolestatisk ikterus.
• Chloasma;
• Akut eller kronisk störning av leverfunktionen kan kräva att man upphör med kombinerade p-piller tills levervärdena återgår till det normala.
Frekvensen av diagnosticerad bröstcancer ökar väldigt lätt hos användare av oral kontraception. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år, är det ökade antalet litet i förhållande till den allmänna risken för bröstcancer. Orsakssamband med kombinerade p-piller är okänt. För mer information se avsnitt Kontraindikationer och Varningar och försiktighet.
Interaktioner
Genombrottsblödningar och/eller utebliven preventiv effekt kan bli följden av interaktioner med andra läkemedel (enzyminducerare) och p-piller (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Ingen erfarenhet av överdos av Estrelen finns. Baserat på allmän erfarenhet av kombinerade p-piller är de symptom som kan förekomma vid en överdos av aktiva tabletter: illamående, kräkningar samt bortfallsblödningar Bortfallsblödning kan även ske hos flickor före den första menstruationen, om de av misstag tagit läkemedlet. Det finns ingen antidot och vidare behandling ska vara symptomatisk.
Farmakodynamik
Pearl Index metodfel: 0,41 (övre gräns 95 % konfidensintervall: 0.85).
Allmänt Pearl Index (metodfel + användarfel): 0,80 (övre gräns 95% konfidensintervall: 1.30).
Verkningsmekanism
Den preventiva effekten av Estrelen är baserad på interaktioner mellan olika faktorer, av vilka de viktigaste är ovulationshämning och förändringar i endometriet.
Farmakodynamiska effekter
I en 3-cyklisk studie av hämning av ägglossning vilken jämförde drospirenon 3 mg/etinylöstradiol 0,020 mg i en 24-dagars-regim och en 21-dagars-regim, visade 24-dagars-regimen en större hämning av follikelutveckling. Efter avsiktligt doseringsfel under det tredje behandlingscykel, visade en större andel kvinnor i 21-dagars-regimen aktivitet i äggstockarna inklusive ägglossning jämfört med kvinnor som använder 24-dagars-regimen Äggstocksaktiviteten återvände till nivåerna före behandlingen under efterbehandlingscykeln i 91,8% av kvinnorna som tog 24-dagars behandling.
Klinisk effekt och säkerhet
Estrelen är ett kombinerade p-piller med etinylestradiol och progestagenet drospirenon. Vid terapeutisk dosering har drospirenon även antiandrogena och lindriga antimineralkortikoida egenskaper. Det har ingen estrogen, glukokortikoid och antiglukokortikoid aktivitet. Detta ger drospirenon en farmakologisk profil som nära liknar det naturliga hormonet progesteron.
Det finns indikationer från kliniska studier att de lindriga antimineralkortikoida egenskaperna hos Estrelen ger en lindrig antimineralkortikoid effekt.
Två multicenter, dubbelblinda, randomiserade studier med placebo utfördes för att utvärdera effekten av och säkerhet hos Estrelen bland kvinnor med måttlig acne vulgaris.
Efter 6 månaders behandling, i jämförelse med placebo, visade etinylöstradiol/drospirenon en statistiskt signifikant ökad reducering på 15,6 % (49,3 % jämfört med 33,7 %) vad gäller inflammatoriska skador, 18,5 % (40,6 % jämfört med 22,1 %) vad gäller icke inflammatoriska skador och 16,5 % (44,6 % jämfört med 28,1 %) vad gäller totalt antal skador. Vidare hamnade en högre andel undersökningsobjekt, 11,8 % (18,6 % jämfört med 6,8 %) vid ‘clear’ eller ‘almost clear’ på undersökningsorganets skala enligt Static Global Assessment (ISGA).
Farmakokinetik
Drospirenon
Absorption
Drospirenon som administreras oralt absorberas snabbt och nästan fullständigt. Maximala serumkoncentrationer av den aktiva substansen på cirka 38 ng/ml uppnås cirka 1-2 timmar efter enkelt intag. Biotillgängligheten är mellan 76 och 85 %. Samtidig förtäring av mat har ingen inverkan på biotillgängligheten hos drospirenon.
Distribution
Efter oral administrering ökar nivåerna av drospirenon i serum med en terminal halveringstid på 31 timmar.
Drospirenon binds till serumalbumin och binds inte till könshormonbindande globulin (SHBG) eller kortikoidbindande globulin (CBG). Endast 3 - 5 % av totala serumkoncentrationer av den aktiva substansen återfinns i fri form. Den etinylestradiol-inducerade ökningen av SHBG påverkar inte bindandet av serumprotein hos drospirenon. Genomsnittlig förmodad distributionsvolym för drospirenon är 3,7 ± 1,2 l/kg.
Metabolism
Drospirenon metaboliseras nästan fullständigt efter oral administrering. De stora metaboliterna i plasma är drospirenon i syreform, som bildas av att laktonringen öppnas, och 4,5-dihydro-drospirenon-3-sulfat, bildad genom reduktion och efterföljande sulfatisering. Drospirenon kan också genomgå oxidativ metabolism katalyserad av CYP3A4
Drospirenon är in vitro kapabel att hämma cytokrom P450 enzymerna CYP1A1, CYP2C9, CYP2C19 och CYP3A4 svagt till måttligt.
Eliminering
Den metaboliska elimineringsgraden för drospirenon i serum är 1,5 ± 0,2 ml/min/kg. Drospirenon utsöndras endast i spårmängder i oförändrad form. Metaboliterna i drospirenon utsöndras med faeces och urin vid en utsöndringsgrad på cirka 1,2 till 1,4. Halveringstiden för utsöndring av metaboliter med urin och faeces är cirka 40h.
Steady-state förhållanden
Vid en behandlingscykel nås maximala steady-state-koncentrationer av drospirenon i serum på cirka 70 ng/ml efter cirka 8 dagars behandling. Nivåer av drospirenon i serum ackumuleras med en faktor på cirka 3 till följd av förhållandet mellan terminal halveringstid och doseringsintervall.
Specifika populationer
Effekt av nedsatt njurfunktion
Nivåer av steady-state drospirenon i serum hos kvinnor med lindrigt nedsatt njurfunktion (kreatinineliminering CLcr, 50-80 mL/min) kunde jämföras med de hos kvinnor med normal njurfunktion. Nivåerna av drospirenon i serum var i genomsnitt 37 % högre hos kvinnor med måttligt nedsatt njurfunktion (CLcr, 30-50 mL/min) jämfört med de hos kvinnor med normal njurfunktion. Drospirenonbehandling tolererades bra av kvinnor med lindrigt och måttligt nedsatt njurfunktion. Drospirenonbehandling visade inga kliniskt signifikanta effekter på koncentrationen kalium i serum.
Effekt av nedsatt leverfunktion
Vid en endosstudie minskade oral eliminering (CL/F) med cirka 50 % hos frivilliga med måttligt nedsatt leverfunktion jämfört med de med normal leverfunktion. Den observerade minskningen i drospirenoneliminering hos frivilliga med måttligt nedsatt leverfunktion innebar inte en uppenbar skillnad vad gäller serumkoncentrationer kalium. Inte heller vid diabetes och samtidig behandling med spironolakton (två faktorer som kan göra en patient benägen för hyperkalemi) observerades koncentrationer kalium i serum över den övre gränsen för normalt intervall. Man kan dra slutsatsen att drospirenon tolereras väl av patienter med lindrigt eller måttligt nedsatt leverfunktion (Child-Pugh B).
Etniska grupper
Inga kliniskt relevanta skillnader vad gäller farmakokinetiken hos drospirenon eller etinylestradiol har observerats hos japanska och västerländska kvinnor.
Ethinylestradiol
Absorption
Etinylestradiol som administreras oralt absorberas snabbt och fullständigt. Maximala serumkoncentrationer på cirka 33 pg/ml uppnås cirka 1-2 timmar efter enkelt intag. Absolut biotillgänglighet som en följd av presystemisk konjugering och första-passage-metabolism är cirka 60 %. Samtidigt födointag minskar biotillgängligheten av etinylestradiol med cirka 25 % hos undersökningsobjekten medan ingen förändring alls observerades hos resten.
Distribution
Nivåerna av etinylestradiol i serum minskar i två faser, den slutliga eliminationsfasen karakteriseras av en halveringstid på cirka 24 timmar. Etinylestradiol binds i hög grad men ospecifikt till serumalbumin (cirka 98,5 %), och inducerar en ökning av serumkoncentrationerna könshormonbindande globulin (SHBG) och kortikoidbindande globulin (CBG). En distributionsvolym på cirka 5 l/kg kunde fastställas.
Metabolism
Etinylestradiol genomgår en betydande första passage metabolism i mag-tarmkanalen och i levern. Etinylestradiol metaboliseras primärt genom aromatisk hydroxylering, men ett stort antal olika hydroxylerade och metylerade metaboliter bildas, och dessa finns närvarande som fria metaboliter och som konjugationer med glukoronider och sulfat. Metabolisk elimineringshastighet för etinylestradiol är cirka 5 ml/min/kg.
Etinylestradiol är in vitro en reversibel hämmare av CYP2C19, CYP1A1 och CYP1A2 samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Eliminering
Inget oförändrat etinylestradiol utsöndras. Metaboliterna av etinylestradiol utsöndras via urin och galla med en kvot på 4:6. Halveringstiden för utsöndringen av metaboliterna är cirka 1 dag.
Steady-state förhållanden
Förhållanden för steady-state uppnås vid den andra halvan av en behandlingscykel och serumnivåerna av etinylestradiol ackumuleras vid en faktor på cirka 2,0 till 2,3.
Prekliniska uppgifter
Hos försöksdjur begränsades effekterna av drospirenon och etinylestradiol till de som var förbundna med vedertagna farmakologiska metoder. I synnerhet avslöjade studier kring reproduktionstoxicitet embryotoxiska och fetotoxiska effekter hos djur som anses vara rasspecifika. Vid exponeringsnivåer över de för användare av Estrelen observerades effekter på sexuell differentiering hos råttfoster men inte hos apfoster. Miljöriskbedömningsstudier har visat att etinylestradiol och drospirenon kan utgöra en risk för vattenmiljön (se avsnitt Hållbarhet, förvaring och hantering).
Innehåll
24 rosa filmdragerade tabletter (aktiva tabletter):
Varje filmdragerad tablett innehåller 0,02 mg etinylestradiol och 3 mg drospirenon.
Hjälpämne(n) med känd effekt: Varje filmdragerad tablett innehåller 44 mg laktosmonohydrat
4 vita filmdragerade placebotabletter (inaktiva):
Denna tablett innehåller inte några aktiva substanser
Hjälpämne(n) med känd effekt: Varje filmdragerad tablett innehåller 89,5 mg laktos, vattenfri
Aktiva filmdragerade tabletter (rosa):
• Tablettens kärna:
o Laktosmonohydrat
o Pregelatiniserad stärkelse (majs)
o Povidon K-30 (E1201)
o Kroskarmellosnatrium
o Polysorbat 80
o Magnesiumstearat (E572)
• Tablettens filmdragering:
o Polyvinylalkohol delvis hydrolyserad
o Titaniumdioxid (E171)
o Macrogol 3350
o Talk
o Järnoxidgult (E172)
o Järnoxidröd (E172)
o Järnoxidsvart (E172)
Placebo filmdragerade tabletter (vita):
• Tablettens kärna:
o Laktos, vattenfri
o Povidon (E1201)
o Magnesiumstearat (E572)
• Tablettens filmdragering:
o Polyvinylalkohol
o Titaniumdioxid (E171)
o Macrogol 3350
o Talk
Hållbarhet, förvaring och hantering
3 år
Inga särskilda förvaringsanvisningar.
Detta läkemedel kan utgöra en risk för miljön (se avsnitt Prekliniska uppgifter). Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.




