1 LÄKEMEDLETS NAMN
Amorest 28 250 mikrogram/35 mikrogram, tabletter
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Den blåa tabletten innehåller norgestimat 250 mikrogram och etinylestradiol 35 mikrogram.
Hjälpämne med känd effekt: Laktos 4 mg.
Den ljusgröna tabletten innehåller inga verksamma ämnen.
Hjälpämne med känd effekt: Laktos 82 mg.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Tablett
Aktiv tablett: rund, 6,4 mm i diameter, blå tablett: präglad ’146’ på en sida.
Placebotablett: rund, 6,4 mm i diameter, ljusgrön tablett: präglad ’475’ på en sida.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Antikonception för kvinnor.
Vid beslut att förskriva Amorest 28 ska den enskilda kvinnans riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), och risken för VTE med Amorest 28 jämfört med andra kombinerade hormonella preventivmedel (se avsnitt 4.3 och 4.4).
4.2 Dosering och administreringssätt
Dosering
Första behandlingscykeln
En blå tablett dagligen från 1:a dagen t.o.m. 21:a dagen av cykeln. En ljusgrön tablett dagligen från 22:a dagen till och med 28:e dagen. Tabletterna bör tas vid ungefär samma tidpunkt varje dag, exempelvis på kvällen.
Fortsatt behandling
Två till fyra dagar efter den sista blå tabletten inträder vanligen en menstruationsliknande blödning. Oavsett om blödning inträffat eller ej påbörjas en ny 28-dagarsbehandling efter den sista ljusgröna tabletten i föregående cykel.
Uppskjutande av menstruation
När kartans första 21 tabletter har tagits, utelämnas de 7 ljusgröna tabletterna och en ny tablettkarta påbörjas, utan något uppehåll, under så många dagar som behövs. Därefter tas 7 ljusgröna tabletter under 7 dagar, följt av en ny karta med 28 tabletter med nytt startdatum.
Glömd tablett
Om mindre än 12 timmar gått sedan tabletten skulle ha tagits påverkas inte den kontraceptiva effekten. Tabletten bör tas så snart misstaget upptäckts, och nästa tablett tas sedan vid ordinarie tid.
Om mer än 12 timmar har gått sedan tabletten skulle ha tagits kan den kontraceptiva effekten vara nedsatt. Följande två grundregler gäller vid glömd tablett:
-
Tablettuppehållet (med blå tabletter) får aldrig överskrida 7 dagar.
-
7 dagar med oavbrutet tablettintag krävs (blå tabletter) för att uppnå tillräcklig hämning av hypotalamus-hypofys-ovarie-axeln.
I enlighet med detta kan följande råd användas i daglig praxis:
-
Vecka 1 (blå tabletter)
Den senaste glömda tabletten skall tas så snart kvinnan kommer ihåg det, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna vid ordinarie tidpunkt. Dessutom skall en barriärmetod, t.ex. kondom, användas under de följande 7 dagarna. Om samlag ägt rum under de föregående 7 dagarna bör möjligheten av en graviditet övervägas. Ju fler glömda tabletter och ju närmare placebotabletterna (ljusgröna tabletter), desto större är risken för graviditet.
-
Vecka 2 (blå tabletter)
Den senaste glömda tabletten skall tas så snart kvinnan kommer ihåg det, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna vid ordinarie tidpunkt. Förutsatt att tabletterna tagits vid korrekt tidpunkt under de föregående 7 dagarna behövs ingen extra preventivmetod. Om så inte är fallet, eller om mer än en tablett glömts, bör kompletterande skydd användas under de följande 7 dagarna.
-
Vecka 3 (blå tabletter)
Risken för minskad skyddseffekt är överhängande med tanke de kommande placebotabletterna. Genom att justera schemat för tablettintaget kan emellertid nedsatt skyddseffekt förhindras. Följer man något av följande två alternativ behövs därför inget kompletterande skydd, förutsatt att tabletterna tagits vid rätt tidpunkt under de 7 dagarna innan den första glömda tabletten. Om så inte är fallet, bör det första alternativet följas, och kompletterande skydd bör dessutom användas under de följande 7 dagarna.
-
Den senaste glömda tabletten skall tas så snart kvinnan kommer ihåg det, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna vid ordinarie tidpunkt. Nästa tablettkarta påbörjas så snart de blå tabletterna i den pågående kartan tagit slut, d.v.s. inga ljusgröna tabletter ska tas. Kvinnan kommer sannolikt inte att få någon bortfallsblödning förrän under perioden med ljusgröna tabletter i den andra tablettkartan, men stänkblödning eller genombrottsblödning kan uppträda under de dagar då blå tabletter tas.
-
Kvinnan kan också rådas att avsluta intaget av blå tabletter från den pågående tablettkartan, och omedelbart fortsätta med de ljusgröna tabletterna. Det totala antalet missade blå tabletter och ljusgröna tabletter får aldrig överstiga 7 dagar. Därefter påbörjas nästa karta.
-
Vecka 4 (ljusgröna tabletter)
Den kontraceptiva effekten är inte nedsatt. Följande tabletter skall tas vid ordinarie tidpunkt.
Vid glömda tabletter och utebliven bortfallsblödning under den första normala perioden med placebotabletter därefter, skall möjligheten av en graviditet övervägas.
Genombrottsblödning
Om genombrottsblödning eller stänkblödning uppträder skall behandlingen fortsätta. Denna typ av blödning upphör normalt efter den tredje cykeln. Om genombrottsblödningen fortsätter att uppträda bör läkare/barnmorska konsulteras.
Byte från annat hormonellt antikonceptionsmedel (t.ex. depotplåster, vaginalring, injektionspreparat etc.)
Vid byte från ett annat kombinerat peroralt antikonceptionsmedel påbörjas lämpligen behandling med Amorest 28 första dagen efter den sista aktiva tabletten i den tidigare behandlingen, men senast på första dagen efter den gängse 7-dagarsperioden utan tablett eller med placebotabletter.
Vid byte från ett peroralt antikonceptionsmedel innehållande endast gestagen skall behandlingen med Amorest 28 påbörjas dagen efter den sista aktiva tabletten i den tidigare behandlingen.
För byte från annan form av hormonellt antikonceptionsmedel (t.ex. plåster, injektionspreparat etc.) hänvisas till respektive produkts förskrivarinformation.
Användning post partum
Kvinnor som väljer att inte amma sitt nyfödda barn kan påbörja en ny behandling med Amorest 28 på den första dagen av den första spontana menstruationen eller 3 veckor efter förlossning, vilketdera som inträffar först.
Efter en abort eller ett missfall som ägt rum före 20 veckors graviditet kan p-pillerbehandling påbörjas genast. Något kompletterande skydd behövs inte. Observera att ägglossning kan inträffa inom 10 dagar efter abort eller missfall.
Efter en abort eller ett missfall som äger rum vid eller efter 20 veckors graviditet, kan hormonella preventivmedel antingen påbörjas på dag 21 efter aborten eller på den första dagen av den första spontana menstruationen, vilketdera som inträffar först. Ett icke-hormonellt preventivmedel måste användas samtidigt under de första 7 dagarna av den första cykeln av behandling med Amorest 28.
Behandlingskontroll
Före förskrivning rekommenderas en noggrann anamnes och en gynekologisk undersökning varvid graviditet utesluts och blodtryck mäts.
Menstruationsstörningar såsom oligomenorré och amenorré bör utredas före förskrivning. Intervallen mellan kontrollerna beror på omständigheterna i det enskilda fallet. Om det ordinerade preparatet kan tänkas påverka latent eller manifest sjukdom, måste tidpunkten för kontrollundersökningen väljas med hänsyn till detta.
Om menstruationen uteblivit två på varandra följande cykler bör möjligheten att graviditet föreligger utredas.
Amenorré med olika varaktighet kan förekomma efter avslutad behandling.
Vid behandling med medicinsk kol, vid kräkning inom 3 timmar efter tablettintag, eller om kraftig diarré pågår under längre tid än 24 timmar, kan den kontraceptiva effekten vara nedsatt, och en icke-hormonell antikonceptionsmetod bör användas som tillägg till dess att 7 blå tabletter har tagits under 7 dagar utan uppehåll. Om kräkning och/eller diarré fortsätter kan den kontraceptiva effekten vara nedsatt.
Äldre
Användning av detta läkemedel är inte indicerat till postmenopausala kvinnor.
4.3 Kontraindikationer
Kombinerade p-piller ska inte användas vid något av nedanstående tillstånd. Om något av dessa tillstånd uppstår under användningen av kombinerade p-piller, ska behandlingen avbrytas omgående.
-
Förekomst av eller risk för venös tromboembolism (VTE)
-
Venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på (t.ex. djup ventrombos [DVT] eller lungemboli [PE])
-
Känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC resistens (inklusive Faktor V Leiden), antitrombin-III-brist, protein C-brist, protein S-brist
-
Större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt 4.4)
-
Hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt 4.4)
-
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
-
Arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
-
Cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
-
Känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupus antikoagulant)
-
Migrän med fokala neurologiska symtom i anamnesen
-
Hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt 4.4) eller på grund av förekomst av en allvarlig riskfaktor som:
-
diabetes mellitus med vaskulära symtom
-
allvarlig hypertoni
-
allvarlig dyslipoproteinemi
-
-
-
Pågående eller tidigare allvarlig leversjukdom, så länge leverfunktionsvärdena inte återgått till de normala.
-
Samtidig användning av läkemedel innehållande ombitasvir/paritaprevir/ritonavir och dasabuvir, läkemedel som innehåller glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir (se avsnitt 4.5).
-
Pågående eller tidigare levertumör (godartad eller elakartad).
-
Hormonberoende känd eller misstänkt malign tumör i genitalier eller bröst.
-
Endometriehyperplasi.
-
Odiagnostiserad vaginalblödning.
-
Kolestatisk gulsot vid graviditet eller gulsot vid tidigare p-pillerbehandling.
-
Känd eller misstänkt graviditet.
-
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt 6.1.
4.4 Varningar och försiktighet
Varningar
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Amorest 28 diskuteras med kvinnan.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången, ska kvinnan ta kontakt med sin läkare/barnmorska. Läkare/barnmorska ska då besluta om användningen ska avbrytas.
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke-användning. Produkter som innehåller levonorgestrel, norgestimat (inklusive Amorest 28 eller noretisteron förknippas med den lägsta risken för VTE. Beslutet att använda Amorest 28 ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Amorest 28, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE-risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
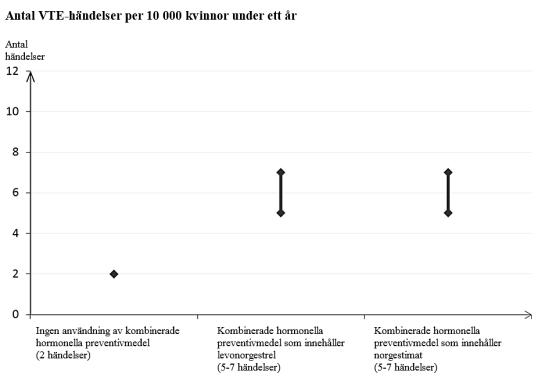
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Av cirka 10 000 kvinnor som använder ett kombinerat hormonellt preventivmedel som innehåller levonorgestrel kommer cirka 61 att utveckla en VTE under ett år.
Aktuell dokumentation tyder på att risken för VTE vid användning kombinerade hormonella preventivmedel som innehåller norgestimat liknar risken för kombinerade preventivmedel som innehåller levonorgestrel.
Antalet VTE-händelser per år är färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE kan vara dödligt i 1-2 % av fallen.
1 Genomsnittsintervallet är på 5-7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en icke-användning på cirka 2,3 till 3,6.
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Amorest 28 är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt 4.3). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt 4.3).
|
Riskfaktor |
Kommentar |
|---|---|
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
|
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada Anm: tillfällig immobilisering inklusive flygresor >4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer |
I dessa situationer är det lämpligt att göra ett uppehåll i användningen av p-pillret (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. Antitrombotisk behandling bör övervägas om Amorest 28 inte har satts ut i förväg. |
|
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Andra medicinska tillstånd som förknippas med VTE |
Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecell-sjukdom. |
|
Stigande ålder |
Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6 veckorsperioden i puerperiet måste beaktas (för information om ”Graviditet och amning” se avsnitt 4.6).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
-
unilateral svullnad av ben och/eller fot eller längs en ven i benet
-
smärta eller ömhet i benet som bara känns vid stående eller gående
-
ökade värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
-
plötslig debut av oförklarlig andfåddhet eller snabb andning
-
plötslig hosta som kan förknippas med hemoptys
-
kraftig bröstsmärta
-
kraftig ostadighetskänsla eller yrsel
-
snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andfåddhet och hosta) är icke-specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har också visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Amorest 28 är kontrainidcerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt 4.3). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt 4.3).
|
Riskfaktor |
Kommentar |
|---|---|
|
Stigande ålder |
Framför allt hos kvinnor över 35 år |
|
Rökning |
Kvinnor över 35 år bör starkt rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
|
Hypertoni | |
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
|
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Migrän |
En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande |
|
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser |
Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
-
plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
-
plötsliga problem med att gå, yrsel, förlorad balans eller koordination
-
plötslig förvirring, svårigheter att tala eller förstå
-
plötsliga synproblem i ett eller båda ögonen
-
plötslig, svår eller långvarig huvudvärk utan känd orsak
-
medvetslöshet eller svimning med eller utan anfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
-
smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
-
obehag som strålar mot ryggen, käken, halsen, armen, magen
-
mättnadskänsla, matsmältningsbesvär eller kvävning
-
svettning, illamående, kräkningar eller yrsel
-
extrem svaghet, ångest eller andfåddhet
-
snabba eller oregelbundna hjärtslag.
Tumörer
En ökad risk för cervixcancer efter långvarig användning av kombinerade p-piller har rapporterats i vissa epidemiologiska studier, men det finns fortfarande olika uppfattningar om i vilken omfattning detta fynd kan hänföras till de sammansatta effekterna av sexuellt beteende och andra faktorer som t.ex. humant papillomvirus (HPV).
En metaanalys från 54 epidemiologiska studier visade på en något ökad relativ risk (RR = 1,24) att få diagnosen bröstcancer hos kvinnor som använder kombinerade p-piller. Den ökade risken försvinner gradvis under loppet av tio år efter avslutad användning. Eftersom bröstcancer är ovanligt hos kvinnor under 40 års ålder är den ökade risken för bröstcancerdiagnos hos användare och före detta användare av kombinerade p-piller liten i jämförelse med den generella risken för bröstcancer. Dessa studier visar inte på något kausalt samband. Det observerade mönstret för ökad risk kan bero på att bröstcancer diagnostiseras tidigare hos kvinnor som använder kombinerade p-piller, de biologiska effekterna av kombinerade p-piller eller av en kombination av dessa. Bröstcancer som diagnostiseras hos de som någon gång använt p-piller tenderar att vara mindre kliniskt avancerad jämfört med cancer hos dem som aldrig använt p-piller.
I sällsynta fall har godartade levertumörer rapporterats hos användare av kombinerade p-piller, och i ännu mer sällsynta fall elakartade levertumörer. I enstaka fall har dessa tumörer lett till livshotande intrabdominella blödningar. Därför bör en levertumör beaktas i differentialdiagnosen då kvinnor som använder kombinerade p-piller får allvarlig smärta i övre delen av buken, leverförstoring eller tecken på intraabdominell blödning.
Andra tillstånd
-
Kvinnor med hypertriglyceridemi, eller med hypertriglyceridemi i släkten, kan löpa en ökad risk för pankreatit vid användning av kombinerade p-piller.
-
Även om små blodtryckshöjningar har rapporterats hos många kvinnor som använder hormonella preventivmedel, är kliniskt relevanta höjningar sällsynta. Något klart samband mellan användning av kombinerade p-piller och klinisk hypertoni har inte fastställts. Om en kliniskt signifikant höjning av blodtrycket utvecklas och kvarstår under behandling med kombinerade p-piller bör p-pillret sättas ut och hypertonin behandlas. Om det bedöms lämpligt kan p-pillerbehandlingen återupptas om normala blodtrycksvärden kan erhållas med hypertonibehandling.
-
Följande tillstånd har rapporterats uppstå eller försämras vid både graviditet och användning av kombinerade p-piller, men övertygande bevis för ett samband med kombinerade p-piller saknas: gulsot och/eller pruritus relaterat till kolestas, gallsten, porfyri, systemisk lupus erytematosus, hemolytiskt uremiskt syndrom, Sydenhams korea, herpes gestationis, otosklerosrelaterad hörselförlust.
-
Akut eller kronisk störning av leverfunktionen kan göra det nödvändigt att avbryta användningen av kombinerade p-piller tills leverfunktionsproverna återgår till det normala. Minst tre månader bör gå sedan leverfunktionstesterna visat normala värden efter någon form av hepatit, innan behandling med kombinerade p-piller påbörjas. Återkommande kolestasrelaterad pruritus, som uppstått under en tidigare graviditet eller tidigare användning av könssteroider bör leda till att användningen av kombinerade p-piller avbryts. Gallblåsesjukdom, inklusive kolecystit och kolelitiasis, har varit förknippad med användning av kombinerade p-piller.
-
Även om kombinerade p-piller kan ha en effekt på perifer insulinresistens och glukostolerans, finns det inga bevis för att det är nödvändigt att ändra doseringen för diabetiker som använder kombinerade p-piller. Kvinnor med diabetes bör dock observeras noga vid användning av kombinerade p-piller.
-
Crohns sjukdom och ulcerös kolit har förknippats med användning av kombinerade p-piller.
-
Kloasma kan ibland uppkomma, särskilt hos användare som haft kloasma under graviditet. Kvinnor som har tendens till kloasma bör undvika solexponering och ultraviolett strålning medan de använder kombinerade p-piller.
-
Patienter med sällsynta ärftliga tillstånd som galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption skall inte använda detta läkemedel.
-
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt 4.8). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
-
Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
All denna information bör beaktas vid förskrivning av detta kombinerade p-piller. När råd ges om val av preventivmetod bör all ovanstående information beaktas.
Läkarundersökning/konsultation
Innan användning av Amorest 28 påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserad på kontraindikationerna (se avsnitt 4.3) och varningar (se avsnitt 4.4). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Amorest 28 jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Minskad effekt
Skyddseffekten hos kombinerade p-piller kan försämras vid glömd tablett (avsnitt 4.2), kräkning eller svår diarré (avsnitt 4.2) eller vid samtidig användning av andra läkemedel (avsnitt 4.5).
Naturläkemedel innehållande Johannesört (Hypericum perforatum) skall inte användas samtidigt med Amorest 28 på grund av risken för minskade plasmakoncentrationer och minskad klinisk effekt för Amorest 28 (se avsnitt 4.5)
Försämrad cykelkontroll
Oregelbundna blödningar (stänkblödning eller genombrottsblödning) kan förekomma med alla kombinerade p-piller, särskilt under de första månadernas användning. En prövoperiod på cirka tre cykler behövs därför innan en utvärdering med avseende på eventuell oregelbunden blödning kan göras.
Kvarstår de oregelbundna blödningarna eller om de uppträder efter tidigare regelbundna cykler, bör icke-hormonella orsaker övervägas och malignitet eller graviditet uteslutas.
Provtagning från livmodern kan också bli aktuellt.
Hos vissa kvinnor kan bortfallsblödningen utebli under intag av placebotabletterna. Om p-pillret har tagits enligt anvisningarna i avsnitt 4.2, är kvinnan sannolikt inte gravid. Har p-pillret däremot inte tagits enligt anvisningarna före den första uteblivna bortfallsblödningen eller om två bortfallsblödningar uteblivit, skall graviditet uteslutas innan kvinnan fortsätter använda kombinerade p-piller.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt 4.3).
Därför måste patienter som behandlas Amorest 28 byta till ett alternativt preventivmedel (t.ex. endast gestagen-innehållande preventivmedel eller icke-hormonella metoder) innan dessa kombinationsbehandlingar påbörjas. Behandling med Amorest 28 kan påbörjas igen 2 veckor efter att dessa kombinationsbehandlingar avslutats.
Potentiell reducering av kontraceptiv effekt associerad med samtidig administrering av andra läkemedel:
Leverenzyminducerande läkemedel
Läkemedel eller naturläkemedel som inducerar enzymer, särskilt CYP3A4, kan minska plasmakoncentrationen av kontraceptiva hormoner och därmed reducera deras effekt och/eller leda till genombrottsblödningar. Maximal enzyminduktion uppträder i allmänhet efter 2-3 veckor men kan kvarstå i åtminstone 4 veckor efter avslutad behandling.
Exemplen inkluderar:
-
vissa antiepileptika (t.ex. karbamazepin, eslikarbazepinacetat, felbamat, oxkarbazepin, fenytoin, primidon, rufinamid, topiramat)
-
(fos)aprepitant
-
barbiturater
-
bosentan
-
griseofulvin
-
vissa (kombinationer av) hiv-proteas hämmare (t.ex. nelfinavir, ritonavir, ritonavir-boostrade proteashämmare)
-
modafinil
-
vissa icke-nukleosida omvända transkriptashämmare (exempelvis nevirapin)
-
rifampicin och rifabutin
-
johannesört
Kolesevelam, en gallsyresekvestrant, givet tillsammans med ett kombinerat p-piller har visat sig minska AUC för etinylestradiol signifikant. Ingen interaktion sågs när preventivmedlet gavs 4 timmar före kolesevelam.
Läkemedel som påverkar absorption
Behandling med aktivt kol förväntas inte försämra absorptionen av steroidhormoner om det ges minst 12 timmar före eller 3 timmar efter Amorest 28.
Hantering av dessa interaktioner
Kvinnor på korttidsbehandling med läkemedel och naturläkemedel som kan reducera plasmanivåerna av kontraceptiva hormoner kan få reducerad kontraceptiv effekt. De bör därför temporärt använda en barriärmetod (t.ex. kondom eller pessar) i tillägg till Amorest 28 under den tid som ett interagerande läkemedel används och i sju dagar efter avslutad behandling. Om behandlingen med detta läkemedel avslutas under vecka 3 eller efter det att alla p-piller i tablettkartan tagits, ska nästa tablettkarta påbörjas nästa dag utan paus. Vid behandling med rifampicin respektive modafinil, bör kvinnan fortsätta använda en barriärmetod i 28 dagar respektive 56 dagar efter avslutad behandling.
Vid långtidsbehandling med läkemedel och naturläkemedel som interagerar med kontraceptiva hormoner rekommenderas en annan tillförlitlig, icke-hormonell preventivmetod.
Ökning av hormonnivåer i plasma vid samtidig administrering av andra läkemedel:
Vissa läkemedel och grapefruktjuice kan öka plasmanivåerna av etinylestadiol om det administreras samtidigt. Exempel är:
-
askorbinsyra
-
CYP3A4-hämmare (inklusive itrakonazol, ketokonazol, vorikonazol, flukonazol och grapefruktjuice)
-
etoricoxib
-
vissa hiv-proteashämmare (t.ex. atazanavir, indinavir)
-
HMG-CoA reduktas-hämmare (inklusive atorvastatin och rosuvastatin)
-
vissa icke-nukleosida omvända transkriptashämmare (exempelvis etravirin)
-
paracetamol.
Förändringar i plasmanivåer av samtidigt administrerade läkemedel:
Kombinerade hormonella preventivmedel kan också påverka farmakokinetiken av vissa andra läkemedel om de används samtidigt.
Läkemedel vars plasmanivåer kan öka (pga. CYP-hämning)
Exempel är:
-
ciklosporin
-
omeprazol
-
prednisolon
-
selegilin
-
teofyllin
-
tizanidin
-
vorikonazol
Läkemedel vars plasmanivåer kan minska (pga. inducerad glukuronidering)
Exempel är:
-
lamotrigin
-
paracetamol
-
klofibrat
-
morfin
-
temazepam
Hantering av dessa interaktioner
Läkare rekommenderas att konsultera produktinformationen för det samtidigt använda läkemedlet för att få ytterligare information om interaktioner med hormonella preventivmedel och eventuella behov av dosjustering.
Gestagenkomponenten norgestimat hydrolyseras snabbt till norelgestromin, följt av biotransformation till norgestrel. De specifika enzym som katalyserar dessa reaktioner är inte kända. Interaktioner som skulle kunna påverka deras transformation kan därför inte förutsägas.
Laboratorietester
Användningen av steroider för antikonception kan påverka resultaten av vissa laboratorietest, inklusive biokemiska parametrar för lever-, sköldkörtel-, binjure- och njurfunktioner, plasmanivåer för (bärar-) proteiner, till exempel kortikosteroidbindande globulin och lipidlipoproteinfraktioner, parametrar för kolhydratmetabolism och parametrar för koagulation och fibrinolys. Förändringarna ligger vanligtvis inom normala laboratorievärden.
Serumnivå av folat kan reduceras vid peroral antikonceptionsbehandling. Detta kan ha klinisk betydelse om en kvinna blir gravid kort efter utsättning av p-piller
4.6 Fertilitet, graviditet och amning
Graviditet
Amorest 28 är kontraindicerat under graviditet.
Epidemiologiska studier antyder inte någon ökad risk för medfödda missbildningar hos barn som fötts av kvinnor som använt p-piller före graviditeten. Huvuddelen av epidemiologiska studier som gjorts under senare tid tyder inte heller på någon teratogen effekt, när p-piller intagits oavsiktligt under tidig graviditet.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Amorest 28 (se avsnitt 4.2 och 4.4).
Amning
Kontraceptiva steroider och/eller dess metaboliter kan utsöndras i bröstmjölk. Dessutom kan kombinerade hormonella preventivmedel som ges under post-partumperioden påverka amningen genom att minska mängden och kvaliteten på bröstmjölken. Om möjligt skall ammande mödrar rådas att inte använda Amorest 28 eller något annat kombinerat hormonellt preventivmedel innan barnet är helt avvant.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Amorest 28 har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
4.8 Biverkningar
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardinfarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt 4.4.
Amorest 28’s säkerhet utvärderades hos 1 891 friska kvinnor i fertil ålder som deltog i 5 kliniska prövningar (2 randomiserade, aktivt kontrollerade prövningar och 3 okontrollerade, öppna prövningar) och fick minst 1 dos av Amorest 28 som preventivmedel. I 3 prövningar följdes försökspersonerna i upp till 24 cykler och i de andra 2 prövningarna följdes försökspersonerna i upp till 12 cykler. I dessa studier insamlades följande biverkningar eller bestämdes från blödningsmönster eller cykelkarakteristika och incidensen kunde endast fastställas per behandlingscykel (per cykel) och inte totalt: illamående, gastrointestinala störningar (rapporterade som illamående eller kräkningar), kräkningar, dysmenorré, metrorragi, onormal bortfallsblödning, amenorré och diarré (diarré identifierades som en biverkning under granskning efter godkännandet för försäljning). Ytterligare en okontrollerad studie (n=8 331) rapporterade biverkningar endast per cykel och inkluderades endast i incidensberäkningen för biverkningar per cykel. För dessa biverkningar per cykel beräknades de poolade incidenserna för cykel 1, 3, 6, 12 och 24 och den högsta incidensen per cykel (cykel 1 för alla utom kräkningar och diarré) användes för att bestämma frekvenskategori för biverkningen.
Baserat på poolade säkerhetsdata från dessa kliniska prövningar var de vanligaste rapporterade (dvs. incidens ≥5%) biverkningarna (med % incidens) huvudvärk (27,9%), vaginal infektion (7,5%), genital flytning (6,0%) och bröstsmärta (5,7 %). Alla biverkningar per cykel, förutom amenorré, var mycket vanliga (≥10%) i cykel 1 (dysmenorré: 40,4 %; illamående: 29,1%; metrorragi: 26,3%; gastrointestinala störningar [rapporterade som illamående eller kräkningar]: 24,6 %; onormal bortfallsblödning: 16,9% och kräkningar: 7,0%). Med undantag för kräkningar och dysmenorré var incidensen av dessa biverkningar högst i cykel 1 och minskade över tiden med ytterligare behandlingscykler (baserat på incidensdata från cykel 1, 3, 6, 12 och 24). Kräkningar ökade i vissa senare cykler, medan dysmenorré förblev relativt stabil med en liten minskning över tiden. De vanligaste rapporterade (≥5% incidens) biverkningarna som identifierades vid erfarenhet med norgestimat- och etinylestradioltabletter efter godkännandet för försäljning (incidens från poolade kliniska prövningsdata) var diarré (11,8% och ryggsmärtor (5,4%). Incidensen i kliniska prövningar av diarré rapporterades per cykel, och därför baserades tilldelningen av frekvenskategori på den högsta incidensen per cykel (cykel 12). Inklusive ovan nämnda biverkningar visar tabell A alla biverkningar som har rapporterats vid användning av Amorest 28 i kliniska prövningar eller vid erfarenhet efter godkännandet för försäljning med norgestimat- och etinylestradioltabletter.
Frekvenskategorierna definieras enligt följande: mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000); och mycket sällsynta (<1/10 000).
|
Organsystem Frekvenskategori |
Biverkning |
|---|---|
|
Infektioner och infestationer |
|
|
vanliga |
urinvägsinfektion, vaginal infektion |
|
Neoplasier, benigna, maligna och ospecificerade (samt cystor och polyper) |
|
|
mindre vanliga1 |
bröstcancer2, leveradenom2, benigna brösttumörer2, fokal nodulär hyperplasi2, fibroadenom i bröst2 |
|
sällsynta |
bröstcystor |
|
Immunsystemet |
|
|
vanliga |
överkänslighet |
|
ingen känd frekvens1 |
Förvärrade symtom av ärftligt eller förvärvat angioödem |
|
Metabolism och nutrition |
|
|
vanliga |
vätskeretention |
|
mindre vanliga |
viktfluktuation, minskad aptit, ökad aptit, dyslipidemi1 |
|
sällsynta |
aptitstörningar |
|
Psykiska störningar |
|
|
vanliga |
depression, nervositet, förändrad sinnesstämning, insomnia |
|
mindre vanliga |
ångest, libidostörningar |
|
Centrala och perifera nervsystemet |
|
|
mycket vanliga |
huvudvärk |
|
vanliga |
migrän, yrsel |
|
mindre vanliga |
synkope, parestesi, konvulsion1 |
|
Ögon |
|
|
mindre vanliga |
synförsämring, torra ögon, kontaktlinsintolerans1 |
|
Öron och balansorgan |
|
|
sällsynta |
yrsel |
|
Hjärtat |
|
|
mindre vanliga |
hjärtklappning |
|
sällsynta |
takykardi |
|
Blodkärl |
|
|
mindre vanliga |
trombis2, hypertoni, blodvallningar |
|
sällsynta |
Venös och arteriell tromboembolism2 inklusive cerebrovaskulär händelse, retinal kärltrombos, myokardinfarkt, djup ventrombos och lungemboli |
|
Andningsvägar, bröstkorg och mediastinum |
|
|
mindre vanliga |
dyspné |
|
Magtarmkanalen |
|
|
mycket vanliga |
gastrointestinala ströningar3,4, kräkningar5, diarré5, illamående4 |
|
vanliga |
gastrointestinala smärtor, buksmärtor, utspänd buk, förstoppning, flatulens |
|
sällsynta |
pankreatit |
|
Lever och gallvägar |
|
|
sällsynta |
hepatit2 |
|
Hud och subkutan vävnad |
|
|
vanliga |
akne, utslag |
|
mindre vanliga |
alopeci, hirsutism, urtikaria, klåda, erytem, missfärgning av huden, angioödem1, erythema nodosum1, nattliga svettningar1 |
|
sällsynta |
hyperhidros, ljuskänslighetsreaktion |
|
Muskuloskeletala systemet och bindväv |
|
|
vanliga |
muskelspasmer, extremitetssmärtor, ryggsmärtor6 |
|
mindre vanliga |
myalgi |
|
Reproduktionsorgan och bröstkörtel |
|
|
mycket vanliga |
dysmenorré4, metrorragi4, onormal bortfallsblödning4 |
|
vanliga |
amenorré4, genital flytning, bröstsmärtor |
|
mindre vanliga |
utsöndring från brösten, bröstförstoring, ovarialcystor, vulvovaginal torrhet, livmoderhalsdysplasi2, hämmad laktation1 |
|
sällsynta |
vaginal flytning |
|
Allmänna symtom och/eller symtom vid administreringsstället |
|
|
vanliga |
bröstsmärtor, ödem, asteniska tillstånd7 |
|
Undersökningar |
|
|
vanliga |
ökad vikt |
|
mindre vanliga |
minskad vikt |
|
1 Dessa biverkningar rapporterade efter godkännandet för försäljning sågs inte i kliniska prövningar. Därför kan den verkliga incidensen av dessa biverkningar inte beräknas utifrån tillgängliga data. 2 Se avsnitt 4.4 ”Varningar och försiktighet” och motsvarande lokal underrubrik. 3 Rapporterades som illamående eller kräkningar. 4 Biverkningsincidensen rapporterades per cykel; frekvenskategorin baserades på högsta poolade incidens i behandlingscykel 1. 5 Biverkningsincidensen rapporterades per cykel; frekvenskategorin baserades på högsta poolade incidens i behandlingscykel 12. 6 Detta beräknade incidensvärde kan vara något högre än den verkliga incidensen, eftersom fler än 1 biverkningsterm som rapporterades i samma prövning kodades som den föredragna MedDRA-termen ”ryggsmärtor”. Det är möjligt att samma försöksperson(er) kan ha rapporterat fler än 1 av biverkningstermerna och kan därför ha räknats fler än en gång för den föredragna termen “ryggsmärtor”. 7 Högre term; frekvenskategorin baseras på incidens av den vanligaste termen inom den högre termen för asteniska tillstånd från poolade kliniska prövningsdata, nämligen trötthet. |
|
Nedan anges ytterligare biverkningar som kan varit förknippade med användningen av hormonella preventivmedel:
Tumörer: benigna levertumörer, maligna levertumörer.
Lever och gallvägar: intrahepatisk kolestas, kolelitiasis, kolestatisk gulsot, Budd Chiaris syndrom.
Reproduktionsorgan och bröstkörtel: storleksökning hos livmoderfibromyom, ökad cervixerosion, tillfällig infertilitet efter avslutad behandling, premenstruellt syndrom.
Hud och subkutan vävnad:seborré, hypertrikos, pemfigoid (herpes gestationis), melasma som kan kvarstå, hemorragisk eruption.
Ögon: förändring av hornhinnans krökning (blir brantare).
Centrala nervsystemet: korea.
Metabolism och nutrition: minskad glukostolerans.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Ingen allvarlig effekt har rapporterats efter akut intag av perorala antikonceptionsmedel. Överdosering kan förorsaka illamående, kräkningar och, hos unga kvinnor, vaginalblödningar. Det finns ingen antidot. Symptomatisk behandling ges.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
ATC-kod: G03AA11
Amorest 28 utövar sin effekt via hämning av gonadotropin genom östrogen och gestagen inverkan av etinylestradiol och norgestimat. Den primära verkningsmekanismen är hämning av ovulationen. Förändringar i cervixslemhinnan, rörligheten i äggledarna och förändringar av endometriet kan också bidra till produktens effekt.
Studier av bindning till receptorer och könshormonbindande globulin (SHBG), liksom studier på djur och människa, har visat att både norgestimat och norelgestromin, som är den huvudsakliga serummetaboliten av norgestimat vid oral administrering, utövar hög gestagen aktivitet med minimal egen androgenicitet.
5.2 Farmakokinetiska egenskaper
Absorption
Norgestimat och etinylestradiol absorberas snabbt efter oral administrering. Efter endos eller flerdos (tre cykler) administrering av Amorest 28 förblir koncentrationen av norgestimat under analysmetodens detektionsgräns (0,1 ng/ml) på grund av snabb metabolism (se Metabolism). Exponeringen för norelgestromin är proportionell till dosen efter norgestimatdoser på 0,180 mg till 0,250 mg. Serumkoncentrationer av etinylestradiol är mätbara inom 0,5 timmar efter intag, och max-nivåer nås cirka 1,2 timmar efter dosering.
Distribution
Norelgestromin och norgestrel är i hög grad bundna (>97 %) till serumproteiner. Norelgestromin är bundet till albumin men inte till SHBG, medan norgestrel är bundet framför allt till SHBG och i mycket mindre grad till albumin. Etinylestradiol är i stor utsträckning bundet till serumalbumin.
Studier har visat att norelgestromins brist på bindning till SHBG spelar en nyckelroll i att förstärka dess biologiska aktivitet. Norgestrel, som bildas från norgestimat, är däremot i hög grad bundet till SHBG, vilket begränsar dess biologiska aktivitet. Dessa fynd, tillsammans med norelgestromins selektivitet för progesteronreceptorn, indikerar att denna metabolit kan förklara norgestimats unika kliniska profil.
Metabolism
Norgestimat metaboliseras snabbt genom första passagemekanismer (i tarm och/eller lever) till norelgestromin (maximala serumkoncentrationer observeras inom 2 timmar) och norgestrel, vilka båda är farmakologiskt aktiva gestagener. Etinylestradiol metaboliseras till olika hydroxylerade metaboliter och dess glukuronid- och sulfatkonjugat.
Eliminering
Såväl norelgestromin, norgestrel som etinylestradiol metaboliseras efter hand och deras metaboliter elimineras via njurarna och i feces. Halveringstiden i elimineringsfasen vid steady-state var 10-15 timmar för etinylestradiol, 24,9 timmar för norelgestromin och 45 timmar för norgestrel. Efter administrering av 14C-norgestimate eliminerades 47 % av den tillförda radioaktiviteten via urinen och 37 % via feces.
Farmakokinetik vid steady-state
Efter administrering av 0,250 mg/0,035 mg etinylestradiol är dygnsexponeringen (medelvärde för AUC0-24h) vid steady-state baserat på icke-SHBG-bunden serumnivå 18,1 h ng/ml för norelgestromin och 3,64 h ng/ml för norgestrel. Efter oralt intag av 0,150 mg levonorgestrel/0,030 mg etinylestradiol var genomsnittlig dygnsexponering vid steady state baserat på icke-SHBG-bunden serumnivå 18,9 h ng/ml för norgestrel. Exponeringen för norgestrel efter intag av 0,250 mg norgestimat/0,035 mg etinylestradiol motsvarar exponeringen efter en dos levonorgestrel av 30 mikrogram i kombination med etinylestradiol.
5.3 Prekliniska säkerhetsuppgifter
Det finns inga prekliniska data av relevans för säkerhetsbedömningen utöver vad som redan beaktats i produktresumén.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Blå tabletter
Pregelatiniserad stärkelse
Magnesiumstearat
Laktos, vattenfri
Laktosmonohydrat
Mikrokristallin cellulosa
Kroskarmellosnatrium
Indigokarmin aluminiumpigment (E132)
All-rac-alfa-Tokoferol
Povidon
Ljusgröna tabletter
Pregelatiniserad stärkelse
Magnesiumstearat
Laktos, vattenfri
Mikrokristallin cellulosa
Kroskarmellosnatrium
Järnoxidgult (E 172)
Briljantblått FCF aluminiumpigment (E133)
6.2 Inkompatibiliteter
Ej relevant.
6.3 Hållbarhet
2 år.
6.4 Särskilda förvaringsanvisningar
Förvaras i originalförpackningen. Ljuskänsligt.
6.5 Förpackningstyp och innehåll
Kalenderblister av PVC/PVdC/Al. Varje kalenderblister innehåller 21 blå tabletter och 7 ljusgröna tabletter. En ytterkartong innehåller 1x28, 3x28, 6x28 respektive 13x28 tabletter.
Varje blister är förpackat i en treskiktslaminerad aluminiumpåse, innehållande torkmedel av silicagel.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
6.6 Särskilda anvisningar för destruktion
Inga särskilda anvisningar.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
CampusPharma AB
Karl Gustavsgatan 1A
411 25, Göteborg
Sverige
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
50862
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 2015-02-26
Förnyat godkännande: 2020-02-26
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
2022-11-07





