Indikationer
NovoMix 30 är indicerat för behandling av diabetes mellitus hos vuxna, ungdomar och barn från 10 års ålder och uppåt.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne.
Dosering
Dosering
Styrkan av insulinanaloger, inklusive insulin aspart, uttrycks i enheter, medan styrkan av humant insulin uttrycks i internationella enheter.
Doseringen av NovoMix 30 är individuell och fastställs med hänsyn till patientens behov. Blodglukoskontroll och justering av insulindosen rekommenderas för att uppnå optimal glykemisk kontroll.
NovoMix 30 kan ges till patienter med typ 2-diabetes som monoterapi. NovoMix 30 kan också ges i kombination med perorala antidiabetika och/eller GLP-1-receptoragonister. Rekommenderad startdos av NovoMix 30 för patienter med typ 2-diabetes är 6 enheter till frukost och 6 enheter till middag (kvällsmål). NovoMix 30 kan även initieras en gång dagligen med 12 enheter till middag (kvällsmål). När NovoMix 30 används en gång dagligen rekommenderas generellt övergång till dosering två gånger dagligen vid doser över 30 enheter. Dosen fördelas på lika stora doser till frukost och middag (kvällsmål). Om dosering två gånger dagligen med NovoMix 30 ger återkommande dagliga hypoglykemiska episoder, kan morgondosen delas upp i morgon- och lunchdos (dosering tre gånger dagligen).
Följande titreringsriktlinjer rekommenderas för dosjusteringar:
|
Blodglukosvärde före måltid |
Blodglukosvärde före måltid |
NovoMix 30 dosjustering |
|
< 4,4 mmol/l |
< 80 mg/dl |
- 2 enheter |
|
4,4 – 6,1 mmol/l |
80 – 110 mg/dl |
0 |
|
6,2 – 7,8 mmol/l |
111 – 140 mg/dl |
+ 2 enheter |
|
7,9 – 10 mmol/l |
141 – 180 mg/dl |
+ 4 enheter |
|
> 10 mmol/l |
> 180 mg/dl |
+ 6 enheter |
Det lägsta av de tre föregående dagarnas blodglukosvärde före måltid bör användas. Dosen bör inte ökas om hypoglykemi uppträdde under dessa dagar. Dosjusteringar kan göras en gång i veckan tills önskat HbA1c uppnåtts. Blodglukosvärden före måltid bör användas för att utvärdera om föregående dos var adekvat.
Hos patienter med typ 2 diabetes, rekommenderas en dosreduktion på 20% till patienter med HbA1c under 8% DCCT standard, för att minimera risken för hypoglykemi när en GLP-1-receptoragonist läggs till NovoMix 30. För patienter med HbA1c högre än 8% DCCT standard ska en dosreduktion övervägas. Därefter ska dosen justeras individuellt.
Hos patienter med typ 1-diabetes är det individuella insulinbehovet vanligen mellan 0,5–1,0 enheter/kg/dag. NovoMix 30 kan helt eller delvis tillfredsställa detta behov.
Justering av dosen kan bli aktuellt vid ökad fysisk ansträngning, förändrad diet eller i samband med annan sjukdom.
Speciella populationer
Äldre (≥ 65 år)
NovoMix 30 kan användas av äldre patienter, men hos patienter äldre än 75 år föreligger dock begränsad erfarenhet av användning med NovoMix 30 i kombination med perorala antidiabetika. För äldre patienter bör glukoskontrollen intensifieras och dosen av insulin aspart justeras individuellt.
Nedsatt njur- och leverfunktion
Nedsatt njur- eller leverfunktion kan minska patientens behov av insulin.
För patienter med nedsatt lever- eller njurfunktion bör glukoskontrollen intensifieras och dosen av insulin aspart justeras individuellt.
Pediatrisk population
NovoMix 30 kan användas till ungdomar och barn från 10 års ålder och uppåt när en blandning av insuliner är att föredra. För barn 6–9 år är den kliniska erfarenheten av NovoMix 30 begränsad.
Det finns inga data för NovoMix 30 på barn yngre än 6 år.
Övergång från andra insulinpreparat
Vid övergång från bifasiskt humant insulin till NovoMix 30 kan patienten initialt fortsätta med samma dos och doseringsregim. Därefter titreras dosen med hänsyn till individuellt behov (se titreringsriktlinjer i ovanstående tabell).
Noggrann kontroll av glukosvärden rekommenderas under övergången och de första veckorna därefter.
Administreringssätt
NovoMix 30 är en bifasisk suspension av insulinanalogen insulin aspart. Suspensionen innehåller snabbverkande och medellångverkande insulin aspart i förhållandet 30/70.
NovoMix 30 är endast avsett för subkutan administrering.
NovoMix 30 administreras subkutant i låret eller i bukväggen. Den gluteala regionen eller deltoidregionen kan också användas. Injektionsställena ska alltid växlas inom samma område för att minska risken för lipodystrofi och kutan amyloidos. Hur olika injektionsställen påverkar absorptionen av NovoMix 30 har inte undersökts. Verkningstiden varierar med dos, injektionsställe, blodflöde, temperatur och fysisk aktivitetsnivå.
NovoMix 30 har ett snabbare anslag än bifasiskt humant insulin och bör i allmänhet ges omedelbart före måltid. Om det behövs kan NovoMix 30 ges strax efter måltid.
För detaljerad bruksanvisning, se bipacksedeln.
NovoMix 30 Penfill
Administrering med injektionshjälpmedel för insulin
NovoMix 30 Penfill är utformad för att användas med injektionshjälpmedel för insulin från Novo Nordisk och med NovoFine eller NovoTwist injektionsnålar. NovoMix 30 Penfill ska endast administreras subkutant med en flergångspenna. Om administrering genom spruta är nödvändig ska en injektionsflaska användas.
NovoMix 30 FlexPen
Administrering med FlexPen
NovoMix 30 FlexPen är en förfylld injektionspenna (färgkodad) utformad för att användas med NovoFine eller NovoTwist injektionsnålar. Med FlexPen kan 1–60 enheter ställas in i steg om 1 enhet. NovoMix 30 FlexPen ska endast administreras subkutant. Om administrering genom spruta är nödvändig ska en injektionsflaska användas.
Varningar och försiktighet
NovoMix 30 får inte administreras intravenöst, eftersom det kan leda till allvarlig hypoglykemi. Även intramuskulär administrering ska undvikas. NovoMix 30 får ej användas i infusionspumpar för insulin.
Före resor mellan olika tidszoner bör patienten rådfråga läkare, då detta kan innebära att patienten måste ta sitt insulin och måltider vid andra tidpunkter.
Hyperglykemi
Otillräcklig dosering eller avbruten behandling kan, speciellt vid typ 1-diabetes, leda till hyperglykemi och diabetesketoacidos. De första symtomen på hyperglykemi utvecklas vanligtvis gradvis under några timmar eller dagar. De omfattar törst, ökad miktionsfrekvens, illamående, kräkningar, dåsighet, rodnad och torr hud, muntorrhet, nedsatt aptit samt acetonluktande andedräkt. Vid typ 1-diabetes leder obehandlad hyperglykemi så småningom till diabetesketoacidos, som är potentiellt letal.
Hypoglykemi
En överhoppad måltid eller en oplanerad större fysisk ansträngning kan leda till hypoglykemi.
Hypoglykemi kan uppträda om insulindosen är för hög i förhållande till insulinbehovet. Vid hypoglykemi eller om hypoglykemi misstänks får NovoMix inte injiceras. Efter att patientens blodglukos stabiliserats bör justering av dosen övervägas.
Jämfört med bifasiskt humant insulin kan NovoMix 30 ha en mera uttalad blodglukossänkande effekt upp till 6 timmar efter injektion. Det kan vara nödvändigt att kompensera detta för den enskilde patienten genom en justering av insulindosen och/eller matintaget.
Patienter med väsentligt förbättrad blodglukoskontroll, t ex genom intensifierad insulinbehandling, kan uppleva att deras vanliga varningssymtom på hypoglykemi förändras och bör få råd med hänsyn till detta. De vanliga varningssymtomen kan utebli hos patienter som haft diabetes under lång tid.
Intensifierad blodglukoskontroll kan öka förutsättningen för hypoglykemiska reaktioner och kräver därför särskild uppmärksamhet under dosintensifieringen.
Eftersom NovoMix 30 bör administreras i omedelbar anslutning till måltid ska det snabba anslaget beaktas hos patienter med samtidig sjukdom eller behandling, där en fördröjd absorption av föda kan förväntas.
Samtidig sjukdom, särskilt infektioner och febersjukdomar, ökar vanligen patientens insulinbehov. Vid samtidig sjukdom i njure, lever eller som påverkar binjurar, hypofys eller sköldkörtel kan dosjustering bli aktuell.
Vid byte mellan olika typer av insulinpreparat kan de tidiga varningssymtomen på hypoglykemi vara mindre uttalade eller annorlunda än de symtom som patienten fått med tidigare använt insulin.
Övergång från andra insulinpreparat
En övergång till en ny typ eller ett annat märke av insulin måste ske under noggrann medicinsk övervakning. Dosjusteringar kan krävas vid förändringar av styrka, märke (tillverkare), typ, ursprung (animalt insulin, humant insulin eller insulinanalog) och/eller tillverkningsmetod (rekombinant-DNA teknik eller animalt ursprung). För patienter som går över till NovoMix 30 från en annan typ av insulin kan antalet injektioner per dag behöva ökas eller dosen behöva justeras jämfört med deras tidigare insulinpreparat. Om dosjustering erfordras, kan detta visa sig vid första dosen eller under de första veckorna eller månaderna.
Reaktioner på injektionsstället
I likhet med annan insulinbehandling kan reaktioner på injektionsstället uppträda och ge smärta, rodnad, urticaria, inflammation, blåmärke, svullnad och klåda. Genom att hela tiden välja nytt injektionsställe inom injektionsområdet minskar risken att utveckla dessa reaktioner. De försvinner normalt inom några få dagar eller veckor. I sällsynta fall kan reaktionerna leda till att behandlingen med NovoMix 30 måste upphöra.
Hud och subkutan vävnad
Patienterna måste instrueras att kontinuerligt växla injektionsställe för att minska risken för lipodystrofi och kutan amyloidos. Det finns en potentiell risk för fördröjd insulinabsorption och försämrad glykemisk kontroll efter insulininjektioner på ställen där dessa reaktioner förekommer. En plötslig ändring av injektionsställe till ett intakt område har visat sig resultera i hypoglykemi. Övervakning av blodsockervärdena rekommenderas efter ändring av injektionsställe från ett påverkat område till ett intakt område. Justering av dosen diabetesläkemedel kan också behövas.
Kombination av NovoMix med pioglitazon
Fall av hjärtsvikt har rapporterats när pioglitazon använts i kombination med insulin, särskilt hos patienter med riskfaktorer för att utveckla hjärtsvikt. Detta ska beaktas om man överväger kombinationsbehandling med pioglitazon och NovoMix. Om kombinationen används ska patienten observeras med avseende på tecken och symtom på hjärtsvikt, viktuppgång och ödem. Behandlingen med pioglitazon ska avbrytas om försämring av hjärtsymtomen inträffar.
Undvika oavsiktlig förväxling/felmedicinering
Patienter måste instrueras att alltid kontrollera insulinetiketten före varje injektion för att undvika oavsiktlig förväxling mellan NovoMix och andra insulinprodukter.
Insulinantikroppar
Administrering av insulin kan ge upphov till bildning av insulinantikroppar. I sällsynta fall kan en justering av insulindosen vara nödvändig vid närvaron av sådana insulinantikroppar för att korrigera en tendens till hyper- eller hypoglykemi.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Ett antal läkemedel kan påverka glukosmetabolismen.
Följande substanser kan minska patientens insulinbehov:
Perorala diabetesmedel, GLP-1-receptoragonister, MAO-hämmare, beta-receptorblockerande medel, ACE-hämmare, salicylater, anabola steroider och sulfonamider.
Följande substanser kan öka patientens insulinbehov:
Perorala antikonceptionsmedel, tiazider, glukokortikoider, tyreoideahormoner, sympatomimetika, tillväxthormon och danazol.
Beta-receptorblockerande medel kan maskera symtomen på hypoglykemi.
Oktreotid/lanreotid kan antingen öka eller minska insulinbehovet.
Alkohol kan intensifiera eller reducera den hypoglykemiska effekten av insulin.
Graviditet
Den kliniska erfarenheten av användning av NovoMix 30 under graviditet är begränsad.
Reproduktionsstudier på djur har inte visat på några skillnader mellan insulin aspart och humant insulin med avseende på embryotoxicitet eller teratogenicitet.
I allmänhet rekommenderas intensifierad blodglukoskontroll och övervakning av gravida kvinnor med diabetes under hela graviditeten och vid planering av graviditet. Insulinbehovet minskar i regel under den första trimestern och ökar därefter under den andra och tredje trimestern. Efter förlossningen återgår insulinbehovet snabbt till nivån före graviditeten.
Amning
Det finns inga begränsningar för behandling med NovoMix 30 under amning. Insulinbehandling av den ammande modern medför ingen risk för barnet. Dosen NovoMix 30 kan dock behöva justeras.
Fertilitet
Reproduktionsstudier på djur har inte visat på några skillnader mellan insulin aspart och humant insulin med avseende på fertilitet.
Trafik
Patientens koncentrations- och reaktionsförmåga kan försämras till följd av hypoglykemi. Detta kan innebära en risk i situationer där denna förmåga är särskilt viktig (t ex när man kör bil eller hanterar maskiner).
Patienter ska rådas att vidta åtgärder för att undvika hypoglykemi under bilkörning eller vid hantering av maskiner. Detta gäller särskilt patienter som ofta drabbas av hypoglykemi eller har svårt att känna igen varningssignaler och för dem som ofta har episoder med hypoglykemi. I dessa fall bör man överväga lämpligheten av bilkörning och hantering av maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De biverkningar som observerats hos patienter som använder NovoMix beror främst på den farmakologiska effekten av insulin aspart.
Den under behandling vanligast rapporterade biverkningen är hypoglykemi. Frekvensen av hypoglykemi varierar med patientpopulation, doseringsregim och den glykemiska kontrollens nivå, se Beskrivning av utvalda biverkningar nedan.
I början av insulinbehandlingen kan refraktionsanomalier, ödem och reaktioner på injektionsstället (smärta, rodnad, urtikaria, inflammation, blåmärke, svullnad och klåda på injektionsstället) uppträda. Dessa reaktioner är vanligtvis övergående. Snabb förbättring av blodglukoskontrollen kan medföra akut smärtsam neuropati som vanligtvis är reversibel. En intensifierad insulinbehandling med en plötslig förbättring av den glykemiska kontrollen kan vara förenad med en tillfällig försämring av diabetesretinopati, medan förbättrad glykemisk kontroll under lång tid minskar risken för vidareutveckling av diabetesretinopati.
Biverkningslista i tabellform
Biverkningarna uppställda nedan är baserade på data från kliniska prövningar och klassificerade efter frekvens och organsystem enligt MedDRA. Frekvenskategorier definieras enligt följande konvention: Mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000); mycket sällsynta (<1/10 000); ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Immunsystemet |
Mindre vanliga – Urtikaria, hudutslag |
|
Mycket sällsynta – Anafylaktisk reaktion* |
|
|
Metabolism och nutrition |
Mycket vanliga – Hypoglykemi* |
|
Centrala och perifera nervsystemet |
Sällsynta – Perifer neuropati (smärtsam neuropati) |
|
Ögon |
Mindre vanliga – Refraktionsrubbningar |
|
Mindre vanliga – Diabetesretinopati |
|
|
Hud och subkutan vävnad |
Mindre vanliga – Lipodystrofi* |
|
Ingen känd frekvens – Kutan amyloidos*† |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mindre vanliga – Ödem |
|
Mindre vanliga – Reaktioner på injektionsstället |
* se Beskrivning av utvalda biverkningar
† Biverkningar rapporterade efter marknadsföring
Beskrivning av utvalda biverkningar
Anafylaktiska reaktioner:
Uppträdande av allmänna överkänslighetsreaktioner (inkluderande generaliserade hudutslag, klåda, svettning, gastrointestinala besvär, angioneurotiskt ödem, andningssvårigheter, palpitation och sänkt blodtryck) är mycket sällsynt men kan vara potentiellt livshotande.
Hypoglykemi:
Den vanligast rapporterade biverkningen är hypoglykemi. Detta tillstånd kan uppstå om insulindosen är för hög i förhållande till insulinbehovet. Allvarlig hypoglykemi kan leda till medvetslöshet och/eller konvulsioner och kan orsaka tillfällig eller permanent nedsättning av hjärnfunktionen eller till och med dödsfall. Symtomen på hypoglykemi uppträder vanligtvis plötsligt. De kan omfatta kallsvettning, sval blek hy, matthet, nervositet eller tremor, oro, ovanlig trötthet eller svaghet, förvirring, koncentrationssvårigheter, dåsighet, uttalad hunger, synförändringar, huvudvärk, illamående och hjärtklappning.
I kliniska prövningar varierade biverkningsfrekvensen med patientpopulation, doseringsregim och den glykemiska kontrollens nivå. I kliniska prövningar skiljer inte den totala förekomsten av hypoglykemi mellan patienter behandlade med insulin aspart jämfört med patienter behandlade med humant insulin.
Hud och subkutan vävnad:
Lipodystrofi (inkluderande lipohypertrofi, lipoatrofi) och kutan amyloidos kan förekomma vid injektionsstället och fördröja den lokala insulinabsorptionen. Kontinuerlig växling av injektionsställe inom det angivna injektionsområdet kan bidra till att minska eller förhindra dessa reaktioner.
Pediatrisk population
Uppföljning efter marknadsföring samt kliniska prövningar tyder inte på att biverkningar i den pediatriska populationen skiljer sig med avseende på frekvens, typ och svårighetsgrad vid jämförelse med den bredare erfarenhet som finns från den allmänna populationen.
Övriga speciella populationer
Uppföljning efter marknadsföring och kliniska prövningar tyder inte på att biverkningar hos äldre patienter och patienter med nedsatt njur- eller leverfunktion skiljer sig vid jämförelse med den bredare erfarenhet som finns från den allmänna populationen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
För insulin finns ingen specifik överdos definierad. Hypoglykemi kan utvecklas gradvis om för hög dos administreras i förhållande till patientens behov:
-
Episoder med lindrig hypoglykemi kan behandlas genom peroral administrering av glukos eller med produkter med socker i. Det rekommenderas därför att patienter med diabetes alltid bär med sig sockerhaltiga produkter.
-
Episoder med svår hypoglykemi, där patienten förlorat medvetandet, kan behandlas med glukagon (0,5–1 mg), som ges intramuskulärt eller subkutant av en person som lärt sig tekniken eller med glukos som ges intravenöst av läkare eller sjuksköterska. Glukos måste ges intravenöst om patienten inte svarar på glukagon inom 10–15 minuter. När patienten återfår medvetandet rekommenderas att kolhydrater ges peroralt för att förhindra återfall.
Farmakodynamik
NovoMix 30 är en bifasisk suspension av 30% lösligt insulin aspart (analog till humant insulin med snabbt anslag) och 70% protamin-kristalliserat insulin aspart (analog till humant insulin med medellång duration).
Verkningsmekanism och farmakodynamisk effekt
Den blodglukossänkande effekten av insulin aspart beror på att glukosupptaget underlättas då insulin binds till receptorer på muskel- och fettceller samt på att glukosfrisättning från levern samtidigt hämmas.
NovoMix 30 är ett bifasiskt preparat av insulin, som innehåller 30% lösligt insulin aspart. Detta insulin har ett snabbt anslag och kan därför ges närmare en måltid (0–10 minuter från måltiden) jämfört med lösligt humant insulin. Den kristallina fasen (70%) består av protamin-kristalliserat insulin aspart, som har en verkningsprofil liknande den för humant isofant (NPH) insulin.
När NovoMix 30 injiceras subkutant, sker anslaget inom 10–20 minuter efter injektionen. Den maximala effekten uppnås 1–4 timmar efter injektionen och durationen är upp till 24 timmar (Figur 1).
Glukos-
infusionshastighet
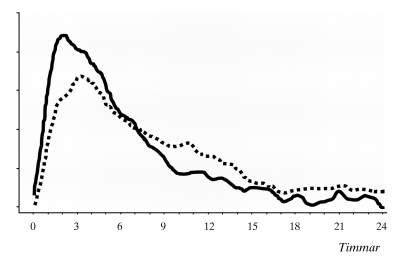
Figur 1: Verkningsprofil för NovoMix 30 (___) och bifasiskt humant insulin 30 (---) hos friska personer.
Klinisk effekt och säkerhet
I en 3-månaders prövning på patienter med typ 1- och typ 2-diabetes gav NovoMix 30 lika bra kontroll över glykosylerat hemoglobin som bifasiskt humant insulin 30. Insulin aspart är ekvipotent med humant insulin baserat på molvikt. Jämfört med bifasiskt humant insulin 30 gav NovoMix 30 doserat före frukost och middag lägre postprandiala blodglukosnivåer efter båda måltiderna (frukost och middag).
En metaanalys omfattande nio prövningar med typ 1- och typ 2-diabetes visade att faste-plasmaglukos var högre hos patienter som behandlades med NovoMix 30 än hos patienter som behandlades med bifasiskt humant insulin 30.
I en prövning randomiserades 341 patienter med typ 2-diabetes till behandling med antingen enbart NovoMix 30 eller i kombination med metformin eller med metformin i kombination med en sulfonureid. Den primära effektvariabeln – HbA1c efter 16 veckors behandling – skiljde sig ej hos patienter med NovoMix 30 kombinerat med metformin och patienter med metformin och sulfonureid. I denna prövning hade 57% av patienterna ett utgångsvärde på HbA1c som var över 9%. För dessa patienter resulterade behandling med NovoMix 30 i kombination med metformin i signifikant lägre HbA1c-värden jämfört med metformin i kombination med sulfonureid.
I en prövning randomiserades patienter med typ 2-diabetes, otillräckligt kontrollerade med enbart perorala diabetesmedel, till behandling två gånger dagligen med NovoMix 30 (117 patienter) eller en gång dagligen med insulin glargin (116 patienter). Efter 28 veckors behandling enligt doseringsriktlinjerna, var den genomsnittliga minskningen i HbA1c 2,8% med NovoMix 30 (medelvärdet vid baslinjen = 9,7%). Med NovoMix 30 uppnådde 66% resp. 42% av patienterna värden på HbA1c under 7% resp. 6,5%. Faste-plasmaglukos reducerades i genomsnitt med cirka 7 mmol/l (från 14,0 mmol/l vid baslinjen till 7,1 mmol/l).
Hos patienter med typ 2-diabetes visade en metaanalys på en minskad risk för nattliga och svåra hypoglykemiska händelser med NovoMix 30 jämfört med bifasiskt humant insulin 30. Risken för hypoglykemiska händelser under dagtid ökade hos patienter som behandlades med NovoMix 30.
Pediatrisk population
I en 16-veckors klinisk prövning på 167 patienter i åldern 10–18 år jämfördes postprandial glykemisk kontroll vid måltidsrelaterad behandling med NovoMix 30 med måltidsrelaterad behandling med humant insulin/bifasiskt humant insulin 30 och NPH-insulin vid sänggående. Medelvärdet av HbA1c förblev samma som vid baslinjen under hela prövningen i båda behandlingsgrupperna och det var ingen skillnad i frekvensen hypoglykemier med NovoMix 30 eller bifasiskt humant insulin 30.
I en mindre (54 patienter) och yngre (6–12 år) patientgrupp, behandlad i en dubbel-blind, cross-over prövning (12 veckor med varje behandling) var frekvensen av hypoglykemiska episoder och postprandial glukosökning signifikant lägre med NovoMix 30 jämfört med bifasiskt humant insulin 30. Slutlig HbA1c var signifikant lägre i gruppen som behandlats med bifasiskt humant insulin 30 jämfört med NovoMix 30.
Farmakokinetik
Absorption, distribution och elimination
I insulin aspart är aminosyran prolin ersatt med asparaginsyra i position B28 och därmed minskar tendensen att hexamerer som kan ses med lösligt humant insulin bildas. Insulin aspart i den lösliga fasen av NovoMix 30 utgör 30% av det totala insulinet; detta absorberas snabbare från den subkutana vävnaden än den lösliga insulinkomponenten i bifasiskt humant insulin. De återstående 70% är i kristallin form som protamin-kristalliserat insulin aspart; detta insulin har en utdragen absorptionsprofil liknande den för humant isofant (NPH) insulin.
Maximal insulinkoncentration i serum är i genomsnitt 50% högre med NovoMix 30 än med bifasiskt humant insulin 30. Tiden till maximal koncentration är i genomsnitt hälften av motsvarande tid för bifasiskt humant insulin 30. Hos friska försökspersoner uppnåddes en genomsnittlig maximal serumkoncentration på 140 ± 32 pmol/l cirka 60 minuter efter en subkutan dos på 0,20 enheter/kg kroppsvikt. Den genomsnittliga halveringstiden (t½) för NovoMix 30, som återspeglar absorptionshastigheten av den protaminbundna fraktionen, var cirka 8–9 timmar. Insulinnivåerna i serum återgick till ursprunglig nivå 15–18 timmar efter en subkutan dos. Hos patienter med typ 2-diabetes uppnåddes maximal koncentration cirka 95 minuter efter dosering och koncentrationer över ursprunglig nivå uppmättes under minst 14 timmar efter dosering.
Speciella populationer
Farmakokinetiken för NovoMix 30 har inte studerats hos äldre eller hos patienter med nedsatt njur- eller leverfunktion.
Pediatrisk population
Farmakokinetiken för NovoMix 30 har inte studerats hos barn och ungdomar. De farmakokinetiska och farmakodynamiska egenskaperna hos lösligt insulin har emellertid undersökts hos barn (6–12 år) och ungdomar (13–17 år) med typ 1-diabetes. Insulin aspart absorberades snabbt i båda åldersgrupperna, med samma tmax som hos vuxna. Cmax var emellertid olika i de olika grupperna, vilket visar betydelsen av individuell titrering av insulin aspart.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, allmän toxicitet, gentoxicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Vid test in vitro, t ex av bindning till insulin- och IGF-1-receptorer och effekter på celltillväxt, betedde sig insulin aspart mycket likt humant insulin. Studier visar också att dissociationen av insulin asparts bindning till insulinreceptorn är samma som för humant insulin.
Innehåll
Kvalitativ och kvantitativ sammansättning
NovoMix 30 Penfill
1 ml av suspensionen innehåller 100 enheter lösligt insulin aspart*/protamin-kristalliserat insulin aspart* i förhållandet 30/70 (vilket motsvarar 3,5 mg). 1 cylinderampull innehåller 3 ml, vilket motsvarar 300 enheter.
NovoMix 30 FlexPen
1 ml av suspensionen innehåller 100 enheter lösligt insulin aspart*/protamin-kristalliserat insulin aspart* i förhållandet 30/70 (vilket motsvarar 3,5 mg). 1 förfylld injektionspenna innehåller 3 ml, vilket motsvarar 300 enheter.
*Insulin aspart är framställt i Saccharomyces cerevisiae genom rekombinant-DNA teknologi.
För fullständig förteckning över hjälpämnen se nedan.
Förteckning över hjälpämnen
Glycerol
Fenol
Metakresol
Zinkklorid
Dinatriumfosfatdihydrat
Natriumklorid
Protaminsulfat
Saltsyra (för pH-justering)
Natriumhydroxid (för pH-justering)
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas ska detta läkemedel inte blandas med andra läkemedel.
Miljöpåverkan
Insulin, aspart (lösligt)
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Insulin, aspart, protamin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
Obruten förpackning: 2 år.
Under användning eller medtagen som reserv: Läkemedlet kan förvaras i högst 4 veckor.
Särskilda förvaringsanvisningar
Obruten förpackning: Förvaras i kylskåp (2°C–8°C). Förvaras ej nära kylelement. Får ej frysas.
NovoMix 30 Penfill
Under användning eller medtagen som reserv: Förvaras vid högst 30°C. Förvaras ej i kylskåp. Får ej frysas.
Förvara cylinderampullen i ytterkartongen. Ljuskänsligt.
NovoMix 30 FlexPen
Under användning eller medtagen som reserv: Förvaras vid högst 30°C.Förvaras ej i kylskåp. Får ej frysas.
Förvara FlexPen med pennhuven påsatt. Ljuskänsligt.
Särskilda anvisningar för destruktion
När NovoMix 30 Penfill eller NovoMix 30 FlexPen tagits ur kylskåpet bör NovoMix Penfill 30 eller eller NovoMix 30 FlexPen uppnå rumstemperatur innan insulinet omblandas enligt den instruktion som gäller för första användningstillfället.
Använd inte läkemedlet om den omblandade injektionsvätskan inte är jämnt vit, grumlig och vattenaktig.
Nödvändigheten av att omblanda NovoMix 30 omedelbart före användning måste framhållas för patienten.
NovoMix 30 som varit fryst får ej användas.
Patienten bör instrueras att kassera injektionsnålen efter varje injektion.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Injektionsnålar, cylinderampuller och förfyllda injektionspennor får inte delas med någon annan.
Cylinderampullen får ej återfyllas.
Förpackningsinformation
NOVOMIX® 30 FLEXPEN®
Injektionsvätska, suspension i förfylld injektionspenna 100 E/ml
(vit, grumlig suspension)
5 x 3 milliliter förfylld injektionspenna, 355:68, F
NOVOMIX® 30 PENFILL®
Injektionsvätska, suspension, cylinderampull 100 E/ml
(vit, grumlig suspension)
5 x 3 milliliter cyl.-amp., 332:46, F
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, suspension i förfylld injektionspenna 100 E/ml





