Indikationer
Brilique, givet tillsammans med acetylsalicylsyra (ASA), är indicerat för prevention av aterotrombotiska händelser hos vuxna patienter med
-
akut koronart syndrom (AKS) eller
-
tidigare hjärtinfarkt och hög risk för att utveckla en aterotrombotisk händelse (se avsnitt Dosering och Farmakodynamik).
Kontraindikationer
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll (se avsnitt Biverkningar).
-
Aktiv patologisk blödning
-
Tidigare genomgången intrakraniell blödning (se avsnitt Biverkningar)
-
Svårt nedsatt leverfunktion (se avsnitt Dosering, Varningar och försiktighet och Farmakokinetik)
-
Samtidig administrering av tikagrelor och starka CYP3A4-hämmare (till exempel ketokonazol, klaritromycin, nefazodon, ritonavir och atazanavir), eftersom samtidig administrering kan leda till en avsevärd ökning av exponeringen för tikagrelor (se avsnitt Interaktioner).
Dosering
Dosering
Patienter som tar Brilique ska även ta en daglig låg underhållsdos av ASA 75‑150 mg, såvida detta ej är specifikt kontraindicerat.
Akut koronart syndrom
Behandling med Brilique ska påbörjas med en laddningsdos på 180 mg (två tabletter à 90 mg) och därefter fortsättas med 90 mg två gånger dagligen. För patienter med akut koronart syndrom rekommenderas behandling med Brilique 90 mg två gånger dagligen i 12 månader om inte utsättning är kliniskt indicerad (se avsnitt Farmakodynamik).
Utsättning av ASA kan övervägas efter 3 månader hos patienter med AKS som har genomgått en perkutan koronar intervention (PCI) och har en ökad risk för blödning. I så fall ska tikagrelor som trombocytaggregationshämmande monoterapi fortsättas i 9 månader (se avsnitt Varningar och försiktighet).
Tidigare hjärtinfarkt
Brilique 60 mg två gånger dagligen är den rekommenderade dosen vid behov av förlängd behandling för patienter som haft hjärtinfarkt för minst ett år sedan och löper hög risk för ny aterotrombotisk händelse (se avsnitt Farmakodynamik). Behandling kan startas utan avbrott som fortsättningsbehandling efter den inledande ettåriga behandlingen med Brilique 90 mg eller behandling med en annan adenosindifosfat (ADP)-receptorhämmare för patienter som haft akut koronart syndrom och löper hög risk för att utveckla en ny aterotrombotisk händelse. Behandling kan även inledas upp till 2 år efter en hjärtinfarkt eller inom ett år efter utsättning av föregående behandling med ADP-receptorhämmare. Det finns begränsat med data kring effekt och säkerhet för tikagrelor bortom 3 års förlängd behandling.
Om byte behövs, bör den första dosen av Brilique administreras 24 timmar efter den sista dosen av det andra trombocythämmande läkemedlet.
Missad dos
Avbrott i behandlingen bör också undvikas. Om en patient missar en dos Brilique ska patienten endast ta en tablett (nästa dos) vid nästa ordinarie tillfälle.
Speciella populationer
Äldre
Ingen dosjustering krävs för äldre (se avsnitt Farmakokinetik).
Nedsatt njurfunktion
Ingen dosjustering behövs för patienter med nedsatt njurfunktion (se avsnitt Farmakokinetik).
Nedsatt leverfunktion
Tikagrelor har ej studerats på patienter med svårt nedsatt leverfunktion och användning till dessa patienter är därför kontraindicerad (se avsnitt Kontraindikationer). Det finns endast begränsad information tillgänglig för patienter med måttligt nedsatt leverfunktion. Dosjustering rekommenderas inte, men tikagrelor bör användas med försiktighet (se avsnitt Varningar och försiktighet och Farmakokinetik). Ingen dosjustering behövs för patienter med lätt nedsatt leverfunktion (se avsnitt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt av tikagrelor för barn under 18 år har inte fastställts. Det finns ingen relevant användning av tikagrelor hos barn med sickelcellssjukdom (se avsnitt Farmakodynamik och Farmakokinetik).
Administreringssätt
För oral användning.
Brilique kan administreras med eller utan mat. För patienter som inte kan svälja tabletten/tabletterna hela kan tabletterna krossas till ett fint pulver som blandas i ett halvt glas vatten och dricks omedelbart. Glaset ska sköljas med ytterligare ett halvt glas vatten och innehållet drickas. Blandningen kan även administreras via en nasogastrisk sond (CH8 eller större). Det är viktigt att spola igenom den nasogastriska sonden med vatten efter att blandningen har administrerats.
Varningar och försiktighet
Blödningsrisk
Användningen av tikagrelor till patienter med känd förhöjd blödningsrisk måste vägas mot nyttan i termer av prevention av aterotrombotiska händelser (se avsnitt Biverkningar och Farmakodynamik). Om tikagrelor är kliniskt indicerat ska det användas med försiktighet till följande patientgrupper:
-
Patienter med benägenhet för blödning (till exempel på grund av nyligen genomgånget trauma, nyligen genomgånget kirurgiskt ingrepp, koagulationsrubbningar, aktiv eller nyligen aktiv gastrointestinal blödning) eller som har ökad risk för trauma. Användning av tikagrelor är kontraindicerad till patienter med aktiv patologisk blödning, till dem med en tidigare genomgången intrakraniell blödning och till patienter med svårt nedsatt leverfunktion (se avsnitt Kontraindikationer).
-
Patienter med samtidig administrering av läkemedel som kan ge en förhöjd blödningsrisk (till exempel icke-steroida antiinflammatoriska läkemedel (NSAIDs), orala antikoagulantia och/eller fibrinolytika) inom 24 timmar från administreringen av tikagrelor.
I två randomiserade kontrollerade studier (TICO och TWILIGHT), på patienter med AKS som har genomgått ett PCI-ingrepp med en läkemedelsavgivande stent, har utsättning av ASA efter 3 månaders dubbel trombocytaggregationshämmande behandling med tikagrelor och ASA (dual antiplatelet therapy, DAPT) och fortsatt trombocytaggregationshämmande monoterapi med tikagrelor (single antiplatelet therapy, SAPT) i 9 respektive 12 månader visat sig minska risken för blödning utan observerad ökning av risken för allvarliga kardiovaskulära händelser (major adverse cardiovascular events, MACE) jämfört med fortsatt DAPT. Beslutet att sätta ut ASA efter 3 månader och fortsätta med tikagrelor som trombocytaggregationshämmande monoterapi i 9 månader hos patienter med ökad risk för blödning ska baseras på klinisk bedömning med beaktande av risken för blödning jämfört med risken för trombotiska händelser (se avsnitt Dosering).
Trombocyttransfusion upphävde inte den trombocythämmande effekten av tikagrelor hos friska försökspersoner och det är osannolikt att det är av klinisk nytta för patienter med blödning. Eftersom samtidig administrering av tikagrelor och desmopressin ej reducerade blödningstiden, är det ej sannolikt att desmopressin är effektivt för hantering av kliniska blödningshändelser (se avsnitt Interaktioner).
Antifibrinolytiska läkemedel (aminokapronsyra eller tranexamsyra) och/eller rekombinant faktor VIIa-behandling kan eventuellt öka hemostasen. Tikagrelor kan sättas in på nytt när blödningsorsaken har identifierats och bringats under kontroll.
Kirurgiska ingrepp
Patienterna ska rådas att informera läkare och tandläkare om att de står på tikagrelor innan något ingrepp bokas in och innan något nytt läkemedel tas i användning.
Patienter i PLATO-studien som genomgick kranskärlskirurgi och som behandlades med tikagrelor hade fler blödningar än patienter som behandlades med klopidogrel när läkemedlet sattes ut inom 1 dag före ingreppet men hade en likartad frekvens av större blödningar jämfört med klopidogrel när behandlingen sattes ut 2 eller flera dagar före ingreppet (se avsnitt Biverkningar). Om en patient ska genomgå elektiv kirurgi och den trombocythämmande effekten ej är önskvärd, ska tikagrelor sättas ut 5 dagar före ingreppet (se avsnitt Farmakodynamik).
Patienter med tidigare ischemisk stroke
Patienter med akut koronart syndrom och tidigare ischemisk stroke kan behandlas med tikagrelor i upp till 12 månader (PLATO-studien).
Patienter med tidigare hjärtinfarkt och tidigare ischemisk stroke inkluderades inte i PEGASUS-studien. Då dessa data saknas kan behandling längre än ett år inte rekommenderas för dessa patienter.
Nedsatt leverfunktion
Användning av tikagrelor är kontraindicerad för patienter med svårt nedsatt leverfunktion (se avsnitt Dosering och Kontraindikationer). Det finns begränsad erfarenhet av tikagrelor hos patienter med måttligt nedsatt leverfunktion och därför rekommenderas försiktighet för dessa patienter (se avsnitt Dosering och Farmakokinetik).
Patienter med risk för bradykardi
Holter EKG‑monitorering har visat en ökad frekvens av mestadels asymptomatiska ventrikulära pauser vid behandling med tikagrelor jämfört med klopidogrel. Patienter med förhöjd risk för bradykardi (till exempel patienter utan pacemaker som har sjuk sinusknuta, AV-block II eller III eller bradykardirelaterad synkope) uteslöts från de huvudstudier som utvärderade säkerhet och effekt för tikagrelor. Med tanke på den begränsade kliniska erfarenheten ska tikagrelor därför användas med försiktighet till dessa patienter, (se avsnitt Farmakodynamik).
Dessutom bör försiktighet iakttas vid samtidig administrering av tikagrelor och läkemedel som är kända för att inducera bradykardi. Någon evidens för kliniskt signifikanta biverkningar observerades dock inte i PLATO-studien efter samtidig administrering av ett eller flera läkemedel som är kända för att inducera bradykardi (till exempel 96 % betablockerare, 33 % kalciumkanalblockerarna diltiazem och verapamil och 4 % digoxin) (se avsnitt Interaktioner).
Under Holter-substudien i PLATO fick fler patienter ventrikulära pauser ≥3 sekunder med tikagrelor än med klopidogrel under den akuta fasen av deras AKS. Ökningen av Holter-detekterade ventrikulära pauser med tikagrelor var högre hos patienter med kronisk hjärtsvikt än i den totala studiepopulationen under den akuta fasen av AKS, men inte efter en månad med tikagrelor eller jämfört med klopidogrel. Det fanns inga negativa kliniska konsekvenser förenade med denna obalans (inklusive synkope och pacemakerinsättning) i denna patientpopulation (se avsnitt Farmakodynamik).
Fall av bradyarytmier och AV-block har rapporterats efter godkännande för försäljning hos patienter som tar tikagrelor (se avsnitt Biverkningar), i första hand hos patienter med ACS där myokardischemi och samtidiga läkemedel som sänker hjärtfrekvensen eller påverkar ledningsförmågan i hjärtat är potentiella störande faktorer. Patientens kliniska tillstånd och samtidig medicinering bör utvärderas som potentiella orsaker före justering av behandling.
Dyspné
Dyspné rapporterades för patienter som behandlades med tikagrelor. Dyspnén är vanligen av lätt till måttlig intensitet och ger ofta med sig utan att det krävs någon utsättning av behandlingen. Patienter med astma/kroniskt obstruktiv lungsjukdom (KOL) kan ha en förhöjd absolut risk för dyspné vid behandling med tikagrelor. Tikagrelor ska användas med försiktighet till patienter med astma och/eller KOL i anamnesen. Mekanismen har inte klargjorts. Om en patient rapporterar ny, långvarig eller förvärrad dyspné ska detta utredas fullständigt och om behandlingen med tikagrelor inte tolereras ska den avbrytas. För mer information, se avsnitt Biverkningar.
Central sömnapné
Central sömnapné inklusive Cheyne-Stokes andning har rapporterats efter godkännande för försäljning hos patienter som tar tikagrelor. Vid misstanke om central sömnapné bör ytterligare klinisk utvärdering övervägas.
Förhöjda kreatininvärden
Kreatininvärden kan stiga under behandling med tikagrelor. Mekanismen har inte klargjorts. Njurfunktionen ska kontrolleras i enlighet med klinisk praxis. För patienter med akut koronart syndrom rekommenderas att njurfunktionen även kontrolleras en månad efter insättningen av behandlingen med tikagrelor, varvid speciell uppmärksamhet ska ges till patienter ≥ 75 år, patienter med måttligt/svårt nedsatt njurfunktion och de som får samtidig behandling med en angiotensinreceptorblockerare (ARB).
Förhöjda urinsyravärden
Hyperurikemi kan förekomma under behandling med tikagrelor (se avsnitt Biverkningar). Försiktighet bör iakttas när det gäller patienter med hyperurikemi eller giktartrit i anamnesen. Som en försiktighetsåtgärd avrådes användning av tikagrelor till patienter med urinsyranefropati.
Trombotisk trombocytopen purpura (TTP)
I mycket sällsynta fall har trombotisk trombocytopen purpura (TTP) rapporterats vid behandling med tikagrelor. TTP karakteriseras av trombocytopeni och mikroangiopatisk hemolytisk anemi associerad med antingen neurologiska fynd, njursvikt eller feber. TTP är ett potentiellt dödligt tillstånd som kräver snabbt insättande av behandling inklusive plasmaferes.
Interferens med trombocytfunktionstest för att diagnostisera heparininducerad trombocytopeni (HIT)
I trombocytaggregationstest (heparin induced platelet activation test, HIPA‑test), som används för att diagnostisera HIT, aktiverar antikroppar mot trombocytfaktor 4/heparinantikroppar i patientserum trombocyterna från friska donatorer i närvaro av heparin.
Falskt negativt resultat i trombocytfunktionstest (inklusive men inte begränsat till HIPA-test) för HIT har rapporterats hos patienter som fått tikagrelor. Detta är relaterat till att tikagrelor, som finns i patientens serum/plasma, hämmar P2Y12-receptorn på de friska donatortrombocyterna i testet. Information om samtidig behandling med tikagrelor krävs för tolkning av trombocytfunktionstester för HIT.
Hos patienter som har utvecklat HIT bör nytta-riskförhållandet för fortsatt behandling med tikagrelor utvärderas, både med hänsyn till det protrombotiska tillståndet för HIT och den ökade risken för blödning med samtidig antikoagulant- och tikagrelorbehandling.
Övrigt
Baserat på ett samband som observerades i PLATO-studien mellan underhållsdosen av ASA och den relativa effekten av tikagrelor jämfört med klopidogrel, rekommenderas ej samtidig administrering av tikagrelor och en hög underhållsdos av ASA (> 300 mg) (se avsnitt Farmakodynamik).
För tidig utsättning
För tidig utsättning av trombocythämmande behandling, inklusive Brilique, skulle kunna leda till en förhöjd risk för kardiovaskulär död, hjärtinfarkt eller stroke till följd av patientens bakomliggande sjukdom. För tidigt avslutad behandling bör därför undvikas.
Natrium
Brilique innehåller mindre än 1 mmol (23 mg) natrium per dosenhet, d.v.s. är näst intill “natriumfritt”.
Interaktioner
Tikagrelor är primärt ett CYP3A4-substrat och en svag CYP3A4-hämmare. Tikagrelor är även ett P-glykoprotein (P-gp)-substrat och en svag P-gp-hämmare och kan öka exponeringen för P-gp-substrat.
Effekter av läkemedel och andra produkter på Tikagrelor
CYP3A4-hämmare
-
Starka CYP3A4-hämmare – Samtidig administrering av ketokonazol och tikagrelor ökade Cmax och AUC för tikagrelor med faktor 2,4 respektive 7,3. Cmax och AUC för den aktiva metaboliten reducerades med 89 % respektive 56 %. Andra starka CYP3A4-hämmare (klaritromycin, nefazodon, ritonavir och atazanavir) förväntas ha liknande effekter, och samtidig användning av starka CYP3A4-hämmare med tikagrelor är därför kontraindicerad (se avsnitt Kontraindikationer).
-
Måttliga CYP3A4-hämmare – Samtidig administrering av diltiazem och tikagrelor ökade Cmax för tikagrelor med 69 % och AUC med faktor 2,7 och sänkte Cmax för den aktiva metaboliten med 38 % medan AUC var oförändrad. Tikagrelor hade ingen effekt på plasmanivåerna av diltiazem. Övriga måttliga CYP3A4-hämmare (till exempel amprenavir, aprepitant, erytromycin och flukonazol) förväntas ha en liknande effekt och kan således administreras tillsammans med tikagrelor.
-
En fördubbling av exponeringen för tikagrelor observerades efter daglig konsumtion av stora mängder grapefruktjuice (3 x 200 ml). En ökad exponering av denna storleksordning förväntas inte vara kliniskt relevant för de flesta patienter.
CYP3A4‑inducerare
Samtidig administrering av rifampicin och tikagrelor sänkte Cmax och AUC för tikagrelor med 73 % respektive 86 %. Cmax för den aktiva metaboliten var oförändrad medan AUC sänktes med 46 %. Övriga CYP3A-inducerare (till exempel fenytoin, karbamazepin och fenobarbital) förväntas minska exponeringen för tikagrelor. Samtidig administrering av tikagrelor och potenta CYP3A-inducerare kan minska exponering och effekt av tikagrelor, därför avråds samtidig användning av tikagrelor.
Cyklosporin (P-gp- och CYP3‑hämmare)
Samtidig administrering av cyklosporin (600 mg) och tikagrelor ökade Cmax och AUC för tikagrelor med 2,3 gånger respektive 2,8 gånger. AUC för den aktiva metaboliten ökade med 32 % och Cmax minskade med 15 % i närvaro av cyklosporin.
Det finns inga tillgängliga data om samtidig användning av tikagrelor och andra aktiva substanser som också är potenta P-gp-hämmare och måttliga CYP3A4‑hämmare (till exempel verapamil, kinidin) som även kan öka exponeringen för tikagrelor. Om kombinationen inte kan undvikas, ska samtidig användning ske med försiktighet.
Övriga läkemedel
Klinisk-farmakologiska interaktionsstudier har visat att samtidig administrering av tikagrelor och heparin, enoxaparin och ASA eller desmopressin inte hade någon effekt på farmakokinetiken för tikagrelor eller den aktiva metaboliten eller på den ADP-inducerade trombocytaggregationen jämfört med enbart tikagrelor. Om de är kliniskt indicerade ska läkemedel som påverkar hemostasen användas med försiktighet i kombination med tikagrelor.
En fördröjd och minskad exponering för orala P2Y12-hämmare, inklusive tikagrelor och dess aktiva metabolit har observerats hos patienter med AKS som behandlades med morfin (35 % reduktion av tikagrelorexponering). Denna interaktion kan ha samband med minskad gastrointestinal motilitet och gäller för andra opioider. Den kliniska relevansen är okänd, men data indikerar potentialen för minskad tikagreloreffekt hos patienter som samtidigt får tikagrelor och morfin. Hos patienter med AKS, som inte kan göra uppehåll med morfin och för vilka snabb P2Y12-hämning bedöms som avgörande, kan användning av en parenteral P2Y12-hämmare övervägas.
Effekter av tikagrelor på andra läkemedel
Läkemedel som metaboliseras av CYP3A4
-
Simvastatin – Samtidig administrering av tikagrelor och simvastatin ökade Cmax för simvastatin med 81 % och AUC med 56 % och ökade Cmax för simvastatinsyra med 64 % och AUC med 52 %, med ökningar för vissa individer med en faktor 2 till 3. Samtidig administrering av tikagrelor och simvastatindoser överstigande 40 mg dagligen skulle kunna ge simvastatin-biverkningar och måste vägas mot den potentiella nyttan. Simvastatin hade ingen effekt på plasmanivåerna av tikagrelor. Tikagrelor kan eventuellt ha liknande effekt på lovastatin. Användning av tikagrelor i kombination med doser av simvastatin eller lovastatin över 40 mg rekommenderas ej.
-
Atorvastatin – Samtidig administrering av atorvastatin och tikagrelor ökade Cmax för atorvastatinsyra med 23 % och AUC med 36 %. Liknande höjningar av AUC och Cmax observerades för alla atorvastatinsyrametaboliter. Höjningarna betraktas ej som kliniskt signifikanta.
-
En liknande effekt på andra statiner som metaboliseras av CYP3A4 kan inte uteslutas. Patienter i PLATO-studien som behandlades med tikagrelor tog en rad olika statiner, utan några bekymmer för någon koppling till statinsäkerheten bland de 93 % av PLATO-kohorten som tog dessa läkemedel.
Tikagrelor är en svag CYP3A4-hämmare. Samtidig administrering av tikagrelor och CYP3A4-substrat med smala terapeutiska index (det vill säga cisaprid eller ergotalkaloider) rekommenderas ej, eftersom tikagrelor kan öka exponeringen av dessa läkemedel.
P-gp-substrat (inklusive digoxin, cyklosporin)
Samtidig administrering av tikagrelor ökade Cmax för digoxin med 75 % och AUC med 28 %. Medeldalnivåerna av digoxin ökade cirka 30 % vid samtidig administrering med tikagrelor, med vissa enskilda maximala ökningar upp till faktor 2. I närvaro av digoxin påverkades inte Cmax och AUC för tikagrelor och dess aktiva metabolit. Därför rekommenderas lämplig klinisk övervakning och/eller laboratorieövervakning när man ger P-gp-beroende läkemedel med smalt terapeutiskt index, såsom digoxin, samtidigt med tikagrelor.
Tikagrelor hade ingen effekt på blodnivåerna av cyklosporin. Effekten av tikagrelor på andra P-gp-substrat har inte studerats.
Läkemedel som metaboliseras av CYP2C9
Samtidig administrering av tikagrelor och tolbutamid ledde ej till några förändringar i plasmanivåerna av något av läkemedlen, vilket tyder på att tikagrelor inte är en CYP2C9-hämmare och att det inte är troligt att det skulle påverka den CYP2C9-medierade metaboliseringen av läkemedel som warfarin och tolbutamid.
Rosuvastatin
Tikagrelor kan påverka den renala utsönderingen av rosuvastatin vilket ökar risken för ackumulering av rosuvastatin. Även om den exakta mekanismen inte är känd ledde samtidig användning av tikagrelor och rosuvastatin i vissa fall till nedsatt njurfunktion, förhöjd CPK-nivå och rabdomyolys.
Orala antikonceptionsmedel
Samtidig administrering av tikagrelor och levonorgestrel och etinylöstradiol ökade exponeringen för etinylöstradiol med cirka 20 % men påverkade ej farmakokinetiken för levonorgestrel. Ingen kliniskt relevant påverkan på effekten av orala antikonceptionsmedel förväntas när levonorgestrel och etinylöstradiol administreras samtidigt med tikagrelor.
Läkemedel kända för att inducera bradykardi
Till följd av observationer av mestadels asymptomatiska ventrikulära pauser och bradykardi bör försiktighet iakttas vid samtidig administrering av tikagrelor och läkemedel som är kända att inducera bradykardi (se avsnitt Varningar och försiktighet). Någon evidens för kliniskt signifikanta biverkningar observerades dock ej i PLATO-studien efter samtidig administrering av ett eller flera läkemedel som är kända att inducera bradykardi (till exempel 96 % betablockerare, 33 % kalciumkanalblockerarna diltiazem och verapamil och 4 % digoxin).
Andra samtidigt administrerade läkemedel
I kliniska studier administrerades tikagrelor ofta tillsammans med ASA, protonpumpshämmare, statiner, betablockerare, angiotensinkonverterande enzym (ACE)-hämmare och angiotensinreceptorblockerare allt efter behov mot olika samtidiga sjukdomstillstånd under lång tid, och även heparin, lågmolekylärt heparin och intravenösa GpIIb/IIIa-hämmare under korta behandlingstider (se avsnitt Farmakodynamik). Ingen evidens för kliniskt signifikanta negativa interaktioner observerades med dessa läkemedel.
Samtidig administrering av tikagrelor och heparin, enoxaparin eller desmopressin hade ingen effekt på aktiverad partiell tromboplastintid (aPTT), aktiverad koagulationstid (ACT) eller faktor Xa-analyser. På grund av potentiella farmakodynamiska interaktioner ska emellertid försiktighet iakttas vid samtidig administrering av tikagrelor och läkemedel kända för att påverka hemostasen.
Till följd av rapporter om kutana blödningsrubbningar med selektiva serotoninåterupptagshämmare (SSRI) (till exempel paroxetin, sertralin och citalopram) rekommenderas försiktighet vid administrering av SSRI tillsammans med tikagrelor eftersom detta kan öka blödningsrisken.
Graviditet
Det finns inga eller begränsad mängd data från användningen av tikagrelor i gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter). Tikagrelor rekommenderas inte under graviditet.
Amning
Tillgängliga farmakodynamiska/toxikologiska djurdata har visat att tikagrelor och dess aktiva metaboliter utsöndras i mjölk (se Prekliniska uppgifter). En risk för nyfödda/spädbarn kan inte uteslutas. Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med tikagrelor efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Tikagrelor saknade effekt på fertiliteten hos han- och hondjur (se Prekliniska uppgifter).
Fertila kvinnor
Kvinnor i fertil ålder ska använda adekvat preventivmetod för att undvika graviditet under behandling med tikagrelor.
Trafik
Tikagrelor har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Vid behandling med tikagrelor har yrsel och förvirring rapporterats. Därför bör patienter som upplever dessa symtom vara försiktiga när de framför fordon eller använder maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerhetsprofilen för tikagrelor har utvärderats i två stora utfallsstudier i fas 3 (PLATO och PEGASUS) som inkluderade fler än 39 000 patienter (se avsnitt Farmakodynamik).
I PLATO avbröt en större andel av patienterna behandlade med tikagrelor behandlingen på grund av biverkningar än de behandlade med klopidogrel (7,4 % mot 5,4 %). I PEGASUS avbröt en större andel av patienter behandlade med tikagrelor behandlingen på grund av biverkningar jämfört med patienter behandlade med enbart ASA(16,1 % för tikagrelor 60 mg tillsammans med ASA jämfört med 8,5 % för enbart ASA-behandlade patienter). De vanligaste rapporterade biverkningarna hos patienter som behandlades med tikagrelor var blödning och dyspné (se avsnitt Varningar och försiktighet).
Biverkningstabell
Följande biverkningar har identifierats i studier eller har rapporterats vid erfarenhet efter godkännande för försäljning med tikagrelor (Tabell 1).
Biverkningarna listas enligt MedDRAs organsystemklass (SOC). Inom varje organsystem rangordnas biverkningarna efter frekvenskategori. Frekvenskategorierna är definierade enligt följande konventioner: Mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 1 – Biverkningar efter frekvens och organsystemklass (SOC)
|
SOC |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Ingen känd frekvens |
|---|---|---|---|---|
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
|
|
Tumörblödningara |
|
|
Blodet och lymfsystemet |
Blödning vid blodrubbningarb |
|
|
Trombotisk trombocytopen purpurac |
|
Immunsystemet |
|
|
Överkänslighet inklusive angioödemc |
|
|
Metabolism och nutrition |
Hyperurikemid |
Gikt/giktartrit |
|
|
|
Psykiska störningar |
|
|
Förvirring |
|
|
Centrala och perifera nervsystemet |
|
Yrsel, synkope, huvudvärk |
Intrakraniell blödningm |
|
|
Ögon |
|
|
Ögonblödninge |
|
|
Öron och balansorgan |
|
Vertigo |
Öronblödning |
|
|
Hjärtat |
Bradyarytmi, AV-block |
|||
|
Blodkärl |
|
Hypotoni |
|
|
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné |
Blödning i respiratoriska systemetf |
|
|
|
Magtarmkanalen |
|
Gastrointestinal blödningg, diarré, illamående, dyspepsi, förstoppning |
Retroperitoneal blödning |
|
|
Hud och subkutan vävnad |
|
Subkutan eller dermal blödningh, utslag, klåda |
|
|
|
Muskuloskeletala systemet och bindväv |
|
|
Muskelblödningari |
|
|
Njurar och urinvägar |
|
Urinvägsblödningj |
|
|
|
Reproduktionsorgan och bröstkörtel |
|
|
Blödningar i reproduktionssystemk |
|
|
Undersökningar |
|
Förhöjt blodkreatinind |
|
|
|
Skador och förgiftningar och behandlings-komplikationer |
|
Blödning efter ingrepp, traumatiska blödningarl |
|
|
a T.ex. blödning från blåscancer, gastrisk cancer, koloncancer
b T.ex. ökad tendens att få blåmärken, spontana hematom, blödningsdiates
c Identifierat i rapporter efter godkännande för försäljning
d Frekvenser härledda från laboratorieobservationer (Stegring av urinsyra till > övre normalgränsen från ett initialt värde under eller inom referensintervall. Kreatininhöjningar på >50 % från initialt värde.) och inte ursprunglig biverkningsrapportfrekvens.
e T.ex. konjunktival, retinal, intraokulär blödning
f T.ex. epistaxis, hemoptys
g T.ex. gingival blödning, rektal blödning, magsårsblödning
h T.ex. ekkymos, hudblödning, petekier
i T.ex. hemartros, muskelblödning
j T.ex. hematuri, cystitblödning
k T.ex. vaginal blödning, hematospermi, postmenopausal blödning
l T.ex. kontusion, traumatiskt hematom, traumatisk blödning
m D.v.s. spontan, procedurrelaterad eller traumatisk intrakraniell blödning
Beskrivning av utvalda biverkningar
Blödning
Blödningsfynd i PLATO
Det totala utfallet av blödningsfrekvenser i PLATO-studien visas i Tabell 2.
Tabell 2 Analys av totala blödningshändelser, Kaplan‑Meier-beräkningar vid 12 månader (PLATO)
|
|
Tikagrelor 90 mg
N=9 235 |
Klopidogrel N=9 186 |
p-värde* |
|
PLATO totalt större |
11,6 |
11,2 |
0,4336 |
|
PLATO större fatala/livshotande |
5,8 |
5,8 |
0,6988 |
|
Icke-CABG-relaterad PLATO större |
4,5 |
3,8 |
0,0264 |
|
Icke-procedurrelaterad PLATO större |
3,1 |
2,3 |
0,0058 |
|
PLATO totalt större + mindre |
16,1 |
14,6 |
0,0084 |
|
Icke-procedurrelaterad PLATO större + mindre |
5,9 |
4,3 |
<0,0001 |
|
TIMI-definierad större |
7,9 |
7,7 |
0,5669 |
|
TIMI-definierad större + mindre |
11,4 |
10,9 |
0,3272 |
Definitioner av blödningskategorier:
Större fatal/livshotande blödning: Kliniskt påtaglig med en sänkning av hemoglobin på >50 g/l eller transfusion av ≥4 erytrocytenheter; eller fatal; eller intrakraniell; eller intraperikardiell med hjärttamponad; eller med hypovolemisk chock eller svår hypotoni som kräver blodtryckshöjande medel eller kirurgi.
Större annan: Kliniskt påtaglig med en sänkning av hemoglobin på 30-50 g/l eller transfusion av 2-3 erytrocytenheter; eller signifikant funktionsnedsättning.
Mindre blödning: Medicinsk intervention krävs för att stoppa eller behandla blödning.
TIMI större-blödning: Kliniskt påtaglig med en sänkning av hemoglobin på >50 g/l eller intrakraniell blödning.
TIMI mindre-blödning: Kliniskt påtaglig med en sänkning av hemoglobin på 30-50 g/l.
*p-värde beräknat från Cox proportionella riskmodell med behandlingsgrupp som enda förklarande variabel
Tikagrelor och klopidogrel skilde sig inte i fråga om frekvenser för PLATO större fatal/livshotande blödning, PLATO total större-blödning, TIMI större-blödning eller TIMI mindre-blödning (tabell 2). Det förekom dock fler PLATO kombinerade större + mindre-blödningar med tikagrelor jämfört med klopidogrel. Få patienter i PLATO hade fatala blödningar: 20 (0,2 %) för tikagrelor och 23 (0,3 %) för klopidogrel (se avsnitt Varningar och försiktighet).
Varken ålder, kön, vikt, ras, geografisk region, samtidiga sjukdomstillstånd, samtidig behandling eller sjukdomshistoria, inklusive en tidigare stroke eller transient ischemisk attack, gav någon prediktion av vare sig total blödning eller PLATO-definerad icke-procedurrelaterad större blödning. Således identifierades ej någon speciell riskgrupp för någon undergrupp av blödningar.
CABG-relaterad blödning:
I PLATO fick 42 % av de 1 584 patienter (12 % av kohorten) som genomgick kranskärlskirurgi en PLATO större fatal/livshotande blödning utan någon skillnad mellan behandlingsgrupperna. Fatal CABG-blödning förekom hos 6 patienter i varje behandlingsgrupp (se avsnitt Varningar och försiktighet).
Icke-CABG-relaterad blödning och icke-procedurrelaterad blödning:
Brilique och klopidogrel skilde sig inte i fråga om PLATO-definierad icke-CABG större fatal/livshotande blödning, men PLATO-definierad total större-blödning, TIMI större och TIMI större + mindre-blödning var vanligare med tikagrelor. När alla procedurrelaterade blödningar togs bort förekom det på likartat sätt fler blödningar med tikagrelor än med klopidogrel (tabell 2). Utsättning av behandlingen på grund av icke-procedurrelaterad blödning var vanligare för tikagrelor (2,9 %) än för klopidogrel (1,2 %; p<0,001).
Intrakraniell blödning:
Det förekom fler icke-procedurrelaterade intrakraniella blödningar med tikagrelor (n=27 blödningar hos 26 patienter, 0,3 %) än med klopidogrel (n=14 blödningar, 0,2 %), av vilka 11 blödningar med tikagrelor och 1 med klopidogrel var fatala. Det förelåg ingen skillnad i det totala antalet fatala blödningar.
Blödningsfynd i PEGASUS
Totalt utfall av blödningshändelser i PEGASUS‑studien visas i tabell 3.
Tabell 3 – Analys av totala blödningshändelser, Kaplan‑Meier‑beräkningar vid 36 månader (PEGASUS)
|
|
Tikagrelor 60 mg två gånger dagligen + ASA N=6 958 |
Enbart ASA N=6 996 |
|
|
|
Säkerhetseffektmått |
KM% |
Riskkvot (95 % KI) |
KM% |
p‑värde |
|
TIMI‑definierade blödningskategorier |
||||
|
TIMI större |
2,3 |
2,32 (1,68, 3,21) |
1,1 |
<0,0001 |
|
Fatal |
0,3 |
1,00 (0,44, 2,27) |
0,3 |
1,0000 |
|
Intrakraniell blödning |
0,6 |
1,33 (0,77, 2,31) |
0,5 |
0,3130 |
|
Övriga TIMI större |
1,6 |
3,61 (2,31, 5,65) |
0,5 |
<0,0001 |
|
TIMI större eller mindre |
3,4 |
2,54 (1,93, 3,35) |
1,4 |
<0,0001 |
|
TIMI större eller mindre eller som kräver läkarvård |
16,6 |
2,64 (2,35, 2,97) |
7,0 |
<0,0001 |
|
PLATO‑definierade blödningskategorier |
||||
|
PLATO större |
3,5 |
2,57 (1,95, 3,37) |
1,4 |
<0,0001 |
|
Fatal/livshotande |
2,4 |
2,38 (1,73, 3,26) |
1,1 |
<0,0001 |
|
Övriga PLATO större |
1,1 |
3,37 (1,95, 5,83) |
0,3 |
<0,0001 |
|
PLATO större eller mindre |
15,2 |
2,71 (2,40, 3,08) |
6,2 |
<0,0001 |
Blödningskategoridefinitioner:
TIMI större: Fatal blödning, ELLER intrakraniell blödning, ELLER kliniskt uppenbara tecken på blödning associerat med ett hemoglobinfall (Hgb) på ≥50 g/l, eller när Hgb inte är tillgängligt, ett hematokritfall (Hct) på 15 %.
Fatal: En blödningshändelse som leder direkt till döden inom 7 dagar.
Övriga TIMI större: Icke‑fatal icke‑intrakraniell TIMI större blödning.
TIMI mindre: Kliniskt påtaglig med 30-50 g/l sänkning av hemoglobin.
TIMI som kräver läkarvård: Kräver intervention, ELLER leder till sjukhusvård, ELLER måste bedömas.
PLATO större fatal/livshotande: Fatal blödning, ELLER en intrakraniell blödning, ELLER intraperikardiell med hjärttamponad, ELLER med hypovolemisk chock eller allvarlig hypotoni som kräver blodtryckshöjande/inotropa läkemedel eller operation ELLER kliniskt påtaglig med >50 g/l sänkning av hemoglobin eller transfusion av ≥4 enheter av röda blodkroppar.
PLATO större övriga: Signifikant funktionsnedsättande, ELLER kliniskt påtaglig med 30-50 g/l sänkning av hemoglobin, ELLER transfusion av 2-3 enheter erytrocyter.
PLATO mindre: Kräver medicinsk intervention för att stoppa eller behandla blödning.
I PEGASUS var TIMI större blödning för tikagrelor 60 mg två gånger dagligen vanligare än för enbart ASA. Ingen ökad blödningsrisk sågs för fatal blödning och endast en mindre ökning observerades för intrakraniella blödningar, jämfört med enbart ASA‑behandling. Det var få fatala blödningshändelser i studien, 11 (0,3 %) för tikagrelor 60 mg och 12 (0,3 %) för enbart ASA-behandling. Den observerade ökade risken för TIMI större blödning med tikagrelor 60 mg berodde främst på en högre frekvens av övriga TIMI större blödningar som berodde på händelser i magtarmkanalen (organsystemklass).
Ökade blödningsmönster liknande TIMI större sågs även för blödningskategorierna TIMI större eller mindre, för PLATO större och för PLATO större eller mindre (se tabell 3). Utsättning av behandlingen på grund av blödning var vanligare med tikagrelor 60 mg jämfört med enbart ASA‑behandling (6,2 % respektive 1,5 %). De flesta av dessa blödningar var av lägre allvarlighetsgrad (klassificerade som TIMI som kräver läkarvård), t.ex. epistaxis, blåmärken och hematom.
Blödningsprofilen för tikagrelor 60 mg var enhetlig för flera predefinierade undergrupper (t.ex. ålder, kön, vikt, etnicitet, geografisk region, samsjuklighet, samtidig behandling och sjukdomshistoria) för blödningshändelserna TIMI större, TIMI större eller mindre och PLATO större.
Intrakraniell blödning:
Spontana intrakraniella blödningar rapporterades med likartade frekvenser för tikagrelor 60 mg och enbart ASA-behandling (n=13, 0,2 % i båda behandlingsgrupperna). Traumatiska och procedurrelaterade intrakraniella blödningar visade en mindre ökning vid behandling med tikagrelor 60 mg (n=15, 0,2 %) jämfört med enbart ASA‑behandling (n=10, 0,1 %). Det förekom 6 fatala intrakraniella blödningar med tikagrelor 60 mg och 5 fatala intrakraniella blödningar med enbart ASA‑behandling. Incidensen för intrakraniell blödning var låg i båda behandlingsgrupperna med tanke på den signifikanta komorbiditeten och den undersökta populationens kardiovaskulära riskfaktorer.
Dyspné
Dyspné, en känsla av andnöd, rapporteras av patienter som behandlas med tikagrelor. Biverkningar av dyspnétyp (dyspné, vilodyspné, ansträngningsdyspné, paroxysmal nattlig dyspné och nattlig dyspné) rapporterades i PLATO sammanlagt av 13,8 % av patienterna som behandlades med tikagrelor och av 7,8 % av patienterna som behandlades med klopidogrel. Prövarna i PLATO-studien bedömde att dyspnén hade ett orsakssamband med behandlingen hos 2,2 % av patienterna som tog tikagrelor och 0,6 % av dem som tog klopidogrel och få dyspnésymtom var allvarliga (0,14 % tikagrelor; 0,02 % klopidogrel) (se avsnitt Varningar och försiktighet). De flesta dyspnésymtomen var av lätt till måttlig intensitet, och de flesta rapporterades som en enstaka episod tidigt efter det att behandlingen hade inletts.
Jämfört med klopidogrel kan patienter med astma/KOL som behandlas med tikagrelor ha en förhöjd risk för icke allvarlig dyspné (3,29 % tikagrelor jämfört med 0,53 % klopidogrel) och allvarlig dyspné (0,38 % tikagrelor jämfört med 0,00 % klopidogrel). I absoluta termer var denna risk högre än i den totala PLATO-populationen. Tikagrelor ska användas med försiktighet till patienter med astma och/eller KOL i anamnesen (se avsnitt Varningar och försiktighet).
Cirka 30 % av episoderna gav med sig inom 7 dagar. PLATO inkluderade patienter med hjärtsvikt, KOL eller astma vid baseline; det var mer sannolikt att dessa patienter, samt äldre, rapporterade dyspné. För tikagrelor avbröt 0,9 % av patienterna behandlingen med studiens aktiva substans på grund av dyspné jämfört med 0,1 % av dem som tog klopidogrel. Den högre incidensen av dyspné med tikagrelor är inte förenad med nyutvecklad eller försämrad hjärt- eller lungsjukdom (se avsnitt Varningar och försiktighet). Tikagrelor påverkar inte lungfunktionstester.
I PEGASUS rapporterades dyspné hos 14,2 % av patienterna som tog tikagrelor 60 mg två gånger dagligen och hos 5,5 % av patienterna som tog enbart ASA. Precis som i PLATO var den rapporterade dyspnén oftast av lätt till måttlig intensitet (se avsnitt Varningar och försiktighet). Patienter som rapporterade dyspné tenderade att vara äldre och hade oftare dyspné, KOL eller astma vid inklusion.
Undersökningar
Urinsyrastegringar: I PLATO steg urinsyra i serum över den övre normalgränsen hos 22 % av patienterna som behandlades med tikagrelor jämfört med 13 % av patienterna som fick klopidogrel. Motsvarande siffror i PEGASUS var 9,1 %, 8,8 % respektive 5,5 % för tikagrelor 90 mg, 60 mg respektive placebo. Medelvärdet för urinsyra i serum ökade cirka 15 % med tikagrelor jämfört med cirka 7,5 % med klopidogrel och sjönk, efter det att behandlingen hade avbrutits, till cirka 7 % med tikagrelor, men utan att någon sänkning observerades för klopidogrel. I PEGASUS sågs en reversibel ökning av medelnivåerna av urinsyra i serum på 6,3 % respektive 5,6 % för tikagrelor 90 mg respektive 60 mg, jämfört med en sänkning på 1,5 % i placebogruppen. I PLATO var frekvensen för giktartrit 0,2 % för tikagrelor jämfört med 0,1 % för klopidogrel. Motsvarande siffror för gikt/giktartrit i PEGASUS var 1,6 %, 1,5 % respektive 1,1 % för tikagrelor 90 mg, 60 mg respektive placebo.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Tikagrelor tolereras väl i enstaka doser på upp till 900 mg. Gastrointestinal toxicitet var dosbegränsande i en studie med enstaka ökande doser. Andra kliniskt betydelsefulla biverkningar som kan förekomma vid överdosering innefattar dyspné och ventrikulära pauser (se avsnitt Biverkningar).
I händelse av en överdosering kan ovanstående potentiella biverkningar förekomma och EKG-övervakning ska övervägas.
Det finns för närvarande ingen känd antidot för att upphäva effekterna av tikagrelor, och tikagrelor är inte dialyserbart (se avsnitt Farmakokinetik). Behandling av överdosering bör följa vanlig lokal medicinsk praxis. Den förväntade effekten av alltför hög dosering av tikagrelor är en förlängd varaktighet för den blödningsrisk som är förenad med trombocythämning. Det är osannolikt att trombocyttransfusion är av klinisk nytta för patienter med blödning (se avsnitt Varningar och försiktighet). Om blödning uppträder ska andra lämpliga understödjande åtgärder vidtas.
Farmakodynamik
Verkningsmekanism
Brilique innehåller tikagrelor, som ingår i den kemiska klassen cyklopentyltriazolopyrimidiner (CPTP) och är en oral, direktverkande, selektiv och reversibel P2Y12-receptorantagonist som förhindrar ADP-medierad P2Y12-beroende trombocytaktivering och aggregation. Tikagrelor förhindrar inte ADP-bindning, men när det är bundet till P2Y12-receptorn förhindrar tikagrelor ADP-inducerad signaltransduktion. Eftersom trombocyter deltar i initiering och/eller utveckling av trombotiska komplikationer vid aterosklerotisk sjukdom har hämning av trombocytfunktionen visats minska risken för kardiovaskulära händelser, såsom dödsfall, hjärtinfarkt eller stroke.
Tikagrelor ökar också lokala endogena adenosinnivåer genom att hämma den ekvilibrativa nukleosidtransportören-1 (ENT-1).
Tikagrelor har visats förstärka följande adenosininducerade effekter hos friska försökspersoner och hos patienter med akut koronart syndrom: vasodilatation (mätt genom ökningar av koronarblodflödet hos friska frivilliga och patienter med akut koronart syndrom; huvudvärk), hämning av trombocytfunktion (i humant helblod in vitro) och dyspné. Man har dock inte tydligt kunnat klarlägga någon koppling mellan de observerade ökningarna av adenosin och de kliniska effekterna (t.ex. morbiditet-mortalitet).
Farmakodynamisk effekt
Insättning av farmakologisk effekt
Hos patienter med stabil kranskärlssjukdom (CAD) som står på ASA uppvisar tikagrelor ett snabbt anslag för den farmakologiska effekten, vilket visas av ett medelvärde för hämningen av trombocytaggregationen (IPA) för tikagrelor på cirka 41 % 0,5 timmar efter en laddningsdos på 180 mg, med en maximal IPA-effekt på 89 % 2-4 timmar efter administrering, och effekten bibehålls mellan 2 till 8 timmar. 90 % av patienterna hade en slutlig IPA > 70 % 2 timmar efter administrering.
Avtagande av farmakologisk effekt
Om kranskärlskirurgi (CABG) planeras är blödningsrisken för tikagrelor förhöjd jämfört med klopidogrel om läkemedlet sätts ut inom mindre än 96 timmar före ingreppet.
Information om byte av läkemedel
Byte från klopidogrel 75 mg till tikagrelor 90 mg två gånger dagligen leder till en absolut IPA-ökning på 26,4 % och byte från tikagrelor till klopidogrel leder till en absolut IPA-minskning på 24,5 %. Patienterna kan byta från klopidogrel till tikagrelor utan något avbrott i den trombocythämmande effekten (se avsnitt Dosering).
Klinisk effekt och säkerhet
Den kliniska evidensen för effekt och säkerhet för tikagrelor härleds från två fas 3‑prövningar:
-
PLATO [PLATelet Inhibition and Patient Outcomes]-studien, en jämförelse av tikagrelor och klopidogrel, båda givna i kombination med ASA och övrig standardbehandling.
-
PEGASUS TIMI‑54 [PrEvention with Tikagrelor of SecondAry Thrombotic Events in High‑RiSk AcUte Coronary Syndrome Patients]-studien, en jämförelse av tikagrelor kombinerat med ASA och enbart ASA-behandling.
PLATO-studien (akut koronart syndrom)
PLATO-studien omfattade 18 624 patienter som sökte inom 24 timmar från debut av symtom på instabil angina, icke-ST-höjningsinfarkt eller ST-höjningsinfarkt, och behandlades initialt medicinskt eller med PCI eller med CABG.
Klinisk effekt
Tillsammans med daglig basal ASA-behandling visade sig tikagrelor 90 mg två gånger dagligen vara överlägset 75 mg klopidogrel dagligen för att förhindra det sammansatta effektmåttet bestående av kardiovaskulär död, hjärtinfarkt eller stroke, varvid skillnaden utgjordes av kardiovaskulär död och hjärtinfarkt. Patienterna erhöll en laddningsdos på 300 mg klopidogrel (eventuellt 600 mg om de genomgått PCI) eller 180 mg tikagrelor.
Resultatet visade sig tidigt (absolut riskreduktion [ARR] 0,6 % och relativ riskreduktion [RRR] 12 % efter 30 dagar), med en konstant behandlingseffekt under hela tolvmånadersperioden som gav en ARR på 1,9 % per år med en RRR på 16 %. Detta tyder på att det är lämpligt att behandla patienterna med tikagrelor 90 mg två gånger dagligen i 12 månader (se avsnitt Dosering). Behandling av 54 patienter med akut kranskärlssjukdom med tikagrelor i stället för klopidogrel förhindrar 1 aterotrombotisk händelse; behandling av 91 förhindrar 1 kardiovaskulär död (se figur 1 och tabell 4).
Behandlingseffekten av tikagrelor jämfört med klopidogrel visar sig vara konsekvent i många undergrupper, inbegripet vikt; kön; diabetes mellitus, transient ischemisk attack eller icke-hemorragisk stroke eller revaskularisering i anamnesen, varvid samtidig behandling inbegriper hepariner, GpIIb/IIIa-hämmare och protonpumpshämmare (se avsnitt Interaktioner); diagnos vid slutlig indexhändelse (ST-höjningsinfarkt, icke-ST-höjningsinfarkt eller instabil angina); och den behandlingsmetod som avsågs användas vid randomisering (invasiv eller medicinsk).
En svagt signifikant behandlingsinteraktion med geografisk region observerades, vilket gör att riskkvoten (HR) för det primära effektmåttet är till tikagrelors fördel i resten av världen men till klopidogrels fördel i Nordamerika, vilket motsvarade cirka 10 % av hela den studerade populationen (p-värde för interaktionen = 0,045). En minskad effekt har observerats med tikagrelor vid ökande ASA-doser och explorativa analyser tyder på ett möjligt samband med ASA-dosen. Vid kronisk behandling med ASA tillsammans med tikagrelor bör den dagliga ASA-dosen ligga på 75-150 mg (se avsnitt Dosering och Varningar och försiktighet).
Figur 1 visar en uppskattning av tiden till en första förekomst av någon av de händelser som ingick i det sammansatta effektmåttet.
Figur 1. Analys av primärt kliniskt sammansatt effektmått för kardiovaskulär död, hjärtinfarkt och stroke (PLATO)
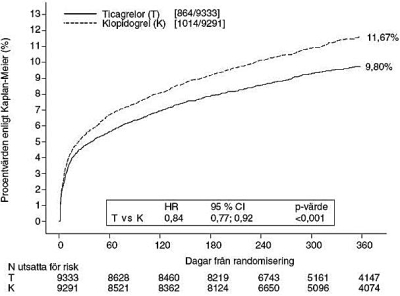
Tikagrelor reducerade förekomsten av det sammansatta primära effektmåttet jämfört med klopidogrel i både instabil angina/icke-ST-höjningsinfarkt- eller ST-höjningsinfarkt-populationen (Tabell 4). Brilique 90 mg två gånger dagligen kan således användas tillsammans med låg dos av ASA för patienter med akut koronart syndrom (instabil angina, icke-ST-höjningsinfarkt [NSTEMI] eller ST-höjningsinfarkt [STEMI]); inklusive patienter som behandlas med läkemedel, och patienter som behandlas med perkutan koronar intervention (PCI) eller kranskärlskirurgi (CABG).
Tabell 4 – Analys av primära och sekundära effektmått (PLATO)
|
Tikagrelor 90 mg två gånger dagligen (% patienter med händelse)N=9 333 |
Klopidogrel 75 mg en gång dagligen (% patienter med händelse) N=9 291 |
ARRa (%/år) |
RRRa (%) (95 % CI) |
p-värde |
|
|
Kardiovaskulär död, hjärtinfarkt (exkl. tyst infarkt) eller stroke |
9,3 |
10,9 |
1,9 |
16 (8, 23) |
0,0003 |
|
Invasiv avsikt |
8,5 |
10,0 |
1,7 |
16 (6, 25) |
0,0025 |
|
Medicinsk avsikt |
11,3 |
13,2 |
2,3 |
15 (0,3, 27) |
0,0444d |
|
Kardiovaskulär död |
3,8 |
4,8 |
1,1 |
21 (9, 31) |
0,0013 |
|
Hjärtinfarkt (exkl. tyst infarkt)b |
5,4 |
6,4 |
1,1 |
16 (5, 25) |
0,0045 |
|
Stroke |
1,3 |
1,1 |
-0,2 |
-17 (-52, 9) |
0,2249 |
|
Mortalitet av alla orsaker, hjärtinfarkt (exkl. tyst infarkt) eller stroke |
9,7 |
11,5 |
2,1 |
16 (8, 23) |
0,0001 |
|
Kardiovaskulär död, total hjärtinfarkt, stroke SRI, RI, TIA eller annan ATEc |
13,8 |
15,7 |
2,1 |
12 (5, 19) |
0,0006 |
|
Mortalitet av alla orsaker |
4,3 |
5,4 |
1,4 |
22 (11, 31) |
0,0003d |
|
Definitiv stenttrombos |
1,2 |
1,7 |
0,6 |
32 (8, 49) |
0,0123d |
aARR = absolut riskreduktion; RRR = relativ riskreduktion = (1-relativ risk) x 100 %. En negativ RRR indikerar en relativ riskökning.
bexklusive tyst hjärtinfarkt.
cSRI = svår recidiverande ischemi; RI = recidiverande ischemi; TIA = transient ischemisk attack; ATE = arteriell trombotisk händelse. Total hjärtinfarkt inkluderar tyst hjärtinfarkt, med datum för händelsen satt till det datum då den upptäcktes.
dnominellt signifikansvärde; alla övriga är formellt statistiskt signifikanta vid fördefinierad hierarkisk testning.
Den genetiska substudien i PLATO
CYP2C19- och ABCB1-genotypning av 10 285 patienter påvisade ett samband mellan genotypgrupper och resultaten i PLATO-studien. Överlägsenheten hos tikagrelor jämfört med klopidogrel när det gäller att minska större kardiovaskulära händelser påverkades inte signifikant av patientens CYP2C19- eller ABCB1-genotyp. I likhet med PLATO-huvudstudien skilde sig inte total PLATO större-blödning mellan tikagrelor och klopidogrel, oavsett CYP2C19- eller ABCB1-genotyp. Icke-CABG-relaterad PLATO större-blödning ökade med tikagrelor jämfört med klopidogrel hos patienter med en eller flera CYP2C19-alleler med förlorad funktion, men var likartad med den för klopidogrel hos patienter utan någon allel med förlorad funktion.
Kombinerat sammansatt effektmått för effekt och säkerhet
Ett kombinerat sammansatt effektmått för effekt och säkerhet (kardiovaskulär död, hjärtinfarkt, stroke eller PLATO-definierad ”totalt större” blödning) tyder på att effektvinsten för tikagrelor jämfört med klopidogrel inte uppvägs av större blödningshändelser (ARR 1,4 %, RRR 8 %, RR 0,92; p=0,0257) under 12 månader efter akut kranskärlssjukdom.
Klinisk säkerhet
Holter-substudie
För att studera förekomsten av ventrikulära pauser och andra arytmier under PLATO-studien genomförde prövarna Holter-monitorering i en undergrupp på nästan 3 000 patienter, av vilka cirka 2 000 registrerades både i den akuta fasen av deras akuta koronara syndrom och efter en månad. Den primära variabeln av intresse var förekomsten av ventrikulära pauser ≥ 3 sekunder. Fler patienter fick ventrikulära pauser med tikagrelor (6,0 %) än med klopidogrel (3,5 %) i den akuta fasen; och 2,2 % respektive 1,6 % efter 1 månad (se avsnitt Varningar och försiktighet). Ökningen av ventrikulära pauser i den akuta fasen av akut koronart syndrom var mer uttalad hos tikagrelorbehandlade patienter med en anamnes av kronisk hjärtsvikt (9,2 % jämfört med 5,4 % hos patienter utan anamnes av kronisk hjärtsvikt; för klopidogrelbehandlade patienter var den 4,0 % hos dem med anamnes av kronisk hjärtsvikt jämfört med 3,6 % hos dem utan anamnes av kronisk hjärtsvikt). Denna obalans förekom inte efter en månad: 2,0 % jämfört med 2,1 % för tikagrelorbehandlade patienter med respektive utan anamnes av kronisk hjärtsvikt; och 3,8 % jämfört med 1,4 % med klopidogrel. Det fanns dock inga negativa kliniska konsekvenser (vilket inkluderar insättning av pacemaker) förenade med denna obalans i denna patientpopulation.
PEGASUS-studien (tidigare hjärtinfarkt)
PEGASUS TIMI‑54‑studien var en händelsedriven, randomiserad, dubbelblind, placebokontrollerad, internationell multicenterstudie med parallella grupper som innefattade 21 162 patienter, för att utvärdera prevention av aterotrombotiska händelser med tikagrelor givet i 2 doser (antingen 90 mg två gånger dagligen eller 60 mg två gånger dagligen) kombinerat med låg dos av ASA (75-150 mg), jämfört med enbart ASA-behandling för patienter med tidigare hjärtinfarkt och ytterligare riskfaktorer för aterotrombos.
Patienter inkluderades om de var 50 år eller äldre med en tidigare hjärtinfarkt (1 till 3 år före randomisering), samt hade minst en av följande riskfaktorer för aterotrombos: ålder ≥ 65 år, diabetes mellitus som krävde medicinering, en andra tidigare hjärtinfarkt, evidens för flerkärlssjuka eller kroniskt nedsatt njurfunktion som inte var terminal.
Patienter exkluderades om man hade planerat att använda en P2Y12‑receptorantagonist, dipyridamol, cilostazol eller behandling med antikoagulantia under studieperioden; om de hade en blödningsrubbning, en tidigare ischemisk stroke eller intrakraniell blödning, en tumör i det centrala nervsystemet eller en intrakraniell vaskulär avvikelse; om de hade haft gastrointestinal blödning inom de föregående 6 månaderna eller en större operation inom de föregående 30 dagarna.
Klinisk effekt
Figur 2 – Analys av primärt kliniskt sammansatt effektmått för kardiovaskulär död, hjärtinfarkt och stroke (PEGASUS)
Tabell 5 – Analys av primära och sekundära effektmått (PEGASUS)
|
|
Tikagrelor 60 mg två gånger dagligen +ASA
|
Enbart ASA
|
p‑värde |
|||
|
Kännetecken |
Patienter med händelser |
KM % |
HR
|
Patienter med händelser |
KM % |
|
|
Primärt effektmått |
||||||
|
Sammansatt kardiovaskulär död/hjärtinfarkt/ stroke |
487 (6,9 %) |
7,8 % |
0,84
|
578 (8,2 %) |
9,0 % |
0,0043 (s) |
|
Kardiovaskulär död |
174 (2,5 %) |
2,9 % |
0,83
|
210 (3,0 %) |
3,4 % |
0,0676 |
|
Hjärtinfarkt |
285 (4,0 %) |
4,5 % |
0,84
|
338 (4,8 %) |
5,2 % |
0,0314 |
|
Stroke |
91 (1,3 %) |
1,5 % |
0,75
|
122 (1,7 %) |
1,9 % |
0,0337 |
|
Sekundära effektmått |
||||||
|
Kardiovaskulär död |
174 (2,5 %) |
2,9 % |
0,83
|
210 (3,0 %) |
3,4 % |
‑ |
|
Mortalitet av alla orsaker |
289 (4,1 %) |
4,7 % |
0,89 (0,76, 1,04) |
326 (4,6 %) |
5,2 % |
|
Riskkvot och p‑värden är beräknade separat för tikagrelor jämfört med enbart ASA från Cox proportionella riskmodell med behandlingsgruppen som den enda förklarande variabeln.
KM-procent beräknad vid 36 månader.
Obs! Antalet första händelser för komponenterna kardiovaskulär död, hjärtinfarkt och stroke är det faktiska antalet av första händelser för varje komponent och adderas inte till antalet händelser i det sammansatta effektmåttet.
(s) Indikerar statistisk signifikans.
KI = konfidensintervall; HR = riskkvot; KM = Kaplan‑Meier; N = antal patienter.
Både regimerna 60 mg två gånger dagligen och 90 mg två gånger dagligen av tikagrelor i kombination med ASA var överlägsna enbart ASA vid preventionen av aterotrombotiska händelser (sammansatt effektmått: kardiovaskulär död, hjärtinfarkt och stroke), med en enhetlig behandlingseffekt över hela studieperioden, vilket gav en RRR på 16 % och en ARR på 1,27 % för tikagrelor 60 mg och en RRR på 15 % och en ARR på 1,19 % för tikagrelor 90 mg.
Även om effektprofilerna för 90 mg och 60 mg var likartad, finns det evidens för att den lägre dosen har en bättre tolerabilitets‑ och säkerhetsprofil i relation till risken för blödning och dyspné. Därför rekommenderas endast Brilique 60 mg två gånger dagligen administrerat samtidigt med ASA för prevention av aterotrombotiska händelser (kardiovaskulär död, hjärtinfarkt och stroke) hos patienter med tidigare hjärtinfarkt och hög risk för att utveckla en aterotrombotisk händelse.
I relation till enbart ASA, reducerade tikagrelor 60 mg två gånger dagligen signifikant det primära sammansatta effektmåttet för kardiovaskulär död, hjärtinfarkt och stroke. Var och en av komponenterna bidrog till reduktionen av det primära sammansatta effektmåttet (kardiovaskulär död 17 % RRR, hjärtinfarkt 16 % RRR och stroke 25 % RRR).
RRR för det sammansatta effektmåttet från 1 till 360 dagar (17 % RRR) och från 361 dagar och därefter (16 % RRR) var likartad. Det finns begränsat med data kring effekt och säkerhet för Brilique bortom 3 års förlängd behandling.
Det fanns ingen evidens av fördelar (ingen reduktion av det primära sammansatta effektmåttet kardiovaskulär död, hjärtinfarkt och stroke, men en ökning av större blödningar) när tikagrelor 60 mg två gånger dagligen infördes på kliniskt stabila patienter > 2 år efter hjärtinfarkt eller mer än ett år efter utsättning av föregående behandling med ADP-receptorhämmare (se även avsnitt Dosering).
Klinisk säkerhet
Andelen utsättningar av tikagrelor 60 mg på grund av blödningar och dyspné var högre hos patienter >75 år (42 %) än hos yngre patienter (intervall: 23‑31 %) med en skillnad på mer än 10 % jämfört med placebo (42 % jämfört med 29 %) hos patienter >75 år.
Pediatrisk population
I en randomiserad, dubbelblind, parallellgrupp fas III-studie (HESTIA 3), randomiserades 193 pediatriska patienter (i åldrarna 2 år upp till 18 år) med sickelcellssjukdom för att antingen få placebo eller tikagrelor med doser på 15 mg till 45 mg två gånger dagligen beroende på kroppsvikt. Tikagrelor resulterade i ett medianvärde för trombocythämning på 35 % före dosering och 56 % 2 timmar efter dosering vid steady state.
Det fanns ingen behandlingsnytta av tikagrelor jämfört med placebo på andelen vaso-ocklusiva kriser.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Brilique för alla grupper av den pediatriska populationen för akut koronart syndrom (AKS) och tidigare hjärtinfarkt (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Tikagrelor uppvisar linjär farmakokinetik och exponeringen för tikagrelor och den aktiva metaboliten (AR-C124910XX) är ungefär dosproportionell upp till 1260 mg.
Absorption
Tikagrelor absorberas snabbt med ett medianvärde för tmax på cirka 1,5 timmar. Bildningen av den huvudsakliga cirkulerande metaboliten AR-C124910XX (också aktiv) från tikagrelor sker snabbt med ett medianvärde för tmax på cirka 2,5 timmar. Efter en oral engångsdos av tikagrelor 90 mg på fastande mage till friska försökspersoner är Cmax 529 ng/ml och AUC 3 451 ng*h/ml. Kvoterna metabolit/modersubstans är 0,28 för Cmax och 0,42 för AUC. Farmakokinetiken för tikagrelor och AR‑C124910XX hos patienter med tidigare hjärtinfarkt var generellt sett likartad med den i populationen med akut koronart syndrom. Baserat på en farmakokinetisk analys av populationen i PEGASUS‑studien var medianvärdet för Cmax 391 ng/ml och AUC var 3 801 ng*h/ml vid steady state för tikagrelor 60 mg. För tikagrelor 90 mg var Cmax 627 ng/ml och AUC var 6 255 ng*h/ml vid steady state.
Medelvärdet för den absoluta biotillgängligheten för tikagrelor uppskattades vara 36 %. Intag av en fettrik måltid ledde till en 21-procentig ökning av AUC för tikagrelor och en 22-procentig minskning av Cmax för den aktiva metaboliten men hade ej någon effekt på Cmax för tikagrelor eller AUC för den aktiva metaboliten. Dessa små förändringar anses ha minimal klinisk betydelse; därför kan tikagrelor tas med eller utan föda. Såväl tikagrelor som den aktiva metaboliten är P-gp-substrat.
Tikagrelor som krossade tabletter blandade i vatten och givet peroralt eller administrerat genom en nasogastrisk sond i magsäcken har en biotillgänglighet som är jämförbar med hela tabletter med avseende på AUC och Cmax för tikagrelor och den aktiva metaboliten. Den initiala exponeringen (0,5 och 1 timme efter dosering) från krossade tikagrelortabletter blandade i vatten var högre jämfört med hela tabletter, men därefter (2 till 48 timmar) en generellt identisk koncentrationsprofil.
Distribution
Distributionsvolymen för tikagrelor vid steady state är 87,5 l. Tikagrelor och den aktiva metaboliten binds i stor utsträckning till humant plasmaprotein (> 99,0 %).
Metabolism
CYP3A4 är det huvudsakliga enzym som ansvarar för metaboliseringen av tikagrelor och bildningen av den aktiva metaboliten, och deras interaktioner med andra CYP3A-substrat sträcker sig från aktivering till hämning.
Den huvudsakliga metaboliten av tikagrelor är AR-C124910XX, som också är aktiv vilket visas genom dess in vitro-bindning till ADP-receptorn P2Y12 på trombocyter. Den systemiska exponeringen för den aktiva metaboliten är cirka 30-40 % av den för Tikagrelor.
Eliminering
Den primära eliminationsvägen för tikagrelor är via metabolisering i levern. När radioaktivt märkt tikagrelor administreras är det genomsnittliga utbytet av radioaktiviteten cirka 84 % (57,8 % i faeces, 26,5 % i urinen). Utbytena av tikagrelor och den aktiva metaboliten i urinen låg båda under 1 % av dosen. Den primära eliminationsvägen för den aktiva metaboliten är med största sannolikhet utsöndring i gallan. Medel-t1/2 var cirka 7 timmar för tikagrelor och 8,5 timmar för den aktiva metaboliten.
Speciella populationer
Äldre
Högre exponeringar för tikagrelor (cirka 25 % för både Cmax och AUC) och den aktiva metaboliten observerades hos äldre patienter med akut kranskärlssjukdom (≥ 75 år) jämfört med yngre patienter i den populationsfarmakokinetiska analysen. Dessa skillnader betraktas ej som kliniskt signifikanta (se avsnitt Dosering).
Pediatrisk population
Det finns begränsad erfarenhet hos barn med sickelcellssjukdom (se avsnitt Dosering och Farmakodynamik).
I HESTIA 3-studien fick pediatriska patienter i åldrarna 2 år upp till 18 år som väger ≥ 12 till ≤ 24 kg, > 24 till ≤ 48 kg och > 48 kg tikagrelor som dispergerbara 15 mg tabletter med doser på 15, 30 och 45 mg två gånger dagligen. Baserat på populationsfarmakokinetisk analys varierade genomsnittligt AUC från 1 095 ng*h/ml till 1 458 ng*h/ml och genomsnittligt Cmax varierade från 143 ng/ml till 206 ng/ml vid steady state.
Kön
Högre exponeringar för tikagrelor och den aktiva metaboliten observerades hos kvinnor jämfört med män. Skillnaderna betraktas ej som kliniskt signifikanta.
Nedsatt njurfunktion
Exponeringen för tikagrelor var cirka 20 % lägre och exponeringen för den aktiva metaboliten var cirka 17 % högre hos patienter med allvarligt nedsatt njurfunktion (kreatininclearance < 30 ml/min) jämfört med hos patienter med normal njurfunktion.
Hos patienter med njursjukdom i slutstadiet som krävde hemodialys var AUC och Cmax för tikagrelor 90 mg, administrerat på en dag utan dialys, 38 % respektive 51 % högre jämfört med hos försökspersoner med normal njurfunktion. En liknande ökning av exponering observerades när tikagrelor administrerades omedelbart före dialys (49 % respektive 61 %), vilket visar att tikagrelor inte är dialyserbart. Exponering för den aktiva metaboliten ökade i mindre utsträckning (AUC 13‑14 % och Cmax 17‑36 %). Hämningen av trombocytaggregationen (IPA) för tikagrelor var oberoende av dialys hos patienter med njursjukdom i slutstadiet och var likartad med den för personer med normal njurfunktion (se avsnitt Dosering).
Nedsatt leverfunktion
Cmax och AUC för tikagrelor var 12 % respektive 23 % högre för patienter med lätt nedsatt leverfunktion jämfört med matchade friska försökspersoner, men IPA‑effekten av tikagrelor var emellertid likartad mellan de två grupperna. Ingen dosjustering behövs för patienter med lindrigt nedsatt leverfunktion. Tikagrelor har inte studerats på patienter med svårt nedsatt leverfunktion och det finns ingen farmakokinetisk information för patienter med måttligt nedsatt leverfunktion. Hos patienter som hade måttlig eller svår förhöjning av en eller flera leverfunktionstester vid inklusion, var plasmakoncentrationerna av tikagrelor i genomsnitt likartade eller något högre jämfört med de utan förhöjda värden vid inklusion. Ingen dosjustering rekommenderas för patienter med måttligt nedsatt leverfunktion (se avsnitt Dosering och Varningar och försiktighet).
Etnicitet
Patienter med asiatiskt ursprung har 39 % högre genomsnittlig biotillgänglighet än kaukasiska patienter. Patienter som betraktade sig själva som svarta hade 18 % lägre biotillgänglighet av tikagrelor jämfört med kaukasiska patienter, i klinisk-farmakologiska studier var exponeringen (Cmax och AUC) för tikagrelor hos japanska försökspersoner cirka 40 % högre (20 % efter justering för kroppsvikt) än hos kaukasier. Exponeringen hos patienter som betraktade sig själva som latinamerikaner var likartad med den för kaukasier.
Prekliniska uppgifter
Prekliniska data för tikagrelor och dess huvudmetabolit visade inte någon oacceptabel risk för biverkningar hos människor, vilket baseras på gängse studier av säkerhetsfarmakologi, toxicitet vid singeldos och upprepade doser och potentiell genotoxicitet.
Gastrointestinal irritation observerades hos flera djurarter vid kliniskt relevanta exponeringsnivåer (se avsnitt Biverkningar).
Hos råtthonor uppvisade tikagrelor i hög dos en ökad incidens av uterustumörer (adenocarcinom) och en ökad incidens av leveradenom. Mekanismen för uterustumörerna är sannolikt en hormonell obalans som kan leda till tumörer hos råttor. Mekanismen bakom leveradenomen beror sannolikt på en gnagarspecifik enzyminduktion i levern. Det bedöms därför som osannolikt att karcinogenicitetsfynden är relevanta för människor.
Hos råttor sågs mindre utvecklingsanomalier vid doser som var toxiska för modern (säkerhetsmarginal 5,1). Hos kaniner sågs en lätt fördröjning av levermognad och skelettutveckling hos foster från kaninmödrar som fått hög dos utan att någon toxicitet visats hos modern (säkerhetsmarginal 4,5).
Studier på råttor och kaniner har visat reproduktionseffekter, med en lätt reducerad viktuppgång hos modern och en sänkt livsduglighet och födelsevikt hos de nyfödda, med en fördröjd tillväxt. Tikagrelor gav oregelbundna cykler (i flertalet fall förlängda cykler) hos honråttor, men påverkade inte den totala fertiliteten hos han- och honråttor. Farmakokinetiska studier utförda med radioaktivt märkt tikagrelor har visat att moderföreningen och dess metaboliter utsöndras i mjölk från råttor (se avsnitt Amning).
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje filmdragerad tablett innehåller 90 mg tikagrelor.
Förteckning över hjälpämnen
Tablettkärna
Mannitol (E421)
Kalciumvätefosfatdihydrat
Magnesiumstearat (E470b)
Natriumstärkelseglykolat typ A
Hydroxipropylcellulosa (E463)
Tablettdragering
Talk
Titandioxid (E171)
Gul järnoxid (E172)
Makrogol 400
Hypromellos (E464)
Blandbarhet
Ej relevant.
Miljöpåverkan
Ticagrelor
Miljörisk:
Användning av ticagrelor har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Ticagrelor bryts ned i miljön.
Bioackumulering:
Ticagrelor har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
PEC/PNEC = 0.090 μg/L / 53 μg/L = 0.00170
PEC/PNEC ≤ 0.1
Environmental Risk Classification
Predicted Environmental Concentration ( PEC)
The PEC is based on the following calculation:
PEC (µg/L) = (A*109*(100-R))/(365*P*V*D*100)
PEC (µg/L) = 1.37*10-6*A*(100-R)
PEC = 1.37 * 10-6 *588.20*(100-0)
= 0.090 µg/L
Where;
A (kg/year) = total sold amount API in Sweden year 2020, data from IQVIA
= 588.20 kg
R (%) = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation)
= 0%
P = number of inhabitants in Sweden
=10*106
V (L/day) = volume of wastewater per capita and day
= 200 L/day (Ref 1)
D = factor for dilution of waste water by surface water flow
= 10 (Ref 1)
Note: The factor 109 converts the quantity used from kg to μg
Metabolism and excretion
Ticagrelor is extensively metabolised in humans with approximately 27% of the dose
excreted as the parent compound.
Ecotoxicity Data
|
Study Type |
Method |
Result |
Reference |
|
Activated sludge, respiration inhibition test |
OECD 209 |
3 h NOEC = 100 mg/L 3 h EC50 >100 mg/L |
2 |
|
Toxicity to the freshwater green alga, Selenastrum capricornutum |
OECD 201 |
72 h NOECgrowth rate = 0.82 mg/L 72 h LOECgrowth rate = 1.9 mg/L 72 h EC50 growth rate = >5.2 mg/L 72 h NOECbiomass = 0.82 mg/L 72 h LOECbiomass = 1.9 mg/L 72 h EC50 biomass = >5.2 mg/L |
3 |
|
Acute toxicity to Daphnia magna |
OECD202 |
48 h EC50 (immobility) = 1.4 mg/L |
4 |
|
Acute toxicity to rainbow trout, Oncorhynchus mykiss |
OECD203 |
96h LC50 (mortality) >2.7 mg/L |
5 |
|
Chronic toxicity to Daphnia magna |
OECD 211 |
21 d NOEC (reproduction, survival length) = 0.53 mg/L 21 d LOEC (reproduction, survival length) = 1.7 mg/L |
6 |
|
Fish early-life stage toxicity with fathead minnow, Pimephales promelas (note 2) |
OECD 210 |
32 d NOEC (hatch, survival, length and weight) = 1.8 mg/L 32 d LOEC (hatch, survival, length and weight) >1.8 mg/L |
7 |
|
Toxicity to sediment dwelling midge, Chironomus riparius |
OECD 218 |
28 d NOEC (development rate, total emergence, sex ratio) = 30 mg/kg dry weight 28 d LOEC (development rate, total emergence, sex ratio) > 30 mg/kg dry weight |
8 |
Predicted No Effect Concentration (PNEC)
Long-term tests have been undertaken for species from three trophic levels. Therefore, the PNEC is based on the chronic toxicity to the giant water flea (Daphnia magna), 0.53 mg/L, and an assessment factor of 10 is applied, in accordance with ECHA guidance.
PNEC = 530/10 µg/L = 53 µg/L
Environmental Risk Classification (PEC/PNEC ratio)
PEC/PNEC = 0.090 μg/L / 53 μg/L = 0.00170
PEC/PNEC = ≤ 0.1
The PEC/PNEC ratio decides the wording of the aquatic environmental risk phrase, and the risk phrase for PEC/PNEC = ≤ 0.1 reads as follows; “Use of ticagrelor has been considered to result in insignificant environmental risk” has been assigned.
In Swedish: “Användning av Tikagrelor har bedömts medföra försumbar risk för miljöpåverkan” under the heading Miljörisk.
Environmental Fate Data
|
Study Type |
Method |
Result |
Reference |
|
Aerobic biodegradation |
OECD 301F |
<5% degradation after 28 days Not readily biodegradable |
9 |
|
Adsorption/desorption to sludge |
OPPTS 835.1110 |
Kd(ads) = 1571 Koc = 4246 |
10 |
|
Aerobic transformation in aquatic sediment systems |
OECD 308 |
DT50 total system = 11.3 days with <15% of applied radioactivity remaining as parent compound (2.3% in water + 8.0% in sediment) compound at the end of the study
DT50 total system = 19.6 days with <15% of applied radioactivity remaining as parent compound (0% in water + 2.8% in sediment) at the end of the study Evidence suggest that the substance is degraded and will not be persistent in the aquatic environment |
11 |
Results from the aerobic biodegradation test (Ref. 9), showed that ticagrelor is not readily biodegradable.
Evidence from the OECD 308 study (Ref. 11) indicates that ticagrelor is likely to dissipate from the aqueous phase and partition into the sediment phase.
High organic matter (HOM) sediment system:
The average mass balances upon application (day zero) showed 22% and 29% of the applied radioactivity remained unaccounted for in the high and low organic matter vessels, respectively. Recoveries in all vessels sacrificed after day 0 were showed mass balances ranging 81.8 to 105.8% of applied radioactivity (AR) throughout the 99-day study.
The radiolabelled ticagrelor dissipated rapidly from the water phase, with a half-life of 2.2 days. The proportion of ticagrelor remaining in the water phase at the end of the study was 6.1% AR in the high organic matter system while no remaining ticagrelor was observed in the water phase of the low organic matter system at the end of the study.
Sediments were extracted with ethanol initially and additional solvent extractions performed to address the high proportion of unextracted residue (observed particularly in the high organic matter sediment). The additional solvent extractions removed varying amounts of additional radioactivity; from the high organic matter sediment, THF, DMSO and SolueneTM removed 17, 18 and 19% AR, respectively and from low organic matter sediment methanol, acetone, THF, DMSO and SolueneTM all removed a further 2 to 8% AR. Nonetheless, at the end of the study an average of 51.7% AR and 31.75% AR were bound to the high and low organic matter sediments, respectively.
The proportion of radiolabel extracted from the sediment and identified as ticagrelor decreased from a maximum of 32.9% at day 14 to 8.0% AR by day 99 in the high organic matter sediment and from a maximum of 47.69% at day 14 to 2.8% AR by day 99 in the low organic matter sediment.
A significant proportion of ticagrelor was mineralised in both systems in this study, with 14% AR and 29% AR having been evolved as carbon dioxide in the high and low organic matter systems at the end of the study.
The calculated total system half-lives were 11.3 days and 19.6 days for the high and low
organic matter systems.
Based on the data above, ticagrelor is not predicted to be readily biodegraded during wastewater treatment. However, there is evidence that metformin hydrochloride will degrade within the aquatic environment.
Based on the above information, the phrase “Ticagrelor is degraded in the environment.” has been assigned.
In Swedish: “Tikagrelor bryts ned i miljön.”under the heading “Nedbrytning”.
Physical Chemistry Data for Ticagrelor
|
Study Type |
Method |
Result |
Reference |
|
Preliminary hydrolysis |
OECD 111 |
18% after 5 days at 50°C (pH 5) <10% after 5 days at 50°C (pH 7) <10% after 5 days at 50°C (pH9) Hydrolysis half-life at 25°C ≥ 1 year |
12 |
|
Water solubility |
OECD 105 |
5.3 mg/L at pH 5 3.5 mg/L at pH 7 11 mg/L at pH 9 |
13 |
|
Octanol/water partition coefficient |
OECD 107 |
log Dow > 4.02 at pH 5, 7 and 9 |
14 |
Ticagrelor is not ionisable, is water soluble and hydrolytically stable. It is not readily biodegradable during sewage treatment and is not predicted to significantly partition onto sludge solids. In the natural environment, ticagrelor is expected to partition into aquatic sediments and undergo significant degradation. The risk of bioaccumulation of ticagrelor in aquatic organisms is low.
Therefore, the phrase “Ticagrelor is degraded in the environment” has been assigned.
In Swedish: “Tikagrelor bryts ned i miljön” under the heading ‘Nedbrytning’.
Bioaccumulation Data
|
Study Type |
Method |
Result |
Reference |
|
Preliminary study: bioconcentration potential in rainbow trout (O. mykiss ) |
OECD305 |
BCF at 1.0 μg/L = 6.36 L/Kg (based on total radioactivity) Not bioaccumulative |
15 |
Ticagrelor is not ionisable, however, the octanol-water distribution coefficient, LogDow, was determined across an environmentally relevant pH-range (Ref. 14).
Bioconcentration of ticagrelor in Oncorhynchus mykiss was assessed, and the whole body BCF at 1.0 µg/L of ticagrelor was 6.36 after 28 days uptake. Since the BCF is < 500, ticagrelor has a low potential for bioaccumulation. Therefore, the phrase ‘Ticagrelor has low potential for bioaccumulation’ has been assigned.
In Swedish: ”Tikagrelor har låg potential att bioackumuleras,” under the heading ”Bioackumulering”.
References
-
[ECHA] European Chemicals Agency. 2008. Guidance on Information Requirements and Chemical Safety Assessment.
-
AZD1640: Effect on the respiration rate of activated sludge.
Brixham Environmental Laboratory, UK. Report No BL8213. December 2005.
-
AZD6140: Toxicity to the green alga Selenastrum capricornutum. Brixham Environmental Laboratory, UK. Report No BL8237. December 2006.
-
AZD1640: Acute Toxicity to Daphnia Magna. Brixham Environmental Laboratory, UK. Report No BLS3310. October 2005.
-
AZD1640: Acute Toxicity to rainbow trout (Oncorhynchus mykiss).
Brixham Environmental Laboratory, UK. Report No BLS3359. October 2005. -
AZD1640: Chronic Toxicity to Daphnia Magna. Brixham Environmental Laboratory, UK. Report No BL8604. September 2008.
-
AZD1640: Determination of effects on the early-life stage of the fathead minnow (Pimephales promelas). Brixham Environmental Laboratory, UK. Report No BL8362. July 2007
-
[14C]AZD1640: Effects in sediment on emergence of the midge, Chironomus riparius. Brixham Environmental Laboratory, UK. Report No BL8659. February 2009.
-
AZD1640: Determination of 28 day ready biodegradability. Brixham Environmental Laboratory, UK. Report No BL8262. March 2006.
-
AZD1640: Adsorption and desorption of sewage sludge. Brixham Environmental Laboratory, UK. Report No BL8344. December 2006.
-
AZD1640: Aerobic transformation in aquatic sediment. Brixham Environmental Laboratory, UK. Report No BL8610. December 2008.
-
AZD1640: Hydrolysis as a function of pH – preliminary study results summary. Brixham Environmental Laboratory, UK. Report No BLS3343. July 2006.
-
AZD1640: Water solubility. Brixham Environmental Laboratory, UK. Report No BL8220. December 2005.
-
ADZ1640: Determintation of n-octanol-water partition coefficient. Brixham Environmental Laboratory, UK. Report No BL8280. January 2007.
-
[14C]AZD1640: Determination of the accumulation of [14C]AZD1640 in rainbow trout (Oncorhynchus mykiss). Brixham Environmental Laboratory, UK. Report No BL8680. September 2008.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Filmdragerad tablett (tablett).
Runda, bikonvexa, gula tabletter märkta med ”90” ovanför ”T” på den ena sidan och omärkta på den andra.
Förpackningsinformation
Filmdragerad tablett 90 mg
Rund, bikonvex, gul, filmdragerad tablett märkt med "90" ovanför "T" på ena sidan och omärkt på den andra
100 x 1 tablett(er) blister, 1080:52, F
56 tablett(er) kalenderförpackning, 626:32, F
168 tablett(er) kalenderförpackning, 1782:46, F
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 90 mg





