Indikationer
Abraxane som monoterapi är indicerat för behandling av metastaserande bröstcancer hos vuxna vid terapisvikt efter första linjens behandling eller då standardbehandling innehållande antracyklin inte är lämplig (se avsnitt Varningar och försiktighet).
Abraxane i kombination med gemcitabin är indicerat för första linjens behandling av vuxna patienter med metastaserande adenocarcinom i pankreas.
Abraxane i kombination med karboplatin är indicerat för första linjens behandling av icke‑småcellig lungcancer hos vuxna patienter som inte är kandidater för potentiellt kurativ kirurgi och/eller strålbehandling.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Amning (se avsnitt Amning).
Patienter som har ett neutrofilantal på <1,5 x 109/L före behandlingsstart.
Dosering
bör endast ges under överinseende av en kvalificerad onkolog vid en avdelning som är specialiserad på cytostatikabehandling. Det ska inte ersätta eller ersättas med andra formuleringar av paklitaxel.
Dosering
Bröstcancer
Den rekommenderade dosen av Abraxane är 260 mg/m2 intravenöst under 30 minuter var tredje vecka.
Dosjusteringar under pågående behandling av bröstcancer
Hos patienter som drabbas av allvarlig neutropeni (neutrofilantal <0,5 x 109/L under en vecka eller längre) eller allvarlig sensorisk neuropati under Abraxane-behandlingen, bör dosen minskas till 220 mg/m2 under efterföljande kurer. Efter återfall av allvarlig neutropeni eller allvarlig sensorisk neuropati bör dosen minskas ytterligare till 180 mg/m2. Abraxane ska inte administreras förrän neutrofilantalet återgått till >1,5 x 109/L. För grad 3 sensorisk neuropati bör behandlingen avbrytas tills en återgång till grad 1 eller 2 har uppnåtts, följt av en dosreducering för alla efterföljande kurer.
Adenocarcinom i pankreas
Den rekommenderade dosen av Abraxane i kombination med gemcitabin är 125 mg/m2 som administreras intravenöst under 30 minuter dag 1, 8 och 15 i varje 28-dagarscykel. Den rekommenderade dosen av gemcitabin är 1 000 mg/m2 som administreras intravenöst under 30 minuter omedelbart efter avslutad administrering av Abraxane på dag 1, 8 och 15 i varje 28-dagarscykel.
Dosjusteringar under behandling av adenocarcinom i pankreas
|
Dosnivå |
Dos av Abraxane (mg/m2) |
Dos av gemcitabin (mg/m2) |
|---|---|---|
|
Full dos |
125 |
1 000 |
|
Första dosreduktion |
100 |
800 |
|
Andra dosreduktion |
75 |
600 |
|
Om ytterligare dosreduktion krävs |
Avsluta behandlingen |
Avsluta behandlingen |
|
Dag i cykeln |
Absolut neutrofilantal (ANC) (109/L) |
Trombocytantal (109/L) |
Dos av Abraxane |
Dos av gemcitabin |
|
|---|---|---|---|---|---|
|
Dag 1 |
< 1,5 |
ELLER |
< 100 |
Skjut upp behandlingen fram till återhämtning |
|
|
Dag 8 |
≥ 0,5 men < 1 |
ELLER |
≥ 50 men < 75 |
Reducera dosen en dosnivå |
|
|
< 0,5 |
ELLER |
< 50 |
Avbryt behandlingen |
||
|
Dag 15: Om dosen dag 8 gavs utan justering: |
|||||
|
Dag 15 |
≥ 0,5 men < 1 |
ELLER |
≥ 50 men < 75 |
Behandla med dosnivå för dag 8 följt av tillväxtfaktorer för vita blodkroppar ELLER reducera dosen en dosnivå från dag 8-dosen |
|
|
< 0,5 |
ELLER |
< 50 |
Avbryt behandlingen |
||
|
Dag 15: Om dosen dag 8 reducerades: |
|||||
|
Dag 15 |
≥ 1 |
OCH |
≥ 75 |
Återgå till dosnivå för dag 1 följt av tillväxtfaktorer för vita blodkroppar ELLER behandla med samma doser som dag 8 |
|
|
≥ 0,5 men < 1 |
ELLER |
≥ 50 men < 75 |
Behandla med dosnivå för dag 8 följt av tillväxtfaktorer för vita blodkroppar ELLER reducera dosen en dosnivå från dag 8-dosen |
||
|
< 0,5 |
ELLER |
< 50 |
Avbryt behandlingen |
||
|
Dag 15: Om behandlingen avbröts dag 8: |
|||||
|
Dag 15 |
≥ 1 |
OCH |
≥ 75 |
Återgå till dosnivå för dag 1 följt av tillväxtfaktorer för vita blodkroppar ELLER reducera dosen en dosnivå från dag 1-dosen |
|
|
≥ 0,5 men < 1 |
ELLER |
≥ 50 men < 75 |
Reducera en dosnivå följt av tillväxtfaktorer för vita blodkroppar ELLER reducera dosen två dosnivåer från dag 1-dosen |
||
|
< 0,5 |
ELLER |
< 50 |
Avbryt behandlingen |
||
Förkortningar: absolut neutrofilantal (ANC = Absolute Neutrophil Count), vita blodkroppar (WBC = white blood cell)
|
Läkemedelsbiverkning |
Dos av Abraxane |
Dos av gemcitabin |
|---|---|---|
|
Febril neutropeni: grad 3 eller 4 |
Avbryt behandlingen tills patienten är feberfri och absolut neutrofilantal (ANC) ≥ 1,5; återuppta behandlingen på nästa lägre dosnivåa |
|
|
Perifer neuropati: grad 3 eller 4 |
Avbryt behandlingen tills en återgång till ≤ grad 1 har uppnåtts; återuppta behandlingen på nästa lägre dosnivåa |
Behandla med samma dos |
|
Hudtoxicitet: grad 2 eller 3 |
Reducera till nästa lägre dosnivåa; avsluta behandlingen om läkemedelsbiverkningarna kvarstår |
|
|
Gastrointestinal toxicitet: mukosit eller diarré av grad 3 |
Avbryt behandlingen tills en återgång till ≤ grad 1 har uppnåtts; återuppta behandlingen på nästa lägre dosnivåa |
|
aSe tabell 1 för reducering av dosnivå
Icke-småcellig lungcancer
Den rekommenderade dosen av Abraxane är 100 mg/m2 intravenöst under 30 minuter dag 1, 8 och 15 i varje 21-dagarscykel. Den rekommenderade dosen av karboplatin är AUC = 6 mg×min/ml endast dag 1 i varje 21-dagarscykel, med början omedelbart efter avslutad administrering av Abraxane.
Dosjusteringar under behandling av icke-småcellig lungcancer
Abraxane ska inte administreras dag 1 i en cykel förrän absoluta neutrofilantalet (ANC) är ≥1,5 x 109/L och trombocytantalet är ≥ 100 x 109/L. För varje efterföljande veckodos av Abraxane måste patienterna ha ett ANC på ≥0,5 x 109/L och ett trombocytantal på 50 x 109/L annars ska dosen inte ges förrän cellantalen normaliserats. När cellantalen normaliserats återupptas dosering den följande veckan enligt kriterierna i tabell 4. Reducera efterföljande dos endast om kriterierna i tabell 4 är uppfyllda.
|
Hematologisk toxicitet |
Förekomst |
Dosav Abraxane (mg/m2)1 |
Dosav karboplatin (AUC mg×min/ml)1 |
|---|---|---|---|
|
Lägsta ANC <0,5 x 109/L med neutropen feber >38 °C ELLER Fördröjning av nästa cykel på grund av ihållande neutropeni2 (lägsta <1,5 x 109/L ELLER Lägsta ANC <0,5 x 109/L i >1 vecka |
Första |
75 |
4,5 |
|
Andra |
50 |
3,0 |
|
|
Tredje |
Avbryt behandlingen |
||
|
Lägsta trombocytnivå <50 x 109/L |
Första |
75 |
4,5 |
|
Andra |
Avbryt behandlingen |
||
1På dag 1 i 21-dagarscykeln reduceras dosen av Abraxane och karboplatin samtidigt. På dag 8 eller 15 i 21-dagarscykeln reduceras dosen av Abraxane; dosen av karboplatin reduceras i efterföljande cykel.
2Maximalt 7 dagar efter planerad dos dag 1 i nästa cykel.
Vid hudtoxicitet av grad 2 eller 3, diarré av grad 3 eller mukosit av grad 3 avbryts behandlingen tills toxiciteten förbättras till ≤ grad 1, och därefter återupptas behandlingen enligt riktlinjerna i tabell 5. Vid perifer neuropati av ≥ grad 3 avbryts behandlingen tills återgång till ≤ grad 1 har uppnåtts. Behandlingen kan återupptas på nästa lägre dosnivå i efterföljande cykler enligt riktlinjerna i tabell 5. Vid annan icke-hematologisk toxicitet av grad 3 eller 4 avbryts behandlingen tills toxiciteten förbättras till ≤ grad 2, och därefter återupptas behandlingen enligt riktlinjerna i tabell 5.
|
Icke-hematologisk toxicitet |
Förekomst |
Dos av Abraxane (mg/m2)1 |
Dos av karboplatin (AUC mg×min/ml)1 |
|---|---|---|---|
|
Hudtoxicitet av grad 2 eller 3 Diarré av grad 3 Mukosit av grad 3 Perifer neuropati ≥ grad 3 Annan icke-hematologisk toxicitet av grad 3 eller 4 |
Första |
75 |
4,5 |
|
Andra |
50 |
3,0 |
|
|
Tredje |
Avbryt behandlingen |
||
|
Hudtoxicitet, diarré eller mukosit av grad 4 |
Första |
Avbryt behandlingen |
|
1På dag 1 i 21-dagarscykeln reduceras dosen av Abraxane och karboplatin samtidigt. På dag 8 eller 15 i 21-dagarscykeln reduceras dosen av Abraxane; dosen av karboplatin reduceras i efterföljande cykel.
Särskilda populationer
Nedsatt leverfunktion
Det krävs ingen dosjustering för patienter med lindrigt nedsatt leverfunktion (totalt bilirubin > 1 till ≤ 1,5 x ULN och aspartataminotransferas [AST] ≤ 10 x ULN), oavsett indikation. Dessa patienter behandlas med samma doser som patienter med normal leverfunktion.
För patienter med metastaserande bröstcancer och patienter med icke-småcellig lungcancer som har måttligt till allvarligt nedsatt leverfunktion (totalt bilirubin > 1,5 till ≤ 5 x ULN och AST ≤ 10 x ULN) rekommenderas en dosreduktion på 20 %. Den reducerade dosen kan ökas till dosen för patienter med normal leverfunktion om patienten tolererar behandlingen under minst två cykler (se avsnitt Varningar och försiktighet och Farmakokinetik).
Det saknas tillräckliga data för att rekommendera dosmodifieringar till patienter med metastaserande adenocarcinom i pankreas som har måttligt till allvarligt nedsatt leverfunktion (se avsnitt Varningar och försiktighet och Farmakokinetik).
Det saknas tillräckliga data för att rekommendera dosmodifieringar till patienter med totalt bilirubin > 5 x ULN eller AST > 10 x ULN, oavsett indikation (se avsnitt Varningar och försiktighet och Farmakokinetik).
Nedsatt njurfunktion
Det krävs ingen dosjustering av startdosen av Abraxane för patienter med lindrigt till måttligt nedsatt njurfunktion (uppskattat kreatininclearance ≥30 till <90 ml/min). Det saknas tillräckliga data för att rekommendera doseringsändringar av Abraxane för patienter med allvarligt nedsatt njurfunktion eller terminal njursjukdom (uppskattat kreatininclearance <30 ml/min (se avsnitt Farmakokinetik).
Äldre
Inga ytterligare dosreduktioner rekommenderas till patienter som är 65 år och äldre, förutom de som redan rekommenderas för alla patienter.
Av de 229 patienterna i den randomiserade studien som fick Abraxane som monoterapi för bröstcancer var 13 % minst 65 år och mindre än 2 % var 75 år och äldre. Ingen märkbar ökad frekvens av toxicitet förekom bland patienter som var minst 65 år och fick Abraxane. En efterföljande analys av 981 patienter som fick Abraxane som monoterapi för metastaserande bröstcancer, varav 15 % var ≥65 år och 2 % var ≥75 år, visade dock en högre incidens av epistaxis, diarré, uttorkning, trötthet och perifera ödem hos patienter ≥65 år.
Av de 421 patienterna med adenocarcinom i pankreas som fick Abraxane i kombination med gemcitabin i den randomiserade studien var 41 % 65 år och äldre och 10 % var 75 år och äldre. Hos patienter i åldern 75 år och äldre som fick Abraxane och gemcitabin observerades en högre incidens av allvarliga biverkningar och biverkningar som ledde till att behandlingen avslutades (se avsnitt Varningar och försiktighet). Patienter med adenocarcinom i pankreas i åldern 75 år och äldre ska noggrant bedömas innan behandling övervägs (se avsnitt Varningar och försiktighet).
Av de 514 patienterna med icke-småcellig lungcancer i den randomiserade studien som fick Abraxane i kombination med karboplatin var 31 % 65 år eller äldre och 3,5 % var 75 år eller äldre. Händelser med myelosuppression, händelser med perifer neuropati, samt artralgi förekom oftare hos patienter som var 65 år eller äldre jämfört med patienter som var yngre än 65 år. Det finns begränsad erfarenhet av användning av Abraxane/karboplatin hos patienter i åldern 75 år eller äldre.
Farmakokinetisk/farmakodynamisk modellering som använde data från 125 patienter med framskridna solida tumörer indikerar att patienter ≥65 år kan vara mer mottagliga för utveckling av neutropeni under den första behandlingscykeln.
Pediatrisk population
Säkerhet och effekt för Abraxane för barn och ungdomar i åldern 0 till yngre än 18 år har ännu inte fastställts. Tillgänglig information finns i avsnitt Biverkningar, Farmakodynamik och Farmakokinetik men inga dosrekommendationer kan ges. Det är inte relevant att använda Abraxane i den pediatriska populationen för indikationerna metastaserande bröstcancer eller adenocarcinom i pankreas eller icke-småcellig lungcancer.
Administreringssätt
Administrera rekonstituerad Abraxane-dispersion intravenöst med hjälp av ett infusionsset med ett 15 µm filter. Efter administrering rekommenderas att den intravenösa infarten spolas med natriumklorid 9 mg/ml (0,9 %) injektionsvätska, lösning för att säkerställa att hela dosen administreras.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Abraxane är en albuminbunden nanopartikel-formulering av paklitaxel, som kan ha påtagligt annorlunda farmakologiska egenskaper än andra formuleringar av paklitaxel (se avsnitten Farmakodynamik och Farmakokinetik). Det ska inte ersätta eller ersättas med andra formuleringar av paklitaxel.
Överkänslighet
Svåra överkänslighetsreaktioner, inklusive mycket sällsynta händelser med anafylaktiska reaktioner med dödlig utgång, har rapporterats i sällsynta fall. Om en överkänslighetsreaktion uppkommer måste behandlingen omedelbart avbrytas och symtomatisk behandling sättas in. Patienten ska inte behandlas med paklitaxel igen.
Hematologi
Benmärgshämning (speciellt neutropeni) inträffar ofta med Abraxane. Neutropeni är dosberoende och utgör en dosbegränsande toxicitet. Antalet blodceller bör kontrolleras frekvent under Abraxane-behandlingen. Patienter bör inte ges en ny behandlingsomgång med Abraxane förrän antalet neutrofiler återgått till en nivå på >1,5 x 109/L och antalet trombocyter återgått till en nivå på >100x 109/L (se avsnitt Dosering).
Neuropati
Sensorisk neuropati förekommer ofta vid Abraxane-behandling, men utveckling av allvarliga symtom är mindre vanligt. Uppkomst av sensorisk neuropati av grad 1 eller 2 kräver oftast ingen dosminskning. Om Abraxane används som monoterapi och sensorisk neuropati av grad 3 utvecklas, bör behandlingen avbrytas tills en återgång till grad 1 eller 2 har uppnåtts, och dosen bör minskas för alla efterföljande kurer av Abraxane (se avsnitt Dosering). Om perifer neuropati av grad 3 eller högre utvecklas under kombinationsbehandling med Abraxane och gemcitabin, bör behandlingen med Abraxane avbrytas och behandlingen med gemcitabin fortsättas med samma dos. Abraxane-behandlingen återupptas i reducerad dos om den perifera neuropatin återgår till grad 0 eller 1 (se avsnitt Dosering). Om perifer neuropati av grad 3 eller högre utvecklas vid kombinationsanvändning av Abraxane och karboplatin ska behandlingen avbrytas tills förbättring till grad 0 eller 1 uppnås, följt av en dosreducering för alla efterföljande behandlingar med Abraxane och karboplatin (se avsnitt Dosering).
Sepsis
Sepsis har rapporterats med en frekvens på 5 % hos patienter med eller utan neutropeni som fick Abraxane i kombination med gemcitabin. Komplikationer på grund av den bakomliggande pankreascancern, särskilt biliär obstruktion eller förekomst av biliär stent, fastställdes som signifikanta bidragande faktorer. Om patienten är febril (oavsett neutrofilantal) ska behandling med bredspektrumantibiotika inledas. Vid uppkomst av febril neutropeni ska behandling med Abraxane och gemcitabin avbrytas tills patienten är feberfri och ANC ≥ 1,5 x 109/L, varefter behandlingen återupptas med reducerade dosnivåer (se avsnitt Dosering).
Pneumonit
Pneumonit förekom hos 1 % av patienterna när Abraxane användes som monoterapi och hos 4 % av patienterna när Abraxane användes i kombination med gemcitabin. Patienterna ska noga övervakas för tecken och symtom på pneumonit. Efter att infektiös etiologi har uteslutits och diagnosen pneumonit har ställts ska behandlingen med Abraxane och gemcitabin sättas ut permanent och lämplig behandling och understödjande åtgärder omgående vidtas (se avsnitt Dosering).
Nedsatt leverfunktion
På grund av att paklitaxels toxicitet kan ökas vid nedsatt leverfunktion bör administreringen av Abraxane ske med försiktighet till patienter med nedsatt leverfunktion. Patienter med nedsatt leverfunktion kan löpa ökad risk för toxicitet, i synnerhet myelosuppression. Dessa patienter bör noga kontrolleras med avseende på utveckling av allvarlig myelosuppression.
Abraxane rekommenderas inte hos patienter som har totalt bilirubin >5 x ULN eller ASAT/ALAT >10 x ULN. Abraxane rekommenderas inte heller till patienter med metastaserande adenocarcinom i pankreas som har måttligt till allvarligt nedsatt leverfunktion (totalt bilirubin > 1,5 x ULN och AST ≤ 10 x ULN) (se avsnitt Farmakokinetik).
Kardiotoxicitet
Sällsynta rapporter om kronisk hjärtsvikt och vänsterkammardysfunktion har observerats bland personer som fått Abraxane. De flesta av dessa personer hade tidigare exponerats för kardiotoxiska läkemedel, t.ex. antracykliner, eller hade en underliggande hjärtanamnes. Patienter som får Abraxane måste därför övervakas noggrant av läkare med avseende på uppkomst av hjärtpåverkan.
CSN-metastaser
Effekt och säkerhet för Abraxane hos patienter med metastaser i det centrala nervsystemet (CNS) har inte fastställts. CNS-metastaser kan i allmänhet inte kontrolleras på ett bra sätt med systemisk kemoterapi.
Gastrointestinala symtom
Om patienter känner illamående, kräks eller får diarré efter administreringen av Abraxane, kan de behandlas med vanliga antiemetika och förstoppande läkemedel.
Ögonpåverkan
Cystiskt makulaödem (CMO) har rapporterats hos patienter som behandlats med Abraxane. Patienter med nedsatt syn ska snarast genomgå en noggrann oftalmologisk undersökning. I fall där CMO diagnosticerats ska behandling med Abraxane avslutas och lämplig behandling sättas in (se avsnitt Biverkningar).
Patienter i åldern 75 år och äldre
För patienter i åldern 75 år och äldre har inga fördelar av kombinationsbehandling med Abraxane och gemcitabin jämfört med gemcitabin som monoterapi påvisats. Hos äldre äldre (≥75 år) som fick Abraxane och gemcitabin observerades en högre incidens av allvarliga biverkningar och biverkningar som ledde till att behandlingen avslutades inklusive hematologiska toxiciteter, perifer neuropati, minskad aptit och dehydrering. Patienter med adenocarcinom i pankreas i åldern 75 år och äldre ska noga bedömas med avseende på hur väl de tolererar Abraxane i kombination med gemcitabin, med särskild hänsyn till allmäntillstånd, komorbiditeter och ökad risk för infektioner (se avsnitt Dosering och Biverkningar).
Övrigt
Även om endast begränsade uppgifter finns tillgängliga har inga tydliga fördelar avseende förlängd total överlevnad påvisats hos patienter med adenocarcinom i pankreas med normala nivåer av CA 19-9 innan påbörjad behandling med Abraxane och gemcitabin (se avsnitt Farmakodynamik).
Erlotinib ska inte ges samtidigt med Abraxane och gemcitabin (se avsnitt Interaktioner).
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per 100 mg, dvs. är näst intill “natriumfritt”.
Interaktioner
Paklitaxels metabolism katalyseras delvis av cytokrom P450-isoenzymerna CYP2C8 och CYP3A4 (se avsnitt Farmakokinetik). Därför, i avsaknad av en farmakokinetisk läkemedelsinteraktionsstudie, bör försiktighet iakttas när paklitaxel administreras med andra läkemedel som är kända för att hämma antingen CYP2C8 eller CYP3A4 (t.ex. ketokonazol och andra imidazol-antimykotika, erytromycin, fluoxetin, gemfibrozil, klopidogrel, cimetidin, ritonavir, saquinavir, indinavir och nelfinavir) på grund av att paklitaxels toxicitet kan ökas till följd av paklitaxelexponering. Administrering av paklitaxel med andra läkemedel som är kända för att inducera antingen CYP2C8 eller CYP3A4 (t.ex. rifampicin, karbamazepin, fenytoin, efavirenz, nevirapin) rekommenderas ej eftersom effekten kan försämras till följd av lägre paklitaxelexponering.
Paklitaxel och gemcitabin har inte samma metaboliska väg. Paklitaxelclearance bestäms huvudsakligen av CYP2C8- och CYP3A4-medierad metabolism följt av biliär utsöndring, medan gemcitabin inaktiveras av cytidindeaminas följt av urinutsöndring. Farmakokinetiska interaktioner mellan Abraxane och gemcitabin har inte utvärderats hos människa.
En farmakokinetisk studie genomfördes med Abraxane och karboplatin på patienter med icke-småcellig lungcancer. Det förekom inga kliniskt relevanta farmakokinetiska interaktioner mellan Abraxane och karboplatin.
Abraxane är indicerat som monoterapi för bröstcancer eller i kombination med gemcitabin för adenocarcinom i pankreas eller i kombination med karboplatin för icke‑småcellig lungcancer (se avsnitt Indikationer). Abraxane ska inte användas i kombination med andra cytostatika.
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Födelsekontroll hos män och kvinnor
Fertila kvinnor bör använda effektiv preventivmetod under behandlingen och upp till en månad efter avslutad behandling med Abraxane. Män som behandlas med Abraxane bör använda effektivt preventivmedel och undvika att göra kvinnor gravida under behandlingen och upp till sex månader efter avslutad behandling.
Graviditet
Det finns mycket begränsade data beträffande användning av paklitaxel under graviditet hos människa. Man misstänker att paklitaxel orsakar allvarliga fosterskador vid administrering under graviditet. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter). Fertila kvinnor ska ha gjort ett graviditetstest innan de påbörjar behandling med Abraxane. Abraxane bör inte användas under graviditet eller till fertila kvinnor som inte använder effektivt preventivmedel, såvida inte det kliniska tillståndet hos modern kräver behandling med paklitaxel.
Amning
Paklitaxel och/eller dess metaboliter utsöndrades i mjölken hos diande råttor (se avsnitt Prekliniska uppgifter). Det är okänt om paklitaxel utsöndras i bröstmjölk. På grund av potentiellt allvarliga effekter hos ammande spädbarn, är Abraxane kontraindicerat under amning. Amning ska avbrytas under behandlingen.
Fertilitet
Paklitaxel ledde till infertilitet hos hanråttor (se avsnitt Prekliniska uppgifter). Enligt fynd hos djur kan fertiliteten hos män och kvinnor försämras. Manliga patienter bör rådfråga om konservering av sperma före behandlingen på grund av risken för bestående infertilitet till följd av behandling med Abraxane.
Trafik
Abraxane har mindre eller måttlig effekt på förmågan att framföra fordon och använda maskiner. Abraxane kan orsaka biverkningar såsom trötthet (mycket vanligt) och yrsel (vanligt), som kan påverka förmågan att köra och använda maskiner. Patienter bör rådas att inte köra bil eller använda maskiner om de känner trötthet eller yrsel.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste kliniskt signifikanta biverkningarna i samband med användning av Abraxane har varit neutropeni, perifer neuropati, artralgi/myalgi och biverkningar från magtarmkanalen.
Sammanfattning i tabellform av biverkningar
Tabell 6 listar de biverkningar som associerats med Abraxane i monoterapi vid olika doser och indikationer under kliniska prövningar (N = 789), Abraxane i kombination med gemcitabin för adenocarcinom i pankreas från den kliniska fas III-prövningen (N = 421), Abraxane i kombination med karboplatin för icke-småcellig lungcancer från den kliniska fas III-prövningen (N = 514) och från användning efter marknadsintroduktion.
Frekvenserna definieras enligt följande: mycket vanliga (≥ 1/10), vanliga (≥ 1/100 till < 1/10), mindre vanliga (≥ 1/1 000 till < 1/100), sällsynta (≥ 1/10 000 till < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgruppering presenteras biverkningarna i fallande allvarlighetsgrad.
Tabell 6: Biverkningar som rapporterades med Abraxane
|
|
Monoterapi (N=789) |
Kombinationsterapi med gemcitabin (N =421) |
Kombinationsterapi med karboplatin (N = 514) |
|
Infektioner och infestationer |
|||
|
Vanliga: |
Infektion, urinvägsinfektion, follikulit, infektion i övre luftvägarna, candidainfektion, sinusit |
Sepsis, lunginflammation, oral candidainfektion |
Lunginflammation, bronkit, infektion i övre luftvägarna, urinvägsinfektion |
|
Mindre vanliga: |
Sepsis1, neutropen sepsis1, lunginflammation, oral candidainfektion, nasofaryngit, cellulit, herpes simplex, virusinfektion, herpes zoster, svampinfektion, kateterrelaterad infektion, infektion på injektionsstället |
|
Sepsis, oral candidainfektion |
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
|||
|
Mindre vanliga: |
Tumörnekros, metastatisk smärta |
|
|
|
Blodet och lymfsystemet |
|||
|
Mycket vanliga: |
Benmärgssuppression, neutropeni, trombocytopeni, anemi, leukopeni, lymfopeni |
Neutropeni, trombocytopeni, anemi |
Neutropeni3, trombocytopeni3, anemi3, leukopeni3 |
|
Vanliga: |
Febril neutropeni |
Pancytopeni |
Febril neutropeni, lymfopeni |
|
Mindre vanliga: |
|
Trombotisk trombocytopen purpura |
Pancytopeni |
|
Sällsynta: |
Pancytopeni |
|
|
|
Immunsystemet |
|||
|
Mycket vanliga: |
Överkänslighet |
|
Läkemedelsöverkänslighet, överkänslighet |
|
Sällsynta: |
Allvarlig överkänslighet1 |
|
|
|
Metabolism och nutrition |
|||
|
Mycket vanliga: |
Anorexi |
Uttorkning, minskad aptit, hypokalemi |
Minskad aptit |
|
Vanliga: |
Uttorkning, minskad aptit, hypokalemi |
|
Uttorkning |
|
Mindre vanliga: |
Hypofosfatemi, vätskeretention, hypoalbuminemi, polydipsi, hyperglykemi, hypokalcemi, hypoglykemi, hyponatremi |
|
|
|
Ingen känd frekvens: |
Tumörlys-syndrom1 |
|
|
|
Psykiska störningar |
|||
|
Mycket vanliga: |
|
Depression, sömnlöshet |
|
|
Vanliga: |
Depression, sömnlöshet, ångest |
Ångest |
Sömnlöshet |
|
Mindre vanliga: |
Rastlöshet |
|
|
|
Centrala och perifera nervsystemet |
|||
|
Mycket vanliga: |
Perifer neuropati, neuropati, hypoestesi, parestesi |
Perifer neuropati, yrsel, huvudvärk, dysgeusi |
Perifer neuropati |
|
Vanliga: |
Perifer sensorisk neuropati, yrsel, perifer motorisk neuropati, ataxi, huvudvärk, sensoriska störningar, somnolens, dysgeusi |
|
Yrsel, huvudvärk, dysgeusi |
|
Mindre vanliga: |
Polyneuropati, areflexi, synkope, postural yrsel, dyskinesi, hyporeflexi, neuralgi, neuropatisk smärta, darrningar, sensorisk förlust |
Förlamning i 7:e kranialnerven |
|
|
Ingen känd frekvens: |
Multipla förlamningar i kranialnerverna1 |
|
|
|
Ögon |
|||
|
Vanliga: |
Dimsyn, ökat tårflöde, ögontorrhet, keratokonjunktivitis sicca, madarosis |
Ökat tårflöde |
Dimsyn |
|
Mindre vanliga: |
Minskad synskärpa, onormal syn, ögonirritation, ögonsmärta, konjunktivit, synrubbningar, klåda i ögonen, keratit |
Cystoid makulaödem |
|
|
Sällsynta: |
Cystoid makulaödem 1 |
|
|
|
Öron och balansorgan |
|||
|
Vanliga: |
Vertigo |
|
|
|
Mindre vanliga: |
Tinnitus, öronvärk |
|
|
|
Hjärtat |
|||
|
Vanliga: |
Arytmi, takykardi, supraventrikulär takykardi |
Kronisk hjärtsvikt, takykardi |
|
|
Sällsynta: |
Hjärtstillestånd, kronisk hjärtsvikt, vänsterkammardysfunktion, atrioventrikulärt block1, bradykardi |
|
|
|
Blodkärl |
|||
|
Vanliga: |
Hypertoni, lymfödem, rodnad, blodvallning |
Hypotoni, hypertoni |
Hypotoni, hypertoni |
|
Mindre vanliga: |
Hypotoni, ortostatisk hypotoni, kalla händer och fötter |
Rodnad |
Rodnad |
|
Sällsynta: |
Trombos |
|
|
|
Andningsvägar, bröstkorg och mediastinum |
|||
|
Mycket vanliga: |
|
Dyspné, epistaxis, hosta |
Dyspné |
|
Vanliga: |
Interstitiell pneumonit2, dyspné, epistaxis, faryngolaryngeal smärta, hosta, rinit, rinorré |
Pneumonit5, nästäppa |
Hemoptysis, epistaxis, hosta |
|
Mindre vanliga: |
Lungemboli, lungtromboemboli, pleural effusion, andnöd vid ansträngning, täppt bihåla, minskade andningsljud, produktiv hosta, allergisk rinit, heshet, nästäppa, nästorrhet, väsande andning |
Halstorrhet, nästorrhet |
Pneumonit5 |
|
Ingen känd frekvens: |
Stämbandsförlamning1 |
|
|
|
Magtarmkanalen |
|||
|
Mycket vanliga: |
Diarré, kräkningar, illamående, förstoppning, stomatit |
Diarré, kräkningar, illamående, förstoppning, buksmärta, smärta i övre buken |
Diarré, kräkningar, illamående, förstoppning |
|
Vanliga: |
Gastroesofageal refluxsjukdom, dyspepsi, buksmärta, utspänd buk, smärta i övre buken, oral hypoestesi |
Tarmobstruktion, kolit, stomatit, muntorrhet |
Stomatit, dyspepsi, dysfagi, buksmärta |
|
Mindre vanliga: |
Rektal hemorragi, dysfagi, flatulens, glossodyni, muntorrhet, smärta i tandköttet, lös avföring, esofagit, smärta i nedre buken, munsår, oral smärta |
|
|
|
Lever och gallvägar |
|||
|
Vanliga: |
|
Kolangit |
Hyperbilirubinemi |
|
Mindre vanliga: |
Hepatomegali |
|
|
|
Hud och subkutan vävnad |
|||
|
Mycket vanliga: |
Alopeci, utslag |
Alopeci, utslag |
Alopeci, utslag |
|
Vanliga: |
Pruritus, torr hud, nagelproblem, erytem, nagelpigmentering/missfärgning, hyperpigmentering av huden, onykolys, nagelförändringar |
Pruritus, torr hud, nagelproblem |
Pruritus, nagelproblem |
|
Mindre vanliga: |
Ljuskänslighet, urtikaria, hudsmärta, generaliserad pruritus, utslag med klåda, hudrubbningar, pigmenteringsstörningar, hyperhidros, nagelavlossning, erytematösa utslag, allmänna utslag, dermatit, nattsvett, makulopalpulösa utslag, vitiligo, hypotrikos, ömma naglar, nagelbesvär, makulära utslag, papulösa utslag, hudlesion, svullet ansikte |
|
Hudfjällning, allergisk dermatit, urtikaria |
|
Mycket sällsynta: |
Stevens-Johnsons syndrom 1, toxisk epidermal nekrolys1 |
|
|
|
Ingen känd frekvens: |
palmar-plantar erytrodysestesi syndrom1, 4, sklerodermi1 |
|
|
|
Muskuloskeletala systemet och bindväv |
|||
|
Mycket vanliga: |
Artralgi, myalgi |
Artralgi, myalgi, smärta i extremiteterna |
Artralgi, myalgi |
|
Vanliga: |
Ryggvärk, smärta i extremiteterna, värk i skelettet, muskelkramper, smärta i armar och ben |
Muskelsvaghet, värk i skelettet |
Ryggvärk, smärta i extremiteterna, muskuloskeletal smärta |
|
Mindre vanliga: |
Smärta i bröstväggen, muskulär svaghet, nacksmärta, smärta i ljumsken, muskelspasmer, muskuloskeletal smärta, flanksmärta, obehag i armar och ben, muskelsvaghet |
|
|
|
Njurar och urinvägar |
|||
|
Vanliga: |
|
Akut njursvikt |
|
|
Mindre vanliga: |
Hematuri, dysuri, pollakiuri, nokturi, polyuri, urininkontinens |
Hemolytiskt uremiskt syndrom |
|
|
Reproduktionsorgan och bröstkörtel |
|||
|
Mindre vanliga: |
Smärta i brösten |
|
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
|||
|
Mycket vanliga: |
Trötthet, asteni, pyrexi |
Trötthet, asteni, pyrexi, perifera ödem, frossbrytningar |
Trötthet, asteni, perifera ödem |
|
Vanliga: |
Olustkänsla, letargi, svaghet, perifera ödem, slemhinneinflammation, smärta, stelhet, ödem, minskad prestationsförmåga, bröstsmärta, influensaliknande sjukdom, hyperpyrexi |
Reaktion på injektionsstället |
Pyrexi, bröstsmärta |
|
Mindre vanliga: |
Obehag i bröstkorgen, onormal gång, svullnad, reaktion på injektionsstället |
|
Slemhinneinflammation, extravasation vid infusionsstället, inflammation vid infusionsstället, utslag vid infusionsstället |
|
Sällsynta: |
Extravasation |
|
|
|
Undersökningar |
|||
|
Mycket vanliga: |
|
Viktminskning, ökad alaninaminotransferas |
|
|
Vanliga: |
Viktminskning, ökad alaninaminotransferas, ökad aspartataminotransferas, minskad hematokrit, minskat antal röda blodkroppar, ökad kroppstemperatur, ökad gammaglutamyltransferas, ökad alkalinfosfatas i blodet |
Ökad aspartataminotransferas, ökad halt av bilirubin i blodet, ökad blodkreatinin |
Viktminskning, ökad alaninaminotransferas, ökad aspartataminotransferas, ökad alkalinfosfatas i blodet |
|
Mindre vanliga: |
Ökat blodtryck, viktökning, ökad laktatdehydrogenas i blodet, ökad blodkreatinin, ökad blodsockerhalt, ökad fosforhalt i blodet, minskad kaliumhalt i blodet, ökad halt av bilirubin |
|
|
|
Skador och förgiftningar och behandlingskomplikationer |
|||
|
Mindre vanliga: |
Blåmärke |
|
|
|
Sällsynta: |
Återuppträdande av lokal strålningsreaktion (radiation recall phenomenon), strålningspenumonit |
|
|
1 Rapporterades under uppföljning av Abraxane efter godkännande.
2 Pneumonitfrekvensen har beräknats utifrån sammanslagna data för 1 310 patienter i kliniska prövningar som fick Abraxane i monoterapi för bröstcancer och för andra indikationer.
3 Baserat på laboratoriebedömningar: maximal grad av myelosuppression (behandlad population).
4 Hos vissa patienter som tidigare exponerats för kapecitabin.
Beskrivning av selekterade biverkningar
Detta avsnitt innehåller de vanligaste och kliniskt viktigaste biverkningarna relaterade till Abraxane.
Biverkningar utvärderades hos 229 patienter med metastaserande bröstcancer som behandlades med Abraxane 260 mg/m2 en gång var tredje vecka i den pivotala fas III-studien (Abraxane som monoterapi).
Biverkningar utvärderades hos 421 patienter med metastaserande pankreascancer som behandlades med Abraxane i kombination med gemcitabin (125 mg/m2 Abraxane i kombination med gemcitabin i en dos på 1 000 mg/m2 som gavs på dag 1, 8 och 15 i varje 28-dagarscykel) och 402 patienter som behandlades med gemcitabin i monoterapi och fick första linjens behandling för metastaserande adenocarcinom i pankreas (Abraxane/gemcitabin).
Biverkningar utvärderades hos 514 patienter med icke-småcellig lungcancer som behandlades med Abraxane i kombination med karboplatin (100mg/m2 Abraxane som gavs på dag 1, 8 och 15 i varje 21-dagarscykel i kombination med karboplatin som gavs på dag 1 i varje cykel) i den randomiserade, kontrollerade, kliniska fas III-prövningen (Abraxane/karboplatin). Patientrapporterad taxantoxicitet bedömdes med hjälp av de 4 delskalorna i frågeformuläret FACT (Functional Assessment of Cancer Therapy)-Taxane. Vid användning av upprepad mätanalys gynnade 3 av de 4 delskalorna (perifer neuropati, smärta i händer/fötter och hörsel) Abraxane och karboplatin (p≤0,002). För den andra delskalan (ödem) fanns det ingen skillnad mellan behandlingsarmarna.
Infektioner och infestationer
Abraxane/gemcitabin
Sepsis rapporterades i en frekvens av 5 % hos patienter med eller utan neutropeni som fick Abraxane i kombination med gemcitabin under genomförandet av en prövning av adenocarcinom i pankreas. Hos patienter som behandlades med Abraxane i kombination med gemcitabin rapporterades 22 fall av sepsis varav 5 hade en dödlig utgång. Komplikationer på grund av bakomliggande pankreascancer, särskilt biliär obstruktion eller förekomst av biliär stent, fastställdes som signifikanta bidragande faktorer. Om patienten är febril (oavsett neutrofilantal) ska behandling med bredspektrumantibiotika inledas. Vid uppkomst av febril neutropeni ska behandling med Abraxane och gemcitabin avbrytas tills patienten är feberfri och ANC ≥ 1,5 x 109/L, varefter behandlingen återupptas med en reducerad dosnivå (se avsnitt Dosering)
Blodet och lymfsystemet
Abraxane som monoterapi-metastatisk bröstcancer
Hos patienter med metastatisk bröstcancer var neutropeni den viktigaste hematologiska toxiciteten (rapporterades hos 79 % av patienterna) och var snabbt reversibel och dosberoende. Leukopeni rapporterades hos 71 % av patienterna. Grad 4 neutropeni (< 0,5 x 109/L) uppkom hos 9 % av patienterna som behandlades med Abraxane. Febril neutropeni förekom hos fyra patienter som behandlades med Abraxane. Anemi (Hb < 10 g/dl) observerades hos 46 % av patienterna som fick Abraxane och var allvarlig (Hb < 8 g/dl) i tre fall. Lymfopeni observerades hos 45 % av patienterna.
Abraxane/gemcitabin
Tabell 7 visar frekvensen och svårighetetsgraden för hematologiska abnormaliteter som upptäcktes i laboratorium hos patienter som behandlades med Abraxane i kombination med gemcitabin eller med gemcitabin.
Tabell 7: Hematologiska abnormaliteter upptäckta i laboratorium i en studie av adenocarcinom i pankreas
|
|
Abraxane (125 mg/m2)/ gemcitabin |
gemcitabin |
||
|
Grad 1–4 (%) |
Grad 3–4 (%) |
Grad 1–4 (%) |
Grad 3–4 (%) |
|
|
Anemia,b |
97 |
13 |
96 |
12 |
|
Neutropenia,b |
73 |
38 |
58 |
27 |
|
Trombocytopenib,c |
74 |
13 |
70 |
9 |
a 405 patienter utvärderades i behandlingsgruppen med Abraxane/gemcitabin
b 388 patienter utvärderades i behandlingsgruppen med gemcitabin
c 404 patienter utvärderades i behandlingsgruppen med Abraxane/gemcitabin
Abraxane/karboplatin
Anemi och trombocytopeni rapporterades oftare i gruppen med Abraxane än i gruppen med Taxol och karboplatin (54 % mot 28 % respektive 45 % mot 27 %).
Centrala och perifera nervsystemet
Abraxane som monoterapi-metastatisk bröstcancer
Frekvensen och svårhetsgraden av neurotoxiciteten var i allmänhet dosberoende hos de patienter som fick Abraxane. Perifer neuropati (mest sensorisk neuropati av grad 1 eller 2) observerades hos 68 % av patienterna som fick Abraxane, där 10 % var grad 3 och inga fall var av grad 4.
Abraxane/gemcitabin
För patienter som behandlades med Abraxane i kombination med gemcitabin var mediantiden till den första förekomsten av perifer neuropati av grad 3 140 dagar. Mediantiden till återgång med minst 1 grad var 21 dagar, och mediantiden till återgång från perifer neuropati av grad 3 till grad 0 eller 1 var 29 dagar. 44 % av patienterna (31/70 patienter) med behandling som avbröts på grund av perifer neuropati kunde återuppta behandling med Abraxane i reducerad dos. Inga patienter som behandlades med Abraxane i kombination med gemcitabin hade perifer neuropati av grad 4.
Abraxane/karboplatin
För patienter med icke‑småcellig lungcancer som behandlades med Abraxane och karboplatin var mediantiden till första förekomst av behandlingsrelaterad perifer neuropati av grad 3 121 dagar, och mediantiden till förbättring från behandlingsrelaterad perifer neuropati av grad 3 till grad 1 var 38 dagar. Inga patienter som behandlades med Abraxane och karboplatin fick perifer neuropati av grad 4.
Ögon
Det har förekommit sällsynta rapporter, vid övervakning efter marknadsföring, om nedsatt synskärpa på grund av cystoid makulaödem under behandling med Abraxane (se avsnitt Varningar och försiktighet).
Andningsvägar, bröstkorg och mediastinum
Abraxane/gemcitabin
Pneumonit rapporterades i en frekvens av 4 % med användning av Abraxane i kombination med gemcitabin. Av de 17 fallen av pneumonit som rapporterades hos patienter som behandlades med Abraxane i kombination med gemcitabin hade två en dödlig utgång. Patienterna ska noga övervakas för tecken och symtom på pneumonit. Efter att infektiös etiologi har uteslutits och diagnosen pneumonit har ställts ska behandlingen med Abraxane och gemcitabin sättas ut permanent och lämplig behandling och understödjande åtgärder omgående vidtas (se avsnitt Dosering).
Magtarmkanalen
Abraxane som monoterapi-metastatisk bröstcancer
Illamående förekom hos 29 % av patienterna och diarré hos 25 % av patienterna.
Hud och subkutan vävnad
Abraxane som monoterapi-metastatisk bröstcancer
Alopeci observerades hos > 80 % av patienterna som behandlades med Abraxane. Majoriteten av händelserna med alopeci inträffade inom mindre än en månad efter påbörjad behandling med Abraxane. Uttalat håravfall, ≥ 50 %, förväntas hos de flesta av patienterna som får alopeci.
Muskuloskeletala systemet och bindväv
Abraxane som monoterapi-metastatisk bröstcancer
Artralgi förekom hos 32 % av patienterna som fick Abraxane och var svår i 6 % av fallen. Myalgi förekom hos 24 % av patienterna som fick Abraxane och var svår i 7 % av fallen. Symptomen var ofta övergående; de uppkom vanligtvis tre dagar efter administrering av Abraxane och försvann sedan inom en vecka.
Allmänna symtom och/eller symtom vid administreringsstället
Abraxane som monoterapi-metastatisk bröstcancer
Asteni/trötthet rapporterades hos 40 % av patienterna.
Pediatrisk population
Studien bestod av 106 patienter, varav 104 var barn i åldrarna från 6 månader till yngre än18 år (se avsnitt Farmakodynamik). Varje patient upplevde minst 1 biverkning. De biverkningar som rapporterats mest frekvent var neutropeni, anemi, leukopeni och feber. Allvarliga biverkningar som rapporterades hos fler än 2 patienter var feber, ryggsmärta, perifert ödem och kräkningar. Inga nya indikationer på biverkningar identifierades i det begränsade antalet pediatriska patienter som behandlades med Abraxane och säkerhetsprofilen var densamma som hos den vuxna populationen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen känd antidot mot överdosering av paklitaxel. I händelse av överdosering måste patienten noga övervakas. Behandlingen bör inriktas på de viktigaste förväntade biverkningarna, vilka är benmärgshämning, mukosit och perifer neuropati.
Farmakodynamik
Verkningsmekanism
Paklitaxel är ett nytt antimikrotubulärt medel som främjar bildningen av mikrotubuli från tubulindimerer och stabiliserar mikrotubuli genom att förhindra depolymerisation. Denna stabilisering medför hämning av den normala dynamiska omorganisationen av det mikrotubulära nätverket som är essentiellt för vitala interfas- och mitotiska funktioner i cellen. Dessutom inducerar paklitaxel bildandet av onormala grupperingar eller buntar i mikrotubuli under hela cellcykeln och multipla stjärnformiga buntar av mikrotubuli under mitosen.
Abraxane innehåller nanopartiklar av humant serumalbumin-paklitaxel med en storlek på cirka 130 nm, där paklitaxel förekommer i ett icke-kristallint, amorft tillstånd. Vid intravenös administrering dissocieras nanopartiklarna snabbt till lösliga, albuminbundna paklitaxelkomplex med en storlek på cirka 10 nm. Albumin är känt för att förmedla endotel-transcytos via kaveoler av beståndsdelar i plasma, och in vitro-studier visar att närvaron av albumin i Abraxane förbättrar transporten av paklitaxel över endotelceller. Det antas att den här förbättrade transendoteliala transporten via kaveoler förmedlas av gp 60-albuminreceptorn och att det sker en förstärkt ackumulering av paklitaxel i tumörområdet på grund av det albuminbindande proteinet SPARC (Secreted Protein Acidic Rich in Cysteine).
Klinisk effekt och säkerhet
Bröstcancer
Data från 106 patienter fördelade på två enarmade, öppna studier och från 454 patienter som behandlats i en randomiserad fas III komparativ studie stödjer användandet av Abraxane vid metastaserande bröstcancer. Denna information presenteras nedan.
Enarmade, öppna studier
I en studie administrerades Abraxane som en 30-minuters infusion med en dos på 175 mg/m2 till 43 patienter med metastaserande bröstcancer. I den andra prövningen användes en dos på 300 mg/m2 som en 30-minuters infusion på 63 patienter med metastaserande bröstcancer. Patienter behandlades utan förmedicinering med steroider eller planerad G-CSF-support. Kurer administrerades med 3 veckors-intervall. Svarsfrekvensen för alla patienter var 39,5 % (95 % CI: 24,9 % - 54,2 %) respektive 47,6 % (95 % CI: 35,3 % - 60,0 %). Medeltiden för sjukdomsprogression var 5,3 månader (175 mg/m2; 95 % CI: 4,6 – 6,2 månader) och 6,1 månader (300 mg/m2; 95 % CI: 4,2 – 9,8 månader).
Randomiserad jämförande studie
Denna multicenter-prövning utfördes på patienter med metastaserande bröstcancer som behandlades var tredje vecka med paklitaxel i monoterapi, antingen som paklitaxel i lösning 175 mg/m2 givet som en tre timmars infusion med förmedicinering för att förhindra överkänslighet (N = 225), eller som Abraxane 260 mg/m2 givet som 30-minuters infusion utan förmedicinering (N = 229).
Sextiofyra procent av patienterna hade försämrad prestationsstatus (ECOG 1 eller 2) vid studiens början, 79 % hade viscerala metastaser och 76 % hade >3 platser med metastaser. Fjorton procent av patienterna hade inte fått kemoterapi tidigare, 27 % hade fått kemoterapi enbart adjuvant, 40 % enbart vid metastaserad sjukdom och 19 % både efter metastasering och som adjuvant behandling. Femtionio procent fick studieläkemedel som andra linjens terapi eller senare. Sjuttiosju procent av patienterna hade tidigare exponerats för antracykliner.
Resultat beträffande respons, tid till sjukdomspregression, överlevnad utan pregression och överlevnad hos patienter som får >1:a linjens terapi visas nedan.
|
Effektvariabel |
Abraxane (260 mg/m2) |
Lösningsbaserad paklitaxel (175 mg/m2) |
p-värde |
|---|---|---|---|
|
Responsgrad [95 % CI] (%) |
|||
|
>1:a linjens terapi |
26,5 [18,98; 34,05] (n = 132) |
13,2 [7,54; 18,93] (n = 136) |
0,006a |
|
*Genomsnittlig tid till sjukdomsprogression [95 % CI] (veckor) |
|||
|
>1:a linjens terapi |
20,9 [15,7; 25,9] (n = 131) |
16,1 [15,0; 19,3] (n = 135) |
0,011b |
|
*Mediantid för överlevnad utan sjukdomsprogression [95 % CI] (veckor) |
|||
|
>1:a linjens terapi |
20,6 [15,6; 25,9] (n = 131) |
16,1 [15,0; 18,3] (n = 135) |
0,010b |
|
*Överlevnad [95 % CI] (veckor) |
|||
|
>1:a linjens terapi |
56,4 [45,1; 76,9] (n = 131) |
46,7 [39,0; 55,3] (n = 136) |
0,020b |
*Denna siffra baseras på en rapport från klinisk studie: CA012-0 Addendum sista datering (23 mars 2005)
a Chi-kvadrattest
b Logrank-test
Tvåhundratjugonio patienter som behandlats med Abraxane i det randomiserade, kontrollerade kliniska försöket utvärderades med avseende på säkerheten. Neurotoxicitet utvärderades genom förbättring på en grad för patienter som upplevde grad 3 perifer neuropati vid någon tidpunkt under behandlingen. Naturalförloppet vid perifer neuropati fram till regress till utgångsläget, på grund av kumulativ toxicitet hos Abraxane efter > 6 behandlingsomgångar, har inte utvärderats.
Adenocarcinom i pankreas
En öppen multinationell, randomiserad multicenterstudie utfördes på 861 patienter för att jämföra Abraxane/gemcitabine med gemcitabin som monoterapi som första linjens behandling hos patienter med metastaserande adenocarcinom i pankreas. Abraxane administrerades till patienter (N = 431) som intravenös infusion under 30–40 minuter i en dos på 125 mg/m2, följt av gemcitabin som intravenös infusion under 30–40 minuter i en dos på 1 000 mg/m2 som gavs dag 1, 8 och 15 i varje 28-dagarscykel. I jämförelsegruppen gavs gemcitabin i monoterapi till patienter (N = 430) i enlighet med den rekommenderade dosen och administreringsschemat. Behandlingen gavs fram till sjukdomsprogression eller utveckling av oacceptabel toxicitet. Av de 431 patienterna med adenocarcinom i pankreas som randomiserades till Abraxane i kombination med gemcitabin var majoriteten (93 %) vita, 4 % var svarta och 2 % asiater. 16 % hade ett värde på 100 på Karnofskys skattningsskala (Karnofsky performance status, KPS); 42 % hade ett KPS-index på 90; 35 % hade ett KPS-index på 80; 7 % hade ett KPS på 70, och <1 % av patienterna hade ett KPS på mindre än 70. Patienter med hög risk för kardiovaskulära händelser, anamnes på perifer artärsjukdom och/eller bindvävssjukdomar och/eller interstitiell lungsjukdom uteslöts från studien.
Patienterna fick en medianbehandlingstid på 3,9 månader i behandlingsgruppen med Abraxane/gemcitabin och 2,8 månader i gruppen med gemcitabin. 32 % av patienterna i gruppen med Abraxane/gemcitabin jämfört med 15 % av patienterna i gruppen med gemcitabin fick sex eller fler månaders behandling. För den behandlade populationen var medianvärdet för relativ dosstyrka för gemcitabin 75 % i gruppen Abraxane/gemcitabin och 85 % i gemcitabingruppen. Medianvärdet för relativ dosstyrka för Abraxane var 81 %. En högre kumulativ mediandos av gemcitabin gavs i gruppen Abraxane/gemcitabin (11 400 mg/m2) jämfört med gemcitabingruppen (9 000 mg/m2).
Det primära effektmåttet var total överlevnad. De huvudsakliga sekundära effektmåtten var progressionsfri överlevnad och total responsfrekvens, båda bedömdes genom en oberoende, central, blindad radiologisk granskning enligt RECIST (Response Evaluation Criteria In Solid Tumors, version 1.0).
|
Abraxane (125 mg/m2)/gemcitabin (N=431) |
gemcitabin (N=430) |
|
|---|---|---|
|
Total överlevnad |
||
|
Antal dödsfall (%) |
333 (77) |
359 (83) |
|
Total medianöverlevnad, månader (95 % CI) |
8,5 (7,89; 9,53) |
6,7 (6,01; 7,23) |
|
HR (riskkvot)A+G/G (95 % CI)a |
0,72 (0,617; 0,835) |
|
|
P värdeb |
<0,0001 |
|
|
Överlevnadsfrekvens % (95 % CI) vid | ||
|
1 år |
35 % (29,7; 39,5) |
22 % (18,1; 26,7) |
|
2 år |
9 % (6,2; 13,1) |
4 % (2,3; 7,2 |
|
75:e percentilen för total överlevnad (månader) |
14,8 |
11,4 |
|
Progressionsfri överlevnad |
||
|
Dödsfall eller progression, n (%) |
277 (64) |
265 (62) |
|
Medianvärde för progressionsfri överlevnad, månader (95 % CI) |
5,5 (4,47; 5,95) |
3,7 (3,61; 4,04) |
|
HR (riskkvot)A+G/G (95 % CI)a |
0,69 (0,581; 0,821) |
|
|
P värdeb |
<0,0001 |
|
|
Total responsfrekvens |
||
|
Bekräftad fullständig eller partiell total respons, n (%) |
99 (23) |
31 (7) |
|
95 % CI |
19,1; 27,2 |
5,0; 10,1 |
|
pA+G/pG (95 % CI) |
3,19 (2,178; 4,662) |
|
|
P värde (chitvå-test) |
<0,0001 |
|
CI = konfidensintervall, HRA+G/G = riskkvot för Abraxane+gemcitabin/gemcitabin, pA+G/pG=responsfrekvenskvot för Abraxane+gemcitabin/gemcitabin
a stratifierad Cox proportionella riskmodell
b stratifierat log-ranktest, stratifierat efter geografisk region (Nordamerika jämfört med andra regioner), KPS (70 till 80 jämfört med 90 till 100) och förekomst av levermetastas (ja eller nej).
Det sågs en statistiskt signifikant förbättring av total överlevnad för patienter som behandlades med Abraxane/gemcitabin jämfört med enbart gemcitabin, med en ökning på 1,8 månader av total medianöverlevnad, 28 % total minskning av risk för dödsfall, 59 % förbättring av frekvenserna för 1-årsöverlevnad och 125 % förbättring av frekvenserna för 2-årsöverlevnad.
Figur 1: Kaplan-Meier-kurva för total överlevnad (intent-to-treat-population)
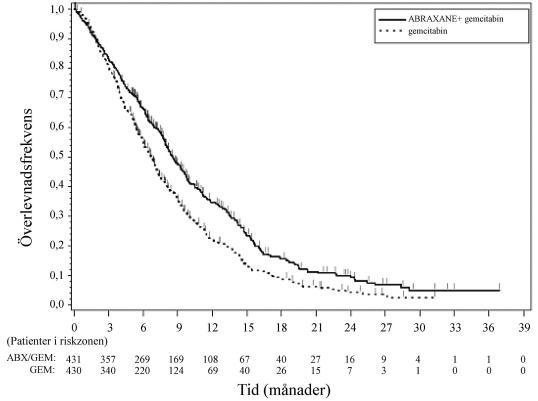
Behandlingseffekterna på total överlevnad gynnade behandlingsgruppen med Abraxane/gemcitabin i majoriteten av de förspecificerade undergrupperna (inklusive kön, KPS, geografisk region, pankreascancerns primära lokalisation, stadium vid diagnos, förekomst av levermetastaser, förekomst av peritoneal carcinomatos, tidigare Whipple-operation, förekomst av biliär stent vid baslinjen, förekomst av lungmetastaser och antal metastaslokalisationer). För patienter i åldern ≥ 75 år i grupperna Abraxane/gemcitabin och gemcitabin var riskkvoten (HR) för överlevnad 1,08 (95 % CI 0,653; 1,797). För patienter med normala nivåer av CA 19-9 vid baslinjen var riskkvoten för överlevnad 1,07 (95 % CI 0,692; 1,661).
Det sågs en statistiskt signifikant förbättring av progressionsfri överlevnad för patienter som behandlades med Abraxane/gemcitabin jämfört med enbart gemcitabin, med en ökning på 1,8 månader av medianvärdet för progressionsfri överlevnad.
Icke-småcellig lungcancer
En randomiserad, öppen multicenterstudie genomfördes på 1 052 kemoterapinaiva patienter med icke-småcellig lungcancer i stadium IIIb/IV. Studien jämförde Abraxane i kombination med karboplatin med lösningsbaserad paklitaxel som första linjens behandling hos patienter med framskriden icke-småcellig lungcancer. Mer än 99 % av patienterna hade en prestationsstatus enligt ECOG (Eastern Cooperative Oncology Group) på 0 eller 1. Patienter med befintlig neuropati av grad ≥2 eller allvarliga medicinska riskfaktorer som involverade något av de viktigaste organsystemen exkluderades. Abraxane administrerades till patienterna (n=521) som en intravenös infusion under 30 minuter i en dos på 100 mg/m2 dag 1, 8 och 15 i varje 21-dagarscykel utan förmedicinering med steroid och utan profylax med granulocyt‑kolonistimulerande faktor. Med början omedelbart efter avslutad administrering av Abraxane, administrerades karboplatin i en dos på AUC = 6 mg×min/ml intravenöst endast dag 1 i varje 21-dagarscykel. Lösningsbaserad paklitaxel administrerades till patienterna (n=531) i en dos på 200 mg/m2 som en intravenös infusion under 3 timmar med normal förmedicinering, omedelbart följt av karboplatin administrerat intravenöst med en dos på AUC = 6 mg×min/ml. Varje läkemedel administrerades dag 1 i varje 21‑dagarscykel. I båda studiegrupperna administrerades behandling tills sjukdomsprogression eller utveckling av oacceptabel toxicitet inträffade. Patienterna fick i mediantal 6 behandlingscykler i båda studiegrupperna.
Det primära effektmåttet var total responsfrekvens definierad som procentandel patienter som uppnådde en objektivt bekräftad fullständig respons eller partiell respons utvärderat genom en oberoende, central, blindad radiologisk granskning enligt RECIST (version 1.0). Patienter i gruppen med Abraxane/karboplatin hade en signifikant högre total responsfrekvens jämfört med patienter i kontrollgruppen: 33 % mot 25 %, p=0,005 (tabell 10). Det fanns en signifikant skillnad i total responsfrekvens i gruppen med Abraxane/karboplatin jämfört med kontrollgruppen hos patienter med icke-småcellig lungcancer av den histologiska typen skivepitelcancer (N=450, 41 % jämfört med 24 %, p<0,001). Detta gav dock ingen skillnad i progressionsfri överlevnad (PFS) eller total överlevnad (OS). Det förelåg ingen skillnad i total responsfrekvens mellan behandlingsgrupperna hos patienter med icke-skivepitelhistologi (N=602, 26 % jämfört med 25 %, p=0,808).
|
Effektparameter |
Abraxane (100 mg/m2/vecka) + karboplatin (N=521) |
Lösningsbaserad paklitaxel (200 mg/m2 var 3:e vecka) + karboplatin (N=531) |
|---|---|---|
|
Total responsfrekvens (oberoende granskning) |
||
|
Bekräftad fullständig eller partiell total respons, n (%) |
170 (33 %) |
132 (25 %) |
|
95 % CI (%) |
28,6; 36,7 |
21,2; 28,5 |
|
pA/pT (95,1 % CI) |
1,313 (1,082; 1,593) |
|
|
P-värdea |
0,005 |
|
CI = konfidensintervall; HRA/T = riskkvot mellan Abraxane/karboplatin och lösningsbaserad paklitaxel/karboplatin; pA/pT = responsfrekvenskvot mellan Abraxane/karboplatin och lösningsbaserad paklitaxel/karboplatin.
a P-värdet är baserat på ett chi-kvadrattest.
Det fanns ingen statistiskt signifikant skillnad i progressionsfri överlevnad (utvärderat genom blindad radiologisk bedömning) och total överlevnad mellan de två behandlingsgrupperna. En efterföljande non-inferiority-analys genomfördes av progressionsfri överlevnad (PFS) och total överlevnad (OS) med en förspecificerad gräns för non-inferiority på 15 %. Kriteriet för non-inferiority uppfylldes för både PFS och OS där den övre gränsen för konfidensintervallet på 95 % för de associerade riskkvoterna var mindre än 1,176 (tabell 11).
|
Effektparameter |
Abraxane (100 mg/m2/vecka) + karboplatin (N=521) |
Lösningsbaserad paklitaxel (200 mg/m2 var 3:e vecka) + karboplatin (N=531) |
|---|---|---|
|
Progressionsfri överlevnada (oberoende granskning) |
||
|
Död eller progression, n (%) |
429 (82 %) |
442 (83 %) |
|
Mediantid till PFS (95 % CI) (månader) |
6,8 (5,7; 7,7) |
6,5 (5,7; 6,9) |
|
HRA/T (95 % CI) |
0,949 (0,830; 1,086) |
|
|
Total överlevnad |
||
|
Antal dödsfall, n (%) |
360 (69 %) |
384 (72 %) |
|
Mediantid till total överlevnad (95 % CI) (månader) |
12,1 (10,8; 12,9) |
11,2 (10,3; 12,6) |
|
HRA/T (95,1 % CI) |
0,922 (0,797; 1,066) |
|
CI = konfidensintervall; HRA/T = riskkvot mellan Abraxane/karboplatin och lösningsbaserad paklitaxel/karboplatin; pA/pT = kvoten av svarsfrekvensen mellan Abraxane/karboplatin och lösningsbaserad paklitaxel/karboplatin.
a Enligt Europeiska läkemedelsmyndighetens metodologiska överväganden för
PFS‑effektmått, användes inte saknade observationer eller initiering av efterföljande ny terapi för uteslutning.
Pediatrisk population
Säkerhet och effekt för pediatriska patienter har inte fastställts (se avsnitt Dosering).
I studie ABI-007-PST-001, en fas 1/2, öppen multicenter- dostitreringssstudie, för att bedöma säkerhet, tolerabilitet och preliminär effekt av Abraxane som ges varje vecka hos pediatriska patienter med recidiverande eller refraktära solida tumörer, inkluderades totalt 106 patienter i åldern ≥ 6 månader till ≤ 24 år.
I fas 1-delen av studien inkluderades totalt 64 patienter i åldern 6 månader till yngre än 18 år gamla och den maximalt tolererade dosen (MTD) fastställdes till 240 mg/m2 administrerad som en intravenös infusion under 30 minuter på dag 1, 8 och 15 i varje 28-dagars cykel.
I fas 2-delen inkluderades totalt 42 patienter, enligt Simons två-stegs minimax design, i åldern 6 månader till 24 år med återkommande eller refraktära Ewings sarkom, neuroblastom eller rhabdomyosarkom för utvärdering av antitumöraktivitet baserat på den totala svarsfrekvensen (Overall Response Rate, ORR). Av de 42 patienterna var 1 patient < 2, 27 i åldern ≥ 2 till <12, 12 i åldern ≥ 12 till <18 och 2 vuxna patienter var i åldern ≥ 18 till 24 år.
I median behandlades patienterna i 2 cykler med MTD. Av de 41 patienterna som kvalificerades för utvärdering av effekt i steg 1, hade 1 patient i rabdomyosarkom-gruppen (N=14) en bekräftad partiell respons (PR) som resulterade i en ORR på 7,1 % (95 % CI: 0,2; 33,9). Ingen bekräftad fullständig respons (Complete Response, CR) eller PR observerades i Ewings sarkom-gruppen (N=13) eller neuroblastom-gruppen (N=14). Ingen av studiegrupperna fortsatte in i steg 2, då det protokolldefinerade kravet på att≥ 2 patienter skulle uppnå ett bekräftat svar inte uppfylldes.
Medianresultatet för total överlevnad var med 1 års uppföljning, 32,1 veckor (95% CI: 21,4, 72,9), 32,0 veckor (95% CI: 12, ej fastställt) och 19,6 veckor (95% CI: 4, 25,7) för Ewings sarkom, neuroblastom respektive rhabdomyosarkom.
Abraxanes övergripande säkerhetsprofil hos pediatriska patienter överensstämde med den kända säkerhetsprofilen av Abraxane hos vuxna (se avsnitt Biverkningar). Baserat på dessa resultat drogs slutsatsen att Abraxane som monoterapi inte har en meningsfull klinisk aktivitet eller överlevnadsfördel som motiverar en vidareutveckling i den pediatriska populationen.
Farmakokinetik
Farmakokinetiken för paklitaxel efter 30- och 180-minuters infusioner av Abraxane vid doser på 80 till 375 mg/m2 bestämdes i kliniska studier. Paklitaxelexponeringen (AUC) ökade linjärt från 2 653 till 16 736 ng/h/ml efter doser från 80 till 300 mg/m2.
I en studie på patienter med framskridna solida tumörer jämfördes farmakokinetikdata för paklitaxel efter Abraxane 260 mg/m2 administrerat intravenöst under 30 minuter med lösningsbaserat paklitaxel 175 mg/m2 administrerat intravenöst under 3 timmar. Baserat på icke-kompartmentell PK-analys var plasmaclearance för paklitaxel större (43 %) med Abraxane än efter en lösningsbaserad paklitaxelinjektion och även distributionsvolym var större (53 %). Det fanns inga skillnader i terminal halveringstid.
I en studie med upprepad dosering, där 12 patienter fick Abraxane intravenöst vid 260 mg/m2 var intrapatient-variabiliteten i AUC 19 % (intervall = 3,21–37,70 %). Det saknades evidens för att paklitaxel ackumulerades vid flera behandlingsomgångar.
Distribution
Efter administrering av Abraxane till patienter med solida tumörer sker distribuering av paklitaxel jämnt till blodkroppar och plasma och binds i hög grad till plasmaproteiner (94 %).
Paklitaxels proteinbindning efter administrering av Abraxane evaluerades med ultrafiltrering i en studie jämförande en och samma patient. Fraktionen av fritt paklitaxel var signifikant högre med Abraxane (6,2 %) än med vätskebaserat paklitaxel (2,3 %). Detta ledde till signifikant högre exponering för obundet paklitaxel med Abraxane jämfört med vätskebaserat paklitaxel, även om den totala exponeringen var jämförbar. Detta beror troligen på att paklitaxel inte stängs in i Cremophor EL-miceller som med vätskebaserat paklitaxel. Enligt publicerad litteratur visar in vitro-studier av bindning till humana serumproteiner, (med paklitaxel i koncentrationer på 0,1 till 50 µg/ml) att förekomsten av cimetidin, ranitidin, dexametason eller difenhydramin inte påverkade proteinbindningsgraden för paklitaxel.
Baserat på populationsfarmakokinetisk analys är den totala distributionsvolymen ungefär 1 741 L. Den stora distributionsvolymen tyder på omfattande extravaskulär distribution och/eller vävnadsbindning av paklitaxel.
Metabolism och eliminering
Enligt publicerad litteratur visar in vitro-studier med humana levermikrosomer och vävnadsskivor att paklitaxel huvudsakligen metaboliseras till 6α-hydroxipaklitaxel och till två mindre metaboliter, 3’-p-hydroxipaklitaxel och 6α-3’-p-dihydroxipaklitaxel. Bildandet av dessa hydroxylerade metaboliter katalyseras av CYP2C8, CYP3A4 respektive både CYP2C8 och CYP3A4 isoenzymer.
Efter en 30-minuters infusion av Abraxane 260 mg/m2 till patienter med metastaserande bröstcancer var medelvärdet för kumulativ utsöndring av oförändrad substans i urinen 4 % av den totala administrerade dosen, med mindre än 1 % som metaboliterna 6α–hydroxipaklitaxel och 3’–p hydroxipaklitaxel, vilket tyder på omfattande icke-renal clearance. Paklitaxel elimineras i huvudsak via levermetabolism och biliär utsöndring.
Vid det kliniska dosintervallet 80 till 300 mg/m2 var genomsnittligt clearance för paklitaxel mellan 13 och 30 l/h/m2 och den genomsnittliga halveringstiden mellan 13 och 27 timmar.
Nedsatt leverfunktion
Effekten av nedsatt leverfunktion på populationsfarmakokinetiken för Abraxane studerades hos patienter med avancerade solida tumörer. Denna analys inkluderade patienter med normal leverfunktion (n=130) och befintlig lindrigt (n=8), måttligt (n=7) eller allvarligt (n=5) nedsatt leverfunktion (enligt kriterier för NCI Organ Dysfunction Working Group). Resultaten visar att lindrigt nedsatt leverfunktion (totalt bilirubin >1 till ≤1,5 x ULN) inte har någon kliniskt relevant effekt på farmakokinetiken för paklitaxel. Patienter med måttligt (totalt bilirubin >1,5 till ≤3 x ULN) eller allvarligt (totalt bilirubin >3 till ≤5 x ULN) nedsatt leverfunktion har en minskning på 22–26 % av den maximala eliminationshastigheten för paklitaxel och en ökning på cirka 20 % av medelvärdet av AUC för paklitaxel jämfört med patienter med normal leverfunktion. Nedsatt leverfunktion har ingen effekt på genomsnittligt Cmax för paklitaxel. Eliminationen av paklitaxel visar även en negativ korrelation med totalt bilirubin och en positiv korrelation med serumalbumin.
Farmakokinetisk/farmakodynamisk modellering visar att det inte finns något samband mellan leverfunktion (enligt albumin vid baslinjen eller nivån av totalt bilirubin) och neutropeni efter justering av exponeringen för Abraxane.
Det finns inga farmakokinetiska data tillgängliga för patienter med totalt bilirubin >5 x ULN eller för patienter med metastaserande adenocarcinom i pankreas (se avsnitt Dosering).
Nedsatt njurfunktion
Populationsfarmakokinetisk analys inkluderade patienter med normal njurfunktion (n=65) och befintlig lindrigt (n=61), måttligt (n=23) eller allvarligt (n=l) nedsatt njurfunktion (enligt utkast till riktlinjer för kriterier för FDA 2010). Lindrigt till måttligt nedsatt njurfunktion (kreatininclearance ≥30 till <90 ml/min) har ingen kliniskt relevant effekt på den maximala eliminationshastigheten och den systemiska exponeringen (AUC och Cmax) för paklitaxel. Farmakokinetiska data är otillräckliga för patienter med allvarligt nedsatt njurfunktion och saknas för patienter med njursjukdom i slutstadiet.
Äldre
Populationsfarmakokinetisk analys för Abraxane inkluderade patienter i åldern 24 till 85 år och visar att ålder inte har någon signifikant påverkan på den maximala eliminationshastigheten och den systemiska exponeringen (AUC och Cmax) för paklitaxel.
Farmakokinetisk/farmakodynamisk modellering som använde data från 125 patienter med framskridna solida tumörer indikerar att patienter ≥65 år kan vara mer mottagliga för utveckling av neutropeni under den första behandlingscykeln, även om paklitaxelexponeringen i plasma inte påverkas av åldern.
Pediatrisk population
Farmakokinetiken för paklitaxel efter 30 minuters intravenös administrering vid dosnivåer på 120 mg/m2 till 270 mg/m2 fastställdes hos 64 patienter (2 till ≤ 18 år) i fas 1 av en fas 1/2-studie med recidiverande och refraktära pediatriska solida tumörer. Efter dosökning från 120 till 270 mg/m2, varieraded paklitaxels genomsnittliga AUC(0-inf) från 8867 till 14361 ng*tim/ml och Cmax från 3488 till 8078 ng/ml.
De dosnormaliserade högsta läkemedelsexponeringsvärdena var jämförbara i hela dosintervallet som studerades. De dosnormaliserade totala läkemedelsexponeringsvärdena var däremot endast jämförbara vid dosintervallet från 120 mg/m2 till 240 mg/m2, med lägre dosnormaliserad AUC∞ vid dosnivån 270 mg/m2. Vid MTD på 240 mg/m2 var genomsnittlig CL 19,1 l/tim och den genomsnittliga terminala halveringstiden var 13,5 timmar.
Hos barn och ungdomspatienter ökade exponeringen för paklitaxel med högre doser och veckovisa läkemedelsexponeringen var högre än hos vuxna patienter.
Andra individbaserade faktorer
Populationsfarmakokinetiska analyser för Abraxane indikerar att kön, ras (asiatisk jämfört med vit) och typ av solid tumör inte har någon kliniskt relevant effekt på den systemiska exponeringen (AUC och Cmax) för paklitaxel. Patienter som vägde 50 kg hade en AUC för paklitaxel som var cirka 25 % lägre än de som vägde 75 kg. Den kliniska relevansen för detta fynd är oklar.
Prekliniska uppgifter
Karcinogenicitet har inte studerats. Enligt publicerad litteratur är dock paklitaxel potentiellt karcinogent och genotoxiskt vid kliniska doser, baserat på dess farmakodynamiska verkningsmekanism. Paklitaxel har påvisats vara klastogent in vitro (kromosomförändringar i humanlymfocyter) och in vivo (mikronukleära tester på möss). Paklitaxel har påvisats vara genotoxisk in vivo (mikrokärntest på mus), men substansen var inte mutagen i Ames-test eller i ett genmutationstest i däggdjursceller från kinesisk hamster (CHO/HGPRT).
Vid doser som administrerades före och under parning och som var lägre än terapeutisk dos till människa associerades paklitaxel med låg fertilitet hos han- och honråttor samt fosterskador. Djurförsök med Abraxane visade icke-reversibla toxiska effekter på de manliga reproduktionsorganen vid kliniskt relevanta exponeringsnivåer. Paklitaxel och/eller dess metaboliter utsöndrades i mjölken hos diande råttor. Efter intravenös administration av radioaktivt märkt paklitaxel till råttor 9 till 10 dygn postpartum var radioaktivitetskoncentrationerna i mjölken högre än i plasmat och sjönk parallellt med koncentrationerna i plasmat.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje injektionsflaska innehåller 100 mg paklitaxel i form av albuminbundna nanopartiklar.
Varje injektionsflaska innehåller 250 mg paklitaxel i form av albuminbundna nanopartiklar.
Efter beredning innehåller varje ml dispersion 5 mg paklitaxel i form av albuminbundna nanopartiklar.
Förteckning över hjälpämnen
Human albuminlösning (innehåller natriumkaprylat och N-acetyl-L tryptofan).
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns under avsnitt Hållbarhet, förvaring och hantering.
Hållbarhet, förvaring och hantering
Hållbarhet
Oöppnade injektionsflaskor
3 år
Hållbarhet för rekonstituerad dispersion i injektionsflaska
Kemisk och fysikalisk stabilitet har för den färdigberedda dispersionen visats i 24 timmar vid 2 °C–8 °C i originalkartongen, skyddat från ljus.
Hållbarhet för den rekonstituerade dispersionen i infusionspåsen
Kemisk och fysikalisk stabilitet har för den färdigberedda dispersionen visats i 24 timmar vid 2 °C–8 °C, följt av 4 timmar vid 25 °C, skyddat från ljus.
Ur ett mikrobiologiskt perspektiv ska den färdigberedda dispersionen användas omedelbart efter beredning och påfyllning av infusionspåsarna, om inte metoden för beredning och påfyllning av infusionspåsen utesluter risken för mikrobiell kontaminering.
Om den inte används omedelbart, så ligger ansvaret för hållbarhetstider och förvaring för användning på användaren.
Den totala kombinerade förvaringstiden för den färdigberedda dispersionen i injektionsflaskan och i infusionspåsen är 24 timmar vid kylförvaring och skyddat från ljus. Det kan följas av förvaring i infusionspåsen i 4 timmar vid högst 25 °C.
Särskilda förvaringsanvisningar
Oöppnade injektionsflaskor
Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt. Varken frysning eller kylning påverkar produktens stabilitet negativt. Inga särskilda temperaturanvisningar.
Färdigberedd dispersion
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet.
Särskilda anvisningar för destruktion och övrig hantering
Försiktighetsåtgärder vid beredning och administrering
Paklitaxel är ett cytotoxiskt anticancer-läkemedel och på samma sätt som med andra potentiellt toxiska föreningar bör man vara försiktig under hanteringen av Abraxane. Användning av handskar, skyddsglasögon och skyddskläder rekommenderas. Om huden kommer i kontakt med dispersionen, skall huden omedelbart sköljas av och tvättas grundligt med tvål och vatten. Om slemhinnor kommer i kontakt med dispersionen, ska slemhinnorna spolas ordentligt med vatten. Abraxane ska endast beredas och administreras av personal som är utbildad i hantering av cytotoxiska ämnen. Gravid personal ska inte hantera Abraxane.
På grund av möjligheten att extravasation inträffar bör infusionsstället noggrant övervakas med avseende på eventuell infiltration under administrering av läkemedlet. Om infusionen av Abraxane begränsas till 30 minuter enligt anvisning minskar sannolikheten för infusionsrelaterade reaktioner.
Beredning och administrering av produkten
Abraxane levereras som ett sterilt, frystorkat pulver för rekonstituering före användning. Efter beredning innehåller varje ml dispersion 5 mg paklitaxel i form av albuminbundna nanopartiklar.
Injektionsflaska à 100 mg: Med en steril spruta ska 20 ml natriumkloridlösning 9 mg/ml (0,9 %) för infusion långsamt injiceras i en injektionsflaska med Abraxane under minst 1 minut.
Injektionsflaska à 250 mg: Med en steril spruta ska 50 ml natriumkloridlösning 9 mg/ml (0,9 %) för infusion långsamt injiceras i en injektionsflaska med Abraxane under minst 1 minut.
Lösningen bör riktas mot flaskans innervägg. Lösningen får inte injiceras direkt på pulvret, eftersom det leder till löddring.
När tillsatsen är klar ska flaskan stå i minst 5 minuter för att pulvret ska blötas upp ordentligt. Därefter ska injektionsflaskan försiktigt och långsamt vridas och/eller vändas under minst 2 minuter, tills allt pulver är fullständigt upplöst. Uppkomst av lödder måste undvikas. Om löddring eller klumpar uppkommer måste lösningen stå i minst 15 minuter tills löddret försvinner.
Den rekonstituerade dispersionen ska vara mjölkaktig och homogen utan synliga fällningar. Viss sättning av den rekonstituerade dispersionen kan förekomma. Om fällningar eller klumpar syns ska flaskan försiktigt vändas igen, för att säkerställa att pulvret är fullständigt upplöst före användning.
Inspektera dispersionen i injektionsflaskan avseende partiklar. Administrera inte den rekonstituerade dispersionen om partiklar observeras i injektionsflaskan.
Den exakta, totala doseringsvolymen av 5 mg/ml dispersion som behövs för patienten ska beräknas och erforderlig mängd rekonstituerad Abraxane ska injiceras i en tom, steril infusionspåse av PVC- eller icke PVC-typ.
Användningen av medicintekniska produkter som innehåller silikonolja som smörjmedel (dvs. sprutor och iv-påsar) för att rekonstituera och administrera Abraxane kan leda till att det bildas proteinhaltiga trådar. Administrera Abraxane med hjälp av ett infusionsset med ett 15 µm filter för att undvika administrering av dessa trådar. Användning av ett 15 µm filter avlägsnar trådar och förändrar inte de fysiska eller kemiska egenskaperna för den rekonstituerade produkten.
Användning av filter med en porstorlek som är mindre än 15 µm kan leda till att filtret blockeras.
Det är inte nödvändigt att använda speciella lösningsbehållare eller administreringssatser utan di(2-etylhexyl)ftalat (DEHP) för att bereda och administrera Abraxane.
Efter administrering rekommenderas att den intravenösa infarten spolas med natriumklorid 9 mg/ml (0,9 %) injektionsvätska, lösning för att säkerställa att hela dosen administreras.
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Förpackningsinformation
Pulver till infusionsvätska, dispersion 5 mg/ml
Vitgult pulver.
20 milliliter inj.-fl. (fri prissättning), EF
Följande produkter har även parallelldistribuerade förpackningar:
Pulver till infusionsvätska, dispersion 5 mg/ml




