1 LÄKEMEDLETS NAMN
Perjeta 420 mg koncentrat till infusionsvätska, lösning
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
En 14 ml-injektionsflaska med koncentrat innehåller 420 mg pertuzumab med en koncentration på 30 mg/ml.
Efter spädning innehåller en ml av lösningen cirka 3,02 mg pertuzumab för initial laddningsdos och cirka 1,59 mg pertuzumab för underhållsdos (se avsnitt 6.6).
Pertuzumab är en humaniserad IgG1 monoklonal antikropp producerad i mammala celler (ovarium från kinesisk hamster) genom rekombinant DNA-teknik.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Koncentrat till infusionsvätska, lösning.
Klar till svagt opalskimrande, färglös till svagt gul lösning
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Tidig bröstcancer
Perjeta är indicerat för användning i kombination med trastuzumab och kemoterapi vid:
-
neoadjuvant behandling av vuxna patienter med HER2-positiv, lokalt avancerad, inflammatorisk bröstcancer eller bröstcancer i tidigt stadium med hög risk för återfall (se avsnitt 5.1)
-
adjuvant behandling av vuxna patienter med HER2-positiv tidig bröstcancer med hög risk för återfall (se avsnitt 5.1)
Metastaserad bröstcancer
Perjeta är indicerat för användning i kombination med trastuzumab och docetaxel av vuxna patienter med HER2-positiv metastaserad eller lokalt recidiverande icke resektabel bröstcancer som inte tidigare behandlats med anti-HER2-terapi eller kemoterapi för sin metastaserade sjukdom.
4.2 Dosering och administreringssätt
Perjeta bör endast initieras under överinseende av läkare som har erfarenhet av administrering av cancerläkemedel. Perjeta bör administreras av sjukvårdspersonal med beredskap att hantera anafylaxi och på en plats där utrustning för återupplivning finns omedelbart tillgänglig.
Dosering
Patienter som ska behandlas med Perjeta måste ha HER2-positiv tumörstatus definierat som 3+ med immunohistokemi (IHC) och/eller ett ratio om ≥ 2,0 med in situ hybridisering (ISH), bedömt med en validerad metod.
För att säkerställa noggranna och reproducerbara resultat, ska testerna genomföras i ett specialiserat laboratorium som kan säkerställa validering av testmetoderna. För fullständiga instruktioner om testning och tolkning, se medföljande information i validerade HER2-testningskit.
Den rekommenderade initiala laddningsdosen av pertuzumab är 840 mg administrerat som en 60-minuters intravenös infusion, därefter följt var tredje vecka av en underhållsdos på 420 mg administrerat under 30 till 60 minuter. En observationsperiod på 30-60 minuter rekommenderas efter varje avslutad Perjeta-infusion. Observationsperioden ska vara avslutad innan någon efterföljande infusion ges av trastuzumab eller kemoterapi (se avsnitt 4.4)
Perjeta och trastuzumab ska ges sekventiellt och inte blandas i samma infusionspåse. Perjeta och trastuzumab kan ges i valfri ordning. Vid administrering tillsammans med pertuzumab rekommenderas att trastuzumab ges enligt ett tre-veckors doseringsschema antingen som:
-
en intravenös infusion med en initial laddningsdos av trastuzumab på 8 mg/kg kroppsvikt, därefter följt var tredje vecka av en underhållsdos på 6 mg/kg kroppsvikt.
eller
-
en subkutan injektion av en fast dos trastuzumab (600 mg) var tredje vecka oavsett patientens kroppsvikt.
Hos patienter som får en taxanbaserad behandling, ska Perjeta och trastuzumab ges först.
Vid administrering tillsammans med Perjeta kan docetaxeldosen initialt vara 75 mg/m2och därefter ökas till 100 mg/m2 vid efterföljande behandlingscykler beroende på vald behandlingsregim och om den initiala dosen tolereras väl. Beroende på val av dosregim kan docetaxel som ett alternativ ges med doseringen 100 mg/m2 var tredje vecka redan från behandlingsstart. Om en karboplatinbaserad behandlingsregim används är den rekommenderade dosen för docetaxel 75 mg/m2 hela tiden (ingen doseskalering). Vid adjuvant behandling med Perjeta är den rekommenderade dosen för paklitaxel 80 mg/m2 en gång per vecka i 12 veckovisa behandlingscykler.
Hos patienter som får en antracyklinbaserad behandling, ska Perjeta och trastuzumab ges efter att hela den antracyklinbaserade behandlingsregimen har fullföljts (se avsnitt 4.4).
Metastaserad bröstcancer
Perjeta ska ges i kombination med trastuzumab och docetaxel. Behandling med Perjeta och trastuzumab kan fortsätta även om behandlingen med docetaxel avbryts.
Tidig bröstcancer
Vid neoadjuvant behandling ska Perjeta administreras i 3 till 6 cykler i kombination med trastuzumab och kemoterapi som en del av en komplett behandlingsregim för tidig bröstcancer (se avsnitt 5.1).
Vid adjuvant behandling ska Perjeta ges i kombination med trastuzumab i totalt ett år (upp till 18 cykler eller fram till sjukdomsprogress eller oacceptabel toxicitet, vilket som inträffar först) som en del av en komplett behandlingsregim för tidig bröstcancer och oavsett tidpunkt för kirurgi. Behandlingen ska inkludera standard antracyklin- och/eller taxan-baserad kemoterapi. Perjeta och trastuzumab ska starta på dag 1 av den första taxan-innehållande cykeln och ska fortsätta även om kemoterapin avbryts.
Sena eller missade doser
För rekommendation om sena eller missade doser, se tabell 1 nedan.
Tabell 1 Rekommendation om sena eller missade doser
|
Tid mellan två sekventiella infusioner |
Perjeta |
trastuzumab |
|
|---|---|---|---|
|
|
i.v. |
s.c. |
|
|
< 6 veckor |
Dosen 420 mg pertuzumab ska ges så snart som möjligt. Vänta inte till nästa planerade doseringstillfälle. Återgå därefter till det ursprungligen planerade dosschemat. |
Dosen 6 mg/kg trastuzumab i.v. ska ges så snart som möjligt. Vänta inte till nästa planerade doseringstillfälle. Återgå därefter till det ursprungligen planerade dosschemat. |
Den fasta dosen 600 mg trastuzumab s.c. ska ges så snart som möjligt. Vänta inte till nästa planerade doseringstillfälle. |
|
≥ 6 veckor |
Laddningsdosen 840 mg pertuzumab ska återigen ges som en 60-minuters intravenös infusion, därefter följt var tredje vecka av en underhållsdos på 420 mg i.v.. |
Laddningsdosen 8 mg/kg av trastuzumab i.v. ska återigen ges under cirka 90 minuter, därefter följt var tredje vecka av en underhållsdos på 6 mg/kg i.v.. |
|
Dosjustering
Dosreduktion rekommenderas inte för Perjeta eller trastuzumab. För detaljer om trastuzumab, se produktresumén (SmPC).
Patienter kan fortsätta med behandling under perioder av reversibel kemoterapi-inducerad myelosuppression men de ska omsorgsfullt övervakas avseende komplikationer till följd av neutropeni under denna tid. För dosjustering av docetaxel och andra kemoterapier, se relevant SmPC.
Om behandlingen med trastuzumab avslutas bör behandlingen med Perjeta avslutas.
Vänsterkammardysfunktion
Perjeta och trastuzumab ska inte administreras under minst 3 veckor om några tecken och symtom som tyder på hjärtsvikt (CHF) uppstår. Behandling med Perjeta ska permanent avslutas om symtomatisk hjärtsvikt bekräftas (se avsnitt 4.4 för mer information).
Patienter med metastaserad bröstcancer
Patienter ska före behandling ha en vänsterkammar-ejektionsfraktion (LVEF) på ≥ 50 %. Perjeta och trastuzumab ska inte ges under minst 3 veckor vid:
-
en nedgång av LVEF till mindre än 40 %.
-
en LVEF på 40%-45 % förknippat med en nedgång på ≥ 10 %-enheter sedan behandlingsstart.
Behandling med Perjeta och trastuzumab kan återupptas om LVEF har återgått till > 45 % eller till 40-45% med en samtidig nedgång på < 10 %-enheter sedan behandlingsstart.
Patienter med tidig bröstcancer
Patienter ska före behandling ha en LVEF på ≥ 55%. (≥ 50% efter avslutning av antracyklinkomponenten av kemoterapin, om den givits). Perjeta och trastuzumab ska inte ges under minst 3 veckor vid:
-
en nedgång av LVEF till mindre än 50% tillsammans med ett fall på ≥ 10%-enheter sedan behandlingsstart.
Behandling med Perjeta och trastuzumab kan återupptas om LVEF återgått till ≥50% eller till en nedgång på < 10%-enheter sedan behandlingsstart.
Äldre patienter
Inga generella skillnader i effekt för Perjeta observerades hos patienter ≥ 65 år och < 65 år, med undantag för diarré som hade en ökad incidens hos patienter ≥ 65 års ålder. Ingen dosjustering är nödvändig hos den äldre populationen ≥ 65 år. Begränsade data finns tillgängliga för patienter > 75 år. Se avsnitt 4.8 för utvärdering av säkerheten av Perjeta hos äldre patienter.
Nedsatt njurfunktion
Dosjustering av pertuzumab behövs inte hos patienter med milt eller måttligt nedsatt njurfunktion. Inga doseringsrekommendationer kan göras för patienter med allvarligt nedsatt njurfunktion eftersom endast begränsade farmakokinetiska data finns tillgängliga (se avsnitt 5.2).
Nedsatt leverfunktion
Säkerhet och effekt för Perjeta har inte studerats hos patienter med nedsatt leverfunktion. Inga särskilda doseringsrekommendationer kan ges.
Pediatrisk population
Säkerhet och effekt för Perjeta hos barn och ungdomar yngre än 18 år har inte fastställts. Det finns inte någon relevant användning av Perjeta i den pediatriska populationen inom indikationen bröstcancer.
Administreringssätt
Perjeta administreras som en intravenös infusion. Läkemedlet ska inte administreras som en intravenös injektion eller bolusinfusion. Anvisningar om spädning av Perjeta innan administrering finns i avsnitt 6.2 och 6.6.
För den initiala laddningsdosen är rekommenderad infusionstid 60 minuter. Om den första infusionen tolereras väl kan efterföljande infusioner administreras under 30 minuter till 60 minuter (se avsnitt 4.4).
Infusionsreaktioner
Infusionshastigheten kan minskas eller avbrytas om patienten utvecklar en infusionsreaktion (se avsnitt 4.8). Infusionen kan återupptas när symtomen avtar. Behandling med syrgas, beta-agonister, antihistaminer, snabba i.v.‑vätskor och antipyretika kan också hjälpa till att lindra symtom.
Överkänslighetsreaktioner/anafylaxi
Infusionen ska omedelbart och permanent avslutas om patienten får en NCI-CTCAE Grad 4 reaktion (anafylaxi), bronkospasm eller akut andnödssyndrom (se avsnitt 4.4).
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
4.4 Varningar och försiktighet
Spårbarhet
För att förbättra spårbarheten av biologiska läkemedel ska namnet och batchnumret för det administrerade läkemedlet tydligt noteras i patientens journal.
Vänsterkammardysfunktion (inklusive hjärtsvikt)
Minskningar i LVEF har rapporterats för läkemedel som blockerar HER2-aktivitet, inklusive Perjeta. Incidens av symtomatisk systolisk dysfunktion i vänsterkammare (LVD [CHF=hjärtsvikt]) var högre hos patienter som behandlats med Perjeta i kombination med trastuzumab och kemoterapi jämfört med trastuzumab och kemoterapi. Patienter som tidigare behandlats med antracykliner eller fått strålbehandling mot bröstområdet kan ha en ökad risk för minskningar i LVEF. Majoriteten av fallen med symtomatisk hjärtsvikt som rapporterades vid adjuvant behandling var patienter som fick antracyklinbaserad kemoterapi (se avsnitt 4.8).
Perjeta har inte studerats hos patienter med: ett värde av LVEF på <50 % innan behandling, en tidigare sjukdomshistoria med hjärtsvikt, minskningar i LVEF till < 50 % under tidigare adjuvant trastuzumab-behandling eller tillstånd som skulle kunna försämra vänsterkammarfunktionen såsom okontrollerad hypertoni, nyligen förekommen hjärtinfarkt, allvarlig hjärtarytmi som kräver behandling eller en total tidigare antracyklin-exponering om > 360 mg/m2 doxorubicin eller ekvivalent.
LVEF ska utvärderas innan behandling med Perjeta inleds och med regelbundna intervaller under behandling med Perjeta (t. ex. en gång vid neoadjuvant behandling och var tolfte vecka vid adjuvant behandling eller metastaserad sjukdom) för att säkerställa att LVEF är inom normala värden. Om LVEF har minskat som nämns i avsnitt 4.2 och inte har förbättrats, eller har minskat ytterligare vid efterföljande utvärdering, ska avbrytande av behandling med Perjeta och trastuzumab starkt övervägas, om inte fördelarna för den enskilda patienten bedöms överväga riskerna.
Risk för hjärtpåverkan ska noggrant övervägas och balanseras mot det medicinska behovet för den individuella patienten innan användning av Perjeta och en antracyklin-baserad behandling påbörjas.
Baserat på de farmakologiska effekterna av pertuzumab och antracykliner kan en ökad risk för hjärttoxicitet förväntas vid samtidig användning av dessa läkemedel jämfört med sekventiell användning.
Sekventiell användning av Perjeta (i kombination med trastuzumab och en taxan) har utvärderats efter epirubicin eller doxorubicin komponenten vid många antracyklin-baserade behandlingar i studierna APHINITY och BERENICE. Däremot finns bara begränsade säkerhetsdata tillgängliga avseende samtidig behandling med Perjeta och en antracyklin. I studien TRYPHAENA gavs Perjeta samtidigt med epirubicin, som en del av FEC-behandling (5-fluorouracil, epirubicin, cyclofosfamid). (se avsnitt 4.8 och 5.1). Endast kemoterapinaiva patienter behandlades och de fick en låg kumulativ dos av epirubicin, (upp till 300 mg/m2). I denna studie var hjärtsäkerheten jämförbar med den som observerades hos patienter som fick samma behandlingsregim men med Perjeta administrerat sekventiellt (efter FEC-kemoterapi).
Infusionsreaktioner
Behandling med Perjeta har förknippats med infusionsreaktioner, inklusive händelser med dödlig utgång (se avsnitt 4.8). Noggrann observation av patienten under infusionen och 60 minuter efter den första infusionen, samt under och 30-60 minuter efter de efterföljande infusionerna av Perjeta rekommenderas. Om en signifikant infusionsreaktion uppstår, ska infusionshastigheten minskas eller infusionen avbrytas och lämpliga medicinska behandlingar administreras. Patienter ska utvärderas och noggrant övervakas tills tecken och symtom helt försvunnit. För patienter med allvarliga infusionsreaktioner ska permanent avslutning av behandlingen övervägas. Denna kliniska bedömning ska baseras på svårighetsgraden av den föregående reaktionen och svaret på administrerad behandling av biverkningen (se avsnitt 4.2).
Överkänslighetsreaktioner/anafylaxi
Patienter bör observeras noggrant för överkänslighetsreaktioner. Svår överkänslighet, inklusive anafylaxi och händelser med dödlig utgång, har observerats med Perjeta (se avsnitt 4.8). Läkemedel för att behandla sådana reaktioner, såväl som akututrustning, ska vara tillgängliga för omedelbar användning. Behandling med Perjeta måste permanent avslutas om något av följande uppstår: NCI-CTCAE Grad 4 överkänslighetsreaktioner (anafylaxi), bronkospasm eller akut andnödssyndrom (se avsnitt 4.2).
Febril neutropeni
Patienter behandlade med Perjeta, trastuzumab och docetaxel har ökad risk för febril neutropeni jämfört med patienter behandlade med placebo, trastuzumab och docetaxel, särskilt under de första 3 behandlingscyklerna (se avsnitt 4.8). I CLEOPATRA-studien på metastaserad bröstcancer var nadirvärdet för neutrofiler liknande hos Perjeta-behandlade och placebo-behandlade patienter. Den högre incidensen av febril neutropeni hos Perjeta-behandlade patienter var förknippad med en högre incidens av mukosit och diarré hos dessa patienter. Symtomatisk behandling för mukosit och diarré ska övervägas. Inga fall av febril neutropeni rapporterades efter avslutad behandling med docetaxel.
Diarré
Perjeta kan framkalla svår diarré. Diarré är vanligast vid samtidig administrering av taxanbehandling. Äldre patienter (≥ 65 år) har en högre risk för diarré jämfört med yngre patienter (< 65 år). Behandla diarrén enligt standardförfarande och riktlinjer. Tidig intervenering med loperamid, vätske- och elektrolytersättning ska övervägas, särskilt hos äldre patienter, och vid fall med allvarlig eller utdragen diarré. Uppehåll i behandlingen med pertuzumab ska övervägas om inga förbättringar av patientens tillstånd uppnås. När diarrén är under kontroll kan behandling med pertuzumab återupptas.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
I en substudie omfattande 37 patienter från den randomiserade pivotala CLEOPATRA-studien på metastaserad bröstcancer observerades inga farmakokinetiska interaktioner mellan pertuzumab och trastuzumab eller mellan pertuzumab och docetaxel. I den populationsfarmakokinetiska analysen har heller inga bevis för interaktion mellan läkemedlen pertuzumab och trastuzumab eller mellan läkemedlen pertuzumab och docetaxcel visats. Denna avsaknad av läkemedelsinteraktion bekräftades av farmakokinetiska data från studierna NEOSPHERE och APHINITY.
Fem studier utvärderade pertuzumabs effekter på farmakokinetiken hos samtidigt administrerade cytotoxiska läkemedel: docetaxel, paklitaxel, gemcitabin, capecitabin, karboplatin och erlotinib. Det fanns inga bevis för någon farmakokinetisk interaktion mellan pertuzumab och något av dessa läkemedel. Farmakokinetiken för pertuzumab i dessa studier var jämförbar med observationer från studier med endast ett läkemedel.
4.6 Fertilitet, graviditet och amning
Preventivmetoder
Fertila kvinnor skall använda effektiv preventivmetod under behandlingen med Perjeta och till och med 6 månader efter sista pertuzumab-dosen.
Graviditet
Det finns begränsad mängd data från användningen av pertuzumab i gravida kvinnor.
Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt 5.3).
Perjeta rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel.
Amning
Eftersom humant IgG utsöndras i människans bröstmjölk och den möjliga absorptionen och skadan för barnet är okänd, måste ett beslut fattas om man ska avbryta amningen eller avbryta/avstå från behandling med Perjeta efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan (se avsnitt 5.2).
Fertilitet
Inga särskilda fertilitetsstudier på djur har genomförts för att utvärdera pertuzumabs effekt. I en toxicitetsstudie med upprepad dosering på cynomolgusapor har inga definitiva slutsatser kunnat dras angående biverkningar på de manliga reproduktionsorganen. Inga biverkningar observerades hos könsmogna kvinnliga cynomolgusapor som exponerades för pertuzumab (se avsnitt 5.3).
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Perjeta har en liten effekt på förmågan att framföra fordon eller använda maskiner baserat på rapporterade biverkningar. Yrsel kan förekomma vid behandling med Perjeta (se avsnitt 4.8). Patienter som får infusionsreaktioner bör avrådas från att framföra fordon och använda maskiner tills symtomen avklingar.
4.8 Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerheten för Perjeta har utvärderats hos fler än 6 000 patienter i fas I-, II- och III‑studier hos patienter med olika maligniteter och huvudsakligen behandlade med Perjeta i kombination med andra antineoplastiska läkemedel. Dessa studier innefattar de pivotala studierna CLEOPATRA (n=808), NEOSPHERE (n=417), TRYPHAENA (n=225), och APHINITY (n=4804) [poolade i tabell 2]. Säkerheten för Perjeta var generellt överensstämmande mellan studierna, även om incidensen och de vanligaste biverkningarna varierade beroende på om Perjeta gavs i monoterapi eller samtidigt med andra antineoplastiska läkemedel.
Lista över biverkningar i tabellform
Tabell 2 sammanfattar biverkningarna från Perjetabehandlade grupper i följande pivotala kliniska studier:
-
CLEOPATRA, där Perjeta gavs i kombination med docetaxel och trastuzumab till patienter med metastaserad bröstcancer (n=453)
-
NEOSPHERE (n=309) och TRYPHAENA (n=218), där Perjeta gavs neoadjuvant i kombination med trastuzumab och kemoterapi till patienter med lokalt avancerad, inflammatorisk, eller tidig bröstcancer
-
APHINITY, där Perjeta gavs adjuvant i kombination med trastuzumab och antracyklinbaserad eller icke-antracyklinbaserad, taxaninnehållande kemoterapi till patienter med tidig bröstcancer (n=2364)
I tabell 2 ingår även biverkningar som rapporterats efter marknadsintroduktionen. Eftersom Perjeta användes i kombination med trastuzumab och kemoterapi i dessa studier är det svårt att säkerställa orsakssambandet mellan en biverkning och ett specifikt läkemedel.
Biverkningarna är listade nedan enligt MedDRAs organsystem och frekvenser:
Mycket vanliga (≥ 1/10)
Vanliga (≥ 1/100, < 1/10)
Mindre vanliga (≥ 1/1 000, <1 /100)
Sällsynta (≥ 1/10 000, < 1/1 000)
Mycket sällsynta (< 1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Inom varje frekvensgruppering och organsystem presenteras biverkningarna efter fallande allvarlighetsgrad.
De vanligaste biverkningarna (≥30%) från dessa poolade data var diarré, alopeci, illamående, trötthet, neutropeni och kräkningar. De vanligaste NCI-CTCAE grad 3‑4 biverkningarna (≥10%) var neutropeni och febril neutropeni.
Tabell 2 Sammanfattning av biverkningar hos patienter som behandlats med Perjeta i kliniska studier^, samt efter marknadsintroduktion#
|
Organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
|
|---|---|---|---|---|---|
|
Infektioner och infestationer |
Nasofaryngit |
Paronyki Övre luftvägsinfektion |
|
|
|
|
Blodet och lymfsystemet |
Febril neutropeni* Neutropeni Leukopeni Anemi |
|
|
|
|
|
Immunsystemet |
Infusions-reaktion°°,* |
Överkänslighet°,* Läkemedels-överkänslighet°,* |
Anafylaktisk reaktion°,* |
Cytokin-frisättnings-syndrom°° |
|
|
Metabolism och nutrition |
Minskad aptit |
|
|
Tumörlys-syndrom# |
|
|
Psykiska störningar |
Sömnlöshet |
|
|
|
|
|
Centrala och perifera nervsystemet |
Perifer neuropati Huvudvärk Smak-förändringar Perifer sensorisk neuropati Yrsel Parestesi |
|
|
|
|
|
Ögon |
Ökat tårflöde |
|
|
|
|
|
Hjärtat |
|
Vänsterkammar-dysfunktion ** |
Hjärtsvikt** |
|
|
|
Blodkärl |
Värmevallning |
|
|
|
|
|
Andningsvägar, bröstkorg och mediastinum |
Hosta Epistaxis (näsblod) Dyspné |
|
Interstitiell lungsjukdom Pleura-utgjutning |
|
|
|
Magtarm-kanalen |
Diarré Kräkning Stomatit Illamående Förstoppning Dyspepsi Buksmärta |
|
|
|
|
|
Hud och subkutan vävnad |
Alopeci Utslag Nagelpåverkan Klåda Torr hud |
|
|
|
|
|
Muskulo-skeletala systemet och bindväv |
Myalgi Artralgi Smärta i extremiteter |
|
|
|
|
|
|
|
|
|||
|
Organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
|---|---|---|---|---|
|
Allmänna symtom och/eller symtom vid administrerings-stället |
Slemhinne-inflammation Perifera ödem Pyrexi Trötthet Asteni |
Frossa Smärta Ödem |
^ Tabell 2 visar poolade data från den totala behandlingsperioden i CLEOPATRA (med data cut off 11 februari 2014; medianantalet Perjeta-cykler var 24) och från den neoadjuvanta behandlingsperioden i NEOSPHERE (medianantalet Perjeta-cykler var 4, för alla behandlingsarmar) och TRYPHAENA (medianantalet Perjeta-cykler var 3–6 för behandlingsarmarna) och från behandlingsperioden i APHINITY (medianantalet Perjeta-cykler var 18).
* Biverkningar med dödlig utgång har rapporterats.
** För den totala behandlingsperioden för 4 studier.
Incidensen av vänsterkammardysfunktion och hjärtsvikt reflekterar MedDRA-terminologin rapporterad i de individuella studierna.
° Överkänslighet/anafylaktisk reaktion är baserat på en grupp av termer.
°° Infusionsreaktion inkluderar ett flertal olika termer inom ett tidsintervall, se ”Beskrivning av utvalda biverkningar” nedan.
# Biverkningar rapporterade efter marknadsintroduktionen.
Beskrivning av utvalda biverkningar
Vänsterkammardysfunktion (LVD)
I den pivotala CLEOPATRA-studien vid metastaserad bröstcancer var incidensen av vänsterkammardysfunktion (LVD) under behandling högre i den placebobehandlade gruppen än i den Perjeta-behandlade gruppen (8,6 % respektive 6,6 %). Incidensen av symtomatisk LVD var också lägre i den Perjeta-behandlade gruppen (1,8 % i den placebobehandlade gruppen jämfört med 1,5 % i den Perjeta-behandlade gruppen) (se avsnitt 4.4).
I den neoadjuvanta studien NEOSPHERE, i vilken patienter fick 4 cykler med Perjeta som neoadjuvant behandling, var incidensen av vänsterkammardysfunktion (LVD) (under den totala behandlingsperioden) högre i gruppen behandlad med Perjeta, trastuzumab och docetaxel (7,5 %) jämfört med gruppen som behandlades med trastuzumab och docetaxel (1,9 %). Det fanns ett fall av symtomatisk LVD i den Perjeta- och trastuzumab-behandlade gruppen.
I den neoadjuvanta studien TRYPHAENA var incidensen av vänsterkammardysfunktion (LVD) (under den totala behandlingsperioden) 8,3 % i gruppen som behandlades med Perjeta plus trastuzumab och FEC (5-fluorouracil, epirubicin, cyclofosfamid)följt av Perjeta plus trastuzumab och docetaxel; 9,3 % i gruppen som behandlades med Perjeta plus trastuzumab och docetaxel efter FEC och 6,6 % i gruppen som behandlades med Perjeta i kombination med TCH (docetaxel, karboplatin och trastuzumab). Incidensen av symtomatisk LVD (hjärtsvikt) var 1,3 % i gruppen som behandlades med Perjeta plus trastuzumab och docetaxel efter FEC (detta exkluderar en patient som fick symtomatisk LVD under FEC-behandling före administrering av Perjeta plus trastuzumab och docetaxel) och även 1,3 % i gruppen som behandlades med Perjeta i kombination med TCH. Inga patienter i gruppen som behandlades med Perjeta plus trastuzumab och FEC följt av Perjeta plus trastuzumab och docetaxel upplevde symtomatisk LVD.
I den neoadjuvanta behandlingsfasen av BERENICE-studien var incidensen av NYHA Klass III/IV symptomatisk LVD (hjärtsvikt enligt NCI-CTCAE v.4) 1,5% i gruppen behandlad med dosintensiv doxorubicin och cyklofosfamid (AC ) följt av Perjeta plus trastuzumab och paklitaxel, och ingen av patienterna (0%) upplevde symptomatisk LVD i gruppen behandlad med FEC följt av Perjeta i kombination med trastuzumab och docetaxel. Incidensen av asymptomatisk LVD (ejektionsfraktionsminskning enligt NCI-CTCAE v.4) var 7% i gruppen behandlad med dosintensiv AC följt av Perjeta plus trastuzumab och paklitaxel och 3,5% i gruppen behandlad med FEC följt av Perjeta plus trastuzumab och docetaxel.
I APHINITY, var incidensen av symptomatisk hjärtsvikt (NYHA klass III eller IV) med en LVEF-minskning på minst 10% från behandlingsstart och till <50% var <1% (0,8% av Perjeta-behandlade patienter jämfört med 0,4% av placebobehandlade patienter). Av patienterna som upplevde symptomatisk hjärtsvikt, återhämtade sig 62,5% av Perjeta-behandlade patienter och 66,7% av placebobehandlade patienter (definierat som 2 LVEF- mätningar i följd över 50%) vid data cutoff. Majoriteten av händelserna rapporterades hos antracyklin-behandlade patienter. Asymptomatiska eller milt symptomatiska (NYHA class II) minskningar i LVEF på minst 10% från behandlingsstart och till <50% rapporterades hos 2,7% av Perjeta-behandlade patienter och 2,9% av placebobehandlade patienter, av vilka 84,4% av Perjeta-behandlade patienter och 87,0% placebo-behandlade patienter hade återhämtat sig vid data cutoff.
Infusionsreaktioner
En infusionsreaktion definierades i de pivotala studierna som en händelse som rapporterats som överkänslighet, anafylaktisk reaktion, akut infusionsreaktion eller cytokinfrisättningssyndrom som uppstår under en infusion eller under samma dag som infusionen givits. I den pivotala studien CLEOPATRA gavs den initiala laddningsdosen Perjeta dagen innan trastuzumab och docetaxel för att undersöka Perjeta-relaterade biverkningar. Under första dagen när endast Perjeta administrerades var den totala frekvensen infusionsreaktioner 9,8 % i den placebo-behandlade gruppen och 13,2 % i den Perjeta-behandlade gruppen. Majoriteten av infusionsreaktionerna var milda eller måttliga. De vanligaste infusionsreaktionerna (≥ 1,0 %) i den Perjeta-behandlade gruppen var pyrexi, frossa, trötthet, huvudvärk, asteni, överkänslighet och kräkningar.
Under den andra behandlingscykeln när alla läkemedel administrerades under samma dag var de vanligaste infusionsreaktionerna (≥ 1,0 %) i den Perjeta-behandlade gruppen trötthet, smakförändringar, läkemedelsöverkänslighet, myalgi och kräkningar (se avsnitt 4.4).
I de neoadjuvanta och adjuvanta studierna administrerades Perjeta samma dag som andra studieläkemedel vid samtliga cykler. Infusionsreaktioner inträffade hos 18,6% - 25,0% av patienterna på den första dagen med Perjeta-administrering (i kombination med trastuzumab och kemoterapi). Typ och händelsernas allvarlighetsgrad överensstämde med de som observerades i CLEOPATRA-studien vid de cykler då Perjeta gavs samma dag som trastuzumab och docetaxel. Majoriteten av infusionsreaktionerna var då milda eller måttliga i allvarlighetsgrad.
Överkänslighetsreaktioner/anafylaxi
I CLEOPATRA-studien vid metastaserad bröstcancer var den totala frekvensen överkänslighets-/anafylaktiska reaktioner som rapporterats av prövaren under hela behandlingsperioden 9,3 % i den placebo-behandlade gruppen och 11,3 % i den Perjeta-behandlade gruppen, av vilka 2,5 % respektive 2,0 % var NCI-CTCAE Grad 3-4. Totalt uppvisade 2 patienter i den placebo-behandlade gruppen och 4 patienter i den Perjeta-behandlade gruppen händelser som beskrevs som anafylaxi av prövaren (se avsnitt 4.4).
Sammanfattningsvis var majoriteten av överkänslighetsreaktionerna milda eller måttliga i allvarlighetsgrad och avhjälptes under behandling. Baserat på gjorda ändringar i behandling i studien, bedömdes de flesta reaktionerna som sekundära till docetaxel-infusioner.
I de neoadjuvanta och adjuvanta studierna överensstämde överkänslighets-/anafylaxihändelserna med de som observerades i CLEOPATRA-studien. I NEOSPHERE-studien upplevde två patienter anafylaxi i den Perjeta- och docetaxel-behandlade gruppen. I båda studierna TRYPHAENA och APHINITY var den totala frekvensen av överkänslighet/anafylaxi högst i den Perjeta- och TCH-behandlade gruppen (13,2 % respektive 7,6%) varav 2,6 % repektive 1,3% var grad 3–4 enligt NCI-CTCAE.
Febril neutropeni
I den pivotala studien CLEOPATRA uppvisade majoriteten av patienterna i båda behandlingsgrupperna leukopeni vid åtminstone ett tillfälle (63,0 % av patienterna i den Perjeta-behandlade gruppen och 58,3 % av patienterna i den placebo-behandlade gruppen). I de flesta fall var det händelser av neutropeni (se avsnitt 4.4). Febril neutropeni förekom hos 13,7 % av Perjeta-behandlade patienter och hos 7,6 % av placebo-behandlade patienter. I båda behandlingsgrupperna var andelen patienter som uppvisade febril neutropeni störst vid första behandlingscykeln och minskade stadigt därefter. En högre incidens av febril neutropeni observerades hos asiatiska patienter i båda behandlingsgrupperna jämfört med hos patienter med annat ursprung och från andra geografiska områden. Bland de asiatiska patienterna var incidensen av febril neutropeni högre i den Perjeta-behandlade gruppen (25,8 %) jämfört med i den placebo-behandlade gruppen (11,3 %).
I NEOSPHERE-studien upplevde 8,4 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel febril neutropeni jämfört med 7,5 % av patienterna som behandlades med trastuzumab och docetaxel. I TRYPHAENA-studien inträffade febril neutropeni hos 17,1 % av patienterna som gavs neoadjuvant behandling med Perjeta + TCH och 9,3 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel efter FEC. I TRYPHAENA-studien var incidensen av febril neutropeni högre hos patienter som fick sex cykler med Perjeta jämfört med patienter som fick tre cykler med Perjeta, oberoende av vilken kemoterapi som gavs. Liksom i studien CLEOPATRA-studien observerades en högre incidens av neutropeni och febril neutropeni bland asiatiska patienter jämfört med andra patienter i de båda neoadjuvanta studierna. I NEOSPHERE-studien upplevde 8,3 % av de asiatiska patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel febril neutropeni jämfört med 4,0 % av de asiatiska patienterna som gavs neoadjuvant behandling med trastuzumab och docetaxel.
I APHINITY-studien inträffade febril neutropeni hos 12,1% av Perjetabehandlade patienter och 11,1% av placebobehandlade patienter. Liksom i studierna CLEOPATRA, TRYPHAENA och NEOSPHERE oberverades en högre incidens av febril neutropeni hos Perjetabehandlade asiatiska patienter jämfört med andra raser i APHINITY-studien (15,9% of Perjeta-behandlade patienter och 9,9% av placebo-behandlade patienter).
Diarré
I CLEOPATRA-studien vid metastaserad bröstcancer förekom diarré hos 68,4 % av de Perjeta-behandlade patienterna och hos 48,7 % av de placebo-behandlade patienterna (se avsnitt 4.4). De flesta fallen var milda till måttliga i allvarlighetsgrad och förekom under de första behandlingscyklerna. Incidensen av diarré med NCI-CTCAE grad 3-4 var 9,3 % hos Perjeta-behandlade patienter jämfört med 5,1 % hos placebo-behandlade patienter. Mediandurationen av den längsta episoden var 18 dagar hos Perjeta-behandlade patienter och 8 dagar hos placebo-behandlade patienter. Patienter med diarré svarade väl vid förebyggande behandling med läkemedel mot diarré.
I NEOSPHERE-studien förekom diarré hos 45,8 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel jämfört med 33,6 % av patienterna som behandlades med trastuzumab och docetaxel. I TRYPHAENA-studien förekom diarré hos 72,3 % av patienterna som gavs neoadjuvant behandling med Perjeta + TCH och 61,4 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel efter FEC. I båda studierna var majoriteten av händelserna milda till måttliga i allvarlighetsgrad.
I APHINITY-studien rapporterades en högre incidens av diarré i den Perjeta-behandlade armen (71,2%) jämfört med placebo-armen (45,2%). Grad ≥ 3 diarré rapporterades hos 9,8% av patienterna i Perjeta-armen jämfört med 3,7% i placebo-armen. Majoriteten av de rapporterade händelserna var grad 1 eller 2 i allvarlighetsgrad. Den högsta incidensen av diarré (alla grader) rapporterades under perioden med målstyrd behandling+taxan-kemoterapi (61,4% av patienterna i Perjeta-armen jämfört med 33,8% av patienterna i placebo-armen), Incidensen av diarré var mycket lägre efter kemoterapin avslutats, och påverkade 18,1% av patienterna i Perjeta-armen jämfört med 9,2% av patienterna i placebo-armen i perioden med målstyrd behandling post-kemoterapi.
Utslag
I CLEOPATRA-studien vid metastaserad bröstcancer förekom utslag hos 51,7 % av Perjeta-behandlade patienter jämfört med hos 38,9 % av placebo-behandlade patienter. De flest fall var av grad 1 eller 2 i allvarlighetsgrad, förekom under de två första behandlingscyklerna och svarade väl vid standardbehandling, såsom topikal eller oral behandling mot akne.
I NEOSPHERE-studien förekom utslag hos 40,2 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel jämfört med 29,0 % av patienterna som behandlades med trastuzumab och docetaxel. I TRYPHAENA-studien förekom utslag hos 36,8 % av patienterna som gavs neoadjuvant behandling med Perjeta + TCH och 20,0 % av patienterna som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel efter FEC. Incidensen av utslag var högre hos patienter som fick sex cykler med Perjeta jämfört med patienter som fick tre cykler med Perjeta, oberoende av vilken kemoterapi som gavs.
I APHINITY-studien inträffade utslag hos 25,8% av patienterna i Perjeta-armen jämfört med 20,3% av patienterna i placeboarmen. Majoriteten av händelserna med utslag var grad 1 eller 2.
Avvikande laboratorievärden
I CLEOPATRA-studien vid metastaserad bröstcancer var incidensen av neutropeni av grad 3–4 enligt NCI-CTCAE v. 3 balanserad i de två behandlingsgrupperna (86,3 % av Perjeta-behandlade patienter och 86,6 % av placebo-behandlade patienter, inklusive 60,7 % respektive 64,8 % neutropeni av grad 4).
I NEOSPHERE-studien var incidensen av neutropeni av grad 3–4 enligt NCI-CTCAE v. 3 74,5 % hos patienter som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel jämfört med 84,5 % hos patienter som behandlades med trastuzumab och docetaxel, inklusive 50,9 % respektive 60,2 % neutropeni av grad 4. I studien TRYPHAENA-studien var incidensen av neutropeni av grad 3–4 enligt NCI-CTCAE v. 3 85,3 % hos patienter som gavs neoadjuvant behandling med Perjeta + TCH och 77,0 % hos patienter som gavs neoadjuvant behandling med Perjeta, trastuzumab och docetaxel efter FEC, inklusive 66,7 % respektive 59,5 % neutropeni av grad 4.
I APHINITY-studien var incidensen av NCI-CTCAE v.4 grad 3-4 neutropeni 40,6% hos patienter behandlade med Perjeta, trastuzumab och kemoterapi jämfört med 39,1% hos patienter behandlade med placebo, trastuzumab och kemoterapi, inkluderande 28,3% respektive 26,5% grad 4 neutropeni.
Äldre patienter
Incidensen av följande biverkningar av alla grader var minst 5% högre hos patienter ≥ 65 års ålder jämfört med patienter < 65 års ålder: minskad aptit, anemi, viktminskning, asteni, dysgeusi, perifer neuropati, hypomagnesemi och diarré. Begränsade data finns tillgängliga hos patienter > 75 års ålder.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Den maximalt tolererade dosen av pertuzumab har inte bestämts. I kliniska studier har engångsdoser på mer än 25 mg/kg (1727 mg) inte testats.
Vid överdosering måste patienter noggrant övervakas avseende tecken eller symtom på biverkningar och lämplig symtomatisk behandling sättas in.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antineoplastiska medel, monoklonala antikroppar, ATC-kod: L01FD02
Verkningsmekanism
Pertuzumab är en rekombinant humaniserad monoklonal antikropp som specifikt binder till den extracellulära dimeriseringsdomänen (subdomän II) på den humana epidermala tillväxtfaktorreceptorn 2 (HER2) och som därigenom blockerar ligandberoende heterodimerisering av HER2 med andra HER-familjemedlemmar inklusive EGFR, HER3 och HER4. Som ett resultat av detta hämmar pertuzumab ligand-initierad intracellulär signalering genom två huvudsakliga signalvägar, mitogenaktiverat protein (MAP) kinas och fosfoinositid 3-kinas (PI3K).
Hämning av dessa signalvägar kan resultera i både apoptos och stoppad celltillväxt. Dessutom medierar pertuzumab antikroppsberoende cellmedierad cytotoxicitet (ADCC).
Medan pertuzumab ensamt hindrade proliferationen av humana tumörceller så ökade kombinationen av pertuzumab och trastuzumab signifikant anti-tumöraktiviteten i HER2-överuttryckande xenograft-modeller.
Klinisk effekt och säkerhet
Effekten av Perjeta vid HER2-positiv bröstcancer har visats i en randomiserad jämförande fas III-studie och en enarmad fas II- studie vid metastaserad bröstcancer, två randomiserade neoadjuvanta fas II-studier vid tidig bröstcancer(en kontrollerad), en icke-randomiserad neoadjuvant fas II-studie och en randomiserad fas III-studie vid adjuvant behandling.
Överuttryck av HER2 bestämdes vid ett centrallaboratorium och definierades som 3+ med immunohistokemi (IHC) eller ett ratio om ≥ 2,0 med in situ hybridisering (ISH) i studierna som beskrivs nedan.
Metastaserad bröstcancer
Perjeta i kombination med trastuzumab och docetaxel
CLEOPATRA (WO20698) är en multicenter, randomiserad, dubbelblind, placebo-kontrollerad fas III-studie som inkluderade 808 patienter med HER2-positiv metastaserad eller lokalt recividerande icke resektabel bröstcancer. Patienter med kliniskt viktiga hjärtriskfaktorer inkluderades inte (se avsnitt 4.4). På grund av exklusion av patienter med hjärnmetastaser finns inga tillgängliga data för Perjetas effekt på hjärnmetastaser. Det finns mycket begränsade data tillgängliga från patienter med lokalt recividerande icke resektabel sjukdom. Patienter randomiserades 1:1 för att behandlas med placebo + trastuzumab + docetaxel eller Perjeta + trastuzumab + docetaxel.
Standarddoser av Perjeta och trastuzumab gavs i ett 3-veckors-schema. Patienter behandlades med Perjeta och trastuzumab fram till sjukdomsprogress, återtaget samtycke eller ohanterlig toxicitet. Docetaxel gavs som en initial dos på 75 mg/m2 som en intravenös infusion var tredje vecka under minst 6 behandlingscykler. Docetaxel-dosen kunde efter prövarens bedömning höjas till 100 mg/m2 om den initiala dosen tolererades väl.
Det primära effektmåttet i studien var progressionsfri överlevnad (PFS), bedömd av en oberoende bedömningsnämnd (IRF) och definierad som tiden från randomiseringsdatum till datum för sjukdomsprogress eller död (oavsett anledning) om död förekom inom 18 veckor efter senaste tumörbedömning. Sekundära effektmått var överlevnad, progressionsfri överlevnad (PFS) (prövarbedömd), tumörrespons (ORR), responsduration, och tid till symtomprogression enligt ”FACT B Quality of Life”-frågeformulär om livskvalitet.
Ungefär hälften av patienterna i varje behandlingsgrupp hade hormonreceptor-positiv sjukdom (definierat som östrogenreceptor (ER)-positiv och/eller progesteronreceptor (PgR)-positiv) och ungefär hälften av patienterna i varje behandlingsgrupp hade fått tidigare adjuvant eller neoadjuvant behandling. De flesta av dessa patienter hade tidigare fått antracyklininnehållande behandling och 11 % av alla patienter hade tidigare fått trastuzumab. Totalt 43 % av patienterna i båda behandlingsgrupperna hade tidigare fått strålbehandling. Patienternas median-LVEF vid inklusion var 65 % (intervall 50 % - 88 %) i båda grupperna.
Resultaten från CLEOPATRA-studien avseende klinisk effekt är sammanfattade i tabell 3. En statistiskt signifikant förbättring i IRF-bedömd PFS visades i den Perjeta-behandlade gruppen jämfört med den placebo-behandlade gruppen. Värdena för prövarbedömd PFS var samma som värdena för IRF-bedömd PFS.
Tabell 3: Sammanfattning av effektdata i CLEOPATRA-studien
|
Parameter |
Placebo+ trastuzumab + docetaxel n=406 |
Perjeta+ trastuzumab + docetaxel n=402 |
HR (95 % KI) |
p-värde |
|---|---|---|---|---|
|
Progressionsfri överlevnad (oberoende bedömning) – primärt effektmått* | ||||
|
Antal patienter med en händelse |
242 (59 %) |
191 (47,5 %) |
0,62 |
<0,0001 |
|
Antal månader i median |
12,4 |
18,5 |
[0,51;0,75] | |
|
Överlevnad – sekundärt effektmått** | ||||
|
Antal patienter med en händelse |
221 (54,4 %) |
168 (41,8 %) |
0,68 |
0,0002 |
|
Antal månader i median |
40,8 |
56,5 |
[0,56;0,84] | |
|
Tumörrespons (ORR)^ - sekundärt effektmått | ||||
|
Antal patienter med mätbar sjukdom |
336 |
343 |
Skillnad i ORR: |
0,0011 |
|
Antal responders** |
233 (69,3 %) |
275 (80,2 %) |
10,8 % | |
|
95 % KI för ORR |
[64,1; 74,2] |
[75,6; 84,3] |
[4,2,17,5] | |
|
Komplett respons (CR) |
14 (4,2 %) |
19 (5,5 %) | ||
|
Partiell respons (PR) |
219 (65,2 %) |
256 (74,6 %) | ||
|
Stabil sjukdom (SD) |
70 (20,8 %) |
50 (14,6 %) | ||
|
Progressiv sjukdom (PD) |
28 (8,3 %) |
13 (3,8 %) | ||
|
Responsduration †^ | ||||
|
n= |
233 |
275 | ||
|
Antal veckor i median |
54,1 |
87,6 | ||
|
95 % KI för median |
[46;64] |
[71;106] |
* Primär analys av progressionsfri överlevnad, sista datum 13:e maj 2011.
** Event‑driven slutgiltig analys av överlevnad, sista datum 11:e februari 2014.
*** Patienter som uppnått komplett eller partiell respons som bästa tumörsvar, bekräftad enligt RECIST-kriterier.
† Utvärderat hos patienter som uppnått komplett eller partiell respons som bästa tumörsvar.
^ Tumörrespons och responsduration är baserade på tumörbedömningar utförda av en oberoende bedömningsnämnd.
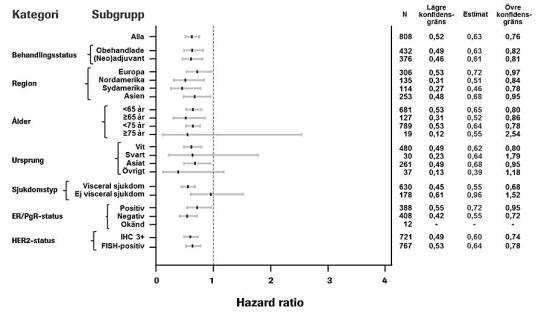
Samstämmiga resultat sågs mellan fördefinierade undergrupper av patienter inklusive undergrupperna baserade på stratifieringsfaktorerna geografisk region och tidigare adjuvant/neoadjuvant behandling eller obehandlad metastaserad bröstcancer (se Figur 1). En post hoc explorativ analys visade att för patienter som tidigare fått trastuzumab (n=88) var HR för IRF-bedömd PFS 0,62 (95 % KI 0,35, 1,07) jämfört med 0,60 (95 % KI 0,43, 0,83) för patienter som hade fått tidigare behandling som inte inkluderade tratuzumab (n=288).
Figur 1 IRF-bedömd progressionsfri överlevnad uppdelad på patient-subgrupper
Den event‑drivna slutliga analysen av överlevnad utfördes när 389 patienter avlidit (221 i den placebobehandlade gruppen och 168 i den Perjeta-behandlade gruppen). Den statistiskt signifikanta överlevnadsfördelen för den Perjeta-behandlade gruppen, tidigare observerad vid en interimanalys av överlevnad (utförd ett år efter primäranalysen), var bibehållen (HR 0,68, p = 0,0002 log-ranktest). Mediantiden till död var 40,8 månader i den placebobehandlade gruppen och 56,5 månader i den Perjeta-behandlade gruppen (se tabell 3, figur 2).
En deskriptiv analys av överlevnad utfördes vid studiens slut när 515 patienter avlidit (280 i den placebobehandlade gruppen och 235 i den Perjeta-behandlade gruppen). Den visade att den statistiskt signifikanta överlevnadsfördelen för den Perjeta-behandlade gruppen, bibehölls över tid efter en median uppföljningstid på 99 månader (HR 0,69, p < 0,0001 log-ranktest). (Mediantiden till död var 40,8 månader i den placebobehandlade gruppen och 57,1 månader i den Perjeta-behandlade gruppen). Riktmärke för uppskattad överlevnad efter 8 år var 37% i den Perjeta-behandlade gruppen och 23% i den placebobehandlade gruppen.
Figur 2 Kaplan-Meier-kurva för event-driven överlevnad
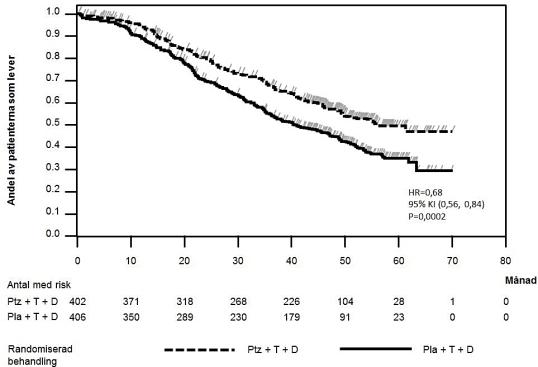
HR = Hazard ratio; KI = konfidensintervall; Pla = placebo; Ptz = pertuzumab (Perjeta); T = trastuzumab (Herceptin); D = docetaxel.
Inga signifikanta skillnader mellan de två behandlingsgrupperna sågs i hälsorelaterad livskvalité bedömd via FACT-B TOI-PFB-värden.
Ytterligare stödjande information från kliniska studier
BO17929 – enarmad studie vid metastaserad bröstcancer
BO17929 var en fas II-, icke-randomiserad studie på patienter med metastaserad bröstcancer vars tumörer progredierat under behandling med trastuzumab. Behandling med Perjeta och trastuzumab resulterade i en responsfrekvens på 24,2 %, och 25,8 % av patienterna uppvisade stabilisering av sjukdom som höll i sig minst 6 månader, vilket indikerar att Perjeta är aktivt efter progress med trastuzumab.
Tidig bröstcancer
Neoadjuvant behandling av bröstcancer
I den neoadjuvanta behandlingssituationen anses lokalt avancerad och inflammatorisk bröstcancer som högrisk oavsett hormonreceptorstatus. Vid tidigt stadium av bröstcancer ska tumörstorlek, grad, hormonreceptorstatus och lymfkörtelmetastaser tas i beaktande i riskbedömningen.
Indikationen vid neoadjuvant behandling av bröstcancer baseras på att en förbättring i andelen patologisk komplett respons visas och trender till förbättring av sjukdomsfri överlevnad som dock inte fastställer eller exakt mäter en nytta när det gäller långsiktiga resultat, såsom överlevnad eller sjukdomsfri överlevnad.
NEOSPHERE (WO20697)
NEOSPHERE är en fas II-, multicenter, multinationell, randomiserad och kontrollerad studie med Perjeta som genomfördes på 417 vuxna kvinnliga patienter med nyligen diagnosticerad, tidig, inflammatorisk eller lokalt avancerad HER2-positiv bröstcancer (T2-4d, primär tumör > 2 cm i diameter) som inte erhållit tidigare trastuzumab-behandling, kemoterapi eller strålbehandling. Patienter med metastaser, bilateral bröstcancer, kliniskt viktiga hjärtriskfaktorer (se avsnitt 4.4) eller LVEF < 55 % inkluderades inte. Majoriteten av patienterna var yngre än 65 år.
Patienter randomiserades till att få en av följande neoadjuvanta behandlingar i 4 cykler före kirurgi:
-
Trastuzumab i kombination med docetaxel
-
Perjeta i kombination med trastuzumab och docetaxel
-
Perjeta i kombination med trastuzumab
-
Perjeta i kombination med docetaxel.
Randomiseringen var stratifierad efter bröstcancertyp (operabel, lokalt avancerad eller inflammatorisk) och ER- eller PgR-positivitet.
Pertuzumab gavs intravenöst med en startdos på 840 mg, följt av 420 mg var tredje vecka. Trastuzumab gavs intravenöst med en startdos på 8 mg/kg, följt av 6 mg/kg var tredje vecka. Docetaxel gavs intravenöst med en startdos på 75 mg/m2, följt av 75 mg/m2 eller 100 mg/m2 (om dosen tolererades) var tredje vecka. Efter kirurgi fick alla patienter 3 cykler av 5-fluorouracil (600 mg/m2), epirubicin (90 mg/m2) och cyklofosfamid (600 mg/m2) (FEC) givet intravenöst var tredje vecka och trastuzumab administrerat intravenöst var tredje vecka för att fullfölja ett års behandling. Patienter som endast fick Perjeta plus trastuzumab före kirurgi fick senare både FEC och docetaxel efter kirurgi.
Det primära effektmåttet i studien var andel patologisk komplett respons (pCR) i bröstet (ypT0/is). Sekundära effektmått var klinisk responsfrekvens, frekvens av bröstsparande kirurgi (endast T2-3-tumörer), sjukdomsfri överlevnad (DFS) och PFS. Ytterligare explorativa pCR-frekvenser omfattade nodal status (ypT0/isN0 och ypT0N0).
Demografin var välbalanserad (medianåldern var 49–50 år, majoriteten var kaukasier [71 %]) och alla patienter var kvinnor. Totalt 7 % av patienterna hade inflammatorisk bröstcancer, 32 % hade lokalt avancerad bröstcancer och 61 % hade operabel bröstcancer. Cirka hälften av patienterna i varje behandlingsgrupp hade hormonreceptor-positiv sjukdom (definierad som ER-positiv och/eller PgR-positiv).
Effektresultaten presenteras i tabell 4. En statistiskt signifikant förbättring av pCR-frekvens (ypT0/is) observerades hos patienter som fick Perjeta i kombination med trastuzumab och docetaxel jämfört med patienter som fick trastuzumab och docetaxel (45,8 % jämfört med 29,0 %, p-värde = 0,0141). Ett samstämmigt resultatmönster observerades oavsett pCR-definition. Skillnaden i pCR-frekvens kan sannolikt översättas till en kliniskt meningsfull skillnad i långtidsutfall och stöds av positiva trender i PFS (HR 0,69, 95% KI 0,34, 1,40) och DFS (HR 0,60, 95% KI 0,28, 1,27).
pCR-frekvenser och graden av behandlingsnytta med Perjeta (Perjeta plus trastuzumab och docetaxel jämfört med patienter som fick trastuzumab och docetaxel) var lägre i undergruppen av patienter med hormonreceptor-positiva tumörer (skillnad på 6 % i pCR i bröstet) än för patienter med hormonreceptor-negativa tumörer (skillnad på 26,4 % i pCR i bröstet). pCR-frekvenser var liknande hos patienter med operabel kontra lokalt avancerad sjukdom. För få patienter med inflammatorisk bröstcancer inkluderades i studien för att dra några definitiva slutsatser men pCR-frekvensen var högre hos patienter som fick Perjeta i kombination med trastuzumab och docetaxel.
TRYPHAENA (BO22280)
TRYPHAENA är en randomiserad, multicenter, klinisk fas II-studie som genomfördes på 225 vuxna kvinnliga patienter med HER2-positiv lokalt avancerad, operabel eller inflammatorisk bröstcancer (T2-4d, primär tumör > 2 cm i diameter) som inte erhållit tidigare trastuzumab-behandling, kemoterapi eller strålbehandling. Patienter med metastaser, bilateral bröstcancer, kliniskt betydelsefulla hjärtriskfaktorer (se avsnitt 4.4) eller LVEF < 55 % inkluderades inte. Majoriteten av patienterna var yngre än 65 år. Patienter randomiserades till att få en av följande tre neoadjuvanta behandlingar före kirurgi:
-
3 cykler med FEC följt av 3 cykler med docetaxel, alla givna samtidigt som Perjeta och trastuzumab
-
3 cykler med enbart FEC följt av 3 cykler med docetaxel, med samtidig administrering av trastuzumab och Perjeta
-
6 cykler med TCH i kombination med Perjeta.
Randomisering skedde enligt bröstcancertyp (operabel, lokalt avancerad eller inflammatorisk) och ER- och/eller PgR-positivitet.
Pertuzumab gavs intravenöst med en startdos på 840 mg, följt av 420 mg var tredje vecka. Trastuzumab gavs intravenöst med en startdos på 8 mg/kg, följt av 6 mg/kg var tredje vecka. FEC (5-fluorouracil [500 mg/m2], epirubicin [100 mg/m2] och cyklofosfamid [600 mg/m2]) gavs intravenöst var tredje vecka under 3 cykler. Docetaxel gavs som intravenös infusion med en startdos på 75 mg/ m2 var tredje vecka med möjlighet till dosökning till 100 mg/m2 enligt prövarens beslut om startdosen tolererades väl. I gruppen som behandlades med Perjeta i kombination med TCH gavs dock docetaxel intravenöst vid 75 mg/m2 (ingen dosökning var tillåten) och karboplatin (AUC 6) gavs intravenöst var tredje vecka. Efter kirurgi fick alla patienter trastuzumab för att fullgöra ett års behandling.
Det primära resultatmåttet för denna studie var hjärtsäkerhet under studiens neoadjuvanta behandlingsperiod. Sekundära effektmått var pCR-frekvens i bröstet (ypT0/is), DFS, PFS och OS.
Demografin var välbalanserad mellan behandlingsarmarna (medianåldern var 49‑50 år, majoriteten var kaukasier [77 %]) och alla patienter var kvinnor. Totalt hade 6 % av patienterna inflammatorisk bröstcancer, 25 % hade lokalt avancerad bröstcancer och 69 % hade operabel bröstcancer. Cirka hälften av patienterna i varje behandlingsgrupp hade ER-positiv och/eller PgR-positiv sjukdom.
Jämfört med publicerade data för liknande behandlingar utan pertuzumab observerades höga pCR-frekvenser i alla 3 behandlingsarmar (se tabell 4). Ett samstämmigt resultatmönster observerades oavsett vilken pCR-definition som användes. pCR-frekvenser var lägre i undergruppen av patienter med hormonreceptor-positiva tumörer (intervall från 46,2 % till 50,0 %) än hos patienter med hormonreceptor-negativa tumörer (intervall från 65,0 % till 83,8 %).
pCR-frekvenser var liknande hos patienter med operabel och lokalt avancerad sjukdom. Det förekom för få patienter med inflammatorisk bröstcancer för att dra några definitiva slutsatser.
Tabell 4: NEOSPHERE (WO20697) och TRYPHAENA (BO22280): översikt över effektdata (”Intent to Treat”‑population)
|
NEOSPHERE (WO20697) |
TRYPHAENA (BO22280) |
||||||
|---|---|---|---|---|---|---|---|
|
Parameter |
trastuzumab +docetaxel N = 107 |
Perjeta + trastuzumab+ docetaxel N = 107 |
Perjeta + trastuzumab N = 107 |
Perjeta + docetaxel N = 96 |
Perjeta + trastuzumab + FEC→ Perjeta + trastuzumab + docetaxel N = 73 |
FEC→ Perjeta + trastuzumab + docetaxel N = 75 |
Perjeta + TCH N = 77 |
|
pCR-frekvens i bröstet (ypT0/is) n (%) [95 % KI]1 |
31 (29,0 %) [20,6; 38,5] |
49 (45,8 %) [36,1; 55,7] |
18 (16,8 %) [10,3; 25,3] |
23 (24,0 %) [15,8; 33,7] |
45 (61,6 %) [49,5; 72,8] |
43 (57,3 %) [45,4; 68,7] |
51 (66,2 %) [54,6; 76,6] |
|
Skillnad i pCR-frekvenser2 [95 % KI]3 |
+16,8 % [3,5; 30,1] |
-12,2 % [-23,8; -0,5] |
-21,8 % [-35,1; -8,5] |
NA |
NA |
NA |
|
|
p-värde (med Simes korr. för CMH-test)4 |
0,0141 (jämfört med trastuzumab + docetaxel) |
0,0198 (jämfört med trastuzumab+ docetaxel) |
0,0030 (jämfört med Perjeta + trastuzumab + docetaxel) |
NA |
NA |
NA |
|
|
pCR-frekvens i bröstet och lymfkörtel (ypT0/is N0) n (%) [95 % KI] |
23 (21,5 %) [14,1; 30,5] |
42 (39,3 %) [30,3; 49,2] |
12 (11,2 %) [5,9; 18,8] |
17 (17,7 %) [10,7; 26,8] |
41 (56,2 %) [44,1; 67,8] |
41 (54,7 %) [42,7; 66,2] |
49 (63,6 %) [51,9; 74,3] |
|
ypT0 N0 n (%) [95 % KI] |
13 (12,1 %) [6,6; 19,9] |
35 (32,7 %) [24,0; 42,5] |
6 (5,6 %) [2,1; 11,8] |
13 (13,2 %) [7,4; 22,0] |
37 (50,7 %) [38,7; 62,6] |
34 (45,3 %) [33,8; 57,3] |
40 (51,9 %) [40,3; 63,5] |
|
Klinisk respons5 |
79 (79,8 %) |
89 (88,1 %) |
69 (67,6 %) |
65 (71,4 %) |
67 (91,8 %) |
71 (94,7 %) |
69 (89,6 %) |
FEC: 5-fluorouracil, epirubicin och cyklofosfamid; TCH: docetaxel, karboplatin och trastuzumab, CMH: Cochran–Mantel–Haenszel
1. 95 % KI för ett binominalt stickprov med Pearson-Clopper-metoden.
2. Behandling Perjeta + trastuzumab + docetaxel och Perjeta + trastuzumab jämförs med trastuzumab + docetaxel, medan Perjeta + docetaxel jämförs med Perjeta + trastuzumab + docetaxel.
3. Cirka 95 % KI för skillnad mellan två responsfrekvenser med Hauck-Anderson-metoden.
4. p-värde från Cochran-Mantel-Haenszel-test, med ”Simes multiplicity”-justering.
5. Klinisk respons representerar patienter med den bästa totala responsen för CR eller PR under den neoadjuvanta perioden (i den primära bröstlesionen).
BERENICE (WO29217)
BERENICE är en icke-randomiserd, öppen, multicenter, multinationell, Fas II-studie utförd med 401 patienter med HER2-positiv lokalt avancerad, inflammatorisk eller tidigt stadium av bröstcancer (med primära tumörer > 2 cm i diameter eller nod‑positiv sjukdom).
BERENICE-studien inkluderade två parallella grupper av patienter. Patienter som ansågs lämpliga för neoadjuvant behandling med trastuzumab plus antracyclin/taxanbaserad kemoterapi allokerades att få en av följande två behandlingsregimer före kirurgi enligt följande:
-
Kohort A - 4 cykler med dosintensiv doxorubicin och cyklofosfamid) administrerat varannan vecka följt av 4 cykler Perjeta i kombination med trastuzumab och paklitaxel
-
Kohort B - 4 cykler av FEC följt av 4 cykler av Perjeta i kombination med trastuzumab och docetaxel.
Efter kirurgi fick alla patienter Perjeta och trastuzumab intravenöst var tredje vecka för att fullgöra 1 års behandling.
Det primära effektmåttet för BERENICE studien är hjärtsäkerhet i den neoadjuvanta fasen av studien. Det primära effektmåttet av hjärtsäkerhet, dvs incidensen av NYHA klass III/IV LVD och minskning av LVEF, överensstämde med tidigare data från den neoadjuvanta behandlingsfasen (se avsnitt 4.4 och 4.8).
Adjuvant behandling
Vid adjuvant behandling, baserat på data från APHINITY-studien, definieras patienter med HER2-positiv tidig bröstcancer med hög risk för återfall som patienter med lymfkörtelpositiv eller hormonreceptornegativ sjukdom.
APHINITY (BO25126)
APHINITY är en randomised, dubbelblind, placebokontrollerad, multicenter fas III-studie som genomfördes på 4804 patienter med HER2-positiv tidig bröstcancer som hade fått sin primärtumör avlägsnad med kirurgi före randomisering. Patienterna randomiserades därefter till att få Perjeta eller placebo, i kombination med adjuvant trastuzumab och kemoterapi. Prövarna valde en av följande antracyklin-baserade eller icke-antracyklin-baserade kemoterapier på individuell basis:
-
3 eller 4 cykler med FEC eller 5-fluorouracil, doxorubicin och cyklofosfamid (FAC), följt av 3 eller 4 cykler med docetaxel eller 12 cykler med paclitaxel varje vecka
-
4 cykler med AC eller epirubicin och cyklofosfamid (EC), följt av 3 eller 4 cykler med docetaxel eller 12 cykler med paclitaxel varje vecka
-
6 cykler med docetaxel i kombination med karboplatin
Med start dag 1 av den taxan-innehållande cykeln gavs Perjeta och trastuzumab intravenöst (se avsnitt 4.2) var tredje vecka i totalt 52 veckor (upp till 18 cykler) eller till recidiv, återtaget medgivande eller oacceptabel toxicitet. Standarddoser gavs av 5‑fluorouracil, epirubicin, doxorubicin, cyklofosfamid, docetaxel, paklitaxel och karboplatin.
Efter fullföljd kemoterapi fick patienterna strålning och/eller hormonbehandling enligt lokala riktlinjer.
Primär effektparameter för studien var invasiv sjukdomsfri överlevnad (IDFS), definierad som tiden från randomisering till första händelsen av ipsilateral lokalt eller regionalt invasivt bröstcancerrecidiv, distalt recidiv, kontralateral invasiv bröstcancer, eller död oavsett orsak. Sekundära effektparametrar var IDFS inklusive en andra primär cancer (ej bröstcancer), överlevnad (OS), sjukdomsfri överlevnad (DFS), recidivfritt intervall (RFI) och distalt recidivfritt intervall (DRFI).
Demografin var välbalanserad mellan de två behandlingsarmarna. Medianåldern var 51 år, och över 99% av patienterna var kvinnor. Majoriteten av patienterna hade nod-positiv (63%) och/eller hormonreceptorpositiv sjukdom (64%), samt (71%) var kaukasier.
Efter en median uppföljningstid på 45,4 månader uppvisade APHINITY-studien en 19%-ig (hazard ratio [HR] = 0,81; 95% KI 0,66, 1,00; p-värde 0,0446) relativ riskreduktion för recidiv eller död hos patienter som randomiserades till att få Perjeta jämfört med patienter som randomiserades till att få placebo.
Efter en median uppföljningstid på 101,2 månader (8,4 år, vid den tredje interimsanalysen av OS, var antalet dödsfall hos patienterna som randomiserats till Perjeta-armen 168 döda [7,0 %] jämfört med 202 dödsfall [8,4 %] i placebo-armen; HR=0,83, 95 % KI [0,68, 1,02].
Effektresultaten från APHINITY-studien sammanfattas i tabell 5 och i figur 3.
Tabell 5 Effektresultat: ITT-populationen
|
|
Perjeta + trastuzumab + kemoterapi n=2400 |
Placebo + trastuzumab + kemoterapi n=2404 |
|---|---|---|
|
Primärt effektmått |
|
|
|
Invasiv sjukdomsfri överlevnad (IDFS)*
|
|
|
|
Antal (%) av patienterna med händelse |
171 (7,1%) |
210 (8,7%) |
|
HR [95% KI] |
0,81 [0,66, 1,00] |
|
|
p-värde (Log-Rank test, stratifierat1) |
0,0446 |
|
|
3 års händelsefri frekvens2 [95% KI] |
94,1 [93,1, 95,0] |
93,2 [92,2, 94,3] |
|
Sekundära effektmått1 |
|
|
|
IDFSinklusive andra primär icke‑bröstcancer* |
|
|
|
Antal (%) av patienterna med händelse |
189 (7,9%) |
230 (9,6%) |
|
HR [95% KI] |
0,82 [0,68, 0,99] |
|
|
p-värde (Log-Rank test, stratifierat1) |
0,0430 |
|
|
3 års händelsefri frekvens2 [95% KI] |
93,5 [92,5, 94,5] |
92,5 [91,4, 93,6] |
|
Sjukdomsfri överlevnad (DFS)* |
|
|
|
Antal (%) av patienterna med händelse |
192 (8,0%) |
236 (9,8%) |
|
HR [95% KI] |
0,81 [0,67, 0,98] |
|
|
p-värde (Log-Rank test, stratifierat1) |
0,0327 |
|
|
3 års händelsefri frekvens2 [95% KI] |
93,4 [92,4, 94,4] |
92,3 [91,2, 93,4] |
|
Överlevnad (OS)** |
|
|
|
Antal (%) av patienterna med händelse |
168 (7,0%) |
168 (7,0%) |
|
HR [95% KI] |
0, 83 [0,68, 1,02] |
|
Förklaring till förkortningar (tabell 5): HR: Hazard Ratio; KI: Konfidensintervall
* Primär analys av invasiv sjukdomsfri överlevnad, cutoff-datum 19 december 2016.
** Data från tredje interim-analysen av överlevnad, cutoff-datum 10 januari 2022.
1. Alla analyser stratifierade efter nod-status, protokollversion, central hormonreceptor-status, och adjuvant kemoterapibehandling.
2. 3-års händelsefri frekvens deriverat från Kaplan-Meier-estimat.
Figur 3 Kaplan-Meierkurva över invasiv sjukdomsfri överlevnad (IDFS)
IDFS= invasiv sjukdomsfri överlevnad; KI= Konfidensintervall; Pla= placebo; Ptz= pertuzumab (Perjeta); T= trastuzumab.
Estimatet av IDFS vid 4 år var 92,3% i gruppen behandlade med Perjeta jämfört med 90,6% i gruppen behandlade med placebo. Vid tidpunkten för estimatet var median uppföljningstid 45,4 månader.
Resultat av subgruppsanalyser
Vid tidpunkten för den primära analysen var fördelarna med Perjeta mer uppenbara i undergrupper av patienter med hög risk för återfall: patienter med nod-positiv eller hormonreceptor-negativ sjukdom (se tabell 6).
Tabell 6 Effektresultat i subgrupper efter nodstatus och hormonreceptorstatus1
|
Population |
Antal IDFS händelser/total n (%) |
Ej stratifierad HR (95% KI) |
|
|---|---|---|---|
|
Perjeta + trastuzumab + kemoterapi |
Placebo +
|
||
|
Nodstatus |
|||
|
Positiv |
139/1503 (9,2%) |
181/1502 (12,1%) |
0,77 (0,62, 0,96) |
|
Negativ |
32/897 (3,6%) |
29/902 (3,2%) |
1,13 (0,68, 1,86) |
|
Hormonreceptorstatus |
|
|
|
|
Negativ |
71/864 (8,2%) |
91/858 (10,6%) |
0,76 (0,56, 1,04) |
|
Positiv |
100/1536 (6,5%) |
119/1546 (7,7%) |
0,86 (0,66, 1,13) |
1 Fördefinierade subgruppsanalyser utan justering för multipla jämförelser och därmed betraktas resultaten som deskriptiva.
Uppskattningar av IDFS-frekvens i den lymfkörtelpositiva subgruppen var 92,0% jämfört med 90,2% vid 3 år och 89,9% jämfört med 86,7% vid 4 år hos Perjeta-behandlade patienter jämfört med placebobehandlade patienter. I den lymfkörtelnegativa subgruppen var uppskattningar av IDFS-frekvenser 97,5% jämfört med 98,4% vid 3 år och 96,2% jämfört med 96,7% vid 4 år hos Perjeta-behandlade patienter jämfört med placebobehandlade patienter. I undergruppen av patienter vars tumörer var hormonreceptornegativa var uppskattningar av IDFS-frekvensen 92,8% jämfört med 91,2% vid 3 år och 91,0% jämfört med 88,7% vid 4 år hos patienter behandlade med Perjeta jämfört med placebobehandlade patienter.
I undergruppen av patienter vars tumörer var hormonreceptorpositiva var uppskattningar av IDFS-frekvensen 94,8% jämfört med 94,4% vid 3 år och 93,0% jämfört med 91,6% vid 4 år hos Perjeta-behandlade patienter jämfört med placebobehandlade patienter.
Patientrapporterade resultat (PRO) av livskvalitet
Sekundära effektmått omfattade bedömningen av patientrapporterat globalt hälsotillstånd, roll och fysisk funktion samt behandlingssymptom med hjälp av EORTC QLQ-C30 och EORTC QLQ-BR23 frågeformulär. I analyserna av patientrapporterade resultat ansågs en 10-punktsskillnad kliniskt relevant.
Patienternas fysiska funktion, globala hälsotillstånd och diarrésymtom visade en kliniskt relevant förändring under kemoterapi i båda behandlingsarmarna. Den genomsnittliga minskningen från behandlingsstart vid tiden för fysisk funktion var -10,7 (95% KI-11,4, -10,0) i Perjeta-armen och -10,6 (95% -11,4, -9,9) i placeboarmen; Det globala hälsotillståndet var -11,2 (95% KI -12,2, -10,2) i Perjeta-armen och -10,2 (95% KI -11,1, -9,2) i placebo-armen. Förändring i diarrésymptom ökade till +22,3 (95% KI 21,0, 23,6) i Perjeta- armen jämfört med +9,2 (95% KI 8,2, 10,2) i placebo-armen.
Därefter återvände fysisk funktion och de globala hälsotillståndsvärdena till nivåerna innan behandlingsstart under den riktade behandlingen i båda behandlingsarmarna. Diarrésymptomen återvände till nivåerna innan behandlingsstart efter HER2-behandling i Perjeta-armen. Tillägget av Perjeta till trastuzumab plus kemoterapi påverkade inte patienternas övergripande rollfunktion under studiens gång.
Immunogenicitet
Patienter i den pivotala studien CLEOPATRA testades vid flera tidpunkter för anti-läkemedels-antikroppar (ADA = anti-drug antibodies) mot Perjeta. Cirka 3,3 % (13/389 patienter) av de Perjeta-behandlade patienterna och 6,7 % (25/372 patienter) av de placebo-behandlade patienterna testades positivt för ADA. I BERENICE visade 4,1% (16/392) av patienterna behandlade med Perjeta positivt test för ADA. Ingen av dessa patienter uppvisade infusions- eller överkänslighetsreaktioner (anafylaxi) som tydligt kunde relateras till ADA.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Perjeta, för alla grupper av den pediatriska populationen för bröstcancer (information om pediatrisk användning finns i avsnitt 4.2).
5.2 Farmakokinetiska egenskaper
En populationsfarmakokinetisk analys genomfördes med data från 481 patienter från olika kliniska studier (fas I, II och III) med olika typer av avancerade maligniteter som fått Perjeta, ensamt eller i kombination, med pertuzumabdoser från 2 till 25 mg/kg administrerat var tredje vecka som en 30-60 minuters intravenös infusion.
Absorption
Perjeta administreras som en intravenös infusion.
Distribution
I alla kliniska studier var distributionsvolymen för centralt kompartment (Vc) 3,11 l och för perifert kompartment (Vp) 2,46 l hos en typisk patient.
Biotransformation
Metabolismen av pertuzumab har inte studerats direkt. Antikroppar elimineras huvudsakligen via katabolism.
Eliminering
Medianclearance (Cl) för pertuzumab var 0,235 liter/dag och median halveringstid var 18 dagar.
Linjäritet/icke-linjäritet
Pertuzumab uppvisade linjär farmakokinetik inom rekommenderat dosintervall.
Äldre patienter
Baserat på en populationsfarmakokinetisk analys observerades ingen signifikant skillnad i pertuzumabs farmakokinetik mellan patienter < 65 år (n = 306) och patienter ≥ 65 år (n = 175).
Nedsatt njurfunktion
Ingen särskild studie avseende nedsatt njurfunktion har genomförts för Perjeta. Baserat på resultat från populationsfarmakokinetiska analysen är pertuzumab-exponeringen hos patienter med milt (kreatininclearance [Clcr] 60 till 90 ml/min, n = 200) och måttligt nedsatt njurfunktion (kreatininclearance [Clcr] 30 till 60 ml/min, n = 71) liknande som hos patienter med normal njurfunktion (Clcr större än 90 ml/min, n=200). Inget samband mellan Clcr och pertuzumab-exponering observerades inom Clcr-intervallet (27 till 244 ml/min).
Andra särskilda populationer
Den populationsfarmakokinetiska analysen visade inte på skillnader i farmakokinetik baserat på ålder, kön och etnicitet (japaner jämfört med icke-japaner). Albumin vid behandlingsstart och fettfri kroppsvikt var de mest signifikanta kovariaterna som påverkade Cl. Cl minskade hos patienter med högre albuminkoncentrationer vid behandlingsstart och ökade hos patienter med större fettfri kroppsvikt. Däremot visade sensitivitetsanalyser genomförda vid rekommenderad dos och schema för pertuzumab att vid extrema värden för dessa två kovariater fanns det ingen signifikant påverkan på möjligheten att uppnå steady-state målkoncentrationer identifierade i prekliniska tumör-xenograft-modeller. Därför finns inget behov av att dosjustera pertuzumab baserat på dessa kovariater.
De farmakokinetiska resultaten för pertuzumab i studierna NEOSPHERE och APHINITY är samstämmiga med prediktionerna från den tidigare populationsfarmakokinetiska modellen. Ingen skillnad observerades i farmakokinetiken för pertuzumab hos patienter med tidig bröstcancer jämfört med patienter med metastaserad bröstcancer.
5.3 Prekliniska säkerhetsuppgifter
Inga särskilda fertilitetsstudier på djur har genomförts för att utvärdera pertuzumabs effekt. Ingen definitiv konklusion av bieffekter på de manliga reproduktionsorganen har kunnat göras i en toxicitetsstudie med upprepad dosering hos cynomolgusapor.
Reproduktionstoxikologiska studier har genomförts på dräktiga cynomolgusapor (dräktighetsdag 19 till 50) med initiala doser på 30 till 150 mg/kg följt av doser på 10 till 100 mg/kg varannan vecka. Dessa dosnivåer resulterade i kliniskt relevanta exponeringar som var 2,5 till 20 gånger högre än rekommenderad dos för människa baserat på Cmax. Intravenös administrering av pertuzumab från dräktighetsdag 19 till 50 (perioden för organogenesen) var embryotoxisk, med dosberoende ökningar av embryo-/fosterdöd mellan dräktighetsdag 25 till 70. Incidensen för förlust av embryo/foster var 33, 50 och 85 % hos dräktiga aphonor behandlade med pertuzumab-doser om 10, 30 och 100 mg/kg varannan vecka (2,5 till 20 gånger större än rekommenderad dos för människa, baserat på Cmax). Vid kejsarsnitt på dräktighetsdag 100 identifierades i alla pertuzumab-dos-grupperna oligohydraminos, minskade relativa lung- och njurvikter och mikroskopiskt bevis på renal hypoplasi förenligt med försenad njurutveckling. Dessutom, förenligt med begränsningar i fostertillväxt, noterades sekundärt till oligohydramnios, lung-hypoplasi (1 av 6 i gruppen 30 mg/kg och 1 av 2 i gruppen 100 mg/kg), ventrikulär septumdefekt (1 av 6 i gruppen 30 mg/kg), tunn kammarvägg (1 av 2 i gruppen 100 mg/kg) och mindre defekter i skelettet (externa - 3 av 6 i gruppen 30 mg/kg). Pertuzumab-exponering rapporterades hos avkomma från alla behandlingsgrupper, vid nivåer på 29 % till 40 % av serumnivåer hos modern vid dräktighetsdag 100.
Intravenös administrering av pertuzumab en gång i veckan med doser upp till 150 mg/kg/dos tolererades generellt väl hos cynomolgus-apor. Med doser på 15 mg/kg och högre noterades intermittent mild behandlingsrelaterad diarré. I en undergrupp av apor resulterade kronisk dosering (7 till 26 vecko-doser) i episoder av allvarlig sekretorisk diarré. Diarrén behandlades (med undantag för dödshjälp till ett djur, 50 mg/kg/dos) med symtomlindring inklusive intravenös vätskeersättningsbehandling.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Koncentrerad ättiksyra
L-Histidin
Sukros
Polysorbat 20
Vatten för injektionsvätskor
6.2 Inkompatibiliteter
Glukoslösning (5 %) ska inte användas för att späda Perjeta eftersom det är kemiskt och fysikaliskt instabilt i sådana lösningar.
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt 6.6.
6.3 Hållbarhet
Oöppnad injektionsflaska
2 år.
Spädd lösning
Kemisk och fysikalisk stabilitet vid användning har demonstrerats i 24 timmar vid 30°C och upp till 30 dagar vid 2°C till 8°C i skydd från ljus.
Ur mikrobiologisk synvinkel ska produkten användas omedelbart. Om inte användningen sker omedelbart är tillämpad förvaringstid och förvaringsbetingelser innan användning användarens ansvar och bör vanligtvis inte vara längre än 24 timmar i 2°C till 8°C om inte spädningen gjorts under kontrollerade och validerade aseptiska förhållanden.
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C - 8°C)
Får ej frysas.
Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Förvaringsanvisningar för läkemedlet efter spädning finns i avsnitt 6.3.
6.5 Förpackningstyp och innehåll
Injektionsflaska (Typ I-glas) med en propp (butylgummi) innehållande 14 ml lösning.
Förpackningsstorlek om 1 injektionsflaska.
6.6 Särskilda anvisningar för destruktion och övrig hantering
Perjeta innehåller inte något antimikrobiellt konserveringsmedel. Därför måste försiktighet iakttas för att säkerställa steriliteten för den beredda infusionslösningen och sjukvårdspersonal bör bereda lösningen.
Perjeta är endast avsett för engångsanvändning.
Injektionsflaskan får inte skakas. 14 ml av koncentratet av Perjeta ska dras upp från injektionsflaskan med en steril nål och spruta samt spädas i en 250 ml PVC eller icke-PVC polyolefin infusionspåse med natriumkloridlösning för infusion 9 mg/ml (0,9 %). Efter spädning ska 1 ml av lösningen innehålla cirka 3,02 mg pertuzumab (840 mg/278 ml) för den initiala laddningsdosen där två injektionsflaskor krävs och cirka 1,59 mg pertuzumab (420 mg/264 ml) för underhållsdosen där en injektionsflaska krävs.
Påsen ska försiktigt vändas för att blanda lösningen och därmed undvika skumbildning.
Parenterala läkemedel ska inspekteras visuellt med avseende på partiklar och missfärgningar före administrering. Om partiklar eller missfärgning observeras ska lösningen inte användas. När infusionslösningen är iordningställd skall den administreras omedelbart (se avsnitt 6.3).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Perjeta är kompatibel med polyvinylklorid (PVC) eller icke-PVC polyolefinpåsar inklusive polyetylen.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
EU/1/13/813/001
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 4 mars 2013
Förnyat godkännande: 8 december 2017
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
26 april 2023
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.





