Indikationer
-
Behandling av blödning och perioperativ blödningsprofylax vid förvärvad brist på koagulationsfaktorer i protrombinkomplexet, såsom brist till följd av behandling med vitamin K-antagonister, eller vid överdosering av vitamin K-antagonister, när snabb korrigering av bristen krävs.
-
Behandling av blödning och perioperativ profylax vid medfödd brist på någon av de vitamin K-beroende koagulationsfaktorerna, när renade specifika koagulationsfaktorprodukter inte finns att tillgå.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Vid eventuell disseminerad intravaskulär koagulation ska behandling med protrombinkomplexpreparat ske först efter att det konsumptiva stadiet passerat.
Känd heparininducerad trombocytopeni.
Dosering
Dosering
Endast allmänna riktlinjer för dosering ges nedan. Behandlingen bör sättas in under överinseende av läkare med erfarenhet av behandling av koagulationsrubbningar.
Dosering och substitutionsbehandlingens längd beror på behandlingens indikation, sjukdomens svårighetsgrad, på lokaliseringen och omfattningen av blödningen, samt på patientens kliniska tillstånd.
Mängden som administreras och frekvensen av administreringarna beräknas utifrån individuella patientdata. Doseringsintervallen måste anpassas till de olika cirkulerande halveringstiderna för respektive koagulationsfaktor i protrombinkomplexet (se avsnitt Farmakokinetik). Individuell dosering kan bara bestämmas utifrån regelbundna mätningar av individuella plasmanivåer av den aktuella koagulationsfaktorn, eller utifrån globala test av protrombinkomplexnivåer (INR, Quick´s test) och en kontinuerlig övervakning av patientens kliniska tillstånd.
Vid större kirurgiska ingrepp är noggrann övervakning av substitutionsterapi med avseende på koagulationsanalys nödvändig (specifika analyser för koagulationsfaktorer och/eller globala tester för protrombinkomplexnivåer).
-
Blödning och perioperativ profylax av blödning under behandling med vitamin K-antagonist.
Dosen baseras på INR före behandling och av målvärdet för INR. INR före behandlingen bör mätas så nära tidpunkten för dosering som möjligt för att kunna beräkna den lämpliga dosen av Confidex. I följande tabell anges de ungefärliga doser (ml/kg kroppsvikt av den färdigberedda produkten och IE faktor IX/kg kroppsvikt) som krävs för att normalisera INR (t.ex. ≤1,3) vid olika initiala INR-värden.
|
INR-värde före behandling |
2,0–3,9 |
4,0–6,0 |
>6,0 |
|
Ungefärlig dos ml/kg kroppsvikt |
1 |
1,4 |
2 |
|
Ungefärlig dos IE (faktor IX)/kg kroppsvikt |
25 |
35 |
50 |
Dos är baserad på kroppsvikt upp till, men inte överstigande, 100 kg. För patienter som väger mer än 100 kg bör den maximala engångsdosen (IE av faktor IX) därför inte överstiga 2500 IE för ett INR på 2,0–3,9, 3500 IE för ett INR på 4,0–6,0 och 5000 IE för ett INR på> 6,0.
Justering av nedsatt hemostas, som inducerats av vitamin K-antagonist, uppnås vanligtvis ungefär 30 minuter efter injektionen.
Samtidig administrering med vtamin K bör beaktas hos patienter som får Confidex för akut reversering av vitamin K-antagonister eftersom vitamin K vanligtvis ger effekt inom 4-6 timmar. Upprepad dosering med Confidex hos patienter vid behov av akut reversering av vitamin K-antagonistbehandling stöds inte av kliniska data och rekommenderas därför inte.
Dessa rekommendationer baseras på data från kliniska studier med ett begränsat antal individer. Tillfrisknande och effektens längd kan variera, varför monitorering av INR under behandlingen är nödvändigt.
-
Blödningar och perioperativ profylax vid medfödd brist på någon av de vitamin K-beroende koagulationsfaktorerna när specifika koagulationsfaktorprodukter inte finns tillgängliga.
Beräkningar av den dos som krävs av protrombinkomplexkoncentratet baseras på data från kliniska studier.
-
1 IE av faktor IX per kg kroppsvikt kan förväntas höja plasmaaktiviteten av faktor IX med 1,3% (0,013 IE/ml) jämfört med den normala.
-
1 IE av faktor VII per kg kroppsvikt höjer plasmaaktiviteten av faktor VII med 1,7% (0,017 IE/ml) jämfört med den normala.
-
1 IE av faktor II per kg kroppsvikt höjer plasmaaktiviteten av faktor II med 1,9% (0,019 IE/ml) jämfört med den normala.
-
1 IE av faktor X per kg kroppsvikt höjer plasmaaktiviteten av faktor X med 1,9% (0,019 IE/ml) jämfört med den normala.
Dosen av en specifik faktor anges i internationella enheter (IE) och är relaterad till den aktuella WHO-standarden för varje faktor. Plasmaaktiviteten för en specifik koagulationsfaktor anges i procent (relativt till normal plasma) eller i internationella enheter (i förhållande till den internationella standarden för den specifika koagulationsfaktorn).
En internationell enhet (IE) av en koagulationsfaktors aktivitet är lika med mängden i 1 ml normal humanplasma.
Till exempel beräknas den dos av faktor X som behövs på fyndet att 1 internationell enhet (IE) av faktor X per kg kroppsvikt ökar aktiviteten av plasmafaktor X med 0,019 IE/ml.
Dosen som behövs bestäms av följande formel:
Enheter som behövs = kroppsvikt [kg] × önskad ökning av faktor X [IE/ml] × 53 där 53 (ml/kg) är det reciproka värdet för beräknat recovery.
Observera att beräkningen är baserad på data från patienter som får vitamin K-antagonister. En beräkning baserad på data från friska försökspersoner skulle ge en lägre uppskattning av dosen som behövs.
Om individuellt recovery är känt ska detta värde användas vid beräkning.
Produktspecifik information finns tillgänglig från kliniska studier på friska frivilliga (N = 15), vid reversering av vitamin K-antagonistbehandling för akut allvarlig blödning eller perioperativ profylax av blödning (N = 98, N = 43) (se avsnitt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt för Confidex för barn och ungdomar har ännu inte fastställts i kontrollerade kliniska studier (se avsnitt Varningar och försiktighet).
Äldre
Dosering och administreringssätt hos äldre patienter (>65 år) är samma som de allmänna rekommendationerna.
Administreringssätt
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering. Den färdigberedda lösningen ska administreras intravenöst (inte mer än 8 ml/minut*).
Lösningen ska vara klar eller lätt opalescent.
*I kliniska studier med Confidex blev patienter som väger <70 kg instruerade att doseras med en maximal infusionshastighet på 0,12 ml/kg/min (mindre än 8 ml/min).
Varningar och försiktighet
Specialist med erfarenhet av behandling av koagulationsrubbningar bör rådfrågas.
Hos patienter med förvärvad brist på de vitamin K-beroende koagulationsfaktorerna (exempelvis inducerad av behandling med vitamin K-antagonister), ska Confidex användas endast när snabb justering av protrombinkomplexnivåerna är nödvändig, exempelvis vid större blödning eller akutkirurgi. I andra fall är dosreduktion för vitamin K-antagonisten och/eller administrering av vitamin K vanligen tillräcklig.
Patienter som får en vitamin K-antagonist kan ha ett bakomliggande tillstånd av hyperkoagulabilitet, och infusion av protrombinkomplexkoncentrat kan förvärra detta.
Vid medfödd brist på någon av de vitamin K-beroende faktorerna, ska specifika koagulationsfaktorprodukter användas, när sådana finns att tillgå.
Om allergiska reaktioner eller reaktioner av anafylaktisk typ skulle inträffa, ska injektionen/infusionen med Confidex stoppas omedelbart (dvs. avbryta injektionen) och adekvat behandling ska sättas in. Typ av biverkning och allvarlighetsgrad avgör vilka behandlingsåtgärder som sätts in. Vid chock ska medicinsk standardbehandling vid chock sättas in.
Det finns risk för trombos eller disseminerad intravaskulär koagulation när patienter, med antingen medfödd eller förvärvad brist, behandlas med humant protrombinkomplexkoncentrat, i synnerhet vid upprepad dosering. Risken kan vara högre vid behandling av isolerad faktor VII brist, eftersom de andra vitamin K-beroende koagulationsfaktorerna med längre halveringstider kan ackumuleras till nivåer betydligt högre än de normala. Patienter som får humant protrombinkomplexkoncentrat ska observeras noggrant avseende tecken eller symtom på intravaskulär koagulation eller trombos.
På grund av risken för tromboemboliska komplikationer ska noggrann övervakning ske när Confidex administreras till patienter med anamnes på kranskärlssjukdom eller hjärtinfarkt, till patienter med leversjukdom, till peri- eller postoperativa patienter, till nyfödda eller till patienter med risk för tromboemboliska fenomen eller disseminerad intravaskulär koagulation eller samtidig inhibitorbrist. I var och en av dessa situationer ska de potentiella fördelarna av behandlingen med Confidex vägas mot risken för dessa komplikationer.
Hos patienter med disseminerad intravaskulär koagulation, kan det i vissa fall vara nödvändigt att byta ut protrombinkomplexets koagulationsfaktorer. Detta utbyte kan dock endast göras efter att det konsumptiva stadiet passerat (dvs. genom behandling av den bakomliggande orsaken, varaktig normalisering av antitrombin III-nivån).
Reversering av vitamin K-antagonister utsätter patienter för den tromboemboliska risken av den underliggande sjukdomen. Ett återupptagande av antikoagulation bör noga övervägas så snart som möjligt.
Oönskade reaktioner kan inkludera utvecklandet av heparininducerad trombocytopeni, typ II (HIT, typ II). Karakteristiska tecken på HIT är ett > 50 procent fall i antal trombocyter och/eller förekomst av nya eller oförklarliga tromboemboliska komplikationer under heparinbehandling. Igångsättandet sker vanligen 4-14 dagar efter initieringen av heparinbehandling men kan inträffa inom 10 timmar hos patienter som nyligen exponerats för heparin (inom de senaste 100 dagarna).
Nefrotiskt syndrom har rapporterats i enstaka fall efter försök med immuntoleransinduktion hos hemofili B-patienter med faktor IX-inhibitorer och som tidigare haft allergiska reaktioner.
Det finns inga tillgängliga data angående användning av Confidex vid perinatal blödning beroende på vitamin K brist hos nyfödda.
Confidex innehåller upp till 343 mg natrium (ca 15 mmol) per 100 ml. Detta bör beaktas hos patienter som ordinerats saltfattig kost.
Virussäkerhet
Standardåtgärder för att förhindra att infektioner överförs från läkemedel tillverkade ur humant blod eller plasma, inkluderar urval av givare, test av individuella donationer och plasmapooler för specifika infektionsmarkörer samt att effektiva tillverkningssteg för inaktivering/eliminering av virus är en del av tillverkningsprocessen. Trots detta kan risken för överföring av infektiösa agens inte helt uteslutas när läkemedel framställda ur humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra patogener.
De åtgärder som vidtas anses effektiva mot höljeförsedda virus som humant immunbristvirus (HIV), hepatit B virus (HBV), och hepatit C virus (HCV) och mot de icke höljeförsedda virusen hepatit A och parvovirus B19.
Adekvat vaccinering (hepatit A och B) rekommenderas för patienter som regelbundet/upprepat behandlas med humana plasmaderiverade protrombinkomplexpreparat.
Det rekommenderas bestämt att varje gång Confidex ges till en patient ska produktnamn och satsnummer noteras (för att upprätthålla en koppling mellan patienten och produktens satsnummer).
Interaktioner
Humana protrombinkomplexpreparat neutraliserar effekten av behandling med vitamin K-antagonist, men det finns inte några kända interaktioner med andra läkemedel.
När man gör heparinkänsliga koagulationstest på patienter som får höga doser av humant protrombinkomplex, måste hänsyn tas till att heparin ingår som en beståndsdel i den tillförda produkten.
Graviditet
Säkerheten vid användning av humant protrombinkomplex under graviditet hos människa har inte fastställts. Djurstudier är inte lämpliga för bedömning av säkerheten med avseende på graviditet, embryonal/fetal utveckling, förlossning eller postnatal utveckling.
Därför bör humant protombinkomplex användas under graviditet endast om klar indikation föreligger.
Amning
Säkerheten vid användning av humant protrombinkomplex under amning hos människa har inte fastställts.
Därför bör humant protombinkomplex användas under amning endast om klar indikation föreligger.
Fertilitet
Inga fertilitetsstudier är tillgängliga.
Trafik
Inga studier på förmågan att framföra fordon och använda maskiner har utförts.
Biverkningar
Sammanfattning av säkerhetsprofilen
Reaktioner av allergisk eller anafylaktisk typ har observerats i mindre vanliga tillfällen, inklusive allvarliga anafylaktiska reaktioner (se avsnitt Varningar och försiktighet).
Substitutionsbehandling kan leda till bildning av cirkulerande antikroppar som hämmar en eller flera av de humana protrombinkomplexfaktorerna. Om sådana inhibitorer uppstår, kommer tillståndet att yttra sig genom dåligt kliniskt svar. I sådana fall rekommenderas att man kontaktar ett specialiserat hemofilicenter för vägledning. Anafylaktiska reaktioner har observerats hos patienter med antikroppar mot faktorer som ingår i Confidex.
Förhöjd kroppstemperatur har observerats i vanliga fall.
Det finns risk för tromboemboliska episoder efter administrering av humant protrombinkomplex (se avsnitt Varningar och försiktighet).
Tabell över biverkningar av Confidex
Följande biverkningar är baserade på data från kliniska studier, erfarenhet efter marknadsföring såväl som på vetenskaplig litteratur.
Tabellen nedan anger biverkningar enligt MedDRAs organklassificering (SOC and Preferred Team Label). Frekvenser har baserats på data från kliniska studier enligt följande: mycket vanliga ( ≥1/10), vanliga (≥1/100 till <1/10), mindre vanliga (≥1/1000 till <1/100), sällsynta (≥1/10 000 till <1/1000), mycket sällsynta (<1/10 000) eller ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Organklass enligt MedDRA |
Biverkning |
Frekvens |
|---|---|---|
|
Blodkärl och andra SOC |
Tromboemboliska event* |
vanliga |
|
Blodet och lymfsystemet |
Disseminerad intravaskulär koagulation |
ingen känd frekvens |
|
Immunsystemet |
Överkänslighet eller allergiska reaktioner |
mindre vanliga |
|
Anafylaktiska reaktioner inklusive anafylaktisk chock |
ingen känd frekvens |
|
|
Utveckling av antikroppar |
ingen känd frekvens |
|
|
Centrala och perifera nervsystemet |
Huvudvärk |
vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Förhöjning av kroppstemperatur |
vanliga |
*inklusive fall med dödlig utgång
För säkerhet beträffande smittoämnen, se avsnitt Varningar och försiktighet.
Pediatrisk population
Det finns inga data angående användning av Confidex i pediatriska population.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
För att undvika överdosering är regelbunden övervakning av koagulationsstatus nödvändig under behandlingen. Detta eftersom användningen av höga doser (överdosering) av humana protrombinkomplexpreparat har kunnat sättas i samband med fall av hjärtinfarkt, disseminerad intravaskulär koagulation, ventrombos och lungemboli. Vid överdosering ökar därför risken för utveckling av tromboemboliska komplikationer eller disseminerad intravaskulär koagulation hos patienter med risk för dessa komplikationer.
Farmakodynamik
Koagulationsfaktorerna II, VII, IX och X, som syntetiseras i levern med hjälp av vitamin K, brukar kallas protrombinkomplexet. Förutom koagulationsfaktorerna innehåller Confidex de vitamin K-beroende koagulationsinhibitorerna Protein C och Protein S.
Faktor VII är zymogen till det aktiva serinproteaset faktor VIIa, som deltar i vävnadsinitieringen av blodkoagulationen (”extrinsic pathway”). Vävnadstromboplastin faktor-faktor VIIa-komplexet aktiverar koagulationsfaktorerna IX and X, varigenom faktorerna IXa and Xa bildas. I takt med att koagulationskaskaden fortgår, aktiveras protrombin (faktor II) och omvandlas till trombin. Genom trombinets verkan konverteras fibrinogen till fibrin och ett koagel börjar bildas. Den normala produktionen av trombin är också av vital betydelse för trombocytfunktionen, som ett led i den primära hemostasen.
Isolerad svår brist på faktor VII leder till minskad trombinbildning och blödningsbenägenhet beroende på försämrad fibrinbildning och försämrad primär hemostas. Isolerad brist på faktor IX är en av de klassiska hemofilisjukdomarna (hemofili B). Isolerad brist på faktor II eller faktor X är mycket sällsynt men i svår form orsakar detta en blödningsbenägenhet som liknar den som ses vid klassisk hemofili.
De övriga innehållsämnena, koagulationsinhibitorerna Protein C och Protein S, syntetiseras även de i levern. Kofaktor Protein S driver den biologiska aktiviteten hos Protein C.
Det aktiverade Protein C förhindrar koagulationen genom att inaktivera koagulationsfaktorerna Va och VIIIa. Protein S som kofaktor för Protein C understöder inaktiveringen av koagulationen. Brist på Protein C kan innebära ökad trombosrisk.
Förvärvad brist på de vitamin K-beroende koagulationsfaktorerna kan uppkomma under behandling med vitamin K-antagonister. Om bristen blir allvarlig orsakar det en allvarlig benägenhet att blöda, som visar sig som retroperitoneala eller cerebrala blödningar, snarare än som muskel- och ledblödningar. Svår leversvikt resulterar också i markant sänkta nivåer av de vitamin K-beroende koagulationsfaktorerna och en klinisk blödningsbenägenhet, som dock ofta är komplex, beroende på en samtidigt pågående låggradig intravaskulär koagulation, låga trombocytvärden, brist på koagulationsinhibitorer och störd fibrinolys.
Administrering av humant protrombinkomplexkoncentrat ger en ökning av plasmanivåerna för de vitamin K-beroende koagulationsfaktorerna och kan temporärt korrigera koagulationsdefekten hos patienter med brist på en eller flera av dessa faktorer.
Farmakokinetik
Farmakokinetisk och in-vivo recovery data genererades i en studie på friska frivilliga (N = 15) och i två studier med avseende på reversering av vitamin K-antagonistbehandling för akut allvarlig blödning eller perioperativ profylax av blödningar (N = 98, N = 43).
Studie i friska försökspersoner:
15 friska frivilliga administrerades med 50 IE/kg av Confidex. IVR är ökningen av den mätbara faktorn i plasma (IE/ml) som kan förväntas efter en infusion av faktorer (IE/kg), som administrerats med Confidex. De inkrementella IVR för faktorerna II, VII, IX, X samt Protein C och S utvärderades. Alla maximala nivåer av komponenterna inträffade inom 3-timmars intervallet. Medelvärdet för de inkrementella IVR svaren varierade mellan 0,016 IE/ml för faktor IX och 0,028 för Protein C. Medianvärdet för halveringstiden i plasma och inkrementell IVR indikeras enligt följande:
|
Parameter |
Median plasmahalveringstid (intervall)/timmar |
Inkrementell IVR (IE/ml per IE/kg b.w.) |
|
|
Geometriskt medelvärde |
90 % CI† |
||
|
Faktor II: |
60 (25–135) |
0,022 |
(0,020 – 0,023) |
|
Faktor VII: |
4 (2–9) |
0,024 |
(0,023 – 0,026) |
|
Faktor IX: |
17 (10–127)* |
0,016 |
(0,014 – 0,018) |
|
Faktor X: |
31 (17–44) |
0,021 |
(0,020 – 0,023) |
|
Protein C: |
47 (9–122)* |
0,028 |
(0,027 – 0,030) |
|
Protein S: |
49 (33–83)* |
0,020 |
(0,018 – 0,021) |
|
† Konfidensintervall * Terminal halveringstid; tvåkompartments modell |
|||
Confidex distribueras och metaboliseras i kroppen på samma sätt som de endogena koagulationsfaktorerna II, VII, IX och X.
Intravenös administrering innebär att beredningen är tillgänglig omedelbart; biotillgängligheten är proportionell till den administrerade dosen.
Studier på reversering av vitamin K-antagonistbehandling för akut allvarlig blödning:
Medelvärdet av in-vivo recovery (IVR) beräknades hos 98 individer som fick Confidex för behandling av blödning under vitamin K-antagonistbehandling. Det inkrementella IVR svaret varierade mellan 0,016 IE/ml för faktor VII och 0,019 IE/ml för protein C.
Studier på reversering av vitamin K-antagonistbehandling för akut allvarlig blödning eller perioperativ profylax av blödning:
Medelvärdet av in-vivo recovery (IVR) beräknades hos 43 individer som fick Confidex för behandling av blödning eller perioperativ profylax av blödning under vitamin K-antagonistbehandling. Den intravenösa administreringen av 1 IE/kg Confidex ökade plasmanivåerna av de vitamin K-beroende koagulationsfaktorerna från 0,013 till 0,023 IE/ ml.
Prekliniska uppgifter
Aktiva innehållsämnen i Confidex är faktorer av protrombinkomplexet (faktorerna II, VII, IX och X). De är utvunna från human plasma och verkar som de endogena beståndsdelarna i plasma.
Toxicitetsstudier med singeldoser av den tidigare pastöriserade men inte nanofiltrerade produkten uppvisade måttlig toxicitet hos möss efter tillförsel av 200 IE/kg, den högsta dos som testades. En intravenös singeldos upp till 100 IE/kg av den pastöriserade och nanofiltrerade produkten tolererades hos råttor. Prekliniska studier med upprepade doser (kronisk toxicitet, karcinogenicitet och reproduktionstoxicitet) kan av praktiska skäl inte utföras hos försöksdjur på grund av antikroppsbildning mot artfrämmande humanproteiner.
Lokal tolerans uppstod efter intravenös administrering av Confidex hos kanin. En neoantigenicitetsstudie hos kanin visade inga tecken på bildning av neoepitop till följd av pastöriseringsprocessen.
Innehåll
Kvalitativ och kvantitativ sammansättning
Confidex tillhandahålls som pulver och vätska till injektionsvätska, lösning och innehåller humant protrombinkomplexkoncentrat. Läkemedlet innehåller nominellt följande mängd IE av humana koagulationsfaktorer:
|
Innehållsämnets namn |
Innehåll efter beredning (IE/ml) |
Confidex 250 IE Innehåll per injektionsflaska (IE) |
Confidex 500 IE Innehåll per injektionsflaska (IE) |
Confidex 1000 IE Innehåll per injektionsflaska (IE) |
|---|---|---|---|---|
|
Aktiva innehållsämnen | ||||
|
Human koagulationsfaktor II |
20−48 |
200−480 |
400−960 |
800−1920 |
|
Human koagulationsfaktor VII |
10−25 |
100−250 |
200−500 |
400−1000 |
|
Human koagulationsfaktor IX |
20−31 |
200−310 |
400−620 |
800−1240 |
|
Human koagulationsfaktor X |
22−60 |
220−600 |
440−1200 |
880−2400 |
|
Ytterligare aktiva innehållsämnen | ||||
|
Protein C |
15−45 |
150−450 |
300−900 |
600–1800 |
|
Protein S |
12−38 |
120−380 |
240−760 |
480−1520 |
Det totala proteininnehållet är 6–14 mg/ml av färdigberedd lösning.
Den specifika faktor IX-aktiviteten är 2,5 IE/mg totalprotein.
Aktiviteterna hos samtliga koagulationsfaktorer såväl som hos Protein C and S (antigen) har testats enligt gällande internationell WHO-standard.
Hjälpämne med känd effekt:
Natrium upp till 343 mg (ungefär 15 mmol) per 100 ml lösning
Förteckning över hjälpämnen
Pulver:
Heparin, humant albumin, humant antitrombin III, natriumklorid, natriumcitrat, saltsyra eller natriumhydroxid (i små mängder för pH justering).
Spädningsvätska:
Vatten för injektionsvätskor.
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt Hållbarhet, förvaring och hantering.
Miljöpåverkan
Koagulationsfaktor II, human
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Koagulationsfaktor IX, human
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Koagulationsfaktor VII, human
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Koagulationsfaktor X, human
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Protein C
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Protein S
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Fysikalisk-kemisk stabilitet har visats i 24 timmar vid rumstemperatur (vid högst 25 °C). Ur mikrobiologisk synpunkt ska dock produkten användas omedelbart.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet ovan.
Särskilda anvisningar för destruktion och övrig hantering
Administreringssätt
Allmänna instruktioner
-
Lösningen ska vara klar eller lätt opalescent. Efter beredning/fyllning av sprutan (se nedan) ska den färdigberedda produkten inspekteras visuellt med avseende på partiklar och missfärgning före administrering.
-
Använd inte lösning som är grumlig eller innehåller fällning.
-
Beredning och fyllning av spruta måste ske under aseptiska förhållanden.
Beredning
Värm vätskan till rumstemperatur. Avlägsna plastlocken från flaskan med pulver och flaskan med lösningen. Behandla gummipropparnas ytor med antiseptisk lösning och låt dem torka innan Mix2Vial förpackningen öppnas.
|
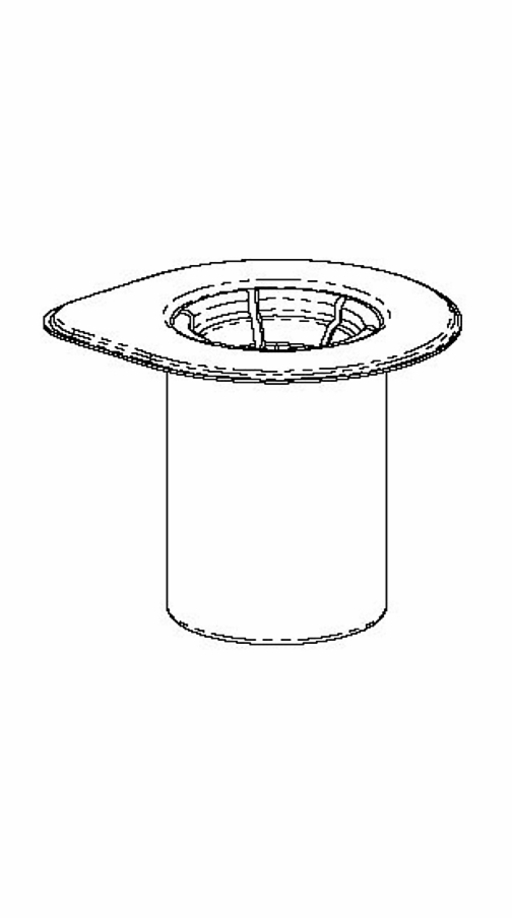
1. Öppna Mix2Vial-förpackningen genom att dra av förslutningen. Avlägsna inte förpackningen med Mix2Vial från blisterförpackningen! |
|
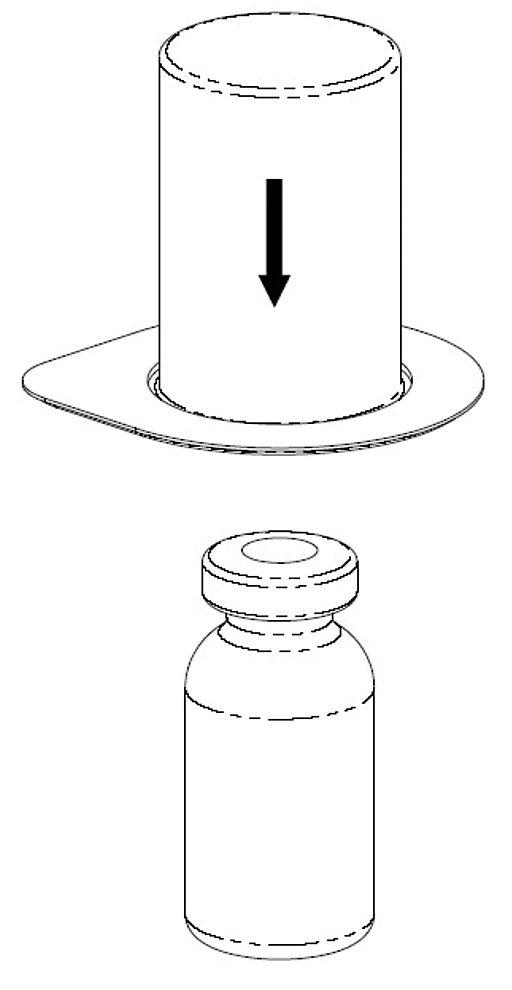
2. Placera flaskan med lösning på en plan, ren yta och håll fast flaskan stadigt. Tag förpackningen med Mix2Vial och blisterförpackningen och tryck fast nålen på den blå adapterdelen rakt ner på lösningsflaskans propp. |
|
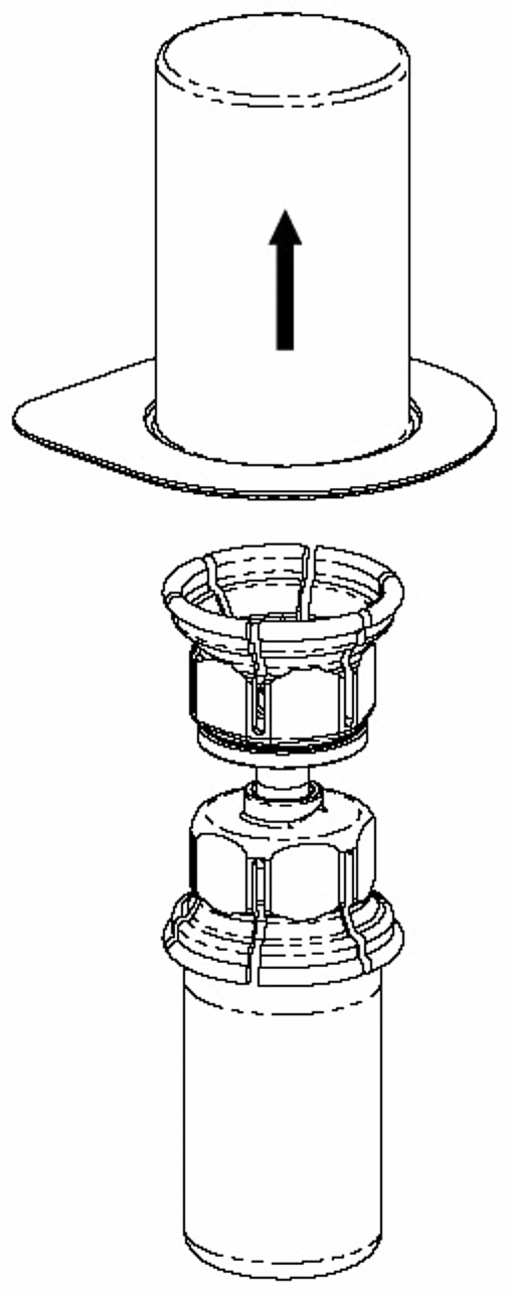
3. Ta försiktigt bort blisterförpackningen från Mix2Vial-setet genom att hålla på kanten och dra vertikalt uppåt. Se till att endast blisterförpackningen tas bort och inte Mix2Vial-setet. |
|
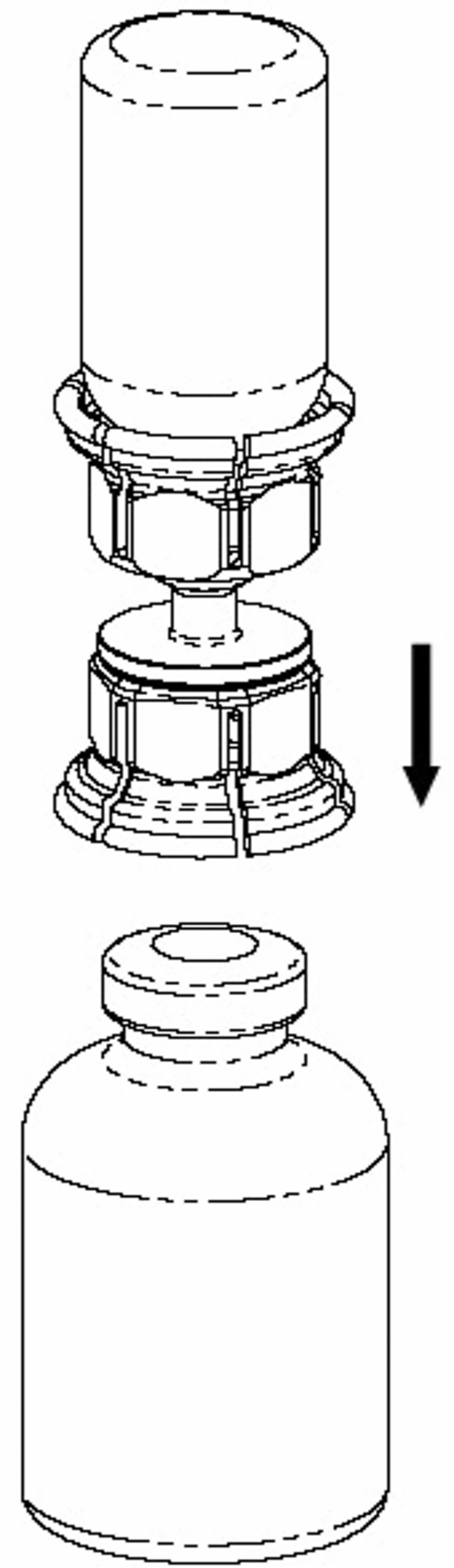
4. Ställ flaskan med pulver på ett plant, fast underlag. Vänd lösningsflaskan med det fastsatta Mix2Vial-setet och tryck fast nålen på den transparenta adaptern rakt ner på pulverflaskans propp. Lösningen kommer automatiskt att rinna över till pulverflaskan. |
|
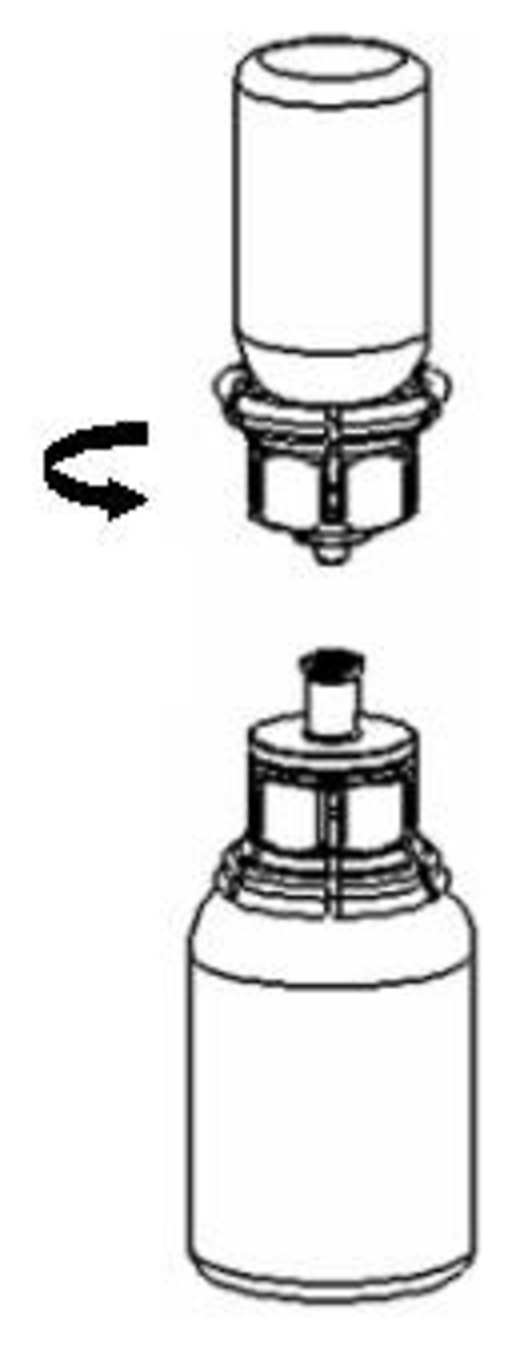
5. Fatta tag i den del av Mix2Vial-setet där pulverflaskan sitter med ena handen och den del av Mix2Vial-setet där lösningsflaskan sitter med den andra handen och skruva moturs försiktigt isär setet i 2 delar. Kassera lösningsflaskan med den blå Mix2 Vial-adaptern fastsatt. |
|
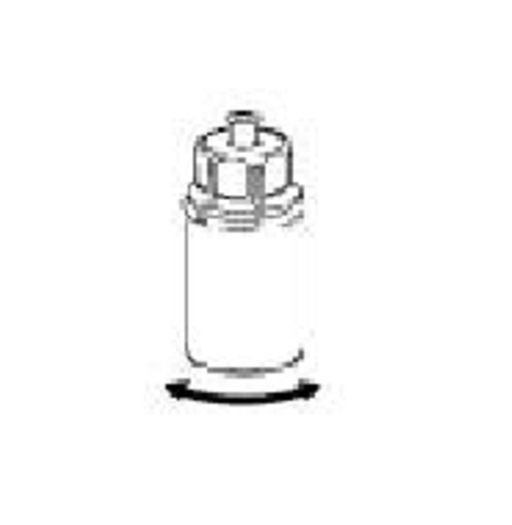
6. Rotera pulverflaskan med den transparanta adapterdelen fastsatt försiktigt tills pulvret löst sig fullständigt. Skaka inte flaskan. |
|
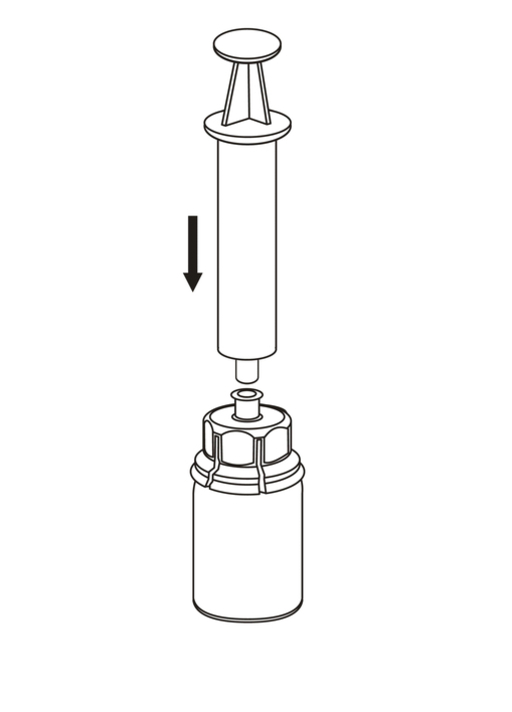
7. Dra in luft i en tom, steril spruta. Medan pulverflaskan står rakt upp kopplas sprutan ihop med Luer-locksinpassningen på Mix2Vial-delen genom att skruva medurs. Spruta in luft i flaskan. |
Fyllning av spruta och administrering
|
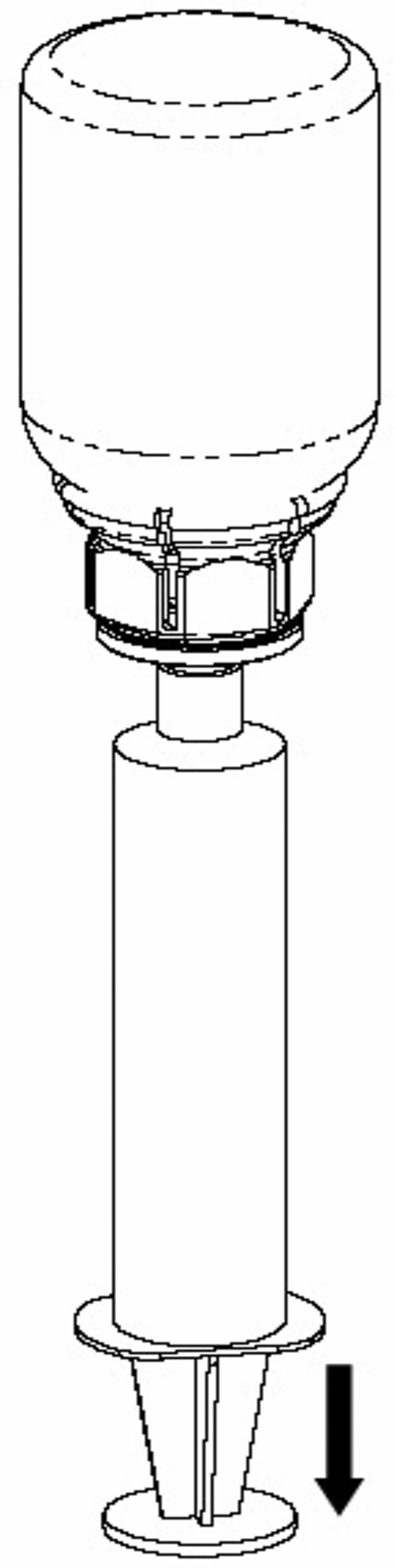
8. Med sprutkolven intryckt vänds flaskan (tillsammans med set och spruta) upp och ned. Dra in lösningen i sprutan genom att föra kolven långsamt tillbaka. |
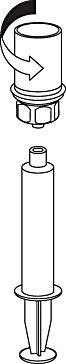
|
9. När all lösning har förts över till sprutan, fatta ett fast tag om sprutan (håll sprutan med kolven nedåt) och koppla bort den transparanta Mix2Vial-adaptern från sprutan genom att skruva moturs. |
Var noggrann med att se till att inget blod kommer in i den fyllda sprutan, eftersom det finns en risk för att blodet kan koagulera i sprutan och att fibrinkoagel därmed kan komma in i patienten.
I de fall då mer än en flaska Confidex krävs, är det möjligt att slå samman flera flaskor Confidex för en engångsinfusion med hjälp av en kommersiellt tillgänglig infusionsanordning.
Confidexlösningen får inte spädas ut.
Den färdigberedda lösningen ska administreras intravenöst (inte mer än 8 ml/min*).
*I kliniska studier med Confidex blev patienter som väger <70 kg instruerade att doseras med en maximal infusionshastighet på 0,12 ml/kg/min (mindre än 8 ml/min).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Confidex finns som ett vitt eller svagt färgat pulver eller sprött fast ämne och tillhandahålls tillsammans med vatten för injektionsvätskor som spädningsvätska. Pulvret och lösningsmedlet levereras i injektionsflaskor.
Förpackningsinformation
Pulver och vätska till injektionsvätska, lösning 250 IE
Vitt eller svagt färgat pulver eller sprött fast ämne.
Pulver och vätska till injektionsvätska, lösning 500 IE
Vitt eller svagt färgat pulver eller sprött fast ämne.
20 milliliter injektionsflaska (fri prissättning), EF, Övriga förskrivare: tandläkare
Pulver och vätska till injektionsvätska, lösning 1000 IE
Vitt eller svagt färgat pulver eller sprött fast ämne.
40 milliliter injektionsflaska (fri prissättning), EF, Övriga förskrivare: tandläkare



