Indikationer
Induktion och underhåll av generell anestesi hos vuxna och barn.
Kontraindikationer
Sevofluran ska inte ges till patienter med känd eller misstänkt överkänslighet mot sevofluran eller andra halogenerade anestetika (t ex tidigare leverfunktionsstörning, feber eller leukocytos av okänd orsak efter anestesi med något av dessa läkemedel).
Sevofluran ska inte ges till patienter med tidigare bekräftad hepatit orsakad av halogenerade anestetika eller med tidigare episod av måttlig till svårt nedsatt leverfunktion med ikterus, feber och eosinofili av oklar genes efter anestesi med sevofluran.
Sevofluran ska inte ges till patienter med känd eller misstänkt genetisk benägenhet för malign hypertermi.
Sevofluran är kontraindicerat för patienter till vilka allmän anestesi är kontraindicerat.
Dosering
Premedicinering bör väljas utifrån patientens individuella behov och narkosläkarens bedömning.
Kirurgisk anestesi
Koncentrationen av sevofluran från förgasaren ska vara känd under narkosen. Detta kan åstadkommas genom att använda en förgasare speciellt kalibrerad för Sevofluran.
Induktion av anestesi
Dosen ska anpassas till individen och titreras till önskad effekt med hänsyn till patientens ålder och kliniska status.
Ett kortverkande barbiturat eller annat intravenöst induktionsmedel kan ges följt av inhalation med sevofluran. Induktion med sevofluran kan uppnås genom inhalation av 0,5–1,0 % sevofluran i syrgas (O2) med eller utan lustgas (N2O), med ökningar om 0,5–1,0 % sevofluran till maximalt 8 % hos vuxna och barn tills önskat anestesidjup uppnås. Hos vuxna uppnås i allmänhet kirurgisk anestesi på mindre än 2 minuter vid inhalation av sevofluran i en koncentration av upp till 5 %. Hos barn uppnås i allmänhet kirurgisk anestesi på mindre än 2 minuter vid inhalation av sevofluran i en koncentration av upp till 7 %.
Underhåll av anestesi
Kirurgisk anestesi kan upprätthållas genom inhalation av 0,5–3 % sevofluran i O2 med eller utan samtidigt intag av N2O.
|
Tabell 1 MAC-värden hos vuxna och pediatriska patienter med avseende på ålder |
||
|---|---|---|
|
Patientens ålder (år) |
Sevofluran i syrgas |
Sevofluran i 65 % N2O/35 % O2 |
|
0 - 1 månad * |
3,3 % | |
|
1 - <6 månader |
3,0 % | |
|
6 månader - <3 år |
2,8 % |
2,0 %** |
|
3 - 12 |
2,5 % | |
|
25 |
2,6 % |
1,4 % |
|
40 |
2,1 % |
1,1 % |
|
60 |
1,7 % |
0,9 % |
|
80 |
1,4 % |
0,7 % |
|
*Nyfödda barn efter fullgången graviditet. MAC hos prematurer har ännu inte fastställts. **Hos pediatriska patienter 1-<3 år gamla användes 60 % N2O/40 % O2. |
||
Uppvaknande
Uppvakningstiden är generellt kort efter anestesi med sevofluran, därför kan patienten behöva postoperativ smärtlindring i ett tidigt stadium.
Äldre
MAC minskar med stigande ålder. Medelkoncentrationen av sevofluran för att uppnå MAC hos en 80-åring är ungefär 50 % av den som krävs för en 20-åring.
Pediatrisk population
Se tabell 1 för MAC-värden hos pediatriska patienter med avseende på ålder vid användning i syrgas, med eller utan samtidig tillförsel av lustgas.
Varningar och försiktighet
Sevofluran ska endast administreras av personal som fått utbildning i administrering av generell anestesi. Utrustning för att hålla patientens luftvägar fria, artificiell ventilation, syrgastillförsel och återupplivning vid cirkulationsstillestånd måste finnas omedelbart tillgängliga. Alla patienter som får anestesi med sevofluran ska övervakas kontinuerligt, inkluderande EKG, blodtryck, syrgasmättnad och endtidal koldioxid (CO2). Koncentrationen av sevofluran från förgasaren måste vara känd med exakthet. Eftersom flyktiga anestetika har skilda fysikaliska egenskaper, ska endast förgasare särskilt kalibrerade för sevofluran användas. Administrering av allmän anestesi måste anpassas efter patientens individuella respons. Hypotoni och andningsdepression ökar när anestesin blir djupare.
Ökning av sevoflurankoncentrationen vid underhållsanestesi leder till dosberoende sänkning av blodtrycket. En kraftig sänkning av blodtrycket kan relateras till anestesidjupet, vilket kan korrigeras genom att den inhalerade sevoflurankoncentrationen minskas. Eftersom sevofluran är olösligt i blod kan hastigare hemodynamiska förändringar förekomma jämfört med andra flyktiga anestetika. Återhämningen efter generell anestesi ska noga fastställas innan patienten får lämna uppvakningsavdelningen.
Uppvaknandet sker normalt snabbt efter administrering av sevofluran, och därför kan patienterna behöva tidig postoperativ smärtlindring.
Trots att medvetandet generellt återkommer inom minuter efter administrering av sevofluran, har inte effekten på den intellektuella funktionen studerats vid två till tre dagar efter anestesi. Som för andra anestetika, kan små förändringar i humöret kvarstå flera dagar efter administrering (se avsnitt Trafik).
Patienter med hjärtsjukdom
Hos patienter med kranskärlssjukdom är det som vid all anestesi viktigt att upprätthålla hemodynamisk stabilitet för att förhindra myokardiell ischemi.
Patienter som genomgår obstetriska ingrepp
Försiktighet ska iakttas vid obstetrisk anestesi på grund av sevoflurans relaxerande effekt på uterus och ökad frekvens av uterina blödningar (se Graviditet).
Patienter som genomgår neurokirurgiska ingrepp
Till patienter som löper risk för förhöjt intrakraniellt tryck (ICP) ska sevofluran administreras med försiktighet och tillsammans med åtgärder för att reducera ICP, såsom hyperventilering.
Krampanfall
Sällsynta fall av krampanfall har rapporterats i samband med användning av sevofluran.
Användning av sevofluran har associerats med krampanfall hos barn samt unga och äldre vuxna, med och utan predisponerande riskfaktorer. En klinisk bedömning är nödvändig före användning av sevofluran hos patienter med risk för krampanfall. Hos barn ska anestesidjupet begränsas. EEG kan möjliggöra en optimering av dosen sevofluran och bidra till att undvika utveckling av krampanfallsaktivitet hos predisponerade patienter (se avsnitt Varningar och försiktighet Pediatrisk population).
Patienter med njurskada
Trots att data från kontrollerade kliniska studier vid låga flödeshastigheter är begränsad, tyder fynd från patient- och djurstudier på en potentiell risk för njurskada, förmodligen orsakad av förening A. Djur- och humanstudier visar att administrering av sevofluran under mer än 2 MAC-timmar och vid flödeshastigheter av färskgas < 2 l/min, kan vara förknippade med proteinuri och glukosuri. Se även avsnitt Farmakodynamik.
Exponeringsnivåerna för förening A, vid vilka klinisk nefrotoxicitet kan förväntas, har inte fastställts. Alla bidragande faktorer till exponering för förening A hos människa ska beaktas, särskilt exponeringens varaktighet, flödeshastigheter av färskgas och koncentrationen av sevofluran.
Den inandade koncentrationen av sevofluran och flödeshastigheten av färskgas ska justeras för att minimera exponeringen för förening A. Exponering för sevofluran ska inte överskrida 2 MAC-timmar vid flödeshastigheter på 1 till <2 l/min. Flödeshastigheter av färskgas < 1 l/min rekommenderas inte.
Patienter med nedsatt njurfunktion
Sevofluran ska administreras med försiktighet tillpatienter med nedsatt njurfunktion (GFR ≤ 60 ml/min). Njurfunktionen ska övervakas postoperativt.
Patienter med leversjukdom
I mycket sällsynta fall har mild, måttlig eller uttalad postoperativ leverdysfunktion eller hepatit (med eller utan ikterus) rapporterats från erfarenhet efter introduktion på marknaden. En klinisk bedömning bör göras vid administrering av sevofluran till patienter med bakomliggande leverproblem eller patienter som får behandling med läkemedel som kan orsaka leverdysfunktion. Hos patienter som tidigare fått leverskada, ikterus, feber eller eosinofili av oklar genes efter inhalation av annat anestesiläkemedel skall administration av sevofluran undvikas om det är möjligt att ge intravenös anestesi eller regional anestesi (se avsnitt Biverkningar).
Patienter med mitokondriella sjukdomar
Försiktighet ska iakttas vid allmän anestesi, inklusive administrering av sevofluran, hos patienter med mitokondriella sjukdomar.
Patientsituationer som kräver beaktning
Särskild försiktighet måste iakttas vid val av dos till patienter som är hypovolemiska, hypotensiva, försvagade eller som på annat sätt har nedsatt hemodynamik, t ex orsakad av samtidig medicinering.
Patienter som vid upprepade tillfällen och inom ett relativt kort tidsintervall, exponeras för halogenerade kolväten, inklusive sevofluran, kan ha en ökad risk för leverskada.
Isolerade rapporter av QT-förlängning, som i mycket sällsynta fall associerats med torsade de pointes (i enstaka fall fatal sådan), har mottagits. Försiktighet ska iakttas vid administrering av sevofluran till känsliga patienter.
Malign hypertermi:
Hos känsliga patienter kan potenta inhalationsanestetika utlösa ett hypermetaboliskt tillstånd i skelettmuskulaturen vilket leder till högt syrgasbehov och det kliniska tillståndet malign hypertermi. I sällsynta fall har malign hypertermi rapporterats vid användning av sevofluran (se även Biverkningar). Det kliniska syndromet kännetecknas av hyperkapni, och kan innefatta muskelstelhet, takykardi, takypné, cyanos, arytmier och/eller instabilt blodtryck. Vissa av dessa ospecifika tecken kan även uppträda under lätt anestesi, akut hypoxi, hyperkapni och hypovolemi. Malign hypertermi med fatal utgång har rapporterats med sevofluran. Behandlingen inkluderar utsättande av utlösande ämnen (t.ex. sevofluran), administrering av dantrolennatrium intravenöst och understödjande behandling. Njursvikt kan uppträda senare, och urinflödet bör övervakas och om möjligt upprätthållas.
Användning av inhalationsanestetika har förknippats med sällsynta fall av förhöjda kaliumnivåer i serum, vilket resulterat i kardiella arytmier och dödsfall hos pediatriska patienter under den postoperativa fasen.
Patienter med latent, såväl som pågående neuromuskulär sjukdom, särskilt Duchennes muskeldystrofi, verkar vara mest känsliga. Samtidig användning av succinylkolin har förknippats med de flesta, men inte alla av dessa fall. Dessa patienter har även haft en signifikant förhöjd nivå av kreatininkinas i serum och i vissa fall urinförändringar förenligt med myoglobinuri. Trots likheten med malign hypertermi visade inga av dessa patienter tecken eller symtom på muskelstelhet eller hypermetabolt tillstånd. Tidig och aggressiv behandlingsåtgärd mot hyperkalemi och resistenta arytmier rekommenderas, liksom påföljande utvärdering för latent neuromuskulär sjukdom.
Byte av uttorkad CO2-absorbent:
Den exotermiska reaktionen mellan sevofluran och CO2-absorber lime förstärks när CO2-absorer lime blir uttorkad, t ex efter en längre periods torrt gasflöde genom flaskan med CO2-absorber lime. I sällsynta fall har extrem hetta, rök och/eller spontan eld från anestesiförgasaren vid användning av sevofluran tillsammans med uttorkad absorber lime (särskilt de som innehåller kaliumhydroxid) rapporterats. En oväntad fördröjning av ökningen av inandad sevoflurankoncentration eller en oväntad minskning av inandad sevoflurankoncentration jämfört med inställningen på förgasaren kan vara ett tecken på överhettning av flaskan med CO2-absorber lime.
En exoterm reaktion som ökar nedbrytningen av sevofluran och bildandet av nedbrytningsprodukter kan uppstå när det CO2-absorberande medlet torkar. Detta kan förkomma efter en förlängd period av torrt gasflöde genom behållaren med CO2-absorberande medel. Nedbrytningsprodukter av sevofluran (metanol, formaldehyd, kolmonoxid och förening A, B, C och D) har observerats i anestesisystemet på en maskin vid experimentell användning, då uttorkad CO2-absorbent och en maximal koncentration sevofluran (8 %) användes under en förlängd tidsperiod (≥ 2 timmar). Formaldehydkoncentrationerna som observerades i anestesisystemet (vid användning av en absorbent innehållande natriumhydroxid) motsvarade en nivå som visats orsaka mild luftvägsirritation. Den kliniska betydelsen av nedbrytningsprodukterna som observerades i denna extrema experimentella modell är inte känd.
Om den behandlande läkaren misstänker att CO2-absorber lime är uttorkad, måste den ersättas innan sevofluran administreras. Färgindikatorn på de flesta CO2-absorber lime behöver inte nödvändigtvis förändras vid uttorkning. Avsaknad av tydlig färgförändring ska därför inte tolkas som ett säkert tecken på tillräcklig hydrering. CO2-absorbenten måste bytas ut regelbundet, oavsett färgindikatorn (se avsnitt Hantering, hållbarhet och förvaring).
Pediatrisk population
Användning av sevofluran har förknippats med krampanfall. Många har drabbat barn och unga vuxna från 2 månaders ålder, de flesta utan predisponerande riskfaktorer. En klinisk bedömning ska göras när sevofluran används till patienter med en risk för krampanfall (se Varningar och försiktighet– Krampanfall).
Ett snabbt uppvaknande kan framkalla ett kortvarigt tillstånd av agitation och försvåra samarbete hos barn (ungefär 25 % av barn under narkos).
Isolerade fall av ventrikulär arytmi har rapporterats hos pediatriska patienter med Pompes sjukdom.
Dystoni, som försvinner utan behandling, har setts hos barn som fått sevofluran för induktion av anestesi. Sambandet med sevofluran är osäkert.
Downs syndrom
En signifikant högre prevalens samt grad av bradykardi har rapporterats hos pediatriska patienter med Downs syndrom, under eller efter induktion med sevofluran.
Interaktioner
Sevofluran har visats säkert och effektivt vid samtidig administrering av många olika slags läkemedel vanligt förekommande under kirurgi, såsom preparat för det centrala nervsystemet, autonoma läkemedel, skelettmuskelavslappnande läkemedel, antiinfektiva läkemedel, inklusive aminoglykosider, hormoner och syntetiska ersättningsprodukter, blodderivat och kardiovaskulära läkemedel, inklusive adrenalin.
Lustgas
I likhet med andra halogenerade flyktiga anestetikum, minskar MAC för sevofluran vid samtidig administrering av lustgas. MAC-ekvivalenten reduceras ungefär 50 % hos vuxna och 25 % hos pediatriska patienter (se Dosering - Underhåll av anestesi)
Neuromuskulärt blockerande läkemedel
I likhet med andra halogenerade anestetikum, påverkar sevofluran både intensiteten och varaktigheten av den neuromuskulära blockaden från icke-depolariserande muskelavslappnande läkemedel. Vid användning som supplement vid anestesi med alfentanil-N2O, förstärker sevofluran den neuromuskulära blockaden inducerad av pankuron, vekuron, atrakurium. Dosjusteringen av dessa muskelavslappnande läkemedel vid samtidig administrering av sevofluran liknar den som krävs för isofluran. Effekten av sevofluran på varaktigheten av den depolariserande neuromuskulärt blockerande effekten av succinylkolin har inte studerats.
Dosminskning av neuromuskulärt blockerande läkemedel under anestesiinduktionen kan orsaka en försening av insättandet av lämpliga betingelser för endotrakeal intubering eller otillräcklig muskelavslappning eftersom potentieringen av neuromuskulärt blockerande läkemedel uppkommer några minuter efter att administreringen av sevofluran påbörjats.
Bland icke-depolariserande läkemedel har interaktioner med vekuron, pankuron och atrakurium studerats. I avsaknad av specifika riktlinjer: (1) minska inte dosen av icke-depolariserande muskelavslappnande läkemedel vid endotrakeal intubering, (2) vid anestesiunderhåll blir dosen av icke-depolariserande muskelavslappnande läkemedel troligen lägre jämfört med den under N2O/opioidanestesi. Administrering av ytterligare doser av muskelrelaxantia bör bedömas med utifrån respons vid nervstimulering.
Benzodiazepiner och opioider
Bensodiazepiner och opiater förväntas minska MAC för sevofluran på samma sätt som andra inhalerade anestesimedel. Administrering av sevofluran är kompatibelt med benzodiazepiner och opioider som ofta används vid kirurgi.
Opioider såsom fentanyl, alfentanil och sufentanil kan, om de kombineras med sevofluran, ge en synergistisk sänkning av hjärtfrekvens, blodtryck och andningsfrekvens.
Betablockerare
Sevofluran kan öka negativa jonotropa, kronotropa och dromotropa effekter av betablockare genom blockad av kardiovaskulära kompensationsmekanismer.
Epinefrin/adrenalin
I likhet med isofluran har sevofluran en sensibiliserande effekt på myokardiet avseende den arytmogena effekten av exogent administrerat adrenalin. Tröskelvärdet för adrenalinutlösta multipla ventrikulära arytmier har fastställts till 5 mikrogram per kg kroppsvikt.
CYP2E1-inducerare
Läkemedel och substanser som ökar aktiviteten av cytokrom P450-isoenzymet CYP2E1, såsom isoniazid och alkohol, kan öka metabolismen av sevofluran och leda till markanta ökningar av plasmakoncentrationerna av fluorid. Samtidig användning av sevofluran och isoniazid kan förstärka den levertoxiska effekten av isoniazid.
Indirekt verkande sympatomimetika
Det finns risk för akuta hypertensiva episoder vid samtidig användning av sevofluran och indirekt verkande sympatomimetika (amfetamin, efedrin).
Verapamil
Försämrad atrioventrikulär överledning har observerats vid samtidig administrering av verapamil och sevofluran.
Johannesört
Allvarlig hypotoni och försenat uppvaknande ur narkos med halogenerade inhalationsanestetika har rapporterats hos patienter på långtidsbehandling med johannesört.
Barbiturater
Administrering av sevofluran är kompatibelt med barbiturater, profolol och andra vanligen använda intravenösa anestesimedel. Lägre dos av sevofluran kan fordras efter användning av intravenösa anestesimedel.
Graviditet
Det finns inga eller begränsade data på användningen av sevofluran hos gravida kvinnor. Djurstudier har visat reproduktionstoxicitet (se avsnitt Prekliniska uppgifter), därför ska sevofluran endast användas under graviditet och av fertila kvinnor som inte använder preventivmedel om absolut nödvändigt.
Förlossningsarbete och förlossning
I en klinisk prövning kunde säkerheten med sevofluran för mödrar och spädbarn visas vid användning under anestesi vid kejsarsnitt. Säkerheten med sevofluran vid förlossningsarbete och vaginal förlossning har inte visats.
Försiktighet bör iakttas vid obstetrisk anestesi på grund av den relaxerande effekten av sevofluran en relaxerande verkan på uterus och ökning av uterusblödning.
Amning
Det är inte känt om sevofluran utsöndras i bröstmjölk. Försiktighet bör därför iakttas när sevofluran ges till en ammande kvinna.
Fertilitet
Djurstudier har visat negativa effekter på fertilitet (se avsnitt Prekliniska uppgifter). Det finns inga data om effekter på fertilitet hos människa.
Trafik
Patienter ska informeras om att förmågan att utföra aktiviteter som kräver mental skärpa, såsom framförande av motorfordon eller användande av riskfyllda maskiner, kan försämras en tid efter allmän anestesi (se Varningar och försiktighet).
Patienter bör inte köra bil efter anestesi med sevofluran under en tidsperiod som fastställts av narkosläkaren.
Biverkningar
Sammanställning av säkerhetsprofilen
I likhet med alla potenta inhalationsanestetika kan sevofluran leda till dosberoende kardiorespiratorisk depression. De flesta biverkningarna är lätta till måttliga och övergående. Illamående och kräkningar, vanliga symtom efter operation och generell anestesi, har rapporterats under den postoperativa perioden. Dessa symtom kan bero på anestesimedlet, andra medel som administrerats pre- eller postoperativt, eller på patientens reaktion på det kirurgiska ingreppet.
De vanligast förekommande biverkningarna som rapporterades var enligt följande:
Hos vuxna patienter: hypotoni, illamående och kräkning.
Hos äldre patienter: bradykardi, hypotoni, och illamående.
Hos pediatriska patienter: agitation, hosta, kräkning och illamående.
Sammanställning av biverkningar i tabellform
Alla reaktioner från kliniska prövningar och erfarenhet efter introduktion på marknaden som åtminstone kan ha en möjlig koppling till sevofluran redovisas i tabellen nedan enligt MedDRA organklassificeringssytemet, föredragen term och frekvens. Följande frekvensgruppering används: Mycket vanliga (≥1/10), Vanliga (≥1/100, <1/10), Mindre vanliga (≥1/1 000, <1/100), Sällsynta (≥1/10 000, <1/1 000), Mycket sällsynta (<1/10 000), inklusive isolerade fall. Efter marknadsföring rapporteras biverkningar frivilligt från en population med okänd exponeringsfrekvens. Därför är det inte möjligt att uppskatta den sanna incidensen av biverkningarna och frekvensen benämns därför som ”ingen känd frekvens (kan inte beräknas från tillgängliga data)”. Typen, allvarlighetsgraden och frekvensen på biverkningarna hos patienter som fått sevofluran i kliniska prövningar var jämförbara med biverkningarna hos patienter som fick referensläkemedlet.
Biverkningar som härrör från kliniska prövningar och erfarenhet efter marknadsföring.
|
Sammanställning av de vanligast förekommande biverkningarna i kliniska prövningar med sevofluran och från erfarenhet efter marknadsföring |
||
|---|---|---|
|
Organklass |
Frekvens |
Biverkan |
|
Immunsystemet |
Ingen känd frekvens |
Anafylaktisk reaktion1 Anafylaktoid reaktion Hyperkänslighet1 |
|
Psykiska störningar |
Mycket vanliga |
Agitation |
|
Mindre vanliga |
Förvirring |
|
|
Ingen känd frekvens |
Delirium |
|
|
Centrala och perifera nervsystemet |
Vanliga |
Sömnighet Yrsel Huvudvärk |
|
Ingen känd frekvens |
Krampanfall2, 3 Dystoni Ökat intrakraniellt tryck |
|
|
Hjärtat |
Mycket vanliga |
Bradykardi |
|
Vanliga |
Takykardi |
|
|
Mindre vanliga |
Fullständig atrioventrikulär block Kardiella arytmier (inklusive ventrikulära arytmier), förmaksflimmer, extrasystole (ventrikulär, supraventrikulär, bigenimi) |
|
|
Ingen känd frekvens |
Hjärtstillestånd4 Ventrikulär fibrillation Torsades de pointes Ventrikulär takykardi, QT-förlängning vid elektrokardiogram |
|
|
Blodkärl |
Mycket vanliga |
Hypotoni |
|
Vanliga |
Hypertoni |
|
|
Andningsvägar, bröstkorg och mediastinum |
Mycket vanliga |
Hosta |
|
Vanliga |
Respiratoriska störningar
Laryngospasm Luftvägsobstruktion |
|
|
Mindre vanliga |
Andningsstillestånd Astma Hypoxi |
|
|
Ingen känd frekvens |
Bronkospasm Dyspné1 Väsande andning1 Benägenhet att hålla andan |
|
|
Magtarmkanalen |
Mycket vanliga |
Illamående Kräkning |
|
Vanliga |
Hypersekretion av saliv |
|
|
Ingen känd frekvens |
Pankreatit |
|
|
Metabolism och nutrition |
Ingen känd frekvens |
Hyperkalemi |
|
Muskuloskeletala systemet och bindväv |
Ingen känd frekvens |
Muskelrigiditet |
|
Lever och gallvägar |
Ingen känd frekvens |
Hepatit1, 2 Leversvikt1, 2 Levernekros1, 2 Gulsot |
|
Njurar och urinvägar |
Ingen känd frekvens |
Tubulointerstitiell nefrit |
|
Hud och subkutan vävnad |
Ingen känd frekvens |
Kontaktdermatit1 Klåda Utslag1 Svullnad i ansiktet1 Nässelutslag |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Vanliga |
Frossa Pyrexi |
|
Ingen känd frekvens |
Obehag i bröstet1 Malign hypertermi1, 2 Ödem |
|
|
Undersökningar |
Vanliga |
Avvikande blodglukos Avvikande leverfunktionstest5 Avvikande antal vita blodkroppar Förhöjd blodfluorid1 |
|
Mindre vanliga |
Förhöjd serumkreatinin |
|
|
Skador och förgiftningar och behandlingskomplikationer |
Vanliga |
Hypotermi |
1 Se avsnitt Biverkningar – Beskrivning av utvalda biverkningar
2 Se avsnitt Varningar och försiktighet
3 Se avsnitt Biverkningar – Pediatrisk population
4 Det har förekommit mycket sällsynta rapporter om hjärtstillestånd i samband med användning av sevofluran efter marknadsföring
5 Ett fåtal fall av övergående förändringar i leverfunktionstest har rapporterats med sevofluran och referensläkemedel.
Beskrivning av utvalda biverkningar
Övergående förhöjningar av nivån oorganisk fluorid i serum kan förekomma under och efter anestesi med sevofluran. Koncentrationen av oorganisk fluorid når vanligtvis sin topp inom två timmar efter avslutad anestesi med sevofluran och återgår till preoperativa nivåer inom 48 timmar. I kliniska prövningar var de förhöjda fluoridkoncentrationerna inte förknippade med nedsatt njurfunktion.
Det finns sällsynta rapporter om postoperativ hepatit. Efter marknadsföring har det även rapporterats sällsynta fall av leversvikt och -nekros förknippade med användning av potenta flyktiga anestetika inklusive sevofluran. Den faktiska incidensen och sambandet med sevofluran kan emellertid inte fastställas med säkerhet (se Varningar och försiktighet).
I sällsynta fall har hyperkänslighetsreaktioner inklusive kontaktdermatit, utslag, dyspné, väsande andning, obehag i bröstet, svullnad i ansiktet, svullnad av ögonlock, erytem, urtikaria, klåda, bronkospasm, anafylaktiska eller anafylaktoida reaktioner rapporterats särskilt i samband med lång tid av yrkesexponering för inhalerbara anestetika inklusive sevofluran.
Hos känsliga individer kan potenta inhalationsanestetika trigga ett hypermetabolt tillstånd i skelettmuskulaturen vilket kan leda till ett högt syrgasbehov samt det kliniska syndromet malign hypertermi (se Varningar odh försiktighet).
Pediatrisk population
Användningen av sevofluran har förknippats med krampanfall. Flera av dessa har förekommit hos barn och unga vuxna från 2 månaders ålder, de flesta utan predisponerande riskfaktorer.
I flera fall rapporterades avsaknad av annan samtidig medicinering, och minst ett fall är bekräftat av EEG. De flesta fallen var enstaka anfall som upphörde spontant eller efter behandling, men även multipla krampanfall har rapporterats. Anfallen har uppträtt under eller i nära anslutning till induktion med sevofluran, under uppvaknandet samt under den post-operativa återhämtningen upp till ett dygn efter anestesin. En klinisk bedömning ska göras när sevofluran används hos patienter med risk för krampanfall (se Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Symtom på överdosering omfattar andningsdepression och cirkulationsinsufficiens.
Vid överdos ska följande åtgärder vidtas:
Administreringen av sevofluran ska avbrytas och stabiliserande åtgärder insättas: bibehåll fria luftvägar, påbörja artificiell eller kontrollerad ventilation med ren syrgas tillsammans med åtgärder för stabilisering av kardiovaskulär funktion.
Farmakodynamik
Sevofluran är en halogenerad metylisopropyleter som ger en snabb induktions- och uppvakningsfas. MAC (minsta alveolära koncentration) är åldersspecifik (se Dosering). Sevofluran ger förlust av medvetande, reversibelt upphävande av smärta och motorisk aktivitet, minskade autonoma reflexer, andnings- och kardiovaskulär depression. Dessa effekter är dosberoende.
Sevofluran har en låg blod/gasfördelningskoefficient (0,65) vilket ger en snabb återhämtning efter anestesi.
Kardiovaskulära effekter: Sevofluran kan ge en koncentrationsrelaterad minskning av blodtrycket. Sevofluran ger en sensibilisering av hjärtmuskulaturen för arytmogena effekter av exogent administrerad epinefrin. Denna sensibilisering liknar den som framkallas av isofluran.
Farmakokinetik
Sevofluran har låg löslighet i blod och vävnad, vilket medför att alveolarkoncentrationen snabbt ökar vid induktion och snabbt minskar vid utsättande av anestesimedlet.
Hos människor metaboliseras < 5 % av absorberat sevofluran i levern till hexafluorisopropanol (HFIP) med frisättning av oorganisk fluorid och koldioxid (eller ett enkolfragment). När HFIP bildats konjugeras det snabbt med glukuronsyra och elimineras via urinen.
Den snabba och omfattande pulmonella eliminationen av sevofluran minimerar den mängd som finns tillgänglig för metabolism. Metabolismen av sevofluran induceras inte av barbiturater.
Prekliniska uppgifter
Gängse studier avseende toxicitet efter enstaka doser och upprepad dosering med sevofluran visade ingen specifik organtoxicitet. Fertilitetsstudier på råttor indikerade en minskning av implantations- och dräktighetsfrekvensen efter upprepad exponering för anestetiska doser. Ingen teratogen effekt har visats i studier på råttor och kaniner. Vid sub-anestetiska koncentrationer under den perinatala fasen hos råttor påvisades en förlängning av dräktigheten.
En studie på hanråttor har visat minskad spermierörlighet och koncentration samt ökad testikeldegenerering efter kronisk exponering av sevofluran (1 MAC sevofluran inhalation i 7 eller 14 dagar) jämfört med kontroller.
Publicerade studier på djur (inklusive primater) vid doser som resulterat i lätt till måttlig anestesi, visar att användningen av anestesiläkemedel under hjärnans snabba tillväxtperiod eller synaptogenes resulterar i cellförlust i hjärnan som utvecklas. Det kan associeras till långvariga kognitiva nedsättningar. Den kliniska signifikansen av dessa icke-kliniska fynd är okänd.
Omfattande in vitro- och in vivo-studier avseende mutagenicitet med sevofluran visade negativa resultat.
Karcinogenicitetsstudier har ej genomförts.
Effekter på cirkulation och syrgasförbrukning: Resultaten från hundstudier indikerar att sevofluran inte orsakar ”coronary steal syndrom” eller förvärrar tidigare myokardiell ischemi. Djurstudier har visat att lever- och njurcirkulationen bibehålls väl med sevofluran. Sevofluran sänker den cerebrala metaboliseringsgraden för syrgas (CMRO2) på ett sätt som är analogt med det som kan observeras med isofluran. Cirka 50 % reduktion av CMRO2 har observerats vid koncentrationer som närmar sig 2,0 MAC. Djurstudier har visat att sevofluran inte har någon signifikant effekt på den cerebrala genomblödningen.
Effekter på centrala nervsystemet: Hos djur ger sevofluran en signifikant dämpad elektroencefalografisk (EEG) aktivitet som är jämförbar med effekten av ekvipotenta doser av isofluran. Det finns inga belägg för att sevofluran är associerat med epileptiform aktivitet under normokapni eller hypokapni. Till skillnad från enfluran har försök att framkalla anfallsliknande EEG-aktivitet under hypokapni med rytmiskt audiostimuli varit negativt.
Förening A: Förening A är en nedbrytningsprodukt från sevofluran, som genereras i CO2-absorberare. Dess koncentration ökar normalt med ökande absorberartemperatur, sevoflurankoncentration samt en sänkning av flödeshastigheten för färsk gas.
Studier utförda på råtta har visat dos- och durationsberoende reversibel nefrotoxicitet (”single cell”-nekros i celler i proximala tubuli). Hos råtta kunde tecken på nefrotoxicitet observeras vid 25-50 ppm efter 6-12 timmars exponering. Relevans för människa är inte känd.
I kliniska studier var högsta koncentration av förening A (användning av sodalime som CO2-absorberare i systemet) 15 ppm hos barn och 32 ppm hos vuxna. I system där bariumlime används som CO2-absorberare har koncentrationer på upp till 61 ppm noterats. Även om erfarenheten av lågflödesanestesi är begränsad, finns hittills inga bevis för njurfunktionsnedsättning på grund av förening A.
Innehåll
Sevofluran 100 %. Hjälpämnen med känd effekt: Inga. Läkemedlet består enbart av aktiv substans.
Miljöpåverkan
Sevofluran
Miljörisk:
Användning av sevofluran har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Sevofluran är potentiellt persistent.
Bioackumulering:
Sevofluran har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Detaljerad miljöinformation / Detailed background information
Due to the application of the medicine and its physical-chemical properties, the parent compound sevoflurane (CAS 28523-86-6) is mainly emitted to the air compartment. Indeed, a minor amount of sevoflurane and its metabolites are maybe emitted down-the-drain. Only the latter releases, parent and metabolite, have been examined in the following risk classification. Thus, only the potential risk to the aquatic compartment is addressed here.
Environmental Risk Classification
Predicted Environmental Concentration (PEC): parent compound
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.5*10-6*A(100-R)
PEC = 0.000112 μg/L
Where:
A = 7359.4 kg * 0.01% (total sold amount API in Sweden year 2018, data from IQVIA (2019); reduced by fraction excreted). The 0.01% represents a worst-case assumption; Justification on reduction see metabolism data below.
R = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 %. This value represents a worst-case assumption due to volatilisation; Justification see data below.
P = number of inhabitants in Sweden = 9 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA, 2016)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA, 2016)
Predicted No Effect Concentration (PNEC): parent compound
Ecotoxicological studies
For sevoflurane information on acute aquatic toxicity on Algae, Fish and Daphnia magna, 3 studies according to OECD 201, 202 and 203 (Ref: Claude MB & Krueger HO, 2008a, Claude & Krueger HO, 2008b, Claude & Krueger HO, 2008c) are given by AbbVie on the Fass website. However, as the primary study reports are not available, the reliability of the studies result could not be reviewed.
Algae (Pseudokirchneriella subcapitata) (OECD 201; Claude & Krueger, 2008a):
EC50 72 h (growth inhibition) > 100 mg/L
Crustacean (Daphnia magna):
Acute toxicity
EC50 48 h (immobilisation) = 48 mg/L (OECD 202 ; Claude & Krueger, 2008b)
Chronic toxicity
Not available
Fish fathead minnow (Pimephales promelas):
Acute toxicity
LC50 96 h (mortality) = 43 mg/L (OECD 203; Claude & Krueger, 2008c)
Chronic toxicity
Not available
AbbVie derived following PNEC:
PNECsurface water = lowest EC50/1000 = 43 µg/L
where 1000 is the assessment factor used. The EC50 for the fathead minnow (Pimephales promelas) has been used for this calculation since it is the most sensitive of the three tested species (algae, crustacean, fish).
This approach is according to REACh Technical Guidance Document, Chapter R.10 (ECHA, 2008) where an assessment factor of 1000 is applied on the lowest acute EC50/LC50 value of three trophic levels.
Environmental risk classification (PEC/PNEC ratio): parent compound
According to the European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00), use of sevoflurane is unlikely to represent a risk for the environment, because the predicted environmental concentration (PEC) is below the action limit 0.01 μg/L.
In addition, based on the available information,
PEC/PNEC = 0.000112/43 = 0.0000026, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase «Use of sevoflurane has been considered to result in insignificant environmental risk.»
Predicted Environmental Concentration (PEC): metabolite HFIP
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.5*10-6*A(100-R)
PEC = 0.0471 μg/L
Where:
A = 7359.4 kg * 168.05 g/mol / 200.05 g/mol * 5% (total sold amount API in Sweden year 2017, data from IQVIA (2018); reduced by fraction excreted). The 5% represents a worst-case assumption; Justification on reduction sees metabolism data below.
R = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 %
P = number of inhabitants in Sweden = 9 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA, 2016)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA, 2016)
Predicted No Effect Concentration (PNEC): metabolite HFIP
Ecotoxicological studies
In the bioaccumulation study (METI, 1985), an acute toxicity to the rice fish (Oryzias latipes) was given. However, detailed information is missing. In addition, results are available in the public literature on the acute toxicity to the fish fathead minnow (Pimephales promelas) (Geiger et al., 1986). A registration dossier under REACh is available on the ECHA website (ECHA, 2018) describing recently performed aquatic toxicity studies with HFIP. It should be noted that the original study reports could not be evaluated. Instead, only information publicly disseminated on the ECHA website served as basis of this assessment. Therefore, definitive quality and reliability cannot be assessed from this limited information. However, the registrants regarded the studies as reliable.
Algae:
ECOSAR predicts an EC50 48h of 126 mg/l for green algae (HFIP is within the applicability domain of the model)
Green alga (Pseudokirchneriella subcapita (synonym Raphidocelis subcapitata) formerly known as Selenastrum capricornutum) (OECD 201, GLP, including analytical monitoring) (ECHA, 2018)
EC50 72 h (growth rate) > 100 mg/L (nominal); > 97.2 mg/L (measured)
NOEC 72 h (growth rate) > 100 mg/L(nominal); > 100 mg/L (measured)
Crustacean:
Acute toxicity
ECOSAR predicts an LC50 48h of 390 mg/l for daphnia (HFIP is within the applicability domain of the model)
Daphnia magna (OECD 202, GLP, including analytical monitoring, limit test) (ECHA, 2018)
EC50 48 h (immobility) > 100mg/L (nominal); > 97.3 mg/L (measured)
Chronic toxicity
Not available
Fish:
Acute toxicity
Fathead minnow (Pimephales promelas)
LC50 96 h (mortality) = 244 mg/L
EC50 96 h (behavioral changes, increased respiration and changes in fish colour) = 177 mg/L; test results based on measured test substance concentrations; flow-through system; initial 117-656 mg HFIP/L nominal (95.9 - 533 mg/L effective); 24.9°C; 5.8 mg DO/l; pH 7.68 (Geiger et al., 1986)
Rice fish (Oryzias latipes) LC50 48 h = 270 mg/L; japanese guideline JIS K 0102; (METI, 1985)
Chronic toxicity
Not available
According to REACh Technical Guidance Document, Chapter R.10 (ECHA, 2008) an assessment factor of 1000 is applied on the lowest EC50/LC50 value of three trophic levels. Experimentally derived data on acute toxicity to fish is available. EC50 for fathead minnow is the more sensitive of the two tested fish species. For daphnia has been performed with 100 mg/L (nominal) and no effects were observed. For algae up to the highest tested concentration (100 mg/L (nominal)) no effects were observed. The 100 mg/L has been used for PNEC derivation as a worst-case estimate.
PNECsurface water = lowest EC50/1000 = 100 µg/L
Environmental risk classification (PEC/PNEC ratio): metabolite
As only experimentally derived acute toxicity data of HFIP to fish is available, risk of environmental impact of sevoflurane cannot be completely excluded, since there is not sufficient ecotoxicity data available.
However, based on the available information,
PEC/PNEC = 0.0471/100 = 0.00047, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase «Use of sevoflurane has been considered to result in insignificant risk.»
Degradation
Biotic degradation
Ready degradability:
For sevoflurane a study according to OECD 301D is given by AbbVie (Ref: Matthews & Schaefer. 2008) on the fass website. However, as the primary study report is not available, the reliability of the study result could not be reviewed.
Test results in ≤ 4.4% degradation in 28 days (OECD 301D; Matthews & Schaefer, 2008).
For the metabolite HFIP biodegradation study was conducted by the Japanese Government for the existing chemicals survey in 1986:
Test results in 0% degradation in 28 days based on the TOC, and 5% degradation in 28 days based on direct quantification (GC) (similar to OECD 301C MITI (I), but with DOC/GC analysis; 30 mg/L standard activated sludge from 10 different places in Japan (no pre-exposure), 25 +/-1 °C, test substance concentration 100 mg/L, solution adjusted to pH 7.0, test solution volume 300 ml, number of replicates n=2, degradation rate of aniline as reference after 7 days 73% based on TOC) (METI, 1986).
These results indicate that sevoflurane as well as HFIP can be regarded as not readily biodegradable.
Inherent degradability:
Information on inherent biodegradability is not available.
Simulation studies:
STP simulation studies and test results in water, sediment and total system are not available.
Abiotic degradation
Hydrolysis:
Experimentally derived information on hydrolysis is not available.
Photolysis:
Experimentally derived information on photolysis in water is not available.
Justification if R is not equal to 0, e.g. modelling results using SimpleTreat:
As sevoflurane is not readily biodegradable, and simulation studies are not available, the default value was used for removal rate R = 0. However, this is a worst-case approach for sevoflurane, as modelling results using SimpleTreat suggest that within STP about 89.3% is emitted to air, 1.88% to sludge, and only 8.82% to water.
As the metabolite HFIP is not readily biodegradable, and simulation studies are not available, the default value was used for removal rate R = 0. Modelling results using SimpleTreat suggest that within STP about 3.8% is emitted to air, 0.939% to sludge, and 95.3% to water.
Justification of chosen degradation phrase:
As sevoflurane as well as its metabolite HFIP are not readily biodegradable, and simulation studies are not available, the medicine is potentially persistent.
Photodegradation:
In the atmosphere Sevoflurane could be removed by chemical reaction with radicals, by photolysis and by wet or dry deposition. The degradation time is assumed to be limited by the reaction with the hydroxyl radical (OH•). The following rate coefficient kOH are described:
Brown et al. (1989): 7.3E-14 cm3/molecule-sec at 300 K
EpiSuite (estimation, AOPWIN): 6.78E-14 cm3/molecule-sec at 298 K
Langbein et al. (1999): 2.7E-14 cm3/molecule-sec at 298 K
Sulbaek Andersen et al. (2010): 1.79E-14 cm3/molecule-sec at 272 K
Sulbaek Andersen et al. (2012): 3.9E-14 cm3/molecule-sec at 298 K
The life-times given in the literature are between 0.6 and 4 years depending on the rate constant, OH radical concentration, and temperature.
For HFIP the estimated rate coefficient kOH is 0.1742E-12 cm3/molecule-sec at 298 K corresponding to a half-life of 92 d (EpiSuite, AOPWIN).
Adsorption and desorption to soil
The soil adsorption coefficient (Koc) of sevoflurane was calculated by ACD/Labs to be 544 L/kg. Estimations via EpiSuite show Koc values of 272.4 L/kg (MCI method) and 63.46 L/kg. (Kow method with a logKow of 1.75). Using the logPow and the recommended QSAR of the TGD for non-hydrophobics, results in a Koc of 209 L/kg. Thus, adsorption of sevoflurane to soil and sediment is assumed to be low.
For HFIP the soil adsorption coefficient (Koc) was estimated via EpiSuite. This estimation results in values of 28.04 L/kg (MCI method) and 27.03 L/kg. (Kow method with a logKow of 1.66). Using the logPow and the recommended QSAR of the TGD for non-hydrophobics, results in a Koc of 76.4 L/kg. Thus, adsorption of HFIP to soil and sediment is assumed to be low.
Volatilisation
Distribution of sevoflurane between air and water (Henry’s law constant) was estimated from the ratio of the vapour pressure to the water solubility. The resulted value of 1870 Pa m3/mole at 25 °C resulting in an air-water partitioning coefficient of 0.378 at 12°C indicates a rapid and significant volatilization from water.
For HFIP an experimental Henrys law constant of 4.31 Pa m3/mol at 25 °C was found in the SRC database (EpiSuite; Rochester & Symonds, 1973).
Bioaccumulation
Bioconcentration factor (BCF):
Bioconcentration study for sevoflurane is not available.
Results of a bioconcentration study conducted by the Japanese Government for the existing chemicals survey in 1986 with the carp Cyprinus carpio indicated that HFIP is not expected to pose a significant risk for bioaccumulation (METI, 1986): Test fish: Carp (average weight: 21.3 g, average length: 9.4 cm, average lipid content 4%, 24-hour medication bathing in the teramicin diffused solution for fish farming at the concentration of 0.005 % in stagnant water, acclimatization 25 °C x 14 days), 100 L Volume glass aquarium, flow-through, water flow: 1155 l /day, dissolved oxygen 1st test vessel 5.2-6.7 and 2nd test vessel 5.7-7.1 mg/l; cultivation period: 6 weeks, 25 +/-2 °C; feed twice a day about 2% of fish weight; concentration of the test substance: 1st test vessel 1 mg/l, 2nd test vessel 0.1 mg/l; analytical method: GC-MS, water analysis twice a week, fish analysis 4 times; the degree of concentration by carp of the test substance was 1.1 to 1.4 times in the 1st concentration division and 1.3 to 2.7 times in the 2nd concentration division. The test fish had no anomaly as the result of appearance inspection.
Partitioning coefficient:
An experimental study according to OECD 107 on the logPow of sevoflurane determined a logPow > 2 (Baxter, 2012). With the analytical method performed in this study it was not possible to detect sevoflurane in the water phase, thus no exact value could be determined. However, this experimentally determined lower limit of the logPow is similar to the calculated values of 2.5 at 25°C (ACD/Labs) and 1.75 (EpiSuite/KOWWIN v1.67).
Sevoflurane: estimated Log Dow = 2.5 at pH 7
For HFIP estimated values for logPow of 1.11 (EpiSuite/KOWWIN v1.68) and 1.57 ± 0.53 (ACD/Labs) could be calculated. Experimental value of 1.66 is given in a generally accepted review (Hansch et al., 1995)
HFIP: Log Dow = 1.66 at pH 7
Justification of chosen bioaccumulation phrase:
Since log Dow < 4 at pH 7, sevoflurane has low potential for bioaccumulation. Moreover, toxicokinetic data from humans show that sevoflurane does not remain in human bodies but is released back into the air.
Since BCF < 500, HFIP has low potential for bioaccumulation. This is supported by the partitioning coefficient, due to log Dow < 4 at pH 7.
Excretion (metabolism)
Sevoflurane predominantly leaves the human body via pulmonary exhalation and reaches the atmosphere as the main target compartment. Scientific literature demonstrates that the administered sevoflurane is mainly emitted intact into the atmosphere, and in a lower extent metabolized to fluoride and hexafluoroisopropanol (HFIP), which is rapidly glucuronidated and excreted as HFIP-glucuronide in urine.
Into wastewater, sevoflurane is excreted to < 0.01% as parent compound (Accorsi et al., 2005) and to 2-5% as metabolite hexafluoroisopropanol (HFIP) (Kharasch, 1996) in alignment to SPC Sweden. The pharmacological activity of the metabolite is not known.
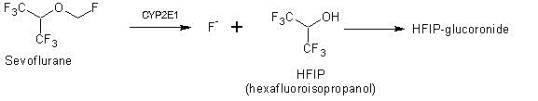
A reduction of A (total sold amount API in Sweden 2017) in the PEC calculation is justified based on excretion/metabolism as follows:
Sevoflurane (Parent):
A = 7359,4 kg * 0.01%
HFIP (Metabolite):
A = 7359,4 kg * MW(metabolite)/MW(parent) * M
= 7359,4 kg * 168.05 g/mol / 200.05 g/mol * 5%
PBT/vPvB assessment
As both Sevoflurane and its metabolite HFIP have low potential for bioaccumulation, they do not fulfil the criteria for PBT and/or vBvP substances and thus should not be flagged.
According to the established EU criteria, the medicine should not be regarded as a PBT/vPvB substance.
References
Accorsi A, Morrone B, Domenichini I, Valenti S, Raffi GB and Violante FS, 2005. Urinary sevoflurane and hexafluoro-isopropanol as biomarkers of low-level occupational exposure to sevoflurane. International Archives of Occupational and Environmental Health, 78, 369-378.
Baxter, 2012. Experimental study report: Sevoflurane, Partition Coefficient n-Octanol/Water (OECD 107), Shake Flask Method. Performed by Siemens AG, Prozess-Sicherheit, Industriepark Höchst, B 596 & B 598, 65926 Frankfurt am Main, Germany.
Brown AC, Canosa-Mas CE, Parr AD, Pierce JM and Wayne RP, 1989. Tropospheric lifetimes of halogenated anaesthetics. Nature, 341, 635-637
Claude MB & Krueger HO, 2008a. Sevoflurane: A 72-hour toxicity screening test with the freshwater alga (Pseudokirchneriella subcapitata). Wildlife International, Ltd, Easton, Maryland, project number 161A-108 (cited from information on the fass website by AbbVie; original report not available to Baxter).
Claude MB & Krueger HO, 2008b. Ultane Sevoflurance: A 48-hour static acute toxicity screening test with the Cladoceran (Daphnia magna). Wildlife International, Ltd, Easton, Maryland, project number 161A-109 (cited from information on the fass website by AbbVie; original report not available to Baxter).
Claude MB & Krueger HO, 2008c. Ultane Sevoflurance: A 96-hour static acute toxicity screening test with the fathead minnow (Pimephales promelas). Wildlife International, Ltd, Easton, Maryland, project number 161A-110 (cited from information on the fass website by AbbVie ; original report not available to Baxter).
ECHA, European Chemicals Agency, 2008. Guidance on information requirements and chemical safety assessment. Guidance on information requirements and chemical safety assessment
ECHA, European Chemicals Agency, 2016. Guidance on information requirements and chemical safety assessment chapter R.16: Environmental exposure assessment version 3.0 February 2016. Guidance on information requirements and chemical safety assessment chapter R.16: Environmental exposure assessment version 3.0 February 2016.
ECHA, European Chemicals Agency, 2018. REACH-Registration dossier 1,1,1,3,3,3-hexafluoroisopropanol (CAS 920-66-1), last modified 2018-02-21. European Chemicals Agency, Helsinki, Finland. Publicly available under: REACH-Registration dossier 1,1,1,3,3,3-hexafluoroisopropanol (CAS 920-66-1)
ECOSAR. Calculation Program. U.S. Environmental Protection Agency. OPPT-Risk Assessment Division. Washington, USA.
Geiger DL, Poirier SH, Brooke LT and Call DJ, 1986. Acute toxicities of organic chemicals to Fathead minnows (Pimephales promelas), Vol. III. Center for Lake Superior Environmental Studies, University of Wisconsin-Superior. Supported by U.S. Environmental Protection Agency, 41.
Hansch C, Leo A, Hoekman D, 1995. Exploring QSAR. Hydrophobic, electronic, and steric constants. American Chemical Society, Washington, DC (USA)
IQVIA, 2018. Consumption assessment in kg for input to enviromental classification - updated 2018 (data 2017), Project 1048212
Kharasch ED, 1996. Metabolism and toxicity of the new anesthetic agents. Acta Anaesthesiologica Belgica, 47, 7-14.
Langbein T, Sonntag H, Trapp D, Hoffmann A, Malms W, Roth EP, Mors V and Zellner R, 1999. Volatile anaesthetics and the atmosphere: atmospheric lifetimes and atmospheric effects of halothane, enflurane, isoflurane, desflurane and sevoflurane. British Journal of Anaesthesia, 82, 66-73
Matthews ME & Schaefer EC, 2008. Sevoflurane: Closed Bottle Test, Wildlife International, Ltd, Easton, Maryland, project number 161E-104 (cited from information on the fass website by AbbVie; original report not available to Baxter).
METI, 1985. Test Report - 1,1,1,3,3,3-Hexafluoro-2-propanol (test substance No. K-451)'s degree of concentration test by carp. 26 July 1985, Chemicals Evaluation And Research Institute, Japan (CERI), Chemicals Safety Research Center (results of existing chemicals survey conducted by the Japanese Government)
METI, 1986. Test Report - 1,1,1,3,3,3-Hexafluoro-2-propanol (test substance No. K-451)'s degradation test by microorganisms. 20 February 1986, Chemicals Evaluation And Research Institute, Japan (CERI), Chemicals Safety Research Center (results of existing chemicals survey conducted by the Japanese Government)
Rochester CH & Symonds JR, 1973. Thermodynamic studies of fluoro alcohols. 1. vapor pressures and enthalpies of vaporization. J. Chem. Soc. Faraday Trans. 1, 69, 1267-73.
Sulbaek Andersen MP, Nielsen OJ, Karpichev B, Wallington TJ and Sander SP, 2012. Atmospheric Chemistry of Isoflurane, Desflurane, and Sevoflurane: Kinetics and Mechanisms of Reactions with Chlorine Atoms and OH Radicals and Global Warming Potentials. J Phys Chem A. 116(24):5806-5820
Sulbaek Andersen MP, Sander SP, Nielsen OJ, Wagner DS, Sanford TJ, Jr. and Wallington TJ, 2010. Inhalation anaesthetics and climate change. British Journal of Anaesthesia, 105, 760-766.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Detta läkemedel har inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Sevofluran skall administreras via en förgasare som kalibrerats speciellt för sevofluran.
Påfyllning sker direkt från flaskan via en ventilförslutning eller,om flaskan inte har ventilförslutning med användning av en lämplig adapter som utformats speciellt för sevofluran förgasare. Enbart förgasare som påvisats vara kompatibla med detta läkemedel ska användas för administrering.
Det har påvisats att sevofluran kan degraderas i närvaro av stark Lewis-syra vilken kan bildas på metall eller glasytor vid svåra förhållanden. Användning av förgasare som innehåller sådan stark Lewis-syra, eller om förhållanden är sådana att det kan bildas under normal användning, ska undvikas.
Koldioxidabsorberande medel ska ej tillåtas torka ut vid administrering av inhalationsanestetika. Om det CO2-absorberande medlet misstänks vara uttorkat ska det bytas ut.





