Indikationer
IXIARO är indicerat för aktiv immunisering mot japansk encefalit hos vuxna, ungdomar, barn och spädbarn i åldern 2 månader och äldre.
IXIARO ska övervägas till personer som löper risk att exponeras under resor eller i arbetet.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt innehåll eller mot restsubstanserna protaminsulfat, formaldehyd, bovint serumalbumin, värdcell-DNA, natriummetabisulfit (se avsnitt innehåll), värdcellsprotein.
Personer som fått överkänslighetsreaktioner efter den första dosen av IXIARO ska inte få den andra dosen.
Administreringen måste skjutas upp vid akuta, svåra febertillstånd.
Dosering
Dosering
Vuxna (18 ≤ 65 år)
En grundvaccinationsserie består av två separata doser på vardera 0,5 ml som ges enligt följande konventionella schema:
Första dosen ges dag 0.
Andra dosen ges 28 dagar efter den första dosen.
Snabbschema:
Personer 18 ≤ 65 år kan vaccineras enligt det snabbschema som följer:
Första dosen på dag 0.
Andra dosen: 7 dagar efter första dosen.
Med båda scheman bör grundimmuniceringen avslutas minst en vecka före eventuell exponering för japanskt encefalitvirus (JEV) (se Varningar och försiktighet).
Det rekommenderas att personer som fått den första dosen av IXIARO fullföljer grundvaccinationsprogrammet på två doser med IXIARO.
Om grundimmuniseringen med två injektioner inte fullföljs, kanske fullt skydd mot sjukdomen inte uppnås. Det finns uppgifter om att en andra injektion som ges upp till 11 månader efter första dosen ger höga serokonversionsfrekvenser (se Farmakodynamik).
Boosterdos
En boosterdos (tredje dos) ska ges inom andra året (dvs. 12–24 månader) efter grundimmuniseringen, före eventuell återexponering för JEV.
Personer med kontinuerlig risk för att få japansk encefalit (laboratoriepersonal eller personer som vistas i endemiska områden) ska få en boosterdos vid månad 12 efter grundimmuniseringen (se Farmakodynamik).
Långsiktiga seroprotektionsdata efter en första boosterdos som har administrerats 12-24 månader efter grundimmunisering tyder på att en andra booster ska ges 10 år efter den första boosterdosen, innan eventuell exponering för JEV.
Äldre (> 65 år)
Grundvaccinationsserien består av två separata doser på 0,5 ml var, enligt följande traditionella schema:
Första dosen på dag 0.
Andra dosen: 28 dagar efter första dosen.
Grundimmuniseringen ska slutföras minst en vecka före eventuell exponering för japanskt encefalitvirus (JEV) (se Varningar och försiktighet).
Det rekommenderas att personer som fått den första dosen av IXIARO fullföljer grundvaccinationsprogrammet på två doser med IXIARO.
Om grundimmuniseringen med två injektioner inte fullföljs, uppnås eventuellt inte fullt skydd mot sjukdomen. Det finns uppgifter om att en andra injektion som ges upp till 11 månader efter första dosen ger höga serokonversionsfrekvenser (se Farmakodynamik).
Boosterdos
Liksom med många vacciner är immunsvaret hos äldre för IXIARO lägre än hos yngre vuxna. Varaktigheten av skyddet är osäker för äldre, varför en boosterdos (tredje dos) ska övervägas före ytterligare exponering för JE-virus. Varaktigheten av seroprotektionen efter en boosterdos är inte känd.
Pediatrisk population
Barn och ungdomar från 3 år till < 18 år
Den primära vaccinationsserien består av två separata doser på 0,5 ml enligt följande schema:
Första dosen ges dag 0.
Andra dosen: 28 dagar efter den första dosen.
Barn från 2 månader till < 3 år
Den primära vaccinationsserien består av två separata doser på 0,25 ml enligt följande schema:
Första dosen ges dag 0.
Andra dosen: 28 dagar efter den första dosen.
Se avsnitt längre ner för anvisningar om hur man bereder en dos på 0,25 ml för barn i åldern 2 månader till < 3 år.
Det rekommenderas att vaccinmottagare som får den första dosen av IXIARO slutför det primära vaccinationsprogrammet om 2 doser med IXIARO.
Boosterdos (Barn och ungdomar)
En boosterdos (tredje dos) ska ges inom det andra året (dvs. 12 - 24 månader) efter grundimmuniseringen, före eventuell återexponering för JEV.
Barn och ungdomar med kontinuerlig risk för att få japansk encefalit (som vistas i endemiska områden) ska ges en boosterdos vid månad 12 efter grundimmuniseringen (se Farmakodynamik).
Barn och ungdomar från 3 år till < 18 år ska ges en enkel 0,5 ml boosterdos.
Barn från 14 månader till < 3 års ålder ska ges en enkel 0,25 ml boosterdos.
Se Hållbarhet, förvaring och hantering nedan för anvisningar om hur man bereder en dos på 0,25 ml för barn i åldern 2 månader till <3 år.
Inga långsiktiga data om seroprotektion längre än två år efter att första boosterdosen administreras 1 år efter grundimmuniseringen har genererats hos barn.
Barn under 2 månader
Säkerhet och effekt för IXIARO för barn som är yngre än 2 månader har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Vaccinet ska administreras intramuskulärt i deltamuskeln (deltoideus). På spädbarn kan främre utsidan på låret användas som injektionsställe. IXIARO får aldrig administreras intravaskulärt.
Om IXIARO administreras samtidigt som injicerbara vaccin, ska de ges med separata sprutor på motsatta ställen.
IXIARO kan dock undantagsvis administreras subkutant till patienter med trombocytopeni eller blödningsrubbningar eftersom blödning kan uppstå efter intramuskulär administrering. Subkutan administrering kan leda till suboptimalt svar på vaccinet. Det finns emellertid inga kliniska effektdata för subkutan administrering.
Varningar och försiktighet
Spårbarhet
För att förbättra spårbarheten av biologiska medicinska produkter ska den administrerade produktens namn och partinummer registreras.
Liksom för alla injicerbara vacciner ska lämplig medicinsk behandling och övervakning alltid finnas i beredskap för behandling av anafylaktiska reaktioner som i sällsynta fall kan inträffa i samband med vaccinationen.
IXIARO får under inga omständigheter administreras intravaskulärt.
Liksom för alla vacciner är det inte säkert att alla som vaccineras med IXIARO erhåller skydd. IXIARO skyddar inte mot encefalit orsakad av andra mikroorganismer.
Liksom för alla intramuskulära injektioner ska vaccinet inte administreras intramuskulärt till personer med trombocytopeni, hemofili eller andra blödningsrubbningar.
Hos vuxna erhölls en serokonversionsgrad på 29,4 procent 10 dagar efter den första intramuskulära vaccinationen och 97,3 procent en vecka efter den andra intramuskulära vaccinationen enligt det konventionella schemat. Efter immunisering med det snabba schemat har en serokonversionsgrad på 99 procent observerats 7 dagar efter den andra intramuskulära vaccinationen. Därför ska grundvaccinationen ske minst en vecka före eventuell exponering för japanskt encefalitvirus.
Skydd mot japansk encefalit garanteras inte förrän andra dosen har erhållits.
Interaktioner
Samtidig administrering av IXIARO med andra vaccin:
Kiniska studier med samtidig administrering av IXIARO och inaktiverat hepatit A-vaccin och med inaktiverat rabiesvaccin enligt två olika scheman har utförts. Någon påverkan på immunresponsen för vacciner mot japanskt encefalitvirus (JEV) eller hepatit A eller rabiesvirus kunde inte påvisas. Säkerhetsprofilerna för IXIARO och övriga studerade vaccin påverkades inte vid samtidig administrering.
Det är inte säkert att personer som behandlas med immunsuppressiva medel eller som har nedsatt immunförsvar kan få ett tillräckligt immunsvar.
Pediatrisk population
Inga interaktionsstudier har utförts på barn eller ungdomar.
Graviditet
Det finns begränsade data från behandling av gravida kvinnor med IXIARO. I djurstudier har resultat av oklar klinisk relevans observerats. Som en försiktighetsåtgärd ska IXIARO undvikas under graviditet.
Amning
Det är inte känt om IXIARO utsöndras i bröstmjölk hos människa. Inga effekter förväntas på det ammade barnet, eftersom den ammande kvinnans systemiska exponering av IXIARO är obetydlig. Eftersom det saknas data och som en säkerhetsåtgärd skaanvändning av IXIARO undvikas under amning.
Fertilitet
En studie på råttor visade inga vaccinrelaterade effekter på honors reproduktion, fostervikt eller avkommans överlevnad och utveckling.
Trafik
IXIARO har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerheten för IXIARO har undersökts i kontrollerade och okontrollerade kliniska studier på 5 021 friska vuxna personer (från icke-endemiska länder) och 1 559 barn och ungdomar (i huvudsak från endemiska länder).
Systemiska biverkningar uppkom hos cirka 40 procent av behandlade personer och cirka 54 % fick reaktioner vid injektionsstället. De uppstår vanligtvis inom de första tre dagarna efter vaccinationen och är vanligtvis lindriga och avtar inom några dagar. Antalet biverkningar ökade inte mellan den första och andra dosen eller efter en boosterdos hos vuxna.
De vanligaste biverkningarna hos vuxna inkluderade huvudvärk (20 procent av försökspersonerna), myalgi (13 procent), smärta vid injektionsstället (33 procent), ömhet på injektionsstället (33 procent) och trötthet (12,9 procent).
De vanligast rapporterade biverkningarna hos barn och ungdomar inkluderade feber, diarré, influensaliknande sjukdom, irritabilitet, smärta på injektionsstället, ömhet på injektionsstället och rodnad på injektionsstället (se tabell 1).
Biverkningarna presenteras med avseende på frekvens:
Mycket vanliga: ≥ 1/10
Vanliga: ≥ 1/100, < 1/10
Mindre vanliga: ≥ 1/1 000, < 1/100
Sällsynta: ≥ 1/10 000, < 1/1 000
Vuxen och äldre population (> 65 år)
Blodet och lymfsystemet
Mindre vanliga: lymfadenopati
Sällsynta: trombocytopeni
Centrala och perifera nervsystemet
Mycket vanliga: huvudvärk
Mindre vanliga: migrän, yrsel
Sällsynta: parestesi, neurit, smakrubbning, synkope*
Ögon
Sällsynta: ögonlocksödem
Öron och balansorgan
Mindre vanliga: yrsel (vertigo)
Hjärtat
Sällsynta: palpitationer, takykardi
Andningsvägar, bröstkorg och mediastinum
Sällsynta: dyspné
Magtarmkanalen
Vanliga: illamående
Mindre vanliga: kräkningar, diarré, buksmärta
Hud och subkutan vävnad
Mindre vanliga: hudutslag, pruritus
Sällsynta: urticaria, erytem, hyperhidros
Muskuloskeletala systemet och bindväv
Mycket vanliga: myalgi
Mindre vanliga: muskuloskeletal stelhet, artralgi
Sällsynta: extremitetssmärta
Allmänna symtom och/eller symtom vid administreringsstället
Mycket vanliga: smärta och ömhet vid injektionsstället, trötthet
Vanliga: influensaliknande sjukdom, pyrexi, andra reaktioner vid injektionsstället, t.ex. hudrodnad, förhårdnad, svullnad, klåda
Mindre vanliga: köldfrossa, sjukdomskänsla, asteni
Sällsynta: perifert ödem
Undersökningar
Mindre vanliga: förhöjda leverenzymer.
*rapporterat också efter försäljning
Pediatrisk population (2 månader till <18 år)
|
Frekvens av biverkningar (%) per dos/ålder |
||
|
Organsystem Rekommenderad term |
0,25 ml N=783 2 månader till <3 år |
0,5 ml N=628 3 till<18 år |
|
Blodet och lymfsystemet | ||
|
Lymfadenopati |
0,1 |
0,0 |
|
Metabolism och nutrition | ||
|
Nedsatt aptit |
8,2 |
1,9 |
|
Centrala och perifera nervsystemet | ||
|
Huvudvärk |
2,9 |
6,1 |
|
Andningsvägar, bröstkorg och mediastinum | ||
|
Hosta |
0,5 |
0,3 |
|
Magtarmkanalen | ||
|
Diarré |
11,9 |
1,4 |
|
Kräkning |
7,3 |
1,9 |
|
Illamående |
3,9 |
1,9 |
|
Buksmärta |
0,1 |
0,0 |
|
Hud och subkutan vävnad | ||
|
Utslag |
6,3 |
1,4 |
|
Muskuloskeletala systemet och bindväv | ||
|
Myalgi |
3,0 |
7,1 |
|
Allmänna symtom och/eller symtom vid administreringsstället | ||
|
Pyrexi |
28,5 |
10,4 |
|
Influensaliknande sjukdom |
10,9 |
2,9 |
|
Irritabilitet |
10,9 |
1,9 |
|
Utmattning |
3,5 |
3,5 |
|
Rodnad vid injektionsstället |
10,0 |
4,1 |
|
Smärta vid injektionsstället |
6,1 |
14,1 |
|
Ömhet vid injektionsstället |
4,2 |
14,7 |
|
Svullnad vid injektionsstället |
3,6 |
2,2 |
|
Förhårdnad vid injektionsstället |
1,2 |
1,9 |
|
Klåda vid injektionsstället |
0,6 |
1,6 |
|
Undersökningar | ||
|
Förhöjda leverenzymer |
0,5 |
0,2 |
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Inga symptom relaterade till fall av överdosering har rapporterats.
Pediatrisk population
Inga fall av överdosering har rapporterats i den pediatriska populationen. Oavsiktlig administrering av en dos på 0,5 ml av IXIARO till barn i åldern 1 år till < 3 år utgör inga säkerhetsproblem.
Farmakodynamik
Verkningsmekanism
Verkningsmekanismen för vacciner mot japansk encefalit (JE) är inte känd. Djurstudier har visat att vaccinet stimulerar immunsystemet att producera antikroppar mot japanskt encefalitvirus som i de flesta fall utgör ett skydd. Provokationsstudier har genomförts på möss som behandlades med humant IXIARO‑antiserum. Studierna visade att nästan alla möss som hade en titer på minst 1:10 i ”Plaque Reduction Neutralization Test” var skyddade mot en letal provokation med japanskt encefalitvirus.
Klinisk effekt och säkerhet
Inga prospektiva effektstudier har utförts. Immunogeniciteten hos IXIARO har undersökts på cirka 3 119 friska vuxna försökspersoner i sju randomiserade, kontrollerade och i fem okontrollerade fas 3-studier och på cirka 550 friska barn som ingick i två randomiserade, kontrollerade och två okontrollerade kliniska fas 3-studier.
Pivotal studie av immunogenicitet (vuxna)
Vaccinets immunogenicitet har utvärderats i en randomiserad, aktivt kontrollerad, prövarblind, klinisk fas 3- multicenterstudie på 867 friska män och kvinnor som antingen fick IXIARO eller vaccinet JE‑VAX (med licens i USA) mot japanskt encefalitvirus (som injicerades subkutant dag 0, 7 och 28). Det co-primära effektmåttet var serokonversionsgraden (anti-JEV-antikroppstiter ≥ 1:10) och GMT (geometrisk genomsnittlig titer) dag 56 som utvärderades med hjälp av neutraliseringstestet Plaque Reduction Neutralization Test (PRNT) på hela studiepopulationen.
Vid dag 56 var andelen försökspersoner som hade serokonverterat nästan samma i båda behandlingsgrupperna (96,4 procent och 93,8 procent för IXIARO respektive JE-VAX). Vid dag 56 hade GMT ökat till 243,6 för IXIARO och 102,0 för JE-VAX. Det immunsvar som framkallades av IXIARO var inte sämre (non-inferior) än det som framkallades av JE-VAX (tabell 2).
|
Serokonversionsgrad |
||
|
Tidpunkt |
IXIARO N=365 % (n) |
JE-VAX N=370 % (n) |
|
Studiebesök 0 (screening) |
0 |
0 |
|
Studiebesök 3 (dag 28) |
54 (197) |
86,8 (321) |
|
Studiebesök 4 (dag 56) |
96,4 (352) |
93,8 (347) |
|
GMT, geometrisk genomsnittlig titer (med Plaque Reduction Neutralization Test) |
||
|
Tidpunkt |
IXIARO N=365 GMT (n) |
JE-VAX N=370 GMT (n) |
|
Studiebesök 0 (screening) |
5,0 (365) |
5,0 (370) |
|
Studiebesök 3 (dag 28) |
17,4 (363) |
76,9 (367) |
|
Studiebesök 4 (dag 56) |
243,6 (361) |
102,0 (364) |
Effekten av ålder på immunsvaret för IXIARO och JE-VAX utvärderades som ett sekundärt effektmått i denna aktivt kontrollerade studie, där försökspersoner med en ålder på ≥50 år (N = 262, genomsnittlig ålder 59,8) jämfördes med försökspersoner under 50 års ålder (N = 605, genomsnittlig ålder 33,9).
Ingen signifikant skillnad kunde påvisas mellan serokonversionsgraden för IXIARO och JE-VAX hos försökspersoner under 50 års ålder jämfört med försökspersoner 50 år och äldre vid dag 28 eller dag 56 efter vaccinationen. GMT (geometrisk genomsnittlig titer) var signifikant högre vid dag 28 hos försökspersoner under 50 års ålder jämfört med försökspersoner 50 år och äldre i gruppen med JE-VAX (89,9 jämfört med 45,9, p = 0,0236), men ingen signifikant skillnad kunde ses vid dag 56 för denna behandlingsgrupp. Ingen signifikant effekt av ålder kunde påvisas för GMT (geometrisk genomsnittlig titer) i gruppen som fick IXIARO. Ingen signifikant skillnad kunde påvisas mellan serokonversionsgraden hos försökspersoner under 50 års ålder jämfört med försökspersoner 50 år och äldre vid dag 28 eller dag 56 hos någon av behandlingsgrupperna.
Antikropparnas varaktighet (vuxna)
Antikropparnas varaktighet har utvärderats i en okontrollerad klinisk fas 3‑uppföljningsstudie på försökspersoner som hade avslutat två pivotala studier och som fick minst en dos av IXIARO. Immunogeniciteten för IXIARO under lång tid utvärderades i en undergrupp med 181 försökspersoner upp till månad 24 (intention-to-treat (ITT)-population) och hos 152 försökspersoner upp till månad 36 efter den första IXIARO-vaccinationen.
Frekvenser av försökspersoner med PRNT50≥1:10 och GMT vid månad 2, 6, 12, 24 och 36 sammanfattas i tabell 3 för ITT-populationen.
|
Frekvens av försökspersoner med PRNT50≥1:10 |
GMT |
|||
|
Tidpunkt |
% (n/N) |
95 % konfidens- intervall |
GMT (N) |
95 % konfidens- intervall |
|
Månad 2 |
98,9 (179/181) |
[96,1; 99,7] |
310,8 (181) |
[268,8; 359,4] |
|
Månad 6 |
95,0 (172/181) |
[90,8; 97,4] |
83,5 (181) |
[70,9; 98,4] |
|
Månad 12 |
83,4 (151/181) |
[77,3; 88,1] |
41,2 (181) |
[34,4; 49,3] |
|
Månad 24 |
81,8 (148/181) |
[75,5; 86,7] |
44,3 (181) |
[36,7; 53,4] |
|
Månad 36 |
84,9 (129/152) |
[78,3; 89,7] |
43,8 (152) |
[36,5; 52,6] |
Den påvisade sänkningen av GMT är enligt förväntningarna och är jämförbar med andra inaktiverade JE-vacciner.
I en annan öppen fas 3-uppföljningsstudie utvärderades antikropparnas varaktighet upp till 24 månader efter grundvaccination. Totalt 116 försökspersoner som hade fått det rekommenderade grundprogrammet med IXIARO inkluderades i denna uppföljningsstudie. Frekvenserna av försökspersoner med PRNT50≥1:10 var 82,8 % (95 % KI: 74,9; 88,6; N=116) vid månad 6 och 58,3 % vid månad 12 (95 % KI: 49,1; 66,9; N=115). Vid månad 24 hade 48,3 % (95 % KI: 39,4; 57,3; N=116) av de försökspersoner som avslutade den rekommenderade grundimmuniseringen fortfarande PRNT50-titrar på ≥1:10. GMT hos dessa försökspersoner var 16,2 (95 % KI: 13,8; 19,0) vid månad 24.
Boosterimmunisering (vuxna)
I en okontrollerad, öppen fas 3-studie gavs en enda boosterdos på 6 mikrogram (0,5 ml) vid månad 15 efter grundimmunisering. Alla de 198 försökspersoner som behandlades inkluderades i ITT- och säkerhetspopulationerna.
Frekvenser av försökspersoner med PRNT50≥1:10 och GMT över tiden sammanfattas i tabell 4.
|
Frekvenser av försökspersoner med PRNT50≥1:10 |
GMT |
|||
|
95 % KI |
95 % KI |
|||
|
Förbooster, dag 0 (n=198) |
69,2 % |
[62,4 %; 75,2 %] |
22,5 |
[19,0; 26,7] |
|
Dag 28 (n=198) |
100,0 % |
[98,1 %, 100,0 %] |
900,1 |
[742,4; 1091,3] |
|
Månad 6 (n=197) |
98,5 % |
[95,6 %, 99,5 %] |
487,4 |
[390,7; 608,1] |
|
Månad 12 (n=194) |
98,5 % |
[95,6 %, 99,5 %] |
361,4 |
[294,5; 443,5] |
Varaktighet av antikroppsskydd efter boosterimmunisering (vuxna)
I en okontrollerad, öppen förlängning av boosterstudien som har beskrivits ovan, följdes 67 försökspersoner upp för fastställande av JEV-neutraliserande antikroppstiter cirka 6 år efter en boosterdos. 96 % av försökspersonerna (64/67) hade fortfarande skyddande antikroppsnivåer (PRNT50≥1:10) med en GMT på 148 (95 %CI: 107; 207). Matematiska modeller tillämpades för att projicera skyddets genomsnittliga varaktighet. Baserat på denna modell uppskattas det att den genomsnittliga skyddstiden kommer att vara i 14 år och 75 % av de vaccinerade kommer att behålla skyddande antikroppsnivåer (PRNT50≥1:10) under 10 år. En andra booster bör därför ges 10 år efter den första boosterdosen, administrerad 1 år efter den primära immuniseringen, innan möjlig exponering för JEV.
Snabbimmuniseringsschema (vuxna)
Immunogeniciteten för IXIARO som administerats i ett snabbvaccinationsschema har utvärderats i en randomiserad, observatörsblind, fas 3-studie. Sammanlagt 217 försökspersoner i åldern 18 ≤ 65 år fick IXIARO tillsammans med inaktiverat rabiesvaccin (Rabipur) i ett snabbt immuniseringsschema på dag 0 och dag 7 och 56 försökspersoner fick IXIARO separat i det konventionella immuniseringsschemat på dag 0 och dag 28. Andelen försökspersoner som serokonverterades innan 7 och 28 dagar efter den senaste immuniseringen var liknande för båda scheman. Serokonversionsfrekvens och antikroppstitrar fortsatte att vara jämförbart höga i upp till 12 månader efter den första immuniseringen i båda scheman (tabell 5).
Snabbschemat testades avseende samtidig administrering av IXIARO och Rabipur men det kan även användas för administrering av enbart IXIARO, eftersom ingen immunstörning av de båda vaccinen observerats.
|
Serokonversionsfrekvens (Frekvens för försökspersoner med PRNT50≥1:10) |
GMT (plackreduktionsneutraliseringstest) |
|||
|---|---|---|---|---|
|
Snabbschema % (n/N) |
Konventionellt schema % (n/N) |
Snabbschema (N) |
Konventionellt schema (N) |
|
|
Vaccinationsschema |
IXIARO dag 0,7 Rabipur dag 0,3,7 |
IXIARO dag 0,28 - |
IXIARO dag 0,7 Rabipur dag 0,3,7 |
IXIARO dag 0, 28 - |
|
Dag 0 |
6 (13/215) |
9 (5/55) |
5,63 (215) |
5,73 (55) |
|
Dag 14 |
99 (206/209) |
Ej tillg. |
715 (209) |
Ej tillg. |
|
Dag 21 |
100 (207/208) |
Ej tillg. |
1255 (208) |
Ej tillg. |
|
Dag 35 |
99 (203/206) |
100 (47/47) |
690 (206) |
376 (47) |
|
Dag 56 |
98 (200/204) |
100 (49/49) |
372 (204) |
337 (49) |
|
Dag 365 |
94 (188/199) |
88 (42/48) |
117 (199) |
39 (48) |
Ej tillg. = ej tillgängligt
Ofullständig grundimmunisering (vuxna)
Boosterdosernas immunogenitet utvärderades också i studien som undersökte immunitetens varaktighet efter olika grundimmuniseringsregimer (2x6 mikrogram: N=116, 1x12 mikrogram: N=116 eller 1x6 mikrogram: N=117). En enda boosterdos på 6 mikrogram (0,5 ml) gavs 11 eller 23 månader efter första dosen till försökspersoner som fastställts vara seronegativa (PRNT50-titrar <1:10) vid månad 6 och/eller 12 efter grundimmuniseringen. Resultaten indikerar att den andra injektionen i grundimmuniseringsserien kan ges upp till 11 månader efter första dosen. Immunsvaren på ytterligare doser vid olika tidpunkter efter fullständig eller ofullständig grundimmunisering visas i tabell 6.
|
(n/N) |
SCR |
GMT |
[95 % KI] |
|
|
Booster efter rekommenderad grundimmunisering (2x6 mikrogram) | ||||
|
Booster vid månad 11 |
(17/17) |
100 % |
673,6 |
[378,7; 1198,2] |
|
Booster vid månad 23 |
(27/27) |
100 % |
2 536,7 |
[1 467,7; 4 384,4] |
|
Andra dos efter ofullständig grundimmunisering (1x6 mikogram) | ||||
|
Andra dos vid månad 11 |
(99/100) |
99 % |
504,3 |
[367,3; 692,3] |
|
Andra dos vid månad 23 |
(5/5) |
100 % |
571,4 |
[88,2; 3 702,9] |
Samtidig användning (vuxna)
Samtidig administrering av IXIARO med inaktiverat hepatit A-virus (HAV) vaccin (HAVRIX 1440)
Samtidig användning av IXIARO och vaccin med inaktiverat hepatit A-virus (HAV), HAVRIX 1440, har undersökts i en klinisk studie. Ingen påverkan på immunsvaret för JE-virus respektive HAV kunde påvisas. Samtidig administrering av IXIARO och hepatit A-vaccin visades inte vara sämre (non-inferior) än enskilda vaccinationer med avseende på GMT-nivåerna (geometrisk genomsnittlig titer) av neutraliserande antikroppar mot JEV och HAV-antikroppar samt med avseende på serokonversionsgraden för båda typerna av antikroppar (tabell 7).
|
Serokonversionsgrad och GMT (geometrisk genomsnittlig titer) för neutraliserande antikroppar mot JEV vid dag 56 |
|||
|
% med SCR |
GMT |
95 % KI |
|
|
Grupp C: IXIARO + HAVRIX 1440 |
100,0 |
202,7 |
[153,7; 261,2] |
|
Grupp A: IXIARO + placebo |
98,2 |
192,2 |
[147,9; 249,8] |
|
Serokonversionsgrad och GMT (geometrisk genomsnittlig titer) för HAV-antikroppar vid dag 28 |
|||
|
% med SCR |
GMT |
95 % KI |
|
|
Grupp C: IXIARO + HAVRIX 1440 |
100,0 |
150,0 |
[111,7; 202,3] |
|
Grupp B: HAVRIX + placebo |
96,2 |
124,0 |
[91,4; 168,2] |
Samtidig administrering av IXIARO med inaktiverat rabiesvaccin (Rabipur)
I en observatörsblind fas 3-studie, har samtidig administrering av IXIARO och Rabipur studerats hos vuxna i åldrarna 18 ≤ 65 år, i jämförelse med respektive enstaka vaccination i ett konventionellt schema. Inga störningar observerades med hänsyn till GMT (Geometrisk medeltiter) och serokonverteringsfrekvens för anti-neutraliserande JEV-antikroppar (tabell 8). Det förekom heller inga störingar i immunförsvaret för Rabipur.
|
Serokonversionsfrekvenser och geometriskt medeltiter för JEV-neutraliserande antikroppar på dag 56 |
||
|---|---|---|
|
SCR [%] (n/N) |
GMT [95 % CI] (N) |
|
|
IXIARO + Rabipur |
100 (157/157) |
299 [254-352] (157) |
|
IXIARO |
100 (49/49) |
337 [252-451] (49) |
Vaccinationsscheman: IXIARO: Dag 0/28, Rabipur: Dag 0/7/28.
Immunogenicitet hos äldre personer (> 65 år)
Immunogeniciteten hos IXIARO har utvärderats i en öppen, okontrollerad studie hos 200 friska äldre personer i åldrarna > 65 till 83 år, inklusive försökspersoner med underliggande förhållanden, såsom hyperkolesterolemi, hypertension, hjärtsjukdom eller icke insulin-beroende diabetes mellitus. JEV-neutraliserade antikroppar fastställdes 42 dagar efter den andra dosen av den primära serien (dag 70). Äldre personer har ett lägre immunsvar för vaccination jämfört med yngre vuxna eller barn, i termer av serokonversionsfrekvens (procentandel försökspersoner med PRNT50 titer ≥1:10) och geometrisk medeltiter (tabell 9).
|
Serokonversionsfrekvenserna och geometrisk medeltiter för JEV-neutraliserande antikropp på dag 70 |
||||
|---|---|---|---|---|
|
n / N |
SCR |
GMT |
95% CI |
|
|
Total studiepopulation |
128/197 |
65 % |
37 |
29,2, 47,8 |
|
Åldersgrupp > 65 - <75 år |
113/173 |
65,3 % |
37,2 |
28,6, 48,3 |
|
Åldersgrupp ≥75 år |
15/23 |
65,2 % |
42,2 |
19,2, 92,7 |
Pediatrisk population
I en fas 2-studie på friska indiska småbarn i åldern ≥ 1 år till < 3 år vaccinerades 24 barn med 0,25 ml IXIARO (den licensierade dosen för denna åldersgrupp) och 24 barn fick vuxendosen 0,5 ml. Data är begränsade men det fanns inga skillnader i säkerhetsprofilen mellan dosen på 0,25 ml respektive 0,5 ml i denna åldersgrupp.
Immunogenicitet och säkerhet för IXIARO hos barn och ungdomar från ett JEV-endemiskt land
Säkerheten och immunogeniciteten för IXIARO utvärderades i en randomiserad, kontrollerad, öppen klinisk prövning som utfördes i Filippinerna, där JEV är endemiskt. Säkerhetsprofilen för IXIARO jämfördes med kontrollvaccinerna Havrix (hepatit A-vaccin, pediatrisk formulering 720 EL.E./0,5 ml) och Prevenar (7-valent pneumokockkonjugatvaccin [difteri CRM197-protein]).
Utvärderingen av immunogenicitet utfördes i en delgrupp av studiepopulationen och innefattade bestämningen av serokonversionsgraden (seroconversion rate, SCR), definierad som JEV-neutraliserande antikroppstiter ≥ 1:10, andelen patienter som uppnådde en minst fyrfaldig ökning av antikroppstitrar och den geometriska genomsnittliga titern (geometric mean titer, GMT) vid dag 56 och månad 7, per dos och per åldersgrupp. Immunsvaren som framkallas av IXIARO presenteras i tabell 10.
|
Vaccindos |
0,25 ml |
0,5 ml |
|||
|
Åldersgrupp |
2 månader– < 6 månader |
6 månader– < 12 månader |
1 år– < 3 år |
3 år– < 12 år |
12 år– < 18 år |
|
Serokonversionsgrader % (n/N) |
|||||
|
Före vaccination |
30 % (3/10) |
0 % (0/20) |
3,2% (4/125) |
16,8% (17/101) |
45,7 % (64/140) |
|
Dag 56 |
100 % (9/9) |
100% (19/19) |
99,2 % (119/120) |
100,0 % (100/100) |
100 % (137/137) |
|
Månad 7 |
100 % (10/10) |
100% (18/18) |
85,5 % (106/124) |
91,0 % (91/100) |
97,1 % (133/137) |
|
Andel patienter som uppnår en ≥ 4-faldig ökning av JEV-antikroppstitrar % (n/N) |
|||||
|
Dag 56 |
100 (9/9) |
94,7 (18/19) |
96,7 (116/120) |
94,0 (94/100) |
77,4 (106/137) |
|
Månad 7 |
90,0 (9/10) |
83,3 (15/18) |
75,8 (94/124) |
71,0 (71/100) |
65,0 (89/137) |
|
Geometrisk genomsnittlig titer (N) |
|||||
|
Före vaccination |
8,42 (10) |
51 (20) |
5,52 (124) |
6,54 (101) |
13,08 (140) |
|
Dag 56 |
687,35 (9) |
377,79 (19) |
258,90 (121) |
213,67 (100) |
175,63 (137) |
|
Månad 7 |
159,27 (10) |
64,00 (18) |
38,91 (125) |
43,60 (100) |
86,61 (137) |
1Negativa titrar före vaccination imputerades till 5.
Säkerhet och tolerabilitet utvärderades i hela studiepopulationen. Föräldrar eller patienter registrerade biverkningar på ett dagbokskort för de första sju dagarna efter varje vaccination. Föräldrar eller patienter fick frågor om eventuella oönskade biverkningar dagen efter den andra vaccinationen och vid personliga besök inklusive vid en medicinsk undersökning 28 dagar (dag 56) och 6 månader (månad 7) efter den andra dosen. Säkerhetsprofilen för IXIARO var jämförbar med den för Havrix eller Prevenar.
Varaktighet av antikroppsskydd och boosterdos hos barn och ungdomar från ett JEV-endemiskt land
Varaktigheten av JEV-neutraliserande antikroppar efter den primära immuniseringen samt säkerhet och immunogenicitet för en IXIARO boosterdos 12 månader efter den primära immuniseringen utvärderades i en randomiserad, kontrollerad, öppen klinisk studie som genomfördes i Filippinerna där JEV är endemiskt (300 barn, medelålder 5,3 år, intervall 1,2 - 17,3 år). 150 barn följdes upp under tre år utan booster, ytterligare 150 barn fick booster efter 1 år (0,25 ml om barnen var <3 år vid tiden för boostern, 0,5 ml om barnen var 3 år eller äldre) och följdes upp under ytterligare två år. Seroprotektionsfrekvensen (SPR) definierad som neutraliserande antikroppstiter ≥1:10 och geometrisk genomsnittlig titer (GMT) visas i tabell 11. Boosterdosen ledde till en markant ökning av GMT och seroprotektionsfrekvensen förblev kvar på 100 % två år efter boostern.
|
|
Utan Booster
|
Boosterdos 12 månader efter primär immunisering
|
|
|
Tidpunkt efter grundimmunisering |
|
0,25 mL Boosterdos N=81 |
0,5 mL Boosterdos N=67 |
|
Seroprotektionsfrekvens % (n/N) |
|||
|
Månad 12 |
89,9 (134/149) |
97,5 (79/81) |
89,6 (60/67) |
|
Månad 13 |
n.a. |
100 (81/81) |
100,0 (67/67) |
|
Månad 24 |
89,0 (130/146) |
100 (80/80) |
100,0 (67/67) |
|
Månad 36 |
90,1 (128/142) |
100,0 (76/76) |
100,0 (67/67) |
|
Geometrisk genomsnittlig titer |
|||
|
Månad 12 |
46 |
67 |
40 |
|
Månad 13 |
n.a. |
2911 |
1366 |
|
Månad 24 |
50 |
572 |
302 |
|
Månad 36 |
59 |
427 |
280 |
n.a. = ej tillgänglig
Immunogenicitet och säkerhet för barn och ungdomar från icke-endemiska länder
Säkerheten och immunogeniciteten för IXIARO utvärderades i en, okontrollerad, öppen klinisk prövning som utfördes i USA, Europa och Australien på friska manliga och kvinnliga försökspersoner som hade planerat att resa till områden med endemisk JEV.
Barn och ungdomar i åldern ≥ 3 till < 18 år fick två vaccindoser på 0,5 ml och barn i åldern ≥ 2 månader till < 3 år fick två vaccindoser på 0,25 ml på dag 0 och dag 28 med intramuskulär injektion. Immunogenicitetsdata utvärderades hos 64 försökspersoner. Värdena för SCR och GMT visas i tabell 12.
|
|
IXIARO-dos |
Tidpunkt |
SCR n / N |
GMT |
95 % KI |
|
Åldersgrupp ≥ 2 månader till < 3 år |
0,25 ml |
Dag 56 |
100 % 5/5 |
216,2 |
106,0; 441,0 |
|
|
|
Månad 7 |
100 % 2/2 |
48,0 |
0,0; 3214485,7 |
|
Åldersgrupp ≥ 3 till < 18 år |
0,5 ml |
Dag 56 |
100 % 57/57 |
340,7 |
269,8; 430,3 |
|
|
|
Månad 7 |
90,6 % 29/32 |
57,1 |
38,4; 84,9 |
Varaktighet av antikroppsskydd hos barn och ungdomar från icke-endemiska länder
Varaktigheten av antikropsskyddet utvärderades under tre år efter primär vaccinering med IXIARO i en okontrollerad, öppen uppföljande klinisk studie som genomfördes i USA, Europa och Australien. Långvariga immunogenicitetsdata utvärderades hos 23 barn, medelåldern var 14,3 år, intervall 3 - 18 år. SPR och GMT visas i tabell 13.
|
|
Seroprotektionsfrekvens (Frekvens av försökspersoner med PRNT50≥1:10) % (n/N) |
Geometrisk genomsnittlig titer (plackreduktionsneutraliseringstest) GMT [95%CI] |
||
|
|
Efter 0,25 ml dos Primär immunisering |
Efter 0,5 ml dos Primär immunisering |
Efter 0,25 ml dos Primär immunisering |
Efter 0,5 ml dos Primär immunisering |
|
Månad 12 |
0 % (0/0) |
89,5 % (17/19) |
- |
48 [28; 80] |
|
Månad 24 |
100 % (1/1) |
90,9 % (20/22) |
193 [n.a.] |
75 [46; 124] |
|
Månad 36 |
100 % (1/1) |
88,9 % (16/18) |
136 [n.a.] |
61 [35; 106] |
n.a. 95 % Konfidensintervall kunde inte fastställas (data från enstaka försökspersoner)
Farmakokinetik
Inte tillämpligt
Prekliniska uppgifter
Icke-kliniska toxicitetsdata är begränsade.
I en reproduktions- och pre-/postnatal toxicitetsstudie kunde inga vaccinrelaterade effekter påvisas på reproduktion, fostervikt, överlevnad och utveckling hos avkomman. Emellertid påvisades ofullständig benbildning i vissa delar av skelettet hos gruppen som fick 2 doser, men inte hos gruppen som fick 3 doser. Det är för närvarande svårt att veta om detta fenomen är behandlingsrelaterat eller inte.
Innehåll
Kvalitativ och kvantitativ sammansättning
1 dos (0,5 ml) av IXIARO innehåller
japanskt encefalitvirus stam SA14-14-2 (inaktiverat)1,2 6 AE3
som motsvarar en styrka på ≤ 460 ng ED50
1 framställt ur vero-celler
2 adsorberat på hydratiserad aluminiumhydroxid (cirka 0,25 milligram Al3+)
3 antigenenheter
Hjälpämnen med känd effekt:
Detta läkemedel innehåller kalium, mindre än 1 mmol (39 mg) per 0,5 ml enkeldos, det vill säga huvudsakligen ”kaliumfri” och, mindre än 1mmol natrium (23 mg) per 0,5 ml enkeldos, det vill säga huvudsakligen ”natriumfri”. Denna produkt kan innehålla spår av rester från natriummetabisulfit i mängder under detektionsgränsen.
Fosfatbuffrad saltlösning 0,0067 M (i PO4) har följande saltlösningssammansättning:
NaCl – 9 mg/ml
KH2PO4 – 0,144 mg/ml
Na2HPO4 – 0,795 mg/ml
Fullständig förteckning över hjälpämnen:
Fosfatbuffrad saltlösning som innehåller
natriumklorid,
kaliumdivätefosfat,
dinatriumvätefosfat,
vatten för injektionsvätskor.
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C–8°C).
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Särskilda anvisningar för destruktion
Den förfyllda sprutan är endast avsedd för engångsbruk och får inte användas till mer än en person. Den förfyllda sprutan är klar för användning. Om det inte medföljer någon nål, ska en steril nål användas.
Använd inte om blisterfolien eller förpackningen har skadats.
Vid förvaring kan det förekomma en fin vit fällning och en klar färglös supernatant.
Skaka sprutan väl före administrering för att erhålla en vit, ogenomskinlig, homogen suspension.
Kassera vaccinet om det innehåller partiklar efter skakning eller om det ser missfärgat ut eller om sprutan ser ut att vara skadad.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Information om administreringen av en dos på 0,5 ml av IXIARO för personer som är 3 år och äldre
Följ nedanstående steg för att administrera hela dosen på 0,5 ml:
-
Skaka sprutan för att erhålla en homogen suspension.
-
Avlägsna skyddshättan från sprutspetsen genom att vrida den försiktigt. Undvik att bryta eller dra av spetsen eftersom det kan skada sprutan.
-
Fäst en nål vid den förfyllda sprutan.
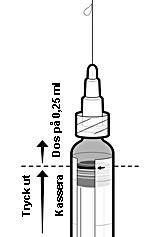
Information om beredningen av en dos på 0,25 ml av IXIARO för användning till barn under 3 år
Följ nedanstående steg för att administrera en dos på 0,25 ml till barn i åldern 2 månader till < 3 år:
-
Skaka sprutan för att erhålla en homogen suspension.
-
Avlägsna skyddshättan från sprutspetsen genom att vrida den försiktigt. Undvik att bryta eller dra av spetsen eftersom det kan skada sprutan.
-
Fäst en nål vid den förfyllda sprutan.
-
Håll sprutan upprätt.
-
Tryck upp kolvproppen till kanten på den röda linjen på sprutkammaren, angiven med en röd pil (se figur 1)*, för att kassera överskott på vaccin.
-
Fäst en ny steril nål innan resten av vaccinet injiceras.
*Om du tryckte upp kolvproppen förbi den röda linjen finns det ingen garanti för att en dos på 0,25 ml återstår och en ny spruta ska användas.
Figur 1: Beredning för administrering av en dos på 0,25 ml
Förpackningsinformation
Injektionsvätska, suspension 6 mikrog
Klar vätska med en vit fällning.
1 styck förfylld spruta (fri prissättning), EF
1 styck förfylld spruta (fri prissättning), tillhandahålls ej
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, suspension 6 mikrog




