Indikationer
Xeplion är indicerat för underhållsbehandling av schizofreni hos vuxna patienter som har stabiliserats med paliperidon eller risperidon.
Hos ett urval av patienter med schizofreni och som tidigare svarat på oralt paliperidon eller risperidon kan Xeplion användas utan föregående stabilisering med oral behandling, om de psykotiska symtomen är lindriga till måttliga och en långverkande injektion behövs.
Kontraindikationer
Överkänslighet mot den aktiva substansen, mot risperidon eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Rekommenderad startdos av Xeplion är 150 mg på behandlingsdag 1 och 100 mg en vecka senare (dag 8), där båda doserna administreras i deltamuskeln för att terapeutiska koncentrationer snabbt ska kunna uppnås (se avsnitt Farmakokinetik). Den tredje dosen bör administreras en månad efter den andra startdosen. Rekommenderad månatlig underhållsdos är 75 mg. Vissa patienter kan behöva lägre eller högre doser inom det rekommenderade dosintervallet på 25 till 150 mg. Det avgörs av den enskilde patientens tolerabilitets- och/eller effektprofil. Patienter med övervikt eller fetma kan behöva doser i övre delen av intervallet (se avsnitt Farmakokinetik). Efter den andra startdosen kan månatliga underhållsdoser administreras antingen i deltamuskeln eller i gluteusmuskeln.
Justering av underhållsdosen kan göras månatligen. När dosjusteringar görs ska Xeplions depotegenskaper beaktas (se avsnitt Farmakokinetik), eftersom den fullständiga effekten av underhållsdoserna kanske inte uppträder förrän efter flera månader.
Byte från oral depotberedning av paliperidon eller oralt risperidon till Xeplion
Xeplion ska sättas in på det sätt som beskrivs i början av avsnitt ovan. Vid månatlig underhållsbehandling med Xeplion kan patienter som tidigare stabiliserats med olika doser av depottabletter av paliperidon nå liknande steady-state-exponering av paliperidon genom injektion. De underhållsdoser av Xeplion som behövs för att nå liknande steady-state-exponering visas här:
|
Doser av depottabletter av paliperidon och Xeplion som behövs för att nå liknande paliperidonexponering vid steady-state vid underhållsbehandling |
|
|
Tidigare dos av depottablett av paliperidon |
Xeplion-injektion |
|
3 mg om dagen |
25–50 mg varje månad |
|
6 mg om dagen |
75 mg varje månad |
|
9 mg om dagen |
100 mg varje månad |
|
12 mg om dagen |
150 mg varje månad |
Tidigare oralt paliperidon eller oralt risperidon kan sättas ut samtidigt som behandlingen med Xeplion sätts in. Hos vissa patienter kan en gradvis utsättning vara fördelaktig. Hos vissa patienter kan ett byte från högre orala paliperidondoser (t.ex. 9–12 mg om dagen) till gluteusmuskelinjektioner med Xeplion ge en lägre plasmaexponering under de första 6 månaderna efter bytet. Därför kan injektion i deltamuskeln övervägas som ett alternativ under de första 6 månaderna.
Byte från långtidsverkande risperidoninjektion till Xeplion
När patienterna ska byta från långtidsverkande risperidoninjektion administreras istället den inledande Xeplion -dosen vid tidpunkten för nästa inplanerade injektion. Xeplion ska sedan administreras en gång per månad. Insättningsdosregimen för den första veckan, innefattande de intramuskulära injektionerna (dag 1 respektive dag 8) som beskrevs i avsnitt ovan, behövs inte.
Patienter som tidigare stabiliserats med olika doser av långtidsverkande risperidoninjektioner kan nå liknande steady-state-exponering för paliperidon vid underhållsbehandling med månatliga doser av Xeplion i enlighet med följande:
|
Doser av långtidsverkande risperidoninjektioner och Xeplion som krävs för att nå liknande paliperidonexponering vid steady-state |
|
|
Tidigare dos av långtidsverkande risperidoninjektion |
Xeplion -injektion |
|
25 mg varannan vecka |
50 mg varje månad |
|
37,5 mg varannan vecka |
75 mg varje månad |
|
50 mg varannan vecka |
100 mg varje månad |
Utsättning av antipsykotiska läkemedel ska göras i enlighet med lämplig produktinformation. Om Xeplion sätts ut måste dess depotegenskaper beaktas. Behovet av fortsatt läkemedelsbehandling av befintliga extrapyramidala symtom (EPS) bör utvärderas regelbundet.
Missade doser
Undvika missade doser
Det rekommenderas att den andra insättningsdosen av Xeplion ges en vecka efter den första dosen. För att undvika att en dos missas kan patienterna få den andra dosen 4 dagar före eller efter den dag (dag 8) då den skulle ha administrerats. På samma sätt rekommenderas att den tredje injektionen och efterföljande injektioner efter insättningsregimen administreras en gång per månad. För att undvika att en månatlig dos missas kan patienterna få injektionen upp till 7 dagar före eller efter den dag i månaden då dosen den egentligen skulle ha administrerats.
Om det planerade datumet för den andra Xeplion -injektionen (dag 8 ± 4 dagar) missas, beror den rekommenderade nya behandlingsinledningen på hur lång tid som har gått sedan patienten fick den första injektionen.
Missad andra insättningsdos (< 4 veckor efter den första injektionen)
Om mindre än 4 veckor har gått sedan den första injektionen ska patienten få den andra injektionen på 100 mg i deltamuskeln så snart som möjligt. En tredje Xeplion -injektion på 75 mg i antingen delta- eller gluteusmuskeln ska administreras 5 veckor efter den första injektionen (oavsett tidpunkten för den andra injektionen). Därefter följer den normala cykeln med injektioner en gång per månad av 25 mg till 150 mg i antingen delta- eller gluteusmuskeln, beroende på den enskilde patientens tolerabilitets- och/eller effektprofil.
Missad andra insättningsdos (4-7 veckor efter den första injektionen)
Om det har gått 4 till 7 veckor sedan den första injektionen av Xeplion ska doseringen återupptas med två injektioner om 100 mg på följande sätt:
-
en injektion i deltamuskeln så snart som möjligt
-
en andra injektion i deltamuskeln en vecka senare
-
därefter återupptas den normala cykeln med injektioner en gång per månad av 25 mg till 150 mg i antingen delta- eller gluteusmuskeln, beroende på den enskilde patientens tolerabilitets- och/eller effektprofil.
Missad andra insättningsdos (> 7 veckor efter den första injektionen)
Om det har gått mer än 7 veckor sedan den första injektionen av Xeplion , ska doseringen inledas på samma sätt som beskrivs för den rekommenderade insättningen av Xeplion ovan.
Missad månatlig underhållsdos (1 månad till 6 veckor)
Efter insättningen rekommenderas en månatlig injektionscykel för Xeplion . Om mindre än 6 veckor har gått sedan den sista injektionen ska den tidigare stabiliserade dosen administreras så snart som möjligt och sedan följas av injektioner en gång per månad.
Missad månatlig underhållsdos (> 6 veckor till 6 månader)
Om mer än 6 veckor har gått sedan den sista injektionen av Xeplion rekommenderas följande:
För patienter som är stabiliserade med doser på 25 till 100 mg:
-
en injektion i deltamuskeln så snart som möjligt med samma dos som patienten tidigare var stabiliserad på
-
en andra injektion i deltamuskeln (samma dos) en vecka senare (dag 8)
-
därefter återupptas den normala cykeln med injektioner en gång per månad av 25 mg till 150 mg i antingen delta- eller gluteusmuskeln, beroende på den enskilde patientens tolerabilitets- och/eller effektprofil.
För patienter som är stabiliserade med 150 mg:
-
en injektion i deltamuskeln så snart som möjligt med en dos på 100 mg
-
en andra injektion i deltamuskeln en vecka senare (dag 8) med en dos på 100 mg
-
därefter återupptas den normala cykeln med injektioner en gång per månad av 25 mg till 150 mg i antingen delta- eller gluteusmuskeln, beroende på den enskilde patientens tolerabilitets- och/eller effektprofil.
Missad månatlig underhållsdos (> 6 månader). Om det har gått mer än 6 månader sedan den sista injektionen av Xeplion , ska doseringen inledas på samma sätt som beskrivs för den rekommenderade insättningen av Xeplion ovan.
Särskilda populationer
Äldre
Effekt och säkerhet hos patienter som är äldre än 65 år har inte fastställts.
Dosrekommendationerna av Xeplion är i allmänhet desamma för äldre patienter med normal njurfunktion som för yngre vuxna patienter med normal njurfunktion. Eftersom äldre patienter kan ha försämrad njurfunktion, kan dock dosjusteringar krävas (se Nedsatt njurfunktion nedan för dosrekommendationer för patienter med nedsatt njurfunktion).
Nedsatt njurfunktion
Xeplion har inte studerats systematiskt hos patienter med nedsatt njurfunktion (se avsnitt Farmakokinetik). För patienter med lätt nedsatt njurfunktion (kreatininclearance ≥ 50 till < 80 ml/min) rekommenderas insättning av Xeplion med en dos på 100 mg på behandlingsdag 1 och sedan 75 mg en vecka senare. Båda doserna ska administreras i deltamuskeln. Den rekommenderade månatliga underhållsdosen är 50 mg med ett intervall på 25 till 100 mg beroende på patientens tolerabilitets- och/eller effektprofil.
Xeplion rekommenderas inte för patienter med måttligt eller gravt nedsatt njurfunktion (kreatininclearance < 50 ml/min) (se avsnitt Varningar och försiktighet).
Nedsatt leverfunktion
Utifrån erfarenheterna med oralt paliperidon krävs inga dosjusteringar för patienter med lindrigt eller måttligt nedsatt leverfunktion. Eftersom paliperidon inte har studerats för patienter med gravt nedsatt leverfunktion rekommenderas försiktighet för sådana patienter (se avsnitt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt för Xeplion hos barn och ungdomar < 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Xeplion är endast avsett för intramuskulär administrering. Det får inte administreras på något annat sätt. Det ska injiceras långsamt, djupt in i deltamuskeln eller gluteusmuskeln. Varje injektion ska administreras av sjukvårdspersonal. Administreringen ska göras med en enda injektion. Dosen ska inte ges i delade injektioner.
Insättningsdoserna på dag 1 och dag 8 måste administreras i deltamuskeln för att terapeutiska koncentrationer snabbt ska kunna uppnås (se avsnitt Farmakokinetik). Efter den andra startdosen kan månatliga underhållsdoser administreras antingen i deltamuskeln eller i gluteusmuskeln. I händelse av smärta vid injektionsstället ska byte från gluteus- till deltainjektioner (och vice versa) övervägas om detta obehag blir stort för patienten (se avsnitt Biverkningar). Det rekommenderas också att injektionerna alternerande ges i vänster och höger sida (se nedan).
För bruksanvisning och hantering av Xeplion, se bipacksedel (information avsedd för hälso- och sjukvårdspersonal).
Administrering i deltamuskeln
Rekommenderad nålstorlek för insättnings- och underhållsadministrering av Xeplion i deltamuskeln avgörs av patientens vikt. För patienter ≥ 90 kg, rekommenderas en 1½ tum, 22 gauge nål (38,1 mm x 0,72 mm). För patienter < 90 kg, rekommenderas en 1 tum, 23 gauge nål (25,4 mm x 0,64 mm). Deltamuskelinjektioner ska alterneras mellan de två deltamusklerna.
Administrering i gluteusmuskeln
Rekommenderad nålstorlek för underhållsadministrering av Xeplion i gluteusmuskeln är 1½ tum, 22 gauge (38,1 mm x 0,72 mm). Administrering ska göras i den övre, yttre kvadranten av gluteusområdet. Gluteusmuskelinjektioner ska alterneras mellan de två gluteusmusklerna.
Varningar och försiktighet
Användning hos patienter som är akut agiterade eller i ett svårt psykotiskt tillstånd
Xeplion ska inte användas för att behandla patienter som är akut agiterade eller i ett svårt psykotiskt tillstånd när omedelbar symtomkontroll krävs.
QT-intervall
Försiktighet ska iakttas när paliperidon förskrivs till patienter med känd kardiovaskulär sjukdom eller en familjehistoria av QT-förlängning, och detta gäller också vid samtidig användning av andra läkemedel som anses förlänga QT-intervallet.
Malignt neuroleptikasyndrom
Malignt neuroleptikasyndrom, som utmärks av hypertermi, muskelstelhet, autonom instabilitet, förändrad medvetandegrad och förhöjda serumnivåer av kreatinfosfokinas, har rapporterats uppträda vid behandling med paliperidon. Ytterligare kliniska tecken kan vara myoglobinuri (rabdomyolys) och akut njursvikt. Om en patient utvecklar tecken eller symtom som tyder på malignt neuroleptikasyndrom ska paliperidon sättas ut.
Tardiv dyskinesi/extrapyramidala symtom
Läkemedel med dopaminreceptorantagonistiska egenskaper har associerats med induktion av tardiv dyskinesi. Detta tillstånd karakteriseras av rytmiska, ofrivilliga rörelser som främst drabbar tungan och/eller ansiktet. Om tecken och symtom på tardiv dyskinesi uppträder ska utsättning av alla antipsykotiska läkemedel, inklusive paliperidon, övervägas.
Försiktighet bör iakttas hos patienter som får både psykostimulantia (t.ex. metylfenidat) och paliperidon samtidigt eftersom extrapyramidala symtom kan uppstå när ett eller båda läkemedlen justeras. Behandling med stimulantia bör sättas ut gradvis (se avsnitt Interaktioner).
Leukopeni, neutropeni och agranulocytos
Fall av leukopeni, neutropeni och agranulocytos har rapporterats vid användning av Xeplion. Agranolucytos har rapporterats mycket sällsynt (<1/10 000 patienter) under uppföljning efter marknadsföringsgodkännandet. Patienter med en historia av kliniskt signifikant låg nivå av vita blodkroppar eller läkemedelsinducerad leukopeni/neutropeni ska övervakas under de första månaderna av behandling. Utsättning av Xeplion ska övervägas vid första tecknet på en klinisk signifikant minskning av antal vita blodkroppar i frånvaro av andra orsakande faktorer. Patienter med klinisk signifikant neutropeni ska noggrant övervakas med avseende på feber eller andra symtom eller tecken på infektion, och ska genast behandlas om sådana symtom eller tecken uppstår. Patienter med svår neutropeni (absolut neutrofilantal
< 1 x 109/l) ska avsluta behandlingen med Xeplion och nivåerna av vita blodkroppar ska följas tills de är återställda.
Överkänslighetsreaktioner
Anafylaktiska reaktioner hos patienter som tidigare tolererat oralt risperidon eller oralt paliperidon har i sällsynta fall rapporterats efter marknadsintroduktionen (se avsnitt Indikationer och Biverkningar).
Om överkänslighetesreaktioner uppstår, avbryt användningen av Xeplion ; sätt in allmän understödjande behandling efter kliniskt behov och övervaka patienten tills tecken och symtom försvinner (se avsnitt Kontraindikationer och Biverkningar).
Hyperglykemi och diabetes mellitus
Hyperglykemi, diabetes mellitus och försämring av befintlig diabetes, inklusive diabeteskoma och ketoacidos, har rapporterats under behandling med paliperidon. Adekvat klinisk övervakning rekommenderas i enlighet med de behandlingsriktlinjer för antipsykotiska läkemedel som används. Patienter som behandlas med Xeplion ska övervakas med avseende på symtom på hyperglykemi (såsom polydipsi, polyuri, polyfagi och svaghet) och patienter med diabets mellitus ska kontrolleras regelbundet med avseende på försämrad glukoskontroll.
Viktökning
Signifikant viktuppgång har rapporterats vid användning av Xeplion . Vikten ska kontrolleras regelbundet.
Användning hos patienter med prolaktinberoende tumörer
Studier av vävnadsodlingar tyder på att celltillväxt i humana brösttumörer kan stimuleras av prolaktin. Även om ingen tydlig association till administrering av antipsykotiska läkemedel ännu kunnat påvisas i kliniska och epidemiologiska studier, rekommenderas försiktighet till patienter med relevant sjukdomshistoria. Paliperidon ska användas med försiktighet till patienter med befintliga tumörer som kan vara prolaktinberoende.
Ortostatisk hypotoni
Paliperidon kan utlösa ortostatisk hypotoni hos vissa patienter, beroende på läkemedlets alfablockerande aktivitet.
Baserat på poolade data från tre placebokontrollerade, 6 veckor långa prövningar av orala depottabletter av paliperidon med fast dos (3, 6, 9 och 12 mg), har ortostatisk hypotoni rapporterats av 2,5 % av patienterna som behandlades med oral paliperidon, jämfört med 0,8 % av patienterna som behandlades med placebo. Xeplion ska användas med försiktighet till patienter med känd kardiovaskulär sjukdom (t.ex. hjärtsvikt, myokardinfarkt eller -ischemi, överledningsrubbningar), cerebrovaskulär sjukdom eller tillstånd som predisponerar för hypotoni (t.ex. dehydrering och hypovolemi).
Kramper
Xeplion ska användas med försiktighet till patienter med en sjukdomshistoria av kramper eller andra tillstånd som kan sänka kramptröskeln.
Nedsatt njurfunktion
Plasmakoncentrationerna av paliperidon är förhöjda hos patienter med nedsatt njurfunktion och därför rekommenderas dosjusteringar för patienter med lindrigt nedsatt njurfunktion. Xeplion rekommenderas inte för patienter med måttligt eller gravt nedsatt njurfunktion (kreatininclearance < 50 ml/min) (se avsnitt Dosering och Farmakokinetik).
Nedsatt leverfunktion
Det finns inga data tillgängliga för patienter med gravt nedsatt leverfunktion (Child-Pugh grad C). Försiktighet rekommenderas om paliperidon ges till sådana patienter.
Äldre patienter med demens
Xeplion har inte studerats på äldre patienter med demens. Xeplion ska användas med försiktighet till äldre patienter med demens med riskfaktorer for stroke.
Den erfarenhet som nämns nedan för risperidon anses gälla även för paliperidon.
Totalmortalitet
I en metaanalys av 17 kontrollerade kliniska prövningar framkom att äldre patienter med demens som behandlades med andra atypiska antipsykotiska läkemedel, inklusive risperidon, aripiprazol, olanzapin och quetiapin, hade ökad mortalitetsrisk jämfört med placebobehandlade patienter. Bland dem som behandlades med risperidon var mortaliteten 4 % jämfört med 3,1 % för placebo.
Cerebrovaskulära biverkningar
En omkring 3 gånger så stor risk för cerebrovaskulära biverkningar har observerats i randomiserade, placebokontrollerade kliniska prövningar med dementa patienter som behandlas med vissa atypiska antipsykotiska läkemedel, inklusive risperidon, aripiprazol och olanzapin. Mekanismen bakom denna ökade risk är inte känd.
Parkinsons sjukdom och Lewykroppsdemens
Läkare ska väga riskerna mot nyttan vid förskrivning av Xeplion till patienter med Parkinsons sjukdom eller Lewykroppsdemens, eftersom båda patientgrupperna kan ha såväl ökad risk att drabbas av malignt neuroleptikasyndrom som ökad känslighet för antipsykotiska läkemedel. Denna ökade känslighet kan, utöver extrapyramidala symtom, också ta sig uttryck i förvirring, medvetandesänkning och postural instabilitet med frekventa fall.
Priapism
Antipsykotiska läkemedel med alfaadrenerga blockerande effekter (inklusive risperidon) har rapporterats inducera priapism. Efter marknadsintroduktionen har priapism även rapporterats för oralt paliperidon, den aktiva metaboliten av risperidon. Patienter ska upplysas om att uppsöka akutsjukvård i de fall då priapism inte upphört inom 4 timmar.
Reglering av kroppstemperatur
Rubbningar av kroppens förmåga att sänka kroppstemperaturen har associerats med antipsykotiska läkemedel. Tillbörlig försiktighet förordas när Xeplion förskrivs till patienter som kommer att hamna i situationer som kan bidra till en höjning av kroppstemperaturen, t.ex. krävande fysisk träning, exponering för extrem hetta, samtidig medicinering med preparat med antikolinerg effekt eller dehydrering.
Venös tromboembolism
Fall av venös tromboembolism (VTE) har rapporterats vid användning av antipsykotiska läkemedel. Eftersom patienter som behandlas med antipsykotiska läkemedel ofta uppvisar förvärvade riskfaktorer för venös tromboembolism bör samtliga möjliga riskfaktorer för VTE identifieras före och under behandling med Xeplion och förebyggande åtgärder sättas in.
Antiemetisk effekt
En antiemetisk effekt har observerats i prekliniska studier med paliperidon. Denna effekt kan, om den uppträder hos människor, maskera tecken och symtom på överdosering av vissa läkemedel eller på tillstånd som tarmobstruktion, Reyes syndrom och hjärntumör.
Administrering
Försiktighet måste iakttas för att undvika oavsiktlig injektion av Xeplion i ett blodkärl.
Intraoperative Floppy Iris Syndrome
Intraoperative Floppy Iris Syndrome (IFIS) har observerats under kataraktkirurgi hos patienter som behandlats med läkemedel som har alfa-1a-adrenerg blockerande effekt, t.ex. Xeplion (se avsnitt Biverkningar).
IFIS kan öka risken för ögonkomplikationer under och efter operationen. Före operation måste ögonkirurgen informeras om pågående eller tidigare bruk av läkemedel med alfa-1a-adrenerg blockerande effekt. Den potentiella fördelen med att avbryta den alfa-1-blockerande terapin före kataraktkirurgi har inte fastställts och måste vägas mot risken att avbryta antipsykosbehandlingen.
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Försiktighet förordas vid förskrivning av Xeplion tillsammans med läkemedel som man vet förlänger QT-intervallet, t.ex. antiarytmika klass IA (t.ex. kinidin, disopyramid), antiarytmika klass III (t.ex. amiodaron, sotalol), vissa antihistaminer, vissa andra antipsykotiska läkemedel och vissa malariamedel (t.ex. meflokin). Denna lista är endast indikativ och inte heltäckande.
Potential hos Xeplion att påverka andra läkemedel
Paliperidon förväntas inte ge upphov till några kliniskt betydelsefulla farmakokinetiska interaktioner med läkemedel som metaboliseras av cytokrom P450-isoenzymer.
Mot bakgrund av de primära CNS-effekterna hos paliperidon (se avsnitt Biverkningar), ska Xeplion användas med försiktighet då det ges i kombination med andra centralt verkande läkemedel, t.ex. anxiolytika, de flesta antipsykotika, sömnmedel, opiater, etc. eller alkohol.
Paliperidon kan motverka effekten av levodopa och andra dopaminagonister. Om denna kombination bedöms som nödvändig, i synnerhet i slutskedet av Parkinsons sjukdom, ska var och en av behandlingarna förskrivas i lägsta effektiva dos.
På grund av läkemedlets potential att inducera ortostatisk hypotoni (se avsnitt Varningar och försiktighet), kan en additiv effekt observeras när Xeplion administreras tillsammans med andra terapeutiska medel som har sådan potential t.ex. andra antipsykotika samt tricykliska antidepressiva läkemedel.
Försiktighet rekommenderas om paliperidon används i kombination med andra läkemedel som är kända att sänka kramptröskeln (t.ex. fenotiaziner eller butyrofenoner, tricykliska antidepressiva eller SSRI, tramadol, meflokin, etc.).
Samadministrering av orala depottabletter av paliperidon vid steady-state (12 mg en gång dagligen) med depottabletter av natriumvalproat (500 mg till 2 000 mg en gång dagligen) påverkade inte de farmakokinetiska egenskaperna hos valproat.
Inga interaktionsstudier har utförts för Xeplion och litium, men en farmakokinetisk interaktion är inte trolig.
Potential hos andra läkemedel att påverka Xeplion
Studier in vitro tyder på att CYP2D6 och CYP3A4 i ytterst liten omfattning kan vara involverade i metabolismen av paliperidon, men det finns inga indikationer varken in vitro eller in vivo på att dessa isoenzymer spelar någon betydelsefull roll i paliperidons metabolism. Samtidig tillförsel av oralt paliperidon och paroxetin, en potent CYP2D6-hämmare, visade ingen kliniskt signifikant effekt på paliperidons farmakokinetik.
Samadministrering av en oral depotberedning av paliperidon en gång dagligen och karbamazepin 200 mg två gånger dagligen orsakade en minskning på ca 37 % av medelvärdet för Cmax och AUC av paliperidon vid steady-state. Denna minskning orsakas till största delen av en ökning på 35 % av paliperidons renala clearance, vilket troligen beror på att karbamazepin inducerar renalt P-gp. En obetydlig minskning av mängden aktiv substans som utsöndras oförändrad i urinen tyder på att effekten på paliperidons CYP-metabolism eller biotillgänglighet vid samtidig administrering av karbamazepin var liten. En större minskning av plasmakoncentrationen av paliperidon skulle kunna ses vid högre doser av karbamazepin. Vid insättning av karbamazepin ska dosen av Xeplion utvärderas och ökas vid behov. Det motsatta gäller vid utsättning av karbamazepin, då dosen av Xeplion ska utvärderas och sänkas vid behov.
Samadministrering av en engångsdos av en oral depottablett av paliperidon 12 mg med depottabletter av natriumvalproat (två 500 mg tabletter en gång dagligen) ledde till ca 50 % ökning av paliperidons Cmax och AUC. Detta beror troligen på ökad oral absorption. Eftersom ingen effekt på systemisk clearance observerades, förväntas inte någon signifikant interaktion mellan depottabletter av natriumvalproat och intramuskulära injektioner av Xeplion. Denna interaktion har inte studerats med Xeplion.
Samtidig användning av Xeplion och risperidon eller med oralt paliperidon
Eftersom paliperidon är den huvudsakliga aktiva metaboliten av risperidon ska försiktighet iakttas när Xeplion administreras samtidigt med risperidon eller med oralt paliperidon under längre perioder. Säkerhetsdata avseende samtidig användning av Xeplion med andra antipsykotika är begränsade.
Samtidig användning av Xeplion och psykostimulantia
Användning av psykostimulantia (t.ex. metylfenidat) i kombination med paliperidon kan leda till extrapyramidala symtom om den ena eller båda behandlingarna förändras (se avsnitt Varningar och försiktighet).
Graviditet
Graviditet
Adekvata data från behandling av gravida kvinnor med paliperidon saknas. Intramuskulärt injicerat paliperidonpalmitat och oralt administrerat paliperidon var inte teratogent i djurstudier, men andra typer av reproduktionstoxikologiska effekter har observerats (se avsnitt Prekliniska uppgifter). Nyfödda som har exponerats för paliperidon under graviditetens tredje trimester, löper risk att få biverkningar inklusive extrapyramidala symtom och/eller utsättningssymtom efter födseln vilka varierar i allvarlighetsgrad och varaktighet. Det finns rapporter på agitation, hypertension, hypotension, tremor, somnolens, andnöd eller ätproblem. Därför ska nyfödda följas noggrant. Xeplion ska användas under graviditet endast då det är absolut nödvändigt.
Amning
Paliperidon passerar över i bröstmjölk i sådan omfattning att effekter på det ammade spädbarnet är sannolika om terapeutiska doser ges till den ammande kvinnan. Xeplion ska inte användas under amning.
Fertilitet
Vid prekliniska studier observerades inga relevanta effekter.
Trafik
Paliperidon kan ha mindre eller måttlig effekt på förmågan att framföra fordon och använda maskiner beroende på potentiella effekter på nervsystemet och synen, såsom sedering, somnolens, synkope, dimsyn (se avsnitt Biverkningar). Patienter ska därför uppmanas att avstå från att framföra fordon eller använda maskiner tills deras individuella känslighet för Xeplion har fastställts.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligast rapporterade biverkningarna i kliniska prövningar var sömnlöshet, huvudvärk, ångest, övre luftvägsinfektion, reaktion vid administreringsstället, parkinsonism, viktökning, akatisi, agitation, sedation/somnolens, illamående, förstoppning, yrsel, muskuloskeletal smärta, takykardi, tremor, buksmärta, kräkningar, diarré, fatigue och dystoni. Av dessa föreföll akatisi och sedation/somnolens vara dosberoende.
Biverkningstabell
Här nedan följer samtliga biverkningar som rapporterats för paliperidon, sorterade på frekvenskategori uppskattad från kliniska prövningar med paliperidonpalmitat. Följande termer och frekvenser används: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Organsystemklass |
Biverkningar |
||||
|
Frekvens |
|||||
|
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
Ingen känd frekvensa |
|
|
Infektioner och infestationer |
|
övre luftvägs-infektion, urinvägs-infektion, influensa |
lunginflammation, bronkit, luftvägsinfektion, sinusit, cystit, öroninfektion, tonsillit, onykomykos, cellvävs-inflammation, subkutan abscess |
ögoninfektion, akarodermatit |
|
|
Blodet och lymfsystemet |
|
|
minskat antal vita blodkroppar, anemi |
neutropeni, trombocytopeni, förhöjt eosinofilantal |
agranulocytos |
|
Immunsystemet |
|
|
överkänslighet |
|
anafylaktisk reaktion |
|
Endokrina systemet |
|
hyper-prolaktinemib |
|
inadekvat utsöndring av antidiuretiskt hormon, glukos i urinen |
|
|
Metabolism och nutrition |
|
hyperglykemi, viktökning, viktminskning, minskad aptit |
diabetes mellitusd, hyperinsulinemi, ökad aptit, anorexi, förhöjda triglycerider i blodet, förhöjt blodkolesterol |
diabetisk ketoacidos, hypoglykemi, polydipsi |
vattenförgiftning |
|
Psykiatriska tillstånd |
sömnlöshete |
agitation, depression, ångest |
sömnstörning, mani, minskad libido, nervositet, mardrömmar |
katatoni, förvirring, somnambulism, känslomässig avtrubbning, anorgasmi |
sömnrelaterad ätstörning |
|
Centrala och perifera nervsystemet |
|
parkinsonismc, akatisic, sedation/
|
tardiv dyskinesi, synkope, psykomotorisk hyperaktivitet, postural yrsel, uppmärksamhets-störning, dysartri, dysgeusi, hypoestesi, parestesi |
malignt neuroleptika-syndrom, cerebral ischemi, avsaknad av respons på stimuli, medvetandeförlust, nedsatt medvetandegrad, konvulsionere, balansstörning, koordinations-svårigheter, huvudtremor |
diabeteskoma |
|
Ögon |
|
|
dimsyn, konjunktivit, torra ögon |
glaukom, ögonrörelse-störning, ögonrullningar, fotofobi, ökat tårflöde, okulär hyperemi |
floppy iris syndrome (intraoperative) |
|
Öron och balansorgan |
|
|
vertigo, tinnitus, öronsmärta |
|
|
|
Hjärtat |
|
takykardi |
atrioventrikulärt block, överledningsrubbningar, förlängt QT-intervall vid EKG, postural ortostatiskt takykardisyndrom, bradykardi, onormalt EKG, palpitationer |
förmaksflimmer, sinusarytmi |
|
|
Blodkärl |
|
hypertoni |
hypotoni, ortostatisk hypotoni |
lungemboli, venös trombos, flushing |
ischemi |
|
Andningsvägar, bröstkorg och mediastinum |
|
hosta, nästäppa |
dyspné, faryngolaryngeal smärta, epistaxis |
sömnapné-syndrom, lungstas, täppthet i luftvägarna, biljud, pipande och väsande andning |
hyperventilering, aspirations-pneumoni, dysfoni |
|
Magtarmkanalen |
|
buksmärta, kräkningar, illamående, förstoppning, diarré, dyspepsi, tandvärk |
bukobehag, gastroenterit, dysfagi, muntorrhet, flatulens |
pankreatit, tunntarms-obstruktion, svullen tunga, feces-inkontinens, fekalom, keilit |
ileus |
|
Lever och gallvägar |
|
transaminas-ökning |
gammaglutamyl-transferasökning, leverenzymökning |
|
gulsot |
|
Hud och subkutan vävnad |
|
|
urtikaria, pruritus, utslag, alopeci, eksem, torr hud, erytem, akne |
läkemedelsutslag, hyperkeratos, seborroisk dermatit, mjäll |
Stevens-Johnsons syndrom/toxisk epidermal nekrolys, angioödem, missfärgning av hud |
|
Muskuloskeletala systemet och bindväv |
|
muskuloskeletal smärta, ryggsmärta, artralgi |
ökat kreatin-fosfokinas i blod, muskelspasmer, ledstelhet, muskelsvaghet |
rabdomyolys, ledsvullnad |
onormal hållning |
|
Njurar och urinvägar |
|
|
urininkontinens, pollakisuri, dysuri |
urinretention |
|
|
Graviditet, puerperium och perinatalperiod |
|
|
|
|
neonatalt utsättnings-syndrom (se avsnitt Graviditet) |
|
Reproduktions-organ och bröstkörtel |
|
amenorré |
erektil dysfunktion, ejakulations-störning, menstruationsstörninge, gynekomasti, galaktorré, sexuell dysfunktion, bröstsmärta |
priapism, bröstobehag, mjölkstockning, bröstförstoring, vaginal flytning |
|
|
Allmänna symtom och/eller symtom vid administrerings-stället |
|
pyrexi, asteni, fatigue, reaktion vid injektionsstället |
ansiktsödem, ödeme, ökad kroppstemperatur, onormal gång, bröstkorgssmärta, obehag i bröstkorgen, sjukdomskänsla, induration |
hypotermi, frossa, törst, utsättnings-syndrom, abscess vid injektionsstället, cellulit vid injektionsstället, cysta vid injektionstället, hematom vid injektionsstället |
minskad kroppstemperatur, nekros vid injektionsstället, sår vid injektionsstället |
|
Skador, förgiftningar och behandlings-komplikationer |
|
|
fall |
|
|
|
a Frekvensen för biverkningar faller under kategorin ”ingen känd frekvens” eftersom de inte observerades i kliniska prövningar med paliperidonpalmitat. De härrörde antingen från spontanrapporter efter marknadsintroduktion och frekvensen kan därmed inte fastställas, eller så härrörde de från data från kliniska prövningar och/eller rapporter efter marknadsintroduktion med risperidon (oavsett beredning) eller oralt paliperidon. b Avser ”Hyperprolaktinemi”, se nedanför. c Avser ”Extrapyramidala symtom”, se nedanför. d I placebo-kontrollerade, pivotala kliniska prövningar rapporterades diabetes mellitus hos 0,32% av de Xeplion-behandlade individerna, jämfört med en andel på 0,39% i placebogruppen. Total incidens i alla kliniska prövningar var 0,65% för alla individer som behandlats med Xeplion. e Sömnlöshet innefattar: insomningssvårigheter, avbruten sömn. Krampanfall innefattar: Grand mal-kramp. Ödem innefattar: generaliserat ödem, perifert ödem, pittingödem. Menstruationsstörning innefattar: fördröjd menstruation, oregelbunden mens, oligomenorré. |
|||||
Biverkningar noterade för beredningar med risperidon.
Eftersom paliperidon är den aktiva metaboliten av risperidon är biverkningsprofilen för dessa läkemedel (både orala och injicerbara formuleringar) relevanta för varandra.
Beskrivning av utvalda biverkningar
Anafylaktisk reaktion
Efter marknadsintroduktionen av Xeplion har i sällsynta fall en anafylaktisk reaktion rapporterats hos patienter som tidigare tolererat oralt risperidon eller oralt paliperidon (se avsnitt Varningar och försiktighet).
Reaktioner vid injektionsstället
Den vanligast rapporterade biverkningen relaterad till injektionsstället var smärta. De flesta av dessa reaktioner rapporterades vara lindriga till måttliga. Subjektiva bedömningar av smärta vid injektionsstället på en VAS-skala tenderade att minska i frekvens och intensitet över tid i samtliga fas 2- och 3-studier med Xeplion. Injektioner i deltamuskeln uppfattades som något mer smärtsamma än motsvarande injektioner i gluteusmuskeln. Andra reaktioner vid injektionsstället var i de flesta fall lindriga och utgjordes av bland annat förhårdnader (vanligt), pruritus (mindre vanligt) och knutor (sällsynt).
Extrapyramidala symtom (EPS)
EPS inkluderar en poolad analys av följande termer: parkinsonism (inkluderar salivhypersekretion, muskuloskeletal stelhet, parkinsonism, dregling, kugghjulsrigiditet, bradykinesi, hypokinesi, maskansikte, muskelstelhet, akinesi, nackstelhet, muskelrigiditet, parkinsonistisk gång och onormal glabellarreflex, parkinsionistisk vilotremor), akatisi (inkluderar akatisi, rastlöshet, hyperkinesi och restless legs-syndrom), dyskinesi (dyskinesi, muskelryckningar, koreoatetos, atetos och myoklonus), dystoni (innefattar: dystoni, hypertoni, tortikollis, ofrivilliga muskelkontraktioner, muskelkontraktur, blefarospasm, okulogyration, tungförlamning, spasm i ansiktet, laryngospasm, myotoni, opistotonus, orofaryngeal spasm, pleurototonus, tungspasm och trismus) och tremor. Det bör noteras att ett bredare spektrum av symptom är inkluderade vilka inte nödvändigtvis har extrapyramidalt ursprung.
Viktökning
I en 13 veckor lång studie med insättningsdosen på 150 mg förelåg en dosberoende trend för den andel individer som uppvisade en onormal viktuppgång på ≥ 7 %, med 5 % incidens i placebogruppen jämfört med 6 %, 8 % och 13 % i de grupper som fick Xeplion i doser om 25 mg, 100 mg respektive 150 mg.
Under den 33 veckor långa öppna övergångs/underhållsperioden i en prövning för att långsiktigt förebygga återfall, uppfyllde 12 % av de Xeplion -behandlade patienterna detta kriterium (viktuppgång på ≥ 7 % från dubbelblindningsfas till slutpunkt). Medelvärdet (SA) av viktförändringen från baslinjen i den öppna delen var + 0,7 (4,79) kg.
Hyperprolaktinemi
I kliniska prövningar observerades medianökningar av serumprolaktin hos patienter av båda könen som fick Xeplion . Biverkningar som kan tyda på ökade prolaktinnivåer (t.ex. amenorré, galaktorré, menstruella rubbningar, gynekomasti) rapporterades för totalt < 1 % av patienterna.
Klasseffekter
QT-förlängning, ventrikelarytmier (ventrikelflimmer, ventrikeltakykardi), plötslig oförklarad död, hjärtstopp och torsade de pointes kan uppträda vid behandling med antipsykotika.
Fall av venös tromboembolism, inkluderande fall av lungemboli och fall av djup ventrombos har rapporterats för antipsykotiska läkemedel (med okänd frekvens).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Symtom
I allmänhet är de tecken och symtom som kan förväntas, de som orsakas av att paliperidons kända farmakologiska effekter blir för stora, dvs. dåsighet och sedering, takykardi och hypotoni, QT-förlängning samt extrapyramidala symtom. Torsade de pointes och ventrikelflimmer har rapporterats för en patient i samband med överdosering av oralt paliperidon. I fråga om akut överdosering ska man beakta möjligheten att flera läkemedel kan vara inblandade.
Behandling
Man ska även väga in läkemedlets depotkaraktär och paliperidons långa elimineringshalveringstid när man tar ställning till patientens behandlingsbehov och återhämtning. Det finns ingen specifik antidot för paliperidon. Generella understödjande åtgärder ska sättas in. Etablera och upprätthåll fri luftväg och säkerställ adekvat syresättning och ventilation.
Kardiovaskulär övervakning ska påbörjas omedelbart och ska innefatta kontinuerlig EKG-övervakning med avseende på eventuella arytmier. Hypotoni och cirkulationskollaps ska behandlas med lämpliga åtgärder, såsom intravenös tillförsel av vätska och/eller sympatomimetiska medel. Vid svåra extrapyramidala symtom ska antikolinergika tillföras. Noggrann kontroll och övervakning ska fortsätta tills patienten har återhämtat sig.
Farmakodynamik
Xeplion innehåller en racemisk blandning av (+)- och (-)‑paliperidon.
Verkningsmekanism
Paliperidon är en selektiv blockerare av monoamineffekter och har farmakologiska egenskaper som skiljer sig från dem hos traditionella neuroleptika. Paliperidon binder starkt till serotonerga 5-HT2- och dopaminerga D2-receptorer. Paliperidon blockerar också alfa-1-adrenerga receptorer och, i mindre utsträckning, H1-histaminerga och alfa-2-adrenerga receptorer. Den farmakologiska aktiviteten hos (+)- och (-)‑enantiomererna av paliperidon är kvalitativt och kvantitativt likartad.
Paliperidon är inte bundet till kolinerga receptorer. Även om paliperidon är en stark D2-antagonist, vilket anses mildra de positiva symtomen på schizofreni, orsakar medlet mindre katalepsi och försämrar de motoriska funktionerna i mindre utsträckning än traditionella neuroleptika. Dominerande central serotoninantagonism kan minska paliperidons tendens att orsaka extrapyramidala biverkningar.
Klinisk effekt
Akut behandling av schizofreni
Effekten av Xeplion vid akut behandling av schizofreni fastställdes i fyra korta (en på 9 veckor och tre på 13 veckor), dubbelblinda, randomiserade, placebokontrollerade studier med fast dos hos vuxna slutenvårdspatienter med akut återfall som uppfyllde DSM-IV-kriterierna för schizofreni. De fasta doserna av Xeplion gavs i dessa studier på dag 1, 8 och 36 i den 9 veckor långa studien och i de 13 veckor långa studierna även på dag 64. Inga ytterligare, kompletterande orala antipsykotika behövdes under den akuta behandlingen av schizofreni med Xeplion . Det primära effektmåttet definierades som en minskning av totalpoängen på PANSS-skalan (Positive and Negative Syndrome Scale) såsom visas i tabellen nedan. PANSS är en validerad skattningsskala, bestående av fem faktorer, som används för att utvärdera positiva symtom, negativa symtom, desorganiserat tankemönster, okontrollerad fientlighet/upphetsning samt ångest/depression. Funktion utvärderades med hjälp av PSP-skalan (Personal and Social Performance scale). PSP är en validerad skala där läkare bedömer patientens personliga och sociala funktion inom fyra områden: socialt värdefulla aktiviteter (arbete och studier), personliga och sociala relationer, förmågan att ta hand om sig själv samt störande och aggressiva beteenden.
I en 13 veckor lång studie (n = 636) som jämförde tre fasta doser av Xeplion (inledande deltamuskelinjektion på 150 mg följt av 3 gluteus- eller deltadoser på antingen 25 mg/4 veckor, 100 mg/4 veckor eller 150 mg/4 veckor) med placebo förbättrade samtliga Xeplion -doser den totala PANSS-poängen mer än placebo. I denna studie uppvisade både behandlingsgruppen 100 mg/4 veckor och 150 mg/4 veckor, men inte gruppen 25 mg/4 veckor, statistiskt signifikant förbättring av PSP-poäng jämfört med placebo. Dessa resultat stöder att effekt erhålls över hela behandlingsperioden och förbättring i PANSS-poäng och observerades så tidigt som dag 4, med signifikant skillnad från placebo i 25 mg- och 150 mg-Xeplion -grupperna på dag 8.
Resultaten från de övriga studierna gav statistiskt signifikanta resultat till fördel för Xeplion , förutom för 50 mg-dosen i en studie (se tabellen nedan).
|
Totalpoäng på PANSS-skalan (Positive and Negative Syndrome Scale) – förändring från baslinjevärdet till effektmått LOCF för studierna R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 och R092670-PSY-3007: analysset för primär effekt |
|||||
|
|
Placebo |
25 mg |
50 mg |
100 mg |
150 mg |
|
R092670-PSY-3007* Medelvärde vid baslinjen (SA) Medelförändring (SA) p-värde (mot placebo) |
n = 160 86,8 (10,31) -2,9 (19,26) -- |
n = 155 86,9 (11,99) -8,0 (19,90) 0,034 |
-- |
n = 161 86,2 (10,77) -11,6 (17,63) < 0,001 |
n = 160 88,4 (11,70) -13,2 (18,48) < 0,001 |
|
R092670-PSY-3003 Medelvärde vid baslinjen (SA) Medelförändring (SA) p-värde (mot placebo) |
n = 132 92,4 (12,55) -4,1 (21,01) -- |
-- |
n = 93 89,9 (10,78) -7,9 (18,71) 0,193 |
n = 94 90,1 (11,66) -11,0 (19,06) 0,019 |
n = 30 92,2 (11,72) -5,5 (19,78) -- |
|
R092670-PSY-3004 Medelvärde vid baslinjen (SA) Medelförändring (SA) p-värde (mot placebo) |
n = 125 90,7 (12,22) -7,0 (20,07) -- |
n = 129 90,7 (12,25) -13,6 (21,45) 0,015 |
n = 128 91,2 (12,02) -13,2 (20,14) 0,017 |
n = 131 90,8 (11,70) -16,1 (20,36) < 0,001 |
-- |
|
R092670-SCH-201 Medelvärde vid baslinjen (SA) Medelförändring (SA) p-värde (mot placebo) |
n = 66 87,8 (13,90) 6,2 (18,25) -- |
-- |
n = 63 88,0 (12,39) -5,2 (21,52) 0,001 |
n = 68 85,2 (11,09) -7,8 (19,40) < 0,0001 |
-- |
|
* För studie R092670-PSY-3007 gavs en insättningsdos på 150 mg till alla patienter i Xeplion-behandlingsgrupperna på dag 1, varefter dosregimen för respektive grupp följdes. Observera: negativ förändring av poängen innebär förbättring. |
|||||
Upprätthålla symtomkontroll och fördröja återfall av schizofreni
Xeplions effektivitet att upprätthålla symtomkontroll och fördröja återfall av schizofreni fastställdes i en lång, dubbelblind, placebokontrollerad studie med flexibla doser omfattande 849 vuxna patienter (ej äldre) som uppfyllde DSM-IV-kriterierna för schizofreni. I studien ingick en 33 veckor lång, öppen fas av akut behandling och stabilisering, en randomiserad, dubbelblind, placebokontrollerad fas för observation av återfall samt en 52 veckor lång öppen förlängningsperiod. I denna studie gavs Xeplion -doser på 25, 50, 75 och 100 mg månatligen; 75 mg-dosen tilläts endast i den 52 veckor långa öppna förlängningsdelen av studien. Patienterna fick initialt flexibla doser (25-100 mg) av Xeplion under en 9 veckor lång övergångsperiod, vilken följdes av en 24 veckor lång underhållsperiod där patienternas PANSS-poäng skulle vara ≤ 75. Dosjusteringar tilläts endast i de första 12 veckorna av underhållsperioden. Totalt 410 stabiliserade patienter randomiserades till att antingen få Xeplion (genomsnittlig behandlingslängd 171 dagar [intervall 1 dag till 407 dagar]) eller placebo (genomsnittlig behandlingslängd 105 dagar [intervall 8 dagar till 441 dagar]) fram tills de fick ett återfall av schizofrenisymtomen i den dubbelblinda fasen med varierande längd. Prövningen avbröts i förtid på grund av effektskäl eftersom man observerade en signifikant längre tid fram till återfall (p < 0,0001, figur 1) hos patienterna som behandlades med Xeplion jämfört med dem som fick placebo (riskkvot (hazard ratio) = 4,32; 95 % KI: 2,4 7,7).
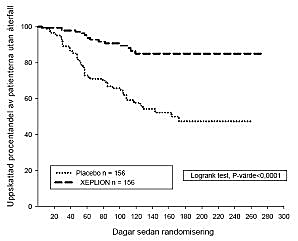
Figur 1: Kaplan-Meier-diagram av tid till återfall – Interimsanalys (interimsanalysset för intent-to-treat)
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Xeplion för alla grupper av den pediatriska populationen för schizofreni (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption och distribution
Paliperidonpalmitat är palmitatesterprodrogen av paliperidon. På grund av paliperidonpalmitats extremt låga vattenlöslighet, löser det sig långsamt efter en intramuskulär injektion innan det hydrolyseras till paliperidon och tas upp av den systemiska cirkulationen. Efter en engångsdos stiger plasmakoncentrationerna av paliperidon gradvis för att nå den högsta plasmakoncentrationen vid en median-Tmax på 13 dagar. Frisättningen av den aktiva substansen startar så tidigt som dag 1 och varar under minst 4 månader.
Efter en intramuskulär engångsdos (25-150 mg) i deltamuskeln, observerades i genomsnitt 28 % högre Cmax jämfört med en injektion i gluteusmuskeln. De två intramuskulära insättningsdoserna i deltamuskeln på 150 mg på dag 1 och 100 mg på dag 8 bidrar till att terapeutiska koncentrationer snabbt kan uppnås. Xeplions frisättningsprofil samt dosregimen gör att terapeutiska koncentrationer kan upprätthållas över tid. Den totala paliperidonexponeringen efter Xeplion -administrering var dosproportionell över dosintervallet 25-150 mg och mindre än dosproportionell för Cmax för doser som översteg 50 mg. Medelvärdet vid steady state för förhållandet mellan högsta och lägsta koncentration för en Xeplion -dos på 100 mg var 1,8 efter administrering i gluteusmuskeln och 2,2 efter administrering i deltamuskeln. Det synbara medianvärdet för paliperidons halveringstid efter administrering av Xeplion i dosintervallet 25-150 mg varierade från 25 till 49 dagar.
Den absoluta biotillgängligheten av paliperidonpalmitat efter administrering av Xeplion är 100 %.
Efter administrering av paliperidonpalmitat interkonverterar (+)- och (-)-enantiomererna av paliperidon och når ett förhållande mellan AUC (+) och (-) på ungefär 1,6 1,8.
Plasmaproteinbindningsgraden för racemiskt paliperidon är 74 %.
Metabolism och eliminering
En vecka efter administrering av en oral engångsdos på 1 mg 14C-märkt paliperidon med omedelbar frisättning hade 59 % av dosen utsöndrats oförändrad i urinen, vilket visar att paliperidon inte metaboliseras i levern i någon större utsträckning. Ungefär 80 % av den tillförda radioaktiviteten återfanns i urinen och 11 % i feces. Fyra metabola vägar har identifierats in vivo, men ingen av dem svarar för mer än 6,5 % av dosen: dealkylering, hydroxylering, dehydrogenering och bensisoxazolklyvning. Visserligen tyder studier in vitro på att CYP2D6 och CYP3A4 har betydelse för paliperidons metabolism, men det finns inga belägg in vivo för att dessa isoenzymer spelar någon betydande roll för paliperidons metabolism. Farmakokinetiska populationsanalyser visade inga märkbara skillnader i skenbar clearance av paliperidon efter administrering av oralt paliperidon mellan snabba och långsamma metaboliserare av CYP2D6-substrat. In vitro-studier på humana levermikrosomer visade att paliperidon inte i någon större utsträckning hämmar metabolismen av läkemedel som metaboliseras av cytokrom P450-isoenzymer, inklusive CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 och CYP3A5.
In vitro-studier har visat att paliperidon är ett P-gp-substrat och en svag hämmare av P-gp i höga koncentrationer. Inga in vivo-data finns att tillgå och den kliniska relevansen är inte känd.
Långtidsverkande injektioner av paliperidonpalmitat jämfört med orala depotberedningar av paliperidon
Xeplion har utformats för att frisätta paliperidon under en månad medan orala depotberedningar av paliperidon administreras dagligen. Insättningsregimen för Xeplion (150 mg/100 mg i deltamuskeln på dag 1/dag 8) har utarbetats för att snabbt nå steady-statekoncentrationer av paliperidon när behandlingen inleds utan att behöva använda orala komplement.
Generellt sett var de totala plasmanivåerna vid insättning av Xeplion inom samma exponeringsintervall som observerats med depottablett paliperidon 6-12 mg. Användningen av insättningsregimen för Xeplion möjliggjorde att patienterna låg i samma exponeringsintervall som med depottablett paliperidon 6 12 mg även vid de lägsta koncentrationerna dagen före dosering (dag 8 och dag 36). På grund av skillnaden i medianvärdet hos de farmakokinetiska profilerna för de två läkemedlen ska försiktighet iakttas när man gör direkta jämförelser av deras farmakokinetiska egenskaper.
Nedsatt leverfunktion
Paliperidon metaboliseras inte i någon större utsträckning i levern. Även om Xeplion inte har studerats för patienter med nedsatt leverfunktion, krävs ingen dosjustering för patienter med lindrigt eller måttligt nedsatt leverfunktion. I en studie av oralt paliperidon hos patienter med måttligt nedsatt leverfunktion (Child-Pugh klass B) var plasmakoncentrationerna av fritt paliperidon liknande dem hos friska individer. Paliperidon har inte studerats hos patienter med gravt nedsatt leverfunktion.
Nedsatt njurfunktion
Distribution av en engångsdos oralt paliperidon 3 mg depottablett studerades hos individer med varierande grad av njurfunktion. Eliminationen av paliperidon minskade med minskande beräknad kreatininclearance. Totalclearance av paliperidon var minskad hos patienter med nedsatt njurfunktion med i genomsnitt 32 % vid lätt (kreatininclearance [CrCl] = 50 till < 80 ml/min), 64 % vid måttligt (CrCl = 30 till < 50 ml/min) och 71 % vid gravt (CrCl = < 30 ml/min) nedsatt njurfunktion, vilket motsvarar en genomsnittlig ökning av exponering (AUCinf) på 1,5, 2,6 respektive 4,8 gånger jämfört med hos friska individer. Utifrån ett begränsat antal observationer av användning av Xeplion hos individer med lätt nedsatt njurfunktion samt farmakokinetiska simuleringar, rekommenderas en reducerad dos (se avsnitt Dosering).
Äldre
Farmakokinetisk populationsanalys visade inte på några farmakokinetiskt åldersrelaterade skillnader.
Kroppsmasseindex (BMI)/kroppsvikt
Farmakokinetiska studier med paliperidonpalmitat har påvisat något lägre (10 20 %) plasmakoncentrationer av paliperidon hos patienter som är överviktiga eller obesa jämfört med normalviktiga patienter (se avsnitt Dosering).
Etnicitet
Farmakokinetiska populationsanalyser från studier med oralt paliperidon gav inga belägg för etnicitetsrelaterade skillnader i paliperidons farmakokinetik efter administrering av Xeplion.
Kön
Inga kliniskt signifikanta skillnader har observerats mellan kvinnor och män.
Rökstatus
Baserat på in vitro-studier där man använt humana leverenzymer utgör paliperidon inte något substrat för CYP1A2, varför rökning inte bör ha någon effekt på paliperidons farmakokinetik. Rökningens effekt på paliperidons farmakokinetik studerades inte för Xeplion. En farmakokinetisk populationsanalys baserad på data med orala depottabletter av paliperidon visade något lägre exponering för paliperidon hos rökare jämfört med icke-rökare. Det är osannolikt att denna skillnad skulle vara av klinisk relevans.
Prekliniska uppgifter
Studier av allmäntoxicitet efter intramuskulära injektioner av paliperidonpalmitat (formuleringen för användning en gång per månad) och oralt administrerat paliperidon hos råttor och hundar visade i huvudsak farmakologiska effekter, såsom sedering och prolaktinmedierade effekter på bröstkörtlar och genitalier. Hos djur som behandlades med paliperidonpalmitat observerades inflammatoriska reaktioner vid det intramuskulära injektionsstället. Enstaka abscesser observerades.
I reproduktionsstudier på råttor med oralt risperidon, vilket i stor utsträckning omvandlas till paliperidon hos råttor och människor, sågs minskad födelsevikt och överlevnad hos avkomman. Inga embryotoxiska effekter eller missbildningar har observerats efter intramuskulär administrering av paliperidonpalmitat till dräktiga råttor upp till den högsta dosen (160 mg/kg/dag), vilket motsvarar 4,1 gånger exponeringsnivån hos människor som får den högsta rekommenderade dosen på 150 mg. Andra dopaminantagonister har, när de givits till dräktiga djur, orsakat negativa effekter på inlärning och motorisk utveckling hos avkomman.
Paliperidonpalmitat och paliperidon var inte gentoxiska. I karcinogenicitetsstudier med oralt risperidon hos råttor och möss observerades ökningar av hypofysadenom (mus), endokrina pankreasadenom (råtta) och bröstkörteladenom (båda djurslagen). Den karcinogena potentialen av intramuskulärt injicerat paliperidonpalmitat utvärderades i råttor. Det förelåg en statistiskt signifikant ökning av bröstkörteladenokarcinom hos råtthonor vid doserna 10, 30 och 60 mg/kg/månad. Hos råtthanar förelåg en statistiskt signifikant ökning av bröstkörteladenom och -karcinom vid doserna 30 och 60 mg/kg/månad, vilket motsvarar 1,2 respektive 2,2 gånger exponeringsnivån hos människor som får den högsta rekommenderade dosen på 150 mg. Dessa tumörer kan relateras till förlängd dopamin-D2-antagonism och hyperprolaktinemi. Vilken relevans dessa tumörfynd hos gnagare har i termer av risker för människor är inte känd.
Innehåll
Kvalitativ och kvantitativ sammansättning
25 mg injektionsvätska, depotsuspension
Varje förfylld spruta innehåller 39 mg paliperidonpalmitat i 0,25 ml, vilket motsvarar 25 mg paliperidon.
50 mg injektionsvätska, depotsuspension
Varje förfylld spruta innehåller 78 mg paliperidonpalmitat i 0,5 ml, vilket motsvarar 50 mg paliperidon.
75 mg injektionsvätska, depotsuspension
Varje förfylld spruta innehåller 117 mg paliperidonpalmitat i 0,75 ml, vilket motsvarar 75 mg paliperidon.
100 mg injektionsvätska, depotsuspension
Varje förfylld spruta innehåller 156 mg paliperidonpalmitat i 1 ml, vilket motsvarar 100 mg paliperidon.
150 mg injektionsvätska, depotsuspension
Varje förfylld spruta innehåller 234 mg paliperidonpalmitat i 1,5 ml, vilket motsvarar 150 mg paliperidon.
Förteckning över hjälpämnen
Polysorbat 20
Polyetylenglykol 4 000
Citronsyramonohydrat
Vattenfritt dinatriumvätefosfat
Natriumdivätefosfatmonohydrat
Natriumhydroxid (för pH-justering)
Vatten för injektionsvätskor
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel.
Miljöpåverkan
Paliperidon
Miljörisk:
Användning av paliperidon har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Paliperidon är potentiellt persistent.
Bioackumulering:
Paliperidon har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
|
PEC (µg/L) |
= |
(A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R) |
|
PEC |
= |
0.000371036 μg/L |
|
Where: |
|
|
|
A |
= |
0.61069425 kg paliperidone (total sold amount API in the most recent sales data for Sweden (2020) was distributed by IQVIA in 2021) 2.0976 kg paliperidone palmitate (equivalent for 1.3439075 kg paliperidone) (total sold amount API in the most recent sales data for Sweden (2020) was distributed by IQVIA in 2021) Total = 1.95460185 kg paliperidone |
|
R |
= |
X % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 if no data is available. |
|
P |
= |
number of inhabitants in Sweden = 10 *106 |
|
V (L/day) |
= |
volume of wastewater per capita and day = 200 (ECHA default) (Ref. 8) |
|
D |
= |
factor for dilution of wastewater by surface water flow = 10 (ECHA default) (Ref. 8) |
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae
Growth inhibition test with green alga (Scenedesmus subspicatus) (OECD 201) [Ref. 1]:
EbC50 72 h (biomass) = 14 mg/L
ErC50 72 h (growth rate) > 16 mg/L
NOEC = 7.0 mg/L
Crustacean
Acute
Acute toxicity to water-flea (Daphnia magna) (OECD 202) [Ref. 2]:
EC50 48 h (immobilization)> 23 mg/L
Chronic
Reproduction test with water-flea (Daphnia magna) (OECD 211) [Ref. 6]:
NOEC 21 days (reproduction) = 2.5 mg/L
Fish
Acute
Acute toxicity to zebra fish (Brachydanio rerio) (OECD 203) [Ref. 3]:
LC50 96 h (Survival and reproduction) = 18 mg/L
Chronic
Fish early life stage test with zebra fish (Brachydanio rerio) (OECD 210) [Ref. 5]:
NOEC 35days (Development and Hatching) = 3.2 mg/L
Other ecotoxicity data
Activated sludge respiration inhibition test (OECD 209) [Ref. 4]
EC50 3h (respiration inhibition) > 2000 mg/L
NOEC 3h ≥ 2000 mg/L
Environmental risk classification (PEC/PNEC ratio)
Calculation of Predicted No Effect Concentration (PNEC)
As long-term toxicity NOEC’s for Paliperidone are available from three different species across three different trophic levels (fish, Daphnia and algae), the PNEC can be calculated by applying an assessment factor of 10.
PNEC (µg/l) = lowest NOEC/10, where 10 is the assessment factor used. The NOEC for the reproduction of Daphnia magna of 2.5 mg/L has been used for this calculation since it is the most sensitive of the three tested species.
PNEC = 2.5 mg/L/10 = 250 µg/L
Environmental risk classification (PEC/PNEC ratio)
PEC/PNEC = 0.000371036 / 250 = 0.00000148414 i.e. PEC/PNEC ≤ 0.1
Conclusion for environmental risk:
Use of Paliperidone has been considered to result in insignificant environmental risk.
DEGRADATION
Biotic degradation
Ready biodegradation
Readily biodegradability (OECD 301F) [Ref.7]:
The biochemical oxygen demand (BOD) of the test item Paliperidone (R076477) in the test media was only slightly above the BOD of the inoculum controls. Therefore, Paliperidone (R076477) was not biodegradable under the test conditions within 28 days.
No degradation of the test item occurred in the abiotic control under the test conditions within 28 days.
In the toxicity control, containing both Paliperidone (R076477) and the reference item sodium benzoate, no inhibitory effect on the biodegradation of the reference item was determined. Thus, Paliperidone (R076477) had no inhibitory effect on the activity of activated sludge microorganisms at the tested concentration of 100 mg/L.
In the procedure controls, the reference item sodium benzoate degraded by an average of 89% by Exposure Day 14, and reached an average biodegradation of 93% by the end of the test (Day 28), thus confirming suitability of the activated sludge.
It can be concluded that Paliperidone (R076477) is not readily biodegradable in a 28-day Manometric Respirometry test according to OECD Guideline No. 301F.
Conclusion for degradation:
Consequently, the medicine Paliperdone is potentially persistent.
BIOACCUMULATION
Partition coefficient octanol/water
Partition coefficient octanol/water (shaking flask method)
The partition coefficients were determined at 20°C between 1-octanol and aqueous buffered solutions.
log Kow = 2.39 (pH = 11.9)
Data according open literature [Ref. 9]:
-
ChemSpider reports:
-
ACD/LogP: 1.52
-
ACD/LogD (pH 7.4): 0.88
-
-
EpiSuite:
-
Log Kow (estimate) = 1.95
-
-
PubChem reports:
-
log Kow = 1.95 (est)
-
Conclusion for bioaccumulation:
Paliperidone has low potential for bioaccumulation.
Excretion (metabolism)
No data available.
PBT/vPvB assessment
Paliperidone does not fulfils the criteria for PBT and/or vBvP.
References
-
Seyfried B., Paliperidone (R076477): Toxicity to Scenedesmus supspicatus in a 72-hour Algal Growth Inhibition Test;RCC Study No. A06254, Janssen Study No. RMD646; October 24, 2005.
-
Seyfried B., Paliperidone (R076477): Acute Toxicity to Daphna magna in a 48-hour Immobilization Test; RCC Study No. A06232, Janssen Study No. RMD647; October 24, 2005.
-
Seyfried B., Paliperidone (R076477): Acute Toxicity to Zebra Fish (Brachydanio rerio) in a 96-hour Static Test; RCC Study No. A06210, Janssen Study No. RMD648; October 24, 2005.
-
Seyfried B., Paliperidone (R076477): Toxicity to Activated Sludge in a Respiration Inhibition Test;RCC Study No. A52290, Janssen Study No. RMD769; April 25, 2006.
-
Peither A., Paliperidone (R076477): Toxicity to Zebra Fish (Brachydanio rerio) in an Early Life Stage Toxicity Test; RCC Study No. A52277, Janssen Study No. RMD768; September 29, 2006.
-
Peither A., Paliperidone (R076477): Effect on Survival and Reproduction of Daphna magna in a semi static test over three weeks; RCC Study No. A52255, Janssen Study No. RMD767; July 5, 2006.
-
Grutzner I., Paliperidone (R076477): Ready Biodegradability in Manometric Respirometry Test; RCC Study No. AO6276, Janssen Study No. RMD645; September 6, 2005.
-
ECHA, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment. http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm
-
US EPA; Estimation Program Interface (EPI) Suite. Ver. 4.1. Nov, 2012
Hållbarhet, förvaring och hantering
Hållbarhet
2 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Injektionsvätska, depotsuspension.
Suspensionen är vit till benvit. Suspensionen har neutralt pH (ungefär 7,0).
Förpackningsinformation
Injektionsvätska, depotsuspension 25 mg
vit till benvit
1 styck förfylld spruta (fri prissättning), tillhandahålls ej
Injektionsvätska, depotsuspension 50 mg
vit till benvit
1 styck förfylld spruta, 2226:05, F
Injektionsvätska, depotsuspension 75 mg
vit till benvit
1 styck förfylld spruta, 3308:45, F
Injektionsvätska, depotsuspension 100 mg
vit till benvit
1 styck förfylld spruta, 4390:85, F
Injektionsvätska, depotsuspension 150 mg
vit till benvit
1 styck förfylld spruta, 6555:65, F
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, depotsuspension 50 mg
Injektionsvätska, depotsuspension 75 mg
Injektionsvätska, depotsuspension 100 mg
Injektionsvätska, depotsuspension 150 mg





