Indikationer
Glivec är indicerat för behandling av
-
vuxna och barn med nydiagnostiserad Philadelphiakromosom- (bcr-abl)-positiv (Ph+) kronisk myeloisk leukemi (KML), för vilka benmärgstransplantation inte är en förstahandsbehandling.
-
vuxna och barn med (Ph+)-KML i kronisk fas efter terapisvikt med interferon alfa-behandling, eller i accelererad fas eller blastkris.
-
vuxna och barn med nyligen diagnosticerad Philadelphia-kromosom-positiv akut lymfoblastisk leukemi (Ph+ ALL) tillsammans med kemoterapi.
-
vuxna patienter med recidiverande eller refraktär Ph+ ALL som monoterapi.
-
vuxna patienter med myelodysplastiska/myeloproliferativa sjukdomar (MDS/MPD) förenat med rearrangemang av platelet-derived growth factor receptor (PDGFR)-genen.
-
vuxna patienter med avancerat hypereosinofilt syndrom (HES) och/eller kronisk eosinofil leukemi (CEL) med FIP1L1-PDGFRα-rearrangemang.
Effekten av Glivec på utfallet av benmärgstransplantation har inte undersökts.
Glivec är indicerat för
-
behandling av vuxna patienter med Kit (CD 117)-positiva, icke-resecerbara och/eller metastaserande, maligna gastrointestinala stromacellstumörer (GIST).
-
adjuvant behandling av vuxna patienter som löper en signifikant risk för recidiv efter resektion av Kit (CD117)-positiv GIST. Patienter som löper låg eller mycket låg risk för återfall ska inte få adjuvant behandling.
-
behandling av vuxna patienter med icke-resecerbara dermatofibrosarkoma protuberans (DFSP) och vuxna patienter med återkommande och/eller metastaserande DFSP som är olämpliga att operera.
Hos vuxna och barn baseras effekten av Glivec på det sammantagna hematologiska och cytogenetiska svaret och progressionsfri överlevnad vid KML, på hematologiskt och cytogenetiskt respons vid Ph+ ALL, MDS/MPD, på hematologisk respons vid HES/CEL och på objektiv tumörrespons hos vuxna patienter vid icke-resecerbara och/eller metastaserande GIST och DFSP och på återfallsfri överlevnad vid adjuvant GIST. Erfarenheten av Glivec hos patienter med MDS/MPD förenat med rearrangemang PDGFR-genen är mycket begränsat (se avsnitt Farmakodynamik). Förutom vid nyligen diagnostiserad KML i kronisk fas finns det inga kontrollerade studier som visar på en klinisk nytta eller ökad överlevnad för dessa sjukdomar.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Behandling skall lämpligen inledas av läkare med erfarenhet av behandling av patienter med hematologiska maligniteter och maligna sarkom.
För andra doser än 400 mg och 800 mg (se Doseringsrekommendationen nedan) finns 100 mg och 400 mg delbara tabletter tillgängliga.
Ordinerad dos skall ges peroralt tillsammans med måltid och ett stort glas vatten för att minimera riskerna för gastrointestinala besvär. Doser på 400 mg eller 600 mg skall ges en gång dagligen, medan en daglig dos på 800 mg skall ges som 400 mg två gånger dagligen, morgon och kväll.
För patienter som inte kan svälja de filmdragerade tabletterna, kan tabletterna slammas upp i endera ett glas icke kolsyrat vatten eller äppeljuice. Ett erforderligt antal tabletter placeras i lämplig volym dryck (cirka 50 ml för en 100 mg-tablett och 200 ml för en 400 mg-tablett) och rörs om med en sked. Suspensionen skall intas omedelbart efter ett fullständigt sönderfall av tabletterna.
Dosering vid KML hos vuxna
Den rekommenderade dosen Glivec är 400 mg dagligen för vuxna patienter med KML i kronisk fas. KML i kronisk fas definieras när alla av följande kriterier uppfyllts: blaster <15% i blod och benmärg, basofiler i perifert blod <20%, trombocyter >100x109/l.
Den rekommenderade dosen Glivec är 600 mg dagligen för vuxna patienter i accelererad fas. Accelererad fas definieras när något av följande kriterier är uppfyllda: blaster ≥15% men <30% i blod eller benmärg, blaster plus promyelocyter ≥30% i blod eller benmärg (förutsatt <30% blaster), basofiler i perifert blod ≥20%, trombocyter <100x109/l utan samband med behandlingen.
Den rekommenderade dosen Glivec är 600 mg dagligen för vuxna patienter i blastkris. Blastkris definieras som blaster ≥30% i blod eller benmärg eller extramedullär sjukdom annan än hepatosplenomegali.
Behandlingstid: I kliniska studier fortsatte behandlingen med Glivec tills sjukdomen tilltog. Effekten av att man avslutar behandlingen efter att ha uppnått fullständigt cytogenetiskt svar har inte undersökts.
Dosökning från 400 mg till 600 mg eller 800 mg till patienter med sjukdom i kronisk fas eller från 600 mg till maximalt 800 mg (givet som 400 mg två gånger dagligen) hos patienter i accelererad fas eller blastkris kan övervägas i följande fall, såvida inte allvarlig biverkan, svår icke-leukemirelaterad neutropeni eller trombocytopeni föreligger: Sjukdomsprogress (när som helst under förloppet), uteblivet tillfredsställande hematologiskt svar efter minst 3 månaders behandling, uteblivet cytogenetiskt svar efter 12 månaders behandling eller förlust av tidigare erhållet hematologiskt och/eller cytogenetiskt svar. Patienterna skall följas noga efter dosupptrappning med tanke på en ökad risk för biverkningar vid högre doser.
Dosering vid KML hos barn
Barndoseringen skall baseras på kroppsyta (mg/m2). Dosen 340 mg/m2 dagligen rekommenderas till barn med KML i kronisk fas respektive KML i avancerad fas (får ej överstiga totaldosen 800 mg). Behandlingen kan ges som en daglig engångsdos eller alternativt kan den dagliga dosen ges vid två tillfällen - en på morgonen och en på kvällen. Aktuell doseringsrekommendation är baserad på ett litet antal pediatriska patienter (se avsnitt Farmakodynamik och Farmakokinetik). Det finns ingen erfarenhet av behandling av barn under 2 års ålder.
Dosökningar från 340 mg/m2 dagligen till 570 mg/m2 dagligen (får ej överskrida totaldosen 800 mg) kan övervägas hos barn i frånvaro av svåra biverkningar och svår non-leukemi-relaterad neutropeni eller trombocytopeni vid följande omständigheter: sjukdomsprogression (när som helst); misslyckande att erhålla ett tillfredsställande hematologiskt svar efter minst 3 månaders behandling, misslyckande att erhålla ett cytogenetiskt svar efter 12 månaders behandling; eller relaps efter tidigare uppnått hematologiskt och/eller cytogenetiskt svar. Patienter bör monitoreras noggrant efter dosökning med tanke på risken för ökad incidens av biverkningar vid högre doser.
Dosering vid Ph+ ALL hos vuxna patienter
Den rekommenderade dosen Glivec är 600 mg dagligen för vuxna patienter med Ph+ ALL. Hematologer som är experter på hantering av denna sjukdom skall övervaka behandlingen i alla behandlingsfaser.
Behandlingsschema: Baserat på befintliga data har Glivec visat sig vara effektivt och säkert när det ges i dosen 600 mg/dag i kombination med kemoterapi i induktionsfas, konsoliderings- och underhållsfas av kemoterapin (se avsnitt Farmakodynamik) hos vuxna patienter med nydiagnostiserad Ph+ ALL. Längden på behandlingen med Glivec kan variera med valt behandlingsprogram men längre exponering med Glivec har generellt gett bättre resultat.
För vuxna patienter med relapserande eller refraktär Ph+ ALL är monoterapi med Glivec vid dosen 600 mg/dag säker, effektiv och kan ges tills sjukdomsprogression uppstår.
Dosering vid Ph+ ALL hos barn
Doseringen hos barn bör baseras på kroppsytan (mg/m2). En dos på 340 mg/m2 dagligen rekommenderas för barn med Ph+ ALL (ska ej överskrida en total dos på 600 mg).
Dosering vid MDS/MPD
Den rekommenderade dosen Glivec är 400 mg dagligen för vuxna patienter med MDS/MPD.
Behandlingstid: I den enda genomförda kliniska studien hittills, fortsatte behandlingen med Glivec tills sjukdomen tilltog (se avsnitt Farmakodynamik). Vid tiden för analys var behandlingstiden i median 47 månader (24 dagar – 60 månader).
Dosering vid HES/CEL
Den rekommenderade dosen Glivec är 100 mg dagligen för vuxna patienter med HES/CEL.
Dosökning från 100 mg till 400 mg kan övervägas för dessa patienter i frånvaro av läkemedelsbiverkningar om behandlingssvaret bedöms vara otillräckligt.
Behandling bör fortsätta så länge patienten har fortsatt nytta.
Dosering vid GIST
Den rekommenderade dosen Glivec är 400 mg dagligen för vuxna patienter med icke-resecerbar och/eller metastaserande, malign GIST.
Det finns begränsade data på effekten av dosökning från 400 mg till 600 mg eller 800 mg hos patienter som progredierar vid den lägre dosen (se avsnitt Farmakodynamik).
Behandlingstid: I kliniska studier med GIST-patienter fortsatte behandlingen med Glivec till sjukdomsprogress. Vid tiden för analys var behandlingstiden i median 7 månader (7 dagar till 13 månader). Effekten av att stoppa behandlingen efter att ha uppnått ett svar har inte undersökts.
Rekommenderad dos Glivec är 400 mg dagligen för adjuvant behandling av vuxna patienter efter resektion av GIST. Optimal behandlingstid är ännu inte fastställd. Behandlingstid i den kliniska studie som denna indikation stödjer sig på var 36 månader (se avsnitt Farmakodynamik).
Dosering vid DFSP
Den rekommenderade dosen Glivec är 800 mg dagligen för vuxna patienter med DFSP.
Dosjustering för biverkningar
Icke-hematologiska biverkningar
Om svåra icke-hematologiska biverkningar uppträder under behandling med Glivec skall behandlingen sättas ut till dess biverkningen har försvunnit. Efter detta kan behandlingen återupptas, där lämplig dosstorlek avgörs efter biverkningens svårighetsgrad.
Om höjning i bilirubin >3 gånger det institutionella övre normala gränsvärdet (IULN) eller i levertransaminaser >5 gånger IULN inträffar, skall man sätta ut Glivec tills bilirubinnivåerna återgått till <1,5 gånger IULN och transaminasnivåerna till <2,5 gånger IULN. Behandling med Glivec kan därefter fortsätta med en reducerad daglig dos. Hos vuxna skall dosen reduceras från 400 mg till 300 mg eller från 600 mg till 400 mg, eller från 800 mg till 600 mg. Hos barn skall dosen reduceras från 340 mg/m2/dag till 260 mg/m2/dag.
Hematologiska biverkningar
Dosreduktion eller utsättande av behandling rekommenderas vid svår neutropeni och trombocytopeni enligt anvisningar i nedanstående tabell.
Dosjustering vid neutropeni och trombocytopeni:
|
HES/CEL (startdos 100 mg) |
ANC-värde <1,0x109/l och/eller trombocyter <50x109/l |
1. Sätt ut Glivec till dess ANC ≥1,5x109/l och trombocyter ≥75x109/l. 2.Återuppta behandling med tidigare Glivec-dos (d.v.s. innan allvarlig biverkan). |
|
KML i kronisk fas, MDS/MPD och GIST (startdos 400 mg) HES/CEL (vid dosen 400 mg) |
ANC-värde <1,0x109/l och/eller trombocyter <50x109/l |
1. Sätt ut Glivec till dess ANC ≥1,5x109/l och trombocyter ≥75x109/l. 2. Återuppta behandling med tidigare Glivec-dos (d.v.s. innan allvarlig biverkan). 3. Om ANC återgår till <1,0x109/l och/eller trombocyter <50x109/l, upprepa steg 1 och återuppta Glivec i reducerad dos om 300 mg. |
|
KML i kronisk fas hos barn (vid dosen 340 mg/m2) |
ANC-värde <1,0x109/l och/eller trombocyter <50x109/l |
1.Sätt ut Glivec till dess ANC ≥1,5x109/l och trombocyter ≥75x109/l. 2.Återuppta behandling med tidigare Glivec-dos (d.v.s. innan allvarlig biverkan). 3.Om ANC återgår till <1,0x109/l och/eller trombocyter <50x109/l, upprepa steg 1 och återuppta Glivec i reducerad dos om 260 mg/m2. |
|
KML i accelererad fas och blastkris och Ph+ ALL (startdos 600 mg) |
a ANC <0,5x109/l och/eller trombocyter <10x109/l |
1. Kontrollera om cytopenin är relaterad till leukemi (märgaspirat eller biopsi). 2. Om cytopenin inte är leukemirelaterad, sänk Glivec-dosen till 400 mg. 3. Om cytopenin kvarstår i 2 veckor, minska ytterligare till 300 mg. 4. Om cytopenin kvarstår i 4 veckor och fortfarande inte har samband med leukemin, avbryt Glivec-behandlingen tills dess ANC ≥1x109/l och trombocyter ≥20x109/l, och återuppta sedan behandlingen med 300 mg. |
|
KML i accelererad fas och blastkris hos barn (startdos 340 mg/m2) |
a ANC<0,5x109/l och/eller trombocyter <10x109/l |
1.Kontrollera om cytopenin är relaterad till leukemi (märgaspirat eller biopsi). 2.Om cytopenin inte är leukemirelaterad, sänk Glivec-dosen till 260 mg. 3.Om cytopenin kvarstår i 2 veckor, minska ytterligare till 200 mg. 4.Om cytopenin kvarstår i 4 veckor och fortfarande inte har samband med leukemin, avbryt Glivec-behandlingen tills dess ANC≥1x109/l och trombocyter ≥20x109/l, och återuppta sedan behandlingen med 200 mg. |
|
DFSP (vid 800 mg) |
ANC <1,0x109/l och/eller trombocyter <50x109/l |
1.Sätt ut Glivec tills dess ANC ≥1,5x109/l och trombocyter ≥75x109/l. 2.Återuppta behandling med 600 mg Glivec. 3.Om ANC återgår till <1,0x109/l och/eller trombocyter <50x109/l, upprepa steg 1 och återuppta Glivec i reducerad dos om 400 mg. |
|
ANC-värde = absolut antal neutrofiler a uppstår efter minst 1 månads behandling |
||
Särskilda grupper
Pediatrisk population
Det finns ingen erfarenhet från barn under 2 år med KML och under 1 års ålder med Ph+ ALL (se avsnitt Farmakodynamik). Det finns mycket begränsad erfarenhet från barn med MDS/MPD, DFSP, GIST och HES/CEL.
Säkerhet och effekt för imatinib för barn med MDS/MPD, DFSP, GIST och HES/CEL yngre än 18 år har inte fastställts i kliniska studier. Tillgänglig publicerad information summeras i avsnitt Farmakodynamik men ingen doseringsrekommendation kan fastställas.
Leverinsufficiens
Imatinib metaboliseras huvudsakligen i levern. Patienter med mild, måttlig eller svår leverfunktionsrubbning skall få lägsta rekommenderade dos på 400 mg dagligen. Dosen kan reduceras om den inte tolereras (se avsnitten Varningar och försiktighet, Biverkningar och Farmakokinetik).
Klassificering av leverfunktionsrubbning:
|
Leverfunktionsrubbning |
Leverfunktionstest |
|
Mild |
Totalbilirubin: =1,5 ULN ASAT: >ULN (kan vara normal eller <ULN om totalbilirubin är >ULN) |
|
Måttlig |
Totalbilirubin: >1,5–3,0 ULN ASAT: oavsett värde |
|
Svår |
Totalbilirubin: >3–10 ULN ASAT: oavsett värde |
ULN = det institutionella övre normala gränsvärdet
ASAT = aspartataminotransferas
Njurinsufficiens
Patienter med lätt nedsatt njurfunktion eller som går på dialys skall ges lägsta rekommenderade dos om 400 mg/dag som startdos. Emellertid rekommenderas försiktighet med dessa patienter. Dosen kan minskas om den inte tolereras. Om dosen tolereras kan den ökas om effekten uteblir (se avsnitten Varningar och försiktighet och Farmakokinetik).
Äldre personer
Imatinibs farmakokinetik har inte specifikt studerats hos äldre personer. Inga betydande åldersrelaterade skillnader i farmakokinetik har noterats på vuxna patienter i kliniska studier, som inkluderade mer än 20% patienter i åldern 65 år och äldre. Inga särskilda dosrekommendationer är nödvändiga för äldre personer.
Varningar och försiktighet
När Glivec ges tillsammans med andra läkemedel kan det finnas en risk för interaktioner. Försiktighet bör iakttas vid intag av Glivec med proteashämmare, antimykotikum, vissa makrolider (se avsnitt Interaktioner), CYP3A4-substrat med smalt terapeutiskt fönster (t ex ciklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortesomib, docetaxel, cinkonidin) eller warfarin och andra kumarinderivat (se avsnitt Interaktioner).
Samtidig användning av imatinib och läkemedel som inducerar CYP3A4 (t ex dexametason, fenytoin, karbamazepin, rifampicin, fenobarbital eller Hypericum perforatum, även känd som johannesört) kan signifikant minska exponeringen för Glivec och därigenom öka risken för terapisvikt. Därför skall samtidig användning av starka inducerare av CYP3A4 och imatinib undvikas (se avsnitt Interaktioner).
Hypotyreos
Kliniska fall av hypotyreos har rapporterats hos patienter som har genomgått tyreoidektomi och som får substitutionsterapi med levotyroxin under behandlingen med Glivec (se avsnitt Interaktioner). Thyroidstimulerande hormon (TSH)-nivåerna skall följas upp noggrant hos dessa patienter.
Levertoxicitet
Glivec metaboliseras huvudsakligen via levern och endast 13% av utsöndringen sker genom njurarna. Hos patienter med leverfunktionsrubbning (mild, måttlig eller svår) skall perifer blodstatus och leverenzymer övervakas noggrant (se avsnitten Dosering, Biverkningar och Farmakokinetik). Det skall noteras att GIST-patienter kan ha levermetastaser, som kan leda till nedsatt leverfunktion.
Fall med leverskada, inklusive leversvikt och levernekros, har observerats vid behandling med imatinib. När imatinib kombineras med kemoterapibehandlingar i högdos har en ökning av allvarliga leverreaktioner upptäckts. Leverfunktion skall monitoreras noggrant i de fall då imatinib kombineras med kemoterapibehandlingar som enligt vad man känner till också har samband med leverdysfunktion (se avsnitt Interaktioner och Biverkningar).
Vätskeretention
Svår vätskeretention (pleurautgjutning, ödem, lungödem, ascites, ytliga ödem) har rapporterats hos ungefär 2,5% av nydiagnostiserade KML-patienter som får behandling med Glivec. Patienterna skall därför vägas regelbundet. Oväntat snabb viktuppgång skall utredas noggrant och adekvat understödjande vård och terapeutiska åtgärder vidtas vid behov. Det var en ökad incidens av dessa händelser i kliniska studier på äldre personer och hos de som tidigare haft hjärtsjukdom. Därför skall man iaktta försiktighet hos patienter med nedsatt hjärtfunktion.
Patienter med hjärtsjukdomar
Patienter med hjärtsjukdomar, riskfaktorer för hjärtsvikt eller njursvikt i anamnesen skall monitoreras noggrant och alla patienter med tecken eller symtom, som överensstämmer med hjärtsvikt eller njursvikt skall utvärderas och behandlas.
Hos patienter med hypereosinofilt syndrom (HES) med ockult infiltration av HES-celler i hjärtmuskeln, har enstaka fall av kardiogen chock/vänster kammardysfunktion förknippats med degranulering av HES-celler i samband med inledande av imatinibbehandling. Tillståndet rapporterades vara reversibelt vid administration av systemiska steroider, åtgärder för cirkulatorisk support och temporärt uppehåll med imatinib. Eftersom hjärtbiverkningar rapporterats som ovanliga med imatinib, skall en noggrann bedömning av nytta/riskförhållandet för imatinibbehandling övervägas hos HES/CEL-populationen före behandlingens början.
Myelodysplastiska/myeloproliferativa sjukdomar förenat med rearrangemang av PDGFR-genen skulle kunna förknippas med höga eosinofil-nivåer. Utvärdering av en kardiologspecialist, utförande av ekokardiogram och bestämmande av troponin i serum skall därför övervägas hos patienter med HES/CEL och hos patienter med MDS/MPD i samband med höga eosinofil-nivåer innan imatinib ges. Om någotdera är onormalt, skall uppföljning av en kardiologspecialist och profylaktisk användning av systemiska steroider (1‑2 mg/kg) i en eller två veckor tillsammans med imatinib övervägas vid behandlingens början.
Gastrointestinala blödningar
I studien på patienter med icke-resercerbar och/eller metastaserande GIST rapporterades både gastrointestinala och intratumorala blödningar (se avsnitt Biverkningar). Baserat på tillgängliga data har inga faktorer (t ex tumörstorlek, tumörplacering, koagulationsrubbningar) identifierats, som identifierar patienter för en högre risk för någondera typen av blödningar. Eftersom ökad kärlteckning och risk för blödning är en del av naturalförloppet vid GIST, skall standardmetoder och procedurer tillämpas för monitorering och handhavande av blödningar hos alla patienter.
Dessutom har antrala kärlektasier (GAVE), en ovanlig orsak till gastrointestinal blödning, rapporterats efter marknadsintroduktion hos patienter med KML, ALL och andra sjukdomar (se avsnitt Biverkningar). Vid behov kan övervägas att avbryta behandlingen med Glivec.
Tumörlyssyndrom
På grund av en eventuell förekomst av tumörlyssyndrom (TLS) rekommenderas korrigering av dehydrering, om klinisk signifikant, samt behandling av höga urinsyranivåer före insättning av Glivec (se avsnitt Biverkningar).
Hepatit B-reaktivering
Hos kroniska bärare av hepatit B virus har reaktivering av hepatit B förekommit efter att dessa patienter fått BCR-ABL tyrosinkinashämmare. Vissa fall ledde till akut leversvikt eller fulminant hepatit med levertransplantation eller dödlig utgång som följd.
Patienter ska testas för HBV-infektion innan behandling med Glivec påbörjas. Specialister på leversjukdomar och på behandling av hepatit B bör konsulteras innan behandling påbörjas hos patienter som testats positivt för hepatit B-serologi (inräknat dem med aktiv sjukdom) och vid patienter som testas positivt för HBV-infektion under behandlingen. Bärare av HBV som behöver behandling med Glivec ska följas noga avseende tecken och symtom på aktiv HBV-infektion under hela behandlingen och i flera månader efter avslutad behandling (se avsnitt Biverkningar).
Fototoxicitet
Exponering för direkt solljus ska undvikas eller minimeras på grund av risken för fototoxicitet i samband med imatinibbehandling. Patienterna ska instrueras att använda skyddande kläder och solskyddsmedel med hög solskyddsfaktor (SPF).
Trombotisk mikroangiopati
BCR-ABL tyrosinkinashämmare (TKI) har associerats med trombotisk mikroangiopati (TMA), inkluderande individuella fallrapporter för Glivec (se avsnitt Biverkningar). Vid förekomst av laboratorie- eller kliniska fynd associerade med TMA hos en patient som får Glivec ska behandlingen avbrytas och grundlig utvärdering för TMA ska genomföras, inkluderande bestämning av ADAMTS13-aktivitet och anti-ADAMTS13-antikroppar. Om anti-ADAMTS13-antikropp är förhöjd i samband med att ADAMTS13-aktiviteten är låg ska behandling med Glivec inte återupptas.
Laboratorieundersökningar
Fullständig blodstatus skall kontrolleras regelbundet under behandling med Glivec. Glivec har förknippats med neutropeni eller trombocytopeni vid behandling av patienter med KML. Dessa cytopenier är dock troligen förknippade med den behandlade sjukdomens olika stadier och är därför vanligare hos patienter med KML i accelererad fas eller blastkris än hos patienter med KML i kronisk fas. Behandling med Glivec kan avbrytas eller dosen reduceras enligt rekommendationer i avsnitt Dosering.
Leverfunktionen (transaminaser, bilirubin, alkaliskt fosfatas) skall övervakas regelbundet hos patienter som får behandling med Glivec.
Hos patienter med nedsatt njurfunktion tycks plasmaexponeringen av imatinib vara högre än hos patienter med normal njurfunktion, förmodligen beroende på förhöjd plasmanivå av surt alfa-1 glykoprotein (AGP), ett protein som binder imatinib, hos dessa patienter. Patienter med nedsatt njurfunktion skall ges den lägsta startdosen. Patienter med kraftigt nedsatt njurfunktion skall behandlas med försiktighet. Dosen kan minskas om den inte tolereras (se avsnitt Dosering och Farmakokinetik).
Långtidsbehandling med imatinib kan vara förknippad med en kliniskt signifikant försämring av njurfunktionen. Njurfunktionen bör därför utvärderas före starten av imatinib-behandling och följas noga under behandling, med särskild uppmärksamhet på patienter med riskfaktorer för nedsatt njurfunktion. Om nedsatt njurfunktion observeras, bör lämplig hantering och behandling förskrivas i enlighet med standardiserade behandlingsriktlinjer.
Pediatrisk population
Det har förekommit fallbeskrivningsrapporter om tillväxthämning hos barn och ungdomar i förpuberteten som har fått imatinib. I en observationsstudie på den pediatriska KML populationen rapporterades en statistiskt signifikant minskning (men av osäker klinisk betydelse) i median längd standardavvikelsepoäng efter 12 och 24 månaders behandling i två små undergrupper oberoende av pubertal status och kön. Liknande resultat har noterats i en observationsstudie i den pediatriska ALL populationen. Noggrann övervakning av tillväxten hos barn som behandlats med imatinib rekommenderas (se avsnitt Biverkningar).
Interaktioner
Aktiva substanser som kan öka plasmakoncentrationen av imatinib
Substanser som hämmar aktiviteten av cytokrom P450-isoenzymet CYP3A4 (t ex proteashämmare såsom indinavir, lopinavir/ritonavir, ritonavir, sakvinavir, telaprevir, nelfinavir, boceprevir; antimykotikum inkluderande ketokonazol, itrakonazol, posakonazol, vorikonazol; vissa makrolider såsom erytromycin, klaritromycin och telitromycin) kan minska metabolismen och öka koncentrationen av imatinib. En signifikant ökning av exponeringen för imatinib noterades (genomsnittligt Cmax och AUC av imatinib ökade med 26 % respektive 40 %) hos friska individer när det gavs samtidigt med en enstaka dos ketokonazol (en CYP3A4-hämmare). Försiktighet skall iakttas när Glivec ges samtidigt som CYP3A4-hämmare.
Aktiva substanser som kan minska plasmakoncentrationen av imatinib
Substanser som inducerar CYP3A4-aktivitet (t ex dexametason, fenytoin, karbamazepin, rifampicin, fenobarbital, fosfenytoin, primidon eller Hypericum perforatum, även känd som johannesört) kan signifikant minska exponeringen för Glivec och därigenom öka risken för terapisvikt. Förbehandling med flera doser rifampicin, 600 mg dagligen, följt av en engångsdos Glivec om 400 mg, ledde till en minskning av Cmax och AUC(0–∞) med åtminstone 54% och 74% av respektive värde utan behandling med rifampicin. Liknande resultat har observerats hos patienter med maligna gliom som behandlades med Glivec samtidigt som de använde enzyminducerande antiepileptiska läkemedel (EIAED) såsom karbamazepin, oxkarbazepin och fenytoin. Plasma-AUC för imatinib minskade med 73% i jämförelse med patienter som inte stod på EIAED. Samtidig användning av rifampicin eller andra starka inducerare av CYP3A4 och imatinib skall undvikas.
Aktiva substanser vars plasmakoncentration kan förändras av Glivec
Imatinib ökar genomsnittligt Cmax och AUC för simvastatin (CYP3A4-substrat) 2 respektive 3,5 gånger, vilket visar att CYP3A4 hämmas av imatinib. Av denna anledning rekommenderas försiktighet när Glivec ges tillsammans med CYP3A4-substrat med snävt terapeutiskt intervall (t ex ciklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanyl, alfentanil, terfenadin, bortezomib, docetaxel och cinkonidin). Glivec kan öka plasmakoncentrationen av andra läkemedel som metaboliseras via 3A4 (t ex triazolobenzodiazepiner, kalciumantagonister av dihydropyridintyp, vissa HMG-CoA-reduktashämmare, dvs. statiner).
På grund av en känd ökad risk för blödningar i samband med användning av imatinib (t ex vid förlust av blod), skall patienter som behöver antikoagulation erhålla lågmolekylärt eller standardheparin, istället för kumarinderivat såsom warfarin.
Glivec hämmar aktiviteten av cytokrom P450-isoenzymet CYP2D6 in vitro vid koncentrationer jämförbara med dem som påverkar CYP3A4-aktivitet. 400 mg imatinib givet två gånger dagligen hade en hämmande effekt på CYP2D6-medierad metabolism av metoprolol, där Cmax och AUC för metoprolol ökade med ungefär 23% (90% KI [1,16-1,30]). Dosjusteringar verkar inte vara nödvändiga när imatinib ges tillsammans med substrat för CYP2D6, försiktighet rekommenderas emellertid för substrat för CYP2D6 med ett snävt terapeutiskt fönster såsom metoprolol. Klinisk övervakning bör övervägas för patienter som behandlas med metoprolol.
Glivec inhiberar paracetamols O-glukuronidering in vitro med Ki-värde på 58,5 mikromol/l. Denna inhibering har inte observerats in vivo vid administrering av Glivec 400 mg och paracetamol 1000 mg. Högre doser av Glivec och paracetamol har inte studerats.
Försiktighet skall därför iakttas när höga doser av Glivec och paracetamol används samtidigt.
Hos patienter som genomgått tyreoidektomi och som behandlas med levotyroxin, kan exponeringen av levotyroxin i plasma minskas vid samtidig behandling med Glivec (se avsnitt Varningar och försiktighet). Försiktighet rekommenderas därför. Emellertid, mekanismen för den observerade interaktionen är för närvarande okänd.
Det finns klinisk erfarenhet av samtidig administrering av Glivec och kemoterapi (se avsnitt Farmakodynamik) hos Ph+ ALL-patienter, men läkemedelsinteraktioner mellan imatinib- och kemoterapibehandlingar är inte väl karakteriserade. Biverkningar hos imatinib, t ex levertoxicitet, benmärgssuppression eller andra, kan öka och det har rapporterats att samtidigt användning av L-asparaginas skulle kunna vara förknippad med ökad levertoxicitet (se avsnitt Biverkningar). Därför krävs särskild försiktighet vid användning av Glivec i kombination.
Graviditet
Fertila kvinnor
Fertila kvinnor skall uppmanas å det bestämdaste att använda effektiv preventivmetod under behandlingen och under minst 15 dagar efter avslutad behandling med Glivec.
Graviditet
Det finns begränsad mängd data från behandling av gravida kvinnor med imatinib. Efter marknadsgodkännandet har det förekommit rapporter om spontana aborter och medfödda missbildningar från kvinnor som har tagit Glivec. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter). Risken för fostret är okänd. Glivec skall användas under graviditet endast då det är absolut nödvändigt. Om läkemedlet används under graviditet måste patienten informeras om risken för fostret.
Amning
Det finns begränsad information om imatinibs distribution i människomjölk. Studier på två ammande kvinnor visar att både imatinib och dess aktiva metabolit kan distribueras i människomjölk. Mjölk-plasma-ratio studerad i en enstaka patient bestämdes till 0,5 för imatinib och 0,9 for metaboliten, vilket tyder på större distribution av metaboliten i mjölken. Med hänsyn taget till total koncentration av imatinib och metabolit tillsammans och maximalt dygnsintag mjölk hos spädbarn skulle den totala exponeringen förväntas vara låg (~10% av en terapeutisk dos). Då effekt av exponering i låg dos på ett spädbarn är okänd bör dock kvinnor inte amma under behandling och under minst 15 dagar efter avslutad behandling med Glivec.
Fertilitet
I pre-kliniska studier, var fertilitet hos han- och honråttor ej påverkad, även om effekter på reproduktionsparametrar observerades (se avsnitt Prekliniska uppgifter). Humana studier på patienter som fått Glivec och effekten på fertilitet och gametogenes har inte utförts. Patienter som är oroliga över sin fertilitet vid behandling med Glivec bör rådgöra med läkare.
Trafik
Patienterna ska informeras om att de kan uppleva biverkningar som yrsel, dimsyn eller trötthet under behandlingen med imatinib. Därför skall man uppmana till försiktighet vid bilkörning eller användning av maskiner.
Biverkningar
Patienter med avancerade maligniteter kan ha flera andra symtom relaterade till grundsjukdomen, dess progression och samtidig behandling med flera andra läkemedel vilket försvårar bedömningen av ett eventuellt orsakssamband vid misstänkt biverkan.
Behandlingsavbrott på grund av läkemedelsrelaterade biverkningar i kliniska prövningar på KML observerades hos 2,4% av nyligen diagnostiserade patienter, 4% av patienter i sen kronisk fas efter att ha sviktat på interferonbehandling, 4% av patienter i accelererad fas efter att ha sviktat på interferonbehandling och 5% av patienter i blastkris efter att ha sviktat på interferonbehandling. Vid GIST avbröts användningen av studieläkemedlet på grund av läkemedelsrelaterade biverkningar hos 4% av patienterna.
Biverkningarna var likartade vid alla indikationer, med två undantag. Det förekom mer myelosuppression hos KML-patienterna än vid GIST, vilket troligen beror på den underliggande sjukdomen. I studien på patienter med icke-resercerbar och/eller metastaserande GIST upplevde 7 (5%) patienter GI-blödningar av Common Toxicity Criteria, CTC-nivå 3/4 (3 patienter), intratumorala blödningar (3 patienter) eller båda (1 patient). Lokaliseringen av GI-tumörerna kan ha varit ursprunget till GI-blödningarna (se avsnitt Varningar och försiktighet). Gastrointestinala och tumorala blödningar kan vara allvarliga och i vissa fall dödliga. De vanligast förekommande (≥10%) läkemedelsrelaterade biverkningarna i båda fallen var lätt illamående, kräkning, diarré, buksmärta, trötthet, myalgi, muskelkramper och hudutslag. Ytliga ödem var vanligt förekommande i alla studier och beskrevs i första hand såsom periorbitala eller underbensödem. Dessa ödem var dock sällan allvarliga och kunde behandlas med hjälp av diuretika och andra understödjande åtgärder eller genom minskning av Glivec-dosen.
När imatinib kombinerades med kemoterapi i högdos på Ph+ ALL-patienter observerades övergående levertoxicitet i form av förhöjning av transaminaser och hyperbilirubinemi. Med hänsyn till den begränsade säkerhetsdatabasen, så är de biverkningar som hittills rapporterats hos barn överensstämmande med den kända säkerhetsprofilen hos vuxna patienter med Ph+ ALL. Säkerhetsdatabasen för barn med Ph+ ALL är mycket begränsad, men inga nya säkerhetsproblem har identifierats.
Olika biverkningar såsom pleurautgjutning, ascites, lungödem och snabb viktuppgång med eller utan ytligt ödem kan sammantaget benämnas ”vätskeretention”. Dessa biverkningar kan vanligen hanteras genom att tillfälligt hålla inne behandlingen med Glivec och ge diuretika och andra adekvata understödjande åtgärder. I en del fall kan dock dessa biverkningar vara allvarliga eller livshotande och ett flertal patienter med blastkris dog med en komplex klinisk bild av pleurautgjutning, hjärtsvikt och njursvikt. Inga särskilda säkerhetsfynd noterades i kliniska prövningar på barn.
Biverkningar
Biverkningar som förekommer i mer än isolerade fall anges nedan, enligt organklass och frekvens. Frekvenskategorierna definieras utifrån följande konvention: Mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde i fallande frekvensordning.
Biverkningarna och deras frekvenser rapporteras i Tabell 1.
Tabell 1 Sammanfattning av biverkningar i tabellform
|
Infektioner och infestationer |
|
|
Mindrevanliga: |
Herpes zoster, herpes simplex, nasofaryngit, pneumoni1, sinuit, cellulit, övre luftvägsinfektion, influensa, urinvägsinfektion, gastroenterit, sepsis |
|
Sällsynta: |
Svampinfektion |
|
Ingen känd frekvens: |
Hepatit B-reaktivering* |
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
|
|
Sällsynta: |
Tumörlyssyndrom |
|
Ingen känd frekvens: |
Tumörblödning/tumörnekros* |
|
Immunsystemet |
|
|
Ingen känd frekvens: |
Anafylaktisk chock* |
|
Blodet och lymfsystemet |
|
|
Mycket vanliga: |
Neutropeni, trombocytopeni, anemi |
|
Vanliga: |
Pancytopeni, febril neutropeni |
|
Mindre vanliga: |
Trombocytemi, lymfopeni, benmärgsdepression, eosinofili, lymfadenopati |
|
Sällsynta: |
Hemolytisk anemi, trombotisk mikroangiopati |
|
Metabolism och nutrition |
|
|
Vanliga: |
Anorexi |
|
Mindrevanliga: |
Hypokalemi, ökad aptit, hypofosfatemi, minskad aptit, dehydrering, gikt, hyperurikemi, hyperkalcemi, hyperglykemi, hyponatremi |
|
Sällsynta: |
Hyperkalemi, hypomagnesemi |
|
Psykiska störningar |
|
|
Vanliga: |
Insomnia |
|
Mindrevanliga: |
Depression, minskad libido, ångest |
|
Sällsynta: |
Förvirring |
|
Centrala och perifera nervsystemet |
|
|
Mycket vanliga: |
Huvudvärk2 |
|
Vanliga: |
Yrsel, parestesier, smakstörning, hypestesi |
|
Mindre vanliga: |
Migrän, somnolens, synkope, perifer neuropati, nedsatt minnesförmåga, ischiassmärta, restless legs syndrom, tremor, hjärnblödning |
|
Sällsynta: |
Ökat intrakraniellt tryck, kramper, opticusneurit |
|
Ingen känd frekvens: |
Cerebralt ödem* |
|
Ögon: |
|
|
Vanliga: |
Ögonlocksödem, ökat tårflöde, bindhinneblödning, konjunktivit, torra ögon, dimsyn |
|
Mindre vanliga: |
Ögonirritation, ögonsmärta, orbitalt ödem, skleral blödning, näthinneblödning, blefarit, makulaödem |
|
Sällsynta: |
Katarakt, glaukom, papillödem |
|
Ingen känd frekvens: |
Blödning i glaskroppen* |
|
Öron och balansorgan |
|
|
Mindre vanliga: |
Yrsel, tinnitus, nedsatt hörsel |
|
Hjärtat |
|
|
Mindre vanliga: |
Palpitationer, takykardi, kronisk hjärtsvikt3, lungödem |
|
Sällsynta: |
Arytmi, förmaksflimmer, hjärtstillestånd, hjärtinfarkt, angina pectoris, perikardiell utgjutning |
|
Ingen känd frekvens: |
Perikardit*, hjärtsäckstamponad* |
|
Blodkärl4 |
|
|
Vanliga: |
Flushing, blödningar |
|
Mindre vanliga: |
Hypertoni, hematom, subduralhematom, perifer kyla, hypotoni, Raynauds fenomen |
|
Ingen känd frekvens: |
Trombos/embolism* |
|
Andningsvägar, bröstkorg och mediastinum |
|
|
Vanliga: |
Dyspné, epistaxis, hosta |
|
Mindre vanliga: |
Pleurautgjutning5, faryngolaryngal smärta, faryngit |
|
Sällsynta: |
Pleurasmärta, lungfibros, pulmonell hypertoni, lungblödning |
|
Ingen känd frekvens: |
Akut respiratorisk svikt11*, interstitiell lungsjukdom* |
|
Magtarmkanalen |
|
|
Mycketvanliga: |
Illamående, diarré, kräkningar, dyspepsi, buksmärta6 |
|
Vanliga: |
Flatulens, utspänd buk, gastroesofageal reflux, förstoppning, muntorrhet, gastrit |
|
Mindre vanliga: |
Stomatit, sår i munnen, gastrointestinal blödning7, rapning, melena, esofagit, ascites, magsår, hematemes, keilit, dysfagi, pankreatit |
|
Sällsynta: |
Kolit, ileus, inflammatorisk tarmsjukdom |
|
Ingen känd frekvens: |
Ileus/tarmobstruktion*, gastrointestinal perforation*, divertikulit*, antrala kärlektasier (GAVE)* |
|
Lever och gallvägar |
|
|
Vanliga: |
Förhöjda leverenzymvärden |
|
Mindre vanliga: |
Hyperbilirubinemi, hepatit, gulsot |
|
Sällsynta: |
Leversvikt8, levernekros |
|
Hud och subkutan vävnad |
|
|
Mycket vanliga: |
Periorbitalt ödem, dermatit/eksem/utslag |
|
Vanliga: |
Klåda, ansiktsödem, torr hud, erytem, alopeci, nattliga svettningar, ljuskänslighetsreaktion |
|
Mindre vanliga: |
Pustulöst utslag, kontusion, ökad svettning, urtikaria, ekkymos, ökad tendens till blåmärken, hypotrikos, hypopigmentering av huden, exfoliativ dermatit, spruckna naglar, follikulit, petekier, psoriasis, purpura, hyperpigmentering av huden, bullöst utslag, pannikulit12 |
|
Sällsynta: |
Akut febril neutrofil dermatos (Sweet’s syndrom), missfärgning av naglar, angioödem, vesikulärutslag, erytema multiforme, leukocytoklastisk vaskulit, Stevens-Johnsons syndrom, akut generaliserad exantematös pustulos (AGEP), pemfigus* |
|
Ingen känd frekvens: |
Palmar-plantar erytrodysestesi syndrom*, likenoid keratos*, lichen planus*, toxisk epidermal nekrolys*, läkemedelsrelaterade utslag med eosinofili och systemiska symtom (DRESS)*, pseudoporfyri* |
|
Muskuloskeletala systemet och bindväv |
|
|
Mycket vanliga: |
Muskelspasm och kramper, muskel- och skelettsmärta inklusive myalgi9, ledvärk, skelettsmärta10 |
|
Vanliga: |
Ledsvullnad |
|
Mindre vanliga: |
Styvhet i leder och muskler, osteonekros* |
|
Sällsynta: |
Muskelsvaghet, artrit, rabdomyolys/myopati |
|
Ingen känd frekvens: |
Tillväxthämning hos barn* |
|
Njurar och urinvägar |
|
|
Mindre vanliga: |
Njursmärta, hematuri, akut njursvikt, ökad frekvens urintömningar |
|
Ingen känd frekvens: |
Kronisk njursvikt |
|
Reproduktionsorgan och bröstkörtel |
|
|
Mindrevanliga: |
Gynekomasti, erektil dysfunktion, menorragi, oregelbunden menstruation, sexuell dysfunktion, ömma bröstvårtor, bröstförstoring, skrotumödem |
|
Sällsynta: |
Blödning i gulkropp/blödande ovarialcysta |
|
Allmännasymtomoch/ellersymtomvidadministreringsstället |
|
|
Mycketvanliga: |
Vätskeretention och ödem, trötthet |
|
Vanliga: |
Svaghet, pyrexi, anasarka, rysningar, stelhet |
|
Mindrevanliga: |
Bröstsmärta, allmän sjukdomskänsla |
|
Undersökningar |
|
|
Mycket vanliga: |
Viktökning |
|
Vanliga: |
Viktnedgång |
|
Mindre vanliga: |
Ökning av kreatinin i blod, ökning av kreatininfosfokinas i blod, ökning av laktatdehydrogenas i blod, ökning av alkaliskt fosfatas i blod |
|
Sällsynta: |
Ökning av amylas i blod |
|
* Dessa typer av biverkningar har framförallt rapporterats baserat på erfarenhet efter introduktionen av Glivec på marknaden. Detta inkluderar spontana fallrapporter samt allvarliga oönskade händelser i pågående studier, expanded access program, kliniska farmakologiska studier och forskningsstudier på icke godkända indikationer. Eftersom dessa biverkningar har rapporterats från en population av okänd storlek har det inte alltid varit möjligt att fastställa deras frekvens eller etablera kausalsamband med imatinibbehandlingen. 1 Pneumoni rapporterades oftast hos patienter med transformerad KML och hos patienter med GIST. 2 Huvudvärk var vanligast hos patienter med GIST. 3 Beräknat på patientår var hjärtbiverkningar inklusive kronisk hjärtsvikt vanligare hos patienter med transformerad KML än hos patienter med kronisk KML. 4 Flushing var vanligast hos patienter med GIST och blödningar (hematom, hemorragi) var vanligast hos patienter med GIST och med transformerad KML (KML-AP och KML-BC). 5 Pleurautgjutning rapporterades oftare för patienter med GIST eller transformerad KML (KML-AP och KML-BC) än för patienter med kronisk KML. 6+7 Buksmärta och gastrointestinal blödning sågs oftare hos patienter med GIST. 8 Ett antal dödsfall i leversvikt och levernekros har rapporterats. 9 Muskel- och skelettsmärta under behandling eller efter avslutad behandling med imatinib har observerats efter marknadsintroduktion. 10 Muskel- och skelettsmärta och besläktade biverkningar sågs oftare hos patienter med KML än hos patienter med GIST. 11 Fall med dödlig utgång har rapporterats hos patienter med framskriden sjukdom, allvarliga infektioner, kraftig neutropeni och andra allvarliga sjukdomar. 12 Inklusive erythema nodosum (knölros). |
|
Avvikelser i laboratorieundersökningar
Hematologi
I KML har cytopenier, särskilt neutropeni och trombocytopeni, varit ett genomgående fynd i alla studier och frekvensen tycks öka vid höga doser ≥750 mg (fas I-studie). Dock var förekomst av cytopeni klart beroende av sjukdomens stadium. Förekomsten av neutropeni av grad 3 eller 4 (ANC <1,0x109/l) och trombocytopeni (trombocytnivåer <50x109/l) var 4 till 6 gånger högre vid blastkris och i accelererad fas (59–64% respektive 44–63% för neutropeni och trombocytopeni) än hos patienter med nyligen diagnostiserad KML i kronisk fas (16,7% neutropeni och 8,9% trombocytopeni). Hos patienter med nyligen diagnostiserad KML i kronisk fas observerades neutropeni av grad 4 (ANC <0,5x109/l) och trombocytopeni (trombocyter <10x109/l) hos 3,6% respektive <1% av patienterna. Mediandurationen av de neutropena och trombocytopena episoderna var vanligtvis 2 till 3 veckor respektive 3 till 4 veckor. Dessa händelser kan vanligen åtgärdas med antingen dosminskning eller uppehåll av Glivec-behandlingen. Endast i sällsynta fall kan det krävas permanent behandlingsavbrott. Hos barn med KML observerades de mest frekventa toxiciteterna vara grad 3- eller grad 4-cytopenier innefattande neutropenier, trombocytopenier och anemier. Dessa uppträder i allmänhet inom de första behandlingsmånaderna.
I studien på patienter med icke-resercerbar och/eller metastaserande GIST rapporterades anemier av grad 3 och 4 hos 5,4% respektive 0,7% av patienterna. Detta kan ha varit relaterat till gastrointestinal eller intra-tumoral blödning hos åtminstone några av dessa patienter. Neutropenier av grad 3 och 4 sågs hos 7,5% respektive 2,7% av patienterna och trombocytopeni av grad 3 hos 0,7% av patienterna. Ingen patient utvecklade trombocytopeni av grad 4. Minskningen i vita blodkroppar (WBC) och antal neutrofiler uppstod huvudsakligen under de första sex veckorna av behandlingen och med relativt stabila värden därefter.
Biokemi
Kraftig förhöjning av transaminaser (< 5 %) eller bilirubin (< 1 %) sågs hos KML-patienterna och kunde vanligen åtgärdas genom dosreduktion eller behandlingsuppehåll (mediandurationen av dessa episoder var ungefär en vecka). Behandlingen avbröts permanent på grund av avvikande värden på leverprover hos mindre än 1 % av KML-patienterna. Hos GIST-patienter (studie B2222), observerades 6,8 % ALAT (alaninaminotransferas)-förhöjningar av grad 3 eller 4 och 4,8 % ASAT (aspartataminotransferas)-förhöjningar av grad 3 eller 4. Förhöjning av bilirubin var under 3 %.
Det har förekommit fall av cytolytisk och kolestatisk hepatit och leversvikt, som i något fall var dödligt, inklusive en patient behandlad med högdos paracetamol.
Beskrivning av valda biverkningar
Hepatit B-reaktivering
Hepatit B-reaktivering har rapporterats i samband med BCR-ABL TKI. Vissa fall ledde till akut leversvikt eller fulminant hepatit med levertransplantation eller dödlig utgång som följd (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Erfarenhet av doser högre än rekommenderad terapeutisk dos är begränsad. Enstaka fall av överdos med Glivec har rapporterats spontant och i litteraturen. I händelse av överdos ska patienten observeras och lämplig symptomatisk behandling ges. I allmänhet rapporterades utgången av dessa fall som “förbättring” eller “återställd”. Händelser som har rapporterats vid olika dosintervall är följande:
Vuxen population
1200 till 1600 mg (duration varierande mellan 1 till 10 dagar): Illamående, kräkningar, diarré, utslag, hudrodnad, ödem, svullnad, trötthet, muskelkramper, trombocytopeni, pancytopeni, buksmärta, huvudvärk, minskad aptit.
1800 till 3200 mg (upp till 3200 mg dagligen i 6 dagar): Svaghet, myalgi, ökat kreatinfosfokinas, ökat bilirubin, magtarmsmärta.
6400 mg (singeldos): Ett fall rapporterad i litteraturen om en patient som fick illamående, kräkningar, buksmärta, pyrexi, ansiktssvullnad, minskat antal neutrofiler, förhöjda transaminaser.
8 till 10 g (singeldos): Kräkningar och mag-tarmsmärta har rapporterats.
Pediatrisk population
En 3-årig pojke exponerad för en singeldos på 400 mg fick kräkningar, diarré och anorexi och en annan 3-årig pojke exponerad för en singeldos på 980 mg fick minskat antal vita blodkroppar och diarré.
I händelse av överdos skall patienten observeras och adekvat understödjande behandling ges.
Farmakodynamik
Verkningsmekanism
Imatinib är en lågmolekylär protein-tyrosinkinashämmare med kraftigt hämmande effekt på aktiviteten hos Bcr-Abl-tyrosinkinas (TK) samt flera TK-receptorer: KIT, stamcellsfaktorreceptorn (SCF) som kodas av c-Kit protoonkogen, discoidin domain receptors (DDR1 och DDR2), kolonistimulerande kofaktorreceptorn (CSF-1R) och trombocytorelaterad tillväxtfaktorreceptorerna alfa och beta (platelet-derived growth factor receptors alpha and beta, PDGFR-alpha and PDGFR-beta). Imatinib kan också hämma cellulära händelser som är medierade av aktivering av dessa receptorkinaser.
Farmakodynamisk effekt
Imatinib är en protein-tyrosinkinashämmare med kraftigt hämmande effekt på Bcr-Abl-tyrosinkinas in vitro, på cellulär nivå och in vivo. Substansen hämmar proliferation selektivt och inducerar apoptos hos såväl Bcr-Abl-positiva cellinjer som hos färska leukemiska celler från patienter med Philadelphiakromosom-positiv KML och akut lymfoblastleukemi (ALL).
In vivo uppvisar ämnet anti-tumöraktivitet givet som enda agens i djurmodeller med Bcr-Abl-positiva tumörceller.
Imatinib är också en hämmare av receptor-tyrosinkinaserna för trombocytrelaterad tillväxtfaktor (platelet-derived growth factor, PDGF), PDGF-R och stamcellsfaktor (SCF), c-Kit och hämmar PDGF- och SCF-medierade cellhändelser. Imatinib hämmar proliferationen in vitro och inducerar apoptos i gastrointestinala stromacellstumörer (GIST), som uttrycker en aktiverande kit-mutation. Uppkommen aktivering av PDGF-receptorn eller Abl protein-tyrosinkinaserna som en konsekvens av fusion med diverse partnerproteiner eller uppkommen produktion av PDGF har satts i samband med patogenesen av MDS/MPD, HES/CEL och DFSP. Imatinib inhiberar signalering och proliferation av celler som drivs av oreglerad PDGFR och Abl kinas-aktivitet.
Kliniska studier vid kronisk myeloisk leukemi
Effekten av Glivec baseras på det sammantagna hematologiska och cytogenetiska svaret samt på progressionsfri överlevnad. Förutom vid nyligen diagnostiserad KML i kronisk fas finns inga kontrollerade studier som visar på en klinisk nytta, såsom förbättring av sjukdomsrelaterade symtom eller ökad överlevnad.
Tre stora, internationella, öppna, icke-kontrollerade fas II-studier har genomförts på patienter med Philadelphiakromosom-positiv (Ph+)-KML i avancerad, blast- eller accelererad fas eller KML i kronisk fas vid terapisvikt med interferon alfa-terapi (IFN). En stor, internationell, öppen, multicenter, randomiserad fas III-studie har genomförts på patienter med nyligen diagnostiserad (Ph+)-KML. Dessutom har barn behandlats i två fas I-studier och en fas II-studie.
I samtliga kliniska studier var 38-40% av patienterna ≥60 års ålder och 10–12% av patienterna var ≥70 års ålder.
Kronisk fas, nyligen diagnostiserade
Denna fas III-studie på vuxna patienter jämförde behandlingen med endera enbart Glivec eller en kombination av interferon-alfa (IFN) och cytarabin (Ara-C). Patienter som uppvisade bristande respons på behandlingen (brist på fullständigt hematologiskt svar (FHS) efter 6 månader, ökande antal vita blodkroppar, inget betydande cytogenetiskt svar (BCyS) efter 24 månader), utebliven respons (förlust av FHS eller BCyS) eller allvarlig intolerans för behandlingen tilläts övergå till den alternativa behandlingsarmen. I Glivec-armen behandlades patienterna med 400 mg dagligen. I IFN-armen behandlades patienterna med en måldos av IFN på 5 MIE/m2/dag subkutant i kombination med subkutant Ara-C 20 mg/m2/dag under 10 dagar/månad.
Totalt 1 106 patienter randomiserades, 553 i vardera armen. Karakteristika vid baslinjen var väl balanserade mellan de båda armarna. Medianåldern var 51 år (18–70 år), varav 21,9% av patienterna ≥ 60 års ålder. Det fanns 59% män och 41% kvinnor; 89,9% kaukasiska och 4,7% svarta patienter. Sju år efter rekrytering av den sista patienten var mediandurationen för förstahandsbehandling 82 respektive 8 månader för Glivec- respektive IFN-armarna. Medianduration för andrahandsbehandling med Glivec var 64 månader. Totalt sett var den genomsnittliga administrerade dygnsdosen 406 ± 76 mg för alla patienter som fick Glivec som försthandsbehandling. Det primära effektmåttet i denna studie är progressionsfri överlevnad. Progression definierades som någon av följande händelser: progression till accelererad fas eller blastkris, död, brist på FHS eller BCyS eller hos patienter som inte uppnådde FHS, ett ökande antal vita blodkroppar trots tillbörlig behandling. Betydande cytogenetiskt svar, hematologiskt svar, molekylärt svar (evaluering av minimal kvarvarande sjukdom) tid till accelererad fas eller blastkris och överlevnad är de huvudsakliga sekundära effektmåtten. Behandlingssvar redovisas i Tabell 2.
Tabell 2 Svar i studie av nyligen diagnostiserad KML (data vid 84 månader)
|
(Bästa behandlingssvar) |
Glivec n=553 |
IFN+Ara - C n=553 |
|
Hematologiskt svar |
||
|
FHS n (%) |
534 (96,6%) * |
313 (56,6%) * |
|
[95% KI] |
[94,7%, 97,9%] |
[52,4%, 60,8%] |
|
Cytogenetiskt svar |
||
|
Betydande svar n (%) |
490 (88,6%) * |
129 (23,3%) * |
|
[95% KI] |
[85,7%, 91,1%] |
[19,9%, 27,1%] |
|
Fullständigt CyS n (%) |
456 (82,5%) * |
64 (11,6%) * |
|
Partiellt CyS n (%) |
34 (6,1%) |
65 (11,8%) |
|
Molekylärt svar** |
||
|
Betydande svar vid 12 månader (%) |
153/305=50,2% |
8/83=9,6% |
|
Betydande svar vid 24 månader (%) |
73/104=70,2% |
3/12=25% |
|
Betydande svar vid 84 månader (%) |
102/116=87,9% |
3/4=75% |
|
* p<0,001, Fischer’s exact test ** procenttal för molekylärt svar baseras på tillgängliga prover. Hematologiska svarskriterier (alla svar skall bekräftas efter ≥4 veckor): WBC <10x109/l, trombocyter <450x109/l, myelocyter+metamyelocyter <5% i blod, inga blaster eller promyelocyter i blod, basofiler <20%, inget extramedullärt engagemang. Kriterier för cytogenetiskt svar: Fullständigt (0% Ph+metafaser), partiellt (1–35%), litet (36–65%) eller minimalt (66–95%). Betydande svar (0–35%) innefattar både fullständiga och partiella svar. Kriterier för betydande molekylärt svar: minskning med ≥3 logaritmer av mängden Bcr-Abl-transkript (mätt med PCR-analys i realtid av kvantitativ omvänd transkriptas) i perifert blod över en standardiserad baseline. |
||
Frekvenser för fullständigt hematologiskt svar, betydande cytogenetiskt svar och fullständigt cytogenetiskt svar vid förstahandsbehandling uppskattades med Kaplan-Meier-analys där patienter som inte svarade på behandling uteslöts vid datum för sista undersökningen. Uppskattade kumulativa frekvenser enligt Kaplan-Meier för förstahandsbehandling med Glivec förbättrades från 12 månaders behandling till 84 månaders behandling enligt följande: FHS från 96,4% till 98,4% respektive FCyS från 69,5% till 87,2%.
Efter 7 års uppföljning sågs 93 (16,8%) progressionshändelser i Glivec-armen, av vilka progression till accelererad fas/blastkris sågs i 37 fall (6,7%), uteblivet betydande CyS i 31 fall (5,6%), uteblivet FHS eller ökning av antalet vita blodkroppar i 15 fall (2,7%) och död som inte var KML-relaterad i 10 fall (1,8%). I IFN-AraC-armen sågs 165 (29,8%) händelser, av vilka 130 uppträdde under förstahandsbehandling med IFN+Ara-C.
Den uppskattade andelen patienter som är fria från progression till accelererad fas eller blastkris efter 84 månader var signifikant högre i Glivec-armen jämfört med i IFN-armen (92,5% mot 85,1%), (p<0,001). Progressionsfrekvensen/år till accelererad fas eller blastkris minskade med behandlingstidens längd och var mindre än 1% årligen under det fjärde och femte året. Den uppskattade andelen progressionsfri överlevnad vid 84 månader var 81,2% i Glivec-armen och 60,6% i kontrollarmen (p<0,001). Progressionsfrekvensen per år för någon typ med Glivec minskade också över tiden.
Totalt avled 71 (12,8%) respektive 85 (15,4%) patienter i Glivec- respektive IFN+Ara-C-grupperna. Vid 84 månader var total uppskattad överlevnad 86,4% (83, 90) respektive 83,3% (80, 87) i de randomiserade Glivec- och IFN+Ara-C-grupperna (p=0,073, log-rank-test). Detta effektmått, tid till händelse, är i hög grad påverkat av den höga andelen patienter som korsades över från IFN+Ara-C till Glivec. Effekten av Glivec-behandling på överlevnad vid nyligen diagnostiserad KML i kronisk fas har undersökts ytterligare i en retrospektiv analys av ovan rapporterade Glivec-data med primärdata från en annan fas III-studie med IFN+Ara-C (n=325) i en identisk behandlingsregim. I denna retrospektiva analys visades Glivecs överlägsenhet över IFN+Ara-C med avseende på total överlevnad (p<0,001). Inom 42 månader hade 47 (8,5%) av Glivec-patienterna och 63 (19,4%) av IFN+Ara-C-patienterna avlidit.
Graden av cytogenetiskt svar och molekylärt svar hade en tydlig effekt på långtidsresultatet för patienter på Glivec. Medan uppskattningsvis 96% (93%) av patienterna med fullständigt CyS (partiellt Cys) vid 12 månader inte hade genomgått progression till accelererad fas/blastkris vid 84 månader var bara 81% av patienterna utan betydande CyS vid 12 månader fria från progression till avancerad KML vid 84 månader (p<0,001 totalt, p=0,25 mellan FCyS och PCyS). För patienter med minskning i Bcr-Abl-transkript med minst 3 logaritmer vid 12 månader, uppskattades sannolikheten för fortsatt progressionsfrihet till accelererad fas/blastkris till 99% vid 84 månader. Liknande resultat sågs vid en riktmärkesanalys efter 18 månader.
I denna studie tilläts dosökningar från 400 mg dagligen till 600 mg dagligen och sedan från 600 mg dagligen till 800 mg dagligen. Efter 42 månaders uppföljning, hade 11 patienter en bekräftad (inom 4 veckor) förlust av sitt cytogenetiska svar. Av dessa 11 patienter upptitrerades 4 patienter till 800 mg dagligen och 2 av dessa återfick sitt cytogenetiska svar (1 partiellt och 1 komplett, den senare uppnådde även ett molekylärt svar), medan av de 7 patienterna som inte upptitrerades återfick endast en komplett cytogenetisk svar. Procenttalet för vissa biverkningar var högre hos de 40 patienterna som upptitrerades till 800 mg dagligen jämfört med patientpopulationen före dosökningen (n=551). De mer frekventa biverkningarna inkluderade gastrointestinala blödningar, konjuktivit och förhöjning av transaminaser eller bilirubin. Andra biverkningar rapporterades med lägre eller lika frekvens.
Kronisk fas, behandlingssvikt med interferonbehandling
532 vuxna patienter behandlades med en startdos på 400 mg. Patienterna fördelades på tre huvudkategorier: behandlingssvikt hematologiskt (29%), cytogenetiskt (35%) och intolerans mot interferon (36%). Patienterna hade tidigare fått IFN-behandling (medianlängd på behandlingen 14 månader) i doser ≥25 x106 IE/vecka och var alla i sen kronisk fas med en mediantid från diagnos på 32 månader. Den primära effektvariabeln i studien var andelen patienter med betydande cytogenetiskt svar (fullständigt plus partiellt svar, 0 till 35% (Ph+)-metafas i benmärgen).
I denna studie uppvisade 65% av patienterna ett betydande cytogenetiskt svar som var fullständigt hos 53% (43% bekräftade) av patienterna (Tabell 3). Fullständigt hematologiskt svar erhölls hos 95% av patienterna.
Accelererad fas
235 vuxna patienter med sjukdom i accelererad fas inkluderades. De första 77 patienterna inledde behandlingen med 400 mg varefter protokollet ändrades för att medge högre dosering och de återstående 158 patienterna började med 600 mg.
Den primära effektvariabeln var andelen patienter med hematologiskt svar, rapporterat antingen som fullständigt hematologiskt svar, inga tecken på leukemi (dvs. frånvaro av blaster i märg och perifert blod men utan fullständig remission i perifert blod som vid fullständigt svar) eller återgång till kronisk fas av KML. Bekräftat hematologiskt svar erhölls hos 71,5% av patienterna (Tabell 3). Det är också viktigt att påpeka att 27,7% av patienterna dessutom uppvisade ett betydande cytogenetiskt svar som var fullständigt hos 20,4% (16% bekräftade) av patienterna. För de patienter som behandlades med 600 mg var den nuvarande uppskattade graden av medianöverlevnad utan sjukdomsprogression och överlevnad totalt 22,9 respektive 42,5 månader.
Myeloisk blastkris
260 patienter med myeloisk blastkris inkluderades. 95 (37%) hade tidigare fått kemoterapi för behandling av antingen accelererad fas eller blastkris (”förbehandlade patienter”), medan 165 (63%) inte hade fått detta (”obehandlade patienter”). De första 37 patienterna inledde behandlingen med en dos om 400 mg varefter protokollet ändrades för att medge högre dosering och de återstående 223 patienterna började med 600 mg.
Den primära effektvariabeln var graden av hematologiskt svar, rapporterat antingen som fullständigt hematologisk remission, inga tecken till leukemi, eller återgång till KML i kronisk fas enligt samma kriterier som studien avseende accelererad fas. I denna studie uppvisade 31% av patienterna ett hematologiskt svar (36% hos tidigare obehandlade patienter och 22% hos tidigare behandlade patienter). Svarsfrekvensen var också högre hos patienter som behandlades med 600 mg (33%) än hos patienter som fick 400 mg (16%, p=0,0220). Den aktuella uppskattningen av medianöverlevnad för tidigare obehandlade och behandlade patienter är 7,7 respektive 4,7 månader.
Lymfoid blastkris
Ett begränsat antal patienter rekryterades i fas I-studier (n=10). Det hematologiska svaret var 70% med en duration på 2-3 månader.
Tabell 3 Behandlingssvar i KML- studier på vuxna
|
Studie 0110 37-månaders data Kronisk fas, Misslyckad IFN-behandling (n=532) |
Studie 0109 40,5-månaders data Accelererad fas (n=235) |
Studie 0102 38-månaders data Myeloisk blastkris (n=260) |
|
|
% av patienterna (KI95%) |
|||
|
Hematologiskt svar1 |
95% (92,3-96,3) |
71% (65,3-77,2) |
31% (25,2-36,8) |
|
Fullständigt hematologiskt svar (FHS) |
95% |
42% |
8% |
|
Inga tecken till leukemi (ITL) |
Inte tillämpligt |
12% |
5% |
|
Återgång till kronisk fas (ÅTK) |
Inte tillämpligt |
17% |
18% |
|
Betydande cytogenetiskt svar2 |
65% (61,2-69,5) |
28% (22,0-33,9) |
15% (11,2-20,4) |
|
Fullständigt |
53% |
20% |
7% |
|
(Bekräftat3) [95% KI] |
(43%) [38,6-47,2] |
(16%) [11,3-21,0] |
(2%) [0,6-4,4] |
|
Partiellt |
12% |
7% |
8% |
|
1 Hematologiska svarskriterier (alla svar skall bekräftas efter ≥ 4 veckor): FHS: Studie 0110 [Vita blodkroppar <10x109/l, trombocyter <450x109/l, myelocyter + metamyelocyter <5% i blod, inga blaster och promyelocyter i blod, basofiler <20%, inget extramedullärt engagemang] och i studier 0102 och 0109 [ANC ≥1,5x109/l, trombocyter ≥100x109/l, inga blaster i blod, benmärgsblaster <5% och ingen extramedullär sjukdom] ITL: Samma kriterier som för FHS men ANC ≥1x109/l och trombocyter ≥20x109/l (enbart 0102 och 0109) ÅTK: <15% blaster i benmärg och perifert blod, <30% blaster + promyelocyter i benmärg och perifert blod, <20% basofiler i perifert blod, ingen extramedullär sjukdom förutom mjälte och lever (enbart i 0102 och 0109). 2 Kriterier för cytogenetiskt svar: Ett betydande svar innefattar både fullständigt och partiellt svar: Fullständigt [0% (Ph+)-metafaser], partiellt (1–35%). 3 Fullständigt cytogenetiskt svar bekräftat genom en andra cytogenetisk utvärdering av benmärgen utförd åtminstone en månad efter den ursprungliga benmärgsstudien. |
|||
Pediatrisk population
Totalt 26 pediatriska patienter <18 års ålder, med endera KML i kronisk fas (n=11) eller KML i blastkris eller (Ph+)-akuta leukemier (n=15) rekryterades till en gradvis dosökande fas I-prövning. Detta var en population av tungt förbehandlade patienter, eftersom 46% hade tidigare genomgått en benmärgstransplantation, BMT och 73% kombinationskemoterapi. Patienterna behandlades med doser av Glivec om 260 mg/m2/dag (n=5), 340 mg/m2/dag (n=9), 440 mg/m2/dag (n=7) och 570 mg/m2/dag (n=5). Av 9 patienter med KML i kronisk fas och tillgängliga cytogenetiska data, uppnådde 4 (44%) respektive 3 (33%) ett fullständigt respektive partiellt cytogenetiskt svar, med ett behandlingssvar av BCyS på 77%.
Totalt 51 barn med nyligen diagnosticerad och obehandlad KML i kronisk fas har enrollerats i en öppen, multicenter, enkelarmad fas II-studie. Patienter behandlades med Glivec om 340 mg/m2/dag, utan avbrott i frånvaro av dosbegränsande toxicitet. Glivec-behandling inducerar ett snabbt svar hos nyligen diagnosticerade barn med KML med ett FHS om 78% efter 8 veckors behandling. Den höga graden av FHS åtföljs av utveckling av ett fullständigt cytogenetiskt svar (FCyS) om 65% vilket är jämförbart med resultaten som observerats hos vuxna. Dessutom observerades ett partiellt cytogenetiskt svar (PCyS) hos 16% för ett BCyS om 81%. Majoriteten av patienterna som nådde ett FCyS utvecklade FCyS mellan månaderna 3 och 10 med en mediantid till svar baserat på Kaplan-Meier-estimat på 5,6 månader.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Glivec för alla grupper av den pediatriska populationen för Philadelphiakromosom- (bcr-abl translokation)-positiv kronisk myeloisk leukemi (information om pediatrisk användning finns i avsnitt Dosering).
Kliniska studier vid Ph+ ALL
Nydiagnostiserade Ph+ ALL
I en kontrollerad studie (ADE10) på induktion av imatinib kontra kemoterapi på 55 nydiagnostiserade patienter som var 55 år och äldre, inducerade imatinib, använt som monoterapi, fullständigt hematologiskt svar i väsentligt högre grad än kemoterapi (96,3% kontra 50%; p=0,0001). När räddningsbehandling med imatinib administrerades på patienter som inte svarade på, alternativt svarade dåligt på kemoterapi, ledde detta till att 9 (81,8%) av 11 patienter uppnådde fullständigt hematologiskt svar. Denna kliniska effekt sammankopplades med högre reduktion av bcr-abl-transkript hos de patienter som behandlats med imatinib än för kemoterapiarmen efter 2 veckors behandling (p=0,02). Samtliga patienter fick imatinib och konsolideringskemoterapi (se Tabell 4) efter induktion och nivåerna av bcr-abl-transkript var identiska för de två armarna vid 8 veckor. Som förväntat på grund av studiens utformning, observerades ingen skillnad i remissionsduration eller sjukdomsfri och total överlevnad, trots att patienter med fullständigt molekylärt svar och fortsatt minimal resterande sjukdom, hade bättre utfall både när det gäller remissionsduration (p=0,01) och sjukdomsfri överlevnad (p=0,02).
Resultaten som observerades i en population på 211 nydiagnostiserade Ph+ ALL-patienter i fyra okontrollerade kliniska studier (AAU02, ADE04, AJP01 och AUS01) stämmer överens med resultaten som beskrivs ovan. Imatinib kombinerat med kemoterapiinduktion (se Tabell 4) ledde till en frekvens på 93% för fullständigt hematologiskt svar (147 av 158 utvärderbara patienter) och 90% för betydande cytogenetiskt svar (19 av 21 utvärderbara patienter). Frekvensen var 48% för fullständigt molekylärt svar (49 av 102 utvärderbara patienter). Sjukdomsfri överlevnad (SFÖ) och total överlevnad (TÖ) överskred konstant 1 år och var större än historiska kontroller (SFÖ p<0,001; TÖ p<0,0001) i två studier (AJP01 och AUS01).
Tabell 4 Kemoterapi-behandling i kombination med imatinib
|
Studie ADE10 |
|
|
Förberedande fas |
DEX 10 mg/m2 oral, dagar 1-5; CP 200 mg/m2 i.v., dagar 3, 4, 5; MTX 12 mg intratekal, dag 1 |
|
Remissionsinduktion |
DEX 10 mg/m2 oral, dagar 6-7, 13-16; VCR 1 mg i.v., dagar 7, 14; IDA 8 mg/m2 i.v. (0.5 tim), dagar 7, 8, 14, 15; CP 500 mg/m2 i.v.(1 tim) dag 1; Ara-C 60 mg/m2 i.v., dagar 22-25, 29-32 |
|
Konsolideringsbehandling I, III, V |
MTX 500 mg/m2 i.v. (24 tim), dagar 1, 15; 6-MP 25 mg/m2 oral, dagar 1-20 |
|
Konsolideringsbehandling II, IV |
Ara-C 75 mg/m2 i.v. (1 tim), dagar 1-5; VM26 60 mg/m2 i.v. (1 tim), dagar 1-5 |
|
Study AAU02 |
|
|
Induktionsbehandling (de novo Ph+ ALL) |
Daunorubicin 30 mg/m2 i.v., dagar 1-3, 15-16; VCR 2 mg total dos i.v., dagar 1, 8, 15, 22; CP 750 mg/m2 i.v., dagar 1, 8; Prednison 60 mg/m2 oral, dagar 1-7, 15-21; IDA 9 mg/m2 oral, dagar 1-28; MTX 15 mg intratekal, dagar 1, 8, 15, 22; Ara-C 40 mg intratekal, dagar 1, 8, 15, 22; Metylprednisolon 40 mg intratekal, dagar 1, 8, 15, 22 |
|
Konsolidering (de novo Ph+ ALL) |
Ara-C 1 000 mg/m2/12 h i.v.(3 tim), dagar 1-4; Mitoxantron 10 mg/m2 i.v. dagar 3-5; MTX 15 mg intratekal, dag 1; Metylprednisolon 40 mg intratekal, dag 1 |
|
Studie ADE04 |
|
|
Förberedande fas |
DEX 10 mg/m2 oral, dagar 1-5; CP 200 mg/m2 i.v., dagar 3-5; MTX 15 mg intratekal, dag 1 |
|
Induktionsbehandling I |
DEX 10 mg/m2 oral, dagar 1-5; VCR 2 mg i.v., dagar 6, 13, 20; Daunorubicin 45 mg/m2 i.v., dagar 6-7, 13-14 |
|
Induktionsbehandling II |
CP 1 g/m2 i.v. (1 tim), dagar 26, 46; Ara-C 75 mg/m2 i.v. (1 tim), dagar 28-31, 35-38, 42-45; 6-MP 60 mg/m2 oral, dagar 26-46 |
|
Konsolideringsbehandling |
DEX 10 mg/m2 oral, dagar 1-5; Vindesin 3 mg/m2 i.v., dag 1; MTX 1,5 g/m2 i.v. (24 tim), dag 1; Etoposid 250 mg/m2 i.v. (1 tim) dagar 4-5; Ara-C 2x 2 g/m2 i.v. (3 tim, q 12 tim), dag 5 |
|
Studie AJP01 |
|
|
Induktionsbehandling |
CP 1,2 g/m2 i.v. (3 tim), dag 1; Daunorubicin 60 mg/m2 i.v. (1 tim), dagar 1-3; Vinkristin 1,3 mg/m2 i.v., dagar 1, 8, 15, 21; Prednisolon 60 mg/m2/dag oral |
|
Konsolideringsbehandling |
Alternerande kemoterapibehandling: högdos kemoterapi med MTX 1 g/m2 i.v. (24 tim), dag 1, och Ara-C 2 g/m2 i.v. (q 12 tim), dagar 2-3, i 4 cykler |
|
Underhållsbehandling |
VCR 1,3 g/m2 i.v., dag 1; Prednisolon 60 mg/m2 oral, dagar 1-5 |
|
Studie AUS01 |
|
|
Induktions-konsolideringsbehandling |
Hyper-CVAD-kur: CP 300 mg/m2 i.v. (3 tim, q 12 tim), dagar 1-3; Vinkristin 2 mg i.v., dagar 4, 11; Doxorubicin 50 mg/m2 i.v. (24 tim), dag 4; DEX 40 mg/dag på dagar 1-4 and 11-14, omväxlande med MTX 1 g/m2 i.v. (24 tim), dag 1, Ara-C 1 g/m2 i.v. (2 tim, q 12 tim), dagar 2-3 (totalt 8 kurer) |
|
Underhållsbehandling |
VCR 2 mg i.v. månatligen i 13 månader; Prednisolon 200 mg oral, 5 dagar per månad i 13 månader |
|
Samtliga behandlingskurer inkluderar administrering av steroider för CNS-profylax. |
|
|
Ara-C: cytosinarabinosid; CP: cyklofosfamid; DEX: dexametason; MTX: metotrexat; 6-MP: 6-merkaptopurin; VM26: teniposid; VCR: vinkristin; IDA: idarubicin; i.v.: intravenös |
|
Pediatrisk population
I studie I2301 inkluderades totalt 93 barn, ungdomar och unga patienter (från 1 till 22 års ålder) med Ph+ ALL i en öppen, multicenter, sekventiell kohort, icke randomiserad fas III-studie, och behandlades med Glivec (340 mg/m2/dag) i kombination med intensiv kemoterapi efter induktionsbehandling. Glivec administrerades intermittent i kohort 1-5, med en ökande behandlingslängd och en tidigare start med Glivec från kohort till kohort; kohort 1 fick den lägsta intensiteten och kohort 5 fick den högsta intensiteten av Glivec (längst behandlingslängd i dagar med en kontinuerlig daglig Glivec dosering under de första kemoterapibehandlingarna). En kontinuerlig daglig exponering av Glivec tidigt under behandlingen i kombination med kemoterapi i kohort 5 patienter (n=50) förbättrade den 4-årliga händelsefria överlevnaden (EFS) jämfört med historiska kontroller (n=120), som fick standard kemoterapi utan Glivec (69,6 % mot 31,6 % respektive). Den uppskattade 4-årliga totala överlevnanden i kohort 5-patienter var 83,6 % jämfört med 44,8 % i historiska kontroller. 20 av de 50 (40 %) patienterna i kohort 5 fick haematopoetisk stamcellstransplantation.
Tabell 5 Kemoterapi-behandling i kombination med imatinib i studie I2301
|
Konsolideringsblock 1 (3 veckor) |
VP-16 (100 mg/m2/dag, IV): dagar 1-5 Ifosfamid (1.8 g/m2/dag, IV): dagar 1-5 MESNA (360 mg/m2/dos q3tim, x 8 doser/dag, IV): dagar 1-5 G-CSF (5 μg/kg, SC): dagar 6-15 eller tills ANC > 1500 efter nadir IT Metotrexat (åldersjusterad): dag 1 ENBART Trippel IT terapi (åldersjusterad): dag 8, 15 |
|
Konsolideringsblock 2 (3 veckor) |
Metotrexat (5 g/m2 över 24 timmar, IV): dag 1 Leucovorin (75 mg/m2 vid timme 36, IV; 15 mg/m2 IV eller PO q6tim x 6 doser)iii: dagar 2 och 3 Trippel IT terapi (åldersjusterad): dag 1 ARA-C (3 g/m2/dos q 12 tim x 4, IV): dagar 2 och 3 G-CSF (5 μg/kg, SC): dagar 4-13 eller tills ANC > 1500 efter nadir |
|
Reinduktionsblock 1 (3 veckor) |
VCR (1.5 mg/m2/dag, IV): dagar 1, 8, och 15 DAUN (45 mg/m2/dag bolus, IV): dagar 1 och 2 CPM (250 mg/m2/dos q12tim x 4 doser, IV): dagar 3 och 4 PEG-ASP (2500 IE/m2, IM): dag 4 G-CSF (5 μg/kg, SC): dagar 5-14 eller tills ANC > 1500 efter nadir Trippel IT terapi (åldersjusterad): dagar 1 och 15 DEX (6 mg/m2/dag, PO): dagar 1-7 och 15-21 |
|
Intensifieringsblock 1 (9 veckor) |
Metotrexat (5 g/m2 över 24 timmar, IV): dagar 1 och 15 Leucovorin (75 mg/m2 vid timme 36, IV; 15 mg/m2 IV eller PO q6tim x 6 doser)iii: dagar 2, 3, 16, och 17 Trippel IT terapi (åldersjusterad): dagar 1 och 22 VP-16 (100 mg/m2/dag, IV): dagar 22-26 CPM (300 mg/m2/dag, IV): dagar 22-26 MESNA (150 mg/m2/dag, IV): dagar 22-26 G-CSF (5 μg/kg, SC): dagar 27-36 eller tills ANC > 1500 efter nadir ARA-C (3 g/m2, q12tim, IV): dagar 43, 44 L-ASP (6000 IE/m2, IM): dag 44 |
|
Reinduktionsblock 2 (3 veckor) |
VCR (1.5 mg/m2/dag, IV): dagar 1, 8 och 15 DAUN (45 mg/m2/dag bolus, IV): dagar 1 och 2 CPM (250 mg/m2/dos q12tim x 4 doser, iv): dagar 3 och 4 PEG-ASP (2500 IE/m2, IM): dagar 4 G-CSF (5 μg/kg, SC): dagar 5-14 eller tills ANC > 1500 efter nadir Trippel IT terapi (åldersjusterad): dagar 1 och 15 DEX (6 mg/m2/dag, PO): dagar 1-7 och 15-21 |
|
Intensifieringsblock 2 (9 veckor) |
Metotrexat (5 g/m2 över 24 timmar, IV): dagar 1 och 15 Leucovorin (75 mg/m2 vid timme 36, IV; 15 mg/m2 IV eller PO q6tim x 6 doser)iii: dagar 2, 3, 16, och 17 Trippel IT terapi (åldersjusterad): dagar 1 och 22 VP-16 (100 mg/m2/dag, IV): dagar 22-26 CPM (300 mg/m2/dag, IV): dagar 22-26 MESNA (150 mg/m2/dag, IV): dagar 22-26 G-CSF (5 μg/kg, SC): dagar 27-36 eller tills ANC > 1500 efter nadir ARA-C (3 g/m2, q12tim, IV): dagar 43, 44 L-ASP (6000 IE/m2, IM): dag 44 |
|
Underhållsbehandling (8-veckors cykler) Cykler 1–4 |
MTX (5 g/m2 över 24 timmar, IV): dag 1 Leucovorin (75 mg/m2 vid timme 36, IV; 15 mg/m2 IV eller PO q6tim x 6 doser)iii: dagar 2 och 3 Trippel IT terapi (åldersjusterad): dagar 1, 29 VCR (1.5 mg/m2, IV): dagar 1, 29 DEX (6 mg/m2/dag PO): dagar 1 5; 29-33 6-MP (75 mg/m2/dag, PO): dagar 8-28 Metotrexat (20 mg/m2/vecka, PO): dagar 8, 15, 22 VP-16 (100 mg/m2, IV): dagar 29-33 CPM (300 mg/m2, IV): dagar 29-33 MESNA IV dagar 29-33 G-CSF (5 μg/kg, SC): dagar 34-43 |
|
Underhållsbehandling (8-veckors cykler) Cykel 5 |
Kraniell bestrålning (Block 5 enbart) 12 Gy i 8 fraktioner för alla patienter som är CNS1 och CNS2 vid diagnos 18 Gy i 10 fraktioner för patienter som är CNS3 vid diagnos VCR (1.5 mg/m2/dag, IV): dagar 1, 29 DEX (6 mg/m2/dag, PO): dagar 1 5; 29-33 6-MP (75 mg/m2/dag, PO): dagar 11-56 (Avvakta med 6-MP under de 6-10 dagar av kraniell bestrålning som startar på dag 1 av Cykel 5. Starta 6-MP på första dagen efter fullföljd kraniell bestrålning.) Metotrexat (20 mg/m2/vecka, PO): dagar 8, 15, 22, 29, 36, 43, 50 |
|
Underhållsbehandling (8-veckors cykler) Cykler 6-12 |
VCR (1.5 mg/m2/dag, IV): dagar 1, 29 DEX (6 mg/m2/dag, PO): dagar 1 5; 29-33 6-MP (75 mg/m2/dag, PO): dagar 1-56 Metotrexat (20 mg/m2/vecka, PO): dagar 1, 8, 15, 22, 29, 36, 43, 50 |
G-CSF = granulocyte colony stimulating factor, VP-16 = etoposid, MTX = metotrexat, IV = intravenös, SC = subkutan, IT = intratekal, PO = oral, IM = intramuskulär, ARA-C = cytarabin, CPM = cyclofosfoamid, VCR = vinkristin, DEX = dexametason, DAUN = daunorubicin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparaginas, PEG-ASP = PEG asparaginas, MESNA= 2-merkaptoetan sulfonat natrium, iii= eller tills MTX nivå är < 0,1 µM, q6tim = var 6:e timme, Gy= Gray
Studie AIT07 var en multicenter, öppen, randomiserad, fas II/III studie som inkluderade 128 patienter (1 till < 18 år) som behandlats med imatinib i kombination med kemoterapi. Säkerhetsdata från denna studie förefaller vara i enlighet med säkerhetsprofilen för imatinib hos Ph+ ALL patienter.
Recidiverande/refraktära Ph+ ALL
När imatinib användes som monoterapi för patienter med recidiverande/refraktär Ph+ ALL, ledde det till en frekvens på 30% för hematologiskt svar (9% fullständig) och en frekvens på 23% för betydande cytogenetiskt svar för 53 av de 411 patienter som var utvärderbara för svar. (Obs! Av de 411 patienterna behandlades 353 i ett utvidgat accessprogram utan insamlande av primära svarsdata). Mediantiden till progression i den totala populationen på 411 patienter med recidiverande/refraktär Ph+ ALL varierade mellan 2,6 och 3,1 månader. Mediantiden för totalöverlevnad var mellan 4,9 och 9 månader för de 401 utvärderbara patienterna. Data var likartade vid reanalys av enbart patienter vid ålder 55 år eller äldre.
Kliniska studier vid MDS/MPD
Erfarenhet med Glivec vid denna indikation är mycket begränsad och baseras på hematologiska och cytogenetiska svarsfrekvenser. Det finns inga kontrollerade studier som uppvisa en klinisk nytta eller ökad överlevnad. En öppen multicenter-, fas-II, klinisk studie (studie B2225) utfördes där Glivec testades på olika populationer av patienter med livshotande sjukdomar sammankopplade med Abl-, Kit- eller PDGFR-proteintyrosinkinaser. Denna studie inkluderade 7 patienter med MDS/MPD, som behandlades med Glivec 400 mg dagligen. Tre patienter uppvisade ett fullständigt hematologiskt svar (FHS) och en patient hade ett partiellt hematologiskt svar (PHS). Vid tiden för originalanalysen utvecklade tre av fyra patienter med klarlagt rearrangemang av PDGFR-genen ett hematologiskt svar (2 FHS och 1 PHS). Åldern på dessa patienter varierade från 20 till 72 år.
En observationell registerstudie (L2401) genomfördes för att samla in långsiktiga data om säkerhet och effekt hos patienter med myeloproliferativa neoplasier med rearrangemang av PDGFR- β som behandlades med Glivec. De 23 patienter som ingick i detta register fick Glivec i en daglig dos om 264 mg i median (intervall: 100 till 400 mg) under en medianduration om 7,2 år (intervall 0,1 till 12,7 år). På grund av registrets observationella karaktär fanns hematologiska, cytogenetiska och molekylära data tillgängliga för 22, 9 respektive 17 av de 23 patienter som inkluderats. Vid konservativt antagande att patienter där data saknades inte svarat på behandlingen observerades FHS hos 20 av 23 (87 %) patienter, FCyS hos 9 av 23 (39,1 %) patienter respektive molekylärt svar hos 11 av 23 (47,8 %) patienter. Beräknat utifrån patienter med minst en giltig utvärdering var svarsfrekvensen för FHS, FCyS och molekylärt svar 20/22 (90,9 %), 9/9 (100 %) respektive 11/17 (64,7 %).
Ytterligare 24 patienter med MDS/MPD rapporterades i 13 publikationer. 21 patienter behandlades med 400 mg dagligen, medan de 3 andra patienterna erhöll lägre doser. Hos elva patienter upptäcktes rearrangemang av PDGFR-genen, varav 9 av dem nådde FHS och 1 PHS. Åldern på dessa patienter varierade från 2 till 79 år. I en nyligen publicerad artikel med uppdaterad information från 6 av dessa 11 patienter klarlades att alla dessa patienter förblev i cytogenetisk remission (intervall 32-38 månader). Samma publikation rapporterade om data från långtidsuppföljning av 12 MDS/MPD-patienter med rearrangemang av PDGFR-genen (5 patienter från studie B2225). Dessa patienter erhöll Glivec under en median av 47 månader (intervall 24 dagar – 60 månader). Hos 6 av dessa patienter överstiger nu uppföljningen 4 år. Elva patienter uppnådde snabbt FHS, 10 hade fullständig utläkning av cytogenetiska abnormiteter och en minskning eller försvinnande av fusionstranskript bestämt med RT-PCR. Hematologiskt och cytogenetiskt svar har kvarstått i median 49 månader (intervall 19-60) respektive 47 månader (intervall 16-59). Den sammantagna överlevnaden är 65 månader sedan diagnos (intervall 25-234). Glivec givet till patienter utan den genetiska translokationen resulterar vanligen inte i någon förbättring.
Det finns inga kliniska studier hos barnpatienter med MDS/MPD. Fem (5) patienter med MDS/MPD associerat med rearrangemang av PDGFR-genen har rapporterats i 4 publikationer. Åldern på dessa patienter sträckte sig från 3 månader till 4 år och imatinib gavs i en dos om 50 mg dagligen eller doser från 92,5 till 340 mg/m2 dagligen. Alla patienter uppnådde fullständigt hematologiskt svar, cytogenetiskt svar och/eller kliniskt svar.
Kliniska studier vid HES/CEL
En öppen, multicenter, fas-II klinisk studie (studie B2225) som testade Glivec hos olika populationer av patienter med livshotande sjukdomar förknippade med Abl, Kit eller PDGFR-protein-tyrosinkinaser genomfördes. I denna studie behandlades 14 patienter med HES/CEL med 100 mg till 1 000 mg Glivec dagligen. Ytterligare 162 patienter med HES/CEL, rapporterade i 35 publicerade fallrapporter och fallserier erhöll Glivec i doser om 75 mg till 800 mg dagligen. Cytogenetiska abnormiteter utvärderades hos 117 av den totala populationen om 176 patienter. Hos 61 av dessa 117 patienter identifierades FIP1L1-PDGFRα-fusionskinas. Ytterligare fyra patienter med HES var positiva för FIP1L1-PDGFRα-fusionskinas i 3 andra publicerade rapporter. Alla 65 patienter som var positiva för FIP1L1-PDGFRα-fusionskinas uppnådde ett fullständigt hematologiskt svar (FHS) som bibehölls i månader (intervall från 1+ till 44+ månader uteslutna vid datum för rapportering). Som rapporterats i en nyligen utgiven publikation, uppnådde 21 av dessa 65 patienter en fullständig cytogenetisk remission med en medianuppföljning på 28 månader (intervall 13-67 månader). Åldern på dessa patienter varierade från 25 till 72 år. Dessutom rapporterade prövarna i fallrapporterna om förbättringar i symtomatologi och andra abnorma organdysfunktioner. Förbättringar i organsystemen rapporterades för hjärta, nervsystemet, hud/subkutan vävnad, andningsvägar/bröstkorg/mediastinum/muskuloskeletala systemet/bindväv/blodkärl och magtarmkanalen.
Det finns inga kontrollerade studier hos barnpatienter med HES/CEL. Tre (3) patienter med HES/CEL associerat med rearrangemang av PDGFR-genen har rapporterats i 3 publikationer. Åldern på dessa patienter sträckte sig från 2 till 16 år och imatinib gavs i en dos om 300 mg/m2 dagligen och doser från 200 till 400 mg dagligen. Alla patienter uppnådde fullständigt hematologiskt svar, fullständigt cytogenetiskt svar och/eller fullständigt molekylärt svar.
Kliniska studier vid icke-resercerbar och/eller metastaserande GIST
En fas-2, öppen, randomiserad, okontrollerad, multinationell studie genomfördes på patienter med icke-resecerbara eller metastaserande, maligna gastrointestinala stromacellstumörer (GIST). I denna studie rekryterades och randomiserades 147 patienter att erhålla endera 400 mg eller 600 mg Glivec en gång dagligen oralt i upp till 36 månader. Dessa patienter varierade i ålder mellan 18 och 83 år och hade en patologisk diagnos av Kit-positiv, malign GIST som var icke-resecerbar och/eller metastaserande. Immunohistokemi utfördes rutinmässigt med Kit-antikropp (A-4502, polyklonalt kaninantiserum, 1:100; DAKO Corporation, Carpinteria, CA) i enlighet med analys med en avidin-biotin-peroxidas-komplexmetod efter antigenåtervinning.
Det primära beviset på effektivitet baserades på objektiva svar. Det krävdes att tumörerna var mätbara vid åtminstone ett sjukdomsställe och svarskarakteriseringen baserades på kriterier från Southwestern Oncology Group (SWOG). Resultaten anges i Tabell 6.
Tabell 6 Bästa tumörsvaren i studie STIB2222 (GIST)
|
Bästa svar |
Alla doser (n=147) 400 mg (n=73) 600 mg (n=74) n (%) |
|
Fullständigt svar Partiellt svar Stabil sjukdom Progressiv sjukdom Inte mätbart Okänt |
1 (0,7) 98 (66,7) 23 (15,6) 18 (12,2) 5 (3,4) 2 (1,4) |
Det var ingen skillnad i svarsfrekvens mellan de båda dosgrupperna. Ett betydande antal patienter som hade en stabil sjukdom vid tiden för interimsanalysen uppnådde partiellt svar vid längre behandling (medianuppföljning 31 månader). Mediantiden till svar var 13 veckor (95% KI 12-23). Mediantiden till behandlingssvikt hos de som svarat var 122 veckor (95% KI 106-147), medan den för patientpopulationen i stort var 84 veckor (95% KI 71–109). Medianöverlevnaden har inte nåtts. Uppskattad överlevnad efter 36 månaders uppföljning enligt Kaplan-Meier är 68%.
I två kliniska prövningar (studie B2222 och intergruppstudien S0033) ökades den dagliga dosen av Glivec till 800 mg hos patienter som sviktade på de lägre dagliga doserna på 400 mg eller 600 mg. Den dagliga dosen ökades till 800 mg hos totalt 103 patienter; 6 patienter uppnådde partiellt svar och 21 stabiliserad sjukdom efter dosökning till en generell klinisk nytta på 26%. Från de säkerhetsdata som finns tillgängliga verkade inte en ökad dos till 800 mg dagligen hos patienter som sviktade på lägre doser på 400 mg eller 600 mg dagligen påverka säkerhetsprofilen för Glivec.
Kliniska studier vid adjuvant GIST
Glivec studerades som adjuvant terapi i en multicenter, dubbelblind, långtids, placebokontrollerad fas III studie (Z9001) omfattande 773 patienter. Åldrarna hos dessa patienter sträckte sig från 18 till 91 år. Patienter som hade en histologisk diagnos av primär GIST uttryckande Kit protein vid immunokemi och en tumörstorlek ≥3 cm i maximal dimension, med radikal resektion av primär GIST inom 14-70 dagar före registrering inkluderades. Efter resektion av primär GIST, randomiserades patienter till en av de två armarna: Glivec 400 mg/dag eller motsvarande placebo under ett år.
Studiens primära endpoint var återfallsfri överlevnad (RFS), definierad som tiden från randomiseringsdagen till dagen för återfall eller död oavsett orsak.
Glivec förlängde signifikant RFS, med 75% av patienterna återfallsfria vid 38 månader i Glivec-gruppen gentemot 20 månader i placebogruppen (95% KI, [30 - icke uppskattningsbart]; respective [14 - icke uppskattningsbart]; (hazard ratio = 0,398 [0,259-0,610], p<0,0001). Vid ett år var total RFS signifikant bättre för Glivec (97,7%) gentemot placebo (82,3%), (p<0,0001). Risken för återfall reducerades alltså med cirka 89% jämfört med placebo (hazard ratio = 0,113 [0,049-0,264].
Risken för återfall hos patienter efter kirurgi av deras primära GIST bedömdes retrospektivt baserat på följande prognostiska faktorer: tumörstorlek, mitotiskt index, tumörens plats. Data för mitotiskt index var tillgängliga för 556 av de 713 i intention-to-treat (ITT)-poulationen. Resultaten av subgruppsanalyser i enlighet med riskklassificeringar enligt United States National Institutes of Health (NIH) och Armed Forces Institute of Pathology (AFIP)- visas i Tabell 7. Ingen fördel observerades i låg- och mycket lågrisk-grupperna. Ingen fördel beträffande total överlevnad har observerats.
Tabell 7 Översikt av Z9001-studiens RFS analyser enligt NIH och AFIP riskklassificering
|
Risk-kriterier |
Risknivå |
% av patienter |
Antal händelser/ Antal patienter |
Total hazard ratio (95%KI)* |
RFS-tal (%) |
|
|
Glivec vs placebo |
12 månader |
24 månader |
||||
|
Glivec vs placebo |
Glivec vs placebo |
|||||
|
NIH |
Låg |
29,5 |
0/86 vs. 2/90 |
N.E. |
100 vs. 98,7 |
100 vs. 95,5 |
|
Intermediär |
25,7 |
4/75 vs. 6/78 |
0,59 (0,17; 2,10) |
100 vs. 94,8 |
97,8 vs. 89,5 |
|
|
Hög |
44,8 |
21/140 vs. 51/127 |
0,29 (0,18; 0,49) |
94,8 vs. 64,0 |
80,7 vs. 46,6 |
|
|
AFIP |
Mycket låg |
20,7 |
0/52 vs. 2/63 |
N.E. |
100 vs. 98,1 |
100 vs. 93,0 |
|
Låg |
25,0 |
2/70 vs. 0/69 |
N.E. |
100 vs. 100 |
97,8 vs. 100 |
|
|
Måttlig |
24,6 |
2/70 vs. 11/67 |
0,16 (0,03; 0,70) |
97,9 vs. 90,8 |
97,9 vs. 73,3 |
|
|
Hög |
29,7 |
16/84 vs. 39/81 |
0,27 (0,15; 0,48) |
98,7 vs. 56,1 |
79,9 vs. 41,5 |
|
* Hel uppföljningsperiod; NE – Not estimable (Går ej att uppskatta)
En andra multicenter, öppen fas III studie (SSG XVIII/AIO) jämförde 12 månaders behandling mot 36 månaders behandling med Glivec 400 mg/dag hos patienter efter kirurgisk resektion av GIST och en av följande: tumördiameter >5 cm och mitosantal >5/50 high power fields (HPF); eller tumördiameter >10 cm och oavsett mitosantal eller oavsett tumörstorlek med mitosantal >10/50 HPF eller tumörer som brustit in i bukhålan. Sammanlagt 397 patienter hade samtyckt och randomiserats till studien (199 patienter i 12-månadersarmen och 198 patienter i 36-månadersarmen), medianåldern var 61 år (intervall 22 till 84 år). Mediantiden för uppföljning var 54 månader (från randomiseringsdatum till sista data) med totalt 83 månader mellan randomisering av första patient till avbrytande.
Studiens primära endpoint var återfallsfri överlevnad (RFS), definierad som tiden från randomiseringsdagen till dagen för återfall eller död oavsett orsak.
Trettiosex (36) månaders behandling med Glivec förlängde signifikant RFS jämfört med 12 månaders behandling med Glivec (hazard ratio (HR) = 0,46 [0,32-0,65], p<0,0001) (Tabell 8, Figur 1).
Dessutom förlängde 36-månaders behandling med Glivec signifikant den totala överlevnaden (OS) jämfört med 12-månaders behandling med Glivec (HR = 0,45 [0,22-0,89], p=0,0187) (Tabell 8, Figur 2).
En förlängd behandlingstid (>36 månader) kan fördröja uppkomsten av ytterligare återfall, men effekterna av denna observation på den totala överlevnaden är fortfarande okänd.
Totala antalet dödsfall var 25 för 12-månader behandlingsarmen och 12 för 36-månader behandlingsarmen.
Behandling med imatinib i 36 månader var överlägsen behandling i 12 månader enligt ITT-analysen, d.v.s. hela studiepopulationen inkluderad. I en planerad subgruppsanalys baserad på mutationstyp, var HR för RFS för 36-månaders behandling av patienter med mutationer i exon 11 0,35 [95% KI: 0,22, 0,56]. Inga slutsatser kan dras för andra mindre vanliga mutationsundergrupper på grund av det låga antalet observerade händelser.
Tabell 8 12-månaders och 36-månaders behandling med Glivec (SSGXVIII/AIO prövning)
|
RFS |
12-månader behandlingsarmen %(KI) |
36-månader behandlingsarmen %KI |
|
12 månader |
93,7 (89,2-96,4) |
95,9 (91,9-97,9) |
|
24 månader |
75,4 (68,6-81,0) |
90,7 (85,6-94,0) |
|
36 månader |
60,1 (52,5-66,9) |
86,6 (80,8-90,8) |
|
48 månader |
52,3 (44,0-59,8) |
78,3 (70,8-84,1) |
|
60 månader |
47,9 (39,0-56,3) |
65,6 (56,1-73,4) |
|
Överlevnad | ||
|
36 månader |
94,0 (89,5-96,7) |
96,3 (92,4-98,2) |
|
48 månader |
87,9 (81,1-92,3) |
95,6 (91,2-97,8) |
|
60 månader |
81,7 (73,0-87,8) |
92,0 (85,3-95,7) |
Figur 1 Kaplan-Meier skattning för endpoint primär återfallsfri överlevnad (ITT population)
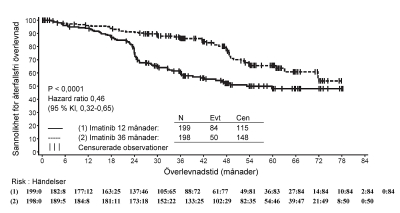
Figur 2 Kaplan-Meier skattning för total överlevnad (ITT population)
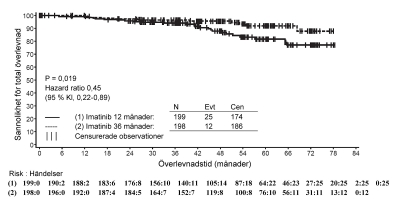
Det finns inga kontrollerade studier hos barnpatienter med c-Kit positiv GIST. Sjutton (17) patienter med GIST (med eller utan Kit och PDGFR mutationer) har rapporterats i 7 publikationer. Åldern på dessa patienter sträckte sig från 8 till 18 år och imatinib gavs både i adjuvanta och metastaserande fall i doser från 300 till 800 mg dagligen. Majoriteten av barnpatienter som behandlats för GIST saknade data för att bekräfta c-kit eller PDGFR mutationer vilket kan ha lett till blandade kliniska utfall.
Kliniska studier vid DFSP
En fas II, öppen, multicenter klinisk studie (studie B2225) utfördes på 12 patienter med DFSP som behandlades med Glivec 800 mg dagligen. Åldrarna hos DFSP-patienterna sträckte sig från 23 till 75 år; DFSP var metastatisk, lokalt återkommande efter initial resektiv kirurgi och bedömd ej vara mottaglig för ytterligare resektiv kirurgi vid tidpunkten för inträde i studien. Primärt kännetecken för effekt baserades på objektiv svarsfrekvens. Av de 12 enrollerade patienterna svarade 9, en fullständigt och 8 partiellt. Tre av de partiellt svarande blev senare sjukdomsfria genom kirurgi. Behandlingstiden i studie B2225 var i median 6,2 månader, med 24,3 månader som maximal tid. Ytterligare 6 DFSP-patienter som behandlades med Glivec rapporterades i 5 publicerade fallrapporter, deras åldrar sträckte sig från 18 månader till 49 år. De vuxna patienterna som rapporterats i den publicerade litteraturen behandlades med antingen 400 mg (4 fall) eller 800 mg (1 fall) Glivec dagligen. Fem (5) patienter svarade, 3 patienter fullständigt och 2 partiellt. Mediantiden för behandling i den publicerade litteraturen sträckte sig mellan 4 veckor och mer än 20 månader. Translokation t(17:22)[q22:q13], eller dess genprodukt, förekom hos nästan alla patienter som svarade på Glivec-behandling.
Det finns inga kontrollerade studier hos barnpatienter med DFSP. Fem (5) patienter med rearrangemang av DFSP och PDGFR-generna har rapporterats i 3 publikationer. Åldern på dessa patienter sträckte sig från nyfödda till 14 år och imatinib gavs i en dos om 50 mg dagligen eller doser från 400 till 520 mg/m2 dagligen. Alla patienter uppnådde partiellt och/eller fullständigt svar.
Farmakokinetik
Glivecs farmakokinetiska egenskaper
Glivecs farmakokinetiska egenskaper har utvärderats i dosintervallet 25 till 1 000 mg. Den farmakokinetiska profilen i plasma analyserades dag 1 och antingen dag 7 eller dag 28, då den genomsnittliga plasmakoncentrationen hade nått steady state.
Absorption
Genomsnittlig absolut biotillgänglighet för imatinib är 98%. Det var hög variabilitet mellan patienter för AUC-värden i plasma för imatinib efter en peroral dos. När dosen ges tillsammans med en måltid med högt fettinnehåll reduceras absorptionen för imatinib obetydligt (11% minskning i Cmax och förlängning av tmax med 1,5 timmar), med en liten minskning av AUC (7,4%) jämfört med under fasta. Effekten av tidigare gastrointestinal kirurgi på läkemedelsabsorption har inte undersökts.
Distribution
Vid kliniskt relevanta koncentrationer av imatinib är bindningen till plasmaproteiner cirka 95% på basis av försök in vitro, huvudsakligen till albumin och orosomukoid och med liten bindning till lipoprotein.
Metabolism
Den huvudsakliga cirkulerande metaboliten hos människa är det N-demetylerade piperazinderivatet, som uppvisar en liknande effekt in vitro som modersubstansen. Plasma-AUC för denna metabolit är bara 16% av AUC för imatinib. Plasmaproteinbindningen av den N-demetylerade metaboliten liknar den för modersubstansen.
Imatinib och N-demetylmetaboliten svarade tillsammans för cirka 65% av den cirkulerande radioaktiviteten (AUC(0-48 tim)). Den resterande cirkulerande radioaktiviteten utgjordes av ett antal smärre metaboliter.
Resultaten in vitro visade att CYP3A4 var det huvudsakliga humana P450-enzymet som katalyserar biotransformeringen av imatinib. Av ett antal tänkbara läkemedel (aciklovir, allopurinol, amfotericin, cytarabin, erytromycin, flukonazol, hydroxiurea, norfloxacin, paracetamol, penicillin V) var det endast erytromycin (IC50 50 µM) och flukonazol (IC50 118 µM) som uppvisade en hämning av imatinibmetabolismen som kunde vara kliniskt relevant.
Imatinib visades in vitro vara en kompetitiv hämmare av substratmarkörer för CYP2C9, CYP2D6 och CYP3A4/5. Ki -värden i humana levermikrosomer var 27, 7,5 respektive 7,9 μmol/l. Maximala plasmakoncentrationsvärden av imatinib hos patienter är 2-4 μmol/l. Följaktligen är en hämning av CYP2D6- och/eller CYP3A4/5-medierad metabolism möjlig av samtidigt givna läkemedel. Imatinib interfererade inte med biotransformeringen av 5-fluorouracil, men det hämmade paklitaxels metabolism, som ett resultat av en kompetitiv hämning av CYP2C8 (Ki = 34,7 μM). Detta Ki-värde är mycket högre än de förväntade plasmanivåerna av imatinib hos patienter. Följaktligen förväntas ingen interaktion vid samtidig administrering av 5-fluorouracil eller paklitaxel och imatinib.
Eliminering
Baserat på återvinningen av substans(er) efter en peroralt tillfört 14C-märkt dos av imatinib, återfanns cirka 81% av dosen inom 7 dagar, dels i faeces (68% av dosen), dels i urinen (13% av dosen). Oförändrat imatinib utgjorde 25% av dosen (5% i urin, 20% i faeces), och övrigt är metaboliter.
Farmakokinetik i plasma
Hos friska frivilliga och efter peroral tillförsel var t½ ungefär 18 timmar, vilket indikerar att dosering en gång dagligen är lämplig. Ökningen av genomsnittlig AUC med ökande dos var linjär och dosproportionerlig i intervallet 25–1 000 mg imatinib efter peroral tillförsel. Imatinibs kinetiska egenskaper ändrades inte vid upprepad dosering och ackumulationen var en faktor 1,5–2,5 vid steady state och dosering en gång dagligen.
Farmakokinetik hos GIST-patienter
Hos patienter med GIST var exponeringen vid steady-state 1,5 gånger högre än den som observerats hos KML-patienter vid samma dos (400 mg dagligen). Baserat på preliminär populationsfarmakokinetik hos GIST-patienter var det tre variabler (albumin, antalet vita blodkroppar och bilirubin), som befanns ha ett statistiskt signifikant samband med farmakokinetiken för imatinib. Minskade värden av albumin orsakade en minskad clearance (CL/f). Större antal vita blodkroppar ledde till en minskning av CL/f. Emellertid, dessa samband är inte tillräckligt uttalade för att kräva en dosjustering. Hos denna patientpopulation kan förekomsten av levermetastaser möjligen leda till leverinsufficiens och minskad metabolism.
Farmakokinetik i populationen
En farmakokinetisk analys i en population av KML-patienter visar på en mindre effekt av ålder på distributionsvolymen (12% ökning hos patienter >65 år). Denna förändring bedöms inte vara kliniskt signifikant. Effekten av kroppsvikt på clearance av imatinib är sådan att för en patient som väger 50 kg förväntas genomsnittlig clearance vara 8,5 l/timme, medan en patient som väger 100 kg förväntas ha ökad clearance motsvarande 11,8 l/timme. Dessa förändringar anses inte vara tillräckligt stora för att motivera en dosjustering på grundval av kroppsvikt. Det föreligger ingen effekt av kön på imatinibs kinetiska egenskaper.
Farmakokinetik hos barn
Liksom hos vuxna patienter, absorberades imatinib snabbt efter oral administrering hos pediatriska patienter i både fas I- och fas II-studier. Dosering till barn med 260 respektive 340 mg/m2/dag uppnådde liknande exponering som doser om 400 mg respektive 600 mg till vuxna patienter. Jämförelsen av AUC(0-24) vid dag 8 och dag 1 vid dosnivån 340 mg/m2/dag uppdagade en ackumulering på 1,7 gånger efter upprepad daglig engångsdosering.
Baserat på en farmakokinetisk analys i en sammanslagen population av pediatriska patienter med hematologiska rubbningar (KML, Ph+ALL, eller andra hematologiska rubbningar som behandlats med imatinib), ökar clearance av imatinib med ökad kroppsyta (BSA). Efter korrigering av BSA effekten, så hade inte annan demografi såsom ålder, kroppsvikt och body mass index kliniskt signifikanta effekter på exponeringen av imatinib. Analysen bekräftar att exponeringen av imatinib hos pediatriska patienter som fick 260 mg/m2 en gång dagligen (överskred ej 400 mg en gång dagligen) eller 340 mg/m2 en gång dagligen (överskred ej 600 mg en gång dagligen) var likt de hos vuxna patienter som fick imatinib 400 mg eller 600 mg en gång dagligen.
Organfunktionsnedsättning
Imatinib och dess metaboliter utsöndras inte signifikant via njurarna. Patienter med lätt till måttligt nedsatt njurfunktion tycks ha högre plasmaexponering än patienter med normal njurfunktion. Ökningen är cirka 1,5 till 2 ggr, vilket motsvarar en 1,5x ökning av plasma-AGP, till vilket imatinib binder starkt. Clearance av fritt aktivt imatinib är förmodligen likartad för patienter med nedsatt njurfunktion och patienter med normal njurfunktion eftersom utsöndring via njuren endast i mindre utsträckning står för eliminationen av imatinib (se avsnitten Dosering och Varningar och försiktighet).
Trots att resultaten från de farmakokinetiska analyserna visade att det finns en betydande variation mellan individer, ökade inte medelexponeringen för imatinib hos patienter med varierande grad av leverfunktionsrubbning jämfört med patienter med normal leverfunktion (se avsnitten Dosering, Varningar och försiktighet och Biverkningar).
Prekliniska uppgifter
Utvärdering av den prekliniska säkerheten för imatinib har gjorts på råtta, hund, apa och kanin.
Toxicitetsstudier vid upprepad dosering uppvisade milda till måttliga hematologiska förändringar hos råtta, hund och apa, samt benmärgsförändringar hos råtta och hund.
Hos råtta och hund var levern målorgan. Milda till måttliga transaminasstegringar och en liten minskning i kolesterol, triglycerider, totala protein- och albuminvärden observerades hos båda djurarterna. Inga histopatologiska förändringar kunde ses i råttlever. Allvarlig levertoxicitet observerades hos hundar som behandlats i 2 veckor, med förhöjda leverenzymer, hepatocellulär nekros, gallgångsnekros och gallgångshyperplasi.
Njurtoxicitet observerades hos apor som behandlats i 2 veckor, med fokal mineralisering och utvidgning av njurtubuli och tubulär nefros. Ökat urea (BUN) och kreatinin observerades hos flera av dessa djur. Hos råtta observerades hyperplasi av epitelet i njurpapillen och i urinblåsan vid doser ≥6 mg/kg i 13-veckorsstudien, utan några förändringar i serum- eller urinparametrar. En ökad frekvens av opportunistiska infektioner observerades vid kronisk behandling med imatinib.
I en 39-veckorsstudie på apa, kunde inget NOAEL (nivån för ingen observerad toxisk effekt) bestämmas vid den lägsta dosen 15 mg/kg, ungefär en tredjedel av den maximala dosen av 800 mg/dag till människa baserat på kroppsytan. Behandlingen innebar en försämring av de normalt undertryckta malariainfektionerna hos dessa djur.
Imatinib ansågs inte vara genotoxiskt i bakterier, mammalieceller (Ames test, muslymfom) in vitro, och i råttmikronukleus in vivo. Positiva genotoxiska effekter avseende klastogenicitet (kromosomavvikelser) erhölls i ett mammaliecellstest in vitro (Chinese hamster ovary) i närvaro av metabolisk aktivering. Två intermediärer från tillverkningsprocessen, som också finns i den färdiga produkten, är positiva för mutagenes i Amestestet. En av dessa intermediärer var även positiv i muslymfomtestet.
I en fertilitetsstudie på hanråttor som doserades 70 dagar innan parning, minskade testikel- och bitestikelvikten och procentandelen rörliga spermier vid 60 mg/kg, ungefär lika med den maximala kliniska dosen av 800 mg/dag baserat på kroppsytan. Detta sågs inte vid doser ≤20 mg/kg. En lätt till måttlig minskning i spermatogenes observerades hos hund vid orala doser ≥30 mg/kg. När honråttor doserades 14 dagar innan parning och till dräktighetsdag 6, sågs ingen effekt på parning eller antal dräktiga honor. Vid doser på 60 mg/kg hade honråttorna en signifikant spontanförlust av foster och ett reducerat antal levande foster. Detta sågs inte vid doser ≤20 mg/kg.
I en oral, pre- och postnatal utvecklingsstudie på råttor, noterades en röd vaginal flytning hos gruppen med 45 mg/kg/dag på endera dräktighetsdag 14 eller 15. Vid samma dos, ökade antalet dödfödda ungar liksom de som avled mellan postpartumdag 0 och 4. Hos F1-avkomman, vid samma dosnivå, minskade medelkroppsvikten från födsel till avlivning och antalet kullar som uppnådde kriterier för preputial separering minskade något. F1-fertilitet påverkades inte, medan ett ökat antal resorptioner och ett ökat antal levande foster noterades med 45 mg/kg/dag. Nivån för ingen observerad effekt (NOEL) för både moderdjurens och F1-generationen var 15 mg/kg/dag (en fjärdedel av den maximala dosen till människa om 800 mg).
Imatinib var teratogent hos råtta när det gavs under organogenesen vid doser ≥100 mg/kg, ungefär lika med den maximala kliniska dosen av 800 mg/dag baserat på kroppsytan. Teratogena effekter omfattade exencefali eller encefalocele, frånvarande/minskat frontal- och frånvarande parietalben. Dessa effekter sågs inte vid doser ≤30 mg/kg.
Inga nya målorgan identifierades i den juvenila utvecklingstoxikologiska studien på råttor (dag 10 till 70 postpartum) med avseende på kända målorgan hos vuxna råttor. I den juvenila toxikologiska studien observerades effekter på tillväxt, försening i vaginal öppning och preputial separation vid ungefär 0,3 till 2 gånger paediatrisk medelexponering vid högsta rekommenderad dos på 340 mg/m2. Dessutom observerades mortalitet hos juvenila djur (kring avvänjningsfasen) vid ungefär 2 gånger paediatrisk medelexponering vid högsta rekommenderad dos på 340 mg/m2.
I den 2-åriga karcinogenicitetsstudien på råtta resulterade administrering av imatinib med 15, 30 och 60 mg/kg/dag i en statistiskt signifikant reduktion av livslängden hos hannar vid 60 mg/kg/dag och honor vid ≥30 mg/kg/dag. Histopatologisk undersökning av avlidna djur visade på kardiomyopati (båda könen), kronisk progressiv nefropati (honor) och papillom i preputiala körtlar som huvudorsak till död eller orsak till avlivning. Målorgan för neoplastiska förändringar var njurar, urinblåsa, urinrör, preputiala och klitorala körtlar, tunntarm, bisköldkörtlar, binjurekörtlar och icke-glandulär magsäck. Nivån för ingen observerad effekt (NOEL) för de olika målorganen med neoplastiska förändringar bestämdes enligt följande: 30 mg/kg/dag för njurarna, urinblåsa, urinrör, tunntarm, bisköldkörtlar, binjurar och icke-glandulär magsäck.
Papillom/karcinom i preputiala och klitorala körtlar noterades från 30 mg/kg/dag och uppåt, vilket utgör ungefär 0,5 respektive 0,3 gånger den dagliga exponeringen hos människa (baserat på AUC) vid 400 mg/dag respektive 800 mg/dag och 0,4 gånger den dagliga exponeringen hos barn (baserat på AUC) vid 340 mg/m2/dag. Nivån för ingen observerad effekt (NOEL) var 15 mg/kg/dag. Njuradenom/karcinom, urinblåse- och urinrörspapillom, tunntarmsadenokarcinom, bisköldkörteladenom, benigna och maligna medullära tumörer i binjurar och papillom/karcinom i icke-glandulär magsäck noterades vid 60 mg/kg/dag, vilket utgör ungefär 1,7 eller 1 gång den dagliga exponeringen hos människa (baserat på AUC) vid 400 mg/dag respektive 800 mg/dag, och 1,2 gånger den dagliga exponeringen hos barn (baserat på AUC) vid 340 mg/m2/dag. Nivån för ingen observerad effect (NOEL) var 30 mg/kg/dag.
Mekanismen bakom och betydelsen av dessa fynd i karcinogenicitetsstudien på råtta för människor är ännu inte klarlagda.
Icke-neoplastiska förändringar som inte identifierats i tidigare prekliniska studier var i det kardiovaskulära systemet, bukspottkörtel, endokrina organ och tänder. De viktigaste förändringarna innefattade hjärthypertrofi och dilatation, vilket hos vissa djur gav symptom på hjärtinsufficiens.
Den aktiva substansen imatinib uppvisar en miljörisk hos sedimentorganismer.
Innehåll
Kvalitativ och kvantitativ sammansättning
Glivec 100 mg filmdragerade tabletter
Varje filmdragerad tablett innehåller 100 mg imatinib (som mesylat).
Glivec 400 mg filmadragerade tabletter
Varje filmdragerad tablett innehåller 400 mg imatinib (som mesylat)
Förteckning över hjälpämnen
Tablettkärna:
Mikrokristallin cellulosa
Krospovidon
Hypromellos
Magnesiumstearat
Vattenfri kolloidal kiseldioxid
Tabletthölje:
Järnoxid, röd (E172)
Järnoxid, gul (E172)
Makrogol
Talk
Hypromellos
Blandbarhet
Ej relevant.
Miljöpåverkan
Imatinib
Miljörisk:
Användning av imatinib har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Imatinib bryts ned långsamt i miljön.
Bioackumulering:
Imatinib har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6 * A * (100 - R) = 1.37*10-6 * 184.95 * 100 = 0.25 μg/L
Where:
A = 184.95 kg imatinib (total sold amount API in Sweden year 2021, data from IQVIA).
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0, if no data is available.
P = number of inhabitants in Sweden = 10 * 106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA 2008)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA 2008).
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae (Selenastrum capricornutum) (OECD201) (NOTOX Project 270225):
EC50 72 h (growth rate) = 6.8 mg/L
NOEC 72 h = 0.96 mg/L
Crustacean (Daphnia magna, waterflea):
Acute toxicity
EC50 48 h (immobilisation) = 80.0 mg/L (ISO 6341) (NOTOX Project 270236)
Chronic toxicity
NOEC 21 days (reproduction) = 5.6 mg/L (OECD 211) (NOTOX Project 485999)
Fish:
Acute toxicity (Cyprinus carpio, carp)
LC50 96 hours = 82 mg/L (OECD 203) (NOTOX Project 306214)
Chronic toxicity (Pimephales promelas, fathead minnow)
NOEC 30 days (time of hatching, hatching success, survival, growth, development of larvae) = 10.0 mg/L; no effect up to the highest concentration tested (OECD 210) (NOTOX Project 486000)
Other ecotoxicity data:
Bacterial respiration inhibition
EC50 3 h = 232 mg/L (activated sludge respiration inhibition) (OECD209) (NOTOX Project 270247)
Sediment-dwelling organisms (Chironomus riparius, non-biting midge)
NOEC 28 days (emergence rate) = 1.8 mg/L (OECD 219) (NOTOX Project 488608)
PNEC derivation:
PNEC = 96 μg/L
PNEC (μg/L) = lowest NOEC/10, where 10 is the assessment factor used if three chronic toxicity studies from three trophic levels are available. The NOEC for the green algae Selenastrum capricornutum has been used for this calculation.
Environmental risk classification (PEC/PNEC ratio)
PEC/PNEC = 0.25 μg/L / 96.0 μg/L = 0.00264, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase "Use of imatinib has been considered to result in insignificant environmental risk."
Degradation
Biotic degradation
Ready degradability:
9 - 12 % degradation in 28 days, not readily biodegradable (OECD 301B). (NOTOX Project 270258)
Simulation studies:
DT50 (total system) = 82.0 – 111.0 days (OECD 308) (NOTOX Project 486002)
Sediments were extracted with 80/20 (v/v) methanol/buffer pH11.
Upon addition of imatinib mesylate to the water layer, imatinib partitioned between the water and sediment layer. Radioactivity in the water layer decreased to < 5% of applied after 29 days of incubation. Mineralisation did not occur. Bound residues accounted for maximum 30 % and 40 % of applied. No relevant metabolites were detected.
Justification of chosen degradation phrase:
According to the pass criteria for OECD308 studies, imatinib can be classified as ‘Imatinib is slowly degraded in the environment' (DT50 for total system ≤ 120 days).
Bioaccumulation
Partitioning coefficient:
logD at pH 7.4 = 2.34 (Kil et al. 2007)
[N-11C-methyl]imatinib hydrochloride solution (50 Al) was added to a test tube containing 2.5 ml of octanol and 2.5 ml of phosphate buffered solution (pH 7.4). The solution was vortexed for 2 min and centrifuged for 2 min at maximum speed. An aliquot (0.1 Al) was taken from an organic layer, and another aliquot (1.0 Al) was taken from an aqueous layer. Then 2.0 ml of sample from the organic layer was added to a second test tube containing 0.5 ml of octanol and 2.5 ml of phosphate-buffered solution (pH 7.4). The same treatment is applied to the second test tube. These repeated procedures were applied to six test tubes so that 12 samples (six from the aqueous layer and six from the organic layer) were obtained. Each sample was counted by a well counter (Picker, Cleveland, OH) to yield the ratio of decay-corrected counts in octanol to decay-corrected counts in buffer.
Justification of chosen bioaccumulation phrase:
Since log P < 4, imatinib has low potential for bioaccumulation.
Excretion (metabolism)
Based on the recovery of compound(s) after an oral 14C-labelled dose of imatinib, approximately 81% of the dose was eliminated within 7 days in feces (68% of dose) and urine (13% of dose). Unchanged imatinib accounted for 25% of the dose (5% urine, 20 % feces), the remainder being metabolites (GLIVEC® (imatinib mesylate) Core Data Sheet).
References
-
ECHA 2008, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment. http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm
-
NOTOX Project 270225. Fresh water algal growth inhibition test with STI571/DS. Final report: 17 December 1999.
-
NOTOX Project 270236. Acute toxicity study in Daphnia magna with STI571/DS (static). Final report: 09 December 1999.
-
NOTOX Project 485999. Daphnia magna, reproduction test with imatinib mesylate (semi-static). Final report: 17 March 2008.
-
NOTOX Project 306214. 96-hour acute toxicity study in carp with STI571/DS (static). Final report: 12 December 2000.
-
NOTOX Project 486000. Fish early-life stage toxicity test with imatinib mesylate (semi-static). Final report: 20 March 2008.
-
NOTOX Project 332911. Activated sludge respiration inhibition test with STI571/DS (contact time: 3 hours). Final report: 15 October 1999.
-
NOTOX Project 488608. Sediment-water Chironomid toxicity test using water spiked with imatinib mesylate. Final report: 15 December 2008.
-
NOTOX Project 270258. Determination of ‘ready’ biodegradability: carbon dioxide (CO2) evolution test (modified Sturm test) with STI571/DS. Final report: 09 November 1999.
-
NOTOX Project 486002. Aerobic degradation of imatinib mesylate in two water/sediment systems. Final report: 15 April 2008.
-
Kil KE, Ding YS, Lin KS, et al. (2007). Synthesis and positron emission tomography studies of carbon-11-labeled imatinib (Gleevec). Nuclear Medicine and Biology; 34:153–163.
-
GLIVEC® (imatinib mesilate) Core Data Sheet Version 2.3. 24 August 2017.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Glivec 100 mg filmdragerade tabletter
Förvaras vid högst 30 °C.
Glivec 400 mg filmdragerade tabletter
Förvaras vid högst 25 °C
Förvaras i originalförpackningen. Fuktkänsligt
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Filmdragerad tablett
Glivec 100 mg filmdragerade tabletter
Mycket mörkgul till brunaktigt orange, rund filmdragerad tablett, märkt "NVR" på ena sidan och "SA" samt med brytskåra på den andra sidan.
Glivec 400 mg filmdragerade tabletter
Mycket mörkgul till brunaktigt orange, oval, bikonvex filmdragerad tablett med fasade kanter. Märkt ”400” på ena sidan och brytskåra på andra sidan med ”SL” på varje sida om brytskåran.
De filmdragerade tabletterna kan delas i två lika stora doser.
Förpackningsinformation
Filmdragerad tablett 100 mg
mycket mörkgul till brunaktigt orange, rund filmdragerad tablett, märkt "NVR" på ena sidan och "SA" samt med brytskåra på den andra sidan
60 styck blister, 4217:42, F
60 styck blister (fri prissättning), tillhandahålls ej
Filmdragerad tablett 400 mg
Mycket mörkgul till brunaktigt orange, oval, bikonvex filmdragerad tablett med fasade kanter. Märkt ”400” på ena sidan och brytskåra på andra sidan med ”SL” på varje sida om brytskåran.
30 styck blister, 8374:51, F
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 100 mg
Filmdragerad tablett 400 mg





