Indikationer
Behandling av diabetes mellitus hos vuxna, ungdomar och barn från 6 års ålder.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Dosering
Toujeo är ett basinsulin som ska administreras en gång dagligen och kan ges när som helst under dagen, helst vid samma tidpunkt varje dag.
Dosregimen (dos och tidpunkt) ska anpassas individuellt.
Vid typ 1-diabetes mellitus ska Toujeo kombineras med ett kort-/snabbverkande insulin för att kompensera för insulinbehovet vid måltider.
Hos patienter med typ 2-diabetes mellitus kan Toujeo även ges tillsammans med andra läkemedel mot hyperglykemi.
Styrkan för detta läkemedel anges i enheter. Dessa enheter är specifika för Toujeo och är inte detsamma som internationella enheter eller enheter som används för andra insulinanaloger (se avsnitt Farmakodynamik).
Flexibel doseringstidpunkt
Vid behov kan Toujeo administreras upp till 3 timmar före eller efter den vanliga tiden för dosering (se avsnitt Farmakodynamik).
Patienter som glömmer bort att ta en dos bör kontrollera sitt blodsocker och därefter återgå till sitt vanliga doseringsschema med dosering en gång dagligen. Patienterna ska informeras om att inte injicera dubbel dos för att kompensera för glömd dos.
Initiering
Patienter med typ 1-diabetes mellitus
Toujeo ska användas en gång dagligen tillsammans med ett måltidsinsulin och kräver individuell dosanpassning.
Patienter med typ 2-diabetes mellitus
Rekommenderad startdos är 0,2 enheter/kg följt av en individuell dosanpassning.
Byte mellan insulin glargin 100 enheter/ml och Toujeo
Insulin glargin 100 enheter/ml och Toujeo är inte bioekvivalenta och inte direkt utbytbara.
-
Byte från insulin glargin 100 enheter/ml till Toujeo kan göras enhet för enhet, men en högre dos av Toujeo (ungefär 10-18%) kan krävas för att uppnå målintervallet för plasmaglukos.
-
Vid byte från Toujeo till insulin glargin 100 enheter/ml ska dosen minskas (ungefär med 20%) för att minska risken för hypoglykemi.
Noggrann kontroll av metabolismen rekommenderas under omställningen och under de närmast påföljande veckorna.
Byte från andra basinsuliner till Toujeo
Vid byte från en behandlingsregim med ett medellångverkande eller långverkande insulin till en dosregim med Toujeo, kan en ändring av dosen av basinsulinet krävas och annan samtidig behandling av hyperglykemi behöva anpassas (dos och tidpunkt för tillägg av snabbverkande insuliner eller snabbverkande insulinanaloger eller doseringen av andra läkemedel mot hyperglykemi).
-
Byte från ett basinsulin, som ges en gång dagligen, till Toujeo en gång dagligen kan göras enhet för enhet baserat på den tidigare dosen basinsulin.
-
Vid byte från ett basinsulin, som ges två gånger dagligen, till Toujeo som ges en gång dagligen, är den rekommenderade initiala dosen av Toujeo 80% av den totala dagliga dosen av det tidigare basinsulinet.
Patienter som står på höga insulindoser, på grund av antikroppar mot humaninsulin, kan uppleva en förbättrad insulineffekt med Toujeo.
Noggrann kontroll av blodsockervärden rekommenderas under övergången och de närmast påföljande veckorna.
Med förbättrad metabol kontroll och åtföljande ökad insulinkänslighet kan det bli nödvändigt med ytterligare justering av dosregimen. Dosjustering kan också krävas om t.ex. patientens vikt eller livsstil förändras, tidpunkten för insulindosen ändras eller andra omständigheter uppkommer som ökar känsligheten för hypo- eller hyperglykemi (se avsnitt Varningar och försiktighet).
Byte från Toujeo till andra basinsuliner
Medicinsk övervakning med noggrann kontroll av metabolismen rekommenderas under övergången och de närmast påföljande veckorna.
Läs produktresumén för det läkemedel som patienten byter till.
Särskilda patientgrupper
Toujeo kan ges till äldre patienter och till patienter med nedsatt njur- eller leverfunktion och till ungdomar och barn från 6 års ålder.
Äldre patienter (≥65 år)
Hos äldre kan progressiv försämring av njurfunktionen leda till ett stadigt minskat behov av insulin (se avsnitt Biverkningar och Farmakodynamik).
Nedsatt njurfunktion
Hos patienter med nedsatt njurfunktion kan insulinbehovet vara nedsatt på grund av minskad insulinmetabolism (se avsnitt Biverkningar).
Nedsatt leverfunktion
Hos patienter med nedsatt leverfunktion kan insulinbehovet vara nedsatt till följd av minskad kapacitet för glukoneogenes och minskad insulinmetabolism.
Pediatrisk population
Toujeo kan användas till ungdomar och barn från 6 års ålder baserat på samma principer som för vuxna patienter (se avsnitt Farmakodynamik och Farmakokinetik). Vid övergång från basinsulin till Toujeo måste en dosminskning av bas- och bolusinsulin övervägas för varje enskild patient för att minska risken för hypoglykemi (se avsnitt Varningar och försiktighet). Säkerheten och effekten av Toujeo har inte fastställts hos barn yngre än 6 år. Inga data finns tillgängliga.
Administreringssätt
Toujeo administreras subkutant.
Toujeo ges som en subkutan injektion i buk, överarm eller lår.
Injektionsstället ska roteras inom ett givet injektionsområde från den ena injektionen till den andra för att minska risken för lipodystrofi och kutan amyloidos (se avsnitt Varningar och försiktighet och Biverkningar).
Toujeo får inte administreras intravenöst. Den förlängda effektdurationen för Toujeo är beroende av att det injiceras i subkutan vävnad. Intravenös administrering av den vanliga subkutana dosen kan resultera i allvarlig hypoglykemi.
Toujeo får inte användas i infusionspumpar.
Toujeo finns tillgänglig i två förfyllda pennor. Dosfönstret visar antalet enheter av Toujeo som ska injiceras. Toujeo SoloStar och Toujeo DoubleStar förfyllda pennor har utformats speciellt för Toujeo och därför krävs ingen omräkning av dosen för någon av pennorna.
Innan Toujeo SoloStar förfylld penna eller Toujeo DoubleStar förfylld penna används måste bruksanvisningen som finns i bipacksedeln läsas noggrant (se avsnitt Hållbarhet, förvaring och hantering).
Med Toujeo SoloStar förfylld penna kan en dos på mellan 1-80 enheter per enskild injektion ges i dossteg om 1 enhet.
Med Toujeo DoubleStar förfylld penna kan en dos på mellan 2-160 enheter per enskild injektion ges i dossteg om 2 enheter.
Vid byte från Toujeo SoloStar till Toujeo DoubleStar, om patientens tidigare dos var ett udda antal (t ex 23 enheter), måste dosen ökas eller minskas med 1 enhet (t ex 24 eller 22 enheter).
Toujeo DoubleStar förfylld penna rekommenderas för patienter som behöver minst 20 enheter per dag. (se avsnitt Hållbarhet, förvaring och hantering).
Toujeo får inte dras upp ur cylinderampullen i Toujeo SoloStar förfylld penna eller Toujeo DoubleStar förfylld penna med hjälp av en spruta. Det kan resultera i en allvarlig överdosering (se avsnitt Varningar och försiktighet, Överdosering och Hållbarhet, förvaring och hantering).
En ny steril nål måste sättas fast före varje injektion. Återanvändning av nålar ökar risken för igentäppta nålar, vilket kan orsaka under- eller överdosering (se avsnitt Varningar och försiktighet och Hållbarhet, förvaring och hantering).
För att förhindra eventuell överföring av sjukdom, ska insulinpennorna aldrig användas till mer än en person, även om man byter injektionsnål (se avsnitt Hållbarhet, förvaring och hantering).
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Toujeo ska inte användas för behandling av diabetesketoacidos. Behandling med snabbverkande insulin, som ges intravenöst, rekommenderas vid detta tillstånd.
Vid otillfredsställande blodsockerkontroll eller vid benägenhet för hyper- eller hypoglykemiska episoder måste en kontroll göras av patientens följsamhet till den föreskrivna behandlingsregimen, val av injektionsställen och injektionsteknik samt alla andra relevanta faktorer, innan en dosjustering övervägs.
Patienterna måste instrueras att kontinuerligt växla injektionsställe för att minska risken för lipodystrofi och kutan amyloidos. Det finns en potentiell risk för fördröjd insulinabsorption och försämrad glykemisk kontroll efter insulininjektioner på ställen där dessa reaktioner förekommer. En plötslig ändring av injektionsställe till ett intakt område har visat sig resultera i hypoglykemi. Övervakning av blodsockervärdena rekommenderas efter ändring av injektionsställe. Justering av dosen diabetesläkemedel kan också behövas.
Hypoglykemi
Tidpunkten för när hypoglykemi uppstår beror på verkningsprofilen hos de insuliner som används och kan därför ändras när behandlingsregimen ändras.
Särskild försiktighet bör iakttas och intensifierad blodsockerkontroll är tillrådlig hos patienter för vilka hypoglykemiska episoder kan vara av särskild klinisk betydelse, t.ex. hos patienter med signifikanta stenoser i kranskärlen eller i blodkärlen som försörjer hjärnan (risk för kardiella eller cerebrala komplikationer p.g.a. hypoglykemi) och hos patienter med proliferativ retinopati, särskilt om denna ej behandlats med fotokoagulation (risk för transitorisk amauros efter hypoglykemi).
Patienter bör känna till under vilka omständigheter varningssymtomen på hypoglykemi är försvagade. Hos vissa riskgrupper kan varningssymtomen på hypoglykemi vara förändrade, mindre uttalade eller utebli. Till dessa hör patienter:
-
vars blodsockerkontroll är märkbart förbättrad,
-
hos vilka hypoglykemi utvecklas gradvis,
-
som är äldre,
-
som har bytt från animalt insulin till humaninsulin,
-
som har en autonom neuropati,
-
som har haft diabetes länge,
-
som lider av psykisk sjukdom,
-
som får samtidig behandling med vissa andra läkemedel (se avsnitt Interaktioner).
Sådana situationer kan ge upphov till allvarlig hypoglykemi (och möjligen medföra medvetslöshet) innan patienten inser att det är hypoglykemi.
Den förlängda effekten av insulin glargin kan fördröja återhämtningen från hypoglykemi.
Om normala eller sänkta värden för glykosylerat hemoglobin konstateras måste risken för återkommande, ej uppmärksammade (särskilt nattliga) episoder med hypoglykemi beaktas.
För att reducera risken för hypoglykemi är det av avgörande betydelse att patienten följer dos- och dietföreskrifterna och administrerar insulinet korrekt samt uppmärksammar symtom på hypoglykemi. Faktorer som ökar benägenheten för hypoglykemi kräver särskilt noggrann övervakning och kan göra det nödvändigt med en dosjustering. Till dessa hör:
-
byte av injektionsområde,
-
ökad insulinkänslighet (t.ex. genom eliminering av stressfaktorer),
-
ovana vid, ökad eller långvarig fysisk aktivitet,
-
interkurrenta sjukdomar (t.ex. kräkningar, diarré),
-
otillräckligt födointag,
-
uteblivna måltider,
-
alkoholkonsumtion,
-
vissa okompenserade endokrina störningar, (t.ex. hypotyreoidism och främre hypofys- eller binjurebarksinsufficiens).
-
samtidig behandling med vissa andra läkemedel (se avsnitt Interaktioner).
Byte mellan insulin glargin 100 enheter/ml och Toujeo
Eftersom insulin glargin 100 enheter/ml och Toujeo inte är bioekvivalenta och inte utbytbara, kan bytet innebära att dosen måste ändras. Bytet ska därför endast ske under strikt medicinsk övervakning (se avsnitt Dosering).
Byte mellan andra insuliner och Toujeo
Byte mellan andra typer av insulin eller insulinmärken och Toujeo bör ske under noggrann medicinsk övervakning. Ändring av styrka, märke (tillverkare), typ (regular, NPH, Lente, långverkande, osv.), ursprung (animaliskt, humant, humana insulinanaloger) och/eller tillverkningsmetod kan resultera i att dosen behöver ändras (se avsnitt Dosering).
Interkurrent sjukdom
Interkurrent sjukdom kräver intensifierad metabol övervakning. I många fall är urintest för ketoner indicerat och det är ofta nödvändigt att justera insulindosen. Insulinbehovet ökar vanligen. Patienter med typ1-diabetes måste fortsätta att regelbundet inta åtminstone en liten mängd kolhydrater, även om de bara kan äta lite eller inte alls eller kräks osv., och de får aldrig hoppa över insulinet helt.
Insulinantikroppar
Administrering av insulin kan leda till att antikroppar mot insulinet bildas. I sällsynta fall kan förekomsten av antikroppar mot insulinet kräva justering av insulindosen för att korrigera tendens till hyper- eller hypoglykemi.
Kombination med Toujeo och pioglitazon
Fall av hjärtsvikt har rapporterats när pioglitazon använts tillsammans med insulin, särskilt hos patienter med riskfaktorer för att utveckla hjärtsvikt. Detta bör man tänka på om man överväger kombinationsbehandling med pioglitazon och Toujeo. Om kombinationen används ska patienten observeras avseende tecken och symtom på hjärtsvikt, viktökning och ödem. Pioglitazon ska sättas ut om någon försämring av hjärtsymtomen inträffar.
Förebyggande av felmedicinering
Läkemedelsfel har rapporterats i vilka andra insuliner, särskilt snabbverkande insuliner, har administrerats av misstag i stället för långverkande insuliner. Insulinetiketten måste alltid kontrolleras före varje injektion för att undvika felmedicinering av Toujeo och andra insuliner (se avsnitt Hållbarhet, förvaring och hantering).
För att undvika doseringsfel och eventuell överdosering måste patienterna instrueras att aldrig använda en spruta för att avlägsna Toujeo (insulin glargin 300 enheter/ml) från en Toujeo SoloStar förfylld penna eller en Toujeo DoubleStar förfylld penna (se avsnitt Överdosering och Hållbarhet, förvaring och hantering).
En ny steril nål måste sättas fast före varje injektion. Patienter måste också instrueras att inte återanvända nålar. Återanvändning av nålar ökar risken för att dessa täpps igen vilket kan orsaka underdosering eller överdosering. I händelse av igentäppt nål måste patienterna följa anvisningarna som beskrivs i steg 3 i bruksanvisningen som medföljer bipacksedeln (se avsnitt Hållbarhet, förvaring och hantering).
Patienterna måste visuellt kontrollera antalet valda enheter på pennans dosväljare. Patienter som är blinda eller har dålig syn ska instrueras i att få hjälp från en annan person med bra syn och som är tränad i att använda insulinpennor.
Se även avsnitt Dosering under ”Administreringssätt”.
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill “natriumfritt”.
Interaktioner
Ett antal substanser påverkar glukosomsättningen och kan kräva dosanpassning av insulin glargin.
Substanser som kan öka den blodsockersänkande effekten och öka benägenheten för hypoglykemi inkluderar läkemedel mot hyperglykemi, ACE-hämmare, disopyramid, fibrater, fluoxetin, monoaminoxidas(MAO)-hämmare, pentoxifyllin, propoxifen, salicylater och sulfonamidantibiotika.
Substanser som kan minska den blodsockersänkande effekten inkluderar kortikosteroider, danazol, diazoxid, diuretika, glukagon, isoniazid, östrogener och progestogener, fentiazinderivat, somatropin, sympatomimetika (t.ex. epinefrin [adrenalin], salbutamol, terbutalin), tyroideahormoner, atypiska antipsykotiska läkemedel (t.ex. klozapin och olanzapin) och proteashämmare.
Betablockerare, klonidin, litiumsalter eller alkohol kan antingen förstärka eller försvaga insulinets blodsockersänkande effekt. Pentamidin kan förorsaka hypoglykemi som ibland kan följas av hyperglykemi.
Under påverkan av sympatikolytiska läkemedel såsom betablockerare, klonidin, guanetidin och reserpin kan dessutom tecknen på adrenerg motreglering försvagas eller utebli.
Graviditet
Det finns ingen klinisk erfarenhet från användning av Toujeo hos gravida kvinnor.
För insulin glargin saknas data från kontrollerade kliniska studier av behandling av gravida kvinnor.
En stor mängd data på gravida kvinnor (över 1000 graviditeter med ett läkemedel som innehåller insulin glargin 100 enheter/ml) tyder inte på några specifika negativa effekter av insulin glargin på graviditet och inga specifika missbildningar eller fetal/neonatal toxicitet orsakad av insulin glargin.
Data från djur tyder inte på någon reproduktionstoxicitet.
Användning av Toujeo kan övervägas under graviditet, om det är kliniskt motiverat.
Det är av avgörande betydelse att patienter med redan existerande diabetes eller havandeskapsdiabetes upprätthåller en god metabol kontroll under hela graviditeten, för att förhindra komplikationer i samband med hyperglykemi. Insulinbehovet kan minska under den första trimestern och ökar vanligen under den andra och tredje trimestern. Omedelbart efter förlossningen minskar insulinbehovet snabbt (ökad risk för hypoglykemi). Noggrann kontroll av blodsockervärdena är nödvändig.
Amning
Det är okänt om insulin glargin utsöndras i bröstmjölk. Ingen metabolisk effekt av intaget insulin glargin hos det ammande nyfödda barnet/spädbarnet förväntas eftersom insulin glargin är en peptid som bryts ner till aminosyror i magtarmkanalen.
Ammande kvinnor kan behöva ändra insulindosen och dieten.
Fertilitet
Djurstudier tyder inte på några skadliga effekter avseende fertilitet.
Trafik
Patientens koncentrations- och reaktionsförmåga kan försämras till följd av hypoglykemi eller hyperglykemi eller exempelvis till följd av nedsatt synförmåga. Detta kan innebära en risk i situationer där denna förmåga är särskilt viktig (t.ex. när man kör bil eller använder maskiner).
Patienterna bör uppmanas att vidta åtgärder för att undvika hypoglykemi under bilkörning. Detta är särskilt viktigt för dem som har försvagade varningssignaler för hypoglykemi eller saknar varningssignaler och för dem som ofta har episoder med hypoglykemi. Under dessa omständigheter bör man överväga om det är lämpligt att köra bil eller använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Följande biverkningar observerades i kliniska studier med Toujeo (se avsnitt Farmakodynamik) och vid klinisk erfarenhet med insulin glargin 100 enheter/ml.
Hypoglykemi, som vanligen är den mest frekventa biverkan vid insulinterapi, kan uppkomma om insulindosen överskrider behovet.
Lista med biverkningar i tabellform
Följande relaterade biverkningar från kliniska studier, klassificerade efter organsystem och i minskande frekvensordning, listas nedan (mycket vanlig: ≥1/10; vanlig: ≥1/100, <1/10; mindre vanlig: ≥1/1000, <1/100; sällsynt ≥1/10 000, <1/1000: mycket sällsynt; <1/10 000; ingen känd frekvens: kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
MedDRA Organsystem |
Mycket vanlig |
Vanlig |
Mindre vanlig |
Sällsynt |
Mycket sällsynt |
Ingen känd frekvens |
|---|---|---|---|---|---|---|
|
Immunsystemet |
Allergisk reaktion |
|
||||
|
Metabolism och nutrition |
Hypoglykemi |
|
||||
|
Centrala och perifera nervsystemet |
Dysgeusi |
|
||||
|
Ögon |
Synnedsättning Retinopati |
|
||||
|
Hud och subkutan vävnad |
Lipohypertrofi |
Lipoatrofi |
Kutan amyloidos |
|||
|
Muskuloskeletala systemet och bindväv |
Myalgi |
|
||||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Reaktioner vid injektionsstället |
Ödem |
|
Beskrivning av utvalda biverkningar
Metabolism och nutrition
Allvarliga hypoglykemiska attacker kan, i synnerhet om de är återkommande, leda till neurologiska skador. Utdragna eller allvarliga hypoglykemiska episoder kan vara livshotande.
Hos många patienter föregås tecken och symtom på neuroglykopeni av tecken på adrenerg motreglering. Generellt gäller att ju mer och snabbare blodsockret faller desto mer markant blir motregleringen och dess symtom.
Immunsystemet
Omedelbara allergiska reaktioner mot insulin är sällsynta. Sådana reaktioner mot insulin (inklusive insulin glargin) eller mot något hjälpämne kan t.ex. medföra generella hudreaktioner, angioödem, bronkospasm, blodtrycksfall och chock och kan vara livshotande. I kliniska studier med Toujeo på vuxna patienter var förekomsten av allergiska reaktioner likartatad hos patienter som behandlades med Toujeo (5,3%) och hos patienter som behandlades med insulin glargin 100 enheter/ml (4,5%).
Ögon
En markant förändring i blodsockerkontrollen kan orsaka en övergående synförsämring på grund av en tillfällig förändring av linsens vätskefyllnad och dess refraktionsindex.
En långvarigt förbättrad blodsockerkontroll minskar risken för progression av diabetesretinopati. En intensifierad insulinterapi med en plötslig förbättring av blodsockerkontrollen kan emellertid ge upphov till att diabetesretinopatin tillfälligt försämras. Hos patienter med proliferativ retinopati kan allvarliga hypoglykemiska attacker orsaka transitorisk amauros särskilt om fotokoagulation ej har genomförts.
Hud och subkutan vävnad
Lipodystrofi och kutan amyloidos kan uppträda i injektionsområdet och fördröja den lokala insulinabsorptionen. Kontinuerlig växling av injektionsställe inom det angivna injektionsområdet kan bidra till att minska eller förhindra dessa reaktioner (se avsnitt Varningar och försiktighet).
Allmänna symtom och/eller symtom vid administreringsstället
Reaktioner på injektionsstället inkluderar rodnad, smärta, klåda, urtikaria, svullnad och inflammation. De flesta mindre reaktioner på insulin vid injektionsstället brukar vanligen gå över inom några dagar till några veckor. I kliniska studier med Toujeo på vuxna patienter var förekomsten av reaktioner på injektionsstället likartatad hos patienter som behandlades med Toujeo (2,5%) och hos patienter som behandlades med insulin glargin 100 enheter/ml (2,8%).
I sällsynta fall kan insulin förorsaka natriumretention och ödem, i synnerhet om en tidigare dålig metabol kontroll förbättras genom intensifierad insulinterapi.
Pediatrisk population
Toujeos säkerhet och effekt har påvisats i en studie på barn i åldern 6 till 18 år. Frekvensen, typen och svårighetsgraden av biverkningarna i den pediatriska populationen indikerar att det inte föreligger någon skillnad mot upplevelsen i den allmänna diabetespopulationen (se avsnitt Farmakodynamik). Klinisk säkerhetsinformation är inte tillgänglig för barn yngre än 6 år.
Andra särskilda populationer
Baserat på resultat från kliniska studier är säkerhetsprofilen för Toujeo hos äldre patienter och patienter med nedsatt njurfunktion likvärdig med den för hela populationen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Symtom
Överdosering av insulin kan leda till allvarlig och ibland långvarig och livshotande hypoglykemi.
Åtgärder
Mindre allvarliga hypoglykemiska attacker kan vanligen åtgärdas genom intag av kolhydrater. Justering av dosering, måltidsmönster eller fysisk aktivitet kan bli nödvändigt.
Allvarligare episoder med koma, kramper eller neurologiska störningar kan behandlas med intramuskulärt/subkutant glukagon eller koncentrerad intravenös glukos. Fortsatt kolhydratintag och observation kan bli nödvändigt, då hypoglykemi kan återkomma efter en till synes klinisk återhämtning.
Farmakodynamik
Verkningsmekanism
Den primära effekten av insulin, inklusive insulin glargin, är reglering av glukosmetabolismen. Insulin och dess analoger sänker blodsockernivåerna genom att stimulera perifert glukosupptag, särskilt i skelettmuskulatur och fettväv, och genom att hämma glukosproduktionen i levern. Insulin hämmar lipolys i fettceller, hämmar proteolys och ökar proteinsyntesen.
Farmakodynamisk effekt
Insulin glargin är en humaninsulinanalog konstruerad för att ha låg löslighet vid neutralt pH. Vid pH 4 är insulin glargin fullständigt lösligt. Efter injektion i subkutan vävnad neutraliseras den sura lösningen, vilket leder till bildning av en fällning från vilken små mängder insulin glargin frigörs kontinuerligt.
I euglykemiska undersökningar observerades att hos patienter med typ 1-diabetes var den glukossänkande effekten av Toujeo stabilare och förlängd jämfört med effekten av insulin glargin 100 enheter/ml efter en subkutan injektion. Diagram 1 visar resultatet från en cross-over studie på 18 patienter med typ 1-diabetes, som utfördes under maximalt 36 timmar efter injektion. Effekten av Toujeo varade längre än 24 timmar (upp till 36 timmar) vid kliniskt relevanta doser.
Den ytterligare fördröjda frisättningen av Toujeo jämfört med insulin glargin 100 enheter/ml kan tillskrivas minskningen av injektionsvolymen med två tredjedelar, vilket resulterar i en mindre yta hos fällningen.
Diagram 1: Verkningsprofil vid steady state hos patienter med typ 1-diabetes i en 36 timmars euglykemisk undersökning
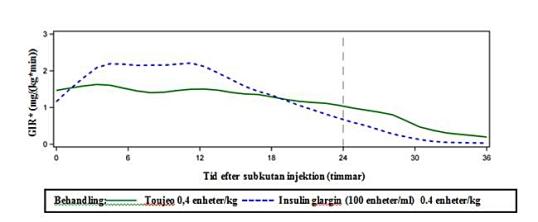
*GIR: Glucose infusion rate (glukosinfusionshastigheten): mängd infunderad glukos för att upprätthålla konstanta plasmaglukosnivåer (genomsnittligt värde per timme). Observationsperioden avslutades efter 36 timmar.
Insulin glargin metaboliseras till två aktiva metaboliter, M1 och M2 (se avsnitt Farmakokinetik).
Insulinreceptorbindning: In vitro studier tyder på att affiniteten till den humana insulinreceptorn för insulin glargin och dess två metaboliter M1 och M2 liknar den för humaninsulin.
IGF-1 receptorbindning: Insulin glargins affinitet för den humana IGF-1 receptorn är ungefär 5-8 gånger högre än för humaninsulin (men ungefär 70-80 gånger lägre än för IGF-1) medan M1 och M2 binder till IGF-1 receptorn med något lägre affinitet jämfört med humaninsulin.
Den totala terapeutiska insulinkoncentrationen (insulin glargin och dess metaboliter) som setts hos patienter med diabetes typ 1 var markant lägre än den som skulle behövas för att uppta hälften av maximal bindningskapacitet till IGF-1 receptorn och den efterföljande aktiveringen av den mitogena proliferativa signalvägen som initieras av IGF-1 receptorn. Fysiologisk koncentration av endogent IGF-1 kan aktivera den mitogena proliferativa signalvägen. Emellertid är de koncentrationer som man sett vid insulinbehandling, inklusive Toujeo-behandling, avsevärt lägre än den farmakologiska koncentration som behövs för att aktivera IGF-1 signalvägen.
I kliniska farmakologiska studier har intravenöst insulin glargin och humaninsulin visats vara ekvipotenta när de ges i samma doser.
Liksom med alla insuliner kan insulin glargins verkningstid påverkas av fysisk aktivitet och andra variabler.
Klinisk effekt och säkerhet
Den sammantagna effekten och säkerheten av Toujeo (insulin glargin 300 enheter/ml) en gång dagligen jämfördes med insulin glargin 100 enheter/ml i öppna, randomiserade parallellstudier som varade i upp till 26 veckor och inkluderade 546 patienter med typ 1-diabetes mellitus samt 2474 patienter med typ 2-diabetes mellitus (Tabell 1 och 2).
Resultaten från alla kliniska studier med Toujeo tyder på att minskningen av HbA1c från utgångsvärdet till studiens slut inte var underlägset insulin glargin 100 enheter/ml. Minskningen av plasmaglukos för Toujeo var vid studiens slut liknande den för insulin glargin 100 enheter/ml med en mer gradvis minskning under titreringsperioden för Toujeo. Den glykemiska kontrollen var likvärdig när Toujeo administrerades en gång dagligen på morgonen eller på kvällen.
Förbättringen av HbA1c påverkades inte av kön, etnicitet, ålder, durationen av diabetes (<10 år och ≥10 år), utgångsvärdet för HbA1c (<8% eller ≥8%) eller utgångsvärdet för BMI (body mass index).
Vid slutet av dessa studier observerades en 10-18% högre dos i Toujeo-gruppen än i jämförelsegruppen, beroende på patientpopulation och annan behandling (Tabell 1 och 2).
Resultaten från kliniska prövningar visar att förekomsten av bekräftad hypoglykemi (när som helst under dagen och på natten) var lägre hos patienter som behandlades med Toujeo jämfört med patienter som behandlades med insulin glargin 100 enheter/ml, hos patienter med typ 2-diabetes som behandlades i kombination med tabletter eller måltidsinsulin. Toujeos minskade risk för bekräftade nattliga hypoglykemier jämfört med insulin glargin 100 enheter/ml vid typ 2-diabetes visades hos patienter som behandlades i kombination med tabletter (18% riskreduktion) och i kombination med måltidsinsulin (21% riskreduktion) från vecka 9 till slutet av studieperioden.
Sammantaget observerades dessa effekter avseende risken för hypoglykemi genomgående oavsett ålder, kön, BMI och durationen av diabetes (<10 år och ≥10 år) hos Toujeo-behandlade patienter jämfört med patienter som behandlades med insulin glargin 100 enheter/ml.
Hos patienter med diabetes typ 1 var förekomsten av hypoglykemi liknande för patienter som behandlades med Toujeo jämfört med patienter som behandlades med insulin glargin 100 enheter/ml (Tabell 3).
|
26 veckors behandling |
||
|---|---|---|
|
IGlar: Insulin glargin 100 enheter/ml a mITT: Modifierad ITT( intention-to-treat) b Behandlingsskillnad: Toujeo– insulin glargin 100 enheter/ml; [95% konfidensintervall] c Förändring från utgångsvärdet till Månad 6 (observerade fall) d Förändring från utgångsvärdet till senast uppmätta värdet under 6 månaders behandling |
||
|
Toujeo |
IGlar |
|
|
Behandling i kombination med |
Måltidsinsulinanalog |
|
|
Antal behandlade individer (mITTa) |
273 |
273 |
|
HbA1c (anges i DCCT) |
||
|
Genomsnittligt utgångsvärde |
8,13 |
8,12 |
|
Justerad genomsnittlig förändring från utgångsvärdet |
-0,40 |
-0,.44 |
|
Justerad genomsnittlig skillnadb |
0,04 [-0,098 till 0,185] |
|
|
Basinsulindosc (enheter/kg) |
||
|
Genomsnittligt utgångsvärde |
0,32 |
0,32 |
|
Genomsnittlig förändring från utgångsvärdet |
0,15 |
0,09 |
|
Kroppsviktd (kg) |
||
|
Genomsnittligt utgångsvärde |
81,89 |
81,80 |
|
Genomsnittlig förändring från utgångsvärdet |
0,46 |
1,02 |
|
26 veckors behandling |
|||||||
|---|---|---|---|---|---|---|---|
|
IGlar: Insulin glargin 100 enheter/ml a mITT: Modifierad ITT (intention-to-treat) b Behandlingsskillnad: Toujeo- insulin glargin 100 enheter/ml; [95% konfidensintervall] c Förändring från utgångsvärdet till Månad 6 (observerade fall) d Förändring från utgångsvärdet till senast uppmätta värdet under 6 månaders behandling |
|||||||
|
Patienter som tidigare behandlades med basinsulin |
Patienter som tidigare behandlades med basinsulin |
Tidigare insulinnaiva patienter |
|||||
|
Behandling i kombination med |
Måltidsinsulinanalog
|
Läkemedel (som inte är ett insulin) mot hyperglykemi |
|||||
|
Toujeo |
IGlar |
Toujeo |
IGlar |
Toujeo |
IGlar |
||
|
Antal behandlade patientera |
404 |
400 |
403 |
405 |
432 |
430 |
|
|
HbA1c (anges i DCCT) |
|||||||
|
Genomsnittligt utgångsvärde |
8,13 |
8,14 |
8,27 |
8,22 |
8,49 |
8,58 |
|
|
Justerad genomsnittlig förändring från utgångsvärdet |
-0,90 |
-0,87 |
-0,73 |
-0,70 |
-1,42 |
-1,46 |
|
|
Justerad genomsnittlig skillnadb |
-0,03
|
-0,03
|
0,04
|
||||
|
Basinsulindosc (enheter/kg) |
|||||||
|
Genomsnittligt utgångsvärde |
0,67 |
0,67 |
0,64 |
0,66 |
0,19 |
0,19 |
|
|
Genomsnittlig förändring från utgångsvärdet |
0,31 |
0,22 |
0,30 |
0,19 |
0,43 |
0,34 |
|
|
Kroppsviktd (kg) |
|||||||
|
Genomsnittligt utgångsvärde |
106,11 |
106,50 |
98,73 |
98,17 |
95,14 |
95,65 |
|
|
Genomsnittlig förändring från utgångsvärdet |
0,93 |
0,90 |
0,08 |
0,66 |
0,50 |
0,71 |
|
|
Diabetespopulation |
Typ 1-diabetes
|
Typ 2-diabetes
|
Typ 2-diabetes
|
||||
|---|---|---|---|---|---|---|---|
|
IGlar: Insulin glargin 100 enheter/ml a Svår hypoglykemi: Episoder när hjälp av annan person krävs för att aktivt administrera kolhydrater, glukagon eller andra åtgärder. b Bekräftad hypoglykemi: All svår hypoglykemi och/eller hypoglykemi bekräftad genom plasmaglukosvvärde ≤3,9 mmol/l. c Nattlig hypoglykemi: Episoder som inträffade mellan kl. 00:00 och 05:59 d 6 månaders behandlingsperiod *RR: beräknad relativ risk (risk ratio); [95% konfidensintervall] |
|||||||
|
Behandling i kombination med |
Måltidsinsulinanalog |
Måltidsinsulinanalog +/-metformin |
Läkemedel (som inte är ett insulin) mot hyperglykemi |
||||
|
Toujeo |
IGlar |
Toujeo |
IGlar |
Toujeo |
IGlar |
||
|
Förekomst (%) av svåra hypoglykemi (n/totalt antal patienter) |
|||||||
|
Hela studieperiodend |
6,6 (18/274) |
9,5 (26/275) |
5,0 (20/404) |
5,7 (23/402) |
1,0 (8/838) |
1,2 (10/844) |
|
|
RR*: 0,69 [0,39;1,23] |
RR: 0,87 [0,48;1,55] |
RR: 0,82 [0,33;2,00] |
|||||
|
Förekomst (%) av bekräftadb hypoglykemi (n/totalt antal patienter) |
|||||||
|
Hela studieperioden |
93,1 (255/274) |
93,5 (257/275) |
81,9 (331/404) |
87,8 (353/402) |
57,6 (483/838) |
64,5 (544/844) |
|
|
RR: 1,00 [0,95;1,04] |
RR: 0,93 [0,88; 0,99] |
RR: 0,89 [0,83; 0,96] |
|||||
|
Förekomst (%) av bekräftad nattligc hypoglykemi (n/totalt antal patienter) |
|||||||
|
Från vecka 9 till studieperiodens slut |
59,3 (162/273) |
56,0 (153/273) |
36,1 (146/404) |
46,0 (184/400) |
18,4 (154/835) |
22,5 (188/835) |
|
|
RR: 1,06 [0,92;1,23] |
RR: 0,79 [0,67;0,93] |
RR: 0,82 [0,68;0,99] |
|||||
Flexibel doseringstidpunkt
Säkerheten och effekten av Toujeo har även utvärderats när det administrerades vid en fast eller flexibel doseringstidpunkt i 2 öppna, randomiserade kliniska studier under 3 månader. Patienter med typ 2-diabetes (n=194) fick Toujeo en gång dagligen på kvällen, antingen vid samma tid på dygnet (fast administreringstidpunkt) eller inom 3 timmar före eller efter den vanliga tidpunkten för dosering (flexibel doseringstidpunkt). Administrering med en flexibel tidpunkt för dosering hade ingen effekt på den glykemiska kontrollen och förekomsten av hypoglykemi.
Antikroppar
Resultaten från studier där Toujeo jämfördes med insulin glargin 100 enheter/ml tyder inte på någon skillnad mellan Toujeo och insulin glargin 100 enheter/ml avseende utveckling av antikroppar mot insulin.
Kroppsvikt
En genomsnittlig förändring av kroppsvikten på mindre än 1 kg, observerades hos Toujeo-behandlade patienter vid slutet av en 6 månaders period (Tabell 1 och 2).
Resultat från en studie avseende progression av diabetesretinopati
Effekten av insulin glargin 100 enheter/ml (givet en gång dagligen) på diabetesretinopati utvärderades i en öppen 5-årig studie i jämförelse med NPH-insulin (givet två gånger dagligen) hos 1024 patienter med typ 2-diabetes där progression av retinopati med 3 eller flera grader på skalan Early Treatment Diabetic Retinopathy Study (ETDRS) undersöktes genom ögonbottenfotografering. Ingen signifikant skillnad observerades avseende progression av diabetesretinopati då insulin glargin 100 enheter/ml jämfördes med NPH-insulin.
Resultat avseende långtidseffekt och säkerhet
Studien ORIGIN (Outcome Reduction with Initial Glargine INtervention) var en randomiserad multicenterstudie med en 2x2 faktoriell design, som utfördes på 12 357 deltagare med hög kardiovaskulär risk med förhöjt fasteglukos (IFG) eller nedsatt glukostolerans (IGT) (12% av deltagarna), eller typ 2-diabetes som behandlats med ≤1 peroralt antidiabetesmedel (88% av deltagarna). Deltagarna randomiserades (1:1) till att få insulin glargin 100 enheter/ml (n=6264) som titrerades för att uppnå fasteplasmaglukos ≤5,3 mmol/l eller standardbehandling (n=6273).
Det första primära effektmåttet var tid till först inträffad kardiovaskulär död, icke-dödlig hjärtinfarkt eller icke-dödlig stroke och det andra primära effektmåttet var tid till att någon av de första primära händelserna inträffade eller till revaskularisering (koronar, karotid eller perifer) eller sjukhusinläggning för hjärtsvikt.
Sekundära effektmått inkluderade mortalitet oberoende av orsak och ett sammantaget mikrovaskulärt resultat.
Insulin glargin 100 enheter/ml ändrade inte den relativa risken för kardiovaskulär sjukdom eller kardiovaskulär död jämfört med standardbehandling. Det fanns inga skillnader mellan insulin glargin och standardbehandling avseende de båda primära effektmåtten, någon av de effektmått som innefattar dessa resultat, mortalitet oberoende av orsak eller sammantaget mikrovaskulärt resultat.
Genomsnittlig dos av insulin glargin 100 enheter/ml vid studiens slut var 0,42 enheter/kg. Vid utgångsläget (baseline) hade deltagarna ett medianvärde av HbA1c (anges i DCCT) på 6,4%. Medianen för HbA1c-värdena under behandling varierade från 5,9 till 6,4% för insulin glargin (100 enheter/ml)-gruppen och från 6,2% till 6,6% för standardbehandlingsgruppen under hela uppföljningstiden.
Frekvensen av allvarlig hypoglykemi (antal drabbade patienter per 100 patientårs exponering) var 1,05 för insulin glargin 100 enheter/ml och 0,30 för standardbehandlingsgruppen och frekvensen av bekräftad ej allvarlig hypoglykemi var 7,71 för insulin glargin 100 enheter/ml och 2,44 för standardbehandlingsgruppen. Under hela den 6 år långa studien var det 42% i insulin glargin-gruppen som aldrig drabbades av hypoglykemi.
Vid det sista besöket under behandlingen hade kroppsvikten i genomsnitt ökat med 1,4 kg för insulin glargin (100 enheter/ml)-gruppen och sänkts med 0,8 kg för standardbehandlingsgruppen jämfört med utgångsvärdet.
Pediatrisk population
Toujeos effektivitet och säkerhet har studerats i en 1:1 randomiserad kontrollerad öppen klinisk studie hos barn och ungdomar med typ 1-diabetes mellitus under en period av 26 veckor (n = 463). Patienter i Toujeo-armen inkluderade 73 barn i åldern <12 år och 160 barn i åldern ≥12 år. Toujeo doserad en gång dagligen visade en liknande minskning av HbA1c och FPG från utgångsläge (baseline) till vecka 26 jämfört med insulin glargin 100 enheter/ml.
Dosresponsanalysen visade att efter den initiala titreringsfasen är kroppsviktsjusterade doser hos pediatriska patienter högre än hos vuxna patienter i stabilt tillstånd.
Den sammantagna förekomsten av hypoglykemi hos patienter i någon av kategorierna var likartad i båda behandlingsgrupperna, med 97,9% av patienterna i Toujeo-gruppen och 98,2% i insulin glargin 100 enheter/ml-gruppen som rapporterade om minst en händelse. På liknande sätt var förekomst av nattlig hypoglykemi jämförbar i behandlingsgrupperna med Toujeo respektive insulin glargin 100 enheter/ml. Andelen patienter som rapporterade svår hypoglykemi var lägre hos patienter i Toujeo-gruppen jämfört med patienter i insulin glargin 100 enheter/ml-gruppen, 6% respektive 8,8%. Andelen patienter med hyperglykemiska episoder med ketos var lägre för Toujeo jämfört med insulin glargin 100 enheter/ml, 6,4% respektive 11,8%. Inga säkerhetsproblem identifierades med Toujeo med avseende på biverkningar och standard säkerhetsparametrar. Antikroppsutvecklingen var begänsad och hade ingen klinisk effekt. Effektivitets- och säkerhetsdata för pediatriska patienter med typ 2-diabetes mellitus har extrapolerats från data för ungdomar och vuxna patienter med typ 1-diabetes mellitus och vuxna patienter med typ 2-diabetes mellitus. Resultat stödjer användningen av Toujeo hos barn med typ 2-diabetes mellitus.
Farmakokinetik
Absorption och distribution
Hos friska individer och diabetespatienter tyder insulinserumkoncentrationerna på en långsammare och mer utdragen absorption, vilket resulterar i en flackare tidskoncentrationsprofil efter subkutan injektion av Toujeo jämfört med insulin glargin 100 enheter/ml.
De farmakokinetiska profilerna överensstämde med Toujeos farmakodynamiska aktivitet.
Steady state-nivån inom det terapeutiska intervallet nås efter 3-4 dagars daglig administrering av Toujeo.
Efter subkutan injektion av Toujeo är den intraindividuella variabiliteten (vilken definieras som koefficienten för variationen vid insulinexponering under 24 timmar) låg vid steady state (17,4%).
Metabolism
Efter subkutan injektion av insulin glargin, metaboliseras insulin glargin snabbt vid beta-kedjans terminala karboxylgrupp och bildar de aktiva metaboliterna M1 (21A-Gly-insulin) och M2 (21A-Gly-des-30B-Thr-insulin). I plasma cirkulerar huvudsakligen metaboliten M1. Exponeringen för M1 ökar med administrerad dos insulin glargin. De farmakokinetiska och farmakodynamiska fynden indikerar att effekten av den subkutana injektionen med insulin glargin huvudsakligen baseras på exponeringen för M1. Insulin glargin och metaboliten M2 var inte påvisbara hos den stora majoriteten av patienter och när de var påvisbara var koncentrationen oberoende av administrerad dos och beredningsform av insulin glargin.
Eliminering
Vid intravenös administrering var halveringstiderna i eliminationsfasen för insulin glargin och humaninsulin jämförbara.
Halveringstiden efter subkutan administrering av Toujeo bestäms av absorptionshastigheten från subkutan vävnad. Toujeos halveringstid efter en subkutan injektion är 18-19 timmar oberoende av dosen.
Pediatrisk population
Befolkningsfarmakokinetisk analys genomfördes för Toujeo baserat på koncentrationsdata för dess huvudmetabolit M1 med användning av data från 75 pediatriska personer (6 till <18 år) med typ 1-diabetes. Kroppsvikt påverkar clearance av Toujeo på ett olinjärt sätt. Som en följd av detta är exponeringen (AUC) hos pediatriska patienter något lägre jämfört med vuxna patienter när de fick samma kroppsviktjusterade dos.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet, och reproduktionseffekter visade inte några särskilda risker för människa.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje ml innehåller 300 enheter insulin glargin* (motsvarande 10,91 mg).
SoloStar injektionspenna
Varje injektionspenna innehåller 1,5 ml injektionsvätska, vilket motsvarar 450 enheter.
DoubleStar injektionspenna
Varje injektionspenna innehåller 3 ml injektionsvätska, vilket motsvarar 900 enheter.
*Insulin glargin tillverkas genom rekombinant DNA-teknik, varvid Escherichia coli används.
Förteckning över hjälpämnen
Zinkklorid
Metakresol
Glycerol
Saltsyra (för pH-justering)
Natriumhydroxid (för pH-justering)
Vatten för injektionsvätskor
Blandbarhet
Toujeo får inte blandas eller spädas med andra insuliner eller andra läkemedel.
Blandning eller spädning av Toujeo kan ändra tids-/verkningsprofilen och blandning kan ge upphov till fällning.
Miljöpåverkan
Insulin, glargin
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CHMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment.
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
Hållbarhet, förvaring och hantering
Hållbarhet
Toujeo SoloStar
30 månader.
Toujeo DoubleStar
36 månader.
Hållbarhet efter första användning av injektionspennan
Läkemedlet kan förvaras maximalt 6 veckor under 30°C och i skydd mot direkt värme eller direkt ljus. Pennor under användning får inte förvaras i kylskåp. Skyddslocket måste sättas tillbaka på pennan efter varje injektion. Ljuskänsligt.
Särskilda förvaringsanvisningar
Före första användning
Förvaras i kylskåp (2°C-8°C).
Får ej frysas eller förvaras i direktkontakt med frysfack eller kylklamp.
Förvara den förfyllda injektionspennan i ytterkartongen. Ljuskänsligt.
Efter första användning eller om pennan medtages som reserv
Särskilda anvisningar för destruktion
Innan injektionspennan används första gången, måste den förvaras vid rumstemperatur i minst 1 timme före användning.
Innan Toujeo SoloStar eller Toujeo DoubleStar förfylld penna används, måste bruksanvisningen som finns i bipacksedeln läsas noggrant. Toujeo förfyllda pennor måste användas enligt rekommendationerna i denna bruksanvisning (se avsnitt Dosering). Instruera patienter att utföra ett säkerhetstest enligt beskrivningen i steg 3 i bruksanvisingen. Om patienter inte gör säkerhetstestet är det osäkert om hela dosen levererats. Om detta sker bör patienter utföra tätare kontroller av blodglukosnivåer samt eventuellt administrera ytterligare insulin.
Cylinderampullen ska inspekteras före användning. Endast klar, färglös lösning, utan synliga fasta partiklar och med vattenlik konsistens får användas. Eftersom Toujeo är en klar lösning, behöver den inte skakas eller blandas före användning.
Insulinetiketten måste alltid kontrolleras före varje injektion för att undvika felmedicinering av Toujeo och andra insuliner. Styrkan ”300” är markerad i honungsgult på etiketten (se avsnitt Varningar och försiktighet).
Patienter bör informeras att dosräknaren hos Toujeo SoloStar eller Toujeo DoubleStar förfylld penna visar antalet enheter av Toujeo som ska injiceras. Ingen omräkning av dosen krävs.
-
Toujeo SoloStar pennan innehåller 450 enheter av Toujeo. Den levererar doser om 1-80 enheter per injektion, i dossteg om 1 enhet.
-
Toujeo DoubleStar pennan innehåller 900 enheter av Toujeo. Den levererar doser om 2-160 enheter per injektion, i dossteg om 2 enheter.
-
För att minska risken för eventuell underdosering, rekommenderas Toujeo DoubleStar för patienter som kräver minst 20 enheter per dag.
-
-
Om säkerhetstest ej genomförs innan första användning av en ny penna, kan underdosering av insulin förekomma.
Man får aldrig använda en spruta för att dra upp Toujeo ur cylinderampullen i en SoloStar förfylld penna. Det kan resultera i en allvarlig överdosering (se avsnitt Dosering, Varningar och försiktighet och Överdosering).
En ny steril nål måste sättas fast före varje injektion. Nålar måste kasseras omedelbart efter användning. Nålar får inte återanvändas. Återanvändning av nålar ökar risken för igentäppta nålar, vilket kan leda till under- eller överdosering. Användning av en ny steril nål för varje injektion minimerar även risken för kontaminering och infektion. I händelse av en igentäppt nål, måste patienterna följa instruktionerna som beskrivs i Steg 3 i bruksanvisningen som medföljer bipacksedeln (se avsnitt Dosering och Varningar och försiktighet).
Använda nålar ska kasseras i en punktionssäker behållare eller enligt gällande rutiner.
Tomma pennor får aldrig återanvändas och måste kasseras enligt gällande rutiner.
För att förhindra eventuell överföring av sjukdom, ska injektionspennan aldrig användas till mer än en person, även om man byter injektionsnål (se avsnitt Dosering).
Egenskaper hos läkemedelsformen
Injektionsvätska, lösning (injektionsvätska).
Klar färglös lösning.
Förpackningsinformation
TOUJEO DOUBLESTAR
Injektionsvätska, lösning i förfylld injektionspenna 300 enheter/ml
(klar, färglös)
3 x 3 milliliter förfylld injektionspenna, 776:90, (F)
TOUJEO SOLOSTAR
Injektionsvätska, lösning i förfylld injektionspenna 300 enheter/ml
(klar, färglös)
5 x 1,5 milliliter förfylld injektionspenna, 655:45, (F)
10 x 1,5 milliliter förfylld injektionspenna, 1262:67, (F)





