1 LÄKEMEDLETS NAMN
Lucentis 10 mg/ml injektionsvätska, lösning i förfylld spruta
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
En ml innehåller 10 mg ranibizumab*. En förfylld spruta innehåller 0,165 ml, vilket motsvarar 1,65 mg ranibizumab. Den utvinningsbara volymen av en förfylld spruta är 0,1 ml. Detta motsvarar en brukbar mängd tillräcklig för att administrera en enskild dos på 0,05 ml innehållande 0,5 mg ranibizumab.
*Ranibizumab är ett humaniserat monoklonalt antikroppsfragment som framställs i Escherichia coli-celler med rekombinant DNA-teknik.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Injektionsvätska, lösning.
Klar, färglös till svagt brungul vattenlösning.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Lucentis är avsett till vuxna för:
-
Behandling av neovaskulär (våt) åldersrelaterad makuladegeneration (AMD)
-
Behandling av nedsatt syn på grund av diabetiska makulaödem (DME)
-
Behandling av proliferativ diabetesretinopati (PDR)
-
Behandling av nedsatt syn på grund av makulaödem till följd av retinal venocklusion (RVO) (grenvensocklusion eller centralvensocklusion)
-
Behandling av nedsatt syn på grund av koroidal neovaskularisering (CNV)
4.2 Dosering och administreringssätt
Lucentis skall administreras av en utbildad oftalmolog med erfarenhet av intravitreala injektioner.
Dosering
Den rekommenderade dosen av Lucentis är 0,5 mg, administrerad som en intravitreal injektion. Detta motsvarar en injektionsvolym på 0,05 ml. Intervallet mellan två doser injicerade i samma öga ska vara minst fyra veckor.
Behandlingen inleds med en injektion per månad och fortsätter tills maximal synskärpa har uppnåtts och/eller inga tecken på sjukdomsaktivitet förekommer, det vill säga inga förändringar avseende synskärpa och andra sjukdomstecken eller symptom under pågående behandling. Hos patienter med våt AMD, DME, PDR och RVO, kan det vara nödvändigt att initialt ge tre eller flera på varandra följande, månatliga injektioner.
Därefter ska behandlande läkare bestämma lämpliga kontroll- och behandlingsintervall vilka baseras på sjukdomsaktivitet bedömd utifrån patientens synskärpa och/eller anatomiska parametrar.
Om läkaren anser att visuella och anatomiska parametrar indikerar att patienten inte drar nytta av fortsatt behandling bör behandling med Lucentis avbrytas.
Kontroller avseende sjukdomsaktivitet kan omfatta klinisk undersökning, funktionstestning eller bilddiagnostik (exempelvis optisk koherenstomografi (OCT) eller fluoresceinangiografi (FA)).
Om patienterna behandlas enligt ”treat-and-extend”-modellen kan behandlingsintervallen gradvis utökas så snart maximal synskärpa uppnåtts och/eller inga tecken på sjukdomsaktivitet förekommer fram till dess att sjukdomsaktivitet eller synförsämring inträffar. Behandlingsintervallen bör inte utökas med mer än två veckor i taget för våt AMD och kan utökas med upp till en månad i taget för DME. För PDR och RVO kan behandlingsintervall också gradvis utökas, men det finns inte tillräckligt med data för att kunna dra slutsatser om längden av dessa intervaller. Om sjukdomsaktiviteten återkommer ska behandlingsintervallen förkortas.
Behandling av synnedsättningar på grund av koroidal neovaskularisering (CNV) bör anpassas individuellt för respektive patient baserat på sjukdomsaktivitet. En del patienter behöver endast en injektion under de första 12 månaderna; andra behöver mer frekvent behandling, inkluderat månatliga injektioner. Vid CNV till följd av patologisk myopi (PM) behöver många patienter endast en eller två injektioner under det första året (se avsnitt 5.1).
Lucentis och fotokoagulation med laser vid DME och vid makulaödem till följd av BRVO
Det finns en viss erfarenhet av att administrera Lucentis samtidigt med fotokoagulation med laser (se avsnitt 5.1). När det ges samma dag ska Lucentis administreras minst 30 minuter efter fotokoagulationen med laser. Lucentis kan administreras till patienter som tidigare har fått fotokoagulation med laser.
Lucentis och verteporfin fotodynamisk terapi vid CNV till följd av PM
Det finns ingen erfarenhet av samtidig administrering av Lucentis och verteporfin.
Särskilda patientgrupper
Nedsatt leverfunktion
Lucentis har inte undersökts hos patienter med nedsatt leverfunktion. Det behövs dock inte något särskilt hänsynstagande i denna patientgrupp.
Nedsatt njurfunktion
Det behövs ingen dosjustering till patienter med nedsatt njurfunktion (se avsnitt 5.2).
Äldre
Det krävs ingen dosjustering till äldre personer. Erfarenheten från patienter med DME som är äldre än 75 år är begränsad.
Pediatrisk population
Säkerhet och effekt för Lucentis för barn och ungdomar under 18 år har inte fastställts. Tillgänglig data hos ungdomar i åldern 12-17 år med synnedsättningar på grund av CNV finns angivet i avsnitt 5.1.
Administreringssätt
Förfylld spruta för engångsbruk, endast avsedd för intravitreal användning. Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 0,5 mg. All utvinningsbar volym i den förfyllda sprutan (0,1 ml) ska inte användas. Överskjutande volym ska drivas ut före injicering. Om hela volymen i den förfyllda sprutan injiceras kan detta leda till överdosering. För att driva ut luftbubblan samt överskjutande mängd läkemedel trycks kolven långsamt in ända tills kanten nedanför gummiproppens konvexa del hamnar i nivå med den svarta doseringslinjen på sprutan (vilket motsvarar 0,05 ml, dvs. 0,5 mg ranibizumab).
Lucentis skall granskas visuellt avseende partiklar och missfärgning före administrering.
Injektionsproceduren skall utföras under aseptiska förhållanden, vilket innefattar användning av kirurgisk handdesinfektion, sterila handskar, en steril duk och ett sterilt spekulum (eller motsvarande) samt tillgång till steril paracentes (vid behov). Patientens anamnes beträffande överkänslighetsreaktioner skall utvärderas noga innan den intravitreala proceduren utförs (se avsnitt 4.4). Adekvat anestetikum och en lokal bredspektrummikrobicid till desinficering av huden runt ögat samt ögonlocket och ögats yta skall administreras före injektionen i enlighet med lokal praxis.
För information om beredning av Lucentis se avsnitt 6.6.
Injektionskanylen skall stickas in 3,5-4,0 mm posteriort om limbus in i glaskroppsrummet med riktning mot ögonglobens centrum. Undvik att rikta nålen längs den horisontella meridianen. Därefter injiceras injektionsvolymen på 0,05 ml. Ett annat skleralt injektionsställe skall användas vid påföljande injektioner. Behandlingen utförs med en förfylld spruta per öga.
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
Patienter med aktiva eller misstänkta infektioner i eller runt ögat.
Patienter med aktiv svår intraokulär inflammation.
4.4 Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Intravitreala injektionsrelaterade reaktioner
Intravitreala injektioner, däribland injektioner med Lucentis, har förknippats med endoftalmit, intraokulär inflammation, regmatogen näthinneavlossning, näthinneruptur och iatrogen traumatisk katarakt. Använd alltid korrekta aseptiska injektionsmetoder då Lucentis administreras. Dessutom skall patienter kontrolleras under veckan efter injektionen för att möjliggöra tidig behandling om en infektion uppkommer. Patienter skall instrueras att omedelbart rapportera alla symtom som tyder på endoftalmit eller någon av ovannämnda händelser.
Ökning av intraokulärt tryck
Övergående ökning av det intraokulära trycket (IOP) har observerats inom 60 minuter efter injektion med Lucentis. Bestående ökning av IOP har också observerats (se avsnitt 4.8). Både det intraokulära trycket och perfusionen i synnervshuvudet måste kontrolleras och hanteras på lämpligt sätt.
Patienter bör informeras om symtom hos de potentiella biverkningarna och uppmanas att informera läkare om de utvecklar symtom som ögonsmärta eller ökat obehag, förvärrad rodnad i ögat, dimmig eller försämrad syn, ökat antal små partiklar i synfältet eller ökad ljuskänslighet (se avsnitt 4.8).
Bilateral behandling
Begränsade data från bilateral användning av Lucentis (inklusive administrering samma dag) tyder inte på en ökad risk för systemiska biverkningar jämfört med ensidig behandling.
Immunogenitet
Det finns en risk för immunogenitet med Lucentis. Eftersom det finns en potential för en ökad systemisk exponering hos patienter med DME kan man inte utesluta en ökad risk för utveckling av överkänslighet i denna patientpopulation. Patienter skall även instrueras att rapportera om en intraokulär inflammation förvärras, vilket kan vara ett kliniskt tecken på antikroppsbildning inne i ögat.
Samtidig användning av andra anti-VEGF (vaskulär endotelcellstillväxtfaktor)
Lucentis skall inte administreras samtidigt med andra anti-VEGF-läkemedel (systemiska eller okulära).
Uppehåll med Lucentis
Låt bli att dosera och avstå från att återuppta behandlingen tidigare än nästa planerade behandling om något av följande inträffar:
-
en minskning av synskärpan med bästa korrektion (BCVA) med ≥30 bokstäver jämfört med den senaste bedömningen av synskärpan;
-
ett intraokulärt tryck på ≥30 mmHg;
-
en bristning i retina;
-
en subretinal blödning som innefattar foveas centrum, eller om blödningens storlek är ≥50 % av det totala lesionsområdet;
-
utförd eller planerad intraokulär operation inom de föregående eller kommande 28 dagarna.
Ruptur av näthinnepigmentepitel
Riskfaktorer associerade med utveckling av ruptur av det retinala pigmentepitelet efter behandling med anti-VEGF terapi mot våt AMD och potentiellt också andra former av CNV är en stor och/eller hög pigmentepitelavlossning. När ranibizumabterapin påbörjas bör försiktighet beaktas hos patienter med dessa riskfaktorer för utveckling av ruptur av det retinala pigmentepitelet.
Regmatogen näthinneavlossning eller hål i makula
Avbryt behandlingen på patienter med regmatogen näthinneavlossning eller makulahål i stadium 3 eller 4.
Populationer med begränsade data
Det finns endast begränsade erfarenhet av att behandla patienter med DME på grund av typ I-diabetes. Lucentis har inte studerats på patienter som tidigare har fått intravitreala injektioner, patienter med aktiva systemiska infektioner eller patienter med samtidiga ögonsjukdomar som t.ex. näthinneavlossning eller makulahål. Det finns begränsad erfarenhet av behandling med Lucentis för diabetespatienter med ett HbA1c-värde över 108 mmol/mol (12 %) och ingen erfarenhet hos patienter med okontrollerad hypertoni. Denna brist på information måste beaktas av läkaren vid behandling av sådana patienter.
Det finns otillräckligt med data för att dra slutsatser om effekten av Lucentis på patienter med RVO som uppvisar irreversibel ischemisk synfunktionsförlust.
Det finns begränsade data för effekten av Lucentis hos PM-patienter som tidigare har genomgått misslyckad fotodynamisk terapi med verteporfin (vPDT)-behandling. Dessutom finns otillräckliga data för att kunna dra någon slutsats om effekten av Lucentis hos PM-patienter med extrafoveala lesioner, även om en konsekvent effekt har observerats hos patienter med subfoveala och juxtafoveala lesioner.
Systemiska biverkningar efter intravitreal användning
Systemiska biverkningar inklusive icke-okulära blödningar och arteriella tromboemboliska händelser har rapporterats efter intravitreal injektion av VEGF-hämmare.
Det finns begränsad data om säkerhet vid behandlingen av patienter med DME, patienter med makulaödem till följd av RVO och patienter med CNV till följd av PM, med stroke eller transitoriska ischemiska attacker i anamnesen. Försiktighet ska iakttas vid behandling av sådana patienter.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Inga formella interaktionsstudier har utförts.
Avseende adjuvant användning av fotodynamisk terapi (PDT) med verteporfin och Lucentis vid våt AMD och PM, se avsnitt 5.1.
För samtidig användning av fotokoagulation med laser och Lucentis vid DME och BRVO, se avsnitt 4.2 och 5.1.
Vid kliniska studier av behandling av nedsatt syn på grund av diabetiska makulaödem (DME) påverkades inte resultaten avseende synskärpa och central retinal tjocklek hos patienter behandlade med Lucentis av samtidig behandling med tiazolidindioner.
4.6 Fertilitet, graviditet och amning
Fertila kvinnor/födelsekontroll hos kvinnor
Fertila kvinnor bör använda effektiv preventivmetod under behandling.
Graviditet
Data från behandling av exponerade gravida kvinnor med ranibizumab saknas. Studier av cynomolgusapor tyder inte på direkta eller indirekta skadliga effekter avseende graviditet eller embryonal/fetal utveckling (se avsnitt 5.3). Den systemiska exponeringen för ranibizumab ärlåg efter okulär administrering, men på grund av dess verkningsmekanism måste ranibizumab betraktas som potentiellt teratogent och embryo-/fetotoxiskt. Därför skall ranibizumab inte användas under graviditet om inte den förväntade nyttan uppväger den potentiella risken för fostret. För kvinnor som vill bli gravida och har behandlats med ranibizumab, rekommenderas att vänta minst 3 månader efter den sista dosen av ranibizumab innan de blir gravida.
Amning
Baserat på mycket begränsade data kan ranibizumab utsöndras i modersmjölk i låga nivåer. Effekterna av ranibizumab på det ammande nyfödda barnet/spädbarnet är okända. Som en försiktighetsåtgärd rekommenderas inte amning under användningen av Lucentis.
Fertilitet
Det finns inga data tillgängliga om fertilitet.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Behandlingsproceduren kan orsaka temporära synstörningar, vilka kan påverka förmågan att framföra fordon eller använda maskiner (se avsnitt 4.8). Patienter som får dessa biverkningar får inte framföra fordon eller använda maskiner förrän de temporära synstörningarna upphört.
4.8 Biverkningar
Summering av säkerhetsprofilen
De flesta biverkningar som rapporterats efter administrering av Lucentis är relaterade till den intravitreala injektionsproceduren.
De oftast rapporterade okulära biverkningar efter injektion av Lucentis är: ögonsmärta, okulär hyperemi, förhöjt intraokulärt tryck, vitritis, glaskroppsavlossning, retinalblödning, synstörning, prickar/fläckar i synfältet, konjunktivalblödning, ögonirritation, känsla av främmande kropp i ögat, ökad tårbildning, blefarit, torrhet i ögat och ögonklåda.
De oftast rapporterade icke-okulära biverkningar är huvudvärk, nasofaryngit och artralgi.
Mindre frekventa, men mer allvarliga biverkningar innefattar endoftalmit, blindhet, näthinneavlossning, näthinneruptur och iatrogen traumatisk katarakt (se avsnitt 4.4).
De biverkningar som upplevdes efter administrering av Lucentis i kliniska studier sammanfattas i tabellen nedan.
Lista i tabellform över biverkningar#
Biverkningarna är angivna enligt klassificering av organsystem och frekvens enligt följande konvention: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
Infektioner och infestationer | |
|
Mycket vanliga |
Nasofaryngit |
|
Vanliga |
Urinvägsinfektion * |
|
Blodet och lymfsystemet |
|
|
Vanliga |
Anemi |
|
Immunsystemet | |
|
Vanliga |
Överkänslighet |
|
Psykiska störningar | |
|
Vanliga |
Ångest |
|
Centrala och perifera nervsystemet |
|
|
Mycket vanliga |
Huvudvärk |
|
Ögon | |
|
Mycket vanliga |
Vitrit, glaskroppsavlossning, retinalblödning, synstörning, ögonsmärta, prickar/fläckar i synfältet, konjunktivalblödning, ögonirritation, känsla av främmande kropp i ögonen, ökad tårbildning, blefarit, torrhet i ögat, okulär hyperemi, ögonklåda. |
|
Vanliga |
Näthinnedegeneration, näthinnestörning, näthinneavlossning, näthinneruptur, avlossning av retinalt pigmentepitel, ruptur av retinalt pigmentepitel, nedsatt synskärpa, blödning i glaskroppen, vitreal störning, uveit, irit, iridocyklit, katarakt, subkapsulär katarakt, grumling av bakre kapsel, punktuell keratit, kornealt skrapsår, ljusväg och inflammatoriska celler (flare) i främre kammaren, dimsyn, blödning på injektionsstället, ögonblödning, konjunktivit, allergisk konjunktivit, utsöndring från ögat, fotopsi, fotofobi, obehag i ögat, ödem i ögonlocket, smärta i ögonlocket, konjunktival hyperemi. |
|
Mindre vanliga |
Blindhet, endoftalmit, hypopyon, hyphema, keratopati, sammanväxning av iris, korneala avlagringar, kornealt ödem, korneala ärr, smärta på injektionsstället, irritation på injektionsstället, onormal känsla i ögat, irritation i ögonlocket. |
|
Andningsvägar, bröstkorg och mediastinum |
|
|
Vanliga |
Hosta |
|
Magtarmkanalen | |
|
Vanliga |
Illamående |
|
Hud och subkutan vävnad |
|
|
Vanliga |
Allergiska reaktioner (hudutslag, urticaria, pruritus, erytem) |
|
Muskuloskeletala systemet och bindväv |
|
|
Mycket vanliga |
Artralgi |
|
Undersökningar | |
|
Mycket vanliga |
Ökat intraokulärt tryck |
|
# Biverkningar definierades som biverkningshändelser (hos minst 0,5 procentenheter av patienterna) som inträffade vid en högre frekvens (minst 2 procentenheter) hos patienter som behandlades med Lucentis 0,5 mg än hos dem som fick kontroll (sham injektion eller Verteporfin PDT). * har endast observerats i DME-populationen |
|
Klassrelaterade biverkningar
I våt AMD fas III studierna var den totala frekvensen av icke okulära blödningar, en biverkan som möjligen är relaterad till systemisk hämning av VEGF (vaskulär endotelcellstillväxtfaktor), något förhöjd hos patienter behandlade med ranibizumab. Mönstret var dock inte konsekvent mellan de olika blödningarna. Det finns en teoretisk risk för arteriella tromboemboliska händelser inklusive stroke och hjärtinfarkt efter intravitreal användning av VEGF-hämmare. Ett lågt incidenstal för arteriella tromboemboliska händelser observerades i de kliniska studierna med Lucentis hos patienter med AMD, DME, PDR, RVO och CNV. Inga större skillnader sågs mellan grupperna som behandlades med ranibizumab jämfört med kontrollgruppen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Fall av oavsiktlig överdos har rapporterats från de kliniska studierna vid våt AMD och i uppföljningar efter godkännandet. Biverkningar som associerades med dessa rapporterade fall var höjt intraokulärt tryck, övergående blindhet, nedsatt synsskärpa, kornealt ödem, smärta i kornea och ögonsmärta. Om en överdos skulle inträffa skall det intraokulära trycket kontrolleras och behandlas om den behandlande läkaren bedömer att det är nödvändigt.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Oftalmologiska medel, antineovaskulära medel, ATC-kod: S01LA04
Verkningsmekanism
Ranibizumab är ett humaniserat rekombinant monoklonalt antikroppsfragment som är riktat mot human vaskulär endotelial tillväxtfaktor A (VEGF-A). Det binds med hög affinitet till VEGF-A-isoformerna (t.ex. VEGF110, VEGF121 och VEGF165) och förhindrar därigenom att VEGF-A binds till dess receptorer VEGFR-1 och VEGFR-2. Bindning av VEGF-A till dess receptorer leder till proliferation av endotelceller och neovaskularisering, såväl som vaskulärt läckage, av vilka samtliga anses bidra till progressionen av den neovaskulära formen av åldersrelaterad makuladegeneration, patologisk myopi och CNV eller till synnedsättning som orsakats av antingen diabetiskt relaterat makulaödem eller makulaödem till följd av RVO.
Klinisk effekt och säkerhet
Behandling av våt AMD
Vid våt AMD har den kliniska säkerheten och effekten av Lucentis bedömts i tre randomiserade, dubbelmaskerade, sham- eller aktivt kontrollerade studier som pågick i 24 månader hos patienter med neovaskulär AMD. Totalt rekryterades 1 323 patienter (879 aktiva och 444 kontroller) till dessa studier.
I studie FVF2598g (MARINA) randomiserades 716 patienter med minimalt klassisk eller ockult, utan inslag av klassiska lesioner, i ett 1:1:1-förhållande och fick månatliga injektioner av Lucentis 0,3 mg, Lucentis 0,5 mg eller sham.
I studie FVF2587g (ANCHOR) randomiserades 423 patienter med företrädesvis klassiska lesioner med CNV i ett 1:1:1-förhållande och fick Lucentis 0,3 mg månatligen, Lucentis 0,5 mg månatligen eller PDT med verteporfin (vid studiestarten och var tredje månad därefter om fluoresceinangiografi visade persistent eller recidiverande vaskulärt läckage).
Viktiga resultatmått är sammanfattade i tabell 1 och figur 1.
Tabell 1 Resultat efter månad 12 och månad 24 i studie FVF2598g (MARINA) och FVF2587g (ANCHOR)
|
|
|
FVF2598g (MARINA) |
FVF2587g (ANCHOR) |
||
|
Resultatmått |
Månad |
Sham (n=238) |
Lucentis 0,5 mg (n=240) |
Verteporfin PDT (n=143) |
Lucentis 0,5 mg (n=140) |
|
Förlust av <15 bokstäver i synskärpa (%)a (bevarad syn, primärt effektmått) |
Månad 12 |
62 % |
95 % |
64 % |
96 % |
|
Månad 24 |
53 % |
90 % |
66 % |
90 % |
|
|
Ökning med ≥15 bokstäver i synskärpa (%)a |
Månad 12 |
5 % |
34 % |
6 % |
40 % |
|
Månad 24 |
4 % |
33 % |
6 % |
41 % |
|
|
Medelförändring av synskärpa (bokstäver) (SD)a |
Månad 12 |
‑10,5 (16,6) |
+7,2 (14,4) |
‑9,5 (16,4) |
+11,3 (14,6) |
|
Månad 24 |
‑14,9 (18,7) |
+6,6 (16,5) |
‑9,8 (17,6) |
+10,7 (16,5) |
|
|
a p<0,01 |
|
|
|
|
|
Figur 1 Medelförändring av synskärpan från baslinjen till månad 24 i studie FVF2598g (MARINA) och studie FVF2587g (ANCHOR)
Resultat från båda studierna visade att fortsatt behandling med ranibizumab även kan vara till nytta för patienter som förlorat ≥15 bokstäver av synskärpan med bästa korrektion (best corrected visual acuity – BCVA) under det första årets behandling.
Man observerade statistiskt signifikanta patientrapporterade visuella funktionsförbättringar med ranibizumabbehandling i både MARINA och ANCHOR jämfört med kontrollgruppen, enligt mätningar med NEI VFQ-25.
I studie FVF3192g (PIER) randomiserades 184 patienter med alla former av neovaskulär AMD i ett 1:1:1-förhållande och fick Lucentis 0,3 mg, Lucentis 0,5 mg (n=61) eller sham-injektioner en gång i månaden under 3 månader i följd, och därefter administrerades en dos var tredje månad. Från månad 14 av studien kunde patienter som behandlats med sham få ranibizumab, och från månad 19 var mer frekventa behandlingar möjliga. Patienter som behandlats med Lucentis i PIER fick i medeltal 10 totala behandlingar.
Efter en inledande genomsnittlig ökning av synskärpan (efter månatlig dosering) försämrades synskärpan vid dosering en gång i kvartalet och återgick till baslinjen efter månad 12 och denna effekt var bevarad hos de flesta ranibizumabbehandlade patienterna (82 %) vid månad 24. Begränsade data från sham-individer som senare fick behandling med ranibizumab visade att tidigt insättande av behandling kan vara associerat med bättre bevarande av synskärpan.
Data från två studier (MONT BLANC, BPD952A2308 och DENALI, BPD952A2309) utförda efter godkännande bekräftade Lucentis effektivitet, men påvisade ingen ytterligare effekt av den kombinerade administreringen av verteporfin (Visudyne PDT) och Lucentis jämfört med Lucentis som monoterapi.
Behandling av nedsatt syn på grund av CNV till följd av PM
Klinisk säkerhet och effekt för Lucentis hos patienter med nedsatt syn på grund av CNV till följd av PM har utvärderats med utgångspunkt från 12 månaders data från den dubbelmaskerade, kontrollerade registreringsstudien F2301 (RADIANCE). I studien randomiserades 277 patienter i ett 2:2:1-förhållande i följande grupper:
-
Grupp I (ranibizumab 0,5 mg, dosregim med utgångspunkt från ”stabilitetskriterier” som definieras som ingen förändring i BCVA jämfört med de två föregående månatliga utvärderingarna).
-
Grupp II (ranibizumab 0,5 mg, dosregim med utgångspunkt från ”sjukdomsaktivitetskriterier” som definieras som nedsatt syn som orsakats av intra- eller subretinal vätska eller aktivt läckage på grund av CNV-lesionen enligt bedömning med OCT och/eller FA).
-
Grupp III (vPDT – patienterna tilläts få behandling med ranibizumab från och med månad 3).
I grupp II, där patienterna fick rekommenderad dos (se avsnitt 4.2), behövde 50,9 % av patienterna 1 eller 2 injektioner, medan 34,5 % behövde 3 till 5 injektioner och 14,7 % behövde 6 till 12 injektioner under studieperioden på 12 månader. 62,9 % av patienterna i grupp II behövde inga injektioner under det andra halvåret av studien.
De viktigaste resultaten från RADIANCE sammanfattas i tabell 2 och figur 2.
Tabell 2 Resultat vid månad 3 och 12 (RADIANCE)
|
|
Grupp I Ranibizumab 0,5 mg “synstabilitet” (n=105) |
Group II Ranibizumab 0,5 mg “sjukdoms-aktivitet” (n=116) |
Group III vPDTb (n=55) |
|
Månad 3 |
|
|
|
|
Genomsnittlig BCVA-förändring från månad 1 till månad 3 jämfört med baselinea (bokstäver) |
+10,5 |
+10,6 |
+2,2 |
|
Andel patienter som vann: ≥15 bokstäver eller uppnådde ≥84 bokstäver i BCVA |
38,1 % |
43,1 % |
14,5 % |
|
Månad 12 |
|
|
|
|
Antal injektioner fram till månad 12: Medelvärde Medianvärde |
4,6 4,0 |
3,5 2,5 |
N/A N/A |
|
Genomsnittlig BCVA-förändring från månad 1 till månad 12 jämfört med baseline (bokstäver) |
+12,8 |
+12,5 |
N/A |
|
Andel patienter som vann: ≥15 bokstäver eller uppnådde ≥84 bokstäver i BCVA |
53,3 % |
51,7 % |
N/A |
|
a p<0,00001 jämfört med vPDT-kontroll b Jämförande kontroll fram till månad 3. De patienter som randomiserades till vPDT tilläts få behandling med ranibizumab från och med månad 3 (I grupp III fick 38 patienter ranibizumab från och med månad 3) |
|||
Figur 2 Genomsnittlig förändring i BCVA från baselinje över tid fram till månad 12 (RADIANCE)
Synförbättringen åtföljdes av en minskad tjocklek av centrala retina.
Patientrapporterade förbättringar observerades inom ranibizumab-behandlingsgrupperna jämfört med vPDT (p-värde <0,05) i form av bättre resultat på total poäng och flera underordnade skalor (allmän syn, närseende, mental hälsa och beroende) i NEI VFQ-25.
Behandling av synnedsättning på grund av CNV (till följd av annat än PM och våt AMD)
Klinisk säkerhet och effekt för Lucentis hos patienter med synnedsättning på grund av CNV har utvärderats baserat på 12 månaders data från den dubbelmaskerade, sham-kontrollerade registreringsstudien G2301 (MINERVA). I studien randomiserades 178 patienter i ett 2:1-förhållande som fick:
-
0,5 mg ranibizumab vid studiestart, följt av individualiserad dosregim med utgångspunkt från sjukdomsaktivitet enligt bedömning av synskärpan och/ eller anatomiska parametrar (t ex försämring i synskärpa, intra-/ subretinal vätska, blödning eller läckage);
-
sham injektion vid studiestart, följt av en individualiserad behandlingsregim med utgångspunkt från sjukdomsaktivitet.
Vid månad 2 fick alla patienter öppen behandlingsregim efter behov.
De viktigaste resultaten från MINERVA sammanfattas i tabell 3 och figur 3. Synförbättringen åtföljdes av en minskning i central retinal tjocklek över en 12-månaders period.
Det genomsnittliga antalet injektioner som gavs under 12 månader var 5,8 i gruppen med ranibizumab mot 5,4 i patientgruppen som fick sham som var berättigade att få ranibizumab from månad 2 och framåt. I sham-gruppen fick 7 av 59 patienter inte någon behandling med ranibizumab i studieögat under 12-månadersperioden.
Tabell 3 Resultat vid månad 2 (MINERVA)
|
|
Ranibizumab 0,5 mg (n=119) |
Sham (n=59) |
|
Medelförändring av BCVA från utgångsvärdet till månad 2 a |
9,5 bokstäver |
‑0,4 bokstäver |
|
Patienter som ökar ≥15 bokstäver från utgångsvärdet eller uppnår 84 bokstäver vid månad 2 |
31,4% |
12,3% |
|
Patienter som inte förlorar >15 bokstäver från utgångsvärdet vid månad 2 |
99,2% |
94,7% |
|
Reducering i CSFTb från utgångsvärdet till månad 2 a |
77 µm |
‑9,8 µm |
|
a Ensidig p<0.001 jämförelse med sham-kontroll b CSFT – central retinal tjocklek (Central retinal subfield thickness) |
||
Figur 3 Genomsnittlig förändring från baslinje-BVCA över tid till månad 12 (MINERVA)
* Observerat genomsnittligt BCVA kan skilja från minsta kvadratiska medelvärdet av BCVA (gäller endast vid månad 2)
Vid jämförelse mellan ranibizumab och sham-kontroll vid månad 2, observerades en jämn behandlingseffekt från baslinjen för hela studiepopulationen liksom för de enskilda bakomliggande orsakerna till CNV:
Tabell 4 Total behandlingseffekt och över baslinjen för de etiologiska subgrupperna.
|
Total etiology och vid baslinjen |
Behandlingseffekt jämfört med sham [bokstäver] |
Patientantal [n] (behandling +sham) |
|
Total |
9,9 |
178 |
|
Angioida strimmor |
14,6 |
27 |
|
Postinflammatorisk retinokoriopati |
6,5 |
28 |
|
Central serös korioretinopati |
5,0 |
23 |
|
Idiopatisk korioretinopati |
11,4 |
63 |
|
Blandade etiologiera |
10,6 |
37 |
|
a omfattar olika etiologier med låg förekomstfrekvens som inte är inkluderade i andra subgrupper |
||
I registreringsstudien G2301 (MINERVA) fick 5 ungdomar i åldern 12 till 17 år med synnedsättning till följd av CNV öppen behandling med 0,5 mg ranibizumab vid studiestart följt av individualiserad behandlingsregim som för den vuxna populationen. BCVA förändring från studiestart till månad 12 förbättrades hos alla 5 patienter, i intervallet 5 till 38 bokstäver (genomsnitt 16,6 bokstäver). Synförbättringen åtföljdes av en stabilisering eller minskning av central retinal tjocklek över 12-månadersperioden. Genomsnittligt antal injektioner med ranibizumab som gavs i studieögat under 12 månader var 3 (varierade mellan 2 till 5). Sammantaget, tolererades ranibizumab behandling väl.
Behandling av nedsatt syn på grund av DME
Effekten och säkerheten för Lucentis har bedömts i tre randomiserade, kontrollerade studier som pågick i minst 12 månader. Totalt 868 patienter (708 aktiva och 160 kontroll) rekryterades till dessa studier.
I fas II-studien D2201 (RESOLVE) behandlades 151 patienter med ranibizumab (6 mg/ml, n=51, 10 mg/ml, n=51) eller sham (n=49) med månatliga intravitreala injektioner. Genomsnittlig förändring i BCVA från månad 1 till 12 jämfört med utgångsvärdet var +7,8 (±7,72) bokstäver för den sammanslagna gruppen ranibizumabbehandlade patienter (n=102), jämfört med –0,1 (±9,77) bokstäver för sham-behandlade patienter, och den genomsnittliga förändringen i BCVA vid månad 12 från utgångsvärdet var 10,3 (±9,1) bokstäver jämfört med ‑1,4 (±14,2) bokstäver, (p<0,0001 för behandlingsdifferensen).
I fas III-studien D2301 (RESTORE) randomiserades 345 patienter i ett 1:1:1-förhållande för behandling med ranibizumab 0,5 mg som monoterapi och sham-fotokoagulation med laser, kombinerad ranibizumab 0,5 mg och fotokoagulation med laser eller sham-injektion och fotokoagulation med laser. 240 patienter som tidigare genomfört den 12 månader långa RESTORE-studien rekryterades till den 24 månader långa öppna förlängda multicenterstudien (RESTORE Extension). Patienterna behandlades med ranibizumab 0,5 mg vid behov (VB) i samma öga som under kärnstudien (D2301 RESTORE).
Viktiga resultatmått är sammanfattade i tabell 5 (RESTORE och Extension) och figur 4 (RESTORE).
Figur 4 Medelförändring i synskärpa från utgångsvärdet över tid i studie D2301 (RESTORE)
BL=utgångsvärde; SE=medelvärdets medelfel
*Skillnad i minsta kvadratmedelvärde, p<0,0001/0,0004 baserat på tvåsidigt stratifierat Cochran-Mantel-Haenszel test
Effekten vid månad 12 var likartad i de flesta subgrupperna. Patienter med BCVA vid baslinjen >73 bokstäver och makulaödem med central retinal tjocklek på <300 µm verkade inte ha någon nytta av behandling med ranibizumab jämfört med fotokoagulation med laser.
Tabell 5 Resultat vid månad 12 i studien D2301 (RESTORE) och månad 36 i studien D2301‑E1 (RESTORE Extension)
|
Resultatmått vid månad 12 jämfört med utgångsvärdet i studie D2301 (RESTORE) |
Ranibizumab 0,5 mg n=115 |
Ranibizumab 0,5 mg + laser n=118 |
Laser n=110 |
|
Genomsnittlig medelförändring i BCVA från månad 1 till månad 12a (±SD) |
6,1 (6,4)a |
5,9 (7,9)a |
0,8 (8,6) |
|
Genomsnittlig förändring i BCVA vid månad 12 (±SD) |
6,8 (8,3)a |
6,4 (11,8)a |
0,9 (11,4) |
|
Ökning med ≥15 bokstäver eller BCVA ≥84 bokstäver vid månad 12 (%) |
22,6 |
22,9 |
8,2 |
|
Genomsnittligt antal injektioner (månad 0–11) |
7,0 |
6,8 |
7,3 (sham) |
|
|
|||
|
Resultatmått vid månad 36 jämfört med utgångspunkten för D2301 (RESTORE) i studien D2301-E1 (RESTORE Extension) |
Tidigare ranibizumab 0,5 mg n=83 |
Tidigare ranibizumab 0,5 mg + laser n=83 |
Tidigare laser n=74* |
|
Genomsnittlig förändring i BCVA vid månad 24 (SD) |
7,9 (9,0) |
6,7 (7,9) |
5,4 (9,0) |
|
Genomsnittlig förändring i BCVA vid månad 36 (SD) |
8,0 (10,1) |
6,7 (9,6) |
6,0 (9,4) |
|
Ökning med ≥15 bokstäver eller BCVA ≥84 bokstäver vid månad 36 (%) |
27,7 |
30,1 |
21,6 |
|
Genomsnittligt antal injektioner (månad 12–35)* |
6,8 |
6,0 |
6,5 |
|
ap<0,0001 för jämförelser av ranibizumab- och lasergruppen. n i D2301-E1 (RESTORE Extension) är antalet patienter som har både ett utgångsvärde både för D2301 (RESTORE) (månad 0) och besöket vid månad 36. * Den andel patienter som inte behövde behandling med ranibizumab under utökningsfasen var 19 %, 25 % respektive 20 % i de grupper som tidigare fått ranibizumab, ranibizumab + laser respektive laser. |
|||
Man observerade statistiskt signifikanta patientrapporterade förbättringar för de flesta synrelaterade funktioner med ranibizumabbehandling (med eller utan laser) jämfört med kontrollgruppen, enligt mätningar med NEI VFQ-25. För övriga underkategorier i frågeformuläret kunde inga skillnader påvisas.
Den långsiktiga säkerhetsprofilen för ranibizumab som observerades under den 24 månader långa utökade studien överensstämmer med Lucentis befintliga säkerhetsprofil.
I fas IIIb-studien D2304 (RETAIN) randomiserades 372 patienter i grupper med ett 1:1:1-förhållande för att erhålla:
-
kombinerad ranibizumab-behandling med 0,5 mg ranibizumab och fotokoagulation med laser enligt ”treat-and-extend”-modellen (TE),
-
monoterapi med ranibizumab 0,5 mg enligt TE-modellen,
-
monoterapi med ranibizumab 0,5 mg VB.
I samtliga grupper administrerades ranibizumab månatligen tills dess att BCVA bedömdes som stabil vid kontroller tre månader i rad. För TE-modellen administrerades ranibizumab med 2–3 månaders mellanrum. Behandlingen återinfördes för alla grupper när en reduktion i BCVA på grund av progression av DME observerades, och fortsatte tills BCVA åter stabiliserats.
Antalet planerade behandlingsbesök efter de 3 initiala injektionerna var 13 och 20 för TE- respektive VB-modellen. För bägge TE-behandlingsmodellerna gällde att över 70 % av patienterna hade en stabil BCVA med en genomsnittlig besöksfrekvens på ≥2 månader.
Viktiga resultatmått är sammanfattade i tabell 6.
Tabell 6 Resultat studie D2304 (RETAIN)
|
Resultatmått jämfört med baslinjen |
TE ranibizumab 0,5 mg + laser n=117 |
TE ranibizumab 0,5 mg enbart n=125 |
VB ranibizumab 0,5 mg n=117 |
|
Genomsnittlig medelförändring i BCVA från månad 1 till månad 12 (SD) |
5,9 (5,5) a |
6,1 (5,7) a |
6,2 (6,0) |
|
Genomsnittlig medelförändring i BCVA från månad 1 till månad 24 (SD) |
6,8 (6,0) |
6,6 (7,1) |
7,0 (6,4) |
|
Genomsnittlig förändring i BCVA vid månad 24 (SD) |
8,3 (8,1) |
6,5 (10,9) |
8,1 (8,5) |
|
Ökning på ≥15 bokstäver eller BCVA ≥84 bokstäver vid månad 24 (%) |
25,6 |
28,0 |
30,8 |
|
Genomsnittligt antal injektioner (månad 0‑23) |
12,4 |
12,8 |
10,7 |
|
ap<0,0001 för bedömning av ”non-inferiority” (inte sämre än) jämfört med VB |
|||
I DME-studier åtföljdes förbättringen av BCVA av en kontinuerlig minskning av central retinal tjocklek för alla behandlingsgrupper.
Behandling av PDR
Den kliniska säkerheten och effekten av Lucentis hos patienter med PDR har bedömts i Protokoll S som utvärderade behandling med ranibizumab 0,5 mg intravitreal injektion jämfört med panretinal fotokoagulation (PRP). Primär endpoint var förändring i genomsnittlig synskärpa vid år 2. Dessutom bedömdes förändring i svårighetsgraden av diabetesretinopati (DR) bedömdes med hjälp av ögonbottensfotografier genom att använda DRSS (diabetic retinopathy severity score).
Protokoll S var en randomiserad, aktivt kontrollerad, parallell, non-inferior, fas III multicenterstudie där 305 patienter (394 studieögon) med PDR med eller utan DME vid baseline rekryterades. Studien jämförde intravitreala injektioner av ranibizumab 0,5 mg med standardbehandling med PRP. Totalt randomiserades 191 ögon (48,5%) till ranibizumab 0,5 mg och 203 ögon (51,5%) till PRP. Totalt 88 ögon (22,3%) hade DME vid baseline: 42 (22,0%) och 46 (22,7%) ögon i ranibizumab respektive PRP-gruppen.
I studien var förändringen i genomsnittlig synskärpa vid år 2 +2,7 bokstäver i gruppen som behandlats med ranibizumab jämfört med -0,7 bokstäver i gruppen som behandlats med PRP. Skillnaden i minsta kvadratmedelvärde (least square means) var 3,5 bokstäver (95% KI: [0,2 till 6,7]).
Vid år 1 fick 41,8% av ögonen en ≥2-stegs förbättring i DRSS vid behandling med ranibizumab (n=189) jämfört med 14,6% av ögonen som behandlats med PRP (n=199). Den uppskattade skillnaden mellan ranibizumab och laser var 27,4% (95% KI: [18,9, 35,9]).
Tabell 7 DRSS förbättring eller försämring med ≥2 eller ≥3 steg vid år 1 i Protokoll S (Last observation carried forward (LOCF)-metoden)
|
Kategoriserad förändring från baseline |
Protokoll S |
||
|
Ranibizumab 0,5 mg (N=189) |
PRP (N=199) |
Skillnad i proportion (%), KI |
|
|
≥2-stegs förbättring |
|||
|
n (%) |
79 (41,8%) |
29 (14,6%) |
27,4 (18,9, 35,9) |
|
≥3-stegs förbättring |
|||
|
n (%) |
54 (28,6%) |
6 (3,0%) |
25,7 (18,9, 32,6) |
|
≥2-stegs försämring |
|||
|
n (%) |
3 (1,6%) |
23 (11,6%) |
‑9,9 (‑14,7, ‑5,2) |
|
≥3-stegs försämring |
|||
|
n (%) |
1 (0,5%) |
8 (4,0%) |
‑3,4 (‑6,3, ‑0,5) |
|
DRSS = diabetic retinopathy severity score, n = antal patienter som uppfyllde tillståndet vid år 1, N = totala antalet studieögon. |
|||
I gruppen som behandlats med ranibizumab i Protokoll S, var vid år 1 ≥2-stegs förbättringen i DRSS likartad i ögon utan DME (39,9%) och vid baseline DME (48,8%).
En analys av 2-årsdata från Protokoll S visade att 42,3% (n=80) av ögonen i gruppen som behandlats med ranibizumab hade en ≥2-stegs förbättring av DRSS från baseline jämfört med 23,1% (n=46) av ögonen i PRP-gruppen. I gruppen som behandlats med ranibizumab oberverades en ≥2-stegs förbättring av DRSS från baseline hos 58,5% av ögonen vid baseline DME och 37,8% (n=56) av ögonen utan DME.
DRSS bedömdes också i tre separata fas III DME-studier med aktiv kontroll (ranibizumab 0,5 mg PRN jämfört med laser) som inkluderade totalt 875 patienter, av vilka cirka 75% var av asiatiskt ursprung. I en metaanalys av dessa studier upplevde 48,4% av patienterna (n=315) med graderbara DRSS-poäng i gruppen klassade med måttligt svår icke-proliferativ DR (NPDR) eller sämre vid baslinjen en ≥2-stegs förbättring i DRSS vid månad 12 vid behandling med ranibizumab (n=192) jämfört med 14,6% av patienterna behandlade med laser (n=123). Den uppskattade skillnaden mellan ranibizumab och laser var 29,9% (95% KI: [20,0, 39,7]). Hos 405 DRSS-graderbara patienter med måttlig NPDR eller bättre observerades en ≥2-stegsförbättring av DRSS hos 1,4% respektive 0,9% av ranibizumab respektive lasergrupperna.
Behandling av synnedsättning på grund av makulaödem till följd av RVO
Den kliniska säkerheten och effekten av Lucentis hos patienter med synnedsätning på grund av makulaödem till följd av RVO har bedömts i de randomiserade, dubbelmaskerade, kontrollerade studierna BRAVO och CRUISE som rekryterat patienter med BRVO (n=397) och CRVO (n=392). I båda studierna fick patientarna antingen 0,3 mg eller 0,5 mg ranibizumab eller sham-injektioner. Efter 6 månader fick patienterna i sham-kontrollgruppen byta till 0,5 mg ranibizumab.
Viktiga resultatmått från BRAVO och CRUISE är sammanfattade i tabell 8 och figur 5 och 6.
Tabell 8 Resultat vid månad 6 och 12 (BRAVO och CRUISE)
|
|
BRAVO |
CRUISE |
||
|
|
Sham/Lucentis 0,5 mg (n=132) |
Lucentis 0,5 mg (n=131) |
Sham/Lucentis 0,5 mg (n=130) |
Lucentis 0,5 mg (n=130) |
|
Genomsnittlig förändring i synskärpa vid månad 6a (bokstäver) (SD) (primärt effektmått) |
7,3 (13,0) |
18,3 (13,2) |
0,8 (16,2) |
14,9 (13,2) |
|
Genomsnittlig förändring i BCVA vid månad 12 (bokstäver) (SD) |
12,1 (14,4) |
18,3 (14,6) |
7,3 (15,9) |
13,9 (14,2) |
|
Ökning på ≥15 bokstäver i synskärpa vid månad 6a (%) |
28,8 |
61,1 |
16,9 |
47,7 |
|
Ökning på ≥15 bokstäver i synskärpa vid månad 12 (%) |
43,9 |
60,3 |
33,1 |
50,8 |
|
Andel (%) som får laser rescue över 12 månader |
61,4 |
34,4 |
N/A |
N/A |
|
ap<0,0001 för båda studierna |
||||
Figur 5 Genomsnittlig förändring från baslinje-BCVA över tid till månad 6 och månad 12 (BRAVO)
BL=utgångsvärde; SE=medelvärdets medelfel
Figur 6 Genomsnittlig förändring från baslinje-BCVA över tid till månad 6 och månad 12 (CRUISE)
BL=utgångsvärde; SE=medelvärdets medelfel
I båda studierna åtföljdes synförbättringen av en kontinuerlig och signifikant minskning av makulaödemet vid mätning av den centrala retinala tjockleken.
Hos patienter med CRVO (CRUISE och förlängningsstudie HORIZON): Patienter behandlade med sham-injektioner under de första 6 månaderna och som därefter fick ranibizumab uppnådde inte jämförbar förbättring i synskärpa vid månad 24 (~6 bokstäver) jämfört med patienter behandlade med ranibizumab från studiestart (~12 bokstäver).
Man observerade statistiskt signifikanta patientrapporterade förbättringar med ranibizumabbehandling i subskalor relaterade till aktivitet som kräver seende på nära och långt håll jämfört med kontrollgruppen, enligt mätningar med NEI VFQ-25.
Den långsiktiga (24 månader) kliniska säkerheten och effekten av Lucentis på patienter med nedsatt syn på grund av makulaödem till följd av RVO bedömdes i studierna BRIGHTER (BRVO) och CYSTAL (CRVO). I båda studierna fick patienterna 0,5 mg ranibizumab PRN dosregim med utgångspunkt från individualiserade stabiliseringskriterier. BRIGHTER var en 3-armad randomiserad aktivt kontrollerad studie som jämförde 0,5 mg ranibizumab given som monoterapi eller i kombination med infogande laserfotokoagulation till enbart laserfotokoagulation. Efter 6 månader kunde patienter i laserarmen ta emot 0,5 mg ranibizumab. CRYSTAL var en enkelarmad studie med 0,5 mg ranibizumab monoterapi.
De viktigaste resultaten från BRIGHTER och CRYSTAL visas i tabell 9.
Tabell 9 Resultat vid månad 6 och 24 (BRIGHTER och CRYSTAL)
|
|
BRIGHTER |
CRYSTAL |
||
|
|
Lucentis 0,5 mg N=180 |
Lucentis 0,5 mg + Laser N=178 |
Laser* N=90 |
Lucentis 0,5 mg N=356 |
|
Genomsnittlig BCVA-förändring vid månad 6a (bokstäver) (SD) |
+14,8 (10,7) |
+14,8 (11,13) |
+6,0 (14,27) |
+12,0 (13,95) |
|
Genomsnittlig BCVA-förändring vid månad 24b (bokstäver) (SD) |
+15,5 (13,91) |
+17,3 (12,61) |
+11,6 (16,09) |
+12,1 (18,60) |
|
Förbättring med ≥15 bokstäver i BCVA vid månad 24 (%) |
52,8 |
59,6 |
43,3 |
49,2 |
|
Genomsnittligt antal injektioner (SD) (Månad 0‑23) |
11,4 (5,81) |
11,3 (6,02) |
NA |
13,1 (6,39) |
|
a p<0,0001 för båda jämförelserna i BRIGHTER vid månad 6: Lucentis 0,5 mg jämfört med laser och Lucentis 0,5 mg + laser jämfört med laser. b p<0,0001 för nollhypotes i CRYSTAL att den genomsnittliga förändringen vid månad 24 från baseline är noll. * Från och med månad 6 var behandling med ranibizumab 0,5 mg tillåten (24 patienter behandlades enbart med laser). |
||||
I BRIGHTER visade sig ranibizumab 0,5 mg med tillsatt laserterapi inte vara underlägset jämfört med ranibizumab monoterapi från baseline till månad 24 (95 % KI: -2,8; 1,4).
I båda studierna observerades en snabb och statistiskt signifikant minskning från baseline i central retinal tjocklek vid månad 1. Den här effekten upprätthölls till månad 24.
Effekten av behandling med ranibizumab var likartad oavsett förekomsten av retinal ischemi. I BRIGHTER hade patienter med ischemi (N = 46) eller utan (N = 133) och behandlade med ranibizumab-monoterapi en genomsnittlig förändring från baseline med +15,3 och +15,6 bokstäver, respektive, vid månad 24. I CRYSTAL hade patienter med ischemi (N = 53) eller utan (N = 300) och behandlade med ranibizumab-monoterapi en genomsnittlig förändring från baseline med +15,0 och +11,5 bokstäver, respektive.
Effekten i termer av synförbättring observerades hos alla patienter behandlade med 0,5 mg ranibizumab-monoterapi oavsett deras sjukdoms varaktighet i både BRIGHTER och CRYSTAL. Hos patienter med mindre än 3 månaders sjukdom observerades en ökning av synskärpan med 13,3 och 10,0 bokstäver under månad 1; och 17,7 och 13,2 bokstäver vid månad 24 i BRIGHTER och CRYSTAL, respektive. Motsvarande förbättring av synskärpan hos patienter med ≥12 månaders sjukdom var 8,6 och 8,4 bokstäver i respektive studier. Initiering av behandling vid tidpunkten för diagnos bör övervägas.
Den långsiktiga säkerhetsprofilen med ranibizumab observerade i 24-månaders studierna är konsistent med den kända säkerhetsprofilen för Lucentis.
Pediatrisk population
Säkerhet och effekt av ranibizumab 0,5 mg i förfylld spruta har inte studerats hos pediatriska patienter.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Lucenits, för alla grupper av den pediatriska populationen för neovaskulär AMD, synnedsättning på grund av DME, synnedsättning på grund av makulaödem till följd av RVO och synnedsättning på grund av CNV och diabetesretinopati (information om pediatrisk användning finns i avsnitt 4.2).
5.2 Farmakokinetiska egenskaper
Efter månatlig intravitreal administrering av Lucentis till patienter med neovaskulär AMD, var serumkoncentrationerna av ranibizumab generellt låga, med maximinivåer (Cmax) vanligtvis under den ranibizumab-koncentration som är nödvändig för att hämma den biologiska aktiviteten hos VEGF med 50 % (11 27 ng/ml, enligt bedömning i en in vitro-analys av cellproliferation). Cmax var dosproportionell över dosintervallet 0,05 till 1,0 mg/öga. Serumkoncentrationer hos ett begränsat antal DME patienter indikerar att en något högre systemisk exponering inte kan uteslutas jämfört med den hos patienter med neovaskulär AMD. Serumkoncentrationer av ranibizumab hos RVO-patienter var likartade eller något högre jämfört med de som observerades hos patienter med neovaskulär AMD.
Baserat på analys av populationsfarmakokinetik och elimineringen av ranibizumab från serum för patienter med neovaskulär AMD som behandlats med 0,5 mg-dosen, så är den genomsnittliga vitreala halveringstiden för ranibizumab cirka 9 dagar. Vid månatlig intravitreal administrering av Lucentis 0,5 mg/öga predikteras att Cmax för ranibizumab i serum, uppnått cirka 1 dag efter dosering, generellt ska ligga mellan 0,79 och 2,90 ng/ml, och Cmin predikteras ligga generellt mellan 0,07 och 0,49 ng/ml. Ranibizumab-koncentrationer i serum förutsägs vara cirka 90 000 gånger lägre än ranibizumab-koncentrationer i glaskroppen.
Patienter med nedsatt njurfunktion: Formella studier för att bedöma farmakokinetiken för Lucentis hos patienter med nedsatt njurfunktion har inte utförts. I en farmakokinetisk populationsanalys av patienter med neovaskulär AMD, hade 68 % (136 av 200) av patienterna nedsatt njurfunktion (46,5 % lindrig [50-80 ml/min], 20 % måttlig [30-50 ml/min] och 1,5 % allvarlig [<30 ml/min]). Av RVO-patienterne hade 48,2 % (253 av 525) nedsatt njurfunktion (36,4 % lindrig, 9,5 % måttlig och 2,3 % allvarlig). Systemisk clearance var något lägre, men detta var inte kliniskt signifikant.
Nedsatt leverfunktion: Formella studier för att bedöma farmakokinetiken för Lucentis hos patienter med nedsatt leverfunktion har inte utförts.
5.3 Prekliniska säkerhetsuppgifter
Bilateral intravitreal administrering av ranibizumab till cynomolgus-apor med doser mellan 0,25 mg/öga och 2,0 mg/öga en gång varannan vecka i upp till 26 veckor ledde till dosberoende ögoneffekter.
Intraokulärt skedde dosberoende ökningar av ljusväg och inflammatoriska celler (flare) i främre kammaren med en topp 2 dagar efter injektion. Allvarlighetsgraden i den inflammatoriska responsen minskade generellt sett vid påföljande injektioner eller under tillfrisknande. I det bakre segmentet uppkom vitreal cellinfiltration och grumlingar, vilket också verkade vara dosberoende och generellt sett kvarstod till slutet av behandlingsperioden. I 26-veckorsstudien förvärrades den vitreala inflammationen i takt med antalet injektioner. Belägg för reversibilitet observerades dock efter tillfrisknande. Karaktären och tidpunkten för inflammationen i det bakre segmentet tyder på en immunmedierad antikroppsrespons, som kan vara kliniskt irrelevant. Kataraktbildning observerades hos vissa djur efter en relativt lång period av intensiv inflammation, vilket tyder på att linsförändringarna var sekundära till allvarlig inflammation. En övergående ökning av det intraokulära trycket efter dosen observerades efter intravitreala injektioner, oavsett dos.
Mikroskopiska ögonförändringar var relaterade till inflammation och indikerade inte degenerativa processer. Granulomatösa inflammatoriska förändringar noterades i synnervspapillen i vissa ögon. Dessa förändringar i det posteriora segmentet minskade, och gick i vissa fall tillbaka helt, under återhämtningsperioden.
Efter intravitreal administrering kunde inga tecken på systemisk toxicitet upptäckas. Antikroppar mot ranibizumab återfanns i serum och glaskropp hos en delgrupp av de behandlade djuren.
Karcinogenitets- och mutagenitetsdata saknas.
Intravitreal ranibizumab-behandling till gravida apor som gav maximal systemisk exponering på 0,9 till 7 gånger största tänkbara kliniska exponering framkallade inte utvecklingsrelaterad toxicitet eller teratogenicitet och hade ingen effekt på moderkakans vikt eller struktur, men baserat på dess farmakologiska effekt skall ranibizumab betraktas som potentiellt teratogent och embryo-/fetotoxiskt.
Avsaknaden av ranibizumab medierade effekter på embryo-fetal utveckling är rimligen relaterad huvudsakligen till oförmågan hos Fab-fragmentet att korsa moderkakan. Likväl beskrevs ett fall med höga ranibizumabserumnivåer hos modern och förekomst av ranibizumab i fetalt serum, vilket tyder på att anti-ranibizumab-antikroppen agerade som (Fc-region innehållande) bärarprotein för ranibizumab, därmed minskades dess serumclearance hos modern och möjliggjordes dess placentaöverföring. Då undersökningarna av embryo-fetal utveckling genomfördes i friska gravida djur och sjukdom (t.ex. diabetes) kan modifiera permeabiliteten av moderkakan gentemot ett Fab-fragment bör denna studie tolkas med försiktighet.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
α,α-trehalosdihydrat
Histidinhydroklorid, monohydrat
Histidin
Polysorbat 20
Vatten för injektionsvätskor
6.2 Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
6.3 Hållbarhet
3 år
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C – 8°C).
Får ej frysas.
Den förfyllda sprutan ska förvaras i den förseglade förpackningen i ytterkartongen. Ljuskänsligt.
Inför användning kan den oöppnade förpackningen förvaras i rumstemperatur (25°C) i upp till 24 timmar.
6.5 Förpackningstyp och innehåll
0,165 ml steril lösning i förfylld spruta (typ I-glas) med en kolvpropp av bromobutylgummi och ett sprutlock bestående av en vit, manipuleringssäker förslutning med ett grått nålskydd av bromobutylgummi inklusive en Luerlåsadapter. Den förfyllda sprutan är försedd med en kolvstång och ett fingerskydd och är innesluten i en förseglad förpackning.
Varje förpackning innehåller en förfylld spruta.
6.6 Särskilda anvisningar för destruktion och övrig hantering
Den förfyllda sprutan är endast avsedd för engångsbruk. Den förfyllda sprutan är steril. Använd inte produkten om förpackningen är skadad. Den förfyllda sprutans sterilitet kan inte garanteras om inte förpackningen förblir förseglad. Använd inte den förfyllda sprutan om lösningen är missfärgad, grumlig eller om den innehåller partiklar.
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 0,5 mg. All utvinningsbar volym i den förfyllda sprutan (0,1 ml) ska inte användas. Överskjutande volym ska drivas ut före injicering. Om hela volymen i den förfyllda sprutan injiceras kan detta leda till överdosering. För att driva ut luftbubblan samt överskjutande mängd läkemedel trycks kolven långsamt in ända tills kanten nedanför gummiproppens konvexa del hamnar i nivå med den svarta doseringslinjen på sprutan (vilket motsvarar 0,05 ml, dvs. 0,5 mg ranibizumab).
En steril injektionskanyl på 30G x ½″ ska användas för den intravitreala injektionen.
Följ nedanstående instruktioner vid beredning av Lucentis för intravitreal administration:
|
Introduktion |
Läs alla instruktioner omsorgsfullt innan den förfyllda sprutan används. Den förfyllda sprutan är endast avsedd för engångsbruk. Den förfyllda sprutan är steril. Använd inte produkten om förpackningen är skadad. Aseptiska förhållanden ska gälla då den förseglade förpackningen öppnas och vid all fortsatt hantering. Obs! Dosen måste justeras till 0,05 ml. |
|
|
Beskrivning av den förfyllda sprutan | 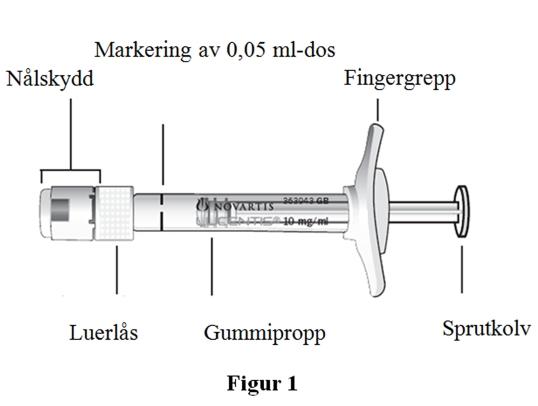
|
|
|
Förberedelser |
1. Kontrollera att paketet innehåller: • en steril förfylld spruta i förseglad förpackning. 2. Dra bort locket till sprutförpackningen och använd aseptisk teknik för att ta fram sprutan försiktigt. |
|
|
Kontroll av sprutan |
3. Kontrollera att: • nålskyddet inte lossnat från Luerlåset. • sprutan inte är skadad. • lösningen ser ut att vara klar, färglös till svagt brungul och inte innehåller några partiklar. 4. Om den förfyllda sprutan inte kan godkännas på någon av ovanstående punkter ska den kasseras, och bytas ut mot en ny spruta. | |
|
Ta bort skyddshöljet |
5. Bryt loss (vrid inte) skyddshöljet (se fig. 2). 6. Kassera skyddshöljet (se fig. 3). | 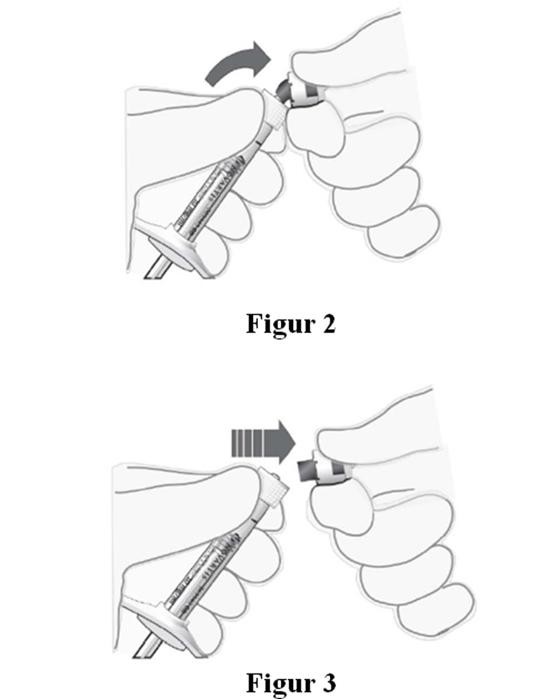
|
|
Sätta dit nålen |
7. Anslut en steril injektionskanyl i storlek 30G x ½″ på sprutan genom att skruva fast den ordentligt vid Luerlåset (se fig. 4). 8. Lossa försiktigt nålskyddet genom att dra det rakt utåt (se fig. 5). Obs! Torka inte av nålen. | 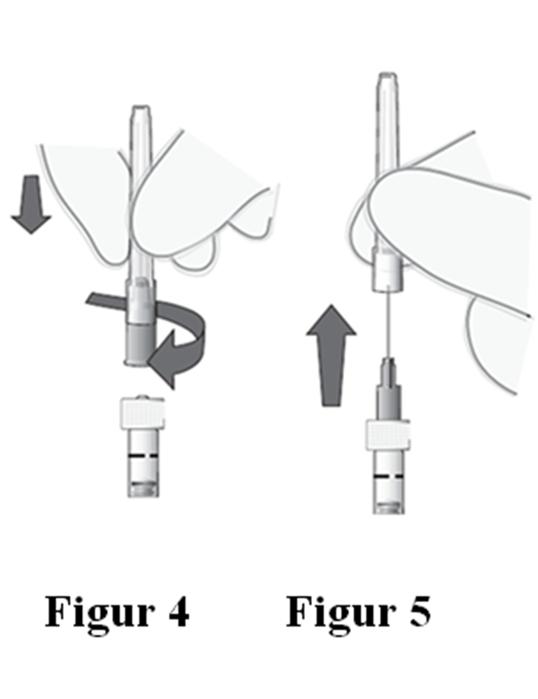
|
|
Eliminera luftbubblor |
9. Håll sprutan rakt. 10. Om du ser luftbubblor, knäpp varsamt med fingret på sprutan tills bubblorna stiger uppåt (se fig. 6). | 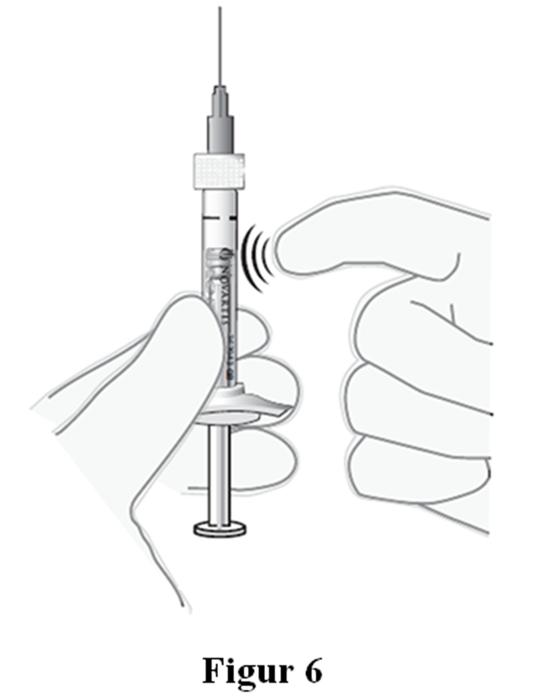
|
|
Justera dosen |
11. Håll sprutan i ögonhöjd och tryck varsamt in kolven tills kanten nedanför gummiproppens konvexa del hamnar i jämnhöjd med dosmarkeringen (se fig. 7). Detta pressar ut luften och överskjutande injektionslösning, samt etablerar en dos på 0,05 ml. Obs! Kolven och gummiproppen sitter inte ihop – detta förhindrar att luft sugs in i sprutan. | 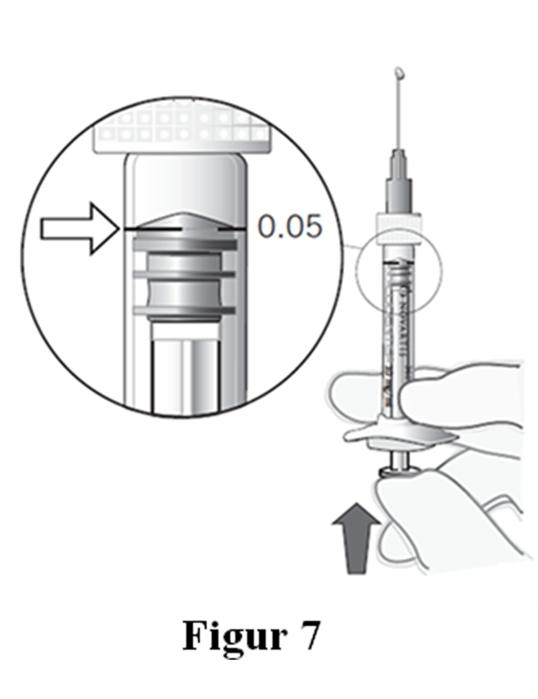
|
|
Injicera |
Injektionsförfarandet bör genomföras under aseptiska förhållanden. 12. injektionskanyl skall stickas in 3,5–4,0 mm posteriort om limbus in i glaskroppsrummet, med undvikande av den horisontella meridianen och med riktning mot ögonglobens centrum. 13. Genomför injektionen långsamt fram tills gummiproppen når sprutans botten för att injicera injektionsvolymen 0,05 ml. 14. Ett annat skleralt injektionsställe bör användas vid påföljande injektioner. 15. Efter genomförd injicering ska nålen inte på nytt förses med skyddslock eller kopplas bort från sprutan. Kassera den använda sprutan med nålen kvarsittande i tillämplig behållare för vassa föremål eller i enlighet med lokala föreskrifter. |
|
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irland
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
EU/1/06/374/003
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 22 januari 2007
Förnyat godkännande: 11 november 2016
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
2023-10-06
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu





