Indikationer
InductOs är avsett för fusionsoperation i ländryggen på en disknivå som ett substitut för autologt bentransplantat hos vuxna med degenerativ disksjukdom som har genomgått minst 6 månaders icke- kirurgisk behandling.
InductOs är avsett för behandling av akuta tibiafrakturer hos vuxna, som ett tillägg till standardbehandling i form av öppen reposition och märgspikning med icke förborrad märgkanal.
Se avnittet Farmakodynamik.
Kontraindikationer
InductOs är kontraindicerat för patienter med:
-
överkänslighet mot den aktiva substansen eller mot något hjälpämne
-
immaturt skelett
-
aktiv malignitet eller patienter som genomgår behandling av en malignitet
-
en aktiv infektion vid operationsområdet
-
compartmentsyndrom eller neurovaskulärt resittillstånd efter compartmentsyndrom
-
patologiska frakturer såsom de som observerats vid (men inte begränsade till) Paget’s sjukdom eller vid benmetastaser.
Dosering
InductOs bör användas av en lämpligt utbildad kirurg.
InductOs måste beredas exakt enligt beredningsanvisningarna.
Lämplig dos bestäms av den mängd behandlad matrix som behövs för den avsedda indikationen.
Om bara en del av produkten behövs, ska den behandlade matrixen klippas till önskad storlek, och den oanvända delen måste kasseras.
Doseringstabell för InductOs 4 mg-förpackning
|
Del av InductOs- behandlad matrix (4 mg-förpackning) |
Mått på InductOs- behandlad matrix |
Volym av InductOs- behandlad matrix |
Koncentration av InductOs- behandlad matrix |
Dos av dibotermin alfa |
|---|---|---|---|---|
|
1 matrix |
2,5 cm x 5 cm |
1,3 cm3 |
1,5 mg/cm3 |
2 mg |
|
1matrix |
2 x (2,5 cm x 5 cm) |
2,7 cm3 |
1,5 mg/cm3 |
4 mg |
Doseringstabell för InductOs 12 mg-förpackning
|
Del av InductOs- behandlad matrix (12 mg-förpackning) |
Mått på InductOs- behandlad matrix |
Volym av InductOs- behandlad matrix |
Koncentration av InductOs- behandlad matrix |
Dos av dibotermin alfa |
|---|---|---|---|---|
|
1/6 av matrixen |
2,5 cm x 5 cm |
1,3 cm3 |
1,5 mg/cm3 |
2 mg |
|
1/3 av matrixen |
2,5 cm x 10 cm |
2,7 cm3 |
1,5 mg/cm3 |
4 mg |
|
2/3 av matrixen |
5 cm x 10 cm |
5,3 cm3 |
1,5 mg/cm3 |
8 mg |
|
Hela matrixen |
7,5 cm x 10 cm |
8 cm3 |
1,5 mg/cm3 |
12 mg |
Fusionsoperation i ländryggen
Den volym som behövs av InductOs bestäms av det intervertebrala diskutrymmet samt storlek, form och inre volymen på det(de) fusionsinstrument för ländryggen som används. Varsamhet måste beaktas så att produkten inte komprimeras eller att volymen som är avsedd för ny benbildning överfylls (se Varningar och försiktighet).
Normalt används 4 mg (2,7 cm3, behandlad matrix) InductOs i det intervertebrala diskutrymmet. Den maximala dosen är begränsad till 8 mg (5,3 cm3 behandlad matrix) InductOs i det intervertebrala diskutrymmet. InductOs ska placeras i fusionsinstrumentet eller i den främre delen av det intervertebrala diskutrymmet.
Operation av akuta tibiafrakturer
Volymen InductOs som implanteras bestäms av frakturens anatomi och möjligheten att stänga såret utan att produkten komprimeras för hårt. I regel behandlas varje fraktur med innehållet i en 12 mg-förpackning. Den maximala dosen är begränsad till 24 mg (12 mg förpackning med 2 hela matrix).
Pediatrisk population
Säkerhet och effekt för InductOs hos barn under 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Läkemedlet administreras genom implantering.
Följ instruktionerna för beredning av läkemedlet före administrering.
Underlåtenhet att följa administreringsmetoden för InductOs kan äventyra produktens säkerhet och effektivitet.
InductOs ska hanteras med pincett. Under hantering och implantering ska vätskeläckage från matrixen mimimeras. Pressa inte produkten.
Fusionsoperation i ländryggen
InductOs får inte användas ensamt för denna indikation, utan ska användas tillsammans med ett eller flera godkända (CE-märkta) fusionsinstrument i ländryggen. Kompatibilitet har påvisats med titan, polyetereterketon (PEEK) och benallograft.
Noggrannhet och försiktighet måste iakttagas för att undvika överfyllning av fusionsinstrumentet och/eller den främre delen av diskutrymmet mellan ryggkotorna (se Varningar och försiktighet).
Före implantering
4 mg-förpackning:
Matrixen är förklippt i två delar på vardera 2,5 cm x 5 cm.
12 mg-förpackning:
Matrixen består av en del på 7,5 cm x 10 cm.
Behandlad matrix ska klippas i 6 lika stora bitar (ungefär 2,5 x 5 cm) för att underlätta valet av dos. De utvalda bitarna kan klippas ytterligare om det behövs.
Den ihåliga geometrin för fusionsinstrumentet måste fyllas noggrant och löst med den volym av InductOs som motsvarar instrumentets inre volym.
Implantering
Enligt normal praxis ska diskmassa och broskdelarna av kotkropparnas ändplattor avlägsnas och de kortikala delarna av ändplattorna behållas, och hemostas ska uppnås (se Interaktioner).
För instruktioner för implantering av instrumentet för fuisonsoperation i ländryggen, se tillverkarens bruksanvisning.
InductOs får inte implanteras bakom instrumentet för fusionsoperation i ländryggen, där direkt åtkomst till ryggmärgskanalen och/eller nervrötter är möjlig. Om läckage in i ryggmärgskanalen och nervroten är möjligt, måste en fysisk barriär återskapas mellan matrixen och neurologisk vävnad, t.ex. genom användning av lokalt ben eller allograft (se Interaktioner).
Efter implantering
När InductOs och fusionsinstrumentet väl är implanterat får insidan av det intervertebrala diskutrymmet inte spolas. Utanför det intervertebrala diskutrymmet ska operationsområdet spolas efter behov, och eventuellt vätskeläckage från den behandlade matrixen ska tvättas bort.
Om det krävs kirurgiskt dränage ska dränageröret placeras på avstånd från implanteringsstället, helst ett skikt ytligare än implanteringsstället.
Operation av akut tibiafraktur
Före implantering
Frakturen ska vara reponerad och fixerad och hemostas ska ha uppnåtts innan InductOs implanteras. InductOs ska vikas eller klippas efter behov före implanteringen.
Implantering
InductOs implanteras efter fraktur- och sårbehandling (dvs. i anslutning till att mjukvävnaden sutureras).
Frakturens åtkomliga yta (frakturlinjer och defekter) bör i möjligaste mån täckas med InductOs. InductOs ska placeras så att frakturområdet överbryggas och det uppstår en god kontakt med de största proximala och distala fragmenten.
InductOs kan placeras i ett tomrum (löst packad), vikt, rullad eller omslutande, enligt vad frakturens geometri kräver. InductOs ger inte mekanisk stabilitet och ska inte användas för att fylla utrymmen som utsätts för kompressionskrafter.
Efter implantering
Spola inte såret efter det att InductOs har implanterats.
Om kirurgisk dränering krävs ska dränaget placeras långt ifrån implanteringsstället eller helst ett skikt ytligare än implanteringsstället.
För att uppnå maximal effekt är det viktigt att se till att InductOs täcks helt av mjukdelar efter implanteringen.
Varningar och försiktighet
Underlåtenhet att följa beredningsinstruktionerna i och administreringsmetoden i avsnittet Dosering kan äventyra säkerheten och effekten för InductOs.
Operation av halskotpelaren
Säkerhet och effekt för InductOs vid kirurgi i halskotpelaren har inte fastställts och InductOs ska inte användas vid detta tillstånd. Lokalt ödem som associerats med användning av InductOs har rapporterats hos patienter i samband med operation av halskotpelaren. Ödemet uppträdde inte omedelbart och inträffade vanligtvis under den första veckan efter operationen. I några fall var ödemet tillräckligt allvarligt för att orsaka luftvägsobstruktion.
Maligniteter
InductOs bör inte användas till patienter med en sjukhistoria eller klinisk misstanke på malignitet vid applikationsområdet (se Kontraindikationer).
Heterotopisk ossifikation
Bruk av InductOs kan orsaka heterotopisk ossifikation vid implantationsstället och/eller de omgivande vävnaderna, vilket kan resultera i komplikationer.
Ökad benresorption
InductOs kan orsaka initial resorption av omgivande trabekulärt ben vilket har visats genom röntgen. Då det ännu inte finns tillräckliga kliniska data bör inte produkten appliceras direkt på trabekulära ben vid tillfällen då övergående benresorption kan medföra risk för benskörhet (se Biverkningar).
Vätskeansamlingar
Bildning av en vätskeansamling (pseudocysta, lokalt ödem, utgjutning vid implantatet), ibland inkapslad, i några fall resulterande i nervkompression och smärta, har rapporterats i samband med bruk av InductOs. Medicinsk behandling (dränage och/eller kirurgiskt avlägsnande) kan krävas ifall symtomen kvarstår (se Biverkningar).
Immunsvar
Både dibotermin alfa och bovint Type I-kollagen kan framkalla immunsvar hos patienter.
Antikroppar mot dibotermin alfa: I kliniska prövningar avseende fusionsoperation av ryggraden utvecklade 1,3 % av patienterna som fick InductOs antikroppar mot dibotermin alfa jämfört med 0,8 % av patienterna som fick autologt bentransplantat. I de kliniska prövningarna på frakturer i långa rörben utvecklade 6,3 % av patienterna som fick dibotermin alfa med bovint typ I-kollagenmatrix antikroppar mot dibotermin alfa jämfört med 1,3 % i kontrollgruppen. Alla patienter som testades avseende neutraliserande antikroppar mot benmorfogent protein-2 var negativa.
Antikroppar mot bovint typ I-kollagen: I kliniska prövningar avseende fusionsoperation av ryggraden, utvecklade 13,5 % av patienterna som fick InductOs antikroppar mot bovint typ I-kollagen jämfört med 14,3 % av patienterna som fick autologt bentransplantat. I de kliniska prövningarna på fraktur av långa rörben utvecklade 13,0 % av patienterna som fick dibotermin alfa med bovint typ I- kollagenmatrix antikroppar mot bovint typ I-kollagen jämfört med 5,3 % av kontrollgruppens patienter. Ingen av patienterna med positiva titrar för bovint typ I-kollagen hade några korsreagerande antikroppar mot humant typ I-kollagen.
Trots att det inte finns något samband i de kliniska studierna som pekar på att de kliniska resultaten påverkas eller att biverkningar uppstår, kan man inte utesluta risken för antikroppsbildning eller överkänslighetsreaktioner. Risken för immunreaktioner mot produkten bör tas i beaktande i de fall där man misstänker att oönskade immunologiska biverkningar kan uppstå. Risker och fördelar med behandlingen bör övervägas speciellt noga för patienter som tidigare fått kollagen som injektion (se Kontraindikationer). Eftersom det saknas erfarenhet rekommenderas inte upprepad användning av InductOs.
Särskilda populationer
Säkerhet och effekt vid bruk av InductOs till patienter med kända autoimmuna sjukdomar har inte fastställts. Dessa autoimmuna sjukdomar inkluderar reumatoid artrit, systemisk lupus erythematosus (SLE), sclerodermi, Sjögren’s syndrom och dermatomyosit/polymyosit.
Säkerhet och effekt av InductOs har inte visats hos patienter med metaboliska bensjukdomar.
Inga studier har utförts på patienter med nedsatt lever-, njur- eller hjärtfunktion.
När det gäller dessa särskilda populationer tillråds läkaren att noggrant överväga fördelarna och riskerna för den enskilda patienten innan InductOs används. Strikt övervakning av patienten och eventuella biverkningar och behandlingens resultat rekommenderas.
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per maximal dos (två 12 mg-förpackningar), dvs. det är i stort sett ”natriumfritt”.
Varningar och försiktighet för bruk vid främre fusionsoperation i ländryggen
Säkerhet och effekt för InductOs har inte fastställts vid följande situationer:
-
vid användning tillsammans med fusionsinstrument för ländryggen som är tillverkade av andra
material än titan, PEEK eller ben
-
implanterat på andra ställen än i ländryggen
-
vid annan kirurgisk teknik än fusionsoperation i ländryggen
För att undvika alltför starka farmakologiska effekter av InductOs måste noggrannhet och försiktighet iakttas för att förhindra överfyllning av instrumentet för fusionsoperation i ländryggen och/eller den främre delen av det intervertebrala diskutrymmet.
Heterotopisk ossifikation
Benbildning utanför det intervertebrala diskutrymmet är inte önskvärt eftersom det kan ha en skadlig effekt på lokala neurovaskulära strukturer.
I kliniska prövningar när degenerativ disksjukdom behandlades med en posterior operation med dibotermin alfa, observerades bakre benbildning vid DT-undersökningar. I vissa fall kan detta leda till nervkompression som potentiellt kräver kirurgisk intervention (se Biverkningar). Som en försiktighetsåtgärd måste en fysisk barriär mellan matrixen och neurologisk vävnad återskapas (se Dosering).
Förskjutning av implanterat instrument
Instrumentet kan förskjutas efter användningen av InductOs vid fusionsoperation i ländryggen vilket kan göra det nödvändigt med en revisionsoperation (se Biverkningar).
Varningar och försiktighet för bruk vid akuta tibiafrakturer
InductOs är avsett för patienter som uppfyller följande krav:
-
adekvat reposition och stabilisering av frakturen för säkerställandet av mekanisk stabilitet
-
adekvat neurovaskulär status (dvs frånvaro av compartmentsyndrom, låg risk för amputation)
-
adekvat hemostas (för att ge ett relativt torrt implanteringsställe)
-
frånvaro av stora segmentdefekter av långa rörben, som kan medföra risk för kompression av mjukdelar
Implantatet bör endast administreras på frakturen under noggrann visuell kontroll och med största försiktighet (se Dosering).
Effektivitetsdata finns endast tillgängligt från kontrollerade kliniska prövningar där öppna tibia frakturer behandlades med märgspikar (se Farmakodynamik). I en klinisk prövning där benmärgskanalen var förborrad till kontakt med kortikalt ben sågs en ökning av antalet infektioner hos patienter behandlade med InductOs jämfört med patienter som fick standardbehandling (se Biverkningar). Användning av InductOs tillsammans med märgspikning med förborrad märgkanal (reamed nails) i öppna tibiafrakturer rekommenderas inte.
InductOs ger inte mekanisk stabilitet och bör inte användas för att fylla utrymmen där det finns kompressionskrafter. Behandlingen av både frakturer på långa rörben och mjukdelar skall baseras på standardförfaranden, inkluderande infektionskontroll.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Inga interaktionsstudier har genomförts.
Eftersom dibotermin alfa är ett protein och inte har återfunnits i den allmänna cirkulationen, är det osannolikt att en farmakokinetisk interaktion mellan läkemedel uppstår.
Vid kliniska försök på akuta tibiafrakturer fick fler InductOs-patienter som även erhållit NSAID under 14 dagar i följd milda eller måttliga biverkningar i anslutning till sårläkningen (t.ex. sårdränering) än InductOs-patienter som inte tog NSAID. Den kliniska effekten påverkades inte, men en interaktion mellan NSAID och InductOs kan inte uteslutas.
Resultat från kliniska prövningar på akuta tibiafrakturer, indikerar att användningen av InductOs hos patienter som får glukokortikoider inte var förknippad med uppenbara biverkningar. I icke-kliniska studier, medförde samtidig administrering av glukokortikoider att benläkningen minskade (mätt i % som avvikelse från kontrollen), men effekten av InductOs ändrades inte.
I en in vitro-studie visades det att dibotermin alfa binds till fibrinbaserade hemostasmedel eller vävnadslim. Användningen av dessa produkter i nära anslutning till InductOs rekommenderas inte eftersom det kan leda till benbildning på platsen för implantationen av det fibrinbaserade hemostasmedlet eller vävnadslimmet (se Dosering)
Graviditet
Det finns inga eller begränsad mängd data från användningen av dibotermin alfa hos gravida kvinnor.
Djurstudier har visat reproduktionstoxikologiska effekter (se Preklinik).
På grund av möjliga risker för fostret vid eventuell utveckling av neutraliserande antikroppar mot dibotermin alfa, rekommenderas inte InductOs under graviditet eller till fertila kvinnor som inte använder preventivmedel (se Varningar och försiktighet).
Amning
Det är okänt om dibotermin alfa/metaboliter utsöndras i bröstmjölk. Med tanke på typen av produkt väntas ingen systemisk exponering av det ammade barnet, men en risk för det nyfödda barnet/spädbarnet kan inte uteslutas.
Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med InductOs efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Ingen påverkan på fertiliteten upptäcktes i djurstudier. Inga kliniska data tillgängliga, potentiell risk för människa okänd.
Trafik
InductOs har ingen eller försumbar påverkan på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste biverkningarna av InductOs vid fusionsoperation i ländryggen var radikulopatihändelser, och vid reparation av akut tibiafraktur var det lokala infektioner. Den allvarligaste biverkningen är lokalt ödem vid operation av halskotpelaren. Incidensen för biverkningar med InductOs påverkades inte av kön, ålder eller ras.
Tabell över biverkningar
Över 1 700 patienter har fått InductOs i kliniska studier. I studierna av frakturer på långa rörben fick över 500 patienter InductOs. I studier av fusionsoperation i ländryggen fick över 600 patienter InductOs. Övriga patienter deltog i studier som använde InductOs för indikationer som för närvarande inte är godkända i EU. Dessa data kompletteras med information från användningen av InductOs i den allmänna befolkningen.
Biverkningsfrekvensen hos patienter som behandlades med InductOs presenteras i tabellen nedan. Frekvenserna defineras som mycket vanliga (> 1/10) eller vanliga (> 100, <1/10). Inga reaktioner observerades för frekvensen mindre vanliga (> 1/1000, <1/100), sällsynta (> 1/10 000, <1/1000), mycket sällsynta (< 1/10 000).
Frekvensen av biverkningar som identifierades efter godkännandet av InductOs är inte kända eftersom dessa reaktioner rapporterades från en population av osäker storlek.
|
Klassificering av organsystem |
Frekvenser |
||
|---|---|---|---|
|
Mycket vanliga |
Vanliga |
Okänd |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Förskjutning av instrument1* Vätskeansamling2* | ||
|
Muskuloskeletala systemet och bindväv |
Heterotopisk ossifikation1,3* |
Osteolys* Ökad benresorption* |
|
|
Centrala och perifera nervsystemet |
Radikulopatihändelser1,4 | ||
|
Infektioner och infestationer |
Lokal infektion5* | ||
1 Observerad under fusionsoperation i ländryggen
2 Vätskeansamling innefattar lokalt ödem, pseudocysta och utgjutningar vid implantatet.
3 Heterotopisk ossifikation innefattar exostos, extraskeletal ossifikation, postoperativ heterotop förkalkning, ökad benbildning och förkalkning vid implantationsstället.
4 Radikulopatihändelser innefattar radikulit, lumbal radikulopati, radikulär smärta, lumbosakral radikulit, radikulopati och ischias.
5 Observerad under användning vid akuta tibiafrakturer
*Ytterligare information tillhandahålls nedan
Beskrivning av valda biverkningar
Ny benbildning och benremodellering
Som en del av dibotermin alfas farmakologiska verkningsmekanism sker en benremodellering (se Farmakodynamik). Under denna process sker benresorption och benbildning. Under vissa omständigheter kan en överdrift av dessa processer leda till komplikationer som nervkompression (pga. heterotopisk ossifikation) eller förskjutning av instrument (förknippat med benresorption eller osteolys).
Under två års uppföljning i kliniska prövningar av fusionsoperation i ländryggen med en posterior metod, förekom heterotopisk ossifikation som syntes på röntgenbilder oftare hos patienter som behandlats med InductOs jämfört med autologt bentransplantat (se Varningar och försiktighet). Detta röntgenfynd kan vara asymtomatiskt eller symtomatiskt.
Vätskeansamlingar
På grund av den angiogena aktiviteten hos InductOs kan vätskeansamlingar (pseudocysta, lokalt ödem, utgjutningar vid implantatet) uppkomma, ibland inkapslade, i några fall resulterande i nervkompression och smärta.
Lokalt ödem observerades ofta när InductOs användes vid steloperation av halskotpelaren.
Ödemet uppträdde inte omedelbart och var, i några fall, tillräckligt allvarligt för att orsaka luftvägsobstruktion (se Varningar och försiktighet).
Lokal infektion
Det var mycket vanligt att en lokal infektion i det frakturerade benet uppstod (>1/10) hos patienter i en klinisk studie där benmärgskanalen var förborrad till kontakt med kortikalt ben. En ökning av antalet infektioner observerades i gruppen behandlad med InductOs jämfört med gruppen som fick standardbehandling (19 % respektive 9 %, se Varningar och försiktighet). Vid användning med märgspikning med icke förborrad märgkanal, var det ingen skillnad i antalet infektioner mellan behandlingsgrupperna (21 % respektive 23 %).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via
Sverige
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Överdosering
Vid överdosering (dvs. en patient får en koncentration eller mängd av dibotermin alfa som är större än vad som rekommenderas) ska behandlingen vara stödjande.
Bruk av InductOs hos patienter som genomgår kirurgi i halskotpelaren, i mängder som är lägre än eller likartade med de för fusionsoperation i ländryggen, har satts i samband med rapporter om lokalt ödem som är tillräckligt allvarligt för att leda till luftvägsobstruktion (se Varningar och försiktighet).
Farmakodynamik
Dibotermin alfa är ett osteoinduktivt protein som ger upphov till bildning av ny benvävnad vid implanteringsstället. Dibotermin alfa binds till receptorer på ytan av mesenkymala celler och gör att cellerna differentieras till brosk- och benbildande celler. De differentierade cellerna bildar trabekulärt ben när matrixen bryts ned, samtidigt som kärlinväxt kan iakttas. Benbildningsprocessen går i riktning från implantatets utsida in mot mitten tills hela InductOs-implantet har ersatts av trabekulärt ben.
När InductOs placerades i trabekulärt ben ledde detta till en övergående resorption av benet kring implantatet och därefter ersättning med nytt, tätare ben. Omvandlingen av det omgivande benet sker på ett sätt som stämmer överens med de biomekaniska krafter som benet utsätts för. Förmågan hos InductOs att stödja omvandlingen kan ligga bakom den biologiska och biomekaniska integreringen av det nya ben som har inducerats av InductOs med det omgivande benet. Röntgen, biomekanisk och histologisk utvärdering av det inducerade benet indikerar att detta ben biologiskt och biomekaniskt fungerar på samma sätt som det egna benet. Därutöver har icke-kliniska studier gett indikationer på att frakturer på ett InductOs-inducerat ben kan självläka på ett sätt som inte skiljer sig från eget ben.
Icke-kliniska studier har givit vid handen att den benbildning som initieras av InductOs är en självbegränsande process vid vilken det bildas en väldefinierad benvolym. Denna självbegränsning beror sannolikt på förlust av dibotermin alfa från implanteringsstället samt på närvaron av BMP-inhibitorer i de omgivande vävnaderna. Dessutom indikerar flera icke-kliniska studier att det på molekylär nivå finns en negativ feedbackmekanism som begränsar bennybildning genom BMP-faktorer.
Histologiskt evidens från djurstudier av fusionsoperation i ländryggen med en anterior eller posterior kirurgisk metod visade att dibotermin alfa som administreras tillsammans med instrument som förbinder kotorna av titan, PEEK eller allograft var biokompatibelt och producerade konsekvent höga frekvenser av fusion oberoende av kirurgisk metod eller instrumentmaterial med mindre synlig fibrös vävnad jämfört med autologt bentransplantat.
Kliniska farmakologiska studier visar att matrixen som sådan inte är osteoinduktiv och att den inte finns närvarande i biopsier som har tagits så tidigt som 16 veckor efter implanteringen.
Farmakodynamisk information specifikt från studier på fusionsoperation i ländryggen
Effekt och säkerhet för InductOs demonstrerades i en randomiserad, kontrollerad, multicenter, jämförande studie på 279 patienter i åldern 19-78 år som genomgick en öppen främre fusionsprocedur av ländryggen. Patienten hade fått åtminstone 6 månaders icke-kirurgisk behandling före behandlingen med InductOs och fusionsoperationen av ländryggen. Patienterna randomiserades till att få ett kotfusionsinstrument av titan fyllt med antingen InductOs eller autologt bentransplantat taget från höftbenskammen.
Vid 24 månader efter operationen, visade det sig att InductOs statistiskt sett inte var sämre än autologt bentransplantat med en relativ framgång för radiologiskt bestämd fusion på 94,4 % för InductOs mot 88,9 % för autologt bentransplantat (95 % tvåsidigt konfidensintervall för skillnaden: -1,53, 12,46). För smärta och handikapp (Oswestryskalan), var den relativa framgången 72,9 % i gruppen som använde InductOs mot 72,5 % i gruppen som använde autologt bentransplantat (95 % tvåsidigt konfidensinterall för skillnaden: -11,2, 12,0).
En post hoc-metaanalys av 6 kontrollerade kliniska prövningar med data från patienter som behandlats med InductOs eller autologt bentransplantat, som administrerades med användning av CE-märkta kotfusionsinstrument eller spacers av benallograft och olika kirurgiska metoder, visade att vid 24 månader efter operationen associerades InductOs med en högre frekvens för lyckad fusion (95 %, 241 av 255 patienter) jämfört med autologt bentransplantat (85 %, 177 av 209 patienter), med en oddskvot på 3,26 (95 % CI: 1,172, 9,075; P = 0,024). Den beräknade absoluta differensen när det gällde frekvensen för lyckad fusion mellan InductOs och autologt bentransplantat var 11,7 % (95 % CI: 0,8 %, 22,5 %; P = 0,035).
I en samlad säkerhetsdataanalys av 8 kliniska prövningar vid 24 månader efter operationen, var frekvensen av patienter med pseudoartros cirka 2 gånger lägre efter behandling med InductOs (4,8 %, 22 av 456 patienter) jämfört med autologt bentransplantat (12,7 %, 31 av 244 patienter).
Farmakodynamisk information specifikt från studier på akuta tibiafrakturer
Effektiviteten hos InductOs demonstrerades i en multinationell, randomiserad, kontrollerad, enkelblind studie av 450 patienter (mellan 18 och 87 år; 81% män) med öppna tibiafrakturer som krävde kirurgiska åtgärder. Patienterna erhöll (i förhållandet 1:1:1) standardvård (kontrollgruppen) bestående av märgspikar och rutinmässig vård av mjukvävnad, standardvård plus InductOs 0,75 mg/ml eller standardvård plus InductOs 1,5 mg/ml. Patienterna följdes under 12 månader efter förslutning av mjukvävnaden.
I den pivotala studien på akuta tibiafrakturer ökade InductOs sannolikheten för frakturläkning; patienter behandlade med InductOs 1,5 mg/ml hade 44 % lägre risk för behandlingsmisslyckande (sekundärt ingrepp för att främja frakturläkning) jämfört med patienter i standardvårdgruppen (RR = 0,56; 95 % CI = 0,40 till 0,78). Dessa resultat styrktes av en panel bestående av radiologer, för vilka behandlingsalternativet hade blindats. Antalet sekundära och efterföljande ingrepp var signifikant lägre för InductOs-patienterna, särskilt i fråga om mer invasiva ingrepp såsom bentransplantation eller byte av spikar (P = 0,0326).
Andelen patienter med frakturläkning efter behandling med InductOs 1,5 mg/ml var signifikant högre vid alla besök från 10 veckor till 12 månader postoperativt, vilket tyder på snabb frakturläkning.
Behandling med InductOs 1,5 mg/ml var signifikant effektivt (jämfört med standardbehandling) hos patienter oavsett om de är rökare eller icke-rökare.
Frakturernas allvarlighetsgrad: Behandling med InductOs 1,5 mg/ml var signifikant effektiv i alla frakturklasser, inbegripet allvarliga Gustilo IIIB-frakturer (52 % lägre sannolikhet för sekundära ingrepp jämfört med standardvårdspatienter).
Andelen patienter med läkta mjukvävnadssår vid den kontroll som gjordes 6 veckor efter behandlingen var signifikant högre i InductOs 1,5 mg/ml-gruppen än i standardvårdsgruppen (83 % och 65 %; P = 0,0010). Andelen patienter som drabbats av materialfel (böjning av eller brott på låsningsskruvar) var signifikant lägre i InductOs 1,5 mg/ml-gruppen än i standardvårdsgruppen (11 % respektive 22 %; P = 0,0174).
Farmakokinetik
InductOs är aktivt vid implanteringsstället. Vid två undersökande studier insamlades pre- och postkirurgiska serumprover från några patienter med frakturer på långa rörben. Inget dibotermin alfa detekterades i serum.
Vid djurstudier (råttor) där man använde InductOs med radioaktivt märkt dibotermin alfa var den genomsnittliga tiden InductOs låg kvar vid implanteringsstället 4–8 dagar. Toppnivåerna för cirkulerande dibotermin alfa (0,1% av den implanterade dosen) observerades inom 6 timmar efter implanteringen. När ämnet injicerades intravenöst var dibotermin alfas halveringstid 16 minuter hos råttor och 6,7 minuter hos cynomolgus-apor. Man kan därför sluta sig till att dibotermin alfa långsamt frigörs från matrixen vid implanteringsstället och snabbt elimineras när det tas upp i den systemiska cirkulationen.
Prekliniska uppgifter
Gängse studier avseende farmakologi, samt toxicitet vid akut och upprepad exponering visade inte några särskilda risker för människa.
I reproduktionstoxicitetsstudier på råttor, där dibotermin alfa administrerades intravenöst för maximal systemisk exponering, observerades ökad fetal vikt och en ökad fetal förbening och en behandlingsrelaterad effekt kan inte uteslutas. Den kliniska betydelsen av detta är okänd.
Anti-dibotermin antikroppar har undersökts hos dräktiga kaniner efter hyperimmunisering med dibotermin alfa för att experimentellt inducera anti-dibotermin alfa-antikroppar. Hos några foster som hade lägre kroppsvikt fann man minskad förbening i frontal- och parietalbenen (4 av 151 foster), som generellt anses vara reversibel, och man kunde inte utesluta antikroppsrelaterade effekter. Man såg inga andra förändringar i fostrets yttre-, inre- eller skelettmorfologi.
Dibotermin alfa har visat varierande effekter på humana tumörcellslinjer in vitro. Tillgängliga in vivo-data för humana tumörcellinjer talar inte för en risk för befrämjande av tumörtillväxt eller metastaser. Som engångsprodukt har InductOs inte testats avseende in vivo-karcinogenicitet (se också Kontraindikationer).
InductOs har studerats i en spinal implantationsmodell på hund. InductOs implanterades direkt på den exponerade duran efter laminektomi. Efter applikationen av InductOs observerades förträngning av foramina och stenos, dock observerades inte någon mineralisering av duran, ingen ryggmärgsstenos, eller några neurologiska defekter.
Innehåll
En injektionsflaska innehåller 4 mg (4 mg-förpackning) eller 12 mg (12 mg-förpackning) dibotermin alfa. Efter rekonstitution innehåller InductOs 1,5 mg/ml dibotermin alfa.
Dibotermin alfa (rekombinant human Bone Morphogenetic Protein-2; rhBMP-2) är ett humant protein som produceras i en rekombinant ovarial cellinje från kinesisk hamster (CHO).
Pulver: Sackaros, glycin glutaminsyra, natriumklorid, polysorbat 80, natriumhydroxid
Spädningsvätska: Vatten för injektionsvätskor
Matrix: Bovint Type I kollagen.
Blandbarhet
Detta läkemedel är inte blandbart med andra läkemedel.
Hållbarhet, förvaring och hantering
Förvaras vid högst 30 °C.
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
InductOs bereds omedelbart före användning. Dibotermin alfa får endast användas efter rekonstitution med spädningsvätskan och matrixen i InductOs-förpackningen.
Efter beredning innehåller InductOs dibotermin alfa i en koncentration av 1,5 mg/ml.
InductOs får inte användas i koncentrationer över 1,5 mg/ml.
Beredning av produkten
För att förhindra att matrix överladdas är det viktigt att man bereder dibotermin alfa och väter matrix som beskrivs nedan.
4 mg-förpackning:
I det osterila området
1. Placera, med användning av steril teknik, en spruta, en nål och matrixens innerförpackning i det sterila området.
2. Desinficera proppen på dibotermin alfa-flaskan och flaskan med spädningsvätska.
3. Använd den återstående sprutan och nålen från beredningssatsen för att rekonstituera dibotermin alfa-flaskan med 3,2 ml spädningsvätska. Spruta långsamt in spädningsvätskan i injektionsflaskan som innehåller frystorkat dibotermin alfa. Snurra injektionsflaskan försiktigt för att underlätta rekonstituering. Skaka inte. Släng sedan spruta och nål.
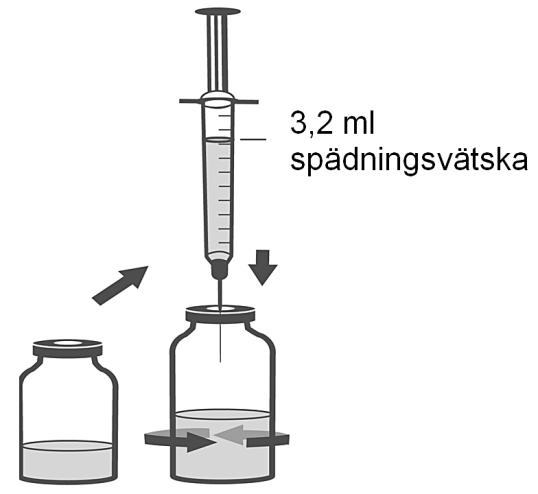
4. Desinficera proppen på flaskan som innehåller rekonstituerat dibotermin alfa.
I det sterila området
5. Öppna innerförpackningen som innehåller matrix och lämna matrix på brickan.
6. Använd aseptisk överföringsteknik samt sprutan och nålen som nämns i steg 1 för att dra upp 2,8 ml av den rekonstituerade dibotermin alfa-lösningen ur injektionsflaskan i det ickesterila området. Håll flaskan upp och ned för att underlätta uppdragningen.
7. Lämna matrix på brickan och fördela ENHETLIGT 1,4 ml av dibotermin alfa-lösningen över var och en av de två 2,5 x 5 cm matrix genom att följa mönstret i figuren nedan.
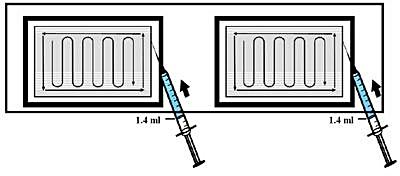
8. Låt färdigberedd InductOs stå MINST 15 minuter innan den används. Produkten måste användas inom 2 timmar efter beredningen.
12 mg-förpackning:
I det osterila området
1. Placera, med användning av steril teknik, en spruta, en nål och matrixens innerförpackning i det sterila området.
2. Desinficera proppen på dibotermin alfa-flaskan och flaskan med spädningsvätska.
3. Använd den återstående sprutan och nålen från beredningssatsen för att rekonstituera dibotermin alfa-flaskan med 8,4 ml spädningsvätska. Spruta långsamt in spädningsvätskan i injektionsflaskan som innehåller frystorkat dibotermin alfa. Snurra injektionsflaskan försiktigt för att underlätta rekonstituering. Skaka inte. Släng sedan spruta och nål.
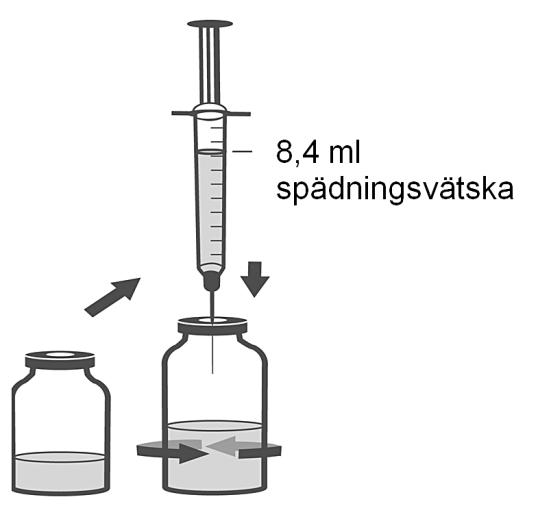
4. Desinficera proppen på flaskan som innehåller rekonstituerat dibotermin alfa.
I det sterila området
5. Öppna matrixens innerförpackning och lämna matrixen på brickan.
6. Använd aseptisk överföringsteknik samt sprutan och nålen som nämns i steg 1 för att dra upp 8 ml av den rekonstituerade dibotermin alfa-lösningen ur injektionsflaskan i det ickesterila området. Håll flaskan upp och ned för att underlätta uppdragningen.
7. Lämna matrixen på brickan och fördela ENHETLIGT dibotermin alfalösningen över matrixen genom att följa mönstret i figuren nedan.
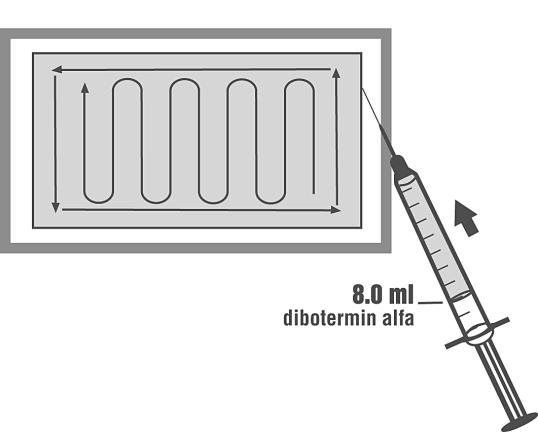
8. Låt färdigberedd InductOs stå MINST 15 minuter innan den används. Produkten måste användas inom 2 timmar efter beredningen.
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Pulver, vätska och matrix till matrix för implantation.
Pulvret är vitt. Vätskan är klar och färglös. Matrixen är vit.




