1 LÄKEMEDLETS NAMN
NovoEight 250 IE pulver och vätska till injektionsvätska, lösning
NovoEight 500 IE pulver och vätska till injektionsvätska, lösning
NovoEight 1000 IE pulver och vätska till injektionsvätska, lösning
NovoEight 1500 IE pulver och vätska till injektionsvätska, lösning
NovoEight 2000 IE pulver och vätska till injektionsvätska, lösning
NovoEight 3000 IE pulver och vätska till injektionsvätska, lösning
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
NovoEight 250 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 250 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 62,5 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
NovoEight 500 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 500 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 125 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
NovoEight 1000 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 1000 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 250 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
NovoEight 1500 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 1500 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 375 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
NovoEight 2000 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 2000 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 500 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
NovoEight 3000 IE pulver och vätska till injektionsvätska, lösning.
Varje injektionsflaska med pulver innehåller nominellt 3000 IE human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Efter beredning innehåller NovoEight cirka 750 IE/ml human koagulationsfaktor VIII (rDNA), turoktokog alfa.
Styrkan (IE) har bestämts med kromogen substratmetod enligt den Europeiska farmakopén (Ph. Eur). Den specifika aktiviteten av NovoEight är cirka 8 300 IE/mg protein.
Turoktokog alfa (human koagulationsfaktor VIII (rDNA)) är ett renat protein som har 1 445 aminosyror med en molekylmassa på cirka 166 kDA. Det framställs genom rekombinant-DNA teknik i ovarieceller från kinesisk hamster (CHO) utan tillsats av några human- eller animalderiverade proteiner i cellodlingsprocessen, reningen eller den slutliga beredningen.
Turoktokog alfa är en rekombinant human koagulationsfaktor VIII med trunkerad B-domän (B-domän med 21 aminosyror av s k vild typ) utan några andra modifieringar i aminosyresekvensen.
Hjälpämne med känd effekt
Detta läkemedel innehåller 30,5 mg natrium per beredd injektionsflaska.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Pulver och vätska till injektionsvätska, lösning.
Vitt eller något gulaktigt pulver eller spröd pulverkaka.
Klar, färglös injektionsvätska.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Behandling och profylax mot blödningar hos patienter med hemofili A (kongenital faktor VIII-brist).
NovoEight kan användas till alla åldersgrupper.
4.2 Dosering och administreringssätt
Behandling ska vara under överinseende av läkare med erfarenhet av behandling av hemofili.
Övervakning av behandling
Under pågående behandling rekommenderas bestämning av faktor VIII-nivåer, med lämpligt test, som vägledning till den dos som ska administreras och frekvensen av upprepade injektioner. Enskilda patienter kan svara olika på behandling med faktor VIII, uppvisa olika halveringstider och utbyte. Dos baserat på kroppsvikt kan kräva justering hos underviktiga och överviktiga patienter. Maximal exponering (Cmax) och total exponering (AUC) ökade med stigande BMI (body mass index) i en farmakokinetisk enkeldosstudie hos vuxna patienter vilket indikerar att dosjustering kan krävas. En dosökning kan krävas för underviktiga patienter (BMI<18,5 kg/m2) och en dosminskning kan krävas för patienter med fetma (BMI ≥30 kg/m2) men det är otillräckliga data för att rekommendera specifika dosjusteringar, se avsnitt 5.2.
I synnerhet vid större kirurgiska ingrepp är noggrann kontroll av substitutionsterapin med hjälp av koagulationsanalys (faktor VIII-aktivitet i plasma) nödvändig.
Vid användning av ett in vitro tromboplastintid (aPTT)-baserad enstegs koagulationstest för bestämning av faktor VIII-aktivitet i patienters blodprov, kan resultaten av faktor VIII-aktiviteten i plasma påverkas signifikant av både aPTT-reagenstypen och referensstandarden som används i testet. Det kan även vara signifikanta skillnader mellan testresultaten som erhålls med aPTT-baserad enstegs koagulationstest och den kromogena metoden enligt Ph. Eur. Detta är särskilt viktigt vid byte av laboratorium och/eller reagens som används i testet.
Dosering
Dosen och substitutionsbehandlingens längd beror på faktor VIII-bristens allvarlighetsgrad, på blödningens plats och omfattning samt på patientens kliniska tillstånd.
Antalet enheter av faktor VIII som administreras uttrycks i internationella enheter (IE), som relaterar till gällande WHO-standard för faktor VIII-preparat. Aktiviteten av faktor VIII i plasma uttrycks antingen i procent (i förhållande till normal human plasma) eller i internationella enheter (i förhållande till en internationell standard för faktor VIII i plasma).
En internationell enhet (IE) av faktor VIII-aktivitet är likvärdig med mängden av faktor VIII i en ml plasma från en frisk människa.
Behandling vid behov
Beräkning av den erforderliga dosen av faktor VIII baserar sig på att man empiriskt funnit att 1 internationell enhet (IE) av faktor VIII per kg kroppsvikt höjer plasmans faktor VIII-aktivitet med 2 IE/dl. Den erforderliga dosen beräknas med följande formel:
Erforderligt antal enheter = kroppsvikt (kg) × önskad ökning av faktor VIII (% eller IE/dl) × 0,5 (IE/kg per IE/dl).
Mängden som ska administreras och administreringsintervallet bör alltid justeras efter klinisk effekt i varje enskilt fall.
Vid nedan angivna blödningar bör faktor VIII-aktiviteten inte falla under angivna plasmanivåer (% av normal eller IE/dl) för motsvarande period. Tabellen nedan kan användas som vägledning för dosering vid blödningsepisoder och vid kirurgiska ingrepp:
Tabell 1 Vägledning för dosering vid blödningsepisoder och kirurgiska ingrepp
|
Grad av blödning/ Typ av kirurgiskt ingrepp Blödning |
Nödvändig faktor VIII-nivå (% eller IE/dl) |
Doseringsfrekvens (timmar)/ Behandlingstid (dagar) |
|---|---|---|
|
Tidig hemartros, muskelblödning eller oral blödning |
20–40 |
Upprepa var 12:e till 24:e timme under minst 1 dag tills blödningen är under kontroll (indikerad av upplevd smärta) eller läkning har uppnåtts |
|
Mer omfattande hemartros, muskelblödning eller hematom |
30–60 |
Upprepa infusionen var 12:e till 24:e timme i 3–4 dagar eller längre tills smärta och akut funktionsnedsättning försvunnit |
|
Livshotande blödningar |
60–100 |
Upprepa infusionen var 8:e till 24:e timme tills det kritiska tillståndet övervunnits |
|
Kirurgi | ||
|---|---|---|
|
Mindre ingrepp, inklusive tandutdragning |
30–60 |
Var 24:e timme under minst 1 dygn tills läkning har uppnåtts |
|
Större ingrepp |
80–100 (pre- och postoperativa) |
Upprepa infusionen var 8:e till 24:e timme tills adekvat sårläkning uppnåtts. Därefter behandling i ytterligare minst 7 dagar för att upprätthålla en faktor VIII-nivå på 30–60% (IE/dl) |
Profylax
Som långtidsprofylax mot blödningar hos patienter med svår hemofili A är den vanliga dosen 20–40 IE faktor VIII per kg kroppsvikt varannan dag eller 20–50 IE faktor VIII per kg kroppsvikt 3 gånger i veckan. Hos vuxna och ungdomar (>12 år) kan en mindre frekvent regim (40-60 IE/kg var tredje dag eller två gånger i veckan) vara tillämplig. I några fall, speciellt hos yngre patienter, kan kortare doseringsintervall eller högre doser krävas.
Kirurgi
Erfarenhet av användning vid kirurgi på barn är begränsad.
Äldre
Erfarenhet av användning till patienter över 65 år saknas.
Pediatrisk population
För långtidsprofylax mot blödningar hos patienter under 12 år rekommenderas doser på 25–50 IE faktor VIII per kg kroppsvikt varannan dag eller 25–60 IE faktor VIII per kg kroppsvikt 3 gånger i veckan. För pediatriska patienter över 12 år rekommenderas samma dos som till vuxna.
Administreringssätt
Intravenös användning.
Rekommenderad infusionshastighet för NovoEight är 1–2 ml/minut. Hastigheten ska anpassas med hänsyn till vad som känns bekvämt för patienten.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt 6.6.
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1.
Känd allergi mot hamsterproteiner.
4.4 Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet
Överkänslighetsreaktioner mot NovoEight av allergisk typ kan förekomma. Läkemedlet innehåller spår av hamsterprotein, som hos vissa patienter kan orsaka allergiska reaktioner. Om symtom på överkänslighet uppstår, bör patienten tillrådas att genast upphöra med att använda läkemedlet och kontakta läkare. Patienter bör informeras om tidiga tecken på överkänslighetsreaktioner såsom nässelfeber, generaliserad urticaria, trånghet i bröstet, pipande andning, hypotoni och anafylaxi.
I händelse av chock ska riktlinjer för chockterapi följas.
Inhibitorer
Bildandet av neutraliserande antikroppar (inhibitorer) mot faktor VIII är en känd komplikation vid behandling av patienter med hemofili A. Dessa inhibitorer är vanligtvis IgG immunoglobuliner riktade mot den prokoagulerande aktiviteten av faktor VIII, som kvantifieras i Bethesda-enheter (BE) per ml plasma med hjälp av det modifierade Bethesda-testet. Risken att utveckla inhibitorer är relaterad till sjukdomens allvarlighetsgrad samt exponering för faktor VIII, med störst risk inom de 50 första exponeringsdagarna men fortsätter hela livet även om risken är mindre vanlig.
Hur kliniskt relevant utvecklingen av inhibitorer är beror på inhibitorns titer, där låg titer, utgör en lägre risk för otillräckligt kliniskt svar än hög titer.
Generellt bör patienter som behandlats med koagulationsfaktor VIII övervakas noggrant för utveckling av inhibitorer med hjälp av lämpliga kliniska observationer och laboratorietester. Om inte förväntad nivå av faktor VIII-aktivitet i plasma uppnås eller om blödningen inte kan kontrolleras med lämplig dos bör test av förekomst av inhibitorer utföras. Hos patienter med höga nivåer av inhibitorer har behandling med faktor VIII eventuellt ingen effekt och andra behandlingsmöjligheter bör övervägas. Behandling av sådana patienter bör skötas av läkare med erfarenhet av patienter med hemofili och faktor VIII inhibitorer.
Kardiovaskulära händelser
Hos patienter med befintliga kardiovaskulära riskfaktorer, kan substitutionsbehandling med FVIII öka den kardiovaskulära risken.
Kateter-relaterade komplikationer
Om tillbehör till central venkateter (CVK) krävs, ska risken för CVK-relaterade komplikationer inkluderande lokala infektioner, bakteriemi och trombos på stället för katetern beaktas.
Varje gång NovoEight administreras till en patient bör preparatets namn och satsnummer registreras så att det finns en länk mellan patient och läkemedlets satsnummer.
Pediatrisk population
Angivna varningar och försiktighetsmått gäller både vuxna och barn.
Om hjälpämnen
Detta läkemedel innehåller 30,5 mg natrium per beredd injektionsflaska, vilket motsvarar 1,5% av det dagliga maximala intaget på 2,0 g natrium för en vuxen enligt WHO:s rekommendationer.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Inga interaktioner mellan human koagulationsfaktor-VIII (rDNA) produkter och andra läkemedel har rapporterats.
4.6 Fertilitet, graviditet och amning
Inga reproduktionsstudier på djur har gjorts med NovoEight. Då hemofili A är mycket sällsynt förekommande hos kvinnor finns ingen erfarenhet av användning av faktor VIII under graviditet och amning. Därför ska faktor VIII användas under graviditet och amning endast då ett uttalat behov föreligger.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
NovoEight har ingen effekt på förmågan att framföra fordon och använda maskiner.
4.8 Biverkningar
Sammanfattning av säkerhetsprofilen
Överkänslighet eller allergiska reaktioner (som kan inkludera angioödem, brännande och stickande känsla vid infusionsstället, frossa, blodvallningar, generaliserad urticaria, huvudvärk, nässelutslag, hypotoni, letargi, illamående, rastlöshet, takykardi, trånghet i bröstet, stickningar, kräkning, väsande andning) har observerats i sällsynta fall och kan i vissa fall utvecklas till allvarlig anafylaxi (inklusive chock).
I mycket sällsynta fall har utveckling av antikroppar mot hamsterprotein med tillhörande överkänslighetsreaktioner observerats.
Neutraliserande antikroppar (inhibitorer) kan utvecklas hos patienter med hemofili A som behandlas med faktor VIII, inklusive NovoEight. Om sådana inhibitorer uppstår kan tillståndet manifesteras som ett otillräckligt kliniskt svar. I sådana fall bör ett specialiserat hemofilicenter kontaktas.
Biverkningslista i tabellform
Nedan tabell följer klassificeringen av organsystem enligt MedDRA (System Organ Class, SOC och Preferred Term Level).
Frekvenser anges enligt följande konvention: mycket vanliga (≥ 1/10 ), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Tabell 2 Frekvensen av biverkningar i kliniska prövningar
|
Organsystem |
Frekvensa i PTP |
Frekvensa i PUP |
Biverkning |
|
Blodet och lymfsystemet |
Mindre vanligab |
Mycket vanligab |
Inhiberande FVIII-antikroppar |
|
Psykiska störningar |
Mindre vanliga |
|
Sömnlöshet |
|
Centrala och perifera nervsystemet |
Mindre vanliga |
|
Huvudvärk, yrsel, brännande känsla |
|
Hjärtat |
Mindre vanliga |
|
Sinustakykardi, akut hjärtinfarkt |
|
Blodkärl |
Mindre vanliga |
|
Hypertoni, lymfödem, hyperemi |
|
|
Vanliga |
Rodnad, ytlig tromboflebit |
|
|
Hud och subkutan vävnad |
|
Vanliga |
Hudutslag, hudrodnad |
|
Mindre vanliga |
|
Hudutslag, likenoid keratos, brännande känsla i huden |
|
|
Muskuloskeletala systemet och bindväv |
Mindre vanliga |
|
Muskuloskeletal stelhet, artropati, smärta i extremiteterna, muskuloskeletal smärta |
|
|
Vanliga |
Hemartros, muskelhemorragi |
|
|
Andningsvägar, bröstkorg och mediastinum |
|
Vanliga |
Hosta |
|
Allmänna symtom och/eller symtom vid injektionsstället |
Vanliga |
|
Reaktioner på injektionsställetc |
|
|
Vanliga |
Feber, erytem på kateterstället |
|
|
Mindre vanliga |
|
Trötthet, värmekänsla, perifert ödem, feber |
|
|
Undersökningar |
Vanliga |
|
Förhöjda leverenzymvärdend |
|
Vanliga |
Anti-faktor VIII antikroppspositiv |
||
|
Mindre vanliga |
|
Ökad hjärtfrekvens |
|
|
Magtarmkanalen |
|
Vanliga |
Kräkning |
|
Skador och förgiftningar och behandlingskomplikationer |
Vanliga |
|
Felaktig dos administrerad |
|
|
Vanliga |
Infusionsrelaterade reaktioner |
|
|
Mindre vanliga |
|
Kontusion |
|
|
Produktproblem |
|
Vanliga |
Trombos i utrustningen |
a Beräknad baserat på totalt antal unika patienter i alla kliniska prövningar (301), av vilka 242 var patienter som tidigare behandlats (PTP) och 60 var tidigare obehandlade patienter (PUP).
b Frekvensen baseras på studier med alla FVIII-produkter, vilka inkluderade patienter med svår hemofili A.
c Reaktioner på injektionsstället omfattar erytem, extravasation och klåda.
d I förhöjda leverenzymer ingår alaninaminotransferas (ALAT), aspartataminotranferas (ASAT), gamma-glutamyltransferas (gamma-GT) och bilirubin.
Beskrivning av utvalda biverkningar
I samtliga kliniska studier av NovoEight hos tidigare behandlade patienter rapporterades totalt 35 biverkningar hos 23 av totalt 242 patienter exponerade för NovoEight. De vanligaste rapporterade biverkningarna var reaktioner på injektionsstället, administrering av felaktig dos och förhöjda leverenzymvärden. Av de 35 biverkningarna rapporterades 2 hos 1 av 31 patienter under 6 år, ingen bland patienter 6–12 år, 1 händelse hos 1 av 24 patienter (12 till <18 år) samt 32 hos 21 av 155 vuxna patienter (≥18 år).
Pediatrisk population
I kliniska prövningar på 63 tidigare behandlade barn mellan 0–12 år och 24 ungdomar mellan 12–18 år med allvarlig hemofili A sågs ingen skillnad i säkerhetsprofilen för NovoEight för den pediatriska populationen jämfört med vuxna.
I prövningen med tidigare obehandlade patienter, mellan 0 och 6 års ålder, rapporterades totalt 46 biverkningar hos 33 av 60 patienter exponerade för NovoEight. Den vanligast rapporterade biverkningen var inhiberande Faktor VIII-antikroppar, se avsnitt 4.4. Genetiska mutationer med hög risk identifierades i 92,3% totalt och 93,8% av inhibitorer med bekräftad hög titer. Inga andra faktorer var signifikant förknippade med utvecklingen av inhibitorer.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Inga överdoseringssymtom har rapporterats för rekombinant koagulationsfaktor VIII.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: hemostatika, koagulationsfaktor VIII, ATC-kod: B02BD02
Verkningsmekanism
NovoEight innehåller turoktokog alfa, en human koagulationsfaktor VIII (rDNA) med trunkerad B-domän. Detta glykoprotein har samma struktur som human faktor VIII när den aktiverats och liknande posttranslationella modifieringar som hos den plasmaframställda molekylen. Det sulfateringsställe i tyrosin som finns vid Tyr1680 (endogen full-längd), vilket är viktigt för bindning till von Willebrand-faktorn, har visats vara helt sulfaterat i turoktokog alfa molekylen. Vid infusion till en hemofilipatient binds turoktokog alfa till endogen von Willebrand-faktor som finns i patientens cirkulation. Faktor VIII/von Willebrand-komplexet består av två molekyler (faktor VIII och von Willebrand-faktor) med olika fysiologiska funktioner. Aktiverad faktor VIII fungerar som en co-faktor för aktiverad faktor IX, vilken påskyndar omvandlingen av faktor X till aktiverad faktor X. Aktiverad faktor X omvandlar protrombin till trombin. Trombin i sin tur omvandlar fibrinogen till fibrin och ett koagel kan bildas. Hemofili A är en könsbunden ärftlig koagulationsstörning orsakad av sänkta nivåer av faktor VIII:C och resulterar i rikliga blödningar i leder, muskler eller inre organ, antingen spontant eller som ett resultat av en oavsiktlig skada eller kirurgiskt trauma. Med substitutionssterapi ökar plasmanivåerna av faktor VIII och möjliggör genom detta en tillfällig korrigering av faktor VIII-bristen och blödningstendenserna.
Notera att annualiserad blödningsfrekvens (ABR) inte är jämförbar mellan olika faktorkoncentrat och mellan olika kliniska studier.
Klinisk effekt
I fyra öppna, icke-kontrollerade multicenterstudier har säkerhet och effekt av NovoEight vid förebyggande och behandling av blödningar samt vid användning under kirurgi studerats hos patienter med allvarlig hemofili A (FVIII-aktivitet ≤1%). Tre av dessa prövningar utfördes på tidigare behandlade patienter och den fjärde på tidigare obehandlade patienter. I prövningarna ingick 298 exponerade patienter; 175 ungdomar eller vuxna patienter utan inhibitorer från 12 års ålder (≥ 150 exponeringsdagar), 63 tidigare behandlade pediatriska patienter utan inhibitorer under 12 år (≥ 50 exponeringsdagar) och 60 tidigare obehandlade patienter under 6 års ålder. 188 av 238 tidigare behandlade patienter fortsatte in i en säkerhetsstudie. Behandling med NovoEight var säker och hade avsedd hemostatisk och profylaktisk effekt. Av de 3 293 rapporterade blödningarna som observerades hos 298 av patienterna var 2 902 (88,1%) under kontroll efter 1–2 infusioner NovoEight.
Tabell 3 Konsumtion av NovoEight och frekvens för framgångsrik hemostatisk behandling hos tidigare obehandlade patienter (PUP) och tidigare behandlade patienter (PTP)
|
Yngre barn (0 till <6 år) PUP |
Yngre barn (0 till <6 år) PTP |
Äldre barn (6 till <12 år) PTP |
Ungdomar (12 till <18 år) PTP |
Vuxna (≥18 år) PTP |
Totalt |
|
|---|---|---|---|---|---|---|
|
Antal patienter |
60 |
31 |
32 |
24 |
151 |
298 |
|
Dos använd för profylax per patient (IE/kg kroppsvikt) Medelvärde (SD) Min. ; Max. |
45,2 (14,4) 4,5 ; 363,8 |
41,5 (8,1) 3,4 ; 196,3 |
38,4 (9,4) 3,2 ; 62,5 |
28,5 (9,3) 17,4 ; 73,9 |
28,5 (8,3) 12,0 ; 97,4 |
32,8 (10,9) 3,2 ; 363,8 |
|
Dos använd för behandling av blödning (IE/kg kroppsvikt) Medelvärde (SD) Min. ; Max. |
43,6 (15,2) 11,9 ; 118,9 |
44,0 (12,6) 21,4 ; 193,8 |
40,4 (10,5) 24,0 ; 71,4 |
29,3 (10,3) 12,4 ; 76,8 |
35,0 (12,3) 6,4; 104,0 |
37,5 (13,4) 6,4 ; 193,8 |
|
Framgångsrik behandling Frekvensa % |
87,0% |
92,2% |
88,4% |
85,1% |
89,6% |
88,9% |
SD: standardavvikelse
a Framgångsrik definieras som antingen ”Utmärkt” eller ”Bra”.
Kliniska data från före läkemedlet godkänts bekräftades av en icke-interventionell säkerhetsstudie som utfördes efter det att läkemedelt godkänts för att tillhandahålla ytterligare dokumentation om immunogeniciteten, effekten och säkerheten hos NovoEight i rutinmässig klinisk praxis. Totalt ingick 68 tidigare behandlade patienter (> 150 ED), varav 14 patienter var <12 år och 54 patienter ≥12 år, som fick antingen behandling vid behov (N = 5) eller profylaktisk (N = 63) behandling i totalt 87,8 patientår och 8967 EDs.
Kirurgi
Totalt 30 kirurgiska ingrepp utfördes på 25 patienter av vilka 26 var större ingrepp och 4 var mindre. Framgångsrik hemostas erhölls vid alla ingrepp och ingen misslyckad behandling rapporterades.
Data på induktion av immuntolerans (ITI) har samlats in hos patienter med hemofili A som hade utvecklat inhibitorer mot faktor VIII. Under klinisk studie hos PUP behandlades 21 patienter med ITI och 18 (86%) patienter avslutade ITI med ett negativt inhibitortestresultat.
5.2 Farmakokinetiska egenskaper
Samtliga farmakokinetiska (PK) studier med NovoEight utfördes efter intravenös administrering av 50 IE/kg NovoEight på tidigare behandlade patienter med allvarlig hemofili A (FVIII ≤ 1%). Analys av plasmaprov utfördes med både enstegs koagulationstest och kromogena substratmetod.
Hur NovoEight uppträder vid FVIII:C bestämningar utvärderades och jämfördes med ett marknadsfört s k full-längd rekombinant faktor VIII-preparat. Studien visade att resultaten för preparaten var jämförbara och konsekventa och att NovoEight därmed kan bestämmas i plasma på ett tillförlitligt sätt och att egen separat NovoEight standard inte är nödvändig.
Farmakokinetiska parametrar för NovoEight vid enkeldos-administrering anges i tabell 4 vid bestämning med enstegs koagulationstest och i tabell 5 vid bestämning med kromogen substratmetod.
Tabell 4 Farmakokinetiska parametrar (enkeldos) för NovoEight (50 IE/kg) efter ålder - enstegs koagulationstest - Medelvärde (SD)
|
Parameter |
0 till <6 år |
6 till <12 år |
≥12 år |
|
n=14 |
n=14 |
n=33 |
|
|
Inkrementellt utbyte (IE/dl)/(IE/kg) |
1,8 (0,7) |
2,0 (0,4) |
2,2 (0,4) |
|
AUC ((IE×h)/dl) |
992 (411) |
1109 (374) |
1526 (577) |
|
Clearance (ml/h×kg) |
6,21 (3,66) |
5,02 (1,68) |
3,63 (1,09) |
|
t½ (h) |
7,65 (1,84) |
8,02 (1,89) |
11,00 (4,65) |
|
Vss (ml/kg) |
56,68 (26,43) |
46,82 (10,63) |
47,40 (9,21) |
|
Cmax (IE/dl) |
100 (58) |
107 (35) |
123 (41) |
|
MRT (h) (Mean residence time) |
9,63 (2,50) |
9,91 (2,57) |
14,19 (5,08) |
Förkortningar: AUC = arean under faktor VIII-aktivitetens tidsprofil; t½ = terminal halveringstid;
Vss = distributionsvolym vid steady-state; Cmax = maximal faktor VIII-aktivitet
Tabell 5 Farmakokinetiska parametrar (enkeldos) för NovoEight (50 IE/kg) efter ålder - kromogen substratmetod – Medelvärde (SD)
|
Parameter |
0 till <6 år |
6 till <12 år |
≥12 år |
|
n=14 |
n=14 |
n=33 |
|
|
Inkrementellt utbyte (IE/dl)/(IE/kg) |
2,2 (0,6) |
2,5 (0,6) |
2,9 (0,6) |
|
AUC ((IE×h)/dl) |
1223 (436) |
1437 (348) |
1963 (773) |
|
Clearance (ml/h×kg) |
4,59 (1,73) |
3,70 (1,00) |
2,86 (0,94) |
|
t½ (h) |
9,99 (1,71) |
9,42 (1,52) |
11,22 (6,86) |
|
Vss (ml/kg) |
55,46 (23,53) |
41,23 (6,00) |
38,18 (10,24) |
|
Cmax (IE/dl) |
112 (31) |
125 (27) |
163 (50) |
|
MRT (h) (Mean residence time) |
12,06 (1,90) |
11,61 (2,32) |
14,54 (5,77) |
Förkortningar: AUC = arean under faktor VIII-aktivitetens tidsprofil; t½ = terminal halveringstid;
Vss = distributionsvolym vid steady-state; Cmax = maximal faktor VIII-aktivitet
De farmakokinetiska parametrarna för barn < 6 år och barn 6 till <12 år var jämförbara. Viss variation i de farmakokinetiska parametrarna för NovoEight observerades mellan pediatriska och vuxna patienter. Den högre clearance och kortare halveringstid som sågs hos pediatriska jämfört med vuxna patienter med hemofili A, kan delvis bero på känd större plasmavolym per kg kroppsvikt hos yngre patienter.
En farmakokinetisk enkeldos studie (50 IE/kg) utfördes med 35 hemofili-patienter (≥ 18 år) i olika BMI-kategorier. Den maximala exponeringen (Cmax) och den totala exponeringen (AUC) ökade med stigande BMI vilket indikerade att dosjustering kan krävas för underviktiga (BMI<18,5 kg/m2) och patienter med fetma (BMI≥30 kg/m2), se avsnitt 4.2.
Tabell 6 Farmakokinetiska parametrar (enkeldos) för NovoEight (50 IE/kg) efter BMI-klassera – enstegs koagulationstest - Medelvärde (SD)
|
PK parameter |
Undervikt N=5 |
Normal vikt N=7 |
Övervikt N=8 |
Fetma klass I N=7 |
Fetma klass II/III N=7 |
|
Inkrementellt utbyte (IE/dl)/(IE/kg) |
1,7 (0,2) |
2,0 (0,2) |
2,4 (0,4) |
2,3 (0,3)b |
2,6 (0,3) |
|
AUC ((IE*h)/dl) |
1510 (360) |
1920 (610) |
1730 (610) |
2030 (840) |
2350 (590) |
|
Clearance (ml/h/kg) |
3,91 (0,94) |
3,20 (1,00) |
3,63 (1,24) |
3,37 (1,79) |
2,51 (0,63) |
|
t½ (h) |
11,3 (2,0) |
11,7 (3,5) |
9,4 (2,9) |
11,2 (3,5) |
11,1 (2,7) |
|
Vss (ml/kg) |
56,8 (5,4) |
44,8 (6,5) |
39,6 (6,0) |
42,0 (9,0) |
35,0 (4,6) |
|
Cmax (IE/dl) |
100 (11) |
121 (10) |
144 (26) |
140 (21) |
161 (32) |
|
MRT (h) (Mean residence time) |
15,1 (3,0) |
15,3 (4,8) |
11,9 (3,7) |
14,4 (4,6) |
14,6 (3,7) |
a BMI-grupper: Undervikt: BMI <18,5 kg/m2, Normal vikt: BMI 18,5-24,9 kg/m2, Övervikt: BMI 25-29,9 kg/m2, Fetma klass I: BMI 30-34,9 kg/m2, Fetma klass II/III: BMI ≥35 kg/m2.
b Baserat endast på 6 patienter.
Tabell 7 Farmakokinetiska parametrar (enkeldos) för NovoEight (50 IE/kg) efter BMI-klassera – kromogen substratmetod - Medelvärde (SD)
|
PK parameter |
Undervikt N=5 |
Normal vikt N=7 |
Övervikt N=9 |
Fetma klass I N=7 |
Fetma klass II/III N=7 |
|
Inkrementellt utbyte (IE/dl)/(IE/kg) |
2,2 (0,4) |
2,9 (0,3) |
3,0 (0,5) |
3,2 (0,5) |
3,5 (0,5) |
|
AUC ((IE*h)/dl) |
1860 (700) |
2730 (860) |
2310 (1020) |
2780 (1210) |
3050 (730) |
|
Clearance (ml/h/kg) |
3,28 (0,87) |
2,25 (0,73) |
2,84 (1,09) |
2,58 (1,56) |
1,94 (0,52) |
|
t½ (h) |
11,7 (2,4) |
11,5 (3,6) |
9,7 (3,4) |
10,4 (3,2) |
10,5 (2,5) |
|
Vss (ml/kg) |
49,1 (10,4) |
31,2 (4,5) |
31,6 (5,8) |
28,9 (5,1) |
25,7 (4,0) |
|
Cmax (IE/dl) |
138 (29) |
185 (24) |
194 (31) |
200 (33) |
227 (32) |
|
MRT (h) (Mean residence time) |
15,5 (3,2) |
15,2 (4,9) |
12,6 (4,8) |
13,5 (4,6) |
13,9 (3,7) |
a BMI-grupper: Undervikt: BMI <18,5 kg/m2, Normal vikt: BMI 18,5-24,9 kg/m2, Övervikt: BMI 25-29,9 kg/m2, Fetma klass I: BMI 30-34,9 kg/m2, Fetma klass II/III: BMI ≥35 kg/m2.
5.3 Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi och allmäntoxicitet visade inte några särskilda risker för människa.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Pulver
Natriumklorid
L-histidin
Sackaros
Polysorbat 80
L-metionin
Kalciumkloriddihydrat
Natriumhydroxid (för pH-justering)
Saltsyra (för pH-justering)
Spädningsvätska
Natriumklorid
Vatten för injektionsvätskor
6.2 Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
6.3 Hållbarhet
Oöppnad injektionsflaska:
30 månader vid förvaring i kylskåp (2°C–8°C).
Under hållbarhetstiden kan läkemedlet förvaras:
• i rumstemperatur (≤30°C) under en enda sammanhängande period på högst 9 månader
eller
• över rumstemperatur (30°C upp till 40°C) under en enda sammanhängande period på högst 3 månader.
När läkemedlet har tagits ut från kylskåpet får det inte sättas tillbaka i kylskåpet igen.
Anteckna datum för när förvaringen påbörjas samt förvaringstemperaturen på ytterkartongen.
Efter beredning av lösning:
Efter beredning har kemisk och fysikalisk hållbarhet påvisats i:
• 24 timmar vid förvaring i 2°C–8°C
• 4 timmar vid förvaring i 30°C, för läkemedel som har förvarats i en enda sammanhängande period på högst 9 månader vid rumstemperatur (≤30°C)
• 4 timmar vid förvaring upp till 40°C, för läkemedel som har förvarats i en enda sammanhängande period på högst 3 månader över rumstemperatur (30°C upp till 40°C).
Ur mikrobiologisk synpunkt bör läkemedlet användas omedelbart efter beredning. Om det inte används genast ansvarar användaren för lagringstid och förvaringsförhållanden och dessa ska normalt inte överskrida det som anges ovan, såvida inte beredning utförts under kontrollerade och validerade aseptiska förhållanden.
Beredd lösning förvarad i rumstemperatur (≤30°C) eller upp till 40°C i mer än 4 timmar ska kasseras.
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C–8°C). Får ej frysas.
Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Anvisningar för förvaring i rumstemperatur (≤30°C) eller upp till 40°C och förvaringsanvisningar efter beredning finns i avsnitt 6.3.
6.5 Förpackningstyp och innehåll
Varje förpackning NovoEight 250 IE, 500 IE, 1000 IE, 1500 IE, 2000 IE och 3000 IE pulver och vätska till injektionsvätska, lösning innehåller:
– 1 injektionsflaska av glas (typ 1) med pulver och förslutning av klorbutylgummi
– 1 steril adapter för flaska för beredning av lösning
– 1 förfylld spruta med 4 ml spädningsvätska och med backstopp (polypropen), gummikolv (brombutyl) och spruthätta med förslutning (brombutyl)
– 1 kolvstång (polypropen).
6.6 Särskilda anvisningar för destruktion och övrig hantering
NovoEight administreras intravenöst efter upplösning av pulvret med spädningsvätskan som finns i sprutan. Efter beredning är lösningen klar eller något oklar. Använd inte lösningar som är grumliga eller har fällningar.
För beredning behövs också ett infusionsset (slang med butterflynål), sterila desinfektionstorkar, kompresser och plåster. Detta ingår inte i förpackningen med NovoEight.
Tillämpa alltid aseptisk teknik.
Beredning
A)
Ta ut injektionsflaskan, adaptern och den förfyllda sprutan ur kartongen. Låt kolvstången ligga kvar orörd i kartongen. Låt injektionsflaskan och den förfyllda sprutan uppnå rumstemperatur. Du kan göra detta genom att hålla dem i händerna tills de känns lika varma som dina händer. Gör inte på något annat sätt för att värma injektionsflaskan och den förfyllda sprutan.
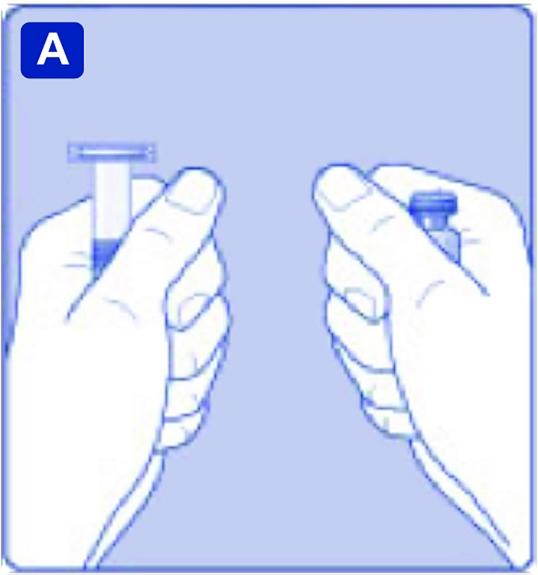
B)
Ta av plastlocket från injektionsflaskan. Om locket sitter löst eller saknas ska injektionsflaskan inte användas. Torka av injektionsflaskans gummiförslutning med en steril desinfektionstork och låt den torka några sekunder före användning.
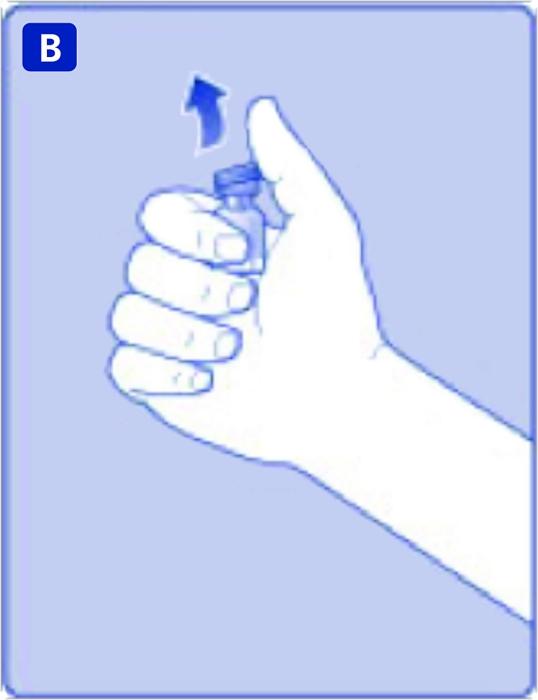
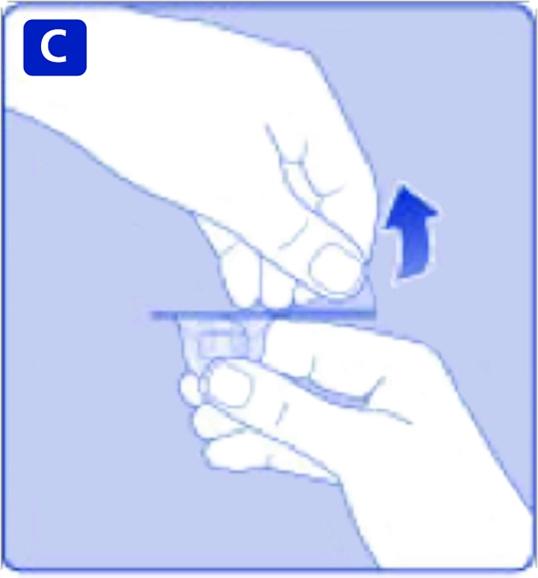
C)
Ta av skyddspappret från adaptern. Om skyddspappret inte sluter helt tätt eller är trasigt ska adaptern inte användas.
Ta inte ut adaptern ur skyddshöljet med fingrarna.
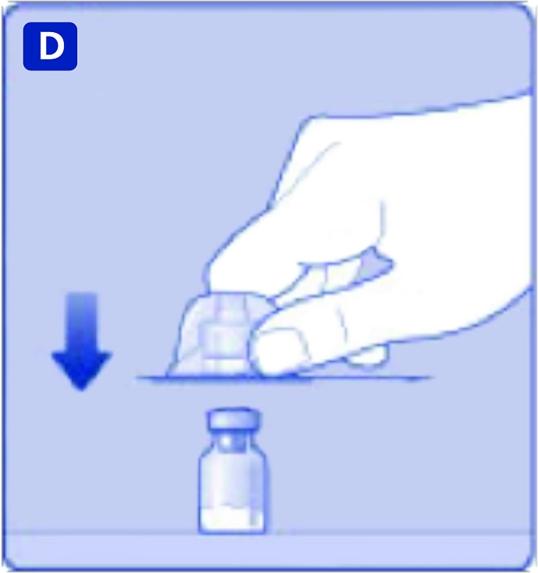
D)
Vänd på skyddshöljet och snäpp på adaptern på injektionsflaskan. När det väl sitter på ska du inte ta bort adaptern från injektionsflaskan.
E)
Tryck lätt på skyddshöljet med tummen och pekfingret som bilden visar. Ta bort skyddshöljet från adaptern.
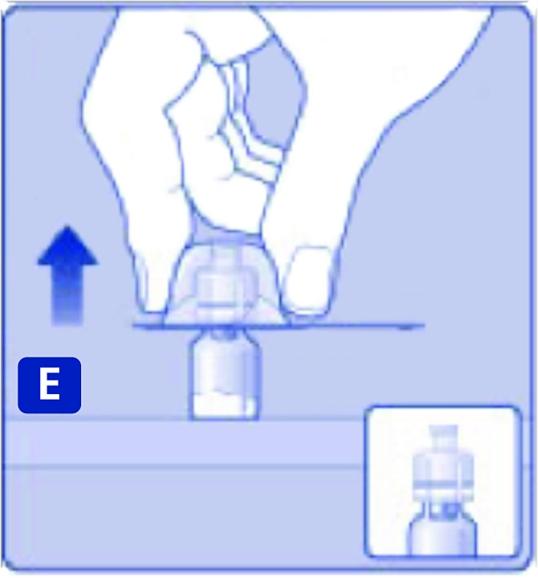
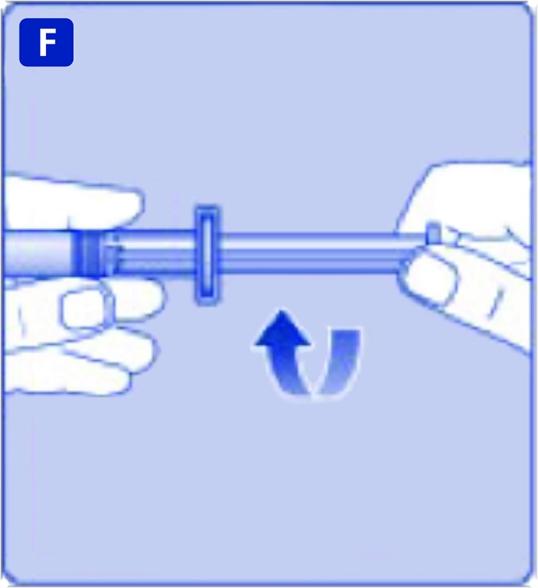
F)
Ta tag i kolvstången i den breda änden och sätt genast ihop den med sprutan genom att skruva in den medurs i den förfyllda sprutans gummikolv tills motstånd känns.
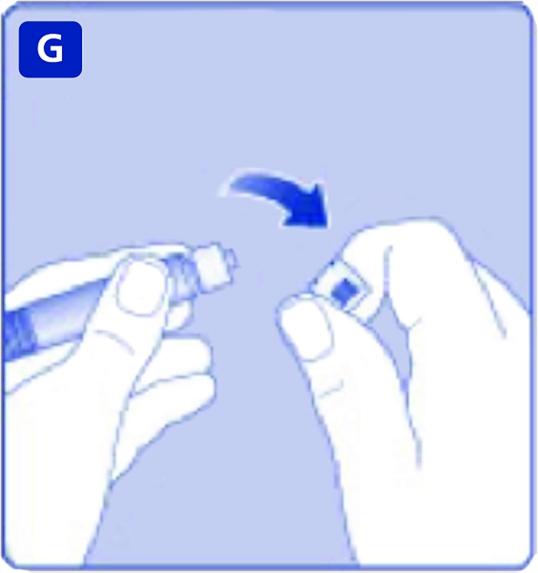
G)
Ta av spruthättan från den förfyllda sprutan genom att böja ner den tills perforeringen bryts. Rör inte vid sprutans topp under spruthättan.
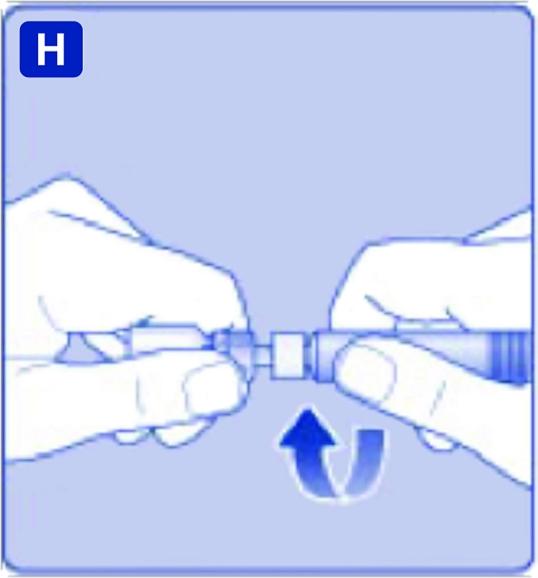
H)
Skruva fast den förfyllda sprutan ordentligt på adaptern tills motstånd känns.
I)
Luta sprutan något med injektionsflaskan pekande neråt. Tryck in kolvstången så att all spädningsvätska injiceras ner i injektionsflaskan.
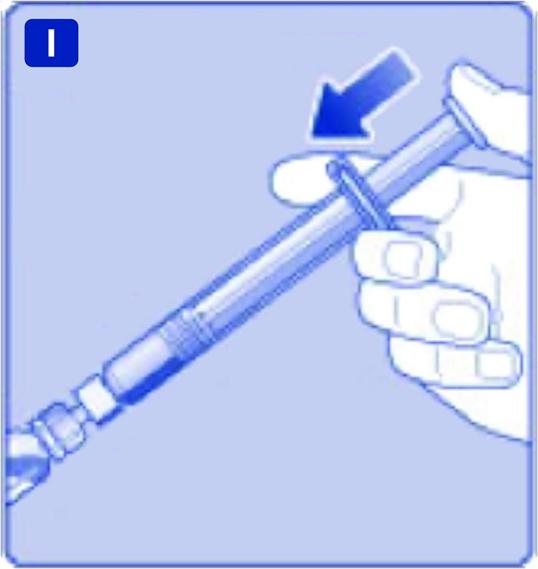
J)
Håll kolvstången nertryckt och snurra försiktigt på injektionsflaskan tills allt pulver är upplöst. Skaka inte injektionsflaskan eftersom det leder till skumbildning.
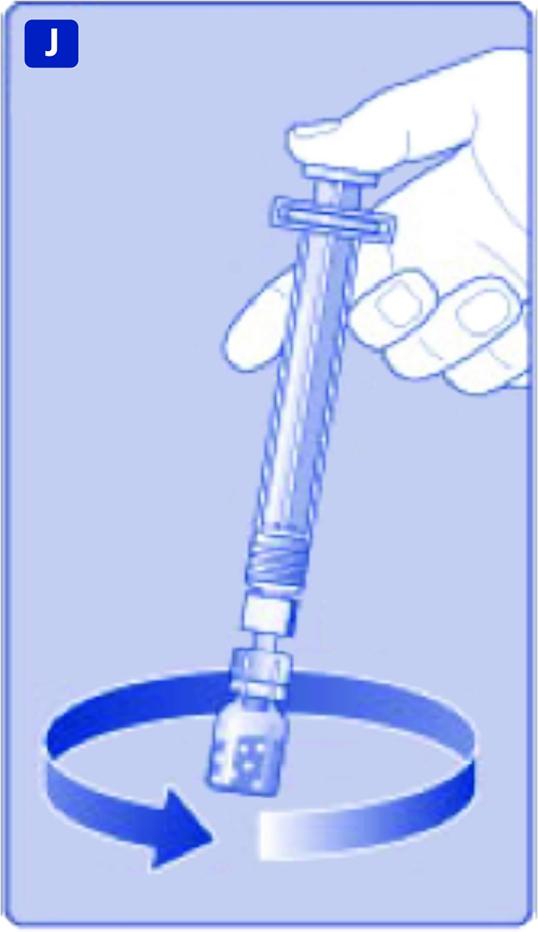
Det rekommenderas att använda NovoEight omedelbart efter beredning. Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt 6.3.
Om en högre dos behövs upprepas steg A till J med ytterligare injektionsflaskor, adaptrar och förfyllda injektionssprutor.
Administrering av den beredda lösningen
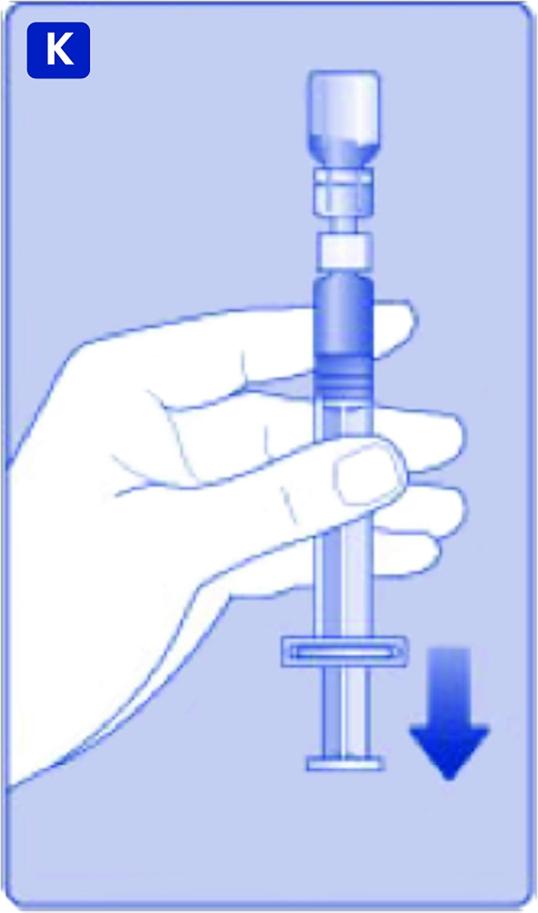
K)
Håll kolvstången helt intryckt. Vänd sprutan med injektionsflaskan upp och ned. Sluta att trycka på kolvstången och låt den själv röra sig tillbaka medan lösningen fyller sprutan. Dra ner kolvstången något, så att lösningen dras in i sprutan.
Om inte hela mängden behövs ska du använda skalan på sprutan för att se hur mycket lösning som du drar upp, enligt anvisning från läkare eller sjuksköterska.
Håll kvar injektionsflaskan upp och ner och knacka lätt på sprutan så att eventuella luftbubblor samlas överst. Tryck långsamt på kolvstången tills alla luftbubblor är borta.
L)
Skruva av adaptern med flaskan.
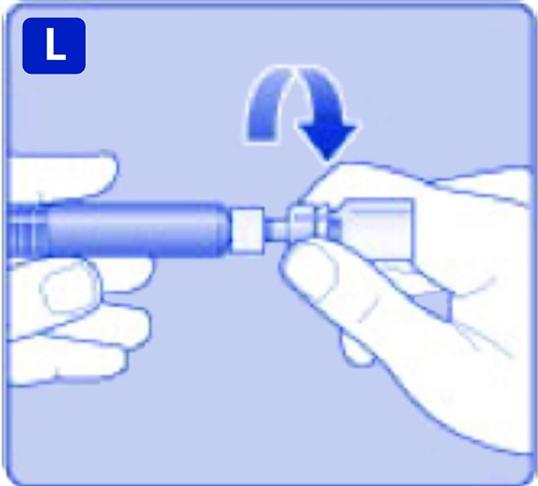
NovoEight är nu färdigt att injiceras. Välj ett lämpligt ställe och injicera NovoEight långsamt i en ven under 2–5 minuter.
Avfallshantering
Efter injektionen ska du kassera oanvänd NovoEight lösning, spruta med infusionssetet, injektionsflaska med adapter och annat avfall enligt apotekspersonals anvisningar.
Kasta det inte bland vanliga hushållssopor.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Danmark
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
NovoEight 250 IE
EU/1/13/888/001
NovoEight 500 IE
EU/1/13/888/002
NovoEight 1000 IE
EU/1/13/888/003
NovoEight 1500 IE
EU/1/13/888/004
NovoEight 2000 IE
EU/1/13/888/005
NovoEight 3000 IE
EU/1/13/888/006
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 13 november 2013
Förnyat godkännande: 30 juli 2018
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
10/2020





