Indikationer
Erivedge är avsett för behandling av vuxna patienter med:
-
symtomatiskt metastaserat basalcellscarcinom
-
lokalt avancerat basalcellscarcinom som inte är lämpat för behandling med kirurgi eller strålning (se avsnitt Farmakodynamik).
Kontraindikationer
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
-
Kvinnor som är gravida eller ammar (se avsnitt Varningar och försiktighet och Graviditet).
-
Fertila kvinnor som inte följer Erivedge graviditetsförebyggande program (se avsnitt Varningar och försiktighet och Graviditet)
-
Samtidig administrering av Johannesört (Hypericum perforatum) (se avsnitt Interaktioner).
Dosering
Erivedge ska endast förskrivas av eller under överinseende av en specialistläkare som har erfarenhet av behandling av den godkända indikationen.
Dosering
Den rekommenderade dosen är en 150 mg kapsel en gång dagligen.
Missade doser
Om en dos missas ska patienten instrueras att inte ta den missade dosen utan fortsätta med nästa schemalagda dos.
Behandlingsduration
I kliniska studier fortsatte behandling med Erivedge tills sjukdomsprogression eller oacceptabel toxicitet. Behandlingsavbrott på upp till 4 veckor var tillåtet baserat på individuell tolerabilitet.
Nyttan av fortsatt behandling ska utvärderas regelbundet, eftersom den optimala behandlingsdurationen varierar för varje enskild patient.
Särskilda patientpopulationer
Äldre
Ingen dosjustering krävs för patienter ≥ 65-års ålder (se avsnitt Farmakokinetik). Av totalt 138 patienter i 4 kliniska studier med Erivedge vid avancerat basalcellscarcinom, var ungefär 40 % av patienterna ≥ 65 år och ingen övergripande skillnad i säkerhet eller effekt observerades mellan dessa patienter och yngre patienter.
Nedsatt njurfunktion
Mild och måttlig njurfunktionsnedsättning förväntas inte påverka elimineringen av vismodegib och ingen dosjustering krävs. Mycket begränsade data finns tillgängliga för patienter med svår njurfunktionsnedsättning. Patienter med svår njurfunktionsnedsättning ska noggrant följas upp avseende biverkningar.
Nedsatt leverfunktion
Ingen dosjustering krävs för patienter med mild, måttlig eller svår leverfunktionsnedsättning, definierat baserat på kriterierna från National Cancer Institute Organ Dysfunction Working Group (NCI-ODWG) för leverfunktionsnedsättning (se avsnitt Farmakokinetik):
-
mild: totalt bilirubin (TB) ≤ Övre normalgräns (upper limit of normal=ULN), aspartataminotransferas (ASAT)>ULN eller ULN<TB≤1,5 x ULN, ASAT oavsett värde
-
måttlig: 1,5 x ULN < TB < 3 x ULN, ASAT oavsett värde
-
svår: 3 x ULN < TB < 10 x ULN, ASAT oavsett värde
Pediatrisk population
Säkerhet och effekt för Erivedge för barn och ungdomar under 18 år har inte fastställts.
Av säkerhetsmässiga skäl (se avsnitt Varningar och försiktighet och Prekliniska uppgifter) ska detta läkemedel inte ges till barn och ungdomar under 18 år.
Administreringssätt
Erivedge är för oralt bruk. Kapslarna måste sväljas hela med vatten, med eller utan föda (se avsnitt Farmakokinetik). För att undvika oavsiktlig exponering till patienter eller sjukvårdspersonal ska kapslarna inte öppnas.
Varningar och försiktighet
Embryo-/fosterdöd eller allvarliga missbildningar
Erivedge kan orsaka embryo-/fosterdöd eller allvarliga missbildningar då det ges till en gravid kvinna (se avsnitt Graviditet). Hedgehoghämmare (se avsnitt Farmakodynamik) såsom vismodegib har visats vara embryotoxiska och/eller teratogena i flera djurarter och kan orsaka allvarliga missbildningar, inklusive kraniofaciala anomaliteter, defekter i medellinjen och defekter på lemmar (se avsnitt Prekliniska uppgifter). Erivedge får inte användas under graviditet (se avsnitt Kontraindikationer).
Kriterier för en fertil kvinna
En fertil kvinna är definierad i Erivedge graviditetsförebyggande program som:
-
En sexuellt mogen kvinna som
-
har menstruerat vid något tillfälle under de föregående 12 månaderna i följd,
-
inte har genomgått hysterektomi eller en bilateral ovariektomi, eller som inte har medicinskt bekräftad permanent prematur ovarialsvikt,
-
inte har en XY genotyp, Turners syndrom, eller uterin agenesi,
-
får amennorré efter cancerbehandling, inklusive behandling med Erivedge.
-
Rådgivning
För en fertil kvinna
Erivedge är kontraindicerat för en fertil kvinna som inte följer Erivedge graviditetsförebyggande program.
En fertil kvinna måste förstå att:
-
Erivedge utgör en teratogen risk för fostret,
-
Hon får inte ta Erivedge om hon är gravid eller planerar att bli gravid,
-
Hon måste ha ett negativt graviditetstest utfört av sjukvårdspersonal inom 7 dagar innan Erivedgebehandlingen inleds,
-
Hon måste ha ett negativt graviditetstest varje månad under behandlingen, även om hon har amennorré,
-
Hon får inte bli gravid medan hon tar Erivedge eller inom 24 månader efter hennes sista dos,
-
Hon måste kunna följa åtgärder för effektiva preventivmetoder,
-
Hon måste använda 2 sorters rekommenderade preventivmetoder (se avsnitt ‘Preventivmetoder’ nedan och 4.6) då hon tar Erivedge, om hon inte förbinder sig att inte ha samlag (avhållsamhet),
-
Hon måste informera sjukvårdspersonal om något av följande inträffar under behandling eller inom 24 månader efter hennes sista dos:
-
Om hon blir gravid eller tror av någon anledning att hon kan vara gravid,
-
Om hon inte får sin förväntade menstruation,
-
Om hon slutar använda preventivmedel förutom om hon förbinder sig att inte ha samlag (avhållsamhet),
-
Om hon behöver byta preventivmedel under behandlingen,
-
-
Hon får inte amma medan hon tar Erivedge och inom 24 månader efter den sista dosen.
För män
Vismodegib finns i sädesvätskan. För att undvika potentiell fosterexponering under graviditet måste en manlig patient förstå att:
-
Erivedge utgör en teratogen risk för fostret om han har oskyddat sex med en gravid kvinna,
-
Han måste alltid använda rekommenderade preventivmetoder (se avsnitt ‘Preventivmetoder’ nedan och avsnitt Graviditet).
-
Han ska berätta för vårdpersonal om hans kvinnliga partner blir gravid medan har tar Erivedge eller inom 2 månader efter hans sista dos.
För sjukvårdspersonal
Sjukvårdspersonal måste utbilda patienterna så de förstår och accepterar alla villkoren i Erivedge graviditetsförebyggande program.
Preventivmetoder
Fertila kvinnor
Kvinnliga patienter måste använda två rekommenderade preventivmetoder inkluderande en högeffektiv metod och en barriärmetod under Erivedgebehandling och inom 24 månader efter den sista dosen (se avsnitt Graviditet).
Män
Manliga patienter måste alltid använda kondom (med spermiedödande medel, om tillgängligt), även efter en vasektomi, då han har sex med en kvinnlig partner medan han tar Erivedge och inom 2 månader efter den sista dosen (se avsnitt Graviditet).
Graviditetstest
För en fertil kvinna ska ett medicinskt övervakat graviditetstest utföras av sjukvårdspersonal inom 7 dagar före behandlingen inleds och varje månad under behandlingen. Graviditetstester som finns lokalt ska ha en känslighet på minst 25 mIE/ml. Patienter som uppvisar amenorré under behandling med Erivedge ska fortsätta med graviditetstest varje månad medan de står på behandling.
Restriktioner för förskrivning och dispensering till fertila kvinnor
Inledande förskrivning och dispensering av Erivedge ska ske inom maximalt 7 dagar efter ett negativt graviditetstest (dag för graviditetstestet = dag 1). Recept på Erivedge ska begränsas till 28 dagars behandling och fortsatt behandling kräver ett nytt recept.
Utbildningsmaterial
För att hjälpa sjukvårdspersonal och patienter att undvika embryonal- och fosterexponering av Erivedge kommer innehavaren av godkännandet för försäljning att tillhandahålla utbildningsmaterial (Erivedge graviditetsförebyggande program) för att tydliggöra de potentiella riskerna som är förknippade med användning av Erivedge.
Effekter på postnatal utveckling
Tidig slutning av epifyserna och tidig pubertet har rapporterats hos pediatriska patienter som exponerats för Erivedge. På grund av den långa elimineringshalveringstiden för läkemedlet kan dessa händelser inträffa eller fortskrida även efter att behandlingen avslutats. Hos djurarter har vismodegib visats orsaka allvarliga irreversibla förändringar för tandtillväxt (degeneration/nekros av odontoblaster, bildande av vätskefyllda cystor i tandpulpan, förbening (ossifiering) av rotkanalen, och blödning) samt slutning av epifysplattan. Fynden av tidig slutning av epifyserna indikerar en potentiell risk för kortväxthet och tandmissbildningar hos spädbarn och barn (se avsnitt Prekliniska uppgifter).
Blodgivare
Patienter ska inte vara blodgivare medan de tar Erivedge och inom 24 månader efter den sista dosen.
Spermiedonation
Manliga patienter ska inte donera sperma då de tar Erivedge eller inom 2 månader efter den sista dosen.
Interaktioner
Samtidig behandling med starka CYP-inducerare (t ex rifampicin, karbamazepin eller fenytoin) ska undvikas eftersom risken för minskade plasmakoncentrationer och minskad effekt av vismodegib inte kan uteslutas (se även avsnitt Interaktioner).
Allvarliga hudbiverkningar
Allvarliga hudbiverkningar (SCARs =Severe cutaneous adverse reactions) inklusive fall av Stevens-Johnsons syndrom/toxisk epidermalnekrolys (SJS/TEN), läkemedelsreaktioner med eosinofili och systemiska symtom (DRESS) samt akut generaliserad exantematös pustulos (AGEP), som kan vara livshotande, har rapporterats vid användning efter marknadsintroduktionen (se avsnitt Biverkningar). Om patienten har utvecklat någon av dessa reaktioner vid användning av vismodegib, får behandling med vismodegib aldrig återinsättas på patienten.
Hjälpämnen
Erivedge kapslar innehåller laktosmonohydrat. Patienter med sällsynta ärftliga problem med galaktosintolerans, total laktasbrist eller glukos-galaktos malabsorption ska inte ta detta läkemedel.
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, alltså i stort sett ‘natriumfritt’.
Interaktioner
Andra läkemedels effekt på vismodegib då de ges tillsammans
Kliniskt signifikanta farmakokinetiska interaktioner förväntas inte mellan vismodegib och läkemedel som höjer pH. Resultat från en klinisk studie visade en 33-%ig minskning av obunden koncentration av vismodegib efter sju dagars samtidig behandling med 20 mg rabeprazol (en protonpumpshämmare) som gavs 2 timmar före varje vismodegibadministrering. Denna interaktion förväntas inte vara kliniskt signifikant.
Kliniskt signifikanta farmakokinetiska interaktioner förväntas inte mellan vismodegib och CYP450 hämmare. Resultat från en klinisk studie visade en 57-%ig ökning av obunden koncentration av vismodegib på dag 7 efter samtidig behandling med 400 mg flukonazol (en måttlig hämmare av CYP2C9) dagligen, men denna interaktion förväntas inte vara kliniskt signifikant. Itrakonazol (en stark hämmare av CYP3A4) 200 mg dagligen påverkade inte vismodegibs AUC0-24h efter 7 dagars samtidig behandling av friska försökspersoner.
Kliniskt signifikanta farmakokinetiska interaktioner mellan vismodegib och P-gp-hämmare förväntas inte. Resultat från en klinisk studie visade ingen kliniskt signifikant farmakokinetisk interaktion mellan vismodegib och itrakonazol (en stark hämmare av P-glykoprotein) hos friska försökspersoner.
Då vismodegib ges tillsammans med inducerare av CYP (rifampicin, karbamazepin, fenytoin eller Johannesört) kan exponeringen av vismodegib minska (se avsnitt Kontraindikationer och Varningar och försiktighet).
Vismodegibs effekt på andra läkemedel då de ges tillsammans
Orala preventivmedel
Resultat från läkemedelsinteraktionsstudier med cancerpatienter visade att systemexponeringen av etinylöstradiol och noretindron inte förändrades då något av läkemedlen gavs tillsammans med vismodegib. Däremot var interaktionsstudien bara med 7 dagars duration och det kan inte uteslutas att vismodegib vid en längre behandlingstid är en inducerare av enzymer som metaboliserar preventivmedelssteroider. Induktion kan leda till minskningar i systemexponeringen av preventivmedelssteroider och därmed minska preventivmedelseffekten.
Effekter på specifika enzymer och transportörer
In vitro-studier tyder på att vismodegib har potential att fungera som en hämmare av bröstcancerresistensprotein (BCRP). In vivo- interaktionsdata finns inte tillgängligt. Det kan inte uteslutas att vismodegib kan ge upphov till ökad exponering av läkemedel som transporteras av detta protein, såsom rosuvastatin, topotekan och sulfasalazin. Samtidig administrering ska utföras med försiktighet och dosjusteringar kan vara nödvändiga.
Kliniskt signifikanta farmakokinetiska interaktioner mellan vismodegib och CYP450-substrat förväntas inte. In vitro var CYP2C8 den mest känsliga CYP isoformen för hämning av vismodegib. Emellertid visade resultat från läkemedelsinteraktionsstudier med cancerpatienter att systemexponeringen av rosiglitazon (ett CYP2C8 substrat) inte förändrades då läkemedlen gavs tillsammans med vismodegib. Därmed kan hämning av CYP enzymer av vismodegib in vivo uteslutas.
Vismodegib hämmar OATP1B1 in vitro. Det kan inte uteslutas att vismodegib kan öka exponeringen av substrat till OATP1B1, t ex bosentan, ezetimib, glibenklamid, repaglinid, valsartan och statiner. Framförallt bör försiktighet iakttas om vismodegib administreras i kombination med någon statin.
Graviditet
Fertila kvinnor
På grund av risken för embryo-/fosterdöd eller allvarliga missbildningar orsakade av vismodegib får inte kvinnor som tar Erivedge vara gravida eller bli gravida under behandlingen samt inom 24 månader efter den sista dosen (se avsnitt Kontraindikationer och Varningar och försiktighet).
Erivedge är kontraindicerat för fertila kvinnor som inte följer Erivedge graviditetsförebyggande program.
I händelse av graviditet eller uteblivna menstruationer
Om patienten blir gravid, får utebliven menstruation, eller misstänker av någon anledning att hon kan vara gravid måste hon meddela behandlande läkare omedelbart.
Bestående utebliven menstruation under behandling med Erivedge ska antas tyda på graviditet tills medicinsk utvärdering och bekräftelse.
Preventivmetoder för män och kvinnor
Fertila kvinnor
Fertila kvinnor måste kunna följa åtgärder för effektiva preventivmetoder. Hon måste använda två rekommenderade preventivmetoder inkluderande en högeffektiv metod och en barriärmetod under Erivedgebehandling och inom 24 månader efter den sista dosen. Fertila kvinnor vars menstruation är oregelbunden eller har slutat måste följa alla råd om effektiva preventivmetoder.
Män
Vismodegib finns i sädesvätskan. För att undvika fosterexponering under graviditet måste manliga patienter alltid använda kondom (med spermiedödande medel, om tillgängligt), även efter en vasektomi, då han har sex med en kvinnlig partner medan han tar Erivedge och inom 2 månader efter sista dosen.
Följande preventivmetoder är rekommenderade former av högeffektiva metoder:
-
Hormonell depåinjektion,
-
Tubarsterilisering,
-
Vasektomi,
-
Intrauterint inlägg (spiral).
Följande preventivmetoder är rekommenderade former av barriärmetoder:
-
Alla kondomer för män (med spermiedödande medel, om tillgängligt),
-
Pessar (med spermiedödande medel, om tillgängligt).
Graviditet
Erivedge kan orsaka embryo-/fosterdöd eller allvarliga missbildningar då det ges till en gravid kvinna (se avsnitt Varningar och försiktighet). Hedgehoghämmare (se avsnitt Farmakodynamik) såsom vismodegib har visats vara embryotoxiska och/eller teratogena i flera djurarter och kan orsaka allvarliga missbildningar, inklusive kraniofaciala anomaliteter, defekter i medellinjen och defekter på lemmar (se avsnitt Prekliniska uppgifter). Om en kvinna som behandlas med Erivedge blir gravid, måste behandlingen stoppas omedelbart.
Amning
Det är inte känt i vilken utsträckning vismodegib utsöndras i bröstmjölk. På grund av dess risk att orsaka allvarliga defekter på utvecklingen får inte kvinnor amma då de tar Erivedge och inom 24 månader efter den sista dosen (se avsnitt Kontraindikationer och Prekliniska uppgifter).
Fertilitet
Human kvinnlig fertilitet kan påverkas vid behandling med Erivedge (se avsnitt Prekliniska uppgifter). Det är inte känt huruvida fertilitetsnedsättningen är reversibel. Dessutom har amennoré observerats i kliniska studier hos fertila kvinnor (se avsnitt Biverkningar). Fertilitetsbevarande strategier bör diskuteras med fertila kvinnor innan behandling med Erivedge inleds.
Fertilitetsnedsättning hos män är inte förväntad (se avsnitt Prekliniska uppgifter).
Amning
Det är inte känt i vilken utsträckning vismodegib utsöndras i bröstmjölk. På grund av dess risk att orsaka allvarliga defekter på utvecklingen får inte kvinnor amma då de tar Erivedge och inom 24 månader efter den sista dosen (se Kontraindikationer och Prekliniska uppgifter).
Fertilitet
Human kvinnlig fertilitet kan påverkas vid behandling med Erivedge (se Prekliniska uppgifter). Det är inte känt huruvida fertilitetsnedsättningen är reversibel. Dessutom har amennoré observerats i kliniska studier hos fertila kvinnor (se Biverkningar). Fertilitetsbevarande strategier bör diskuteras med fertila kvinnor innan behandling med Erivedge inleds.
Fertilitetsnedsättning hos män är inte förväntad (se Prekliniska uppgifter).
Trafik
Erivedge har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av biverkningsprofilen
De vanligaste biverkningarna som inträffade hos ≥30% av patienterna var muskelspasmer (74,6%), alopeci (65,9%), dysgeusi (58,7%), viktminskning (50,0%), trötthet (47,1%), illamående (34,8%) och diarré (33,3%).
Tabell över biverkningar
Biverkningar presenteras i tabell 1 nedan efter systemorganklass och absolut frekvens.
Frekvenserna definieras som:
Mycket vanliga (≥ 1/10)
Vanliga (≥ 1/100, < 1/10)
Mindre vanliga (≥ 1/1 000, < 1/100)
Sällsynta (≥ 1/10 000, <1/1,000)
Mycket sällsynta (< 1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Inom varje frekvensgruppering presenteras biverkningarna efter minskande allvarlighetsgrad.
Säkerheten för Erivedge har utvärderats i kliniska studier med 138 patienter som behandlats för avancerat basalcellscarcinom (aBCC), vilket inkluderar både metastaserat basalcellscarcinom (mBCC) och lokalt avancerat basalcellscarcinom (laBCC). I fyra öppna kliniska studier i fas 1 och 2 behandlades patienterna med minst en dos Erivedge i monoterapi med doser ≥150 mg. Doser >150 mg medförde inte högre plasmakoncentrationer i kliniska studier och patienter med doser >150 mg har inkluderats i analysen. Dessutom har säkerheten utvärderats i en studie efter marknadsgodkännandet som inkluderade 1215 patienter med aBCC som behandlades med doseringen 150 mg och utvärderades avseende säkerhet. Rent generellt var den observerade säkerhetsprofilen jämförbar hos både patienter med mBCC och laBCC och mellan studierna enligt beskrivningen nedan.
Tabell 1 Biverkningar som inträffade hos patienter som behandlades med Erivedge
|
MedDRA Systemorganklass |
Mycket vanliga |
Vanliga |
Ingen känd frekvens |
|---|---|---|---|
|
Endokrina systemet |
tidig pubertet**** |
||
|
Metabolism och nutrition |
minskad aptit |
dehydrering |
|
|
Centrala och perifera nervsystemet |
dysgeusi ageusi |
hypogeusi |
|
|
Magtarmkanalen |
illamående diarré förstoppning kräkning dyspepsi |
övre buksmärta buksmärta |
|
|
Lever och gallvägar |
|
förhöjda leverenzymer** |
läkemedelsinducerad leverskada***** |
|
Hud och subkutan vävnad |
alopeci klåda hudutslag |
madarosis (förlust av ögonfransar) onormal hårväxt |
stevens-Johnsons syndrom (SJS) /toxisk epidermal-nekrolys (TEN), läkemedelsreak-tioner med eosinofili och systemiska symtom (DRESS) samt akut generaliserad exantematös pustulos (AGEP)****** |
|
Muskuloskeletala systemet och bindväv |
muskelspasmer artralgi smärta i extremiteter |
ryggsmärta muskuloskeletal bröstsmärta myalgi flanksmärta Muskuloskeletal smärta Förhöjt kreatinfosfokinas i blodet*** |
tidig slutning av epifysen**** |
|
Reproduktionsorgan och bröstkörtel |
amenorré* |
|
|
|
Allmänna symptom och/eller symptom vid administreringsstället |
viktminskning trötthet smärta |
asteni |
|
|
All rapportering är baserad på biverkningar av alla grader enligt National Cancer Institute - Common Terminology Criteria for Adverse Events v 3.0 om inte annat angivits. *Av de 138 patienter med avancerat BCC var 10 kvinnor fertila. Bland dessa kvinnor observerades amenorré hos 3 patienter (30 %). MedDRA = Medical Dictionary for Regulatory Activities ** inkluderar följande termer: onormala leverfunktionsvärden, ökning av blodbilirubin, gamma-glutamyltransferas, aspartataminotransferas, alkaliskt fosfatas och leverenzymer. *** Observerat hos patienter under en studie efter marknadsgodkännandet med 1215 säkerhetsutvärderbara patienter. ****Enstaka fall har rapporterats hos patienter med medulloblastom vid användning efter marknadsintroduktionen (se avsnitt Varningar och försiktighet) ***** Fall av läkemedelsinducerad leverskada har rapporterats hos patienter vid användning efter marknadsintroduktionen. ******Fall av SCAR (inklusive SJS/TEN, DRESS och AGEP) har rapporterats vid användning efter marknadsintroduktionen. |
|||
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Erivedge har administrerats i doser som var 3,6 gånger högre än den rekommenderade dagliga 150 mg-dosen. Inga ökningar i vismodegibs plasmanivåer eller toxicitet har observerats under dessa kliniska studier.
Farmakodynamik
Verkningsmekanism
Vismodegib är en oralt tillgänglig, lågmolekylär hämmare av Hedgehog. Hedgehog signalerar genom det transmembrana proteinet Smoothened (SMO) vilket leder till att transkriptionsfaktorn GLI (”Glioma-Associated Oncogene”) aktiveras och lokaliseras till cellkärnan där den inducerar transkription av Hedgehogs målgener. Många av dessa gener är inblandade i proliferation, överlevnad och differentiering. Vismodegib binder till och hämmar SMO-proteinet och blockerar därigenom Hedgehog signaltransduktion.
Klinisk effekt och säkerhet
Den pivotala studien ERIVANCE BCC (SHH4476g), var en internationell, enarmad, multicenter, 2-kohortstudie. Metastaserat BCC definierades som BCC som hade spritts bortom huden till andra delar av kroppen, inklusive lymfkörtlarna, lungor, ben och/eller inre organ. LaBCC patienter hade kutana lesioner som var olämpliga för kirurgi (inoperabla, multipelt återkommande då kurativ kirurgi inte bedömdes som möjlig eller för dem där kirurgi skulle medföra en betydande deformering eller morbiditet) och för vilka strålning inte fungerat eller var kontraindicerat eller olämpligt. Innan inklusion i studien bekräftades BCC-diagnosen med histologi. Patienter med Gorlin syndrom som hade minst en aBCC-lesion och uppfyllde inklusionskriterierna kunde delta i studien.
Patienter behandlades med orala doser med Erivedge 150 mg dagligen.
Medianåldern på den evaluerbara populationen var 62 år (46 % var minst 65 år gamla), 61 % var män och 100 % vita. För kohorten med mBCC, hade 97 % av patienterna haft tidigare behandling inklusive kirurgi (97 %), strålning (58 %), och systemiska behandlingar (30 %). För kohorten med laBCC (n = 63), hade 94 % av patienterna haft tidigare behandling inklusive kirurgi (89 %), strålning (27 %), och systemisk/topikal behandling (11 %). Mediandurationen på behandlingen var 12,9 månader (intervall 0,7 till 47,8 månader).
Det primära effektmåttet var objektiv responsfrekvens (objective response rate=ORR) och utvärderades av en oberoende utvärderingsgrupp (independent review facility =IRF) som sammanfattas i tabell 2. Objektivt svar definierades som komplett eller partiellt svar fastställt vid två efterföljande utvärderingar med minst 4 veckors mellanrum. I kohorten med mBCC bedömdes tumörsvaret enligt svarsbedömningskriterierna i fasta tumörer (Response Evaluation Criteria in Solid Tumours=RECIST) version 1.0. I kohorten med laBCC bedömdes tumörsvaret baserat på visuell bedömning av extern tumör och ulceration, tumörbild (om lämpligt) och tumörbiopsi. En patient ansågs svara på behandlingen i laBCC-kohorten om minst en av följande kriterier uppnåddes och patienten inte upplevde progression: (1) ≥ 30 % reduktion i lesionsstorlek [summan av den längsta diametern (SLD)], från före behandlingen (baseline) i mållesionen vid strålning; (2) ≥ 30 % reduktion i SLD från före behandlingen (baseline) i externt synlig dimension av mållesionen; (3) Komplett resolution av ulceration i alla mållesioner. Nyckeldata sammanfattas i tabell 2:
|
IRF-bedömd |
Prövar-bedömd |
|||
|---|---|---|---|---|
|
mBCC (n = 33) |
laBCC** (n = 63) |
mBCC (n = 33) |
laBCC** (n = 63) |
|
|
“Responders” 95 % KI för övergripande respons |
11 (33,3 %)
(19,2%,
|
30 (47,6 %)
(35,5 %,
|
16 (48,5 %)
(30,8%,
|
38 (60,3 %)
(47,2 %,
|
|
Komplett respons |
0 |
14 (22,2 %) |
0 |
20 (31,7 %) |
|
Partiell respons |
11 (33,3 %) |
16 (25,4 %) |
16 (48,5 %) |
18 (28,6 %) |
|
Stabil sjukdom |
20 |
22 |
14 |
15 |
|
Progressiv sjukdom ‡ |
1 |
8 |
2 |
6 |
|
Medianduration
|
7,6 |
9,5 |
14,8 |
26,2 |
|
(95% KI) |
(5,5, 9,4) |
(7,4, 21,4) |
(5,6, 17,0) |
(9,0, 37,6) |
|
Median
|
9,5 |
9,5 |
9,3 |
12,9 |
|
(95% KI) |
(7,4, 11,1) |
(7,4, 14,8) |
(7,4, 16,6) |
(10,2, 28,0) |
|
Medianöver-
|
33,4 |
NE |
||
|
(95% KI) |
(18,1, NE) |
(NE, NE) |
||
|
1-års-överlev-
|
78,7% |
93,2% |
||
|
(95% KI) |
(64,7, 92,7) |
(86,8, 99,6) |
||
NE = kan inte fastställas (=not estimable)
* Effekt-utvärderbar patientpopulation definieras som alla patienter som inkluderades som fick någon mängd av Erivedge och för vilka den oberoende patologens tolkning av arkiverad vävnad eller biopsi före behandlingen överensstämde med BCC.
† Ej utvärderbara/saknade data inkluderade 1 mBCC och 4 laBCC patienter.
‡ Progression i laBCC kohort definieras som uppfylla någon av följande kriterier: (1) ≥ 20 % ökning av summan av de längsta dimensionerna (SLD) från nadir i mållesioner (antingen genom röntgen eller genom externt synlig dimension), (2) Ny ulceration av mållesioner kvarstår utan tecken på läkning under minst 2 veckor, (3) Nya lesioner vid röntgen eller fysisk undersökning,
(4) Progression av icke mållesioner enligt RECIST.
**54 % av laBCC- patienterna hade inga histopatologiska tecken på BCC vid 24 veckor.
Som visas i vattenfallgraferna i figur 1 and 2, ses maximal reduktion i storlek av mållesion(er) för varje patient, och majoriteten av patienterna i båda kohorterna upplevde krympande tumör enligt utvärdering av IRF.
Figur 1 SHH4476g Metastaserat BCC-kohort
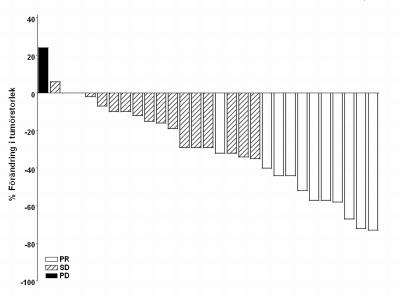
Obs: Tumörstorlek är baserat på summan av de längsta dimensionerna för mållesioner. PD = progressiv sjukdom, SD = stabil sjukdom, PR = partiell respons. 3 patienter hade bästa procentuella förändring i tumörstorlek på 0; dessa representeras av minimala positiva staplar i figuren. Fyra patienter exkluderades från figuren: 3 patienter med stabil sjukdom bedömdes som enbart icke mållesioner och 1 patient var inte utvärderingsbar.
Figur 2 SHH4476g Lokalt avancerat BCC-kohort
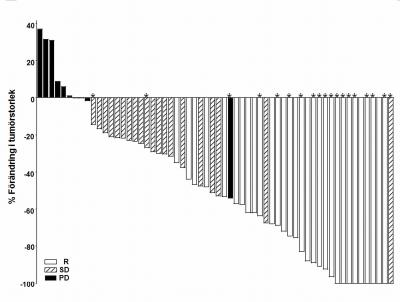
Obs: Tumörstorlek är baserat på summan av de längsta dimensionerna för mållesioner. PD = progressiv sjukdom, SD = stabil sjukdom, PR = partiell respons, * = komplett läkning av ulceration(er). Responsbedömningen var baserad på en kompositeffektparameter som definieras ovan. Fyra patienter hade inga lesionsmätningar och inkluderades inte i grafen.
Tid till maximal tumörreduktion
Bland patienter som uppnådde tumörreduktion, var mediantiden för maximal tumörreduktion 5,6 månader för patienter med laBCC och 5.5 månader för patienter med mBCC baserat på IRF-bedömning. Enligt prövarbedömning var mediantiden för maximal tumörreduktion 6,7 månader för patienter med laBCC och 5.5 månader för patienter med mBCC.
Kardiell elekrofysiologi
I en grundlig QTc-studie hos 60 friska försökspersoner sågs ingen effekt på QTc-intervallet vid terapeutiska doser av Erivedge.
Studieresultat efter marknadsgodkännandet
Efter marknadsgodkännandet gjordes en öppen, icke-jämförande, multicenter, klinisk fas II-studie (MO25616) hos 1232 patienter med avancerat basalcellscarcinom (aBCC), av vilka 1215 patienter var utvärderbara avseende effekt och säkerhet med laBCC (n = 1119) eller mBCC (n = 96). LaBCC definierades som kutan lesion som inte var lämplig för kirurgi (inoperabel, eller för dem där kirurgi skulle leda till en betydande deformitet) och för dem där strålning inte lyckades eller var kontraindicerat. Metastaserat BCC definierades vid förekomst av histologiskt bekräftad fjärrmetastas. Innan studieinklusion bekräftades BCC-diagnosen med histologi. Patienterna behandlades med en oral daglig dos av Erivedge 150 mg. Medianåldern för alla patienter var 72 år. Majoriteten av patienterna var män (57%); 8% hade mBCC medan 92% hade laBCC. För metastas-kohorten hade majoriteten av patienterna fått tidigare behandling, inklusive kirurgi (91%), strålning (62%) och systemisk behandling (16%). För den lokalt avancerade kohorten hade majoriteten av patienterna fått tidigare behandling, inklusive kirurgi (85%), strålning (28%) och systemisk behandling (7%). Behandlingens medianduration för alla patienter var 8,6 månader (intervall 0 till 44,1).
Bland patienterna i den effektutvärderbara populationen med mätbar och histologiskt bekräftad sjukdom svarade 68,5% i gruppen med laBCC och 36,9% i gruppen med mBCC på behandling, enligt RECIST v1.1. Av patienterna som hade ett bekräftat svar (partiellt eller komplett) var mediandurationen av svaret 23,0 månader (95% KI: 20,4, 26,7) i kohorten med laBCC och 13,9 månader (95% KI: 9,2, NE) i kohorten med mBCC. Komplett svar erhölls hos 4,8% av patienterna i mBCC-kohorten och 33,4% i kohorten med laBCC. Partiellt svar erhölls hos 32,1% av patienterna i mBCC-kohorten och 35,1% i kohorten med laBCC.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Erivedge, för alla grupper av den pediatriska populationen med basalcellscarcinom (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Erivedge är en högpermeabel förening med låg löslighet i vatten (BCS Class 2). Den absoluta biotillgänglighetens medelvärde (CV%) för en singeldos Erivedge är 31,8 (14,5) %. Absorptionen är mättnadsbar vilket bevisas av avsaknaden av dosproportionell ökning av exponeringen efter en singeldos av 270 mg och 540 mg Erivedge. Under kliniskt relevanta förhållanden (steady state), är farmakokinetiken för vismodegib inte påverkad av föda. Därför kan Erivedge tas utan hänsyn till måltider.
Distribution
Distributionsvolymen för vismodegib är låg, inom intervallet 16,4 till 26,6 l. In vitro binding av vismodegib till humana plasmaproteiner är hög (97 %) vid kliniskt relavanta koncentrationer. Vismodegib binder både till humant serumalbumin och alfa-1-syraglykoprotein (AAG). In vitro bindning till AAG är mättnadsbar vid kliniskt relevanta koncentrationer. Ex vivo plasmaproteinbindning hos patienter är > 99 %. Vismodegibkoncentrationer är starkt korrelerat till AAG-nivåer, uppvisar parallella fluktuationer av AAG och totalt vismodegib över tid och konsekvent låga obundna vismodegibnivåer.
Metabolism
Vismodegib elimineras långsamt med en kombination av metabolism och exkretion av oförändrat modersubstans. Vismodegib finns främst i plasma, med koncentrationer som motsvarar mer än 98 % av totalt cirkulerande koncentrationer (inklusive tillhörande metaboliter). Metabolismvägarna för vismodegib hos människa inkluderar oxidation, glukuronidering och en ovanlig pyridinringsklyvning. CYP2C9 verkar delvis bidra till metabolismen av vismodegib in vivo.
Eliminering
Efter oral administrering av en radioaktivt märkt dos absorberades vismodegib och eliminerades långsamt via en kombination av metabolism och exkretion av modersubstansen, där majoriteten återfanns i feces (82 % av given dos), med 4,4 % av den administrerade dosen återfunnen i urin. Vismodegib och dess metaboliter elimineras främst via den hepatiska vägen.
Efter kontinuerlig dosering en gång om dagen verkar farmakokinetiken för vismodegib vara ickelinjär- på grund av mättnadsbar absorption och mättnadsbar proteinbindning. Efter en oral singeldos är den terminala halveringstiden för vismodegib cirka 12 dagar.
Den skenbara halveringstiden för vismodegib vid steady state uppskattas vara 4 dagar vid kontinuerlig daglig dosering. Vid kontinuerlig daglig dosering blir det en 3-faldig ackumulering av vismodegibs totala plasmakoncentrationer.
Vismodegib hämmar UGT2B7 in vitro och det kan inte uteslutas att hämning sker in vivo i tarmen.
Särskilda populationer
Äldre
Det finns begränsade data för äldre personer. I kliniska prövningar med aBCC, hade ungefär 40 % av patienterna geriatrisk ålder (≥ 65 år). Populationsfarmakokinetiska analyser tyder på att ålder inte har en kliniskt signifikant påverkan på steady-statekoncentrationen för vismodegib.
Kön
Baserat på populationsfarmakokinetiska analyser av kombinerade data från 121 män och 104 kvinnor förefaller inte kön påverka farmakokinetiken för vismodegib.
Ras
Det finns begränsade data på icke-kaukasiska patienter. Eftersom antalet patienter som inte var kaukasier endast utgjorde < 3 % av den totala populationen (6 svarta, 219 kaukasier) utvärderades inte ras som en covariat i den populationsfarmakokinetiska analysen.
Nedsatt njurfunktion
Renal utsöndring av oralt administrerat vismodegib är låg. Därför är det osannolikt att mild till måttligt nedsatt njurfunktion har en kliniskt signifikant effekt på farmakokinetiken för vismodegib. Baserat på en populationsfarmakokinetisk analys hos patienter med mild (BSA-indexerat kreatininclearance (KrCl) 50 till 80 ml/min, n=58), och måttlig (BSA-indexerat KrCl 30 till 50 ml/min, n=16) njurfunktionsnedsättning, hade mild till måttligt nedsatt njurfunktion ingen kliniskt signifikant effekt på farmakokinetiken för vismodegib (se avsnitt Dosering). Mycket begränsade data finns tillgängligt för patienter med svår njurfunktionsnedsättning.
Nedsatt leverfunktion
De huvudsakliga elimineringsvägarna för vismodegib innefattar hepatisk metabolism och biliär/intestinal sekretion. I en klinisk studie hos patienter med nedsatt leverfunktion (graden av funktionsnedsättning baserades på patientens ASAT och totalbilirubinnivåer) efter upprepade doser av vismodegib, visades att hos patienter med mild (NCI-ODWG kriterier, n=8), måttlig (NCI-ODWG kriterier, n=6), och svår (NCI-ODWG kriterier, n=3) leverfunktionsnedsättning, var den farmakokinetiska profilen av vismodegib jämförbar med den hos personer med normal leverfunktion (n=9) (se avsnitt Dosering).
Pediatriska patienter
Det finns otillräckliga farmakokinetiska data hos pediatriska patienter.
Prekliniska uppgifter
Den prekliniska säkerhetsprofilen för Erivedge har utvärderats i mus, råtta och hund.
Toxikologiska studier med upprepad dosering
I allmänhet var tolerabiliteten för Erivedge vid toxikologiska studier med upprepad dosering hos råtta och hund begränsad av ospecifika toxikologiska manifestationer inkluderande minskad ökning av kropssvikten och konsumtion av föda. Ytterligare fynd vid kliniskt relevant exponering inkluderade fekal förändring; skelettmuskelryckningar eller tremor; alopeci; svullnad; follikulär hyperkeratos, och inflammation i trampdynorna; samt ökat LDL- och HDL-kolesterol. Minskad hematokrit eller antal blodplättar observerades hos vissa hundar vid kliniskt relevanta exponeringar; däremot fanns det inget tecken på en primär effekt på benmärgen för påverkade djur.
Karcinogenicitet
Pilomatrikom Karcinogenicitetsstudier har utförts på mus och råtta.Karcinogen potential har enbart identifierats hos råtta och begränsades till benigna hårfollikeltumörer, inklusive pilomatrikom och keratoakantom vid >10% respektive >60% av AUC (0-24 tim) vid steady state vid rekommenderad human dosering. Inga maligna tumörer identifierades hos något av de testade djurarterna.Godartade hårfollikeltumörer har inte rapporterats i kliniska studier med Erivedge, och relevansen av detta fynd för människa är därför oklart.
Mutagenicitet
Det finns inga tecken på genotoxicitet i in vitro analyser (reverserad bakteriell mutagenes [Ames] och kromosom-avvikelseanalys på humana lymfocyter) eller i in vivo mikrokärntest på benmärgsceller i råtta.
Fertilitet
I den riktade 26-veckors fertilitetsstudien med vismodegib på råttor observerades signifikant ökad absolut vikt av sädesblåsor och minskad absolut vikt av prostata. Dessutom hade förhållandet av organvikt till final kroppsvikt signifikant ökat för epididymis, cauda epididymis, testiklar och sädesblåsor. I samma studie förekom inga histopatologiska fynd i reproduktiva organ hos hanar eller påverkan på effektmått för fertilitet, inklusive procentandel rörliga spermier vid en dos av 100 mg/kg/dag vid slutet av dosering eller återhämtningsfas (motsvarande 1,3-gånger AUC0-24 tim vid steady state för den rekommenderade humana dosen). Dessutom observerades inga effekter på manliga reproduktiva organ hos sexuellt mogna råttor och hundar i de generella toxicitetsstudierna upp till 26 veckor. Ett ökat antal degenererande germinalceller och hypospermi hos sexuellt omogna hundar observerade vid en dos av ≥ 50 mg/kg/dag i den 4-veckors generella toxicitetsstudien. Effekten hade en oklar koppling till vismodegib.
I den riktade 26-veckors fertilitetsstudien med vismodegib på råttor observerades vismodegibrelaterade effekter på reproduktiva organ hos honor vid en dos av 100 mg/kg/dag direkt efter avslutad behandling, inklusive färre implantationer, ökad procentandel preimplantatorisk förlust och ett minskat antal dräktiga honor med livskraftiga embryon. Liknande fynd observerades inte efter en 16-veckors återhämtningsperiod. Inga korrelativa histopatologiska förändringar observerades. Exponeringen hos honråttor vid en dos av 100 mg/kg motsvarar 1,2-gånger AUC0-24 tim vid steady state för den rekommenderade humana dosen. Dessutom observerades ett minskat antal gulkroppar vid en dos av 100 mg/kg/dag i den generella 26-veckors toxicitetsstudien med vismodegib. Effekten var inte upphävd vid slutet av en 8-veckors återhämtningsperiod.
Teratogenicitet
I en embryo-/fosterutvecklingsstudie i vilken dräktiga råttor gavs vismodegib dagligen under organogenesen, passerade vismodegib placentan och var starkt toxiskt för graviditeten. Missbildningar inklusive kranofaciala anomalier, öppen perineum, och avsaknad av och/eller ihopväxta fingrar eller tår, observerades hos foster till moderdjuren vid doser som motsvarade 20 % av den typiska steady-state exponeringen hos patienter och en 100 % incidens av fosterdöd observerades vid högre doser.
Postnatal utveckling
Riktade prekliniska studier för att utvärdera risken för att vismodegib påverkar den postnatala utvecklingen har inte utförts. Däremot har irreversibla förändringar för tandtillväxt samt prematur slutning av epifysplattan observerats i toxikologiska studier på råtta vid kliniskt relevanta exponeringar, och indikerar en risk vid postnatal utveckling.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje hård kapsel innehåller 150 mg vismodegib.
Hjälpämne med känd effekt:
Varje hård kapsel innehåller 71,5 mg laktosmonohydrat.
Förteckning över hjälpämnen
Kapselinnehåll
Mikrokristallin cellulosa
Laktosmonohydrat
Natriumlaurylsulfat
Povidon (K29/32)
Natriumstärkelseglykolat (typ A)
Talk
Magnesiumstearat
Kapselhölje
Svart järnoxid (E172)
Röd järnoxid (E172)
Titandioxid (E171)
Gelatin
Tryckbläck
Shellack
Svart järnoxid (E172)
Blandbarhet
Ej relevant.
Miljöpåverkan
Vismodegib
Miljörisk:
Användning av vismodegib har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Vismodegib är potentiellt persistent.
Bioackumulering:
Vismodegib har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Identification and characterisation
Chemical name: Vismodegib
CAS number: 879085-55-9 [1]
Molecular weight: 421.31 [1]
Brand name: Erivedge [1]
Physico-chemical properties
Aqueous solubility: 0.879 mg/l (20 °C) (OECD 105) [1]
Dissociation constant, pKa: 3.4–3.5 (base) [1]
Melting point: 186–188 °C (OECD 102) [1]
Vapour pressure: ND
Boiling point: ND
KH: 8.87*E–15 atm*m3/mol QSAR
QSAR = QSAR-modelled (EPISuite, SPARC, ACD Solaris)
Predicted Environmental Concentration (PEC)
PEC is calculated according to the formula:
PEC (μg/l) = (A x 1'000'000'000 x (100-R)) / (365 x P x V x D x 100) = 1.37 x 10-6 x A x (100 - R) = 0.00016 μg/l
Where:
A Sold quantity =1.1466000 kg/y sales data from IQVIA / LIF - kg consumption 2021
R Removal rate = 0 % Default [2]
P Population of Sweden = 10 000 000
V Volume of Wastewater = 200 l/day Default [2]
D Factor for Dilution = 10 Default [2]
Predicted No Effect Concentration (PNEC)
Ecotoxicological Studies
Green alga (Raphidocelis subcapitata): [3]
72 h ErC50 (growth rate) = 118 μg/l (OECD 201)
72 h ErC10 (growth rate) = 92 μg/l (OECD 201)
72 h EyC50 (yield) = 99 μg/l (OECD 201)
72 h EyC10 (yield) = 81 μg/l (OECD 201)
Water-flea (Daphnia magna): [4]
21 d NOEC (reproduction) = 1500 μg/l (OECD 211)
Zebra fish (Danio rerio): [5]
35 d NOEC (overall NOEC) = 1600 μg/l (OECD 210)
Micro-organisms (activated sludge):
3 h NOEC = 1000 mg/l (OECD 209) [6]
28 d NOEC (toxicity control) = 54 mg/l (OECD 301 F) [7]
PNEC Derivation
The PNEC is based on the following data:
PNEC (μg/l) = lowest chronic EC10/10, where 10 is the assessment factor used. An EC10 with respect to growth rate inhibition of 92 μg/l for Algae has been used for this calculation.
PNEC = 92 μg/l / 10 = 9.2 μg/l.
Environmental Risk Classification (PEC/PNEC Ratio)
PEC Predicted Environmental Concentration = 0.00016 μg/l
PNEC Predicted No Effect Concentration = 9.20 μg/l
Ratio PEC/PNEC = 0.00002
PEC/PNEC =0.00016/9.20 = 0.00002 for Vismodegib which justifies the phrase 'Use of Vismodegib has been considered to result in insignificant environmental risk.'
Degradation
Biotic Degradation
Ready biodegradability: [7]
0% after 28 days of incubation BOD/ThOD (OECD 301 F)
Other degradation information: [8]
DT50 (water) = 3.3–3.7 d (OECD 308)
DT50 (sediment) >1 y (OECD 308)
DT50 (total system) >1 y (OECD 308)
Vismodegib is not readily biodegradable; it is also not degradable in water/sediment systems. This justifies the phrase 'Vismodegib is potentially persistent.'
Bioaccumulation/Adsorption
logPOW = 1.59 (pH 7, non-dissociated state) (OECD 117) [9]
KOC (soils) = 2129–5001 l/kg (OECD 106) [10]
KOC (sludges) = 684–895 l/kg (OECD 106) [10]
BCF = 54 l/kg QSAR
Vismodegib has low potential for bioaccumulation since the log POW is <4.
Excretion/metabolism
The metabolism of vismodegib was investigated in both in vitro and in vivo investigations. The major metabolic pathways involved oxidations of the 4-chloro-3 (pyridine-2-yl)-phenyl moiety followed by sequential glucuronidation or sulfation. In mass balance studies in rat and dog, drug derived radioactivity was recovered largely in feces followed by bile. [11]
References
1. F. Hoffmann-La Roche Ltd (2021): Environmental Risk Assessment Summary for Vismodegib. https://www.roche.com/sustainability/environment/environmental-risk-assessment-downloads.htm.
2. European Medicines Agency (EMA) (2006/2015): Guideline on the environmental risk assessment of medicinal products for human use. European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP), 01 June 2006, EMA/CHMP/SWP/447/00 corr 2.
3. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). RO5450815-000: Toxicity to Pseudokirchneriella subcapitata in a 72-Hour Algal Growth Inhibition Test. Harlan study no. D09861.
4. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). RO5450815-000: Effect on Survival and Reproduction of Daphnia magna in a Semi-Static Test over Three Weeks. Harlan study no. D096631.
5. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). RO5450815-000: Toxic Effects to Zebrafish (Brachydanio rerio ) in an Early-Life Stage Toxicity Test. Harlan study no. C96642.
6. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2010). RO5450815-000: Toxicity to Activated Sludge in a Respiration Inhibition Test. Harlan study no. C96653.
7. BMG Engineering Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2010). PAS-RO5450815-000. Ready biodegradability – Evaluation of the aerobic biodegradability in an aqueous medium: Manometric Respirometry Test. BMG study no. A09–01583.
8. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). [14C]-RO5450815-000: Route and Rate of Degradation in Aerobic Aquatic Sediment Systems. Harlan study no. C96620.
9. BMG Engineering Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2010). PAS-RO5450815-000. Determination of the partition coefficient between octanol and water (logPow) by high-performance liquid chromatography (HPLC). BMG study no. A09–01587.
10. Harlan Laboratories, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). [14C]-RO5450815-000: Adsorption/Desorption on Three Soils and Two Sludges. Harlan study no. C96618.
11. European Medicines Agency (EMA). Committee for Medicinal Products for Human Use (CHMP). Assessment report for Erivedge. EMA/297688/2013, 25 April 2013.
Hållbarhet, förvaring och hantering
Hållbarhet
4 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Tillslut burken väl. Fuktkänsligt.
Särskilda anvisningar för destruktion
Ej använt läkemedel ska efter behandlingens slut omedelbart kasseras av patienten enligt lokala regler (om tillämpligt, t ex återlämna kapslarna till apotekspersonal eller läkare).
Egenskaper hos läkemedelsformen
Hård kapsel (kapsel).
Rosafärgad ogenomskinlig underdel märkt ”150 mg” och grå ogenomskinlig överdel märkt ”VISMO” med svart bläck.
Kapselstorleken är ‘storlek 1’ (dimensioner 19,0 x 6,6 mm).





