Indikationer
Antikonception
Vid beslut att förskriva Yasminelle ska den enskilda kvinnans riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), och risken för VTE med Yasminelle jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet).
Kontraindikationer
Kombinerade hormonella preventivmedel bör inte användas vid följande tillstånd. Om något av dessa tillstånd uppstår för första gången under användningen av kombinerade hormonella preventivmedel, bör behandlingen upphöra omgående.
-
Förekomst av eller risk för venös tromboembolism (VTE)
-
Venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på (t.ex. djup ventrombos [DVT] eller lungemboli [PE])
-
Känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC-resistens (inklusive Faktor-V-Leiden), antitrombin-III-brist, protein C-brist, protein S-brist
-
Större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet)
-
Hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet)
-
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
-
Arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
-
Cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
-
Känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupus antikoagulant)
-
Migrän med fokala neurologiska symtom i anamnesen
-
Hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
-
diabetes mellitus med vaskulära symtom
-
allvarlig hypertoni
-
allvarlig dyslipoproteinemi
-
-
-
Pågående eller tidigare allvarlig leversjukdom, så länge leverfunktionsvärdena inte återgått till de normala
-
Allvarlig njurinsufficiens eller akut njursvikt
-
Pågående eller tidigare levertumör (godartad eller malign)
-
Känt eller misstänkt malignt tillstånd i genitalier eller bröst, om detta är könshormonberoende
-
Odiagnostiserad vaginalblödning
-
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Innehåll.
Yasminelle är kontraindicerat vid samtidig behandling med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, läkemedel som innehåller glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Interaktioner).
Dosering
Administreringssätt
Oral användning
Dosering
Hur används Yasminelle?
Tabletterna bör tas vid ungefär samma tid varje dag, om nödvändigt tillsammans med lite vätska, och fortlöpande i den ordning som visas på blisterförpackningen. En tablett tas dagligen i 21 dagar. Varje nästkommande förpackning påbörjas efter sju dagars tablettuppehåll, under vilket en bortfallsblödning vanligtvis inträffar. Den börjar vanligen på dag 2-3 efter den sista tabletten och har i vissa fall inte upphört innan nästa blisterförpackning påbörjas.
Hur man börjar ta Yasminelle
-
Om inte något hormonellt preventivmedel använts under den senaste månaden
Tablettintaget skall påbörjas på dag 1 i kvinnans naturliga menstruationscykel (d.v.s. den första blödningsdagen).
-
Vid byte från ett kombinerat hormonellt preventivmedel (kombinerat oralt preventivmedel, vaginalring eller transdermalt plåster)
Kvinnan bör helst påbörja intaget av Yasminelle dagen efter den sista aktiva tabletten (den sista tabletten som innehåller aktiv substans) med det tidigare p-pillret, men senast dagen efter den tablettfria perioden alternativt efter perioden med placebotabletter av det tidigare p-pillret. Om en vaginalring eller ett transdermalt plåster har använts bör kvinnan helst påbörja intaget av Yasminelle samma dag som ringen eller plåstret tas bort, och allra senast när nästa behandling/applicering skulle ha inletts.
-
Vid byte från metod med enbart gestagen (minipiller, injektion, implantat) eller ett gestagenutsöndrande intrauterint system (IUS)
Det går att byta när som helst från minipiller (från ett implantat eller spiral på dagen för dess avlägsnande, från ett injicerbart preventivmedel vid tidpunkten för nästa injektion), men kvinnan bör rådas att i dessa fall använda barriärmetod de första 7 dagarna av tablettintag.
-
Efter abort i första trimestern
Intaget kan påbörjas med det samma. I detta fall behövs inget ytterligare skydd.
-
Efter förlossning eller abort i andra trimestern
Kvinnan bör rådas att påbörja behandlingen mellan dag 21 och 28 efter förlossningen eller aborten i andra trimestern. Om hon börjar intaget senare bör hon rådas att dessutom använda en barriärmetod under de första sju dagarna. Har samlag redan ägt rum bör graviditet uteslutas innan p-pilleranvändningen påbörjas eller så måste kvinnan invänta sin första mens.
För ammande kvinnor, se avsnitt Graviditet.
Om man har glömt att ta tabletter
Om det har gått högst 12 timmar sedan tabletten skulle ha tagits är det preventiva skyddet inte nedsatt. Tabletten bör tas så snart som möjligt och nästa tablett tas sedan vid ordinarie tidpunkt.
Om det har gått mer än 12 timmar sedan tabletten skulle ha tagits, kan den preventiva säkerheten vara nedsatt. Följande två grundregler gäller vid glömd tablett:
-
tablettuppehållet får aldrig överskrida 7 dagar
-
7 dagars oavbrutet tablettintag krävs för att uppnå tillräcklig hämning av hypotalamus-hypofys-ovarie axeln.
I enlighet med detta kan följande råd användas i allmän praxis:
-
Vecka 1
Den senast glömda tabletten skall tas så snart som kvinnan kommer ihåg, även om detta innebär att hon tar två tabletter vid samma tillfälle. Därefter fortsätter hon att ta tabletterna på ordinarie tidpunkt. En barriärmetod som kondom bör användas de närmaste sju dagarna. Har samlag ägt rum under de föregående sju dagarna, bör möjligheten av en graviditet övervägas. Ju fler glömda tabletter och ju närmare de är tablettuppehållet, desto större är risken för graviditet. -
Vecka 2
Den senast glömda tabletten skall tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna på ordinarie tidpunkt. Under förutsättning att tabletterna tagits vid rätt tidpunkt de föregående sju dagarna, behövs inget ytterligare skydd. Om mer än 1 tablett är glömd bör kompletterande skydd användas under sju dagar. -
Vecka 3
Risken för minskad tillförlitlighet är överhängande med tanke på det kommande 7-dagars tablettuppehållet. Genom att justera schemat för tablettintaget, går det emellertid att förhindra att skyddseffekten minskar. Följer man något av följande två alternativ behövs därför inget extra skydd, under förutsättning att alla tabletterna togs på rätt tid under de sju dagarna precis innan den första glömda tabletten. Om så inte är fallet, bör det första alternativet följas och extra skydd bör användas även under de kommande sju dagarna.
-
Den senast glömda tabletten bör tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tidpunkt. Därefter tas tabletterna på ordinarie tidpunkt. Nästa blisterförpackning måste påbörjas så snart den pågående förpackningen har tagit slut, d.v.s. inget tablettuppehåll görs mellan förpackningarna. Kvinnan kommer troligtvis inte få någon bortfallsblödning förrän den andra förpackningen är slut, men spotting eller genombrottsblödning kan uppträda under dagar då tabletter tas.
-
Kvinnan kan också rådas att avbryta tablettintaget från den aktuella blisterkartan. Därefter skall hon göra ett uppehåll på upp till sju dagar, inklusive de dagar hon glömt tabletter, och därefter fortsätta med nästa förpackning.
Vid glömda tabletter och vid utebliven bortfallsblödning under det första normala tablettuppehållet, bör möjligheten för graviditet beaktas.
Råd vid gastrointestinala sjukdomstillstånd
Vid kraftiga gastrointestinala störningar (t.ex. kräkningar eller diarré) kan absorptionen vara ofullständig och ytterligare preventiva åtgärder bör vidtas. Vid kräkningar inom 3-4 timmar efter tablettintaget, skall en ny tablett (ersättningstablett) tas så snart som möjligt. Den nya tabletten skall om möjligt tas inom 12 timmar från den vanliga tiden för tablettintag. Om mer än 12 timmar passerat gäller de råd vid glömda tabletter som ges i avsnitt ”Om man har glömt att ta tabletter”. Om kvinnan inte vill ändra sitt normala schema för intag av tabletter, måste de extra tabletterna tas från en annan blisterkarta.
Att förskjuta menstruationen
För att förskjuta menstruationen bör kvinnan fortsätta med nästa blisterkarta Yasminelle utan att göra något tablettuppehåll. Förskjutningen kan pågå fram till att den andra förpackningen är slut. Under förskjutningen kan genombrottsblödning eller spotting uppträda. Normalt intag av Yasminelle återupptas sedan efter det vanliga uppehållet på sju dagar.
För att ändra blödningsdag till en annan veckodag än den vanliga, kan den kommande tablettfria perioden förkortas med önskat antal dagar. Ju kortare uppehåll, desto större risk att bortfallsblödningen uteblir och att kvinnan får en genombrottsblödning och spotting under intag från efterföljande karta (på samma sätt som vid förskjutning av menstruationen).
Ytterligare information om särskilda patientgrupper
Pediatrisk population
Yasminelle är endast indicerat efter menarke.
Äldre
Yasminelle är inte indicerat efter menopaus.
Patienter med nedsatt leverfunktion
Yasminelle är kontraindicerad hos kvinnor med allvarlig leversjukdom, se även avsnitt Kontraindikationer och Farmakokinetik.
Patienter med nedsatt njurfunktion
Yasminelle är kontraindicerad hos kvinnor med kraftigt nedsatt njurfunktion eller akut njursvikt, se även avsnitt Kontraindikationer och Farmakokinetik.
Varningar och försiktighet
Varningar
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Yasminelle diskuteras med kvinnan.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången, ska kvinnan ta kontakt med sin läkare/barnmorska. Läkare/barnmorska ska då besluta om användningen ska avbrytas.
Vid misstänkt eller bekräftad VTE eller ATE ska användning av hormonella preventivmedel avbrytas. Om behandling med antikoagulantia påbörjas ska lämpligt alternativt preventivmedel användas pga teratogenicitet vid behandling med antikoagulantia (kumariner).
-
Cirkulationsrubbningar
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke-användning. Produkter som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Andra produkter som t.ex. Yasminelle kan ha en risk som är dubbelt så stor. Beslutet att använda en annan produkt än den med den lägsta risken för VTE ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Yasminelle, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE-risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
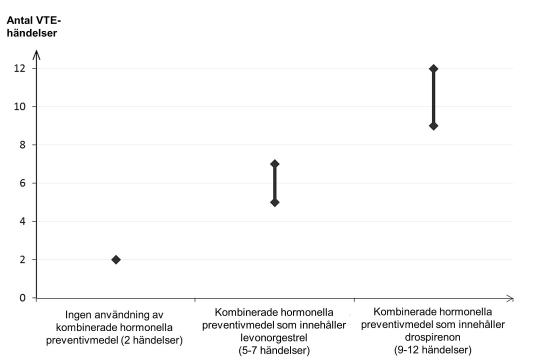
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Man uppskattar1 att av 10 000 kvinnor som använder kombinerade hormonella preventivmedel innehållande drospirenon kommer mellan 9 och 12 kvinnor att utveckla en VTE under ett år; detta kan jämföras med cirka 6 kvinnor2 som använder kombinerade hormonella preventivmedel som innehåller levonorgestrel.
1Dessa förekomster uppskattades från samtliga epidemiologiska studiedata med hjälp av relativa risker för de olika produkterna jämfört med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
2Genomsnittsintervallet är på 5–7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en icke-användning på cirka 2,3 till 3,6
I båda fallen är antalet VTE-händelser per år färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE kan vara dödligt i 1–2 % av fallen.
Antal VTE-händelser per 10 000 kvinnor under ett år
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Yasminelle är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
|
Riskfaktor |
Kommentar |
|---|---|
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
|
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada Anm: tillfällig immobilisering inklusive flygresor >4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer |
I dessa situationer är det lämpligt att göra ett uppehåll i användningen av p-pillret (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. Antitrombotisk behandling bör övervägas om Yasminelle inte har satts ut i förväg. |
|
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Andra medicinska tillstånd som förknippas med VTE |
Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecell-sjukdom. |
|
Stigande ålder |
Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6-veckorsperioden i puerperiet måste beaktas (för information om ”Graviditet och amning” se avsnitt Graviditet: se även grafen för risk för VTE).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
-
unilateral svullnad av ben och/eller fot eller längs en ven i benet
-
smärta eller ömhet i benet som bara känns vid stående eller gående
-
ökade värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
-
plötslig debut av oförklarlig andfåddhet eller snabb andning
-
plötslig hosta som kan förknippas med hemoptys
-
kraftig bröstsmärta
-
kraftig ostadighetskänsla eller yrsel
-
snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andfåddhet och hosta) är icke-specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har också visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Yasminelle är kontrainidcerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
|
Riskfaktor |
Kommentar |
|---|---|
|
Stigande ålder |
Framför allt hos kvinnor över 35 år |
|
Rökning |
Kvinnor över 35 år bör starkt rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
|
Hypertoni | |
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
|
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Migrän |
En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
|
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser |
Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
-
plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
-
plötsliga problem med att gå, yrsel, förlorad balans eller koordination
-
plötslig förvirring, svårigheter att tala eller förstå
-
plötsliga synproblem i ett eller båda ögonen
-
plötslig, svår eller långvarig huvudvärk utan känd orsak
-
medvetslöshet eller svimning med eller utan anfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
-
smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
-
obehag som strålar mot ryggen, käken, halsen, armen, magen
-
mättnadskänsla, matsmältningsbesvär eller kvävning
-
svettning, illamående, kräkningar eller yrsel
-
extrem svaghet, ångest eller andfåddhet
-
snabba eller oregelbundna hjärtslag.
-
Tumörer
En ökad risk för cervixcancer hos kvinnor som använt kombinerade p-piller under lång tid (>5 år) har rapporterats i vissa epidemiologiska studier, men fortsatt oenighet råder om i vilken omfattning detta kan vara resultat av ett sexuellt beteende och andra faktorer såsom humant papillomavirus (HPV).
En metaanalys från 54 epidemiologiska studier visade på en något ökad relativ risk (RR = 1,24) att få bröstcancer diagnostiserad hos kvinnor som använder kombinerade p-piller. Den ökade risken försvinner gradvis under loppet av tio år efter avslutad användning. Eftersom bröstcancer är ovanligt hos kvinnor under 40 års ålder är den ökade risken för bröstcancerdiagnos hos användare och före detta användare av kombinerade p-piller liten i jämförelse med den generella risken för bröstcancer. Dessa studier visar inte på något kausalt samband. Det observerade mönstret för ökad risk kan bero på att bröstcancer diagnostiseras tidigare hos kvinnor som använder kombinerade p-piller, de biologiska effekterna av kombinerade p-piller eller av en kombination av dessa. Bröstcancer som diagnostiseras hos de som någon gång använt p-piller tenderar att vara mindre kliniskt avancerade jämfört med cancer hos de som aldrig använt p-piller.
I sällsynta fall har godartade levertumörer, och ännu mer sällan, maligna levertumörer rapporterats hos användare av kombinerade p-piller. I enstaka fall har dessa tumörer lett till livshotande intra-abdominella blödningar. Levertumör bör övervägas som differentialdiagnos när svår smärta i övre delen av buken, leverförstoring eller tecken på intra-abdominell blödning uppträder hos kvinnor som använder kombinerade p-piller.
Användning av högdoserade kombinerade p-piller (50 µg etinylestradiol) minskar risken för endometrie- och ovariecancer. Om detta även gäller för lågdoserade kombinerade p-piller är ännu inte bekräftat.
-
Övriga tillstånd
Den gestagena komponenten i Yasminelle är en aldosteronantagonist med kaliumsparande effekt. I de flesta fall förväntas ingen ökning av kaliumnivåerna. I en klinisk studie sågs dock en liten men inte signifikant ökning av serumkaliumnivåerna under behandling med drospirenon, hos patienter med lätt eller måttlig njurfunktionsnedsättning och samtidig användning av kaliumsparande läkemedel. Kontroll av serumkalium rekommenderas därför under den första behandlingscykeln hos patienter med njurinsufficiens och där serumkalium före behandling ligger i övre delen av referensområdet, särskilt vid samtidig användning av kaliumsparande läkemedel. Se även avsnitt Interaktioner.
Kvinnor med hypertriglyceridemi eller sådan i familjeanamnesen kan ha en förhöjd risk för pankreatit vid användning av kombinerade p-piller.
Även om små höjningar av blodtrycket har rapporterats hos många kvinnor som använder kombinerade p-piller, är kliniskt relevanta höjningar sällsynta. Endast i dessa sällsynta fall finns skäl för att omedelbart avbryta användningen av kombinerade p-piller. Stiger blodtrycksvärden konstant eller en kliniskt signifikant blodtrycksökning inte svarar tillräckligt på blodtryckssänkande behandling hos kvinnor som redan har hypertoni, måste det kombinerade p-pillret sättas ut. När så anses lämpligt kan användningen av ett kombinerat p-piller återupptas om normala blodtrycksvärden uppnås med blodtryckssänkande terapi.
Följande tillstånd har rapporterats förekomma eller förvärras både i samband med graviditet och användning av kombinerade p-piller, men det finns inte övertygande bevis för ett samband med användning av kombinerade p-piller: gulsot och/eller klåda relaterad till kolestas, gallsten, porfyri, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, Sydenhams korea, herpes gestationis, otosklerosrelaterad hörselnedsättning.
Exogena östrogener kan inducera eller förvärra symtom av ärftligt och förvärvat angioödem.
Akuta eller kroniska störningar av leverfunktionen kan göra det nödvändigt att sätta ut behandlingen av kombinerade p-piller tills värdena för leverfunktionen återgår till de normala. Recidiv av kolestatisk gulsot och/eller kolestasrelaterad klåda som tidigare uppträtt under en graviditet eller under tidigare användning av könshormoner gör det nödvändigt att avbryta användningen av kombinerade p-piller.
Även om kombinerade p-piller kan påverka den perifera insulinresistensen och glukostoleransen, finns det inga bevis för att det är nödvändigt att ändra doseringen hos diabetiker som använder kombinerade p-piller (innehållende < 0,05 mg etinylestradiol). Kvinnor som har diabetes bör dock stå under noggrann läkarkontroll, speciellt under den första tiden med kombinerade p-piller.
Försämring av epilepsi, Crohns sjukdom samt ulcerös kolit har rapporterats under användning av kombinerade p-piller.
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Ibland kan kloasma förekomma, särskilt hos kvinnor som haft kloasma under tidigare graviditet. Kvinnor med benägenhet för kloasma bör undvika solexponering eller exponering för ultraviolett ljus under användning av kombinerade p-piller.
Detta läkemedel innehåller 46 mg laktos per tablett. Patienter med sällsynta ärftliga sjukdomar som galaktosintolerans, total laktasbrist eller glukos-galaktos malabsorption och som går på en laktosfri diet bör ta hänsyn till denna laktosmängd.
Läkarundersökning/konsultation
Innan användning av Yasminelle påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserad på kontraindikationerna (se avsnitt Kontraindikationer) och varningar (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Yasminelle jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv- infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Minskad effekt
Säkerheten hos kombinerade p-piller kan försämras t.ex. vid glömd tablett (se avsnitt Dosering) vid gastrointestinal störning (se avsnitt Dosering) eller vid samtidig användning av andra läkemedel (se avsnitt Interaktioner).
Försämrad cykelkontroll
Oregelbundna blödningar (spotting eller genombrottsblödning) kan förekomma med alla kombinerade p-piller, särskilt under de första månadernas användning och en tillvänjningsperiod på ca tre cykler behövs innan en utvärdering kan göras.
Kvarstår de oregelbundna blödningarna eller om de uppträder efter tidigare regelbundna cykler, bör icke-hormonella orsaker övervägas och malignitet eller graviditet uteslutas. Abrasio kan också bli aktuellt.
Hos vissa kvinnor kan bortfallsblödningen utebli under tablettuppehållet. Om p-pillret har tagits enligt anvisningarna i avsnitt Dosering, är kvinnan sannolikt inte gravid. Har p-pillret däremot inte tagits enligt anvisningarna före den första uteblivna bortfallsblödningen eller om två bortfallsblödningar uteblivit, måste graviditet uteslutas innan kvinnan fortsätter använda kombinerade p-piller.
Interaktioner
Observera: Produktresumé för andra, samtidigt använda, läkemedel, bör konsulteras för att identifiera potentiella interaktioner.
-
Andra läkemedels effekt på Yasminelle
Interaktioner kan förekomma med läkemedel som inducerar mikrosomala enzymer vilket kan resultera i ökad clearance av könshormoner och det kan leda till genombrottsblödningar och/eller utebliven preventiv effekt.
Hantering
Enzyminduktion kan observeras efter några dagars behandling. Maximal enzyminduktion observeras i allmänhet inom några veckor. Efter avslutad behandling kan enzyminduktionen kvarstå i ca 4 veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel bör temporärt använda en barriärmetod eller annan preventivmetod förutom det kombinerade p-pillret. Barriärmetoden måste användas under pågående läkemedelsbehandling och i 28 dagar efter avslutad behandling. Om samtidigt intag av annat läkemedel fortsätter efter det att de aktiva tabletterna i blisterkartan med p-piller tagit slut, måste nästa p-pillerkarta påbörjas omedelbart och den normalt tablettfria perioden hoppas över.
Långtidsbehandling
Till kvinnor som står på långtidsbehandling med leverenzyminducerande läkemedel rekommenderas en annan pålitlig icke-hormonell preventivmetod.
Följande interaktioner har rapporterats i litteraturen.
Ämnen som ökar clearance av kombinerade p-piller (minskar effekten av kombinerade p-piller genom enzyminduktion), t.ex.:
Barbiturater, bosentan, karbamazepin, fenytoin, primidon, rifampicin och HIV-läkemedel ritonavir, nevirapin och efavirenz och troligen även felbamat, griseofulvin, oxkarbazepin, topiramat och produkter som innehåller extrakt av Johannesört (Hypericum perforatum).
Ämnen med varierande effekt på kombinerade p-pillers clearance:
När kombinerade p-piller administreras samtidigt som många kombinationer av HIV-proteashämmare och icke-nukleosida hämmare av omvänt transkriptas, inklusive kombinationer av HCV-hämmare kan plasmakoncentrationen av östrogen eller gestagener öka eller minska. Nettoeffekten av dessa förändringar kan vara kliniskt relevant i vissa fall.
Därför bör förskrivarinformationen för samtidigt administrerade HIV/HCV-läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella tillhörande rekommendationer. I tveksamma fall bör tillägg av en barriärmetod användas av kvinnor som behandlas med proteashämmare eller icke-nukleosida hämmare av omvänt transkriptas.
Substanser som minskar clearance av kombinerade p-piller (enzymhämmare):
Den kliniska relevansen av potentiella interaktioner med enzymhämmare är okänd. Samtidig administrering av starka CYP3A4-hämmare kan öka plasmakoncentrationer av östrogen eller progestin, eller båda.
En multipel dosstudie med drospirenon (3 mg/dag) och etinylestradiol (0,02 mg/dag) visar att samtidig administration av den starka CYP3A4-hämmaren ketokonazol i 10 dagar ökar AUC (0-24 h) av drospirenon och etinylestradiol 2,7 gånger respektive 1,4 gånger.
När doser med etoricoxib 60-120 mg/dag tas samtidigt med ett kombinationspreparat som innehåller 35 mikrogram etinylestradiol ökar plasmakoncentrationen av etinylestradiol 1,4-1,6 gånger.
-
Yasminelles effekt på andra läkemedel
Kombinerade p-piller kan påverka metabolismen av vissa andra aktiva substanser. Följaktligen kan koncentrationen i plasma och vävnad antingen öka (t.ex. ciklosporin) eller minska (t.ex. lamotrigin).
Baserat på interaktionsstudier in vivo på kvinnliga försökspersoner där omeprazol, simvastatin eller midazolam användes som markör, uppvisar den kliniskt relevanta interaktionen av drospirenon i doser om 3 mg ringa benägenhet att interagera med den cytokrom P450-medierade metabolismen av andra aktiva substanser.
Kliniska data visar att etinylestradiol hämmar clearance av CYP1A2-substrat vilket ger en svag (t.ex teofyllin) till måttlig (t.ex tizanidin) ökning i plasmakoncentrationen för dessa.
-
Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt Kontraindikationer).
Därför måste patienter som behandlas med Yasminelle byta till ett alternativt preventivmedel (t.ex. endast gestagen-innehållande preventivmedel eller icke hormonella metoder) innan dessa kombinationsbehandlingar påbörjas. Yasminelle kan påbörjas igen 2 veckor efter att dessa kombinationsbehandlingar avslutats.
Hos patienter utan njurinsufficiens visade ett samtidigt intag av drosperinon och ACE-hämmare eller NSAID preparat ingen signifikant effekt på serumkalium. Samtidig användning av Yasminelle och aldosteronantagonister eller kaliumsparande diuretika är dock ej undersökt. I detta fall bör serumkalium testas under första behandlingscykeln. Se även avsnitt Varningar och försiktighet.
-
Övriga former av interaktioner
Laboratorietester
Användningen av steroider för antikonception kan påverka resultaten av vissa laboratorietest, inklusive biokemiska parametrar för lever-, sköldkörtel-, binjure- och njurfunktioner, plasmanivåer för (bärar-) proteiner, till exempel kortikosteroidbindande globulin och lipid-lipoprotein-fraktioner, parametrar för kolhydratmetabolism och parametrar för koagulation och fibrinolys. Förändringarna ligger vanligtvis inom normala laboratorievärden. Genom sin svagt anti-mineralkortikoida aktivitet medför drospirenon en ökad aktivitet hos plasma-renin och plasmaaldosteron.
Graviditet
Yasminelle skall inte användas under graviditet.
Om graviditet inträffar under användning av Yasminelle skall behandlingen omedelbart avslutas. Omfattande epidemiologiska studier har inte visat på en förhöjd risk för medfödda missbildningar hos barn födda av kvinnor som använde kombinerade p-piller före graviditet, eller på fosterskadande effekter när kombinerade p-piller oavsiktligt användes under graviditeten.
Djurstudier har visat biverkningar under graviditet och amning (se avsnitt Prekliniska uppgifter.). Baserat på data från djurstudier kan biverkningar på grund av hormonell verkan av de aktiva substanserna inte uteslutas. Risken för biverkningar för människa bedöms som liten grundat på erfarenhet av användning av kombinerade p-piller under graviditet.
Tillgängliga data från användning av Yasminelle under graviditet är för begränsade för att några slutsatser skall kunna göras avseende eventuellt negativa effekter av Yasminelle på graviditet eller på fostrets eller den nyföddas hälsa. Tillförlitliga epidemiologiska data från behandling av gravida kvinnor med Yasminelle saknas hittills.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Yasminelle (se avsnitt Dosering och Varningar och försiktighet).
Amning
Amningen kan påverkas av kombinerade p-piller eftersom dessa kan reducera mängden och ändra sammansättningen på mjölken. Därför bör användning av kombinerade p-piller vanligtvis inte rekommenderas förrän kvinnan slutat amma. Små mängder av hormonerna och/eller deras metaboliter kan utsöndras i bröstmjölken vid användning av kombinerade p-piller. Dessa mängder kan påverka barnet.
Trafik
Inga studier har gjorts där påverkan på förmågan att framföra fordon och använda maskiner studerats. Inga effekter på förmågan att köra och använda maskiner har observerats hos användare av kombinerade p-piller.
Biverkningar
För allvarliga biverkningar hos användare av kombinerade hormonella preventivmedel, se även avsnitt Varningar och försiktighet.
Följande biverkningar har rapporterats vid användning av Yasminelle:
|
Klassificering av organsystem (MedDRA) |
Biverkningsfrekvens |
|||
|---|---|---|---|---|
|
Vanliga ≥ 1/100, <1/10 |
Mindre vanliga ≥ 1/1 000, < 1/100 |
Sällsynta ≥ 1/10 000, <1/1 000 |
Ingen känd frekvens |
|
|
Infektioner och infestationer |
Candidiasis Herpes simplex | |||
|
Immunsystemet |
Allergiska reaktioner |
Astma |
Förvärring av symtom på ärftligt och förvärvat angioödem |
|
|
Metabolism och nutrition |
Ökad aptit | |||
|
Psykiska störningar |
Emotionell instabilitet |
Depression Nervositet Sömnrubbningar | ||
|
Centrala och perifera nervsystemet |
Huvudvärk |
Parestesier Vertigo | ||
|
Öron och balansorgan |
Hypakusi | |||
|
Ögon |
Synrubbningar | |||
|
Hjärtat |
Extraslag Takykardi | |||
|
Blodkärl |
Lungemboli Hypertension Hypotension Migrän Åderbråck |
Venös tromboembolism (VTE) Arteriell tromboembolism (ATE) | ||
|
Andningsvägar, bröstkorg och mediastinum |
Faryngit | |||
|
Magtarmkanalen |
Buksmärta |
Illamående Kräkning Gastroenterit Diarré Förstoppning Gastrointestinala besvär | ||
|
Hud och subkutan vävnad |
Acne |
Alopeci Eksem Klåda Utslag Torr hud Seborré Hudåkommor |
Erytema nodosum Erytema multiforme | |
|
Muskuloskeletala systemet och bindväv |
Nacksmärta Smärta i extremiteter Muskelkramper | |||
|
Njurar och urinvägar |
Cystit | |||
|
Reproduktionsorgan och bröstkörtel |
Smärta i brösten Bröstförstoring Ömma bröst Dysmenoré Metrorragi |
Brösttumörer Bröstcystor Galaktorré Ovarialcystor Blodvallning Menstruella besvär Amenorré Menorragi Vaginal candidiasis Vaginit Vaginal flytning Vulvovaginala besvär Vaginal torrhet Bäckensmärta Misstänkta vaginalutstryk Minskad libido | ||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Ödem Asteni Smärta Svår törst Ökad svettning | |||
|
Undersökningar |
Viktökning |
Viktminskning | ||
|
Den lämpligaste MedDRA termen används för att beskriva en viss biverkning och dess synonymer och relaterade tillstånd. | ||||
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Följande biverkningar har rapporterats hos användare av kombinerade p-piller, se text under avsnitt Varningar och försiktighet Varningar och försiktighetsmått:
-
venösa tromboemboliska sjukdomar
-
arteriella tromboemboliska sjukdomar
-
högt blodtryck
-
levertumörer
-
förekomst eller försämring av tillstånd där ett samband med användning av kombinerade p-piller inte är säkerställt: Crohns sjukdom, ulcerös kolit, epilepsi, uterint myom, porfyri, systemisk lupus erythematosus, herpes gestationis, Sydenhams chorea, hemolytisk uremiskt syndrom, kolestasisk gulsot
-
kloasma
-
akut eller kroniskt nedsatt leverfunktion kan göra det nödvändigt att avbryta behandlingen med kombinerade p-piller tills värdena i leverfunktionstester åter är normala.
Frekvensen av diagnosticerad bröstcancer är något ökad bland användare av kombinerade p-piller. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år är denna ökning av antalet fall liten jämfört med den totala risken att drabbas av bröstcancer. Sambandet med användning av kombinerade p-piller är okänt. För ytterligare information, se avsnitten Kontraindikationer samt 4.4.
Interaktioner
Genombrottsblödning och/eller utebliven preventiv effekt kan bero på interaktioner av andra läkemedel (enzyminducerare) med p-piller (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns hittills inga erfarenheter från överdosering med Yasminelle. Baserat på allmänna erfarenheter av orala kombinations p-piller, är de symtom som kan tänkas uppträda i detta fall illamående, kräkningar samt bortfallsblödning. Bortfallsblödning kan även ske hos flickor före den första menstruationen, om de av misstag tagit läkemedlet. Det finns ingen antidot och behandling bör vara symtomatisk.
Farmakodynamik
Pearl-index för metodmisslyckande: 0,11 (övre tvåsidig 95% konfidensgräns: 0,60)
Övergripande pearl-index (metodmisslyckande + patientmisslyckande): 0,31 (övre tvåsidig 95% konfidensgräns: 0,91)
Den preventiva effekten av Yasminelle baseras på ett samspel av olika faktorer, av vilka de viktigaste är ovalutionshämning och förändringarna i endometriet.
Yasminelle är ett oralt kombinerat preventivmedel innehållande etinylestradiol och gestagenet drospirenon. Vid terapeutisk dosering har drospirenon också antiandrogena och svagt anti-mineralkortikoida egenskaper, men inga östrogena, glukokortikoida eller antiglukokortikoida egenskaper. Detta ger drospirenon en farmakologisk profil som i mycket liknar det naturliga hormonet progesteron.
Resultat från kliniska studier tyder på att Yasminelle har en svagt antimineralkortikoid effekt.
Farmakokinetik
Drospirenon
Absorption
Drospirenon som administreras oralt absorberas snabbt och nästan fullständigt. Efter en engångsdos uppnås maximala serumnivåer av den aktiva substansen på ca 38 ng/ml inom 1-2 timmar efter intag. Biotillgängligheten är mellan 76 och 85%. Biotillgängligheten av drospirenon påverkas ej av samtidigt födointag.
Distribution
Efter oral tillförsel minskar drospirenonnivåerna i serum med en slutlig halveringstid på 31 timmar. Drospirenon binds till serumalbumin och binder varken till SHBG (Sex Hormone Binding Globulin) eller CBG (Corticoid Binding Globulin). Endast 3 - 5% av de totala koncentrationerna av aktiv substans i serum är fritt. Den etinylestradiolinducerade ökningen av SHBG påverkar inte bindningen av drospirenon till serumprotein. Den genomsnittliga skenbara distributionsvolymen för drospirenon är 3,7 ± 1,2 l/kg.
Metabolism
Efter oral tillförsel genomgår drospirenon en betydande metabolism. De huvudsakliga metaboliterna i plasma är syraformen av drospirenon, bildad genom öppning av laktonringen och 4,5-dihydro-drospirenon-3-sulfat, bildad genom reduktion och efterföljande sulfatisering. Drospirenon kan även genomgå oxidativ metabolism katalyserad av CYP3A4.
Drospirenon är in vitro kapabel att hämma cytokrom P450-enzymerna CYP1A1, CYP2C9, CYP2C19 och CYP3A4 svagt till måttligt.
Elimination
Clearance för drospirenon i serum är 1,5 ± 0,2 ml/min/kg. Endast spårmängder av drospirenon utsöndras i oförändrad form. Metaboliterna av drospirenon utsöndras i feces och urinen i förhållandet ca 1,2 till 1,4. Halveringstiden för utsöndringen av metaboliter via urin och feces är ca 40 timmar.
Steady state
Under behandlingscykeln uppnås de maximala jämviktskoncentrationerna för drospirenon i serum på ca 70 ng/ml efter cirka 8 dagars behandling. Nivåerna av drospirenon i serum ackumulerades med en faktor på ca 3 till följd av förhållandet mellan terminal halveringstid och doseringsintervall.
Särskilda patientgrupper
Effekter vid nedsatt njurfunktion
Hos kvinnor med lätt nedsatt njurfunktion (kreatinclearance CLcr, 50-80 ml/min) var steady-state serumkoncentration av drospirenon jämförbar med den hos kvinnor med normal njurfunktion. Serumkoncentrationen av drospirenon var i genomsnitt 37% högre hos kvinnor med måttligt nedsatt njurfunktion (CLcr, 30-50 ml/min) jämfört med den hos kvinnor med normal njurfunktion. Behandling med drospirenon tolererades också väl av kvinnor med mild och måttligt nedsatt njurfunktion. Drospirenonbehandlingen visade inte på någon kliniskt signifikant påverkan på koncentrationen av serumkalium.
Effekt vid nedsatt leverfunktion
I en singeldosstudie minskade oral clearance (CL/F) med ungefär 50% hos försökspersoner med måttligt nedsatt leverfunktion jämfört med personer med normal leverfunktion. Den observerade minskningen av drospirenonclearance hos försökspersoner med måttligt nedsatt leverfunktion medför uppenbarligen ingen skillnad i serumkoncentration av kalium. Även vid diabetes och samtidig behandling med spironolakton (två faktorer vilka kan predisponera för hyperkalemi hos patienter) kunde inte någon ökning av serumkoncentrationen av kalium till den övre normalgränsen konstateras. Det kan konkluderas att drospirenon tolereras väl hos patienter med mild eller måttligt nedsatt leverfunktion (Child-Pugh B).
Etniska grupper
Inga kliniskt relevanta skillnader i farmakokinetiken av drospirenon eller etinylestradiol har observerats mellan japanska eller kaukasiska kvinnor.
Etinylestradiol
Absorption
Etinylestradiol absorberas snabbt och fullständigt efter oralt intag. Efter ett intag av en peroral engångsdos uppnås maximal plasmakoncentration 33 pg/ml efter 1-2 timmar. Den absoluta biotillgängligheten är, beroende på presystemisk konjugering och first-pass metabolism ca 60%. Samtidigt intag av föda reducerade biotillgängligheten av etinylestradiol med omkring 25% hos de undersökta personerna medan denna förändring ej kunde ses hos andra.
Distribution
Koncentrationen av serumetinylestradiol minskar i två faser, där den terminala distributionsfasen karaktäriseras av en halveringstid på 24 timmar. Etinylestradiol är i hög grad, men icke specifikt, bundet till plasmaproteiner (ca 98%). Etinylestradiol inducerar en ökning av plasmakoncentrationen av SHBG och CBG (Corticoid Binding Globulin). Etinylestradiol har en skenbar distributionsvolym på 5 l/kg.
Metabolism
Etinylestradiol genomgår betydande första-passage-metabolism i mag-tarmkanalen och i levern. Etinylestradiol metaboliseras primärt genom aromatisk hydroxylering, men det bildas även hydroxylerade och metylerade metaboliter. Dessa återfinns som fria metaboliter och som konjugat med glukuronider och sulfater. Den metaboliska clearencehastigheten för etinylestradiol är ca 5 ml/min/kg.
Etinylestradiol är in vitro en reversibel hämmare av CYP2C19, CYP1A1 och CYP1A2 samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Elimination
Etinylestradiol utsöndras inte i oförändrad form i någon större omfattning. Metaboliterna av etinylestradiol utsöndras i urin och galla i förhållandet 4:6. Halveringstiden för utsöndringen är ca 1 dag.
Steady state
Jämvikt uppnås under andra hälften av en behandlingscykel och serumnivåerna för etinylestradiol ackumuleras med en faktor av ca 2,0 till 2,3.
Prekliniska uppgifter
Effekterna av drospirenon och etinylestradiol hos laboratoriedjur begränsade sig till de som har samband med känd farmakologisk verkan. Reproduktionstoxikologiska studier visade på embryo- och fostertoxicitet hos djur vilka anses artspecifika. Vid exponering för halter, vilka överstiger de som uppnås av Yasminelle-användare, observerades effekter på differentiering av fortplantningsorganen hos råtta men inte hos apa. Miljöriskbedömningsstudier har visat att etinylestradiol och drospirenon kan utgöra en risk mot vattenmiljön (se avsnitt Hållbarhet, förvaring och hantering).
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje filmdragerad tablett innehåller 0,020 mg etinylestradiol (som betadex clathrat) och 3 mg drospirenon.
Hjälpämne med känd effekt: laktos 46 mg (48,18 mg som laktosmonohydrat)
Förteckning över hjälpämnen
Tablettkärna:
Laktosmonohydrat
Majsstärkelse
Magnesiumstearat (E470b)
Tablettdragering:
Hypromellos (E464)
Talk (E553b)
Titandioxid (E 171)
Järnoxidpigment, rött (E 172)
Blandbarhet
Ej relevant.
Miljöpåverkan
Drospirenon
Miljörisk:
Användning av drospirenon har bedömts medföra låg risk för miljöpåverkan.
Nedbrytning:
Drospirenon är potentiellt persistent.
Bioackumulering:
Drospirenon har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R) = 0.014 μg/L
Where:
A = 105 kg (total sold amount API in Sweden year 2021, data from IQVIA / LIF)
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 if no data is available
P = number of inhabitants in Sweden = 10 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Reference I)
D = factor for dilution of wastewater by surface water flow = 10 (ECHA default) (Reference I)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies*
Algae (green algae, Desmodesmus subspicatus):
ErC50 72 hours (growth rate) > 7600 μg/L. Guideline OECD 201. (Reference II)
Crustacean (waterflea, Daphnia magna):
Acute toxicity
EC50 48 hours (immobilization) > 8000 μg/L. Guideline OECD 202. (Reference III)
Chronic toxicity
NOEC 21 days (reproduction) = 556 μg/L. Guideline OECD 211. (Reference IV)
Fish (zebrafish, Danio rerio):
Acute toxicity
LC50 96 hours (survival) = 7000 μg/L. Guideline OECD 203. (Reference V)
Chronic toxicity
NOEC 216 days (fecundity, sex ratio, histopathological changes of gonads) = 0.23 μg/L. non-standard test method – fish full life-cycle test. (Reference VI)
Microorganisms (activated sludge):
EC50 30 min (respiration inhibition) > 100 mg/L. Guideline OECD 209. (Reference VII)
The PNEC was calculated by division of the lowest effect level (NOEC) of the most sensitive taxonomic group considering an appropriate assessment factor (AF). The most sensitive taxonomic group were fish and the lowest effect level was reported as NOEC = 0.23 µg/L. The regulatory default standard AF of 10 was used, which is applicable when there are chronic aquatic toxicity studies representing the three trophic levels (algae, crustaceans, and fish).
PNEC = 0.23 µg/L / 10 = 0.023 µg/L
Environmental risk classification (PEC/PNEC ratio)
The risk quotient PEC/PNEC was calculated with 0.014 µg/L / 0.023 µg/L = 0.63.
Justification of chosen environmental risk phrase:
A risk quotient between 0.1 and 1 qualifies for the phrase “Use of Drospirenone has been considered to result in low environmental risk.”.
Degradation
Biotic degradation
Ready degradability:
Drospirenone was studied for aerobic biodegradability in water in a manometric respiration test with municipal sewage sludge. The study reported less than 3 % biodegradation of Drospirenone in 28 days. Guideline OECD 301. (Reference VIII)
Simulation studies:
The transformation of [14C] drospirenone in sediments and natural water was assessed in two different aerobic and anaerobic sediment/water systems at a temperature of 20 ± 2 °C continuously in the dark according to guideline OECD 308. Water and sediment were extracted for radio-HPLC separation, by using various extraction solvents such as acetonitrile, acetonitrile/water mixture and acetonitrile/HCl mixture. For mass balance determination, aquatic samples were measured by liquid scintillation counting, sediment samples combusted.
Only slight ultimate biodegradation was observed in the test systems. The accumulative amount of evolved [14]CO2 for the aerobic test systems was 1.4 and 3.8 % of the applied radioactivity.
Primary degradation was observed for drospirenone to a low degree in the water/sediment test samples. Two fractions with degradation products were observed in the HPLC analysis. Since the main metabolite appeared from day 3 onwards (although not continuously in the water phase), it is likely, that this metabolite is the isomer ZK 35096 (10). Because the second metabolite occurred only at day 37 (one replicate) and day 59 in one sediment type, it is of minor importance.
Dissipation was determined with DT50, DT75 and DT90values in the water layer of the aerobic transformation with 2.1, 4.1and 6.8 days for high organic carbon sediment system and 2.2, 4.5 and 7.5 days for low organic carbon system. The degradation DT50, DT75 and DT90 values in the total system were 9.9, 20 and 33 days for high organic carbon sediment system and 36, 72 and 119 days for low organic carbon system. The calculated systems half-lives, however, are very hypothetical, since there was no clear trend of decreasing concentrations of the extracted [14C] drospirenone between day 0 and day 100.
Therefore, the half-life of drospirenone in the environment is considered to exceed the threshold of 120 days. Guideline OECD 308. (Reference IX)
Abiotic degradation
Hydrolysis:
This study reported a half-life of > 12.8 days to a non-active isomer at pH 7. Guideline EC C7 (HPLC method). (Reference X)
Justification of chosen degradation phrase:
Drospirenone established a DT50 > 120 d for the total system which qualifies for the phrase “Drospirenone is potentially persistent.”.
Bioaccumulation
Partitioning coefficient:
The log Dow was reported with 3.1 at pH 7. Guideline OECD 117. (Reference XI)
Bioconcentration factor (BCF):
The study with drospirenone was conducted in the bluegill sunfish Lepomis macrochirus. Concentrations were 0.1 and 1.0 µg/L [14C]drospirenone. The fish were exposed over 35 days with a subsequent depuration phase of 29 days.
The steady state bioconcentration factors for total radioactive residue were 97 and 99 for the 0.1 and 1.0 μg/L treatment level, respectively, based on lipid content of 4.83 %. Normalised to 5% fat tissue, the BCFss for whole fish are 100 and 102 for the 0.1 and 1.0 μg/L treatment levels, respectively. Guideline OECD 305. (Reference XII)
Justification of chosen bioaccumulation phrase:
As the log Dow was < 4 and/or BCF < 500 Drospirenone is not considered bioaccumulative which qualifies for the phrase “Drospirenone has low potential for bioaccumulation.”.
Excretion (metabolism)
Drospirenone is only to a small extent excreted unchanged. Conjugates such as glucuronides and sulphates as well as hydroxylated compounds were identified. (Reference XIII, XIV)
References
-
Guidance on information requirements and Chemical Safety Assessment Chapter R.16: Environmental exposure assessment. V3.0, Feb. 2016.
-
Growth inhibition test of drospirenone on the green algae Scenedesmus subspicatus. Experimental Toxicology, Schering AG, study no. TX1997085, report no. AU49 (1997)
-
Acute immobilization of drospirenone with Daphnia magna. Experimental Toxicology, Schering AG, study no. TX97141, report no. AT51 (1997)
-
Reproduction study of drospirenone (ZK 30595) in Daphnia magna. Nonclinical Drug Safety, Bayer HealthCare AG, study no. TOXT6082178, report no. A52014 (2011)
-
Acute toxicity of drospirenone to the zebrafish (Danio rerio). Experimental Toxicology, Schering AG, study no TX97042, report no. AU44 (1997)
-
Full-life-cycle-tests with drospirenone (BAY 86-4888) on the fathead minnow (Pimephales promelas). Nonclinical Drug Safety, Bayer HealthCare AG, study no TOXT6082898, report no. A62532 (2011)
-
Respiration inhibition gest of drospirenone (ZK 30595) on activated sludge micro organisms. Nonclinical Drug Safety, Bayer Schering Pharma AG, study no TXST20070211, report no. A40777 (2008)
-
Study on the biodegradability of drospirenone in the CO2- evolution test (modified Sturm-test). Experimental Toxicology, Schering AG, study no. TX97155, report no. AT51 (1997)
-
[14C] Drospirenone: Aerobic and anaerobic transformation in aquatic sediment systems). Nonclinical Drug Safety, Bayer Schering Pharma AG, study no. TXEX20070018, report no. A48365 (2008)
-
The rate of hydrolysis of drospirenone (ZK 30595). General Physical Chemistry, Schering AG, study no. 1274, report no. LY67 (1997)
-
The determination of the n-octanol-water partition coefficient of ZK 30595. General Physical Chemistry, Schering AG, study no. 1290, report no. LY66 (1997)
-
[14C] Drospirenone: Bioconcentration study with bluegill sunfish (Lepomis macrochirus) under flow-through conditions. Nonclinical Drug Safety, Bayer Schering Pharma AG. Study no. TXEX20070017, report no. A48324
-
Absolute and relative bioavailability of ZK 30595 after oral administration of SH T 470 C and SH T 470 D, respectively to 8 young women. Schering AG, Pharmacokinetics/Biometrics/Human Pharmacology, study no. KI87053, report no. 8235 (1990)
-
Absolute bioavailability, excretory balance, and qualitative investigation of the biotransformation of 14C-ZK 30595 following i.v. and p.o. administration in healthy, elderly female volunteers. Schering AG, Pharmacokinetics, study no. KI93037, report no. A166 (1995)
Etinylestradiol
Miljörisk:
Användning av etinylestradiol har bedömts medföra hög risk för miljöpåverkan.
Nedbrytning:
Etinylestradiol bryts ned i miljön.
Bioackumulering:
Etinylestradiol har hög potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R) = 0.00037 μg/L
Where:
A = 2.691 kg (total sold amount API in Sweden year 2022, data from IQVIA / LIF)
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 if no data is available
P = number of inhabitants in Sweden = 10 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Reference I)
D = factor for dilution of wastewater by surface water flow = 10 (ECHA default) (Reference I)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae (green algae, Desmodesmus subspicatus):
NOEC 72 hours (growth rate) = 117 μg/L, ErC50 72 hours (growth rate) = 460 μg/L. Guideline OECD 201. (Reference II)
Crustacean (waterflea, Daphnia magna):
Acute toxicity
EC50 48 hours (immobilization) = 6400 μg/L. Guideline OECD 202. (Reference III)
Chronic toxicity
NOEC 21 days (reproduction) ≥ 387 μg/L. Guideline FDA TAD 4.09. (Reference IV)
Fish:
Acute toxicity (rainbow trout, Oncorhynchus mykiss)
LC50 96 hours (survival) = 1600 μg/L. Guideline FDA TAD 4.11. (Reference V)
Chronic toxicity (fathead minnow, Pimephales promelas)
NOEC 300 days (life-cycle test: growth, sexual development) = 0.001 μg/L. Guideline OECD EPA FIFRA Subdev. E, 72-5. (Reference VI)
The PNEC was calculated by division of the lowest effect level (NOEC) of the most sensitive taxonomic group considering an appropriate assessment factor (AF). The most sensitive taxonomic group was fish, and the lowest effect level was reported as NOEC = 0.0003 µg/L. The regulatory default standard AF of 10 was used, which is applicable when there are chronic aquatic toxicity studies representing the three trophic levels (algae, crustaceans, and fish).
PNEC = 0.0003 µg/L / 10 = 0.00003 µg/L
Environmental risk classification (PEC/PNEC ratio)
The risk quotient PEC/PNEC was calculated with 0.00037 µg/L / 0.00003 µg/L = 12.3.
Justification of chosen environmental risk phrase:
A risk quotient above 10 qualifies for the phrase “Use of ethinylestradiol has been considered to result in high environmental risk.”.
Degradation
Biotic degradation
Ready degradability:
Ethinylestradiol was studied for aerobic biodegradability in water in a CO2 evolution test according to guideline FDA TAD 3.11 (8). Ethinylestradiol was introduced into the test system at a concentration of 10 mg/L as carbon. The study reported 3 % biodegradation of ethinylestradiol in 28 days, wherefore the substance is considered not readily biodegradable. Guideline FDA TAD 3.11. (Reference VII)
Simulation studies:
A study on transformation in aquatic/sediment systems according to test guideline OECD 308 was conducted. The transformation of [14C] ethinylestradiol in sediments and natural water was assessed in three different aerobic sediment/water systems. The disappearance half-lifes of [14C] ethinylestradiol were in the overlying water of aerobic systems 4.0 and 5.9 days for the high and low organic carbon content, respectively. Since for one of the low organic carbon content sediment the total mass balance was not reached as recommended in the guideline OECD 308 (≥ 90%), this result was not further evaluated.
The extraction from sediments were performed by the following method, which was validated for spiked sediments prior to application to test samples: The sediment is extracted by using 50 mL acetonitrile:water, 80:20, v:v as extraction solvent. If more than 5 % of the applied amount is found in the second extract the sediment is extracted a third time using acetonitrile:1 M HCl 80:20, v:v. A portion of the combined extracts was then reduced by rotary evaporation at 40 °C and at least 60 mbar. The concentrated sample was then analyzed by HPLC for parent compound and extractable metabolites.
The parent compound was recovered to 0 % from all water and sediment samples at day 99. Only slight ultimate biodegradation was observed in the test systems. The accumulative amount of evolved 14CO2 for the aerobic test systems was 2.5 and 5.1 % of the applied radioactivity. Primary degradation was observed for ethinylestradiol to a low degree in the water/sediment test samples. One metabolite occurred only occasionally. Most of the introduced radioactivity was sediment-bound (50-62 %).
In the total water/sediment systems the DT50 of [14C] ethinylestradiol was 24, 36, and 28 days for the 2 systems. The DT50 values differed ranked in two cases below the threshold of 32 days and exceeded this threshold in one case. Since two of three water-sediment systems report DT50 below the criterion and the exceedance of one system is moderate, ethinylestradiol can be classified as being degradable.
In conclusion, this study reported a half-life of ethinylestradiol of 4.0-5.9 days in water and 24-36 days in sediment/total system. Guideline OECD 308. (Reference VIII)
Abiotic degradation
Hydrolysis:
This study reported that ethinylestradiol is hydrolytically stable. Guideline FDA TAD 3.09. (Reference IX)
Justification of chosen degradation phrase:
The degradation half-life in the total system of the OECD 308 study qualifies for the phrase “ethinylestradiol is degraded in the environment”.
Bioaccumulation
Partitioning coefficient:
The log Dow was reported as 4.2. Guideline FDA TAD 3.02. (Reference X)
Bioconcentration factor (BCF):
A bioaccumulation study with ethinylestradiol was conducted in the bluegill sunfish Lepomis macrochirus. The fish were exposed to concentrations of 1 and 10 ng/L [14C] ethinylestradiol, over 35 days with a subsequent depuration phase of 29 days. The steady state bioconcentration factors (BCFs) for total radioactive residue were 371 and 634 for the 1.0 and 10 ng/L treatment level, respectively. The steady state bioconcentration factors for total radioactive residue (TRR) based on lipid content of 3.61 % were 371 at the 1.0 ng/L treatment level and 634 at the 10 ng/L treatment level. Normalised to 5 % fat tissue, the BCFss for total radioactive residues for whole fish are 514 and 878 for the 1.0 and 10 ng/L treatment levels, respectively. Guideline OECD 305. (Reference XI)
Justification of chosen bioaccumulation phrase:
As the log Dow was > 4 and BCF > 500 ethinylestradiol is considered bioaccumulative which qualifies for the phrase “ethinylestradiol has high potential for bioaccumulation.”.
References
-
Guidance on information requirements and Chemical Safety Assessment Chapter R.16: Environmental exposure assessment. V3.0, Feb. 2016.
-
Growth inhibition test of ethinylestradiol (ZK 4944) on the green algae Desmodesmus subspicatus. Experimental Toxicology, Schering AG, Study no. TXST20020060, Report no. A12518 (2004).
-
Acute immobilization of ethinylestradiol with Daphnia magna. Experimental Toxicology, Schering AG, Study no. TXS94269, Report no. AG47 (1997).
-
Chronic toxicity study of ethinylestradiol on Daphnia magna. Experimental Toxicology, Schering AG, Study no. TXS94268, Report no. AG95 (1999).
-
Acute toxicity test of ethinylestradiol with rainbow trout. Experimental Toxicology, Schering AG, Study no. TX93145, Report no. A987 (1995).
-
Ethinylestradiol: Determination of the chronic toxicity to fathead minnow Pimephales promelas full lifecycle. Experimental Toxicology, Schering AG, Zeneca study no. AA1099/B, Schering study no. TX95192 (1997).
-
Study on aerobic biodegradation of ethinylestradiol. Experimental Toxicology, Schering AG, Study no. TX93157, Report no. AA74 (1995).
-
[14C] Ethinylestradiol: Aerobic and anaerobic transformation in aquatic sediment systems. Bayer Schering Pharma AG, Nonclinical drug Safety, Springborn Smithers Laboratories, Horn, Switzerland study no. 1121.000.753 (2008).
-
Physicochemical data for environmental risk assessment of ethinylestradiol (ZK 4944). General Physical Chemistry, Schering AG, report no. KO 41 (1993).
-
[14C] Ethinylestradiol: Bioconcentration study with bluegill sunfish (Lepomis macrochirus) under flow-through conditions. Bayer Schering Pharma AG, Nonclinical drug Safety, Springborn Smithers Laboratories, Horn, Switzerland study no. 1121.000.135 (2008).
Hållbarhet, förvaring och hantering
Hållbarhet
5 år
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar
Särskilda anvisningar för destruktion
Detta läkemedel kan utgöra en risk mot miljön (se avsnitt Prekliniska uppgifter).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Filmdragerad tablett.
Ljusrosa, runda tabletter med konvex yta. Ena sidan är märkt med bokstäverna ”DS” inom en liksidig sexhörning.
Förpackningsinformation
Filmdragerad tablett 0,02 mg/3 mg
Ljusrosa, runda tabletter med konvex yta. Ena sidan är märkt med bokstäverna ”DS” inom en liksidig sexhörning.
3 x 21 tablett(er) blister (fri prissättning), EF, Övriga förskrivare: barnmorska
1 x 21 tablett(er) blister (fri prissättning), tillhandahålls ej
6 x 21 tablett(er) blister (fri prissättning), tillhandahålls ej





