1 LÄKEMEDLETS NAMN
Gamunex 100 mg/ml infusionsvätska, lösning
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
2.1 Allmän beskrivning
Humant, normalt immunglobulin (IVIg).
2.2 Kvalitativ och kvantitativ sammansättning
En ml innehåller:
humant normalt immunglobulin 100 mg
(renhet minst 98 % IgG)
Varje injektionsflaska à 10 ml innehåller: 1 g humant, normalt immunglobulin
Varje injektionsflaska à 50 ml innehåller: 5 g humant, normalt immunglobulin
Varje injektionsflaska à 100 ml innehåller: 10 g humant, normalt immunglobulin
Varje injektionsflaska à 200 ml innehåller: 20 g humant, normalt immunglobulin
Varje injektionsflaska à 400 ml innehåller: 40 g humant, normalt immunglobulin
Fördelning av IgG-subklasser (ungefärliga värden):
IgG1 .................... 62,8 %
IgG2 .................... 29,7 %
IgG3 ...................... 4,8 %
IgG4 ......................2,7 %
Minsta nivå av mässlingantikroppar (IgG) är 9 IU/ml
Maximalt IgA-innehåll: 84 mikrogram/ml.
Framställd ur human plasma från blodgivare.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Infusionsvätska, lösning
Lösningen är klar till lätt opaliserande, färglös eller svagt gul.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Substitutionsbehandling för vuxna, barn och ungdomar (0–18 år) vid:
-
primära immunbristsyndrom (PID) med nedsatt antikroppsproduktion
-
sekundära immunbristtillstång (SID) hos patienter med allvarliga eller återkommande infektioner, ineffektiv antimikrobiell behandling och antingen konstaterad specifik antikroppsbrist (PSAF)* eller IgG i serum på <4 g/l.
*PSAF = uppnår inte en minst 2-faldig ökning av IgG-antikroppstitern efter vaccination med pneumokockpolysackarid- och polypeptidantigen.
Mässlingsprofylax före/efter exponering av mässling av känsliga vuxna, barn och ungdomar (0-18 år) där aktiv immunisering (vaccination) är kontraindicerat eller inte är rekommenderat.
Hänsyn bör också tas till officiella rekommendationer om intravenös användning av humant immunoglobulin vid mässlingsprofylax före/efter exponering av aktiv immunisering.
Immunmodulering hos vuxna samt barn och ungdomar (0–18 år) vid:
-
primär immuntrombocytopeni (ITP), hos patienter med stor blödningsrisk eller före kirurgi för att korrigera antalet trombocyter
-
Guillain-Barrés syndrom
-
Kawasakis sjukdom (i samband med acetylsalicylsyra, se avsnitt 4.2)
-
kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP)
-
multifokal motorisk neuropati (MMN)
Immunmodulering hos vuxna ≥18 år vid:
-
allvarliga, akuta exacerbationer av myasthenia gravis.
4.2 Dosering och administreringssätt
IVIg behandling ska inledas och övervakas under överinseende av en läkare med erfarenhet av behandling av immunbristsjukdomar.
Dosering
Dos och doseringsregim beror på indikationen.
Dosen kan behöva anpassas efter varje patient beroende på det kliniska svaret. Dos som baseras på kroppsvikt kan behöva justeras för under- eller överviktiga patienter.
Följande dosregimer anges som vägledning.
Substitutionsbehandling vid primära immunbristsyndrom
Doseringsregimen ska ge ett lägsta IgG dalvärde (mätt före nästföljande infusion) på minst 6 g/l, eller ligga inom de normala referensvärdena för åldersgruppen. Det tar 3-6 månader från behandlingsstart innan jämvikt (steady state-värden för IgG) uppnås. Rekommenderad startdos är 0,4–0,8 g/kg som ges en gång, följt av minst 0,2 g/kg som ges var 3-4:e vecka.
Den dos som krävs för att uppnå ett IgG dalvärde på 6 g/l är i storleksordningen 0,2–0,8 g/kg/månad. Doseringsintervallet när steady state har uppnåtts varierar mellan 3 och 4 veckor. IgG dalvärde ska mätas och bedömas tillsammans med infektionsincidens. För att minska frekvensen av bakterieinfektioner kan det bli nödvändigt att öka dosen och sikta på högre dalvärde.
Substitutionsbehandling vid sekundära immunbristtillstånd (enligt definition i avsnitt 4.1)
Rekommenderad dos är 0,2‑0,4 g/kg var 3-4:e vecka.
IgG dalvärde ska mätas och bedömas tillsammans med infektionsincidens. Dosen ska justeras efter behov för att uppnå optimalt skydd mot infektioner, varför en ökning kan vara nödvändig till patienter med kvarstående infektion medan en dosminskning kan övervägas när patienten är infektionsfri.
Mässlingsprofylax före/efter exponering
Profylax efter exponering
Om en känslig patient har exponerats för mässling ska en dos på 0,4 g/kg ges så snart som möjligt och inom 6 dagar efter exponering. Denna dos ger en serumnivå > 240 mIU/ml av mässlingsantikroppar i minst 2 veckor. Serumnivåer bör kontrolleras efter 2 veckor och dokumenteras. Ytterligare en dos på 0,4 g/kg kan upprepas en gång efter 2 veckor om det behövs för att upprätthålla serumnivå > 240 mIU/ml.
Om en PID/SID-patient har exponerats för mässling och regelbundet får IVIg-infusioner, bör det övervägas att administrera en extra dos av IVIg så snart som möjligt och inom 6 dagar efter exponering. En dos på 0,4 g/kg bör ge en seriumnivå > 240 mIU/ml av mässlingsantikroppar i minst 2 veckor.
Pre-exponeringsprofylax
Om en PID/SID-patient löper risk för framtida mässlingsexponering och får en IVIg-underhållsdos på mindre än 0,53 g/kg var 3-4:e vecka, bör denna dos ökas en gång till 0,53 g/kg. Detta bör ge en serumnivå på > 240 mIU/ml av mässlingsantikroppar i minst 22 dagar efter infusion.
Immunmodulering i
Primär immuntrombocytopeni
Det finns två alternativa behandlingsprogram:
• 0,8–1 g/kg dag 1. Denna dos kan upprepas en gång inom 3 dagar
• 0,4 g/kg dagligen i 2-5 dagar. Behandlingen kan upprepas vid återfall.
Guillain-Barrés syndrom
0,4 g/kg/dag i 5 dagar (vid återfall kan doseringen upprepas).
Kawasakis sjukdom
2,0 g/kg ska ges som en engångsdos. Patienterna ska få samtidig behandling med acetylsalicylsyra.
Kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP)
Startdos: 2 g/kg i delade doser över 2‑5 dagar i följd.
Underhållsdoser: 1 g/kg i delade doser fördelat över 1‑2 dagar i följd var 3:e vecka.
Behandlingseffekten ska utvärderas efter varje cykel. Om ingen behandlingseffekt ses efter 6 månader ska behandlingen sättas ut.
Om behandlingen har effekt avgör läkaren om långtidsbehandling ska sättas in, baserat på patientens respons och respons på underhållsbehandling. Dosering och doseringsintervall kan behöva anpassas efter sjukdomsförloppet hos varje enskild patient.
Multifokal motorisk neuropati (MMN)
Startdos: 2 g/kg i delade doser över 2‑5 dagar i följd.
Underhållsdos: 1 g/kg var 2-4:e vecka eller 2 g/kg var 4:e-8:e vecka.
Behandlingseffekten ska utvärderas efter varje cykel. Om ingen behandlingseffekt ses efter 6 månader ska behandlingen sättas ut.
Om behandlingen har effekt avgör läkaren om långtidsbehandling ska sättas in, baserat på patientens respons och respons på underhållsbehandling. Dosering och doseringsintervall kan behöva anpassas efter sjukdomsförloppet hos varje enskild patient.
Allvarliga, akuta exacerbationer av myasthenia gravis
2 g/kg fördelat över 2 dagar i följd (en dos om 1 g/kg per dag).
Kliniska studier av Gamunex omfattade inte tillräckligt många deltagare i åldern 65 år och äldre för att en exakt behandlingseffekt skulle kunna fastställas.
|
Indikation |
Dos |
Infusionsfrekvens |
|---|---|---|
|
Substitutionsbehandling: |
||
|
Primärt immunbristsyndrom |
Startdos: 0,4-0,8 g/kg Underhållsdos: 0,2-0,8 g/kg |
var 3-4:e vecka |
|
Sekundära immunbristtillstånd (enligt definition i avsnitt 4.1.) |
0,2-0,4 g/kg |
var 3-4:e vecka |
|
Mässlingsprofylax före/efter exponering: |
||
|
Post-exponeringsprofylax hos mottagliga patienter |
0,4 g/kg |
Så snart som möjligt och inom 6 dagar, som eventuellt kan upprepas en gång efter 2 veckor för att bibehålla serumnivån av mässlingsantikroppar > 240 mIU/ml |
|
Post-exponeringsprofylax hos PID/SID-patienter |
0,4 g/kg |
Utöver underhållsbehandling ges en extra dos inom 6 dagar efter exponering |
|
Pre-exponeringsprofylax hos PID/SID-patienter |
0,53 g/kg |
Om en patient får en underhållsdos på mindre än 0,53 g/kg var 3-4:e vecka, bör dosen ökas en gång till minst 0,53 g/kg |
|
Immunmodulering: |
||
|
Primär immuntrombocytopeni |
0,8-1 g/kg eller |
dag 1, kan upprepas en gång inom 3 dagar |
|
0,4 g/kg/dag |
i 2-5 dagar |
|
|
Guillain-Barrés syndrom |
0,4 g/kg/dag |
i 5 dagar |
|
Kawasakis sjukdom |
2 g/kg |
som en engångsdos tillsammans med acetylsalicylsyra |
|
Kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP) |
Startdos: 2 g/kg |
i uppdelade doser fördelat över 2-5 dagar |
|
Underhållsdos: 1 g/kg |
var 3:e vecka i uppdelade doser fördelat över 1-2 dagar |
|
|
Multifokal motorisk neuropati (MMN) |
Startdos: 2 g/kg |
i uppdelade doser fördelat över 2-5 dagar i följd |
|
Underhållsdos: 1 g/kg eller |
var 3-4:e vecka eller |
|
|
2 g/kg |
var 4-8:e vecka i uppdelade doser fördelat över 2-5 dagar |
|
|
Allvarliga, akuta exacerbationer av myasthenia gravis |
2 g/kg |
administreras fördelat på 2 dagar i följd (dos om 1 g/kg per dygn) |
Pediatrisk population
Dosering till barn och ungdomar (0–18 år) är inte annorlunda än till vuxna eftersom dosering för varje indikation ges enligt kroppsvikt och måste justeras utefter det kliniska utfallet för ovan nämnda tillstånd.
Nedsatt leverfunktion
Det finns inga belägg för att dosjustering är nödvändig.
Nedsatt njurfunktion
Ingen dosjustering såvida det inte är kliniskt motiverat, se avsnitt 4.4.
Äldre
Ingen dosjustering såvida det inte är kliniskt motiverat, se avsnitt 4.4.
Administreringssätt
För intravenös användning.
Humant normalt immunglobulin ska ges som en intravenös infusion med en initial hastighet på 0,6–1,2 ml/kg/timme under 30 minuter. Se avsnitt 4.4. Vid biverkning måste antingen administreringshastigheten minskas eller infusionen avbrytas. Om infusionen tolereras väl kan administreringshastigheten gradvis ökas till max 4,8–8,4 ml/kg/timme.
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen (humana immunglobuliner) eller mot något hjälpämne, som anges i avsnitt 4.4 och 6.1.
Patienter med selektiv IgA-brist som har utvecklat antikroppar mot IgA, eftersom administrering av en IgA-innehållande produkt kan leda till anafylaxi.
4.4 Varningar och försiktighet
Alla patienter ska kontrolleras noga när höga infusionshastigheter (8,4 ml/kg kroppsvikt per timme) används. Hos barn eller patienter med risk för njursvikt ska högsta infusionshastighet inte överstiga 4,8 ml/kg kroppsvikt per timme.
Gamunex får inte blandas med andra infusionsvätskor (t.ex. koksaltlösning) eller andra läkemedel. Om spädning är nödvändig före infusion kan 50 mg/ml glukoslösning användas för detta ändamål.
Hos patienter med latent diabetes (där övergående glukosuri kan förekomma), diabetes eller hos patienter som står på en låg sockerdiet skall användningen av 50 mg/ml glukoslösning noga kontrolleras. Se varning nedan om akut njursvikt.
Gamunex och heparin ska inte administreras samtidigt i samma infusionssystem.
Spårbarhet
För att förbättra spårbarheten för biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Försiktighet
Eventuella komplikationer kan ofta undvikas genom att säkerställa att patienterna:
-
inte är känsliga för humant, normalt immunglobulin genom att initialt injicera läkemedlet långsamt (0,6–1,2 ml/kg per timme). För patienter som är mer benägna att vara känsliga (t.ex. vid byte från annan IVIg eller tidigare allergisk reaktion), kan en initial infusionshastighet på 0,1 ml/kg per timme övervägas.
-
övervakas noggrant med avseende på eventuella symtom under hela infusionsperioden. Särskilt patienter som inte tidigare fått humant immunglobulin, patienter som har bytt från ett annat IVIg-läkemedel eller om det varit ett långt uppehåll sedan den senaste infusionen, ska övervakas under första infusionen och under den första timmen efter första infusionen i en kontrollerad vårdmiljö för att upptäcka potentiella tecken på biverkningar och för att säkerställa att akut behandling kan ges omedelbart om problem skulle uppstå. Alla andra patienter ska observeras i minst 20 minuter efter administrering.
Hos alla patienter kräver IVIg-administrering:
-
adekvat vätsketillförsel innan IVIg-infusionen startar
-
övervakning av urinmängd
-
övervakning av serumkreatininnivåer
-
att loopdiuretika inte används samtidigt (se avsnitt 4.5).
Vid biverkningar måste antingen infusionshastigheten minskas eller infusionen avbrytas. Vilken behandling som krävs beror på biverkningens typ och svårighetsgrad.
Infusionsrelaterad reaktion
Vissa biverkningar (t.ex. huvudvärk, rodnad, frossa, myalgi, väsande andning, takykardi, värk i ländryggen, illamående och hypotoni) kan bero på infusionshastigheten. Den rekommenderade infusionshastigheten som anges i avsnitt 4.2 måste följas noga. Patienter måste övervakas och observeras noggrant för eventuella symtom under hela infusionsperioden.
Biverkningar kan förekomma oftare:
-
hos patienter som får humant, normalt immunglobulin för första gången eller, i sällsynta fall, när man byter humant normalt immunglobulinpreparat eller om det varit ett långt uppehåll sedan den senaste infusionen
-
hos patienter med en aktiv infektion eller underliggande kronisk inflammation.
Överkänslighet
Överkänslighetsreaktioner är sällsynta.
Anafylaxi kan utvecklas hos patienter:
-
med ej detekterbart IgA som har IgA-antikroppar
-
som har tolererat tidigare behandling med humant normalt immunglobulin
I händelse av chock ska rutinmässig behandling av chock sättas in.
Tromboemboli
Det finns kliniska belägg för ett samband mellan IVIg-administrering och tromboemboliska händelser såsom hjärtinfarkt, cerebrovaskulär händelse (inklusive stroke), lungemboli och djupa ventromboser, vilka antas ha samband med en relativ ökning i blodviskositet genom det höga inflödet av immunglobulin hos riskpatienter. Försiktighet bör iakttas vid förskrivning och infusion av IVIg till överviktiga patienter och patienter med preexisterande riskfaktorer för trombotiska händelser (såsom hög ålder, hypertoni, diabetes mellitus, kärlsjukdom eller trombotiska episoder i anamnesen, patienter med förvärvad eller ärftlig trombofili, patienter med långa perioder av orörlighet, svårt hypovolemiska patienter och patienter med sjukdomar som ökar blodets viskositet).
Hos patienter som löper risk att drabbas av tromboemboliska biverkningar ska IVIg-produkter administreras med minsta möjliga infusionshastighet och dos.
Akut njursvikt
Fall av akut njursvikt har rapporterats hos patienter som får IVIg-behandling. I de flesta fall har riskfaktorer identifierats såsom preexisterande njurinsufficiens, diabetes mellitus, hypovolemi, övervikt, samtidig behandling med nefrotoxiska läkemedel eller ålder över 65 år.
Njurparametrar ska analyseras före infusion av IVIg, särskilt hos patienter som bedöms ha en potentiellt ökad risk för akut njursvikt, och därefter med lämpliga intervall. Hos patienter med risk för akut njursvikt ska IVIg-produkter administreras med lägsta möjliga infusionshastighet och dos. Vid nedsatt njurfunktion ska utsättning av IVIg övervägas.
Även om rapporter om njurdysfunktion och akut njursvikt har haft samband med användning av många av de godkända IVIg-produkterna, som innehåller olika hjälpämnen t.ex. sackaros, glukos och maltos, står de som innehåller sackaros som stabiliseringsmedel för en oproportionerligt stor andel av det totala antalet. Hos riskpatienter kan användning av IVIg-produkter som inte innehåller dessa hjälpämnen övervägas. Gamunex innehåller inte sackaros, maltos eller glukos.
Aseptiskt meningitsyndrom (AMS)
AMS har rapporterats i samband med IVIg-behandling. Syndromet uppträder vanligen inom några timmar upp till 2 dagar efter IVIg-behandling. Undersökning av cerebrospinalvätska är ofta positiv med pleocytos upp till flera tusen celler per mm3, framförallt granulocyter, och förhöjda proteinvärden upp till flera hundra mg/dl. AMS kan uppträda mer frekvent vid högdosbehandling med IVIg (2 g/kg).
Patienter som uppvisar sådana tecken och symtom ska genomgå en grundlig neurologisk undersökning, inklusive studier av cerebrospinalvätska, för att utesluta andra orsaker till meningit.
Utsättning av IVIg-behandling har resulterat i remission av AMS inom loppet av några dagar utan följdverkningar.
Hemolytisk anemi
IVIg-produkter kan innehålla blodgruppsantikroppar som kan verka som hemolysiner och inducera beläggning av immunglobulin på röda blodkroppar in vivo, vilket leder till en positiv direkt antiglobulinreaktion (Coombs test) och i sällsynta fall till hemolys. Hemolytisk anemi kan utvecklas efter IVIg-behandling till följd av ökad sekvestrering av röda blodkroppar. Patienter som får IVIg ska övervakas avseende kliniska tecken och symtom på hemolys (se avsnitt 4.8).
Följande riskfaktorer är förenade med utvecklandet av hemolys: höga doser, antingen givna som en enda administrering eller uppdelat på flera dygn; icke-0 blodgrupp; och underliggande inflammatoriskt tillstånd. Ökad vaksamhet rekommenderas för icke-0 blodgruppspatienter som får höga doser vid icke-PID-indikationer. Hemolys har sällan rapporterats hos patienter som fått ersättningsterapi för PID.
Enstaka fall av hemolysrelaterad njurinsufficiens/njursvikt med dödlig utgång har inträffat.
Neutropeni/leukopeni
En övergående minskning av antalet neutrofiler och/eller episoder av neutropeni, ibland allvarliga, har rapporterats efter behandling med IVIg. Detta har oftast utvecklats inom några timmar eller dagar efter IVIg-administrering och gått tillbaka spontant inom 7 till 14 dagar.
Transfusionsrelaterad akut lungskada (TRALI)
Det har förekommit en del rapporter om akut icke-kardiogent lungödem (transfusionsrelaterad akut lungskada eller TRALI) hos patienter som får IVIg. TRALI kännetecknas av svår hypoxi, dyspné, takypne, cyanos, feber och hypotoni. Symtom på TRALI utvecklas i typiska fall under eller inom 6 timmar efter en transfusion, ofta inom 1‑2 timmar. IVIg-mottagare måste därför övervakas avseende lungbiverkningar och IVIg-infusionen avbrytas omedelbart vid sådana reaktioner. TRALI är ett potentiellt livshotande tillstånd som kräver omedelbar intensivvård.
Interferens med serologiska tester
Efter administrering av immunglobulin kan den tillfälliga ökningen av de olika passivt överförda antikropparna i patientens blod leda till falskt positiva resultat i serologiska tester. Passiv överföring av antikroppar mot erytrocytantigener, t.ex. A, B, D, kan påverka vissa serologiska tester för antikroppar mot röda blodkroppar t.ex. direkt antiglobulintest (DAT, direkt Coombs test).
Överförbara agens
Standardåtgärder för att förhindra infektioner till följd av användning av läkemedel framställda av humant blod eller human plasma inkluderar val av donatorer, screening av individuella donationer och plasmapooler för specifika infektionsmarkörer samt inklusion av effektiva tillverkningssteg för att inaktivera/avlägsna virus. Trots detta kan risken för överföring av smittämnen inte helt uteslutas, när läkemedel framställda av humant blod eller human plasma administreras. Detta gäller även okända eller nya virus och andra patogener.
De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus såsom humant immunbristvirus (HIV), hepatit B-virus (HBV) och hepatit C-virus (HCV). De vidtagna åtgärderna kan vara av begränsat värde när det gäller icke höljeförsedda virus såsom HAV och parvovirus B19.
Det finns övertygande klinisk erfarenhet av att hepatit A eller parvovirus B19 inte överförs med immunglobuliner och det antas också att antikroppsinnehållet ger ett viktigt bidrag till virussäkerheten.
Det rekommenderas starkt att varje gång Gamunex administreras till en patient skall produktens namn och tillverkningssatsnummer noteras för att upprätthålla en koppling mellan patienten och produktens tillverkningssats.
Pediatrisk population
Även om det föreligger begränsade data, förväntas det att samma varningar, försiktighetsåtgärder och riskfaktorer tillämpas för den pediatriska populationen. I rapporter efter godkännandet observeras att IVIg-högdosindikationer hos barn, speciellt Kawasakis sjukdom, är förenade med en ökad rapportering av hemolytiska reaktioner jämfört med andra IVIg-indikationer hos barn.
Läkare måste allvarligt överväga att följa hemoglobinnivåerna 24–48 timmar efter avslutad IVIg om hemolys misstänks. Om förnyad behandling erfordras rekommenderas starkt att man följer hemoglobinnivåerna i en vecka efter den följande IVIg-dosen om hemolys befaras. Familjer ska instrueras att återvända om deras barn utvecklar symtom på hemolys, såsom blekhet, trötthet, mörkfärgad urin, andnöd och hjärtklappning.
Natriuminnehåll
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per engångsdos (upp till högst 2 g/kg), d.v.s. är näst intill "natriumfritt".
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Levande försvagade virusvacciner
Administrering av immunglobuliner kan försämra effekten av levande försvagade virusvacciner mot t.ex. mässling, påssjuka, röda hund eller vattkoppor under minst 6 veckor och upp till 3 månader. Efter administrering av detta läkemedel, bör ett intervall på tre månader förflyta före vaccination med levande, försvagade virusvacciner. När det gäller mässling kan försämringen kvarstå i upp till 1 år. Därför bör patienter som får mässlingsvaccin få sin antikroppsstatus kontrollerad.
Loopdiuretika
Undvik samtidig användning av loopdiuretika.
Pediatrisk population
Även om specifika interaktionsstudier inte har utförts i pediatrisk population förväntas inga skillnader mellan vuxna och barn.
4.6 Fertilitet, graviditet och amning
Graviditet
Säkerheten hos detta läkemedel vid användning under graviditet hos människa har inte fastställts i kontrollerade kliniska prövningar. Gamunex skall därför endast ges med försiktighet till gravida kvinnor. IVIg-produkter har visats passera placenta, i ökande grad under den tredje trimestern. Klinisk erfarenhet av immunglobuliner tyder på att inga skadliga effekter på graviditeten eller på fostret och det nyfödda barnet kan förväntas.
Amning
Säkerheten hos detta läkemedel vid användning hos ammande mödrar har inte fastställts i kontrollerade kliniska prövningar och bör därför endast ges med försiktighet till ammande mödrar. Immunglobuliner utsöndras i bröstmjölk. Inga negativa effekter förväntas på ammade nyfödda/spädbarn.
Fertilitet
Klinisk erfarenhet av immunglobuliner tyder på att inga skadliga effekter på fertiliteten kan förväntas.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Gamunex har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Patienter som upplevt biverkningar under behandlingen bör vänta tills dessa avklingat innan de kör bil eller använder maskiner.
4.8 Biverkningar
Sammanfattning av säkerhetsprofilen
Biverkningar orsakade av humana normala immunglobuliner (i avtagande frekvens) är (se även avsnitt 4.4):
-
frossbrytningar, huvudvärk, yrsel, feber, kräkningar, allergiska reaktioner, illamående, artralgi, lågt blodtryck och måttlig ländryggsmärta
-
reversibla hemolytiska reaktioner, särskilt hos personer med blodgrupp A, B och AB, och (i sällsynta fall) hemolytisk anemi som kräver transfusion
-
(i sällsynta fall) ett plötsligt blodtrycksfall samt, i enstaka fall, anafylaktisk chock, även om patienten inte har visat någon överkänslighet vid tidigare administrering
-
(i sällsynta fall) övergående hudreaktioner (såsom kutan lupus erythematosus – frekvens okänd)
-
(i mycket sällsynta fall) tromboemboliska reaktioner som hjärtinfarkt, stroke, lungemboli, djup ventrombos
-
fall av reversibel aseptisk meningit
-
fall av förhöjt serumkreatinin och/eller akut njursvikt
-
fall av transfusionsrelaterad akut lungskada (TRALI).
Förteckning över biverkningar i tabellform
Den tabell som presenteras nedan är uppdelad enligt organklassificeringen i MedDRA-systemet (klassificering av organsystem och föredragen term). Frekvenserna har utvärderats enligt följande princip: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
Organsystem enligt MedDRA |
Biverkningar |
Frekvens per patient |
Frekvens per infusion |
|---|---|---|---|
|
Infektioner och infestationer |
Faryngit |
Mindre vanliga |
Mindre vanliga |
|
Sinuit, uretrit, virusinfektion i övre luftvägarna |
Mindre vanliga |
Sällsynta |
|
|
Blodet och lymfsystemet |
Hemolytisk anemi, lymfocytos |
Mindre vanliga |
Sällsynta |
|
Immunsystemet |
Överkänslighet |
Mindre vanliga |
Sällsynta |
|
Psykiska störningar |
Ångest |
Mindre vanliga |
Sällsynta |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Mycket vanliga |
Vanliga |
|
Yrsel |
Mindre vanliga |
Mindre vanliga |
|
|
Afoni |
Mindre vanliga |
Sällsynta |
|
|
Ögon |
Fotofobi |
Mindre vanliga |
Sällsynta |
|
Blodkärl |
Hypertoni |
Vanliga |
Mindre vanliga |
|
Hypertensiv kris, hypotoni, rodnad, hyperemi |
Mindre vanliga |
Sällsynta |
|
|
Andningsvägar, bröstkorg och mediastinum |
Väsande andning, hosta, nästäppa |
Mindre vanliga |
Mindre vanliga |
|
Dyspné |
Mindre vanliga |
Sällsynta |
|
|
Magtarmkanalen |
Illamående, kräkningar |
Vanliga |
Mindre vanliga |
|
Buksmärtor, diarré, dyspepsi |
Mindre vanliga |
Sällsynta |
|
|
Hud och subkutan vävnad |
Hudutslag, klåda, urtikaria |
Vanliga |
Mindre vanliga |
|
Hudexfoliation, dermatit, kontaktdermatit, palmarerytrem |
Mindre vanliga |
Sällsynta |
|
|
Muskuloskeletala systemet och bindväv |
Artalgi, ryggvärk |
Vanliga |
Mindre vanliga |
|
Myalgi |
Mindre vanliga |
Mindre vanliga |
|
|
Muskuloskeletal smärta, muskuloskeletal stelhet, nacksmärta |
Mindre vanliga |
Sällsynta |
|
|
Njurar och urinvägar |
Hemoglobinuri |
Mindre vanliga |
Sällsynta |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Pyrexi |
Vanliga |
Vanliga |
|
Influensaliknande sjukdom, frossa, trötthet |
Vanliga |
Mindre vanliga |
|
|
Asteni |
Mindre vanliga |
Mindre vanliga |
|
|
Bröstsmärtor, reaktion på injektionsstället, sjukdomskänsla |
Mindre vanliga |
Sällsynta |
|
|
Undersökningar |
Förhöjt blodtryck, minskat antal vita blodkroppar, minskat hemoglobinvärde, förekomst av fritt hemoglobin, förhöjd sänka |
Mindre vanliga |
Sällsynt |
|
Skador och förgiftningar och behandlingskomplikationer |
Kontusion |
Mindre vanliga |
Sällsynta |
Pediatrisk population
Frekvens, typ och svårighetsgrad av biverkningar hos barn förväntas vara desamma som hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Överdosering kan leda till vätskeöverskott och hyperviskositet, särskilt hos riskpatienter, t.ex. barn, äldre patienter eller patienter med nedsatt hjärt- eller njurfunktion (se avsnitt 4.4).
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: immunsera och immunglobuliner: humant, normalt immunglobulin för intravaskulärt bruk
ATC-kod: J06B A02
Humant, normalt immunglobulin innehåller främst immunglobulin G (IgG) med ett brett spektrum av antikroppar mot infektiösa agens.
Humant normalt immunglobulin innehåller de IgG-antikroppar som finns hos normalpopulationen. Det framställs oftast från poolad plasma från minst 1000 donatorer. Det har en fördelning av immunglobulin G-subklasser som till stor del liknar den i normal human plasma. Adekvata doser av detta läkemedel kan återställa onormalt låga nivåer av immunglobulin G till normala nivåer. Verkningsmekanismen för andra indikationer än substitutionsbehandling är ännu inte helt klarlagd.
Gamunex är justerad till ett svagt surt pH. Eftersom Gamunex har en svag buffertkapacitet, neutraliseras det snabbt av blodet under infusionen. Även efter administrering av höga doser Gamunex registrerades ingen förändring av blodets pH. Osmolaliteten är 258 mOsmol/kg lösning och närmar sig alltså normalområdet (285–295 mOsmol/kg).
Kliniska prövningar utförda med Gamunex på patienter med kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP):
Effektprövningen IVIg-C CIDP (ICE-studien), en dubbelblind, randomiserad, placebokontrollerad studie, undersökte effekt och säkerhet med Gamunex vid behandling av CIDP. Totalt 117 CIDP-patienter randomiserades till att få antingen Gamunex eller placebo var tredje vecka. Laddningsdos var 2 g/kg kroppsvikt; underhållsdos var 1 g/kg kroppsvikt.
Frekvenserna av patienter som svarade på behandling (fastställt genom förbättrad INCAT-poäng och bibehållen förbättring på ≥1 under effektperioden på 24 veckor) var signifikant högre i gruppen som fick Gamunex (54 %) jämfört med placebogruppen (21 %, p=0,0002). Muskelstyrkan mätt med MRC-poäng och gripstyrka, samt känsel mätt med ISS-poäng förbättrades signifikant mer i gruppen som fick Gamunex jämfört med placebo.
På grund av det begränsade antalet patienter ≥65 år som inkluderades i studien, kunde exakt behandlingseffekt inte fastställas med avseende på INCAT-poängen. När det gällde gripstyrka visades en statistiskt signifikant behandlingseffekt till fördel för Gamunex.
Av de som svarade på behandling, svarade mindre än hälften efter laddningsdosen (vid vecka 3), men de flesta svarade efter den andra dosen (vid vecka 6). De som inte svarade på behandling fick gå över till den alternativa behandlingen, för att på nytt erhålla upp till högst 24 veckors behandling.
Alla som svarade på behandling randomiserades på nytt i en förlängningsfas för ännu en 6-månadersperiod av underhållsbehandling med antingen Gamunex eller placebo. Av de som tidigare svarade på Gamunex, var den verkliga relapsfrekvensen signifikant högre hos de patienter som randomiserats till att få placebo (42 %) än hos dem som randomiserats till att få Gamunex (13 %, p=0,012).
ICE-studien har visat korttids- och långtidseffekt av Gamunex vid behandling av CIDP. Resultaten sammanfattas i följande tabell.
|
Gamunex |
Placebo |
p |
|
|---|---|---|---|
|
Frekvens av patienter som svarade på behandling under effektperioden (primärt resultatmått) |
54 % |
21 % |
0,0002 |
|
Sannolikhet för relaps under förlängningsperioden |
13 % |
45 % |
0,013 |
|
Gripstyrka (kPA)1 (förändring från utgångsvärde) | |||
|
Dominant hand |
13,2 |
1,5 |
0,0008 |
|
Icke-dominant hand |
13,3 |
4,3 |
0,005 |
|
Muskelstyrka (MRC3 summapoäng)1 (förändring från utgångsvärde) |
3,3 |
0,2 |
0,001 |
|
Känslighet (ISS4-poäng)2 (förändring från utgångsvärde) |
-1,2 |
0,2 |
0,021 |
1 Förbättring indikeras med positiv siffra
2 Förbättring indikeras med negativ siffra
3 MRC: Medical Research Council
4 ISS: INCAT sensorisk summapoäng
Kliniska prövningar utförda med Gamunex på patienter med exacerbationer av myasthenia gravis:
En studie av Zinman et al. (2007), en randomiserad, dubbe-blind, placebo kontrollerad studie med 51 patienter, utvärderade Gamunex 2g/kg, gett som en engångsdos under 2 dagar i följd för behandling av myasthenia gravis (MG) exacerbationer. Primärt effektmått var förändringen från baslinjen i poängsystemet QMG på dag 14. På dag 14 var medelvärdet av ändringen i QMG-poäng -2,54 (p=0,047). En kliniskt relevant effekt på MG-exacerbationer observerades enbart i den subgrupp av patienter med moderat till allvarlig MG vid baslinjen (QMG-poäng >10.5) och en ändring med medelvärde -3,39 (p=0,010).
Ytterligare stöd kommer från en multicenter, prospektiv, öppen, icke-kontrollerad klinisk prövning, som även undersökte effekt och säkerhet för Gamunex vid behandling av myasthenia gravis-exacerbationer. Totalt rekryterades 49 patienter till den kliniska prövningen. Dessa fick en total engångsdos av Gamunex om 2 g/kg under 2 dagar i följd (en dos om 1 g/kg per dag). Inga patienter med antikroppar för MuSK deltog.
Primärt effektmått var förändringen i det kvantitativa poängsystemet Quantitative Myasthenia Gravis (QMG) från baslinjen (dag 0) till dag 14. Medelvärdet av OMG förändringen var -6,4 för den utvärderingsbara populationen och -6,7 för säkerhetspopulationen.
Analys av sekundära och explorativa effektmått (utvärderat genom QMG, MG-ADL och MG komposit-värden) stödde resultaten från det primära effektmåttet.
5.2 Farmakokinetiska egenskaper
Absorption
Humant normalt immunglobulin är omedelbart och fullt biotillgängligt i mottagarens cirkulation efter intravenös administrering.
Distribution
Det fördelas relativt snabbt mellan plasma och extravaskulär vätska. Jämvikt uppstår efter ungefär 3–5 dagar mellan intravaskulära och extravaskulära kompartment.
Eliminering
Humant normalt immunglobulin har en halveringstid på cirka 35 dagar, fastställd hos patienter med primär antikroppsbrist och överstiger därför de 21 dagar hos friska försökspersoner som beskrivs i litteraturen. Denna halveringstid kan dock variera från patient till patient, särskilt vid primär immunbrist.
IgG och IgG-komplex bryts ned i det mononucleära fagocytsystemets celler.
Pediatrisk population
Inga skillnader i farmakokinetiska egenskaper förväntas i den pediatriska populationen.
Mässlingsprofylax före/efter exponering
Inga kliniska studier har utförts på känsliga patienter avseende Mässlingsprofylax före/efter exponering.
Gamunex uppfyller kravet på specifikation av lägsta styrka för mässlingsantikroppar på 0,36 x Center for Biologics Evaluation and Research (CBER) Standard. Doseringen baseras på farmakokinetiska beräkningar som tar hänsyn till kroppsvikt, blodvolym och halveringstid för immunglobuliner. Dessa beräkningar förutspår en:
-
Serumtiter vid 13,5 dagar = 270 mIU/ml (dos: 0,4 g/kg). Detta ger en säkerhetsmarginal som är mer än dubbelt så hög som WHO:s skyddstiter på 120 mIU/ml.
-
Serumtiter efter 22 dagar (t1/2) = 180 mIU/ml (dos: 0,4 g/kg).
-
Serumtiter efter 22 dagar (t1/2) = 238,5 mIU/ml (dos: 0,53 g/kg – profylax före exponering).
5.3 Prekliniska säkerhetsuppgifter
Immunglobuliner är normala komponenter i människokroppen. Eftersom administrering av immunglobuliner i djurstudier kan leda till bildning av antikroppar, finns det begränsade prekliniska säkerhetsdata. I de akuta och subakuta djurstudier som genomfördes visade Gamunex inte några särskilda risker för människa.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Glycin, vatten för injektionsvätskor.
6.2 Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel förutom de som nämns i avsnitt 6.6.
6.3 Hållbarhet
3 år
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C–8°C). Får ej frysas. Förvaras i ytterkartongen.
Läkemedlet kan förvaras i ytterkartongen under en engångsperiod på upp till 6 månader i rumstemperatur (högst 25°C). I detta fall går läkemedlets hållbarhetstid ut i slutet av denna 6-månadersperiod. Det nya utgångsdatumet måste noteras på ytterkartongen. Det nya utgångsdatumet får inte vara ett senare datum än det tryckta utgångsdatumet. Därefter måste läkemedlet användas omgående eller destrueras. Förvaring i kylskåp eller frys efter detta datum är inte möjlig.
6.5 Förpackningstyp och innehåll
Intravenös infusionsvätska, lösning, i injektionsflaskor av typ I- eller II-glas med proppar av klorbutyl.
Förpackningsstorlekar:
En injektionsflaska om 10 ml innehåller: 1 g humant normalt immunglobulin
En injektionsflaska om 50 ml innehåller: 5 g humant normalt immunglobulin
En injektionsflaska om 100 ml innehåller: 10 g humant normalt immunglobulin
En injektionsflaska om 200 ml innehåller: 20 g humant normalt immunglobulin
En injektionsflaska om 400 ml innehåller: 40 g humant normalt immunglobulin
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
6.6 Särskilda anvisningar för destruktion
Före infusion måste Gamunex värmas till rums- eller kroppstemperatur. Lösningen ska vara klar eller något opaliserande och färglös eller svagt gul. Lösningar som är grumliga eller innehåller partiklar skall inte användas.
Kvarvarande produkt eller avfall ska kasseras enligt gällande lokala krav.
När behållaren har öppnats ska innehållet infunderas omedelbart. Efterföljande förvaring, även i kylskåp, är inte tillåtet på grund av möjlig mikrobiell kolonisering.
Om spädning är nödvändig före infusion, kan 50 mg/ml glukoslösning användas för detta ändamål. Gamunex får inte blandas med koksaltlösning.
Gamunex och heparin får inte administreras samtidigt i samma infusionssystem.
Infusionsslangarna kan spolas med 50 mg/ml glukoslösning eller med natrtiumkloridlösning (9 mg/ml) och skall inte spolas med heparin.
Heparin Lock, genom vilken Gamunex har administrerats, ska spolas med 50 mg/ml glukoslösning eller natriumkloridlösning (9 mg/ml) och ska inte spolas med heparin.
Bruksanvisning för injektionsflaskor (endast injektionsflaskor på 50 ml, 100 ml, 200 ml och 400 ml)
Injektionsflaskorna levereras med en hängetikett (fig. 1). Efter isättning av infusionssetet (fig. 2), vänd injektionsflaskan upp och ned och etikettens ögla viks bakåt (fig. 3). Tryck hårt med fingrarna för att skapa ett veck på vardera sidan av öglan där den sitter ihop med resten av etiketten (fig. 4). Häng upp injektionsflaskan på infusionsstativet i den ögla som bildats (fig. 5).
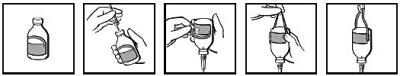
|
||||
|
Fig. 1 |
Fig. 2 |
Fig. 3 |
Fig. 4 |
Fig. 5 |
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Grifols Deutschland GmbH
Colmarer Straße 22
60528 Frankfurt
Tyskland
Tfn: +49 69-660 593 100
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
23484
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 2008-04-04
Förnyat godkännande: 2011-06-08
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
2022-11-10





