Indikationer
Lodotra är indicerat för behandling av måttlig till svår aktiv reumatoid artrit, i synnerhet vid åtföljande morgonstelhet hos vuxna.
Kontraindikationer
Lodotra är kontraindicerat till patienter som är överkänsliga mot den aktiva substansen eller mot något hjälpämne.
Dosering
Dosering
Lämplig dos beror på tillståndets svårighetsgrad och den enskilda patientens svar. I allmänhet rekommenderas 10 mg prednison som startdos.
I vissa fall kan en högre initialdos behövas (t.ex. 15 eller 20 mg prednison). Beroende på de kliniska symtomen och patientens svar kan initialdosen stegvis minskas till en lägre underhållsdos.
Vid övergång från standardbehandling (glukokortikoidadministrering på morgonen) till Lodotra som ges vid sänggåendet (omkring kl. 22) skall samma dos (motsvarande prednison i mg) behållas. Efter övergången kan dosen justeras utifrån den kliniska situationen.
Vid långtidsbehandling av reumatoid artrit skall den individuella dosen på upp till 10 mg prednison dagligen justeras utifrån sjukdomsförloppets svårighetsgrad.
Beroende på terapisvaret kan dosen minskas i steg om 1 mg varannan till var fjärde vecka tills lämplig underhållsdos uppnås.
Om behandlingen med Lodotra skall avbrytas, skall dosen minskas i steg om 1 mg varannan till var fjärde vecka, med övervakning av hypofys-binjure-axelparametrar vid behov.
Pediatrisk population
Användning till barn och ungdomar rekommenderas inte eftersom dokumentationen med avseende på tolerabilitet och effektivitet är otillräcklig.
Administreringssätt
Lodotra skall tas vid sänggåendet (omkring kl. 22) tillsammans med eller efter ett kvällsmål och sväljas hela tillsammans med tillräcklig mängd vätska. Om det har gått mer än 2–3 timmar sedan kvällsmålet, bör Lodotra tas tillsammans med en lätt måltid eller mellanmål (t.ex. en smörgås med skinka eller ost). Lodotra skall inte tas fastande. Det kan resultera i minskad biotillgänglighet.
Lodotra är utformad så att den aktiva substansen frisätts med en fördröjning på omkring 4–6 timmar efter intag. Frisättningen av den aktiva substansen och de farmakologiska effekterna börjar på natten.
Lodotra tabletter med modifierad frisättning består av en kärna som innehåller prednison och en inert dragering. Den fördröjda frisättningen av prednison är beroende av att drageringen är intakt. Därför får tabletterna med modifierad frisättning inte brytas, delas eller tuggas.
Hos patienter med hypotyreoidism eller levercirros kan jämförelsevis låga doser vara tillräckliga eller så kan dosreduktion vara nödvändig.
Varningar och försiktighet
En prednisonbaserad läkemedelsbehandling bör endast ges då det är absolut nödvändigt och skall åtföljas av lämplig behandling mot infektioner vidföljande tillstånd:
- Akuta virusinfektioner (herpes zoster, herpes simplex, varicella, herpetisk keratit)
- HBsAg-positiv kronisk aktiv hepatit
- Cirka 8 veckor före och 2 veckor efter immunisering med levande vacciner
- Systemiska mykoser och parasitoser (t.ex. nematoder)
- Poliomyelit
- Lymfadenit efter BCG-ympning
- Akuta och kroniska bakterieinfektioner
- Tuberkulos i anamnesen (försiktighet: reaktivering!). På grund av de immunsuppressiva egenskaperna kan glukokortikoider inducera eller förvärra infektioner. Patienterna skall följas noga, t.ex. genom att tuberkulintest utförs. Patienter som löper speciell risk skall erhålla tuberkulostatisk behandling.
Prednisonbaserad läkemedelsbehandling skall dessutom endast ges då det är nödvändigt och skall vid behov åtföljas av lämplig terapi om något av följande tillstånd förekommer:
- Sår i magtarmkanalen
- Allvarlig osteoporos och osteomalaci
- Svårkontrollerad hypertoni
- Svår diabetes mellitus
- Psykiska rubbningar (även i patientens anamnes)
- Glaukom med sluten eller öppen kammarvinkel
- Hornhinnesår och skador på hornhinnan
På grund av risken för tarmperforation skall prednison endast användas om det är absolut nödvändigt och med adekvat uppföljning vid:
- Svår ulcerös kolit med hotande perforation
- Divertikulit
- Enteroanastomos (omedelbart postoperativt)
De önskade plasmakoncentrationerna av prednison kan inte uppnås med Lodotra om det tas under fastande förhållanden. Lodotra skall därför alltid tas tillsammans med ett kvällsmål för att försäkra sig om att effekten blir tillräcklig. Vid dosering med Lodotra uppnåddes endast låga plasmakoncentrationer efter 6-7% av doseringstillfällena i de farmakokinetiska studierna, i en enskild studie var andelen med låg plasma koncentration 11% när det intogs enligt rekommendationerna. Detta bör beaktas när Lodotra inte är tillräckligt effektivt. I dessa situationer kan ett byte till behandling med konventionella tabletter med omedelbar frisättning övervägas.
Lodotra skall inte ersättas med prednisontabletter med omedelbar frisättning i samma behandlingsregim eftersom Lodotra har fördröjd frisättning.
Vid byte, utsättning eller avbrott i långtidsbehandling, bör följande risker beaktas: Reaktivering av reumatoid sjukdomsaktivitet, akut binjuresvikt (speciellt i samband med stressituationer som t.ex. infektioner, efter olyckor, i samband med ökad fysisk belastning), kortisonutsättningssyndrom.
På grund de farmakologiska egenskaperna skall Lodotra inte ges vid akuta indikationer som ersättning för prednisontabletter med omedelbar frisättning.
Under den tid Lodotra används bör ett eventuellt ökat behov av insulin eller orala antidiabetika utredas. Patienter med diabetes mellitus bör därför följas noga under behandlingen.
Under behandlingen med Lodotra krävs regelbundna blodtryckskontroller hos patienter med svårkontrollerad hypertoni.
Patienter med svår hjärtinsufficiens måste övervakas noga på grund av risken för försämring av tillståndet. Försiktighet krävs när kortikosteroider, inklusive prednison, förskrivs till patienter med nyligen genomgången hjärtinfarkt på grund av risken för hjärtruptur.
Försiktighet krävs när kortikosteroider, inklusive prednison, förskrivs till patienter med nedsatt njurfunktion
Sömnstörningar har visats vara vanligare förekommande med Lodotra än med konventionella beredningar med omedelbar frisättning som tas på morgonen. Om sömnlöshet uppträder kan byte till en konventionell beredning med omedelbar frisättning rekommenderas.
Behandlingen med Lodotra kan även dölja tecken och symtom på en befintlig eller begynnande infektion och kan sålunda göra det svårare att ställa diagnos.
Även vid låga doser medför långtidsanvändning av Lodotra en ökad risk för infektion. Dessa möjliga infektioner kan även framkallas av mikroorganismer som endast i sällsynta fall orsakar infektion under normala förhållanden (så kallade opportunistiska infektioner).
Vissa virussjukdomar (vattkoppor, mässling) kan få ett allvarligare förlopp hos patienter som behandlas med glukokortikoider. Immunsupprimerade personer utan tidigare vattkopps- eller mässlingsinfektion är speciellt i riskzonen. Om dessa personer, under tiden de behandlas med Lodotra, har kontakt med personer som är infekterade med vattkoppor eller mässling, skall en preventiv behandling inledas, om det behövs.
Hos patienter med känd eller misstänkt Strongyloides (springmask) infestation kan glukokortikoider leda till Strongyloides hyperinfektion och spridning med utbredd larvmigration.
Vaccinationer med inaktiverade vacciner är i allmänhet möjliga. Hänsyn måste dock tas till att immunsvaret och följaktligen resultatet av vaccinationen kan bli sämre med glukokortikoider i höga doser.
Vid långvarig terapi med Lodotra rekommenderas regelbunden klinisk uppföljning (inklusive oftalmologiska undersökningar med tre månaders intervall). Om jämförelsevis höga doser ges, måste tillräcklig tillförsel av kaliumtillskott och begränsning av natrium säkerställas samtidigt som serumkaliumnivåerna skall övervakas.
Vid kraftig fysiologisk stress orsakad av vissa händelser (olyckor, operation etc.) under behandlingen med Lodotra, kan en tillfällig dosökning vara nödvändig.
Beroende på behandlingstiden och den använda dosen bör en negativ inverkan på kalciummetabolismen förväntas. Osteoporosprofylax rekommenderas därför och är speciellt viktig om det finns andra riskfaktorer (inklusive familjär predisposition, hög ålder, postmenopausal status, otillräckligt intag av protein och kalcium, storrökning, hög alkoholkonsumtion eller minskad fysisk aktivitet). Profylax baseras på tillräcklig tillförsel av kalcium och D-vitamin samt på fysisk aktivitet. Vid manifest osteoporos skall ytterligare terapi övervägas.
Detta läkemedel innehåller laktosmonohydrat. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist, glukos-galaktosmalabsorption.
Vid användning av prednisolon i höga doser under en längre tid (30 mg/dag i minst 4 veckor) har reversibla störningar av spermatogenesen iakttagits, vilka kvarstod i flera månader efter att läkemedlet satts ut.
Interaktioner
Hjärtglykosider: Effekten av glykosiderna kan förstärkas av kaliumbrist.
Saluretika/laxermedel: Kaliumutsöndringen ökar.
Medel mot diabetes: Den blodsockersänkande effekten minskar.
Kumarinderivat: Effekten av antikoagulantia av kumarintyp kan minska eller öka.
Icke-steroida antiflogistiska/antireumatiska medel, salicylater och indometacin: Det finns ökad risk för magtarmblödningar.
Icke-depolariserande muskelrelaxerande medel: Muskelrelaxeringen kan bli förlängd.
Atropin och andra antikolinergika: Samtidig användning av Lodotra kan resultera i ytterligare ökat intraokulärt tryck.
Prazikvantel: Glukokortikoider kan minska koncentrationerna av prazikvantel i blodet.
Klorokin, hydroxyklorokin, meflokin: Det finns en ökad risk för myopatier, kardiomypatier.
Somatropin: Effekten av somatropin kan minska.
Östrogener (t.ex. perorala preventivmedel): Kan förstärka effekten av glukokortikoider.
Lakrits: Möjlig hämning av metabolismen av glukokortikoider.
Rifampicin, fenytoin, barbiturater, bupropion och primidon: Effekten av glukokortikoider minskar.
Ciklosporin: Ciklosporinnivåerna i blod ökar. Risken för krampanfall ökar.
Amfotericin B: Eventuellt ökad risk för hypokalemi.
Cyklofosfamid: Eventuellt förstärkta effekter av cyklofosfamid.
ACE-hämmare: Ökad risk för förändringar i blodstatus.
CYP3A-hämmare: Samtidig behandling med CYP3A-hämmare, inklusive läkemedel som innehåller kobicistat, väntas öka risken för systemiska biverkningar. Kombinationen ska undvikas såvida inte nyttan uppväger den ökade risken för systemiska biverkningar av kortikosteroider, och om så är fallet ska patienter övervakas avseende systemiska biverkningar av kortikosteroider.
Antacida innehållande aluminium och magnesium: Absorptionen av glukokortikoider minskar. Eftersom Lodotra har fördröjd absorption är en interaktion mellan prednison och aluminium/magnesium-antacida osannolik.
Påverkan på diagnostiska metoder: Hudreaktioner som orsakas av allergitester kan dämpas. TSH-ökning efter tillförsel av protirelin kan minska.
Graviditet
Graviditet
Lodotra skall användas under graviditet endast då fördelarna överväger de potentiella riskerna. Den lägsta effektiva Lodotra-dos som behövs för att bibehålla adekvat sjukdomskontroll skall användas.
Djurstudier tyder på att administrering av farmakologiska doser av glukokortikoider under graviditet kan öka risken för intrauterin tillväxthämning hos fostret, kardiovaskulär och/eller metabolisk sjukdom hos vuxna samt kan ha effekt på glukokortikoidreceptordensiteten och neurotransmittoromsättningen eller den neuropsykologiska utvecklingen.
Prednison har orsakat gomspalt i djurstudier. Diskussioner pågår om möjligheten av en ökad risk för utveckling av gomspalt hos ett mänskligt foster, till följd av administrering av glukokortikoider under den första trimestern.
Om glukokortikoider administreras mot slutet av graviditeten finns en risk för atrofi av fostrets binjurebark, vilket kan kräva ersättningsterapi hos det nyfödda barnet. Behandlingen av barnet måste minskas långsamt.
Amning
Glukokortikoider passerar över i bröstmjölk i små mängder (upp till 0,23 % av en engångsdos). För doser upp till 10 mg dagligen ligger den mängd som intas via bröstmjölk under detektionsnivån. Hittills har ingen skada hos spädbarn rapporterats. Glukokortikoider skall ändå förskrivas endast när fördelarna för moder och barn överväger riskerna.
Eftersom koncentrationskvoten för mjölk/plasma ökar med doser över 10 mg/dag (t.ex. påträffas 25 % av serumkoncentrationen i bröstmjölken vid 80 mg prednison dagligen), rekommenderas att amning avbryts i sådana fall.
Amning
Glukokortikoider passerar över i bröstmjölk i små mängder (upp till 0,23 % av en engångsdos). För doser upp till 10 mg dagligen ligger den mängd som intas via bröstmjölk under detektionsnivån. Hittills har ingen skada hos spädbarn rapporterats. Glukokortikoider skall ändå förskrivas endast när fördelarna för moder och barn överväger riskerna.
Eftersom koncentrationskvoten för mjölk/plasma ökar med doser över 10 mg/dag (t.ex. påträffas 25 % av serumkoncentrationen i bröstmjölken vid 80 mg prednison dagligen), rekommenderas att amning avbryts i sådana fall.
Trafik
Inga studier har utförts.
Biverkningar
Frekvens och svårighetsgrad av de biverkningar som redovisas nedan beror på dosering och behandlingstid. Inom det rekommenderade dosintervallet för Lodotra (kortikoidterapi i låg dos med dagliga doser på mellan 1 och 10 mg) förekommer de redovisade biverkningarna mindre ofta och med lägre svårighetsgrad jämfört med doser över 10 mg.
Följande biverkningar kan förekomma beroende på behandlingstid och dosering:
mycket vanliga (≥1/10), vanliga (≥1/100 till <1/10), mindre vanliga (≥1/1 000 till <1/100), sällsynta (≥1/10 000 till <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data)
Blodet och lymfsystemet:
Vanliga: Måttlig leukocytos, lymfopeni, eosinopeni, polycytemi
Hjärtat
Ingen känd frekvens: Takykardi
Immunsystemet:
Vanliga: Nedsatt immunförsvar, maskering av infektioner, förvärrande av latenta infektioner
Sällsynta: Allergiska reaktioner
Infektioner och infestationer
Vanliga: Ökar känsligheten för och svårighetsgraden av infektioner
Endokrina systemet:
Vanliga: Binjuresuppression och induktion av Cushings syndrom (typiska symtom: månformat ansikte, fetma på överkroppen, plethora)
Sällsynta: Störd insöndring av könshormon (amenorré, impotens), störning av sköldkörtelfunktionen
Metabolism och nutrition:
Vanliga: Natriumretention med ödem, ökad kaliumutsöndring (försiktighet: arytmier), ökad aptit och viktökning, minskad glukostolerans, diabetes mellitus, hyperkolesterolemi och hypertriglyceridemi
Ingen känd frekvens: Reversibel epidural, epikardiell eller mediastinal lipomatos, hypokalemisk alkalos
Psykiska störningar:
Vanliga: Sömnlöshet
Sällsynta: Depression, irritabilitet, eufori, ökad impulsivitet, psykos
Centrala och perifera nervsystemet:
Vanliga: Huvudvärk.
Sällsynta: Pseudotumör cerebri, manifestation av en latent epilepsi och ökad predisponering för att utveckla anfall vid manifest epilepsi.
Ögon:
Vanliga: Katarakt, i synnerhet med bakre subkapsulär grumling, glaukom
Sällsynta: Aggravation av symtom i samband med hornhinnesår, främjande av virus-, svamp- och bakterieinflammationer i ögat
Ingen känd frekvens: Central serös korioretinopati
Blodkärl:
Mindre vanliga: Hypertoni, ökad risk för arterioskleros och trombos, vaskulit (även utsättningssyndrom efter långvarig terapi)
Magtarmkanalen:
Mindre vanliga (utan samtidig behandling med NSAID): Gastrointestinala sår, gastrointestinala blödningar
Sällsynta: Pankreatit
Ingen känd frekvens: Illamående, diarré, kräkning
Hud och subkutan vävnad:
Vanliga: Striae rubrae, atrofi, telangiektasi, ökad kapillärskörhet, petekier, ekkymoser
Mindre vanliga: Hypertrikos, steroid acne, fördröjd sårläkning, rosacealiknande (perioral) dermatit, förändrad hudpigmentering
Sällsynta: Överkänslighetsreaktioner, t.ex. läkemedelsexantem
Ingen känd frekvens: Hirsutism
Muskuloskeletala systemet och bindväv:
Vanliga: Muskelatrofi och muskelsvaghet, osteoporos (dosrelaterat, kan förekomma även vid korttidsanvändning)
Sällsynta: Aseptisk osteonekros (överarmsbenets huvud och lårbenshuvudet)
Ingen känd frekvens: Steroid myopati, senruptur, kot och benfrakturer
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Överdosering
Inga fall av överdosering av Lodotra har rapporterats. Vid överdosering kan en ökning av biverkningarna, i synnerhet endokrina, metaboliska och elektrolytrelaterade effekter förväntas.
Det finns ingen känd antidot mot prednison.
Farmakodynamik
Prednison är en icke-fluorerad glukokortikoid för systemisk terapi.
Prednison uppvisar en dosberoende effekt på metabolismen i nästan alla vävnader. Under fysiologiska förhållanden är dessa effekter mycket viktiga för att upprätthålla organismens homeostas i vila och under stress samt för kontroll av aktiviteterna i immunsystemet.
I doser som normalt förskrivs för Lodotra har prednison en omedelbar antiinflammatorisk (antiexsudativ och antiproliferativ) effekt och en fördröjd immunsuppressiv effekt. Det hämmar kemotaxi och immuncellernas aktivitet samt frisättningen och effekten hos mediatorer av inflammatoriska reaktioner och immunreaktioner, t.ex. hos lysosomala enzymer, prostaglandiner och leukotriener.
Långtidsbehandling med höga doser resulterar i försämrat svar av immunsystemet och av binjurebarken. Den mineralotropa effekt som är uttalad hos hydrokortison kan fortfarande detekteras hos prednison och kan kräva övervakning av elektrolytnivåerna i serum.
Hos patienter med reumatoid artrit når proinflammatoriska cytokiner som t.ex. interleukinerna IL-1 och IL-6 och tumörnekrosfaktor-alfa (TNFα) maximala plasmanivåer under de tidiga morgontimmarna (t.ex. IL-6 mellan kl. 07 och 08). Cytokinkoncentrationerna minskar efter administrering av Lodotra och efterföljande frisättning av prednison under natten (med start av absorptionen mellan kl. 02–04 och Cmax mellan kl. 04–06).
Effekten och säkerheten av Lodotra bedömdes i två randomiserade, dubbelblinda studier i patienter med aktiv reumatoid artrit.
I den första studien, en multicenter, randomiserad, dubbelblind fas III-studie under 12 veckor med totalt 288 patienter som förbehandlats med prednison eller prednisolon uppvisade den grupp som bytte till Lodotra med samma dos en genomsnittlig minskning på 23 % av durationen av morgonstelhet, medan durationen i referensgruppen inte ändrades. Detaljer presenteras i följande tabell.
|
Relativ förändring [%] |
Lodotra (n = 125) |
Prednison (omedelbar frisättning) (n = 129) |
|
Medelvärde (SD) Median (min, max) |
–23 (89) –34 (–100, 500) |
0 (89) –13 (–100, 610) |
I en efterföljande öppen uppföljningsfas (9 månaders behandling) var den genomsnittliga relativa förändringen av duration av morgonstelhet jämfört med baslinjen omkring 50 %.
|
Lodotra |
||
|---|---|---|
|
Duration av morgonstelhet [min] |
Medelvärde (SD) |
N |
|
0 månader Start av studien |
156 (97) |
142 |
|
12 månader Slut på öppen fas |
74 (92) |
103 |
I samma studie iakttogs efter 12 veckors behandling en medianminskning av proinflammatoriskt cytokin IL-6 på 29 % i gruppen som behandlades med Lodotra, medan ingen förändring iakttogs i referensgruppen som erhöll standardprednison. Efter 12 månaders behandling med Lodotra var IL-6-nivån fortfarande stabil.
|
Lodotra |
||
|---|---|---|
|
IL-6 [IE/l] |
median (min, max) |
N |
|
0 månader Start av studien |
860 (200, 23 000) |
142 |
|
12 månader Slut på öppen fas |
470 (200, 18 300) |
103 |
Värden <200 IE/l angavs till 200 IE/l för statistiska analyser
Effekten av Lodotra som tilläggsbehandling till DMARD konfirmerades i den andra randomiserade, placebokontrollerade studien i patienter som inte svarade tillfredsställande på endast DMARD. Efter 12 veckor hade Lodotra patienterna ett signifikant högre behandlingssvar i form av ACR20 och ACR50 (46,8% respektive 22,1%) jämfört med placebo patienterna (29,4% respektive 10,1%). Det var också en större medelförändring i DAS 28 graderingen från baslinjen (5,2 för Lodotra gruppen och 5,1 för placebo gruppen) till vecka 12 i Lodotra gruppen (-1,2) jämfört med vad man såg i placebo gruppen (-0,7).
Dessutom var varaktigheten av morgonstelheten efter 12 veckors behandling i medel 86,0 minuter (-66 minuters skillnad) i Lodotra gruppen och 114,1 minuter (-42,6 minuters skillnad ) i placebo gruppen.
Lodotra kan säkert användas i kombination med andra DMARD.
Farmakokinetik
Absorption:
Lodotra är tabletter med modifierad frisättning som innehåller prednison. Prednison frisätts mellan 4–6 timmar efter intag av Lodotra. Därefter absorberas prednison snabbt och nästan fullständigt.
Distribution:
Maximala serumnivåer uppnås omkring 6–9 timmar efter intag.
Metabolism:
Mer än 80 % av prednisonet omvandlas till prednisolon vid första passage-metabolismen i levern. Förhållandet mellan prednison och prednisolon är cirka 1:6 till 1:10. Prednison i sig har försumbara farmakologiska effekter. Prednisolon är den aktiva metaboliten. Föreningarna är reversibelt bundna till plasmaproteiner med hög affinitet till transkortin (kortikosteroidbindande globulin, CBG) och låg affinitet till plasmaalbumin.
I det lägre dosintervallet (upp till 5 mg) förekommer cirka 6 % fritt prednisolon. Utsöndringen via metabolism är doslinjär i detta intervall. I dosintervallet över 10 mg är transkortinets bindningskapacitet allt mer förbrukad och det förekommer mer fritt prednisolon. Detta kan resultera i en snabbare utsöndring via metabolisering.
Elimination:
Prednisolon utsöndras primärt genom levermetabolism, till omkring 70 % genom glukoronidering och till omkring 30 % genom sulfatering. Det sker även omvandling till
11ß, 17ß-dihydroxiandrosta-1,4-dien-3-on och till 1,4-pregnadien-20-ol. Metaboliterna uppvisar ingen hormonell aktivitet och genomgår primärt njurelimination. Försumbara mängder prednison och prednisolon påträffas oförändrade i urinen. Elimineringshalveringstiden i plasma för prednis(ol)on är cirka 3 timmar. Hos patienter med svår leverfunktionsnedsättning kan halveringstiden vara förlängd och en dosminskning bör övervägas. Durationen av de biologiska effekterna av prednis(ol)on överskrider durationen av förekomsten i serum.
Biotillgänglighet
En biotillgänglighetsstudie hos 27 friska deltagare som genomfördes 2003 visade följande resultat i jämförelse med en prednisontablett med omedelbar frisättning:
|
Parameter |
Lodotra 5 mg: 2,5 timmar efter en lätt måltid |
Lodotra 5 mg: Omedelbart efter en måltid |
Referens- preparat 5 mg fastande |
|---|---|---|---|
|
Maximal plasma¬koncentration (Cmax): ng/ml |
20,2 (18,5; 21,9) |
21,8 (20,0; 23,7) |
20,7 (19,0; 22,5) |
|
Tid till maximal plasma¬koncentration (tmax): h |
6,0 (4,5; 10,0) |
6,5 (4,5; 9,0) |
2,0 (1,0; 4,0) |
|
Duration av fördröjningen av läkemedels¬frisättning (tlag): h |
4,0 (3,5; 5,0) |
3,5 (2,0; 5,5) |
0,0 (0,0; 0,5) |
|
Område under koncentration-tid-kurvan (AUC 0–∞): ng x h/ml |
110 (101; 119) |
123 (114; 133) |
109 (101; 118) |
Värdena är geometriska minstakvadratmedelvärden och -intervall
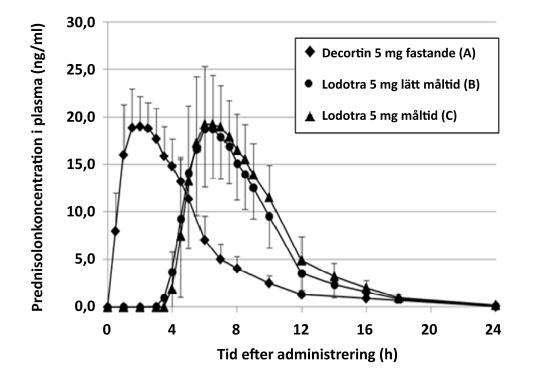
Bild: Genomsnittliga prednisonnivåer i plasma efter en engångsdos på 5 mg prednison administrerad som Lodotra 5 mg eller en tablett med omedelbar frisättning. 5 mg-tablett med omedelbar frisättning (A: fastande, intag kl. 2), Lodotra 5 mg (B: 2,5 timmar efter ett lätt kvällsmål) och Lodotra 5 mg (C: omedelbart efter ett fullständigt kvällsmål).
Plasmakoncentrationsprofilerna för Lodotra är mycket lika en tablett med omedelbar frisättning med den viktiga skillnaden att Lodotra-profilen är fördröjd med 4–6 timmar efter intag av läkemedlet. Lägre plasmakoncentrationer har iakttagits efter 6–7 % av doserna.
Dosproportionalitet påvisades för Lodotra 1 mg, 2 mg och 5 mg, baserat på AUC och Cmax.
Prekliniska uppgifter
Subkronisk/kronisk toxicitet
Ljus- och elektronmikroskopiska förändringar iakttogs i de Langerhanska cellöarna hos råttor efter daglig intraperitoneal administrering av 33 mg/kg kroppsvikt i 7 till 14 dagar. Hos kaniner kunde experimentell leverskada produceras genom administrering av 2 till 3 mg/kg kroppsvikt/dag i 2 till 4 veckor. Histotoxiska effekter (myonekroser) rapporterades efter flera veckors administrering av 0,5 till 5 mg/kg kroppsvikt till marsvin och 4 mg/kg kroppsvikt till hundar.
Mutagen och tumörbildande potential
Den toxicitet som iakttagits vid djurstudier med prednison kan förknippas med överdriven farmakologisk aktivitet. Inga genotoxiska effekter av prednison har iakttagits vid konventionella genotoxicitetstester.
Reproduktionstoxicitet
I reproduktionsstudier på djur har glukokortikoider som t.ex. prednison påvisats framkalla missbildningar (gomspalt, skelettmissbildningar). Vid parenteral administrering har mindre missbildningar av skalle, käke och tunga setts hos råttor. Intrauterin tillväxthämning har setts.
Det anses osannolikt att liknande effekter inträffar hos patienter vid terapeutiska doser.
Innehåll
Kvalitativ och kvantitativ sammansättning
Lodotra 1 mg:
En tablett med modifierad frisättning innehåller 1 mg prednison.
Lodotra 2 mg:
En tablett med modifierad frisättning innehåller 2 mg prednison.
Lodotra 5 mg:
En tablett med modifierad frisättning innehåller 5 mg prednison.
Hjälpämne med känd effekt: Laktos
Lodotra 1 mg:
En tablett med modifierad frisättning innehåller 42,80 mg laktos.
Lodotra 2 mg:
En tablett med modifierad frisättning innehåller 41,80 mg laktos.
Lodotra 5 mg:
En tablett med modifierad frisättning innehåller 38,80 mg laktos.
Förteckning över hjälpämnen
Tablettkärna:
Kolloidal vattenfri kiseldioxid
Kroskarmellosnatrium
Laktosmonohydrat
Magnesiumstearat
Povidon K 29/32
Röd järnoxid E 172
Tablettdragering:
Kolloidal vattenfri kiseldioxid
Kalciumvätefosfatdihydrat
Glyceroldibehenat
Magnesiumstearat
Povidon K 29/32
Gul järnoxid E 172
Blandbarhet
Ej relevant
Hållbarhet, förvaring och hantering
Hållbarhet
2 år
Hållbarhetstid efter första öppnandet av burken: 14 veckor.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Särskilda anvisningar för destruktion
Inga särskilda anvisningar.
Förpackningsinformation
Tablett med modifierad frisättning 1 mg
Svagt gulvit cylindrisk tablett med modifierad frisättning märkt med NP1 på ena sidan.
Tablett med modifierad frisättning 2 mg
Gulvit cylindrisk tablett med modifierad frisättning märkt med NP2 på ena sidan
Tablett med modifierad frisättning 5 mg
Ljusgul cylindrisk tablett med modifierad frisättning märkt med NP5 på ena sidan.


