Indikationer
NeoRecormon är indicerat för:
-
Behandling av symtomgivande anemi vid kroniskt nedsatt njurfunktion hos vuxna och barn.
-
Förebyggande av anemi hos prematura barn med en födelsevikt på 750 till 1500 g och en fosterålder på mindre än 34 veckor.
-
Behandling av symtomgivande anemi hos vuxna patienter med icke-myeloida maligniteter som behandlas med kemoterapi.
-
Öka mängden autologt blod hos patienter i ett predonationsprogram
Användning vid denna indikation måste vägas mot den rapporterade ökade risken för tromboemboli. Behandling skall endast ges till patienter med måttlig anemi (Hb 10 - 13 g/dl [6,21 - 8,07 mmol/l], utan järnbrist) om lagringsmöjligheter av blod saknas eller är otillräckliga när den planerade, omfattande elektiva operationen kräver en stor mängd blod (4 eller fler enheter blod för kvinnor och 5 eller fler enheter för män). Se Farmakodynamik.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som angesunder Innehåll.
Dåligt kontrollerad hypertoni.
Vid indikationen “Behandling för att öka mängden autologt blod”: hjärtinfarkt eller stroke månaden före behandling, instabil angina pectoris, ökad risk för djup ventrombos t.ex. venös tromboembolisk sjukdomshistoria.
Dosering
Behandling med NeoRecormon skall initieras av läkare med erfarenhet av ovan nämnda indikationer. Då anafylaktiska reaktioner har iakttagits hos enstaka patienter, rekommenderas att första dosen ges under medicinsk övervakning.
Dosering
Behandling av symtomgivande anemi hos vuxna patienter och barn med kroniskt nedsatt njurfunktion
Anemisymtom och följdsymtom kan variera med ålder, kön och total sjukdomsbörda. En läkares utvärdering av den enskilda patientens kliniska tillstånd och kondition är nödvändig. NeoRecormon ska administreras subkutant eller intravenöst för att öka hemoglobin till en nivå som inte överstiger 12 g/dl (7,45 mmol/l). Subkutan användning är att föredra hos patienter som inte erhåller hemodialys för att undvika punktion av perifera vener.
Vid intravenös administration skall lösningen injiceras under ungefär 2 minuter, d.v.s. hos hemodialyspatienter via den arteriovenösa fisteln i slutet av dialysbehandlingen.
På grund av variabilitet inom patienter kan enstaka individuella hemoglobinvärden för en patient observeras över eller under den önskade hemoglobinnivån. Variabilitet i hemoglobin bör hanteras genom dosändringar, med hänsyn tagen till målintervallet för hemoglobin mellan 10 g/dl (6,21 mmol/l) och 12 g/dl (7,45 mmol/l). En bibehållen hemoglobinnivå över 12 g/dl (7,45 mmol/l) bör undvikas. Vägledning för lämplig dosjustering när hemoglobinvärden överstigande 12 g/dl (7,45 mmol/l) observeras beskrivs nedan.
En ökning i hemoglobin på mer än 2 g/dl (1,25 mmol/l) under en fyraveckorsperiod bör undvikas. Om det inträffar bör lämplig dosjustering göras. Om ökningen av hemoglobin är större än 2 g/dl (1,25 mmol/l) under en månad eller om hemoglobinnivån ökar och närmar sig 12 g/dl (7,45 mmol/l), ska dosen reduceras med ungefär 25 %. Om hemoglobinnivån fortsätter att öka bör behandlingen avbrytas. När hemoglobinnivån börjar minska bör behandlingen återupptas med en dos som är ungefär 25 % lägre än den tidigare givna dosen.
Patienter bör kontrolleras noggrant för att säkerställa att den lägsta godkända effektiva dosen av NeoRecormon används för att tillgodose adekvat kontroll av anemisymtomen samtidigt som en hemoglobinkoncentration under eller vid 12 g/dl (7,45 mmol/l) upprätthålls.
Försiktighet bör iakttas vid upptrappning av NeoRecormon-dosen hos patienter med kronisk njursvikt. Hos patienter med ett dåligt hemoglobinsvar på NeoRecormon bör alternativa förklaringar till det dåliga svaret övervägas (se Varningar och försiktighet och Farmakodynamik).
Vid hypertoni eller kardiovaskulära-, cerebrovaskulära- eller perifera kärlsjukdomar skall hemoglobinökningen per vecka och målvärdet för hemoglobin bestämmas individuellt med hänsyn tagen till den kliniska bilden.
Behandlingen med NeoRecormon indelas i två faser.
-
Korrektionsfasen
-
Subkutan administration:
Initialdosen är 3 x 20 IE/kg kroppsvikt och vecka. Dosen kan ökas var fjärde vecka med 3 x 20 IE/kg och vecka om ökningen av hemoglobin ej är tillräcklig (< 0,25 g/dl per vecka).
Veckodosen kan också delas i dagliga doser.
-
Intravenös administration:
Initialdosen är 3 x 40 IE/kg och vecka. Dosen kan ökas efter 4 veckor till 80 IE/kg – tre gånger i veckan – och vid behov med en ökning på ytterligare 20 IE/kg tre gånger i veckan med en månads intervall.
För båda administrationssätten gäller att den maximala dosen inte skall överstiga 720 IE/kg och vecka.
2. Underhållsfasen
För att bibehålla ett hemoglobinvärde på mellan 10 och 12 g/dl minskas initialt dosen till hälften av den tidigare givna mängden. Därefter justeras dosen i intervall om en eller två veckor, individuellt för patienten (underhållsdos).
Vid subkutan administrering kan den totala veckodosen ges som injektion antingen en gång per vecka eller uppdelad i tre till sju doser per vecka. Patienter som är stabila på dosering en gång per vecka kan övergå till dosering varannan vecka. I detta fall kan dosökning bli nödvändig.
Resultat från kliniska studier på barn har i genomsnitt visat att ju yngre patienterna är desto högre doser NeoRecormon behövs. Emellertid skall det rekommenderade dosschemat följas eftersom det individuella svaret ej kan förutses.
Behandling med NeoRecormon är vanligtvis en långtidsterapi. Den kan dock avbrytas när som helst om så är nödvändigt. Doseringen en gång per vecka är baserad på data från kliniska studier med en behandlingstid på 24 veckor.
Förebyggande av anemi hos prematura barn
Lösningen ges subkutant i en dos av 3 x 250 IE/kg kroppsvikt och vecka. Prematura barn som redan transfunderats när behandlingen med NeoRecormon inleds får troligtvis inte samma utbyte av behandlingen som ej transfunderade barn. Den rekommenderade behandlingstiden är 6 veckor.
Behandling av kemoterapi-inducerad symtomgivande anemi hos cancerpatienter
NeoRecormon ska administreras subkutant till patienter med anemi (dvs hemoglobinkoncentration ≤ 10 g/dl (6,21 mmol/l)). Anemisymtom och följdsymtom kan variera med ålder, kön och total sjukdomsbörda. En läkares utvärdering av den enskilda patientens kliniska tillstånd och kondition är nödvändig.
Den totala veckodosen kan ges som injektion antingen en gång per vecka eller uppdelad i 3 till 7 doser per vecka.
Den rekommenderade initialdosen är 30 000 IE per vecka (vilket motsvarar ungefär 450 IE/kg kroppsvikt per vecka, baserat på en genomsnittlig patientvikt).
På grund av variabilitet inom patienter kan enstaka individuella hemoglobinvärden för en patient observeras över eller under den önskade hemoglobinnivån. Variabilitet i hemoglobin bör hanteras genom dosändringar, med hänsyn tagen till målintervallet för hemoglobin mellan 10 g/dl (6,21 mmol/l) och 12 g/dl (7,45 mmol/l). En bibehållen hemoglobinnivå över 12 g/dl (7,45 mmol/l) bör undvikas. Vägledning för lämplig dosjustering när hemoglobinvärden överstigande 12 g/dl (7,45 mmol/l) observeras beskrivs nedan.
Om hemoglobinvärdet efter 4 veckors behandling ökat med minst 1 g/dl (0,62 mmol/l) bör samma dos ges fortsättningsvis. Om hemoglobinvärdet inte har ökat med minst 1 g/dl (0,62 mmol/l) bör en dubblering av veckodosen övervägas. Om hemoglobinvärdet efter 8 veckors behandling ej ökat med minst 1 g/dl (0,62 mmol/l) är svar på behandlingen ej troligt varför den bör avbrytas.
Behandlingen skall fortsätta upp till 4 veckor efter avslutad kemoterapi.
Den maximala dosen bör ej överstiga 60 000 IE per vecka.
När det terapeutiska målet för den enskilde patienten har uppnåtts bör dosen reduceras med 25-50 % för att behålla hemoglobinvärdet på den nivån. Lämplig dostitrering bör övervägas.
Om hemoglobinvärdet överstiger 12 g/dl (7,45 mmol/l), ska dosen reduceras med ungefär 25-50 %. Behandlingen med NeoRecormon bör avbrytas tillfälligt om hemoglobinnivån överstiger 13 g/dl (8,1 mmol/l). När hemoglobinnivån minskar till 12 g/dl (7,45 mmol/l) eller därunder, bör behandlingen återupptas med en dos som är ungefär 25 % lägre än den tidigare givna dosen.
Om ökningen av hemoglobin är större än 2 g/dl (1,3 mmol/l) efter 4 veckor bör dosen reduceras med 25-50 %.
Patienter bör kontrolleras noggrant för att säkerställa att den lägsta godkända dosen av NeoRecormon används för att tillgodose adekvat kontroll av anemisymtomen.
Behandling för att öka mängden autologt blod
Lösningen ges intravenöst i ungefär 2 minuter eller subkutant.
NeoRecormon i förfylld spruta ges två gånger i veckan i 4 veckor. I de fall patienternas hematokritvärden tillåter blodtappning, d.v.s. hematokrit ≥ 33 % ges NeoRecormon vid slutet av bloddonationen.
Ett hematokritvärde på 48 % skall inte överskridas under hela behandlingsperioden.
Dosen måste bestämmas av kirurgerna, individuellt för varje patient, som en funktion av hur stor mängd donerat blod som krävs och den endogena blodkroppsreserven:
-
Mängden donerat blod som krävs beror på den förväntade blodförlusten, användandet av blodsparande åtgärder och patientens fysiska tillstånd.
Denna mängd skall vara den kvantitet som förväntas vara tillräcklig för att undvika homologa blodtransfusioner.
Den mängd donerat blod som krävs uttrycks i enheter där en enhet i nomogrammet är lika med 180 ml röda blodkroppar.
-
Förmågan att donera blod beror huvudsakligen på patientens blodvolym och det basala hematokritvärdet. Båda variablerna bestämmer den endogena röda blodkroppsreserven, som kan beräknas enligt följande formel.
endogen rödablodkroppsreserv = blodvolym (ml)x(hematokrit-33):100
kvinnor: blodvolym (ml) = 41 (ml/kg)xkroppsvikt (kg)+1200 (ml)
män: blodvolym (ml) = 44 (ml/kg)xkroppsvikt (kg)+1600 (ml)
(kroppsvikt ≥ 45 kg)
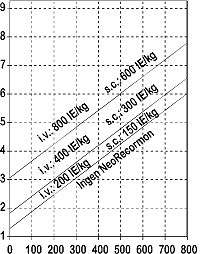
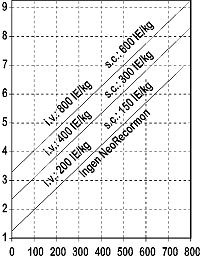
Indikationen för behandling med NeoRecormon och endosmängden, om den ges, skall bestämmas av mängden donerat blod som krävs och den endogena röda-blodkroppsreserven enligt följande figurer.
|
Kvinna |
Man |
|
Mängd donerat blod som krävs [enheter] |
Mängd donerat blod som krävs [enheter] |
|
|
|
|
Endogen rödablodkroppsreserv [ml] |
Endogen rödablodkroppsreserv [ml] |
Engångsdosen beräknad enligt ovan ges två gånger i veckan i 4 veckor. Den maximala dosen skall inte överskrida 1600 IE/kg kroppsvikt och vecka för intravenös administrering eller 1200 IE/kg och vecka vid subkutan administrering.
Administreringssätt
NeoRecormon förfylld spruta är färdig att använda. Endast lösningar som är klara eller lätt opaliserande, färglösa och praktiskt taget fria från synbara partiklar får injiceras.
NeoRecormon i förfylld spruta är en steril produkt utan konserveringsmedel. Under inga omständigheter får mer än en dos ges per spruta. Preparatet är endast avsett för engångsbruk.
Varningar och försiktighet
Spårbarhet
För att förbättra spårbarheten för biologiska läkemedel ska produktnamnet och satsnumret på det administrerade läkemedlet tydligt noteras i patientens journal.
NeoRecormon skall användas med försiktighet vid refraktär anemi med ökad förekomst av blaster i transformation, epilepsi, trombocytos och kronisk leverinsufficiens. Folsyra- och vitamin B12-brist skall uteslutas då dessa bristtillstånd minskar effekten av NeoRecormon.
Försiktighet bör iakttas vid upptrappning av NeoRecormon-dosen hos patienter med kronisk njursvikt eftersom höga kumulativa epoetindoser kan vara förknippade med en ökad risk för död, allvarliga kardiovaskulära och cerebrovaskulära händelser. Hos patienter med ett dåligt hemoglobinsvar på epoetiner bör alternativa förklaringar till det dåliga svaret övervägas (se Dosering och Farmakodynamik).
För att säkerställa effektiv erytropoes, ska järnstatus utvärderas för alla patienter före och under behandling. Tilläggsbehandling med järn kan bli nödvändig och den ska genomföras i enlighet med terapiriktlinjer.
Kraftigt aluminiumöverskott beroende på behandling av njurinsufficiens kan minska effekten av NeoRecormon.
Indikationen för behandling med NeoRecormon av nefrosklerotiska patienter som ännu ej dialysbehandlats skall bedömas individuellt eftersom en progress av njurinsufficiensen ej med säkerhet kan uteslutas.
Aplasi av röda blodkroppar (pure red cell aplasia, PRCA)
PRCA som orsakats av neutraliserande antikroppar mot erytropoietin har rapporterats i samband med erytropoietinbehandling, inklusive NeoRecormon. Dessa antikroppar har visat korsreaktivitet med alla erytropoietiska proteiner och patienter som misstänks ha eller har visat sig ha neutraliserande antikroppar mot erytropoietin bör inte ställas över på NeoRecormon (se Biverkningar).
PRCA hos patienter med hepatit C
En paradoxal minskning i hemoglobin och utveckling av allvarlig anemi associerad med låga värden av retikulocyter ska genast leda till avbruten epoetinbehandling och testning av anti-erytropoietinantikroppar. Fall har rapporterats hos patienter med hepatit C behandlade med interferon och ribavirin, när epoetiner används samtidigt. Epoetiner är inte godkända för behandling av anemi associerat med hepatit C.
Kontroll av blodtryck
En blodtrycksstegring eller försämring av befintlig hypertoni kan, särskilt vid snabb hematokritökning, förekomma. Blodtrycksstegringar kan behandlas med läkemedel. Om blodtrycksstegringar inte kan kontrolleras med läkemedelsbehandling, rekommenderas ett tillfälligt avbrott i behandlingen med NeoRecormon. Särskilt i början av behandlingen rekommenderas regelbunden kontroll av blodtrycket, även mellan dialysbehandlingar. Hypertensiv kris med encefalopatiliknande symtom kan förekomma och kräver omedelbar omvårdnad av läkare och intensiv medicinsk vård. Särskild hänsyn ska tas till plötslig, stickande, migränliknande huvudvärk som kan vara ett möjligt varningstecken.
Allvarliga hudbiverkningar såsom Steven-Johnsons syndrom och toxisk epidermal nekrolys, vilka kan vara livshotande eller dödliga, har rapporterats i samband med epoetinbehandling. De allvarligare fallen har observerats vid behandling med långverkande epoetiner. I samband med att behandlingen ordineras ska patienterna informeras om tecken och symtom, samt övervakas noggrant med avseende på hudreaktioner. Om tecken och symtom som tyder på dessa reaktioner uppstår ska NeoRecormon omedelbart sättas ut och en alternativ behandling övervägas. Om patienten utvecklat en allvarlig hudreaktion, såsom Steven-Johnsons syndrom eller toxisk epidermal nekrolys, på grund av NeoRecormon får behandling med erytropoesstimulerande läkemedel (ESL) aldrig återupptas hos denna patient.
Kronisk njurinsufficiens
Hos patienter med kronisk njurinsufficiens kan en måttlig och dosberoende trombocytökning som ligger inom normalgränserna uppträda vid behandling med NeoRecormon, särskilt efter intravenös tillförsel. Denna går tillbaka under fortsatt behandling. Det rekommenderas att trombocytvärdet kontrolleras regelbundet under de första 8 veckorna av behandlingen.
Hemoglobinkoncentration
Hos patienter med kronisk njurinsufficiens bör hemoglobinkoncentrationen vid underhållsbehandling inte överstiga den övre gränsen av målvärdet för hemoglobinkoncentrationen som rekommenderas i avsnitt Dosering. En ökad risk för död och allvarliga kardiovaskulära händelser eller cerebrovaskulära händelser inklusive stroke observerades i kliniska prövningar när ESL administrerades för att uppnå ett hemoglobinvärde över 12 g/dl (7,45 mmol/l).
Kontrollerade kliniska studier har inte visat signifikanta fördelar som beror på administrering av epoetiner, när hemoglobinkoncentrationen ökas till en högre nivå än nödvändigt för att kontrollera anemisymtomen och för att undvika blodtransfusion.
Hos prematura barn kan en lätt ökning av trombocytantalet förekomma, särskilt upp till dag 12-14 efter födseln, därför skall trombocyterna kontrolleras regelbundet.
Effekt på tumörtillväxt
Epoetiner är tillväxtfaktorer som primärt stimulerar produktionen av röda blodkroppar. Erytropoietinreceptorer kan finnas uttryckta på ytan av olika tumörceller. Liksom för alla tillväxtfaktorer finns en misstanke om att epoetiner skulle kunna stimulera tillväxten av tumörer. I flera kontrollerade studier har inte epoetiner visats förbättra överlevnad (overall survival) eller minska risken för tumörprogression hos patienter med anemi associerad med cancer.
I kontrollerade kliniska studier har användning av NeoRecormon och andra erytropoesstimulerande läkemedel (ESL) visat:
-
förkortad tid till tumörprogression hos patienter med avancerad huvud- och halscancer som får strålningsbehandling, vid administrering för att uppnå ett hemoglobinvärde större än 14 g/dl (8,69 mmol/l),
-
förkortad överlevnad och ökad död på grund av sjukdomsprogression vid 4 månader hos patienter med metastaserad bröstcancer som får kemoterapi, vid administrering för att uppnå ett hemoglobinvärde på 12-14 g/dl (7,45-8,69 mmol/l),
-
ökad risk för död vid administrering för att uppnå ett hemoglobinvärde på 12 g/dl (7,45 mmol/l) hos patienter med aktiv malign sjukdom som varken får kemoterapi eller strålningsbehandling. ESL är inte indicerat för användning till denna patientpopulation.
På grund av det som nämns ovan, bör blodtransfusioner i vissa kliniska situationer föredras som behandling för att kontrollera anemin hos cancerpatienter. Beslutet att administrera rekombinanta erytropoietiner bör baseras på en värdering av risken kontra nyttan, taget efter diskussion med den individuella patienten, som bör ha den specifika kliniska bilden i åtanke. Faktorer som bör tas hänsyn till i värderingen bör inkludera typ av tumör och tumörens stadium, graden av anemi, förväntad överlevnad, omgivningen där patienten behandlas, och patientens önskemål (se Farmakodynamik).
Det kan förekomma en blodtrycksstegring som kan behandlas med läkemedel. Därför rekommenderas kontroll av blodtrycket, särskilt i inledningsfasen hos cancerpatienter.
Trombocytvärden och Hb-värden skall kontrolleras med jämna mellanrum hos cancerpatienter.
Hos patienter i ett autologt predonationsprogram kan en ökning av trombocyterna förekomma, vanligtvis inom normalområdet. Därför rekommenderas kontroll av trombocytvärdet minst en gång i veckan hos dessa patienter. Om en ökning av trombocyterna på mer än 150 x 109/l föreligger eller en trombocytökning över normalgränsen, skall behandlingen med NeoRecormon avbrytas.
En potentiell risk för att erytropoietin skulle kunna orsaka retinopati hos för tidigt födda barn, kunde inte uteslutas. Försiktighet ska därför iakttagas och beslutet att behandla för tidigt födda barn ska vägas mot den potentiella nyttan och risken med denna behandling och mot risken med andra tillgängliga behandlingsalternativ.
Hos patienter med kronisk njurinsufficiens behövs ofta en ökning av heparindosen göras under hemodialysbehandling vid behandling med NeoRecormon beroende på hematokritökningen. Tilltäppning av dialyssystemet kan förekomma om hepariniseringen ej är optimal.
Tidig revision av shunten och blodproppsprofylax genom tillförsel av t.ex. acetylsalicylsyra rekommenderas hos patienter med kronisk njurinsufficiens vid risk för shunttrombos.
Serumkalium- och fosfatnivåer skall kontrolleras regelbundet under behandling med NeoRecormon. Kaliumstegring har rapporterats hos enstaka uremiska patienter som NeoRecormon-behandlats. Emellertid har något kausalt samband ej fastlagts. Om en ökad kaliumnivå observeras bör man överväga att avbryta behandlingen med NeoRecormon tills nivån är korrigerad.
För användning av NeoRecormon i ett autologt donationsprogram måste hänsyn tas till gällande föreskrifter för bloddonation, särskilt:
-
endast patienter med hematokrit ≥ 33 % (hemoglobin ≥ 11 g/dl [6,83 mmol/l]) skall lämna blod;
-
särskild försiktighet skall iakttagas med patienter som väger under 50 kg;
-
varje enskild volym som tappas skall inte överstiga ca. 12 % av patientens beräknade blodvolym.
Behandling skall reserveras för patienter hos vilka det anses vara av särskild betydelse att undvika homolog blodtransfusion med beaktande av riskerna/fördelarna med homologa blodtransfusioner.
Missbruk
Missbruk hos friska personer kan leda till en kraftig ökning av hematokritvärdet. Detta kan leda till livshotande hjärt/kärl-komplikationer.
Hjälpämnen
NeoRecormon i förfylld spruta innehåller upp till 0,3 mg fenylalanin/spruta som hjälpämne. Detta bör därför beaktas hos patienter som lider av svåra former av fenylketonuri.
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per spruta, dvs är näst intill “natriumfritt”.
Interaktioner
De hittills kända kliniska erfarenheterna av NeoRecormon talar inte för någon interaktion med andra läkemedel.
Djurexperiment visar att epoetin beta inte potentierar myelotoxiciteten hos cytostatika såsom etoposid, cisplatin, cyklofosfamid och fluorouracil.
Graviditet
För epoetin beta saknas kliniska data från behandling av gravida kvinnor.
Förskrivning till gravida kvinnor ska ske med försiktighet.
Amning
Det är inte känt om epoetin beta utsöndras i bröstmjölk. Ett beslut om att fortsätta/avbryta amning eller att fortsätta/avbryta behandling med epoetin beta bör göras med hänsyn till nyttan av amning för barnet och fördelen med epoetin beta-behandling för kvinnan.
Fertilitet
Djurstudier tyder inte på direkta eller indirekta skadliga effekter vad gäller graviditet, embryonal-/fosterutveckling, förlossning eller utveckling efter födsel (se Prekliniska uppgifter).
Trafik
NeoRecormon har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen:
Baserat på resultat i kliniska prövningar, som inkluderade 1725 patienter, får cirka 8 % av patienterna som behandlas med NeoRecormon biverkningar.
Anemiska patienter med kronisk njurinsufficiens
Den vanligaste biverkningen vid behandling med NeoRecormon är blodtrycksstegring eller försämring av befintlig hypertoni, särskilt vid snabb hematokritökning (se Varningar och försiktighet). Hypertensiv kris med encefalopatiliknande symtom (t.ex. huvudvärk, omtöckningstillstånd, motoriska problem - såsom talsvårigheter eller försämrad gång och epileptiska krampanfall) kan även förekomma hos enstaka patienter med normalt eller lågt blodtryck (se Varningar och försiktighet).
Shunttrombos kan förekomma, särskilt hos patienter med en tendens till lågt blodtryck eller vars arteriovenösa fistel företer komplikationer (t.ex. stenoser, aneurysm), se Varningar och försiktighet. I de flesta fall observeras en sänkning av serumjärn samtidigt med höjningen av hematokriten (se Varningar och försiktighet).
Dessutom har en tillfällig ökning av serumkalium- och fosfatnivåer observerats i enstaka fall (se Varningar och försiktighet).
I enstaka fall har neutraliserande anti-erytropoietin antikroppsmedierad aplasi av röda blodkroppar (PRCA) rapporterats vid behandling med NeoRecormon. Om anti-erytropoietin antikroppsmedierad PRCA är diagnostiserat ska behandlingen med NeoRecormon avbrytas och patienten bör inte behandlas med något annat erytropoietiskt protein (se Varningar och försiktighet).
Biverkningar anges i tabell 1 nedan.
Patienter med cancer
Huvudvärk och hypertoni relaterat till behandling med epoetin beta och som kan behandlas med läkemedel är vanligt (se Varningar och försiktighet).
Hos några patienter har en sänkning av serumjärn observerats (se Varningar och försiktighet).
Kliniska studier har visat en högre frekvens av tromboemboliska händelser hos cancerpatienter behandlade med NeoRecormon jämfört med obehandlade eller placebobehandlade försökspersoner. Hos patienter som behandlats med NeoRecormon är incidensen 7 % jämfört med 4 % hos kontrollgrupperna. Detta har inte förknippats med någon ökning av tromboembolisk dödlighet jämfört med kontrollgrupperna.
Biverkningar anges i tabell 2 nedan.
Patienter i ett autologt blodpredonationsprogram
Patienter i ett autologt predonationsprogram har rapporterats visa en något ökad förekomst av tromboembolier. Ett kausalt samband med behandling med NeoRecormon har dock ej kunnat fastställas.
I placebokontrollerade studier var tillfällig järnbrist mer uttalad hos patienter som behandlades med NeoRecormon än hos kontrollgrupperna (se Varningar och försiktighet).
Allvarliga hudbiverkningar såsom Steven-Johnsons syndrom och toxisk epidermal nekrolys, vilka kan vara livshotande eller dödliga, har rapporterats i samband med epoetinbehandling (se Varningar och försiktighet).
Biverkningar anges i tabell 3 nedan.
Tabell över biverkningar
Biverkningar anges enligt MedDRA:s klassificering av organsystem och frekvenskategori.
Frekvenskategorierna för biverkningar definieras enligt följande:
mycket vanliga (≥ 1/10); vanliga (≥ 1/100 till < 1/10); mindre vanliga (≥ 1/1000 till < 1/100); sällsynta (≥ 1/10000 till < 1/1000); mycket sällsynta (< 1/10000); okända (kan inte beräknas från tillgängliga data).
|
Organsystem |
Biverkning |
Frekvens |
|---|---|---|
|
Blodkärl |
Hypertoni Hypertensiv kris |
Vanlig Mindre vanlig |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanlig |
|
Blodet och lymfsystemet |
Shunttrombos Trombocytos |
Sällsynt Mycket sällsynt |
|
Organsystem |
Biverkning |
Frekvens |
|---|---|---|
|
Blodkärl |
Hypertoni |
Vanlig |
|
Blodet och lymfsystemet |
Tromboembolisk händelse |
Vanlig |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanlig |
|
Organsystem |
Biverkning |
Frekvens |
|---|---|---|
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanlig |
Prematura barn
En sänkning av serumferritinnivåer är mycket vanlig (se Varningar och försiktighet).
Beskrivning av utvalda biverkningar
I sällsynta fall kan hudreaktioner som är relaterade till behandling med epoetin beta såsom utslag, klåda, nässelutslag och reaktioner vid injektionsstället förekomma. Anafylaktiska reaktioner relaterade till behandling med epoetin beta har iakttagits i mycket sällsynta fall. I kontrollerade kliniska prövningar har dock ingen ökad förekomst av överkänslighetsreaktioner iakttagits.
I mycket sällsynta fall, har influensaliknande symtom relaterade till behandling med epoetin beta såsom feber, frossa, huvudvärk, ont i armar och ben, skelettsmärtor och sjukdomskänsla rapporterats, särskilt i början av behandlingen. Dessa reaktioner var lindriga eller milda till sin natur och avtog efter ett par timmar eller dagar.
Data från en kontrollerad klinisk prövning med epoetin alfa eller darbepoetin alfa rapporterade incidensen av stroke som vanlig.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Den terapeutiska gränsen för NeoRecormon är mycket vid. Inga symtom av förgiftning har observerats ens vid mycket höga serumnivåer.
Farmakodynamik
Verkningsmekanism
Erytropoietin är ett glykoprotein som stimulerar bildningen av erytrocyter från deras tillhörande stamceller. Det verkar som en mitosstimulerande faktor och ett differentierande hormon.
Epoetin beta, den aktiva substansen i NeoRecormon, är i sin aminosyra- och kolhydratsammansättning identiskt med erytropoietin som har isolerats i urin från anemiska patienter.
Den biologiska effekten av epoetin beta har påvisats efter intravenös och subkutan administrering i olika djurmodeller in vivo (normala och uremiska råttor, möss med polycytemi och hundar). Efter tillförsel av epoetin beta ökar antalet erytrocyter och retikulocyter samt ökar Hb-värdet och 59Fe-upptagningsförmågan.
Ett ökat 3H-thymidinupptag i erytroida kärnförande mjältceller har setts in vitro (cellkultur av musmjälte) efter inkubering med epoetin beta.
Studier av cellkulturer av human benmärg visade att epoetin beta stimulerar erytropoiesen specifikt och ej påverkar leukopoiesen. Cytotoxisk påverkan av epoetin beta på benmärg eller humana hudceller har ej iakttagits.
Efter endosadministrering av epoetin beta sågs inga beteendeförändringar eller förändringar av rörelseförmågan hos möss eller någon påverkan på cirkulations- eller andningsorgan hos hund.
Klinisk effekt och säkerhet
I en randomiserad, dubbel-blind, placebo-kontrollerad studie med 4038 patienter med kronisk njursjukdom som inte erhöll dialys och som hade typ 2 diabetes och hemoglobinnivåer ≤ 11 g/dl, fick patienterna antingen behandling med darbepoetin alfa för att nå målnivån för hemoglobin på 13 g/dl eller placebo (se Varningar och försiktighet). Studien uppnådde varken det primära syftet att demonstrera en minskning av risken för dödlighet oavsett orsak, kardiovaskulär dödlighet, eller terminal njursvikt (end stage renal disease (ESRD)). Analys av individuella komponenter av det sammansatta effektmåttet visade följande HR (95 % KI): död 1,05 (0,92, 1,21), stroke 1,92 (1,38, 2,68), hjärtsvikt 0,89 (0,74, 1,08), hjärtinfarkt 0,96 (0,75, 1,23), hospitalisering för myokardiell ischemi 0,84 (0,55, 1,27), terminal njursvikt 1,02 (0,87, 1,18).
Poolade post-hoc-analyser av kliniska studier av erytropoietinstimulerande läkemedel (ESL) har utförts hos patienter med kronisk njursvikt (i dialys, ej i dialys, hos patienter med eller utan diabetes). En tendens till ökade riskuppskattningar för total mortalitet, kardiovaskulära och cerebrovaskulära händelser förknippade med högre kumulativa ESL-doser observerades oberoende av diabetes- eller dialysstatus (se Dosrering och Varningar och försiktighet).
Erytropoietin är en tillväxtfaktor som primärt stimulerar produktionen av röda blodkroppar. Erytropoietinreceptorer kan finnas uttryckta på ytan av olika tumörceller.
Överlevnad och tumörprogression har undersökts i fem stora kontrollerade studier omfattande totalt 2833 patienter. Fyra av dessa var dubbelblinda placebokontrollerade studier och en studie var öppen. Två av studierna inkluderade patienter som behandlades med kemoterapi. Målvärdet för hemoglobinkoncentrationen var > 13 g/dl i de två studierna. I de övriga tre studierna var målvärdet för hemoglobinkoncentrationen 12 – 14 g/dl. I den öppna studien var det ingen skillnad i överlevnad mellan patienter som behandlades med rekombinant humant erytropoietin och kontrollgruppen. I de fyra placebokontrollerade studierna var hazard ratio för överlevnad mellan 1,25 och 2,47, till kontrollgruppernas fördel. Dessa studier har visat en konsekvent oförklarad statistiskt signifikant ökad dödlighet hos patienter som har anemi associerad med olika vanligt förekommande cancerformer och som behandlades med rekombinant humant erytropoietin jämfört med kontrollgrupperna. Utfallet av överlevnad i studierna kunde inte förklaras tillfredställande av skillnader i trombosincidensen och relaterade komplikationer mellan de som behandlades med rekombinant humant erytropoietin och de i kontrollgruppen.
En meta-analys baserad på individuella patientdata, vilken innehöll data från alla 12 kontrollerade kliniska studier med NeoRecormon på anemiska cancerpatienter (n=2301), visade ett totalt hazard ratio punktestimat för överlevnad på 1,13, till kontrollgruppernas fördel (95% KI: 0,87, 1,46). Hos patienter med en hemoglobinnivå vid start på ≤ 10 g/dl (n=899) var hazard ratio punktestimatet för överlevnad 0,98 (95% KI: 0,68 till 1,40). En ökad relativ risk för tromboemboliska händelser observerades i den totala populationen (RR 1,62, 95% KI: 1,13, 2,31).
En dataanalys på patientnivå har också utförts på mer än 13 900 cancerpatienter (kemoterapi, strålbehandling, kombinerad kemo- och strålterapi eller ingen behandling alls) i 53 kontrollerade kliniska prövningar med flera epoetiner inblandade. Meta-analys av data för total överlevnad gav en punktskattning av riskkvoten på 1,06 till kontrollgruppernas fördel (95 % KI: 1,00, 1,12; 53 studier och 13933 patienter) och för cancerpatienterna som fick kemoterapi var hazard ratio för den totala överlevnaden 1,04 (95 % KI: 0,97, 1,11; 38 studier och 10 441 patienter). Meta-analyser indikerade också konsekvent en signifikant ökad relativ risk för tromboemboliska händelser hos cancerpatienter som fått rekombinant humant erytropoietin (se Varningar och försiktighet).
I mycket sällsynta fall har neutraliserande anti-erytropoietin antikroppar med eller utan aplasi av röda blodkroppar (PRCA) förekommit under rHuEPO-behandling.
Farmakokinetik
Farmakokinetiska undersökningar på friska försökspersoner och uremiska patienter visar att halveringstiden för intravenöst administrerat epoetin beta är mellan 4 och 12 timmar och att distributionsvolymen motsvarar en till två gånger plasmavolymen. Analoga resultat har erhållits i djurförsök hos uremiska och normala råttor.
Efter subkutan administrering av Epoetin beta hos uremiska patienter resulterar den förlängda absorptionen i en serumkoncentrationsplatå, varvid den maximala koncentrationen nås efter i genomsnitt 12 – 28 timmar. Den terminala halveringstiden är längre än efter intravenös administrering med ett genomsnitt på 13 – 28 timmar.
Biotillgängligheten för Epoetin beta efter subkutan administrering är mellan 23 och 42 % jämfört med intravenös administrering.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet och reproduktionseffekter visade inte några särskilda risker för människa.
En karcinogenicitetsstudie av homologt erytropoietin till möss visade inga tecken till någon proliferativ eller tumörframkallande potential.
Innehåll
NeoRecormon 500 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 500 internationella enheter (IE) motsvarande 4,15 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 1667 IE epoetin beta.
NeoRecormon 2000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 2000 internationella enheter (IE) motsvarande 16,6 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 6667 IE epoetin beta.
NeoRecormon 3000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 3000 internationella enheter (IE) motsvarande 24,9 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 10000 IE epoetin beta.
NeoRecormon 4000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 4000 internationella enheter (IE) motsvarande 33,2 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 13 333 IE epoetin beta.
NeoRecormon 5000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 5000 internationella enheter (IE) motsvarande 41,5 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 16 667 IE epoetin beta.
NeoRecormon 6000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,3 ml injektionsvätska, lösning innehåller 6000 internationella enheter (IE) motsvarande 49,8 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 20 000 IE epoetin beta.
*NeoRecormon 10000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,6 ml injektionsvätska, lösning innehåller 10 000 internationella enheter (IE) motsvarande 83 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 16 667 IE epoetin beta.
NeoRecormon 20000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,6 ml injektionsvätska, lösning innehåller 20 000 internationella enheter (IE) motsvarande 166 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 33 333 IE epoetin beta.
NeoRecormon 30000 IE injektionsvätska, lösning i förfylld spruta
En förfylld injektionsspruta med 0,6 ml injektionsvätska, lösning innehåller 30 000 internationella enheter (IE) motsvarande 250 mikrogram epoetin beta* (rekombinant humant erytropoietin).
1 ml injektionsvätska, lösning innehåller 50 000 IE epoetin beta.
* tillverkat i ovarialceller från kinesisk hamster (CHO-celler) med rekombinant DNA-teknologi
Hjälpämnen med känd effekt:
Fenylalanin (upp till 0,3 mg/spruta)
Natrium (mindre än 1 mmol/spruta)
Förteckning över hjälpämnen
Karbamid,
Natriumklorid,
Polysorbat 20,
Natriumdivätefosfatdihydrat,
Dinatriumfosfatdodekahydrat,
Kalciumkloriddihydrat,
Glycin,
L-Leucin,
L-Isoleucin,
L-Treonin,
L-Glutaminsyra,
L-Fenylalanin,
Vatten för injektionsvätskor.
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Miljöpåverkan
Epoetin beta
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön. Även om biomolekyler såsom vacciner och hormoner är undantagna, bör de fortfarande betraktas som biologiskt aktiva.
Hållbarhet, förvaring och hantering
2 år. Förvaras i kylskåp (2°C-8°C).
Förvara den förfyllda sprutan i ytterkartongen. Ljuskänsligt.
För att underlätta ambulatorisk användning får patienten ta ur preparatet från kylskåp och förvara det i rumstemperatur (ej över 25°C) under en enstaka period på upp till 3 dagar.
Tvätta först händerna!
-
Ta en injektionsspruta från förpackningen och kontrollera att lösningen är klar, färglös och i stort sett utan synliga partiklar. Avlägsna locket på injektionssprutan.
-
Ta en injektionsnål från förpackningen, sätt fast den på injektionssprutan och ta bort skyddslocket på injektionsnålen.
-
Ta bort luft från injektionssprutan och nålen genom att hålla injektionssprutan vertikalt och försiktigt pressa kolven uppåt. Fortsätt att pressa kolven tills injektionssprutan innehåller den mängd NeoRecormon som ordinerats.
-
Rengör huden på injektionsstället med en alkoholtuss. Skapa hudveck genom att klämma ihop huden mellan tummen och pekfingret. Håll i injektionssprutans cylinder nära nålen och stick in nålen i hudvecket med en snabb och säker rörelse. Injicera NeoRecormon lösning. Dra tillbaka sprutan snabbt och tryck med en torr steril bomullstuss på injektionsstället.
Detta läkemedel är endast avsett för engångsbruk. Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Förpackningsinformation
Injektionsvätska, lösning i förfylld spruta 2000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 3000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 4000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 500 IE
Färglös, klar till lätt opaliserande lösning
förfylld spruta (fri prissättning), tillhandahålls ej
förfylld spruta (fri prissättning), tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 5000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 6000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 10000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta, 3818:20, F
Injektionsvätska, lösning i förfylld spruta 20000 IE
Färglös, klar till lätt opaliserande lösning
6 styck förfylld spruta (fri prissättning), tillhandahålls ej
Injektionsvätska, lösning i förfylld spruta 30000 IE
Färglös, klar till lätt opaliserande lösning
4 styck förfylld spruta, 7551:25, F
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, lösning i förfylld spruta 2000 IE
Injektionsvätska, lösning i förfylld spruta 3000 IE
Injektionsvätska, lösning i förfylld spruta 4000 IE
Injektionsvätska, lösning i förfylld spruta 5000 IE
Injektionsvätska, lösning i förfylld spruta 6000 IE
Injektionsvätska, lösning i förfylld spruta 10000 IE
Injektionsvätska, lösning i förfylld spruta 30000 IE