SmofKabiven
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa den igen.
-
Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
-
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad SmofKabiven är och vad det används för
2. Vad du behöver veta innan du använder SmofKabiven
3. Hur du använder SmofKabiven
4. Eventuella biverkningar
5. Hur SmofKabiven ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad SmofKabiven är och vad det används för
SmofKabiven är en emulsion och ges som dropp (intravenös infusion). Läkemedlet består av aminosyror (proteiners byggstenar), glukos (kolhydrater), lipider (fetter) och salter (elektrolyter) i en påse av plast och kan ges till vuxna och barn som är 2 år eller äldre.
SmofKabiven ges till dig av vårdpersonal då näringstillförsel på annat sätt är omöjlig, är otillräcklig eller olämplig.
2. Vad du behöver veta innan du använder SmofKabiven
Använd inte SmofKabiven
-
om du är allergisk mot aktiva substanser eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6)
-
om du är allergisk mot fisk eller ägg
-
om du är allergisk mot jordnötter eller soja ska du inte använda detta läkemedel. SmofKabiven innehåller sojaolja.
-
om du har onormalt höga nivåer av fetter i blodet (hyperlipidemi)
-
om du har svår leversjukdom
-
om du har problem som påverkar blodets levring (koagulationsrubbning)
-
om du har en rubbning av kroppens förmåga att omvandla och bryta ned aminosyror
-
om du lider av svår njursvikt och saknar tillgång till dialys
-
om du är i akut chock
-
om du har förhöjda och obehandlade blodsockernivåer (hyperglykemi)
-
om du har förhöjda nivåer av de salter (elektrolyter) som ingår i SmofKabiven
-
om du har vätska i lungorna (akut lungödem)
-
vid övervätskning (hyperhydrering)
-
vid obehandlad hjärtsvikt
-
om du har en rubbning i ditt blodlevringssystem (hemofagocytotiskt syndrom)
-
vid instabila tillstånd t.ex. efter allvarliga skador, obehandlad diabetes, hjärtinfarkt, stroke, blodpropp, metabolisk acidos (rubbning i ämnesomsättningen som ger för mycket syra i blodet), blodförgiftning, vid koma samt vid för lite vätska i kroppen (hypotonisk dehydrering)
-
till barn under 2 års ålder
Varningar och försiktighet
Tala med läkare innan du använder SmofKabiven om du har:
-
njursvikt,
-
diabetes,
-
pankreatit (bukspottkörtelinflammation),
-
leversvikt,
-
hypotyreoidism (sköldkörtelproblem),
-
sepsis (blodförgiftning).
Om du under infusionen drabbas av feber, hudutslag, svullnad, andnöd, frossa, svettning, illamående eller kräkningar säg genast till vårdpersonal, eftersom dessa symtom kan bero på en allergisk reaktion eller på att du fått för stor mängd läkemedel.
Din läkare kan behöva kontrollera ditt blod regelbundet med avseende på bl.a. leverfunktion.
Barn och ungdomar
SmofKabiven är inte avsett för nyfödda barn eller barn som är yngre än 2 år. SmofKabiven kan ges till barn som är 2 till 18 år gamla.
Andra läkemedel och SmofKabiven
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel även receptfria sådana.
Graviditet och amning
Data från användning av SmofKabiven under graviditet och amning saknas. SmofKabiven ska därför endast ges till gravida eller ammande kvinnor om läkaren anser det nödvändigt. Användning av SmofKabiven kan övervägas under graviditet och amning, om din läkare anser det.
Körförmåga och användning av maskiner
Ej relevant eftersom läkemedlet ges på sjukhus.
3. Hur du använder SmofKabiven
Använd alltid detta läkemedel exakt enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Din läkare kommer att anpassa doseringen individuellt till dig utifrån din kroppsvikt samt kroppsfunktion. SmofKabiven kommer att ges till dig av vårdpersonal.
Om du använt för stor mängd av SmofKabiven
Det är inte troligt att du får för mycket läkemedel, eftersom SmofKabiven ges till dig av vårdpersonal.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Vanliga(kan förekomma hos upp till 1 av 10 användare): Svag ökning av kroppstemperaturen.
Mindre vanliga(kan förekomma hos upp till 1 av 100 användare): Förhöjda levervärden i blodet, aptitlöshet, illamående, kräkningar, frossa, yrsel och huvudvärk.
Sällsynta(kan förekomma hos upp till 1 av 1000 användare): Lågt eller högt blodtryck, andnöd, hjärtklappning (takykardi). Överkänslighetsreaktioner (kan ge symtom såsom svullnad, feber, blodtrycksfall, hudutslag, nässelutslag (upphöjda röda områden), rodnad, huvudvärk). Upplevelse av värme eller kyla. Blek hy. Blåaktiga läppar och hud (på grund av lite syre i blodet). Smärta i nacke, rygg, skelett, bröst och länd.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
5. Hur SmofKabiven ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras i ytterpåsen. Förvaras vid högst 25ºC. Får ej frysas.
Används före utgångsdatum som anges på etiketten på påsen och ytterförpackningen. Utgångsdatumet är den sista dagen i angiven månad.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
|
De aktiva substanserna är: |
g per 1000 ml |
|---|---|
|
Alanin |
7,1 |
|
Arginin |
6,1 |
|
Glycin |
5,6 |
|
Histidin |
1,5 |
|
Isoleucin |
2,5 |
|
Leucin |
3,8 |
|
Lysin (som acetat) |
3,4 |
|
Metionin |
2,2 |
|
Fenylalanin |
2,6 |
|
Prolin |
5,7 |
|
Serin |
3,3 |
|
Taurin |
0,5 |
|
Treonin |
2,2 |
|
Tryptofan |
1,0 |
|
Tyrosin |
0,20 |
|
Valin |
3,1 |
|
Kalciumklorid (som dihydrat) |
0,28 |
|
Natriumglycerofosfat (som hydrat) |
2,1 |
|
Magnesiumsulfat (som heptahydrat) |
0,61 |
|
Kaliumklorid |
2,3 |
|
Natriumacetat (som trihydrat) |
1,7 |
|
Zinksulfat (som heptahydrat) |
0,0066 |
|
Glukos (som monohydrat) |
127 |
|
Sojaolja, raffinerad |
11,4 |
|
Triglycerider, medellångkedjiga |
11,4 |
|
Olivolja, raffinerad |
9,5 |
|
Fiskolja, rik på omega-3-fettsyror |
5,7 |
Övriga innehållsämnen är: glycerol, renade äggfosfolipider, all-rac-α-Tokoferol, natriumhydroxid (pH-justering), natriumoleat, ättiksyra (pH-justering), saltsyra (pH-justering) och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Glukos- och aminosyralösningarna är klara, färglösa eller svagt gula och partikelfria. Fettemulsionen är vit och homogen.
Förpackningsstorlekar:
1 x 493 ml, 6 x 493 ml
1 x 986 ml, 4 x 986 ml
1 x 1477 ml, 4 x 1477 ml
1 x 1970 ml, 4 x 1970 ml
1 x 2463 ml, 3 x 2463 ml
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Fresenius Kabi AB, 751 74 Uppsala, Sverige
Tillverkare
Fresenius Kabi AB, 751 74 Uppsala, Sverige
Fresenius Kabi Austria GmbH, 8055 Graz, Österrike
Denna bipacksedel ändrades senast 2023-02-17
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Varningar och försiktighet
För att undvika risker förenade med för höga infusionshastigheter rekommenderas en kontinuerlig och välkontrollerad infusion, om möjligt administrerad med hjälp av en volumetrisk pump.
På grund av ökad risk för infektioner vid infusion i central ven skall strikt aseptisk teknik tillämpas för att undvika kontaminering, särskilt vid kateterinläggning och hantering.
Serumglukos, elektrolyter och osmolaritet samt vätskebalans, syra-bas status och lever- och enzymtester bör kontrolleras.
Vid varje tecken på anafylaktisk reaktion (såsom feber, frossa, utslag eller andnöd) skall infusionen omedelbart avbrytas.
SmofKabiven skall inte ges parallellt med blod via samma infusionsset på grund av risken för pseudoagglutinering.
Administreringssätt
Intravenös användning, infusion i central ven.
För total parenteral nutrition bör spårämnen, vitaminer och eventuellt elektrolyter (hänsyn tas till elektrolyterna som redan finns i SmofKabiven) tillsättas till SmofKabiven efter patientens behov.
Vuxna
Dos
Dosintervallet 13-31 ml SmofKabiven/kg/dygn ger 0,6-1,6 g aminosyror/kg/dygn (0,10-0,25 g kväve/kg/dygn) samt 14-35 kcal/kg/dygn av total energi (12-27 kcal/kg/dygn av icke-proteinhaltig energi).
Infusionshastighet
Maximal infusionshastighet för glukos är 0,25 g/kg/timme, för aminosyror 0,1 g/kg/timme och för lipider 0,15 g/kg/timme.
Infusionshastigheten skall inte överstiga 2,0 ml/kg/timme (motsvarande 0,25 g glukos, 0,1 g aminosyror och 0,08 g lipid/kg/timme). Rekommenderad infusionstid är 14-24 timmar.
Maximal dygnsdos
Den maximala dygnsdosen varierar med patientens kliniska tillstånd och kan också ändras från dag till dag. Den rekommenderade maximala dygnsdosen är 35 ml/kg/dygn.
Pediatrisk population
Barn (2-11 år)
Dos
Dosen på upp till 35 ml/kg/dygn bör regelbundet anpassas till kraven hos den pediatriska patienten, som varierar mer än hos vuxna patienter.
Infusionshastighet:
Den rekommenderade maximala infusionshastigheten är 2,4 ml/kg/timme (motsvarande 0,12 g aminosyror/kg/timme, 0,30 g glukos/kg/timme och 0,09 g lipider/kg/timme). Vid den rekommenderade maximala infusionshastigheten, infundera inte under längre tid än 14 timmar 30 minuter, utom i undantagsfall och då med noggrann övervakning. Rekommenderad infusionstid är 12-24 timmar.
Maximal dygnsdos
Den maximala dygnsdosen varierar med det kliniska tillståndet hos patienten och kan också ändras från dag till dag. Den rekommenderade maximala dygnsdosen är 35 ml/kg/dygn.
Ungdomar (12-18 år)
Till ungdomar kan SmofKabiven användas som till vuxna.
Anvisningar för användning och hantering
Produkten skall inte användas om förpackningen är skadad.
Använd innehållet endast om aminosyra- och glukoslösningarna är klara och färglösa eller svagt gula och om fettemulsionen är vit och homogen. Innehållet i de tre separata kamrarna måste blandas före användning samt före tillsatser via tillsatsporten.
Efter svagsvetsarnas öppnande skall innerpåsen vändas ett antal gånger för att säkerställa en homogen blandning som inte uppvisar något som helst tecken på fasseparation.
Enbart för engångsbruk. Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Blandbarhet
Kompatibilitetsdata är tillgängliga för de namngivna produkterna Dipeptiven, Tracel/Addaven, Glycophos, Addiphos, Vitalipid Adult/Infant och Soluvit i nedan volymer och generiska elektrolyter i nedan koncentrationer. Vid tillförsel av elektrolyter bör hänsyn tas till det mängder som redan finns i påsen för att tillgodose patientens kliniska behov. Genererade data stödjer tillägg till den blandade påsen enligt sammanfattande tabell nedan:
Kompatibilitetsintervall för stabilitet upp till 8 dagar, dvs 6 dagars förvaring vid 2-8°C följt av 48 timmar vid 20-25°C
|
Enhet |
Maximalt totalinnehåll |
|||||
|
SmofKabiven påsstorlek |
ml |
493 |
986 |
1477 |
1970 |
2463 |
|
Tillsats |
Volym |
|||||
|
Dipeptiven |
ml |
0-100 |
0 - 300 |
0 - 300 |
0 - 300 |
0 - 300 |
|
Addaven/Tracel |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Soluvit |
injektions-flaska |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
|
Vitalipid Adult/Infant |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Elektrolytgränser1 |
Mängd per påse |
|||||
|
Natrium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Kalium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Kalcium |
mmol |
≤ 2,5 |
≤ 5 |
≤ 7,5 |
≤ 10 |
≤ 12,5 |
|
Magnesium |
mmol |
≤ 2,5 |
≤ 5 |
≤ 7,5 |
≤ 10 |
≤ 12,5 |
|
Fosfat, oorganiskt (Addiphos) ELLER Fosfat, organiskt (Glycophos)2 |
mmol |
≤ 7,5 |
≤ 15 |
≤ 22,5 |
≤ 30 |
≤ 37,5 |
|
Zink |
mmol |
≤ 0,1 |
≤ 0,2 |
≤ 0,25 |
≤ 0,3 |
≤ 0,35 |
|
Selen |
µmol |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1,15 |
1 inkluderar mängder från alla produkter.
2 tillsatser av Glycophos kan fördubblas med en stabilitet på 7 dagar, dvs, 6 dagars förvaring vid 2-8°C följt av 24 timmar vid 20-25°C.
Observera att denna tabell är avsedd att presentera kompatibilitet. Det är inte en doseringsriktlinje.
Se nationellt godkänd information till förskrivare innan förskrivning av namngivna produkter.
Blandbarhetsdata för fler tillsatser och förvaringstider för olika blandningar tillhandahålles på förfrågan.
Tillsatser skall utföras aseptiskt.
Hållbarhet efter blandning av påsens kamrar
Vid användning av den blandade trekammarpåsen har kemisk och fysikalisk stabilitet visats i 48 timmar vid 20-25°C. Ur mikrobiologisk synvinkel ska infusionsvätskan användas omedelbart. Om produkten inte används omedelbart är användaren ansvarig för lagringstid och lagringsförhållanden och dessa skall normalt inte överstiga 24 timmar vid 2-8°C, såvida inte blandning har utförts under kontrollerade och validerade aseptiska förhållanden.
Hållbarhet efter tillsatser
Vid användning av den blandade trekammarpåsen med tillsatser har fysikalisk-kemisk stabilitet visats för upp till 8 dagar, dvs 6 dagar vid 2-8°C följt av 48 timmar vid 20-25°C, inklusive tid för administrering.
Om tillsatser görs ska blandningarna av mikrobiologiska skäl användas direkt. Om blandningarna inte används omedelbart efter beredning är lagringstid och förvaringsförhållanden före administrering användarens ansvar. Förvaringstiden ska normalt inte överskrida 24 timmar vid 2-8°C, såvida inte tillsatser gjorts under kontrollerade och validerade aseptiska förhållanden.
BruksanvisningSmofKabiven
Påsen
493 ml:
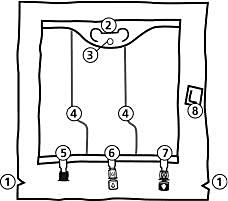
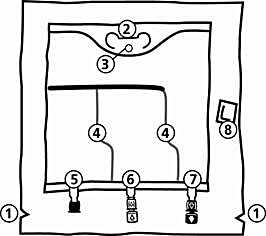
986 ml, 1477 ml, 1970 ml, 2463 ml:
-
Rivmarkering i ytterpåsen
-
Handtag
-
Hål för upphängning av påsen
-
Svagsvetsar
-
Blindport (används bara under tillverkning)
-
Tillsatsport (vit)
-
Infusionsport (blå)
-
Syreabsorbator
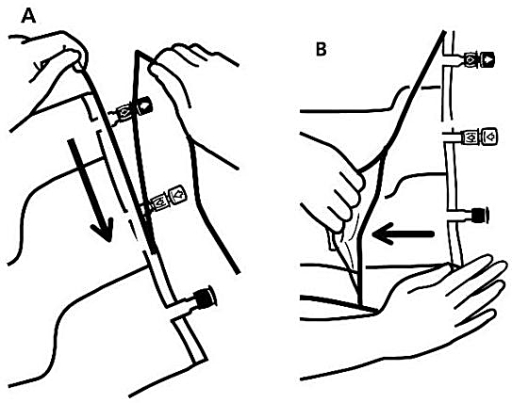
1. Avlägsnande av ytterpåsen
-
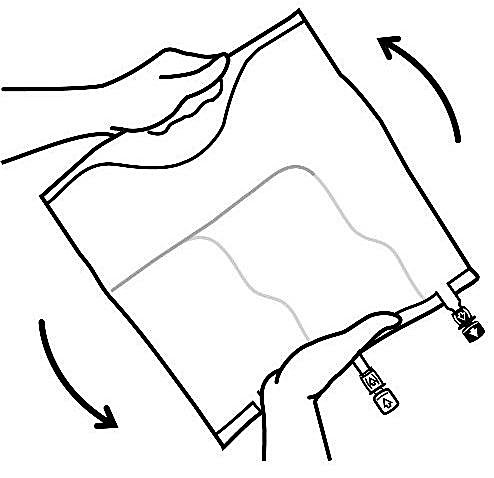
För att ta av ytterpåsen, håll påsen horisontellt och dra från rivmarkeringen intill portarna längs den övre kanten (Bild A).
-
Dra sedan längs hela långsidan, ta av ytterpåsen och släng den tillsammans med syreabsorbatorn (Bild B).
2. Blandning
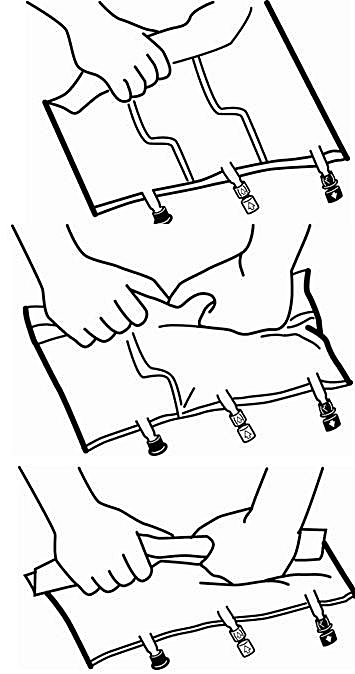
-
Lägg påsen på en plan yta.
-
Rulla ihop påsen ordentligt, från handtagssidan mot portarna, först med högerhanden och sedan genom att oavbrutet trycka med vänsterhanden tills de vertikala svagsvetsarna öppnas. De vertikala svagsvetsarna öppnas med hjälp av trycket från vätskan. Svagsvetsarna kan även öppnas innan ytterpåsen avlägsnas.
Observera: Lösningarna blandas lätt även när den horisontella förslutningen är stängd.
493 ml, 986 ml, 1477 ml, 1970 ml, 2463 ml:
-
Blanda innehållet i de tre kamrarna noggrant genom att vända påsen tre gånger.
3. Slutförande av beredningen
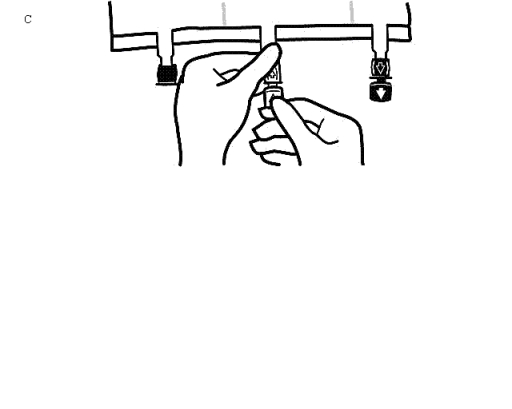
-
Placera påsen på en plan yta igen. Omedelbart innan injektion av tillsatser görs, avlägsna förseglingen från den vita tillsatsporten (Bild C).
Observera: Tillsatsportens membran är sterilt.
-
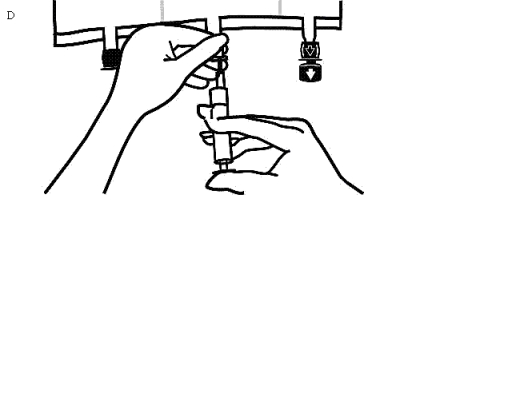
Håll i tillsatsportens sadel, stick in nålen och injicera tillsatslösningen (med känd blandbarhet) genom mitten av injektionsstället (Bild D).
-
Blanda noggrant mellan varje injektion genom att vända påsen tre gånger. Använd kanyler med nålar av storleken 18-23 gauge och en maximal längd på 40 mm.
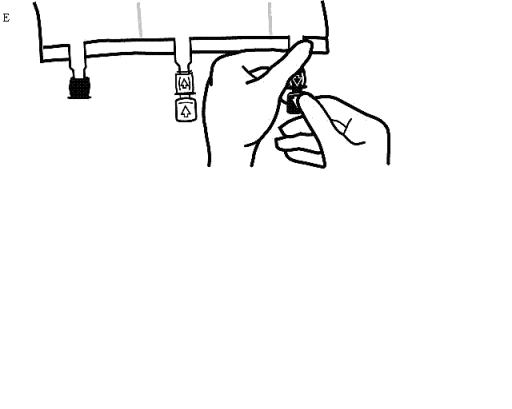
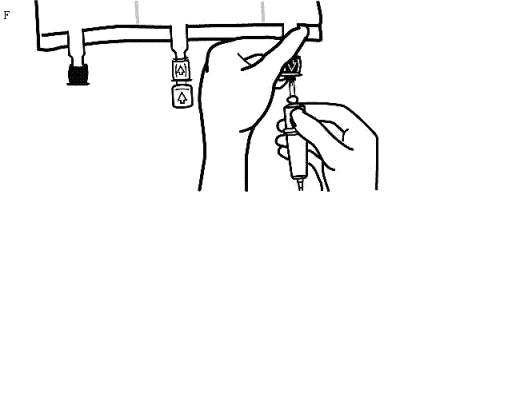
-
Omedelbart innan infusionsaggregatet förs in, ta av förseglingen från den blåa infusionsporten (Bild E).
Observera: Infusionsportens membran är sterilt.
-
Använd ickeluftade infusionsaggregat eller stäng luftningsventilen på ett luftat set.
-
Håll i infusionsportens sadel.
-
Tryck in spetsen genom infusionsportens skyddshinna. Hela spetsen måste vara inne för att säkerställa dess placering (Bild F).
Observera: Innerdelen av infusionsporten är steril.
4. Upphängning av påsen
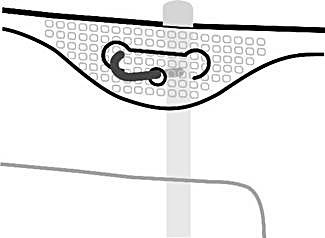
-
Häng upp påsen i hålet under handtaget.





