FIRMAGON
degarelix
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa den igen.
-
Om du har ytterligare frågor vänd dig till läkare.
-
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad FIRMAGON är och vad det används för
2. Vad du behöver veta innan du använder FIRMAGON
3. Hur du använder FIRMAGON
4. Eventuella biverkningar
5. Hur FIRMAGON ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad FIRMAGON är och vad det används för
FIRMAGON innehåller degarelix.
Degarelix är en syntetisk hormonblockerare som används vid behandling av prostatacancer och för behandling av högrisk prostatacancer före strålbehandling samt i kombination med strålbehandling hos vuxna män. Degarelix liknar ett naturligt hormon (gonadotropinfrisättande hormon, GnRH) och blockerar dess effekter genom en direkt verkan. Därigenom minskar degarelix omedelbart nivån av det manliga hormonet testosteron som stimulerar prostatacancer.
2. Vad du behöver veta innan du använder FIRMAGON
Använd inte FIRMAGON
-
om du är allergisk mot degarelix eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
Varningar och försiktighet
Tala om för läkaren om du har något av följande:
-
Några kardiovaskulära tillstånd eller problem med hjärtrytmen (arytmi) eller behandlas med läkemedel mot detta tillstånd. Risken för hjärtrytmrubbningar kan öka vid användning av FIRMAGON.
-
Diabetes mellitus. Förvärring eller debut av diabetes kan inträffa. Om du har diabetes kan du behöva mäta blodsockret oftare.
-
Leversjukdom. Leverfunktionen kan behöva övervakas.
-
Njursjukdom. Användning av FIRMAGON har inte undersökts hos patienter med allvarlig njursjukdom.
-
Osteoporos (benskörhet) eller något annat tillstånd som kan påverka styrkan i dina ben. En minskad testosteronnivå kan minska kalcium i benet (benförtunning).
-
Allvarlig överkänslighet. Användning av FIRMAGON har inte undersökts hos patienter med allvarliga överkänslighetsreaktioner.
Barn och ungdomar
Ge inte detta läkemedel till barn eller ungdomar.
Andra läkemedel och FIRMAGON
FIRMAGON kan påverka vissa läkemedel som används mot hjärtrytmrubbningar (t ex kinidin, prokainamid, amiodaron och sotalol) eller andra läkemedel som kan påverka hjärtrytmen (t ex metadon (som används för smärtlindring och som avgiftning vid missbruk), cisaprid, moxifloxacin (ett antibiotikum), antipsykotiska medel).
Tala om för läkaren om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Körförmåga och användning av maskiner
Trötthet och yrsel är vanliga biverkningar som kan försämra din förmåga att köra bil eller använda maskiner. Dessa biverkningar kan orsakas av behandlingen eller vara symtom på sjukdomen.
3. Hur du använder FIRMAGON
Detta läkemedel injiceras vanligen av en sköterska eller läkare.
Rekommenderad startdos är två injektioner om 120 mg efter varandra. Därefter kommer du att få en injektion om 80 mg per månad. Den injicerade vätskan bildar en gel från vilken degarelix frisätts under en månad
FIRMAGON får ENDAST injiceras under huden (subkutant). FIRMAGON får INTE ges i ett blodkärl (intravenöst). Försiktighetsåtgärder måste vidtas för att undvika injektion i en ven av misstag. Injektionsstället varierar inom bukområdet.
Om du har glömt att använda FIRMAGON
Tala med läkaren om du tror att din månadsdos av FIRMAGON har glömts bort.
Om du har ytterligare frågor om detta läkemedel kontakta läkare.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Mycket allvarliga allergiska reaktioner är sällsynta för detta läkemedel. Upplever du svåra utslag, klåda och får svårt att andas, kan detta vara symtom på en allvarlig allergisk reaktion.
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
Värmevallningar, smärta och rodnad vid injektionsstället. Biverkningar vid injektionsstället är vanligare med startdosen än med underhållsdosen.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
-
svullnad, knutor och förhårdnad på injektionsstället
-
frossa, feber eller influensaliknande symtom efter injektionen
-
sömnproblem, trötthet, yrsel, huvudvärk
-
viktökning, illamående, diarré, förhöjda leverenzymvärden
-
ökad svettning (inkluderat nattliga svettningar), hudutslag
-
blodbrist (anemi)
-
smärta och obehag i muskler och skelett
-
förminskad testikelstorlek, bröstsvullnad, impotens
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
-
förlust av sexualdrift, smärta i testiklarna, bäckensmärta, utebliven sädesuttömning, irritation i genitalierna, bröstsmärta
-
depression, mental försämring
-
hudrodnad, håravfall, knutor i huden, känselbortfall
-
allergiska reaktioner, nässelfeber, klåda
-
nedsatt aptit, förstoppning, kräkning, muntorrhet, buksmärta, magbesvär, blodsockerhöjning/diabetes, kolesterolökning, förändringar av kalcium i blodet, viktminskning
-
högt blodtryck, förändringar i hjärtrytmen, förändringar i EKG (QT-förlängning), känsla av oregelbundna hjärtslag, andnöd, svullna händer och fötter
-
muskelsvaghet, muskelryckningar, svullna/stela leder, benskörhet/benbrist, ömma leder
-
tätare och brådskande urinering, svårighet att urinera, smärtsam urinering, nattlig urinering, försämrad njurfunktion, inkontinens
-
dimsyn
-
obehag vid injektion inklusive blodtrycksfall och långsam hjärtrytm (vasovagal reaktion)
-
sjukdomskänsla.
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
-
neutropen feber (ett mycket lågt antal vita blodkroppar i kombination med feber), hjärtattack och hjärtsvikt
-
oförklarlig smärta, kramper, ömhet eller svaghet i musklerna. Muskelproblemen kan vara allvarliga, inklusive muskelnedbrytning som resulterar i njurskador.
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare)
-
infektion, abscess eller nekros (lokal vävnadsdöd) vid injektionsstället
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur FIRMAGON ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på ytterkartong, injektionsflaska och spruta. Utgångsdatumet är den sista dagen i angiven månad.
Inga särskilda förvaringsanvisningar.
Efter beredning
Detta läkemedel är hållbart i 2 timmar vid 25ºC.
På grund av risken för mikrobiologisk kontaminering bör detta läkemedel användas omedelbart. Om det inte används omedelbart är användning av detta läkemedel användarens ansvar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
-
Den aktiva substansen är degarelix. Varje injektionsflaska innehåller 80 mg degarelix (som acetat). 1 ml färdigberedd lösning innehåller 20 mg degarelix.
-
Övrigt innehållsämne i pulver är mannitol (E421).
-
Vätskan består av vatten till injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
FIRMAGON är ett pulver och lösningsmedel för injektionsvätska, lösning. Pulvret är vitt till benvitt. Lösningsmedlet är en klar, färglös lösning.
FIRMAGON finns tillgängligt i 2 förpackningsstolekar.
Förpackningsstorlek med 1 tråg innehållande:
1 injektionsflaska med pulver innehållande 80 mg degarelix, 1 förfylld injektionsspruta med 4,2 ml spädningsvätska, 1 sprutkolv, 1 adapter till injektionsflaska, 1 injektionsnål
Förpackningsstorlek med 3 tråg innehållande:
3 injektionsflaskor innehållande 80 mg degarelix och 3 förfyllda injektionssprutor med 4,2 ml spädningsvätska. 3 sprutkolvar, 3 adaptrar till injektionsflaska och 3 injektionsnålar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Ferring Pharmaceuticals A/S
Amager Strandvej 405
2770 Kastrup
Danmark
Tel: +45 88 33 88 34
Tillverkare
Ferring GmBH
Wittland 11
D-24109 Kiel
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
|
België/Belgique/Belgien Ferring N.V. Tel/Tél: +32-53 72 92 00 ferringnvsa@ferring.be |
Lietuva CentralPharma Communication UAB Tel.: +370 5 243 0444 centralpharma@centralpharma.lt |
|
България Φаρмонт ЕООД Тел: +359 2 807 5022 farmont@farmont.bg |
Luxembourg/Luxemburg Ferring N.V. Belgique/Belgien Tel/Tél: +32-53 72 92 00 ferringnvsa@ferring.be |
|
Česká republika Ferring Pharmaceuticals CZ s.r.o. Tel: +420 234 701 333 cz1-info@ferring.com |
Magyarország Ferring Magyarország Gyógyszerkereskedelmi Kft. Tel.: +36 1 236 3800 ferring@ferring.hu |
|
Danmark Ferring Lægemidler A/S Tlf: +45 88 16 88 17 |
Malta E.J. Busuttil Ltd Tel: +356 21447184 info@ejbusuttil.com |
|
Deutschland Ferring Arzneimittel GmbH Tel: +49-(0)431-5852 0 info-service@ferring.de |
Nederland Ferring B.V. Tel: +31-235680300 infoNL@ferring.com |
|
Eesti CentralPharma Communication OÜ Tel: +372 601 5540 centralpharma@centralpharma.ee |
Norge Ferring Legemidler AS Tlf: +47 22 02 08 80 mail@oslo.ferring.com |
|
Ελλάδα Ferring Ελλάς MEΠΕ Τηλ: +30 210 68 43 449 |
Österreich Ferring Arzneimittel Ges.m.b.H. Tel: +43 1 60 8080 office@ferring.at |
|
España Ferring, S.A.U. Tel: +34 91 387 70 00 Registros@ferring.com |
Polska Ferring Pharmaceuticals Poland Sp. z o.o. Tel: +48 22 246 06 80 PL0-Recepcja@ferring.com |
|
France Ferring S.A.S. Tél : +33 1 49 08 67 60 information.medicale@ferring.com |
Portugal Ferring Portuguesa – Produtos Farmacêuticos, Sociedade Unipessoal, Lda. Tel: +351 21 940 5190 |
|
Hrvatska Clinres farmacija d.o.o. Tel: +385 1 2396 900 info@clinres-farmacija.hr |
România Ferring Pharmaceuticals Romania SRL Tel: +40 356 113 270 |
|
Ireland Ferring Ireland Ltd. Tel: +353 1 4637355 EnquiriesIrelandMailbox@ferring.com |
Slovenija SALUS, Veletrgovina, d.o.o. Tel: +386 1 5899 179 regulatory@salus.si |
|
Ísland Vistor hf. Sími: +354 535 70 00 |
Slovenská republika Ferring Slovakia s.r.o. Tel: +421 2 54 416 010 SK0-Recepcia@ferring.com |
|
Italia Ferring S.p.A. Tel: +39 02 640 00 11 |
Suomi/Finland Ferring Lääkkeet Oy Puh/Tel: +358 207 401 440 info@ferring.fi |
|
Κύπρος A. Potamitis Medicare Ltd Τηλ: +357 22583333 a.potamitismedicare@cytanet.com.cy |
Sverige Ferring Läkemedel AB Tel: +46 40 691 69 00 info@ferring.se |
|
Latvija CentralPharma Communication SIA Tālr.: +371 674 50497 centralpharma@centralpharma.lv |
United Kingdom (Northern Ireland) Ferring Ireland Ltd. Tel: +353 1 4637355 EnquiriesIrelandMailbox@ferring.com |
Denna bipacksedel ändrades senast 2022-03-30
Övriga informationskällor
Information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu/.
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Bruksanvisning för korrekt användning
OBSERVERA:
-
SKAKA INTE INJEKTIONSFLASKAN
Förpackningen innehåller en injektionsflaska med pulver och en förfylld injektionsspruta med spädningsvätska som måste färdigställas för subkutan injektion.
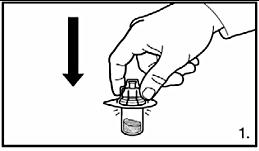
|
1. Ta bort skyddet från adapterförpackningen. Sätt fast adaptern på injektionsflaskan med pulver genom att pressa ner adaptern tills spetsen trycks genom gummiproppen och adaptern knäpps på plats. |
|
2. Förbered den förfyllda sprutan genom att sätta fast sprutkolven. |
|
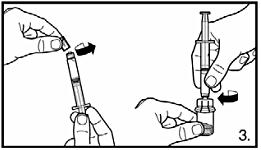
|
3. Ta bort skyddshatten från den förfyllda sprutan. Sätt fast sprutan på injektionsflaskan med pulver genom att skruva fast den på adaptern. Överför all spädningsvätska till injektionsflaskan med pulver. |
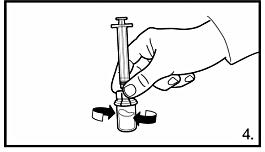
|
4. Med sprutan fortfarande fastsatt på adaptern, snurra försiktigt tills vätskan är klar och utan olösta partiklar. Om pulvret fäster vid glaset ovanför vätskeytan kan injektionsflaskan lutas försiktigt. För att undvika skumbildning: skaka inte flaskan. En ring med små luftbubblor på vätskans yta är acceptabelt. Beredningsprocessen tar vanligtvis några minuter men kan i vissa fall ta upp till 15 minuter. |
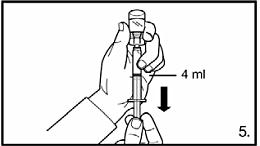
|
5. Vänd injektionsflaskan upp-och-ner och dra upp lösningen till markeringen på injektionssprutan. Se alltid till att dra upp exakt volym och avlägsna eventuella luftbubblor. |
|
6. Ta bort sprutan från adaptern och sätt fast nålen för djup subkutan injektion på sprutan. |
|
|
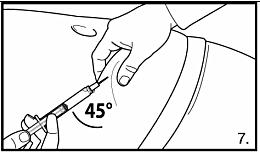
7. Utför en djup subkutan injektion. För att göra detta: Ta tag i huden på buken, lyft upp den subkutana vävnaden och stick in nålen djupt i minst 45 graders vinkel. Injicera 4 ml FIRMAGON 80 mg långsamt omedelbart efter beredningen*. |
|
8. Injektionerna bör inte ges i områden där patienten exponeras för tryck, t ex i närheten av bälte eller byxlinning eller nära revbenen. Injicera inte direkt i en ven. Dra försiktigt tillbaka kolven för att se om blod sugits upp. Om det finns blod i sprutan kan produkten inte längre användas. Avbryt processen och kassera sprutan och nålen. (Färdigställ en ny dos för patienten.) |
|
* Kemisk och fysisk stabilitet vid användning har visats för 2 timmar vid 25ºC. Ur mikrobiologisk synvinkel bör produkten användas omedelbart, såvida inte beredningsmetoden utesluter risk för mikrobiologisk kontaminering. Om produkten inte används omedelbart är förvaringstider och förhållanden vid användning användarens ansvar.





