Indikationer
RotaTeq är indicerat för aktiv immunisering av spädbarn från 6 till 32 veckors ålder för förebyggande av gastroenterit orsakat av rotavirusinfektion (se avsnitt Dosering, Varningar och försiktighet och Farmakodynamik).
Användningen av RotaTeq ska ske i enlighet med officiella rekommendationer.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Överkänslighet efter en föregående administrering av rotavirusvaccin.
Tidigare anamnes på tarminvagination.
Patienter med medfödd missbildning av magtarmkanalen som kan vara predisponerande för tarminvagination.
Spädbarn med känd eller misstänkt nedsättning av immunförsvaret (se avsnitten Varningar och försiktighet och Biverkningar).
Administrering av RotaTeq bör senareläggas hos spädbarn med allvarlig akut febersjukdom. Förekomst av lindrig infektion utgör dock ingen kontraindikation för immunisering.
Administrering av RotaTeq bör senareläggas hos patienter med akut diarré eller kräkning.
Dosering
Dosering
Från födseln till 6 veckors ålder
RotaTeq är inte avsett för denna del av den pediatriska populationen.
Säkerhet och effekt för RotaTeq för barn från födseln till 6 veckors ålder har inte fastställts.
Från 6 veckors till 32 veckors ålder
Vaccinationskuren består av tre doser.
Den första dosen av RotaTeq kan administreras från 6 veckors ålder men inte senare än 12 veckors ålder.
RotaTeq får ges till prematura spädbarn förutsatt att graviditeten varade minst 25 veckor. Dessa spädbarn bör få den första dosen RotaTeq minst sex veckor efter födseln (se avsnitten Varningar och försiktighet och Farmakodynamik)
Doserna ska ges med ett intervall på minst 4 veckor mellan varje dos.
Vaccinationskuren med tre doser bör helst vara avslutad vid 20–22 veckors ålder. Om nödvändigt, kan den tredje (sista) dosen ges upp till och med 32 veckors ålder (se avsnitt Farmakodynamik).
Eftersom det inte finns någon data angående utbytbarheten av RotaTeq och andra rotavirusvaccin, rekommenderas det att spädbarn som får sin första dos av RotaTeq bör fortsätta med samma vaccin för de efterföljande doserna.
Om man observerar eller har en stark misstanke om att en ofullständig dos har svalts (t.ex. om barnet spottar ut eller kräks upp vaccinet) kan man ge en extra dos som ersättning vid samma vaccinationsbesök. Detta har dock inte undersökts i kliniska prövningar. Om problemet uppstår igen ska ingen ytterligare ersättningsdos ges.
Inga ytterligare doser rekommenderas efter fullföljandet av vaccinationskuren med 3 doser (se avsnitt Varningar och försiktighet och Farmakodynamik angående tillgänglig information om bestående skydd).
Från 33 veckors till 18 års ålder
RotaTeq är inte avsett för denna del av den pediatriska populationen.
Administreringssätt
RotaTeq får endast administreras oralt.
RotaTeq FÅR INTE UNDER NÅGRA OMSTÄNDIGHETER INJICERAS.
RotaTeq kan administreras utan hänsyn till mat, vätska eller bröstmjölk.
Se avsnitt Hållbarhet, förvaring och hantering för anvisningar om administrering.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Som för alla vacciner bör adekvat medicinsk behandling finnas lätt tillgänglig i fall av anafylaktisk reaktion som kan uppträda efter administrering av vaccinet (se avsnitt Biverkningar)
Uppgifter om säkerhet och effekt från kliniska prövningar saknas angående administrering av RotaTeq till spädbarn med nedsatt immunförsvar, de som exponerats för en immunsuppressiv behandling in utero, spädbarn som infekterats med hiv eller spädbarn som fått en blodtransfusion eller immunglobuliner inom 42 dagar före vaccinering. Asymtomatisk hiv-infektion förväntas inte påverka säkerheten eller effekten för RotaTeq. Eftersom tillräcklig data saknas rekommenderas dock inte administrering av RotaTeq till spädbarn med asymtomatisk hiv-infektion. Administrering av RotaTeq till spädbarn som exponerats för immsunsuppressiv behandling in utero bör baseras på noggrant övervägande av potentiella fördelar och risker.
Efter godkännandet för försäljning har det rapporterats om fall av gastroenterit associerade med vaccinvirus hos spädbarn med svår kombinerad immunbrist (SCID, se avsnitt Kontraindikationer).
I kliniska prövningar påvisades RotaTeq i avföringen hos 8,9 % av vaccinerade barn nästan enbart under veckan efter dos 1 och hos endast en vaccinmottagare (0,3 %) efter dos 3. Den högsta utsöndringen inträffade inom 7 dagar efter doseringen. Överföring av vaccinvirusstammar till icke-vaccinerade kontakter har observerats efter introduktion på marknaden. RotaTeq bör därför administreras med försiktighet till individer med nära kontakter som har nedsatt immunförsvar (t.ex. individer med maligniteter eller som på annat sätt är immunkomprometterade, eller individer som genomgår immunsuppressiv behandling). Dessutom ska personer som sköter om spädbarn som nyligen har fått vaccin, vidta noggranna hygienåtgärder, särskilt när de har hanterat exkret.
I en klinisk prövning administrerades RotaTeq till ca 1 000 spädbarn som föddes efter 25 till 36 graviditetsveckor. Den första dosen administrerades från 6 veckor efter födseln. Säkerhet och effekt för RotaTeq var jämförbara mellan denna subgrupp spädbarn och spädbarn som föddes efter fullgången graviditet. Dock föddes 19 av de ca 1 000 spädbarnen efter 25 till 28 veckor, 55 föddes efter 29 till 31 veckor och återstoden föddes efter 32 till 36 veckor. Se avsnitten Dosering och Farmakodynamik.
Tarminvagination
Som en försiktighetsåtgärd ska hälso- och sjukvårdspersonal följa upp eventuella symtom som antyder tarminvagination (svåra buksmärtor, ihållande kräkningar, blodig avföring, uppsvälld buk och/eller hög feber) eftersom data från observationsstudier tyder på en ökad risk för tarminvagination, oftast inom 7 dagar efter rotavirusvaccination (se avsnitt Biverkningar).Föräldrar/vårdnadshavare ska instrueras att omgående rapportera sådana symtom till vårdgivaren.
För spädbarn med benägenhet för tarminvagination, se avsnitt Kontraindikationer.
Det saknas uppgifter om säkerhet och effekt för spädbarn med aktiv mag-tarmsjukdom (inklusive kronisk diarré) eller tillväxtretardation. Administrering av RotaTeq kan övervägas till sådana spädbarn, om det enligt läkarens åsikt medför en högre risk att inte ge vaccinet och om försiktighet iakttas.
Skyddsnivån som uppnås med RotaTeq baseras på att alla 3 doserna ges i sin helhet. Liksom för alla vacciner är det inte säkert att vaccination med RotaTeq leder till fullständigt skydd hos alla mottagare. RotaTeq skyddar inte mot gastroenterit orsakat av andra patogener än rotavirus.
Kliniska prövningar avseende effekt mot gastroenterit orsakad av rotavirus har utförts i Europa, USA, Latinamerika och Asien. I dessa prövningar var G1P[8] den mest förekommande genotypen av rotavirus, medan genotyperna G2P[4], G3P[8], G4P[8] och G9P[8] identifierades mer sällan. Graden av RotaTeqs skydd mot infektion orsakad av andra typer av rotavirus och i andra befolkningsgrupper är inte känd.
Det saknas kliniska data för användningen av RotaTeq som profylax efter exponering.
Den potentiella risken för apné och behovet av andningsövervakning under 48‑72 timmar ska beaktas när primärimmuniseringsserien ges till mycket prematura spädbarn (födda ≤ 28 graviditetsveckor) och särskilt för dem med tidigare känd omogen lungutveckling. Eftersom fördelen med vaccination är hög för denna spädbarnsgrupp ska vaccinationen inte utebli eller skjutas upp.
RotaTeq FÅR INTE UNDER NÅGRA OMSTÄNDIGHETER INJICERAS.
Sackaros
RotaTeq innehåller sackaros. Patienter med något av följande sällsynta, ärftliga tillstånd bör inte använda detta läkemedel: fruktosintolerans, glukos-galaktosmalabsorption eller sukras-isomaltas-brist. Se avsnitt Innehåll.
Natrium
Detta vaccin innehåller 37,6 mg natrium per dos, motsvarande 1,88 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna). Se avsnitt Innehåll.
Interaktioner
Samtidig administrering av RotaTeq och vacciner innehållande en eller flera av följande antigener vid ca 2, 4 och 6 månaders ålder visade att immunsvaret och säkerhetsprofilen för de administrerade vaccinerna inte påverkades:
-
Vaccin mot difteri, stelkramp och kikhosta, acellulärt (DTaP)
-
Vaccin mot Haemophilus influenzae typ b (Hib)
-
Vaccin mot polio, inaktiverat (IPV)
-
Vaccin mot hepatit B (HBV)
-
Vaccin mot pneumokockinfektioner, konjugerat (PCV).
Samtidig administrering av RotaTeq och DTaP-IPV-HBV-Hib-vaccin (Infanrix hexa) vid ca 2, 3 och 4 månaders ålder visade att immunsvaret och säkerhetsprofilen för de administrerade vaccinerna inte påverkades jämfört med separat administrering.
Samtidig administrering av RotaTeq och ett konjugerat vaccin mot grupp C-meningokockinfektion (MenCC, det vaccin som studerats var ett tetanustoxoidkonjugat) vid 3 och 5 månaders ålder (och oftast samtidigt som DTaP-IPV-Hib-vaccin) följt av en tredje dos RotaTeq vid ca 6 månaders ålder visade att immunsvaret för RotaTeq och MenCC inte påverkades. Samtidig administrering resulterade i en acceptabel säkerhetsprofil.
Samtidig administrering av RotaTeq och oralt vaccin mot polio (OPV) påverkade inte immunsvaret på poliovirusantigenerna. Även om samtidig administrering av OPV reducerade immunsvaren på rotavirusvaccin en aning, så finns det för tillfället ingen evidens för att kliniskt skydd mot svår rotavirus-gastroenterit påverkas. Immunsvar på RotaTeq påverkades inte när OPV administrerades två veckor efter RotaTeq.
Därför kan RotaTeq ges samtidigt som monovalenta eller kombinerade vaccin för spädbarn innehållande en eller flera av följande antigener: DTaP, Hib, IPV eller OPV, HBV, PCV och MenCC.
Graviditet
RotaTeq är endast avsett för användning hos spädbarn. Således finns inga data angående användning under graviditet tillgängliga.
Amning
RotaTeq är endast avsett för användning hos spädbarn. Således finns inga data angående användning under amning tillgängliga.
Fertilitet
Fertilitets-eller reproduktionsstudier på djur har inte utförts.
Trafik
Ej relevant.
Biverkningar
a. Sammanfattning av säkerhetsprofilen
I en subgrupp av spädbarn från 3 placebokontrollerade kliniska prövningar, i vilka 6 130 fick RotaTeq och 5 560 placebo, utvärderades RotaTeq angående alla biverkningar inom 42 dagar efter vaccination med eller utan samtidig användning av andra pediatriska vacciner. Av spädbarnen som fick RotaTeq rapporterade totalt 47 % en biverkan, jämfört med 45,8 % av spädbarnen som fick placebo. De vanligaste oönskade reaktionerna som förekom oftare med vaccin än med placebo var feber (20,9 %), diarré (17,6 %) och kräkning (10,1 %).
Allvarliga biverkningar bedömdes hos alla deltagare (n=36 150 RotaTeq och n=35 536 placebo) från 3 kliniska prövningar i upp till 42 dagar efter varje dos. Den totala frekvensen av allvarliga biverkningar var 0,1 % bland RotaTeq-mottagare och 0,2 % bland placebomottagare.
b. Sammanfattningstabell över biverkningar
De biverkningar som var vanligare i vaccingruppen i kliniska prövningar listas nedan per organsystem och frekvens. Baserat på data sammanställda från 3 kliniska prövningar, i vilka 6 130 spädbarn fick RotaTeq och 5 560 spädbarn fick placebo, var de angivna biverkningarna mellan 0,2 % och 2,5 % vanligare i gruppen som fick RotaTeq.
Frekvenserna rapporteras som:
Mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000); mycket sällsynta (<1/10 000); ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Biverkningar efter administrering av RotaTeq i kliniska prövningar och biverkningar som rapporterats efter introduktion på marknaden (i kursiv stil) |
||
|---|---|---|
|
Organsystem |
Frekvens |
Biverkning |
|
Infektioner och infestationer |
Vanliga |
Övre luftvägsinfektion |
|
Mindre vanliga |
Nasofaryngit, otitis media |
|
|
Immunsystemet |
Ingen känd frekvens |
Anafylaktisk reaktion†† |
|
Andningsvägar, bröstkorg och mediastinum |
Sällsynta |
Bronkospasm |
|
Magtarmkanalen |
Mycket vanliga |
Diarré, kräkningar |
|
Mindre vanliga |
Hematochezi†, smärta i övre delen av buken |
|
|
Mycket sällsynta |
Tarminvagination α* |
|
|
Hud och subkutan vävnad |
Mindre vanliga |
Utslag |
|
Sällsynta |
Urticaria†*
|
|
|
Ingen känd frekvens |
Angioödem†† |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mycket vanliga |
Feber |
|
Ingen känd frekvens |
Irritabilitet†† |
|
† Denna biverkning identifierades genom övervakning efter introduktion på marknaden. Frekvenskategorin uppskattades baserat på relevanta kliniska prövningar.
αFrekvenskategorin uppskattades baserat på data från observationsstudier.
* Se avsnitt Varningar och försiktighet.
††Biverkningar efter introduktion på marknaden (frekvensen kan inte beräknas från tillgängliga data).
c. Beskrivning av utvalda biverkningar
Kawasakis sjukdom rapporterades hos 5 av 36 150 mottagare av vaccin (< 0,1 %) och 1 av 35 536 mottagare av placebo (< 0,1 %) med en relativ risk (RR) på 4,9 [95 % KI, 0,6 – 239,1] (ej statistiskt signifikant). Ingen ökad risk för Kawasakis sjukdom observerades bland spädbarn som fick RotaTeq i en stor observationsstudie för kontroll av säkerheten efter introduktion på marknaden (se avsnitt Farmakodynamik).
Tarminvagination
Data från observationsstudier avseende säkerhet utförda i flera länder tyder på att rotavirusvaccin ger en ökad risk för tarminvagination, med upp till 6 ytterligare fall per 100 000 spädbarn inom 7 dagar efter vaccination. Det finns begränsade belägg för en mindre riskökning efter den andra dosen. Bakgrundsincidensen av tarminvagination hos spädbarn under ett års ålder i dessa länder sträckte sig från 25 till 101 per 100 000 spädbarn per år. Det är oklart om rotavirusvaccin påverkar den totala incidensen av tarminvagination baserat på längre uppföljningsperioder (se avsnitt Varningar och försiktighet).
d. Andra speciella populationer
Apné hos mycket prematura spädbarn (födda ≤28 graviditetsveckan) (se avsnitt Varningar och försiktighet)
Gastroenterit med utsöndring av vaccinvirus hos spädbarn med svår kombinerad immunbrist (SCID) har rapporterats efter introduktion på marknaden.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det har förekommit rapporter om administrering av doser som varit högre än de rekommenderade doserna av RotaTeq.
Generellt sett var biverkningsprofilen vid överdosering jämförbar med den som observerats med rekommenderade doser av RotaTeq.
Farmakodynamik
Effekt
I kliniska prövningar visades effekt mot gastroenterit orsakad av rotavirus av genotyperna G1P[8], G2P[4], G3P[8], G4P[8] och G9P[8].
Den skyddande effekten av RotaTeq utvärderades på två sätt i den placebo-kontrollerade prövningen Rotavirus Efficacy and Safety Trial (REST):
-
Hos 5 673 vaccinerade spädbarn (2 834 i vaccingruppen) uppmättes skyddseffekten som en reduktion av incidensen av rotavirus- (RV-) gastroenterit orsakad av vaccingenotyper (G1-G4) som inträffade minst 14 dagar efter den tredje vaccindosen och genom hela den första rotavirussäsongen efter vaccination.
-
Hos 68 038 vaccinerade spädbarn (34 035 i vaccingruppen) uppmättes skyddseffekten som en reduktion av antalet hospitaliseringar och besök på akutmottagningar för RV-gastroenterit från 14 dagar efter den tredje dosen.
Resultaten av analyserna presenteras i följande tabell.
|
Reduktion av incidensen av RV-gastroenterit under en hel säsong efter vaccination (RotaTeq n=2834) % [95 % KI] |
||||||
|---|---|---|---|---|---|---|
|
Effekt mot någon allvarlighetsgrad per rotavirusgenotyp |
||||||
|
Allvarlig* sjukdom (G1-G4) |
Alla svårighets-grader (G1-G4) |
G1 |
G2 |
G3 |
G4 |
G9 |
|
98,0 % [88,3; 100,0]† |
74,0 % [66,8; 79,9]† |
74,9 % [67,3; 80,9]† |
63,4 % [2,6; 88,2]† |
82,7 % [<0; 99,6] |
48,1 % [<0; 91,6] |
65,4 % [<0; 99,3] |
* Allvarlig definieras som >16 poäng av maximalt 24, enligt ett validerat kliniskt klassificeringssystem grundat på intensitet och varaktighet av symtom (feber, kräkning, diarré och beteendeförändringar).
† Statistiskt signifikant
|
Reduktion av antalet hospitaliseringar/besök på akutmottagningar för RV-gastroenterit i upp till 2 år efter vaccination (RotaTeq n=34 035) [95 % KI] |
|||||
|---|---|---|---|---|---|
|
G1-G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
|
94,5 % [91,2; 96,6]† |
95,1 % [91,6; 97,1]† |
87,6 % [<0; 98,5] |
93,4 % [49,4; 99,1]† |
89,1 % [52,0; 97,5]† |
100 % [69,6; 100]† |
† Statistiskt signifikant
Reduktion av incidensen av RV-gastroenterit orsakad av genotyperna G1-G4 under den andra rotavirussäsongen efter vaccination var 88,0 % [95 % KI 49,4; 98,7] för allvarlig gastroenterit och 62,6 % [95% KI 44,3; 75,4] för gastroenterit oavsett svårighetsgrad.
Effekten mot rotavirusgenotyperna G2P[4], G3P[8], G4P[8] och G9P[8] baserades på färre fall än för G1. Effekten som observerades mot G2P[4] orsakades troligtvis av vaccinets G2-komponent.
I en kombinerad post-hoc-analys av REST och en annan fas III-studie, var vaccinets effekt mot RVG-fall orsakade av G1-, G2-, G3- och G4-serotyp (oavsett svårighetsgrad) 61,5 % [95 % KI: 14,2; 84,2] hos spädbarn i åldern >26 till ≤32 veckor vid dos 3.
En utvidgning av REST genomfördes i enbart Finland. Denna finska utvidgningsstudie (FES) omfattade 20 736 individer som tidigare inkluderats i REST. I FES följdes spädbarnen under upp till 3 år efter vaccinationen.
Inom REST uppsöktes sjukvården 403 gånger (20 gånger i vaccingruppen och 383 i placebogruppen) i samband med RV-gastroenterit orsakad av G1-G4 och G9 i per-protokoll-populationen. Ytterligare data från FES ökade antalet med totalt 136 besök, varav 9 i vaccingruppen och 127 i placebogruppen. Sammantaget skedde 31 % respektive 25 % av besöken i de olika grupperna under FES.
Baserat på kombinerade data från REST och FES minskade antalet fall av inläggning på sjukhus och besök på akutmottagningar för RV-gastroenterit upp till 3 år efter vaccinationen med 94,4 % (95 % KI: 91,6; 96,2) för genotyperna G1-G4, 95,5 % (95 % KI: 92,8; 97,2) för genotyp G1, 81,9 % (95 % KI: 16,1; 98,0) för genotyp G2, 89,0 % (95 % KI: 53,3; 98,7) för genotyp G3, 83,4 % (95 % KI: 51,2; 95,8) för genotyp G4 och 94,2 % (95 % KI: 62,2; 99,9) för genotyp G9. Under år 3 förekom inga sjukvårdskontakter för RV-gastroenterit i vaccingruppen (n=3 112) och en (ej typningsbar) i placebogruppen (n=3 126).
En fullständig vaccinationsserie bestående av 3 doser RotaTeq ska administreras (se avsnitt Dosering) för att tillhandahålla den nivå och varaktighet av skydd mot rotavirus-gastroenterit som observerades i de kliniska studierna. Post hoc-analyser indikerade dock att RotaTeq uppnådde viss minskning i antalet rotavirus-gastroenteritfall, av tillräcklig svårighetsgrad för att kräva inläggning på sjukhus eller besök på akutmottagning, innan alla 3 doser administrerats (dvs. från cirka 14 dagar efter administration av den första dosen och framåt).
Effekt hos prematura spädbarn
I REST administrerades RotaTeq till ca 1 000 spädbarn som var födda efter 25 till 36 graviditetsveckor. Effekten för RotaTeq var jämförbar mellan denna subgrupp spädbarn och spädbarn födda efter fullgången graviditet.
Observationsstudie för kontroll av säkerheten efter introduktion på marknaden
I en stor prospektiv observationsstudie efter introduktion på marknaden i USA, analyserades risken för Kawasakis sjukdom hos 85 150 spädbarn som fick en eller flera doser av RotaTeq (17 433 personårs uppföljningstid).
Under uppföljningsperioden 0-30 dagar efter vaccination, fanns ingen statistiskt signifikant skillnad i andelen fall av Kawasakis sjukdom jämfört med det förväntade bakgrundstalet. Dessutom fanns ingen statistiskt signifikant ökad risk för denna biverkning under uppföljningsperioden 0-30 dagar jämfört med en samtidig kontrollgrupp av spädbarn som fick DTaP, men inte RotaTeq (n=62 617, 12 339 personårs uppföljningstid). Ett bekräftat fall identifierades bland spädbarn vaccinerade med RotaTeq jämfört med ett bekräftat fall i den samtida kontrollgruppen DTaP (relativ risk = 0,7; 95 % KI: 0,01-55,56). I den allmänna säkerhetsanalysen identifierades inga specifika säkerhetsproblem.
Studiedata för effektivitet
Observationsstudier efter godkännande för försäljning som visar effektiviteten avseende förebyggande av RV-gastroenterit (RVGE)
|
Studiedesign (region) |
Studiepopulation |
Effektmått |
Effektivitet % [95 %KI] |
RV-säsong |
|
Analys av anspråksdatabas (USA) |
33 140 vaccinerade 26 167 ovaccinerade I åldern ≥7 månader Fick 3 doser |
Hospitalisering och besök på akutmottagningar på grund av RVGE Besök i öppenvård på grund av RVGE Hospitalisering och besök på akutmottagningar på grund av gastroenterit av alla orsaker |
100 % [87,100] 96 % [76,100] 59 % [47,68] |
2007-2008 |
|
Kohortstudie (Frankrike) |
1 895 vaccinerade med 3 doser 2 102 ovaccinerade I åldern <2 år |
Hospitalisering på grund RVGE |
98 % [83,100] |
2007-2008 2008-2009 |
|
Fallkontroll-studie (USA) |
402 fall 2 559 kontroller* I åldern <8 år Fick 3 doser |
Hospitalisering och besök på akutmottagningar på grund av RVGE Stamspecifik - G1P[8] - G2P[4] - G3P[8] - G12P[8] Åldersspecifik - 1:a levnadsåret - 2:a levnadsåret - 3:e levnadsåret - 4:e levnadsåret - 5:e levnadsåret - 6:e‑7:e levnadsåret |
80 % [74,84] 89 % [55,97] 87 % [65,95] 80 % [64,89] 78 % [71,84] 91 % [78,96] 82 % [69,89] 88 % [78,93] 76 % [51,88] 60 % [16,81] 69 % [43,84] |
2011-2012 2012-2013 |
|
*Kontroller med RV-negativ akut gastroenterit |
||||
Immunogenicitet
Den immunologiska mekanism genom vilken RotaTeq skyddar mot gastroenterit orsakat av rotavirus är inte fullständigt klarlagd. För närvarande har inte något immunologiskt korrelat för skydd identifierats för rotavirusvacciner. I fas III‑prövningar uppvisade mellan 92,5% och 100% av barn som fick RotaTeq en signifikant ökning av antirotavirus IgA i serum efter 3 vaccindoser. Vaccinet inducerar ett immunsvar med påvisande av neutraliserande antikroppar i serum mot de fem humana rotavirusproteinerna som uttrycks på reassortanterna (G1, G2, G3, G4 och P[8]).
Farmakokinetik
Ej relevant.
Prekliniska uppgifter
En oral toxicitetsstudie med engångsdos och upprepad dos på möss visade inga särskilda risker för människa. Dosen som administrerades till möss var cirka 2,79 x 108 infektionsenheter per kg (ungefär 14 gånger den planerade dosen till spädbarn).
Innehåll
Kvalitativ och kvantitativ sammansättning
En dos (2 ml) innehåller:
|
Rotavirus typ* G1 |
ej mindre än 2,2 x 106 IE1,2 |
|
Rotavirus typ* G2 |
ej mindre än 2,8 x 106 IE1,2 |
|
Rotavirus typ* G3 |
ej mindre än 2,2 x 106 IE1,2 |
|
Rotavirus typ* G4 |
ej mindre än 2,0 x 106 IE1,2 |
|
Rotavirus typ* P1A[8] |
ej mindre än 2,3 x 106 IE1,2 |
*Human-bovina rotavirusreassortanter (levande) producerade i Vero-celler.
1Infektiösa Enheter
2 Som lägre konfidensintervallsgräns (p= 0,95)
Hjälpämnen med känd effekt
Detta vaccin innehåller 1 080 mg sackarosoch 37,6 mg natrium (se avsnitt Varningar och försiktighet).
Förteckning över hjälpämnen
Sackaros
Natriumcitrat
Natriumdivätefosfatmonohydrat
Natriumhydroxid
Polysorbat 80
Odlingsmedia (innehållande oorganiska salter, aminosyror och vitaminer)
Renat vatten
Blandbarhet
Då blandbarhetsstudier saknas får detta vaccin inte blandas med andra läkemedel.
Miljöpåverkan
Rotavirus, G1 reassortant, levande
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment (Ref. I).
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
References
-
Committee for Medicinal Products for Human Use (CHMP); Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. 1 June 2006, Ref EMEA/CPMP/SWP/4447/00.
Rotavirus, G2 reassortant, levande
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment (Ref. I).
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
References
-
Committee for Medicinal Products for Human Use (CHMP); Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. 1 June 2006, Ref EMEA/CPMP/SWP/4447/00.
Rotavirus, G3 reassortant, levande
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment (Ref. I).
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
References
-
Committee for Medicinal Products for Human Use (CHMP); Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. 1 June 2006, Ref EMEA/CPMP/SWP/4447/00.
Rotavirus, G4 reassortant, levande
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment (Ref. I).
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
References
-
Committee for Medicinal Products for Human Use (CHMP); Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. 1 June 2006, Ref EMEA/CPMP/SWP/4447/00.
Rotavirus, P1 reassortant, levande
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment (Ref. I).
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
References
-
Committee for Medicinal Products for Human Use (CHMP); Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. 1 June 2006, Ref EMEA/CPMP/SWP/4447/00.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år
RotaTeq ska administreras genast efter uttagning från kylförvaring.
Särskilda förvaringsanvisningar
Förvaras och transporteras kallt (2oC-8oC).
Förvara doseringstuben i ytterkartongen. Ljuskänsligt.
Särskilda anvisningar för destruktion och övrig hantering
Vaccinet ska administreras oralt utan att blandas med några andra vacciner eller lösningar. Får ej spädas.
|
För att administrera vaccinet: |
|
|---|---|
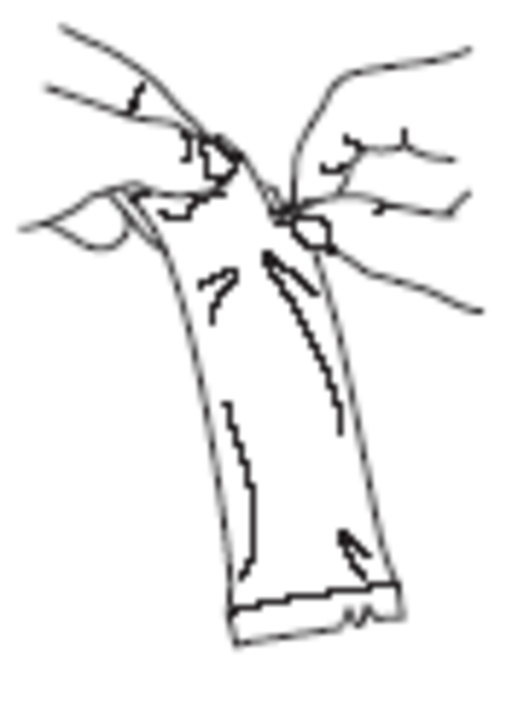
|
Riv upp skyddspåsen och ta ut doseringstuben. |
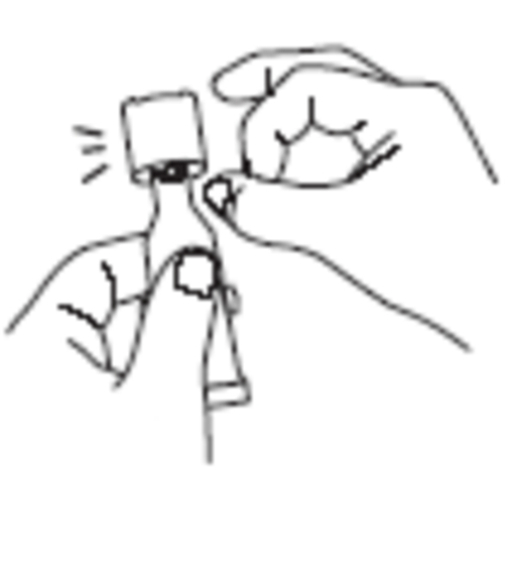
|
Avlägsna vätskan från tubens spets genom att hålla tuben lodrätt och knacka på den vridbara hatten. |

|
Öppna doseringstuben med 2 enkla rörelser: 1.Punktera tubens spets genom att skruva hatten medurs tills den fastnar. |
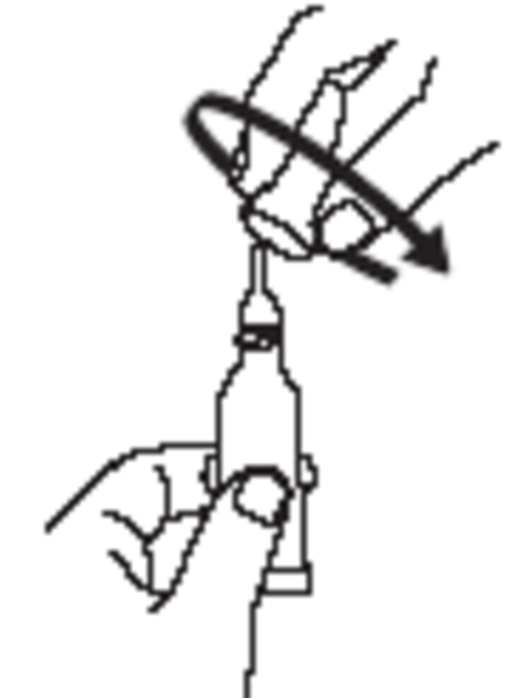
|
2.Avlägsna hatten genom att vrida den moturs. |
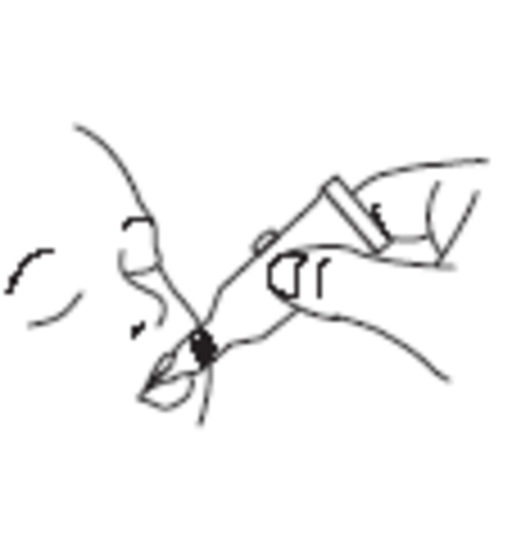
|
Administrera dosen genom att försiktigt klämma ut vätskan i barnets mun mot kindens insida tills doseringstuben är tom. (Det kan finnas en restdroppe kvar i tubens spets) |
|
|
Kasta den tomma tuben och hatten i godkända behållare för biologiskt avfall enligt lokala föreskrifter. |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Oral lösning
Blekgul, klar vätska som kan ha en rosa nyans





