Indikationer
Behandling av diabetes mellitus hos vuxna, ungdomar och barn från 1 års ålder.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller något hjälpämne som anges i avsnitt Innehåll.
Dosering
Dosering
Detta läkemedel är ett basinsulin för subkutan administrering en gång dagligen vid valfri tidpunkt, men lämpligen vid samma tidpunkt varje dag.
Insulinanalogers styrka, inklusive insulin degludek, uttrycks i enheter. En (1) enhet insulin degludek motsvarar 1 internationell enhet humant insulin, 1 enhet insulin glargin (100 enheter/ml), eller 1 enhet insulin detemir.
Hos patienter med diabetes mellitus typ 2 kan detta läkemedel administreras ensamt eller i vilken kombination som helst med perorala antidiabetika, GLP-1 receptoragonister samt bolusinsulin (se avsnitt Farmakodynamik).
Vid diabetes mellitus typ 1 måste Tresiba kombineras med ett kort-/snabbverkande insulin för att täcka behovet av insulin vid måltiderna.
Tresiba ska doseras enligt den enskilda patientens behov. Det rekommenderas att optimera den glykemiska kontrollen med hjälp av dosjusteringar utifrån fastande plasmaglukosvärden.
Justering av dosen kan bli nödvändig vid ökad fysisk ansträngning, förändrad diet eller i samband med annan sjukdom.
Tresiba 100 enheter/ml och Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Tresiba finns i två styrkor. I båda fallen ställs aktuell dos in i enheter. Dosstegen skiljer sig dock mellan de olika styrkorna av läkemedlet.
-
Tresiba 100 enheter/ml kan administreras i doser på 1-80 enheter per injektion i steg om 1 enhet.
-
Tresiba 200 enheter/ml kan administreras i doser på 2-160 enheter per injektion i steg om 2 enheter. Dosen erhålls i halva volymen jämfört med basinsulinpreparat med styrkan 100 enheter/ml.
Dosräknaren visar antal enheter oavsett styrka. Omräkning av dosen ska inte göras när en patient övergår till en ny styrka.
Tresiba 100 enheter/ml FlexPen injektionsvätska, lösning i förfylld injektionspenna
• Tresiba 100 enheter/ml kan administreras i doser på 1-60 enheter per injektion i steg om 1 enhet.
Flexibilitet i doseringstidpunkt
När administrering vid samma tidpunkt varje dag inte är möjlig, ger Tresiba möjlighet till flexibilitet i tidpunkt för administrering av insulinet (se avsnitt Farmakodynamik). Det ska alltid vara minst 8 timmar mellan injektionerna. Det saknas klinisk erfarenhet av flexibilitet i doseringstidpunkt för Tresiba hos barn och ungdomar.
Vid bortglömd dos rekommenderas patienten att ta den när de upptäcker detta och därefter återuppta sitt vanliga doseringsschema en gång dagligen.
Behandlingsstart
Patienter med diabetes mellitus typ 2
Den rekommenderade dagliga startdosen är 10 enheter följt av individuella dosjusteringar.
Patienter med diabetes mellitus typ 1
Tresiba ska användas en gång dagligen tillsammans med måltidsinsulin och kräver efterföljande individuella dosjusteringar.
Övergång från andra insulinpreparat
Noggrann kontroll av glukosvärden under övergången och de följande veckorna rekommenderas. Det kan krävas justering av doser och tidpunkter för kort-/snabbverkande insulinpreparat eller annan samtidig diabetesbehandling.
Patienter med diabetes mellitus typ 2
För patienter med typ 2-diabetes som behandlas med basinsulin en gång dagligen, mixinsulin, insuliner som patienten själv blandat, eller vid basal-bolus behandling, kan övergången från basinsulin till Tresiba göras enhet för enhet utifrån tidigare dos basinsulin följt av individuell dosjustering.
En dosminskning på 20% utifrån tidigare basinsulindos, följt av individuell dosjustering ska övervägas vid
-
övergång till Tresiba från basinsulin doserat två gånger dagligen
-
övergång till Tresiba från insulin glargin (300 enheter/ml).
Patienter med diabetes mellitus typ 1
För patienter med typ 1-diabetes bör en dosminskning på 20% utifrån den tidigare basinsulindosen eller basinsulinkomponenten i en kontinuerlig subkutan insulininfusion övervägas med efterföljande individuella dosjusteringar baserat på glykemisk respons.
Användning av Tresiba i kombination med GLP-1 receptoragonister till patienter med typ 2-diabetes mellitus
Vid tillägg av Tresiba till GLP-1 receptoragonister rekommenderas en startdos på 10 enheter/dag, som därefter justeras individuellt.
Vid tillägg av GLP-1 receptoragonist till Tresiba rekommenderas en dosreduktion av Tresiba på 20% för att minimera risken för hypoglykemi. Därefter ska dosen justeras individuellt.
Speciella populationer
Äldre (≥65 år)
Tresiba kan användas av äldre. Glukosmätningen ska intensifieras och insulindosen justeras individuellt (se avsnitt Farmakokinetik).
Nedsatt njur- och leverfunktion
Tresiba kan användas av patienter med nedsatt njur- och leverfunktion. Glukosmätningen ska intensifieras och insulindosen justeras individuellt (se avsnitt Farmakokinetik).
Pediatrisk population
Det finns ingen klinisk erfarenhet vid användning av detta läkemedel hos barn under 1 års ålder. Detta läkemedel kan användas till ungdomar och barn från 1 års ålder (se avsnitt Farmakodynamik). Vid övergång från basinsulin till Tresiba är det nödvändigt att överväga en individuellt baserad dosminskning av bas- och bolusinsulin, för att minimera risken för hypoglykemi (se avsnitt Varningar och försiktighet).
Administreringssätt
Endast avsett för subkutan användning.
Tresiba får inte administreras intravenöst eftersom det kan leda till allvarlig hypoglykemi.
Detta läkemedel får inte administreras intramuskulärt eftersom det kan förändra absorptionen.
Detta läkemedel får inte användas i infusionspumpar för insulin.
Tresiba får inte dras upp från den förfyllda pennans cylinderampull till en spruta (se avsnitt Varningar och försiktighet).
Tresiba administreras subkutant genom injektion i låret, överarmen eller bukväggen. Injektionsställena ska alltid växlas inom samma område, för att minska risken för lipodystrofi och kutan amyloidos (se avsnitt Varningar och försiktighet och Biverkningar).
Patienter ska instrueras att alltid använda en ny nål. Återanvändning av injektionsnålar till insulinpennor ökar risken för tilltäppta nålar, vilket kan leda till under- eller överdosering. I händelse av tilltäppta nålar, måste patienter följa instruktionerna i bruksanvisningen som medföljer bipacksedeln (se avsnitt Hållbarhet, förvaring och hantering).
Tresiba 100 enheter/ml och Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Tresiba tillhandahålls i en förfylld injektionspenna som är utformad för att användas med NovoFine eller NovoTwist injektionsnålar.
-
Den förfyllda injektionspennan med 100 enheter/ml kan ställas in på 1–80 enheter i steg om 1 enhet.
-
Den förfyllda injektionspennan med 200 enheter/ml kan ställas in på 2–160 enheter i steg om 2 enheter.
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Tresiba tillhandahålls i en cylinderampull som är utformad för att användas med injektionshjälpmedel för insulin från Novo Nordisk och med NovoFine eller NovoTwist injektionsnålar.
Tresiba 100 enheter/ml FlexPen injektionsvätska, lösning i förfylld injektionspenna
Tresiba tillhandahålls i en förfylld injektionspenna som är utformad för att användas med NovoFine eller NovoTwist injektionsnålar. Tresiba FlexPen kan ställas in på 1-60 enheter i steg om 1 enhet.
Varningar och försiktighet
Hypoglykemi
En överhoppad måltid eller en oplanerad större fysisk ansträngning kan leda till hypoglykemi.
Hypoglykemi kan uppträda om insulindosen är för hög i förhållande till insulinbehovet (se avsnitt Interaktioner, Biverkningar och Överdosering).
Hos barn är det viktigt att reglera insulindoser (framförallt vid basal-bolus regim) med hänsyn till intag av föda och fysisk aktivitet för att minimera risken för hypoglykemi.
Patienter med väsentligt förbättrad blodglukoskontroll, t ex genom intensifierad insulinbehandling, kan uppleva att deras vanliga varningssymtom vid hypoglykemi förändras och måste få råd med hänsyn till detta. De vanliga varningssymtomen kan utebli hos patienter som haft diabetes under lång tid.
Samtidig sjukdom, särskilt infektioner och feber, ökar vanligtvis patientens behov av insulin. Samtidig njur- eller leversjukdom eller sjukdom med påverkan på binjurar, hypofys eller sköldkörtel kan kräva förändring av insulindosen.
Liksom med andra basinsulinpreparat kan den förlängda effekten av Tresiba försena återhämtningen från hypoglykemi.
Hyperglykemi
Administrering av snabbverkande insulin rekommenderas vid allvarlig hyperglykemi.
Otillräcklig dosering och/eller avbruten behandling hos patienter som har behov av insulin kan leda till hyperglykemi och potentiellt till diabetisk ketoacidos. Dessutom kan annan samtidig sjukdom, särskilt infektioner, leda till hyperglykemi och därmed öka behovet av insulin.
De första symtomen på hyperglykemi kommer vanligtvis gradvis under några timmar eller dagar. De omfattar törst, ökad miktionsfrekvens, illamående, kräkningar, dåsighet, rodnad och torr hud, muntorrhet och nedsatt aptit samt acetonluktande andedräkt. Vid diabetes mellitus typ 1 leder obehandlad hyperglykemi så småningom till diabetisk ketoacidos, som är potentiellt letal.
Övergång från andra insulinpreparat
En övergång till annan typ, annat märke eller annan tillverkare av insulin måste ske under medicinsk övervakning och kan leda till att dosen måste justeras.
Hud och subkutan vävnad
Patienterna måste instrueras att kontinuerligt växla injektionsställe för att minska risken för lipodystrofi och kutan amyloidos. Det finns en potentiell risk för fördröjd insulinabsorption och försämrad glykemisk kontroll efter insulininjektioner på ställen där dessa reaktioner förekommer. En plötslig ändring av injektionsställe till ett intakt område har visat sig resultera i hypoglykemi. Övervakning av blodsockervärdena rekommenderas efter ändring av injektionsställe från ett påverkat område till ett intakt område. Justering av dosen diabetesläkemedel kan också behövas.
Kombination av pioglitazon och insulinpreparat
Fall av hjärtsvikt har rapporterats när pioglitazon använts i kombination med insulin, särskilt hos patienter med riskfaktorer för att utveckla hjärtsvikt. Detta ska beaktas om man överväger kombinationsbehandling med pioglitazon och Tresiba. Om kombinationen används ska patienten observeras med avseende på tecken och symtom på hjärtsvikt, viktuppgång och ödem. Behandlingen med pioglitazon ska avbrytas om försämring av hjärtsymtomen inträffar.
Ögonbesvär
En intensifierad insulinbehandling med en plötslig förbättring av den glykemiska kontrollen kan vara förenad med en tillfällig försämring av diabetisk retinopati, medan förbättrad glykemisk kontroll under lång tid minskar risken för vidareutveckling av diabetisk retinopati.
Undvika felmedicinering
Patienterna måste instrueras att alltid kontrollera etiketten på insulinet före varje injektion, för att undvika förväxling mellan de båda styrkorna av Tresiba eller med andra insulinpreparat.
Patienterna måste instrueras att visuellt kontrollera angivna enheter på injektionspennans dosräknare. Det är därför ett krav att patienten kan läsa dosräknaren på pennan för att kunna injicera sig själv. Patienter som är blinda eller har nedsatt syn ska instrueras att alltid ta hjälp av en annan person med bra syn som har fått undervisning i hur man använder insulinpennan.
För att undvika feldosering och potentiell överdosering, ska patienter och hälso- och sjukvårdspersonal aldrig använda en spruta för att dra upp läkemedlet från cylinderampullen i den förfyllda pennan.
I händelse av tilltäppta nålar, måste patienter följa instruktionerna som beskrivs i bruksanvisningen som medföljer bipacksedeln (se avsnitt Hållbarhet, förvaring och hantering).
Insulinantikroppar
Administrering av insulin kan ge utveckling av antikroppar mot insulin. I sällsynta fall kan förekomst av dessa antikroppar kräva justering av insulindosen för att korrigera en tendens till hyper- eller hypoglykemi.
Natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, dvs. det är näst intill ”natriumfritt”.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Ett antal läkemedel kan påverka glukosmetabolismen.
Följande substanser kan minska insulinbehovet
Perorala antidiabetika, GLP 1-receptoragonister, MAO-hämmare, beta-receptorblockerande medel, ACE-hämmare, salicylater, anabola steroider och sulfonamider.
Följande substanser kan öka insulinbehovet
Perorala antikonceptionsmedel, tiazider, glukokortikoider, tyreoideahormoner, sympatomimetika, tillväxthormon och danazol.
Beta-receptorblockerande medel kan maskera symtomen på hypoglykemi.
Oktreotid/lanreotid kan antingen öka eller minska insulinbehovet.
Alkohol kan intensifiera eller reducera den hypoglykemiska effekten av insulin.
Graviditet
Användning av Tresiba hos gravida kvinnor med diabetes har undersökts i en interventionell prövning (se avsnitt Farmakodynamik). En måttlig mängd data från kliniska prövningar och efter marknadsintroduktion på gravida kvinnor (mer än 400 graviditetsutfall) indikerar inte på missbildningar eller feto/neonatal toxicitet. Reproduktionsstudier på djur har inte visat på någon skillnad mellan insulin degludek och humant insulin med avseende på embryotoxicitet eller teratogenicitet.
Behandling med Tresiba kan övervägas under graviditet om det är kliniskt motiverat.
Generellt rekommenderas en intensifierad glukoskontroll och övervakning av gravida kvinnor med diabetes under hela graviditeten och när graviditet planeras. Insulinbehovet minskar i regel under den första trimestern och ökar därefter under den andra och tredje trimestern. Efter förlossningen återgår insulinbehovet vanligtvis snabbt till nivån före graviditeten. Noggrann övervakning av glukoskontroll rekommenderas och insulindosen ska justeras individuellt.
Amning
Det finns ingen klinisk erfarenhet av Tresiba under amning. Hos råttor utsöndrades insulin degludek i mjölken. Koncentrationen i mjölken var lägre än i plasma.
Det är okänt om insulin degludek utsöndras i bröstmjölk. Inga metabola effekter förväntas hos ammade nyfödda/spädbarn.
Fertilitet
Reproduktionsstudier på djur med insulin degludek har inte visat några skadliga effekter på fertiliteten.
Trafik
Detta läkemedel har ingen eller försumbar påverkan på körförmågan och förmågan att använda maskiner. Dock kan patientens koncentrations- och reaktionsförmåga kan försämras till följd av hypoglykemi. Detta kan innebära en risk i situationer där denna förmåga är särskilt viktig (t ex när man kör bil eller använder maskiner).
Patienter måste rådas att försöka undvika hypoglykemi vid bilkörning. Detta gäller särskilt patienter som ofta drabbas av hypoglykemi eller har svårt att känna igen de tidiga varningssignalerna på hypoglykemi. I dessa fall bör man överväga lämpligheten av bilkörning.
Biverkningar
Sammanfattning av säkerhetsprofilen
Den vanligaste biverkningen som rapporterats under behandlingen är hypoglykemi (se avsnittet ”Beskrivning av utvalda biverkningar” nedan).
Biverkningslista i tabellform
Biverkningar uppställda nedan är baserade på data från kliniska prövningar och klassificerade efter organsystem enligt MedDRA. Frekvenskategorier definieras enligt följande konvention: Mycket vanliga (≥1/10); vanliga (≥1/100 till <1/10); mindre vanliga (≥1/1 000 till <1/100); sällsynta (≥1/10 000 till <1/1 000); mycket sällsynta (<1/10 000) samt ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Klassificering av organsystem |
Frekvens |
Biverkning |
|
Immunsystemet |
Sällsynta |
Överkänslighet Urticaria |
|
Metabolism och nutrition |
Mycket vanliga |
Hypoglykemi |
|
Hud och subkutan vävnad |
Mindre vanliga |
Lipodystrofi |
|
Ingen känd frekvens |
Kutan amyloidos† |
|
|
Allmänna symptom och/eller symtom via administreringsstället |
Vanliga |
Reaktioner vid injektionsstället |
|
Mindre vanliga |
Perifert ödem |
† Biverkningar rapporterade efter marknadsföring
Beskrivning av utvalda biverkningar
Immunsystemet
Allergiska reaktioner kan uppstå vid användning av insulinpreparat. Omedelbara allergiska reaktioner mot själva insulinet eller mot hjälpämnena kan vara potentiellt livshotande.
Med Tresiba har i sällsynta fall överkänslighet (i form av svullnad av tunga och läppar, diarré, illamående, trötthet och klåda) samt urticaria rapporterats.
Hypoglykemi
Hypoglykemi kan uppstå om insulindosen är för hög i förhållande till insulinbehovet. Allvarlig hypoglykemi kan leda till medvetslöshet och/eller konvulsioner och kan orsaka tillfällig eller permanent nedsättning av hjärnfunktionen eller till och med dödsfall. Symtomen på hypoglykemi uppstår vanligtvis plötsligt. De kan omfatta kallsvettningar, sval blek hy, matthet, nervositet eller tremor, oro, ovanlig trötthet eller svaghet, förvirring, koncentrationssvårigheter, dåsighet, uttalad hunger, synförändringar, huvudvärk, illamående och hjärtklappning.
Hud och subkutan vävnad
Lipodystrofi (inklusive lipohypertrofi, lipoatrofi) och kutan amyloidos kan förekomma vid injektionsstället och fördröja den lokala insulinabsorptionen. Kontinuerlig växling av injektionsställe inom det angivna injektionsområdet kan bidra till att minska eller förhindra dessa reaktioner (se avsnitt Varningar och försiktighet).
Reaktioner vid injektionsstället
Reaktioner vid injektionsstället (inkl. hematom, smärta, blödning, erytem, knutor, svullnad, missfärgning, klåda, värmekänsla samt knöl vid injektionsstället) förekom hos patienter som behandlades med Tresiba. Dessa reaktioner är vanligtvis lindriga och övergående och försvinner normalt vid fortsatt behandling.
Pediatrisk population
Tresiba har administrerats till barn och ungdomar upp till 18 år i syfte att undersöka de farmakokinetiska egenskaperna (se avsnitt Farmakokinetik). Säkerhet och effekt har visats i en långtidsstudie på barn i åldern 1 till under 18 år. Frekvensen, typen och allvarlighetsgraden av biverkningar i den pediatriska populationen tyder inte på skillnader vid jämförelse med erfarenheten i den allmänna populationen av patienter med diabetes (se avsnitt Farmakodynamik).
Övriga speciella populationer
Resultat av kliniska prövningar tyder inte på att biverkningar hos äldre och patienter med nedsatt njur- eller leverfunktion skiljer sig med avseende på frekvens, typ och svårighetsgrad vid jämförelse med den bredare erfarenhet som finns från den allmänna populationen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
För insulin finns ingen specifik överdosering. Hypoglykemi kan dock utvecklas gradvis om patienten får högre doser av insulin än vad som behövs:
-
Lindrig hypoglykemi kan behandlas genom peroral administrering av glukos eller med produkter innehållande socker. Det rekommenderas därför att patienter med diabetes alltid bär med sig sockerhaltiga produkter.
-
Allvarlig hypoglykemi, där patienten inte klarar att behandla sig själv, kan behandlas med glukagon eller med glukos som ges intravenöst av läkare eller sjuksköterska. Glukos måste ges intravenöst om patienten inte svarar på glukagon inom 10–15 minuter. När patienten återfår medvetandet rekommenderas att kolhydrater ges peroralt för att förhindra återfall.
Farmakodynamik
Verkningsmekanism
Insulin degludek binds specifikt till receptorn för humant insulin och ger samma farmakologiska effekt som humant insulin.
Den blodglukossänkande effekten hos insulin beror på att glukosupptaget underlättas då insulin binds till receptorer på muskel- och fettceller, samt på att glukosutsöndring från levern samtidigt hämmas.
Farmakodynamiska effekter
Tresiba är ett basinsulin som bildar lösliga multihexamerer vid subkutan injektion. Därmed skapas en depå varifrån insulin degludek långsamt och kontinuerligt absorberas i blodet, vilket ger den jämna och stabila glukossänkande effekten hos Tresiba (se figur 1). Under en period av 24 timmar med behandling en gång dagligen hade Tresiba, till skillnad från insulin glargin, en glukossänkande effekt som var jämnt fördelad mellan de första 12 timmarna och de efterföljande 12 timmarna (AUCGIR,0-12h,SS/AUCGIR,total,SS = 0,5).
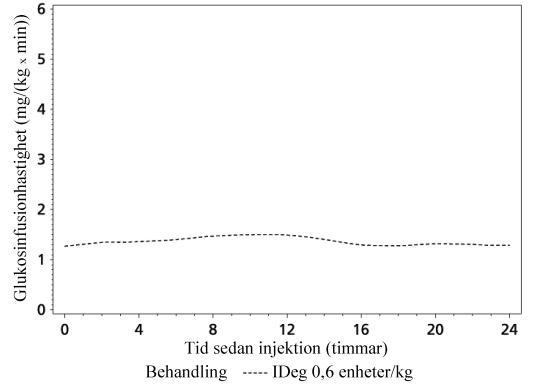
Figur 1 Profil för glukosinfusionshastighet, utjämnad, steady state - Genomsnittlig profil 0–24 timmar - IDeg 100 enheter/ml 0,6 enheter/kg - Prövning 1987
Verkningstiden för Tresiba är över 42 timmar inom det terapeutiska dosintervallet.
Steady state uppnås efter 2–3 dagars dosadministrering.
Dag till dag variationen, uttryckt i variationskoefficienten, i den glukossänkande effekten under ett doseringsintervall på 0-24 timmar vid steady state (AUCGIR,τ,SS) är 20% för insulin degludek, vilket är signifikant lägre än för insulin glargin (100 enheter/ml).
Den totala glukossänkande effekten av Tresiba ökar linjärt med ökad dos.
Den totala glukossänkande effekten av Tresiba 100 enheter/ml och 200 enheter/ml är jämförbar efter administrering av samma doser av de två preparaten.
Det finns inga kliniskt relevanta skillnader i farmakodynamiken hos detta läkemedel mellan äldre och yngre vuxna patienter.
Klinisk effekt och säkerhet
11 multinationella kliniska prövningar med 26 eller 52 veckors varaktighet genomfördes som kontrollerade, öppna, randomiserade, parallella treat-to-target-prövningar där 4 275 patienter exponerades för Tresiba (1 102 med diabetes mellitus typ 1 och 3 173 med diabetes mellitus typ 2).
I de öppna prövningarna utvärderades effekten av Tresiba hos patienter med typ 1 diabetes mellitus (Tabell 2), hos insulinnaiva patienter (initiering av insulin vid typ 2 diabetes mellitus, Tabell 3) och hos patienter som använt insulin tidigare (intensifiering av insulin vid typ 2 diabetes mellitus, Tabell 4) med fasta eller flexibla doseringstider (Tabell 5). I samtliga prövningar bekräftades att minskningen i HbA1c, från baseline tills att prövningen avslutades, var ”non-inferior”(inte underlägsen) i förhållande till jämförelsepreparaten (insulin detemir och insulin glargin (100 enheter/ml)). Medan förbättringar i HbA1c var ”non-inferior” jämfört med andra insulinpreparat, var Tresiba i jämförelse med sitagliptin däremot statistiskt signifikant överlägset när det gällde reducering av HbA1c (Tabell 4).
I en prospektiv planerad metaanalys av sju bekräftande öppna, treat-to-target prövningar, omfattande patienter med diabetes mellitus typ 1 och 2, var Tresiba överlägset i form av ett lägre antal behandlingsutlösta bekräftade hypoglykemiska episoder (beror huvudsakligen på fördelar vid diabetes mellitus typ 2, se Tabell 1) och nattliga bekräftade hypoglykemiska episoder jämfört med insulin glargin (100 enheter/ml) (administrerat enligt godkänd produktinformation). Den lägre risken för hypoglykemi uppnåddes vid en lägre genomsnittlig nivå av fastande plasmaglukos (FPG) med Tresiba än med insulin glargin.
Tabell 1 Resultat av metaanalys av hypoglykemi
|
Bekräftad hypoglykemia |
||
|
Beräknad relativ risk (Insulin degludek/Insulin glargin) |
Totalt |
Nattlig |
|
Diabetes mellitus typ 1 + typ 2 (poolade) Underhållsperiod b Geriatriska patienter ≥65 år |
0,91* 0,84* 0,82 |
0,74* 0,68* 0,65* |
|
Diabetes mellitus typ 1 Underhållsperiod b |
1,10 1,02 |
0,83 0,75* |
|
Diabetes mellitus typ 2 Underhållsperiod b Enbart basalbehandling hos patienter som inte tidigare använt insulin |
0,83* 0,75* 0,83* |
0,68* 0,62* 0,64* |
*Statistiskt signifikant a Bekräftad hypoglykemi definierades som episoder med plasmaglukosvärde <3,1 mmol/l eller där patienten behövde hjälp av en annan person. Nattlig bekräftad hypoglykemi definierades som episoder som inträffade mellan midnatt och 06.00. bEpisoder från vecka 16
Det finns ingen kliniskt relevant utveckling av antikroppar mot insulin efter långvarig behandling med Tresiba.
Tabell 2 Resultat från öppna kliniska prövningar vid diabetes mellitus typ 1
|
52 veckors behandling |
26 veckors behandling |
|||
|
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
Tresiba1 |
Insulin detemir1 |
|
|
Antal patienter |
472 |
157 |
302 |
153 |
|
HbA1c (%, DCCT standard) |
||||
|
Prövningens slut |
7,3 |
7,3 |
7,3 |
7,3 |
|
Förändring, medelvärde |
-0,40 |
-0,39 |
-0,73 |
-0,65 |
|
Differens: -0,01 [-0,14; 0,11] |
Differens: -0,09[-0,23;0,05] |
|||
|
FPG (mmol/l) |
||||
|
Prövningens slut |
7,8 |
8,3 |
7,3 |
8,9 |
|
Förändring, medelvärde |
-1,27 |
-1,39 |
-2,60 |
-0,62 |
|
Differens: -0,33 [-1,03; 0,36] |
Differens: -1,66 [-2,37; -0,95] |
|||
|
Hypoglykemifrekvens (per patientår av exponering) |
||||
|
Allvarlig |
0,21 |
0,16 |
0,31 |
0,39 |
|
Bekräftad2 |
42,54 |
40,18 |
45,83 |
45,69 |
|
Kvot: 1,07 [0,89;1,28] |
Kvot: 0,98 [0,80;1,20] |
|||
|
Nattlig bekräftad2 |
4,41 |
5,86 |
4,14 |
5,93 |
|
Kvot: 0,75 [0,59;0,96] |
Kvot: 0,66 [0,49;0,88] |
|||
1 Vid dosering en gång dagligen + insulin aspart för att täcka insulinbehovet vid måltider.
2 Bekräftad hypoglykemi definierades som episoder med plasmaglukosvärde <3,1 mmol/l eller där patienten behövde hjälp av en annan person. Nattlig bekräftad hypoglykemi definierades som episoder som inträffade mellan midnatt och 06.00.
Tabell 3 Resultat från öppna kliniska prövningar på insulinnaiva patienter med diabetes mellitus typ 2 (initiering av insulin)
|
52 veckors behandling |
26 veckors behandling |
|||
|
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
|
|
Antal patienter |
773 |
257 |
228 |
229 |
|
HbA1c (%, DCCT standard) |
||||
|
Prövningens slut |
7,1 |
7,0 |
7,0 |
6,9 |
|
Förändring, medelvärde |
-1,06 |
-1,19 |
-1,30 |
-1,32 |
|
Differens: 0,09 [-0,04; 0,22] |
Differens: 0,04 [-0,11; 0,19] |
|||
|
FPG (mmol/l) | ||||
|
Prövningens slut |
5,9 |
6,4 |
5,9 |
6,3 |
|
Förändring, medelvärde |
-3,76 |
-3,30 |
-3,70 |
-3,38 |
|
Differens: -0,43 [-0,74; -0,13] |
Differens: -0,42 [-0,78; -0,06] |
|||
|
Hypoglykemifrekvens (per patientår av exponering) |
||||
|
Allvarlig |
0 |
0,02 |
0 |
0 |
|
Bekräftad2 |
1,52 |
1,85 |
1,22 |
1,42 |
|
Kvot: 0,82 [0,64;1,04] |
Kvot: 0,86 [0,58;1,28] |
|||
|
Nattlig bekräftad2 |
0,25 |
0,39 |
0,18 |
0,28 |
|
Kvot: 0,64 [0,42;0,98] |
Kvot: 0,64 [0,30;1,37] |
|||
1 Dosering en gång dagligen + metformin ± DPP-IV-hämmare.
2 Bekräftad hypoglykemi definierades som episoder med plasmaglukosvärde <3,1 mmol/l eller där patienten behövde hjälp av en annan person. Nattlig bekräftad hypoglykemi definierades som episoder som inträffade mellan midnatt och 06.00.
Tabell 4 Resultat från öppna kliniska prövningar vid diabetes mellitus typ 2: vänster – användare av basinsulin; höger – insulinnaiva
|
52 veckors behandling |
26 veckors behandling |
|||
|
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
Tresiba2 |
Sitagliptin2 |
|
|
Antal patienter |
744 |
248 |
225 |
222 |
|
HbA1c (%, DCCT standard) |
||||
|
Prövningens slut |
7,1 |
7,1 |
7,2 |
7,7 |
|
Förändring, medelvärde |
-1,17 |
-1,29 |
-1,56 |
-1,22 |
|
Differens: 0,08 [-0,05; 0,21] |
Differens: -0,43 [-0,61; -0,24] |
|||
|
FPG (mmol/l) |
||||
|
Prövningens slut |
6,8 |
7,1 |
6,2 |
8,5 |
|
Förändring, medelvärde |
-2,44 |
-2,14 |
-3,22 |
-1,39 |
|
Differens: -0,29 [-0,65; 0,06] |
Differens: -2,17 [-2,59; -1,74] |
|||
|
Hypoglykemifrekvens (per patientår av exponering) |
||||
|
Allvarlig hypoglykemi |
0,06 |
0,05 |
0,01 |
0 |
|
Bekräftad3 |
11,09 |
13,63 |
3,07 |
1,26 |
|
Kvot: 0,82 [0,69;0,99] |
Kvot: 3,81 [2,40;6,05] |
|||
|
Nattlig bekräftad3 |
1,39 |
1,84 |
0,52 |
0,30 |
|
Kvot: 0,75 [0,58;0,99] |
Kvot: 1,93 [0,90;4,10] |
|||
1 Dosering en gång dagligen + insulin aspart för att täcka insulinbehovet vid måltider ± metformin ± pioglitazon
2 Dosering en gång dagligen ± metformin SU/glinid ± pioglitazon
3 Bekräftad hypoglykemi definierades som episoder med plasmaglukosvärde <3,1 mmol/l eller där patienten behövde hjälp av en annan person. Nattlig bekräftad hypoglykemi definierades som episoder som inträffade mellan midnatt och 06.00.
Tabell 5 Resultat från en öppen klinisk prövning med flexibel dosering av Tresiba vid diabetes mellitus typ 2
|
26 veckors behandling |
|||
|
Tresiba1 |
Tresiba Flex2 |
Insulin glargin (100 enheter/ml)3 |
|
|
Antal patienter |
228 |
229 |
230 |
|
HbA1c(%, DCCT standard) |
|||
|
Prövningens slut |
7,3 |
7,2 |
7,1 |
|
Förändring, medelvärde |
-1,07 |
-1,28 |
-1,26 |
|
Differens: -0,13 [-0,29; 0,03] 5 |
Differens: 0,04 [-0,12; 0,20] |
||
|
FPG (mmol/l) | |||
|
Prövningens slut |
5,8 |
5,8 |
6,2 |
|
Genomsnittlig förändring från baseline |
-2,91 |
-3,15 |
-2,78 |
|
Differens: 0,05 [-0,45; -0,35] 5 |
Differens: -0,42 [-0,82; -0,02] |
||
|
Hypoglykemifrekvens (per patientår av exponering) |
|||
|
Allvarlig |
0,02 |
0,02 |
0,02 |
|
Bekräftad4 |
3,63 |
3,64 |
3,48 |
|
Kvot: 1,10 [0,79;1,52] 6 |
Kvot: 1,03 [0,75;1,40] |
||
|
Nattlig bekräftad4 |
0,56 |
0,63 |
0,75 |
|
Kvot: 1,18 [0,66;2,12] 6 |
Kvot: 0,77 [0,44;1,35] |
||
1 Dosering en gång dagligen (tillsammans med huvudmåltiden på kvällen) + en eller två av följande perorala antidiabetika: SU, metformin eller DPP-4 hämmare.
2 Flexibel dosering en gång dagligen (intervaller om cirka 8–40 timmar mellan doserna) + en eller två av följande perorala antidiabetika: SU, metformin eller
DPP-4-hämmare.
3 Dosering en gång dagligen + en eller två av följande perorala antidiabetika: SU, metformin eller DPP-4 hämmare.
4 Bekräftad hypoglykemi definierades som episoder med plasmaglukosvärde <3,1 mmol/l eller där patienten behövde hjälp av en annan person. Nattlig bekräftad hypoglykemi definierades som episoder som inträffade mellan midnatt och 06.00.
5 Skillnaden gäller Tresiba Flex – Tresiba
6 Kvoten gäller Tresiba Flex/Tresiba.
I en 104-veckors klinisk studie uppnådde 57% av patienterna med typ 2-diabetes som behandlats med Tresiba (insulin degludek) i kombination med metformin målvärdet för HbA1c, <7,0% DCCT standard. Resten av patienterna fortsatte i en 26-veckors öppen studie med randomisering till att antingen få tillägg av liraglutid eller en enkeldos av insulin aspart (till den största måltiden). I insulin degludek + liraglutid gruppen reducerades insulindosen med 20% för att minimera risken för hypoglykemi. Tillägg av liraglutid gav en statistiskt större sänkning av HbA1c (-0,73% för liraglutid vs. -0,40% för jämförelseläkemedel, uppskattade medeltal) och kroppsvikt (-3,03 kg vs. 0,72 kg, uppskattade medeltal). Frekvensen av hypoglykemiska episoder (per patientår av exponering) var statistiskt signifikant lägre vid tillägg av liraglutid jämfört med tillägg av en enkeldos insulin aspart (1,0 vs. 8,15; kvot: 0,13; 95% CI: (0,08–0,21).
Vidare genomfördes två 64-veckors kontrollerade, dubbelblinda, randomiserade, cross-over, treat-to-target prövningar på patienter med minst en riskfaktor för hypoglykemi och med diabetes mellitus typ 1 (501 patienter) eller diabetes mellitus typ 2 (721 patienter). Patienterna randomiserades till antingen Tresiba eller insulin glargin (100 enheter/ml) följt av cross-over. I prövningarna undersöktes frekvensen av hypoglykemi vid behandling med Tresiba jämfört med insulin glargin (100 enheter/ml) (se Tabell 6).
Tabell 6 Resultat från de dubbelblinda, cross-over prövningarna vid diabetes mellitus typ 1 och typ 2
|
Typ 1 diabetes mellitus |
Typ 2 diabetes mellitus |
|||
|
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
Tresiba2 |
Insulin glargin (100 enheter/ml)2 |
|
|
N |
501 |
721 |
||
|
HbA1c (%, DCCT standard) |
||||
|
Baseline |
7,6 |
7,6 |
||
|
Behandlingens slut |
6,9 |
6,9 |
7,1 |
7,0 |
|
FPG (mmol/l) |
||||
|
Baseline |
9,4 |
7,6 |
||
|
Behandlingens slut |
7,5 |
8,4 |
6,0 |
6,1 |
|
Frekvens av allvarlig hypoglykemi3 |
||||
|
Underhållsperiod4 |
0,69 |
0,92 |
0,05 |
0,09 |
|
Kvot: 0,65 [0,48; 0,89] |
Kvot: 0,54 [0,21; 1,42] |
|||
|
Frekvens av allvarlig eller BG-bekräftad symptomatisk hypoglykemi3,5 |
||||
|
Underhållsperiod4 |
22,01 |
24,63 |
1,86 |
2,65 |
|
Kvot: 0,89 [0,85; 0,94] |
Kvot: 0,70 [0,61; 0,80] |
|||
|
Frekvens av allvarlig eller BG-bekräftad symptomatisk nattlig hypoglykemi3.5 |
||||
|
Underhållsperiod4 |
2,77 |
4,29 |
0,55 |
0,94 |
|
Kvot: 0,64 [0,56; 0,73] |
Kvot: 0,58 [0,46; 0,74] |
|||
1 Vid behandling en gång om dagen + insulin aspart för att täcka insulinbehovet vid måltid
2 Vid behandling en gång om dagen ± perorala antidiabetika (kombinationer med metformin, DPP-4 hämmare, alfa-glukosidashämmare, tiazolidindioner, och SGLT-2 hämmare)
3 Per patientår av exponering
4 Episoder från vecka 16 i varje behandlingsperiod
5 Blodglukosbekräftad (BG) symptomatisk hypoglykemi definierades som episoder som bekräftats med plasmaglukosvärde under 3,1 mmol/l, och med symptom på hypoglykemi. Nattligt bekräftad hypoglykemi definierades som episoder mellan midnatt och klockan 6 på morgonen
Kardiovaskulär utvärdering
DEVOTE var en randomiserad, dubbelblind, och händelsestyrd klinisk prövning med en medianvaraktighet på 2 år jämförande kardiovaskulär säkerhet av Tresiba mot insulin glargin (100 enheter/ml) i 7 637 patienter med typ 2-diabetes med hög risk för kardiovaskulära händelser.
Den primära analysen var tid från randomisering till första inträffade 3-komponent större negativa kardiovaskulära händelse (Major Adverse Cardiovascular Events, MACE) definierad som kardiovaskulär död, icke-fatal hjärtinfarkt eller icke-fatal stroke. Prövningen var designad som en non-inferiority prövning för att utesluta en förspecificerad riskmarginal på 1,3 för MACE hazardkvot (HR) när Tresiba jämfördes med insulin glargin. Den kardiovaskulära säkerheten för Tresiba jämfört med insulin glargin bekräftades (HR 0,91 [0,78; 1,06]) (Bild 2).
Resultaten från subgruppsanalyser (t ex kön, tid med diabetes, kardiovaskulär riskgrupp och tidigare insulinregim) var i linje med den primära analysen.
N: Antal försökspersoner med en första händelse som bekräftats av EAC under prövningen. %: Procent försökspersoner med en första händelse som bekräftats av EAC beräknat i förhållande till antalet randomiserade försökspersoner. EAC: Event adjudication committee. CI: 95% konfidensintervall.
Bild 2 Forest-diagram över analys av sammansatt 3-punkts MACE och individuella kardiovaskulära utfallsmått i DEVOTE
Vid studiestart, var HbA1c 8,4% DCCT standard i båda behandlingsgrupperna och efter 2 år var HbA1c 7,5% DCCT standard både med Tresiba och insulin glargin.
Tresiba var överlägset bättre än insulin glargin med avseende på lägre frekvens allvarliga hypoglykemier och en mindre andel patienter som upplevde allvarliga hypoglykemier. Frekvensen nattliga allvarliga hypoglykemier var signifikant lägre för Tresiba jämfört med insulin glargin (Tabell 7).
Tabell 7 Resultat från DEVOTE
|
|
Tresiba1 |
Insulin glargin (100 enheter/ml)1 |
|
N |
3818 |
3819 |
|
Frekvens hypoglykemier (per 100 patientår av observation) |
||
|
Allvarliga |
3,70 |
6,25 |
|
|
Frekvenskvot: 0,60 [0,48; 0,76] |
|
|
Nattliga allvarliga2 |
0,65 |
1,40 |
|
|
Frekvenskvot: 0,47 [0,31; 0,73] |
|
|
Andel patienter med hypoglykemier (procent av patienterna) |
||
|
Allvarliga |
4,9 |
6,6 |
|
|
Oddskvot: 0,73 [0,60; 0,89] |
|
1 Som tillägg till standardbehandling av diabetes och kardiovaskulär sjukdom
2 Nattliga allvarliga hypoglykemier definierades som episoder mellan midnatt och klockan 6 på morgonen.
Graviditet
Tresiba har studerats i en öppen, randomiserad, aktivt kontrollerad klinisk prövning där gravida kvinnor med diabetes mellitus typ 1 behandlades inom en basal-bolus behandlingsregim med Tresiba (92 kvinnor) eller insulin detemir (96 kvinnor) som basinsulin, båda i kombination med insulin aspart som måltidsinsulin (EXPECT).
Tresiba visade icke-inferioritet jämfört med insulin detemir uppmätt genom HbA1c vid det sista inplanerade HbA1c-besöket före förlossning efter graviditetsvecka 16. Dessutom observerades ingen skillnad mellan behandlingsgrupperna i glykemisk kontroll (förändring av HbA1c, FPG och PPG) under graviditeten.
Inga kliniskt relevanta skillnader observerades mellan Tresiba och insulin detemir i utfallsmåtten för moderns säkerhet: hypoglykemi, förlossning i förtid och biverkningar under graviditeten. Havandeskapsförgiftning rapporterades hos 12 patienter som behandlades med Tresiba (13,2%) och hos 7 patienter (7,4%) som behandlades med insulin detemir. Oplanerat kejsarsnitt rapporterades hos 23 patienter (25,3%) som behandlades med Tresiba och hos 15 patienter (16,0%) som behandlades med insulin detemir. Merparten av de biverkningar som rapporterades i båda grupperna var icke-allvarliga, av lindrig svårighetsgrad, osannolikt relaterade till studieläkemedlet och hade utfallet ”tillfrisknat/återställd”. Inga dödsfall rapporterade hos de patienter som var randomiserade i prövningen.
Ingen perinatal eller neonatal död rapporterades. Inga kliniskt relevanta skillnader observerades mellan Tresiba och insulin detemir i utfallsmåtten för graviditet (tidig fosterdöd, förekomst av allvarlig abnormitet, neonatal hypoglykemi, perinatal dödlighet, neonatal dödlighet, fetal makrosomi, stor med hänsyn till gestationsålder och biverkningar hos spädbarnet under de första 30 dagarna efter födseln).
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Tresiba för:
-
Nyfödda och spädbarn från födseln till yngre än 12 månader med diabetes mellitus typ 1 samt barn från födseln till yngre än 10 år med diabetes mellitus typ 2, då den sjukdom eller det tillstånd som det specifika läkemedlet är avsett för inte förekommer i den specificerade pediatriska undergruppen (se avsnitt Dosering för information om pediatrisk användning).
Effekt och säkerhet av Tresiba har studerats i en 1:1 randomiserad kontrollerad klinisk prövning på barn och ungdomar med typ 1-diabetes mellitus under 26 veckor (n=350) med 26 veckors förlängning (n=280). I armen med Tresiba ingick 43 barn i åldern 1–5 år, 70 barn i åldern 6–11 år och 61 ungdomar i åldern 12–17 år. Tresiba doserat 1 gång dagligen visade liknande minskning i HbA1c vid vecka 52 och större minskning i fasteplasmaglukos (FPG) från baseline som insulin detemir doserat 1 eller 2 gånger dagligen. Detta uppnåddes med 30% lägre dagliga doser av Tresiba jämfört med insulin detemir. Frekvensen (händelser per patientår av exponering) av allvarliga hypoglykemier (ISPAD definition; 0,51 vs. 0,33), bekräftade hypoglykemier (57,71 vs. 54,05) och nattliga hypoglykemier (6,03 vs. 7,60) för Tresiba vs. insulin detemir var jämförbar. I båda behandlingsarmarna hade barn 6–11 år en numeriskt högre frekvens av bekräftad hypoglykemi än i andra åldersgrupper. En numeriskt högre frekvens av allvarlig hypoglykemi observerades för Tresiba hos barn i gruppen 6-11 år. Frekvensen hyperglykemiepisoder med ketos var signifikant lägre för Tresiba jämfört med insulin detemir, 0,68 resp. 1,09. Inga säkerhetsproblem avseende biverkningar och standard säkerhetsparametrar identifierades. Utveckling av antikroppar var sparsamt förekommande och var utan klinisk betydelse. Effekt och säkerhet hos ungdomar med typ 2-diabetes har extrapolerats från data för ungdomar och vuxna med typ 1-diabetes och vuxna med typ 2-diabetes. Resultaten stöder användning av Tresiba till ungdomar med typ 2-diabetes.
Farmakokinetik
Absorption
Efter subkutan injektion bildas lösliga och stabila multihexamerer, vilket skapar en depå av insulin i den subkutana vävnaden. Insulin degludek-monomererna separerar gradvis från multihexamererna vilket ger en långsam och kontinuerlig tillförsel av insulin degludek i blodet.
Steady-state serumkoncentration uppnås efter 2–3 dagars daglig administrering av Tresiba.
Under en period av 24 timmar med behandling en gång dagligen var exponeringen för insulin degludek jämnt distribuerad under de första 12 timmarna och de följande 12 timmarna. Förhållandet mellan AUCIDeg,0-12h,SS och AUCIDeg,τ,SS var 0,5.
Distribution
Affiniteten av insulin degludek till serumalbumin motsvarar en plasmaproteinbindning på > 99% i human plasma.
Metabolism
Insulin degludek bryts ned på liknande sätt som humant insulin. Alla metaboliter som bildas är inaktiva.
Eliminering
Halveringstiden efter subkutan administrering av Tresiba bestäms av absorptionshastigheten från den subkutana vävnaden. Halveringstiden för Tresiba är ungefär 25 timmar oberoende av dos.
Linjäritet
Dosproportionalitet vid total exponering har observerats efter subkutan administrering inom det terapeutiska dosintervallet. Vid direkt jämförelse uppfylls kraven för bioekvivalens för Tresiba 100 enheter/ml och Tresiba 200 enheter/ml (baserat på AUCIDeg,τ,SS och Cmax,IDeg,SS).
Kön
Det finns inga skillnader mellan kön i de farmakokinetiska egenskaperna hos detta läkemedel.
Äldre, etnisk tillhörighet och nedsatt njur- och leverfunktion
Det finns inga skillnader i farmakokinetiken för insulin degludek mellan äldre och yngre patienter, mellan olika etniska grupper eller mellan friska personer och patienter med nedsatt njur- eller leverfunktion.
Pediatrisk population
De farmakokinetiska egenskaperna hos insulin degludek hos barn (1–11 år) och ungdomar (12–18 år) var i steady state jämförbara med de som observerats hos vuxna med diabetes mellitus typ 1. Total exponering efter en enkeldos var dock högre hos barn och ungdomar än hos vuxna med diabetes mellitus typ 1.
Prekliniska uppgifter
Gängse studier visade inte några säkerhetsrisker för människa baserat på studier avseende säkerhetsfarmakologi, toxicitet vid upprepade doser, karcinogen potential och reproduktionstoxicitet.
Förhållandet mellan mitogen och metabol effekt för insulin degludek är jämförbart med humant insulin.
Innehåll
Kvalitativ och kvantitativ sammansättning
Tresiba 100 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Varje förfylld injektionspenna innehåller 300 enheter insulin degludek i 3 ml injektionsvätska.
1 ml lösning innehåller 100 enheter insulin degludek* (motsvarar 3,66 mg insulin degludek).
Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Varje förfylld injektionspenna innehåller 600 enheter insulin degludek i 3 ml injektionsvätska.
1 ml lösning innehåller 200 enheter insulin degludek* (motsvarar 7,32 mg insulin degludek).
Tresiba 100 enheter/ml FlexPen injektionsvätska, lösning i förfylld injektionspenna
Varje förfylld injektionspenna innehåller 300 enheter insulin degludek i 3 ml injektionsvätska.
1ml lösning innehåller 100enheter insulin degludek* (motsvarar 3,66mg insulin degludek).
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Varje cylinderampull innehåller 300 enheter insulin degludek i 3 ml injektionsvätska.
1 ml lösning innehåller 100 enheter insulin degludek* (motsvarar 3,66 mg insulin degludek).
*Framställt med rekombinant-DNA teknik i Saccharomyces cerevisiae.
Förteckning över hjälpämnen
Glycerol
Metakresol
Fenol
Zinkacetat
Saltsyra (för pH-justering)
Natriumhydroxid (för pH-justering)
Vatten för injektionsvätskor
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel.
Substanser som tillsätts till Tresiba kan leda till nedbrytning av insulin degludek.
Tresiba får aldrig tillsättas till infusionslösningar.
Miljöpåverkan
Insulin degludek
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön. Även om biomolekyler, såsom vacciner och hormoner, är undantagna bör de ändå betraktas som biologiskt aktiva.
Hållbarhet, förvaring och hantering
Hållbarhet
30 månader.
Tresiba 100 enheter/ml FlexTouch/FlexPen injektionsvätska, lösning i förfylld injektionspenna
Påbörjat insulin eller insulin medtaget som reserv är hållbart i högst 8 veckor vid förvaring vid högst 30°C. Kan förvaras i kylskåp (2°C – 8°C). Förvara pennan med pennhuven påsatt för att skydda den mot ljus.
Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Påbörjat insulin eller insulin medtaget som reserv är hållbart i högst 8 veckor vid förvaring vid högst 30°C. Kan förvaras i kylskåp (2°C – 8°C). Förvara pennan med pennhuven påsatt för att skydda den mot ljus.
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Påbörjat insulin eller insulin medtaget som reserv är hållbart i högst 8 veckor vid förvaring vid högst 30°C. Förvaras i skydd mot kyla. Förvara cylinderampullen i ytterkartongen för att skydda den mot ljus.
Särskilda förvaringsanvisningar
Tresiba 100 enheter/ml FlexTouch/FlexPen injektionsvätska, lösning i förfylld injektionspenna
Före första användningen:
Förvaras i kylskåp (2°C – 8°C). Får ej frysas.
Placeras inte nära kylelementet.
Förvaras med pennhuven påsatt. Ljuskänsligt.
Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Före första användningen:
Förvaras i kylskåp (2°C – 8°C). Får ej frysas.
Placeras inte nära kylelementet.
Förvaras med pennhuven påsatt. Ljuskänsligt.
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Före första användningen:
Förvaras i kylskåp (2°C – 8°C). Får ej frysas.
Placeras inte nära kylelementet.
Förvara cylinderampullerna i ytterkartongen för att skydda dem mot ljus.
Särskilda anvisningar för destruktion
Detta läkemedel är endast avsett för personligt bruk. Läkemedlet får inte återfyllas
Tresiba får endast användas om lösningen är klar och färglös.
Tresiba som varit fryst får inte användas.
En ny injektionsnål måste alltid sättas på före varje användning. Nålar får aldrig återanvändas. Patienten bör kassera injektionsnålen efter varje injektion.
I händelse av tilltäppta nålar, måste patienterna följa instruktionerna som beskrivs i bruksanvisningen som medföljer bipacksedeln.
Avfall ska kasseras enligt gällande anvisningar.
En utförlig bruksanvisning finns i bipacksedeln.
Tresiba i en förfylld injektionspenna finns i två styrkor. ”Tresiba 100 enheter/ml” eller ”Tresiba 200 enheter/ml” är tydligt markerat på pennans etikett och förpackning.
Tresiba 100 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Tresiba 100 enheter/ml förpackning och etikett är ljusgrön.
Den förfyllda injektionspennan är utformad för att användas med NovoFine/NovoTwist injektionsnålar upp till en längd av 8 mm.
Den kan ställas in på 1–80 enheter i steg om 1 enhet. Utförlig bruksanvisning som medföljer den förfyllda injektionspennan måste följas.
Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Tresiba 200 enheter/ml förpackning och etikett är mörkgrön med ränder, med en röd ruta som markerar formuleringens styrka.
Den förfyllda injektionspennan är utformad för att användas med NovoFine/NovoTwist injektionsnålar upp till en längd av 8 mm.
Den kan ställas in på 2–160 enheter i steg om 2 enheter. Utförlig bruksanvisning som medföljer den förfyllda injektionspennan måste följas.
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Cylinderampullen är utformad för att användas med administrationshjälpmedel från Novo Nordisk (injektionshjälpmedel för upprepad användning som inte ingår i förpackningen) och med NovoFine/NovoTwist injektionsnålar upp till en längd av 8 mm. Utförlig bruksanvisning som medföljer injektionshjälpmedlet måste följas.
Tresiba 100 enheter/ml FlexPen injektionsvätska, lösning i förfylld injektionspenna
Tresiba 100 enheter/ml förpackning och etikett är ljusgrön.
Den förfyllda injektionspennan är utformad för att användas med NovoFine/NovoTwist injektionsnålar upp till en längd av 8 mm.
Den kan ställas in på 1–60 enheter i steg om 1 enhet. Utförlig bruksanvisning som medföljer den förfyllda injektionspennan måste följas.
Egenskaper hos läkemedelsformen
Tresiba 100 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Injektionsvätska, lösning.
Tresiba 200 enheter/ml FlexTouch injektionsvätska, lösning i förfylld injektionspenna
Injektionsvätska, lösning.
Tresiba 100 enheter/ml FlexPen injektionsvätska, lösning i förfylld injektionspenna
Injektionsvätska, lösning.
Tresiba 100 enheter/ml Penfill injektionsvätska, lösning i cylinderampull
Injektionsvätska, lösning.
Klar, färglös, neutral lösning.
Förpackningsinformation
TRESIBA FLEXTOUCH
Injektionsvätska, lösning i förfylld injektionspenna 100 enheter/ml
(klar, färglös lösning)
5 x 3 milliliter förfylld injektionspenna, 667:25, (F)
Injektionsvätska, lösning i förfylld injektionspenna 200 enheter/ml
(klar, färglös lösning)
3 x 3 milliliter förfylld injektionspenna, 791:05, (F)
TRESIBA PENFILL
Injektionsvätska, lösning i cylinderampull 100 enheter/ml
(klar, färglös lösning)
5 x 3 milliliter cylinderampull, kassett, 642:48, (F)
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, lösning i förfylld injektionspenna 100 enheter/ml
Injektionsvätska, lösning i förfylld injektionspenna 200 enheter/ml
Injektionsvätska, lösning i cylinderampull 100 enheter/ml





