Indikationer
Nimenrix är avsett för aktiv immunisering av personer från 6 veckors ålder mot invasiv meningokocksjukdom orsakad av Neisseria meningitidis grupp A, C, W-135 och Y.
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Nimenrix ska användas i enlighet med tillgängliga officiella rekommendationer.
Primärvaccination
Spädbarn från 6 veckors och upp till 6 månaders ålder: två doser om vardera 0,5 ml ges med ett intervall om 2 månader mellan doserna.
Spädbarn från 6 månaders ålder, barn, ungdomar och vuxna: en engångsdos om 0,5 ml ges.
Ytterligen en primärdos Nimenrix kan vara lämpligt för vissa individer (se avsnitt Varningar och försiktighet).
Påfyllnadsdos (booster)
Data angående antikroppars varaktighet på längre sikt efter vaccination med Nimenrix är tillgängliga upp till 10 år efter vaccination (se avsnitt Varningar och försiktighet och Farmakodynamik).
Efter genomförd primärvaccinationsserie av spädbarn från 6 veckors till högst 12 månaders ålder ska en boosterdos ges vid 12 månader, efter ett intervall på minst 2 månader efter den sista Nimenrix-vaccinationen (se avsnitt Farmakodynamik).
Till tidigare vaccinerade barn som är 12 månader eller äldre kan Nimenrix ges som boosterdos om de tidigare primärvaccinerats med ett konjugerat eller rent polysackaridvaccin mot meningokocker (se avsnitt Varningar och försiktighet och Farmakodynamik).
Administreringssätt
Vaccinet skall endast ges genom intramuskulär injektion.
Hos spädbarn är rekommenderat injektionsställe den anterolaterala delen av låret. Från 1 års ålder är det rekommenderade injektionsstället den anterolatera delen av låret eller deltoidmuskeln (se avsnitt Varningar och försiktighet och Interaktioner).
Anvisningar om beredning av vaccinet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Nimenrix ska inte under några omständigheter administreras intravaskulärt, intradermalt eller subkutant.
Det är god klinisk praxis att före vaccinationen granska anamnesen (i synnerhet med avseende på tidigare vaccination och eventuell förekomst av biverkningar) samt göra en klinisk undersökning.
Beredskap skall alltid finnas för adekvat medicinsk behandling och övervakning i händelse av en sällsynt anafylaktisk reaktion efter administrering av vaccinet.
Tillstötande sjukdom
Vaccination med Nimenrix ska skjutas upp för individer som lider av en akut svår febersjukdom. Vid en lindrig infektion som t.ex. en förkylning ska inte vaccinationen skjutas upp.
Syncope
Syncope (svimning) kan inträffa efter eller till och med före vaccination, framför allt hos ungdomar, som en psykogen reaktion på nålsticket. Detta kan åtföljas av flera neurologiska symtom såsom övergående synrubbning, parestesi och rörelser av tonisk-klonisk typ i extremiteterna under återhämtning. Det är viktigt att rutiner finns på plats för att undvika skador vid svimning.
Trombocytopeni och koagulationssjukdomar
Nimenrix ska ges med försiktighet till personer med trombocytopeni eller någon blödningssjukdom, eftersom blödning kan förekomma efter en intramuskulär injektion till dessa personer.
Nedsatt immunförsvar
Hos patienter som erhåller immunsuppressiv behandling eller patienter med nedsatt immunförsvar uppnås eventuellt inte ett adekvat immunsvar
Personer med familjär komplementbrist (t.ex. C5- eller C3-brist) samt personer med behandling som hämmar terminal komplementaktivering (t.ex. ekulizumab) har en ökad risk för invasiv sjukdom orsakad av Neisseria meningitidis serogrupp A, C, W-135 och Y, även om de utvecklar antikroppar efter vaccinering med Nimenrix.
Skydd mot meningokocksjukdom
Nimenrix ger endast skydd mot Neisseria meningitidis grupp A, C, W-135 och Y. Vaccinet skyddar inte mot några andra grupper av Neisseria meningitidis.
Ett skyddande immunsvar uppnås eventuellt inte hos alla vaccinerade personer.
Effekt av tidigare vaccination med rent polysackaridvaccin mot meningokocker
Personer som tidigare vaccinerats med ett rent polysackaridvaccin mot meningokocker och som vaccinerades med Nimenrix 30 till 42 månader senare hade lägre GMT (geometrisk genomsnittlig titer) än personer som inte vaccinerats med något meningokockvaccin de föregående 10 åren mätt med rSBA-test (serum bactericidal assay med kaninkomplement) (se avsnitt Farmakodynamik). Den kliniska relevansen av denna observation är inte känd.
Effekt av antikroppar mot tetanustoxoid före vaccination
Säkerheten och immunogeniciteten för Nimenrix utvärderades när det administrerades efter eller samtidigt med ett vaccin innehållande difteri- och tetanustoxoider, acellulärt pertussis, inaktiverade poliovirus (1, 2 och 3), hepatit B-ytantigen och Haemophilus influenzae typ b -polyribosylribosfosfat konjugerat till tetanustoxoid ( DTaP-HBV-IPV/Hib) under det andra levnadsåret. Administrering av Nimenrix en månad efter DTaP-HBV-IPV/Hib-vaccinet resulterade i lägre GMT (rSBA) mot grupp A, C och W-135 jämfört med samtidig administrering (se avsnitt Interaktioner). Den kliniska relevansen av denna observation är inte känd.
Immunrespons hos spädbarn i åldern 6 månader upp till 12 månader
En engångsdos administrerad vid 6 månaders ålder gav lägre titrar av baktericida antikroppar mot grupp W-135 och Y vid analys med humant komplement (hSBA) jämfört med då tre doser administrerades vid 2, 4 och 6 månaders ålder (se avsnitt Farmakodynamik). Den kliniska relevansen av denna observation är inte känd. Om ett spädbarn i åldern 6 månader upp till 12 månader förväntas löpa särskild risk för invasiv meningokocksjukdom på grund av exponering för grupp W-135 och/eller Y, kan man överväga att ge en andra primärdos Nimenrix efter 2 månader.
Immunrespons hos småbarn i åldern 12–14 månader
En månad efter en dos Nimenrix sågs liknande rSBA-titrar hos småbarn i åldern 12-14 månader mot grupp A, C, W-135 och Y som vid en månad efter 2 doser med Nimenrix givna med två månaders mellanrum.
En engångsdos gav lägre hSBA-titrar mot grupp W-135 och Y jämfört med då två doser gavs med två månaders mellanrum. Likartad respons mot grupp A och C observerades efter en och två doser (se avsnitt Farmakodynamik). Den kliniska relevansen av denna observation är inte känd. Om ett litet barn väntas löpa särskild risk för invasiv meningokocksjukdom på grund av exponering för grupp W-135 och Y, kan man överväga att ge en andra dos Nimenrix efter 2 månader. När det gäller avtagande halter av antikroppar mot grupp A eller grupp C efter den första dosen Nimenrix hos barn i åldern 12–23 månader, se under ”Varaktighet av baktericida antikroppsnivåer”.
Varaktighet av baktericida antikroppsnivåer
Efter administrering med Nimenrix ses en sänkning av baktericida antikroppsnivåer mot grupp A när hSBA används (se avsnitt Farmakodynamik). Den kliniska relevansen av denna observation är inte känd. Om en person har fått en dos Nimenrix för mer än ungefär ett år sedan och löper en ökad risk att exponeras för grupp A bör man emellertid överväga om en påfyllnadsdos (booster) bör ges.
En nedgång i antikroppsnivåer har observerats över tid för grupperna A, C, W-135 och Y. Den kliniska relevansen av denna observation är inte känd. En påfyllnadsdos (booster) kan övervägas till individer som vaccinerats som småbarn som fortfarande har en hög risk att exponeras för meningokocksjukdom orsakad av grupperna A, C, W-135 och Y (se avsnitt Farmakodynamik).
Effekt av Nimenrix på koncentrationer av anti-tetanusantikropp
Nimenrix ersätter inte gängse tetanusimmunisering trots att en ökning av koncentrationen av anti-tetanustoxoidantikroppar (TT) iakttogs efter vaccination med Nimenrix.
Om Nimenrix ges samtidigt med eller en månad före ett TT-innehållande vaccin under det andra levnadsåret försämras inte svaret på TT och säkerheten påverkas inte i någon betydande utsträckning. För barn över 2 års ålder finns inga data tillgängliga.
Natriuminnehåll
Detta vaccin innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Hos spädbarn kan Nimenrix ges samtidigt med kombinerade DTaP-HBV-IPV/Hib-vacciner och 10-valent konjugerat pneumokockvaccin.
Från 1 års ålder kan Nimenrix ges samtidigt med följande vacciner: hepatit A- (HAV) och hepatit B-vaccin (HBV), mässling-påssjuke-röda hund (MPR)-vaccin, mässling-påssjuke-röda hund-varicella (MPRV)-vaccin, 10-valent konjugerat pneumokockvaccin eller säsongsinfluensavaccin utan adjuvans.
Under det andra levnadsåret kan Nimenrix även ges samtidigt med kombinerade difteri-tetanus-acellulär pertussis (DTaP)-vacciner, bland annat DTaP-kombinationsvaccin med hepatit B-, inaktiverat poliovirus eller Haemophilus influenzae typ b (HBV, IPV eller Hib)-vaccin, t.ex. DTaP-HBV-IPV/Hib-vaccin och 13-valent konjugerat pneumokockvaccin.
Hos individer i åldern 9 till 25 år kan Nimenrix ges samtidigt med bivalent [typ 16 och 18] rekombinant vaccin mot humant papillomvirus (HPV2).
Om möjligt bör emellertid Nimenrix och ett TT-innehållande vaccin, t.ex. DTaP-HBV-IPV/Hib-vaccin, ges samtidigt eller så ska Nimenrix administreras minst en månad före det TT-innehållande vaccinet.
En månad efter samtidig administrering med ett 10-valent konjugerat pneumokockvaccin sågs ett lägre geometriskt medelvärde för antikroppskoncentrationer (GMC) och antikropps-GMT enligt opsonofagocytisk analys (OPA) för en pneumokockserotyp (18C konjugerat till bärarprotein av tetanustoxoid). Den kliniska relevansen av denna observation är inte känd. Samtidig administrering påverkade inte immunresponsen på de övriga nio pneumokockserotyperna.
En månad efter samtidig administrering med ett kombinerat vaccin innehållande tetanustoxoid, difteritoxoid med reducerat antigeninnehåll och adsorberat vaccin mot acellulär pertussis (Tdap) hos individer i åldern 9 till 25 år observerades lägre GMC för varje pertussisantigen (pertussistoxoid [PT], filamentöst hemagglutinin [FHA] och pertaktin [PRN]). Fler än 98 % av individerna hade koncentrationer av anti-PT, anti-FHA eller anti-PRN som låg över analysens tröskelvärden. Det är inte känt vilken klinisk relevans dessa observationer har. Samtidig administrering påverkade inte immunresponsen på Nimenrix eller tetanus- eller difteriantigenerna som ingick i Tdap.
Om Nimenrix ska ges samtidigt som ett annat injicerbart vaccin ska vaccinerna alltid ges på olika injektionsställen.
Hos patienter som erhåller immunsuppressiv behandling uppnås eventuellt inte något adekvat svar.
Graviditet
Det finns begränsad erfarenhet från användning av Nimenrix hos gravida kvinnor.
Djurstudier tyder inte på direkta eller indirekta skadliga effekter vad gäller graviditet, embryonal-/fosterutveckling, förlossning eller utveckling efter födsel (se avsnitt Prekliniska uppgifter).
Nimenrix ska användas under graviditet endast om absolut nödvändigt och de möjliga fördelarna uppväger de potentiella riskerna för fostret.
Amning
Det är inte känt om Nimenrix utsöndras i bröstmjölk.
Nimenrix ska endast användas under amning när de möjliga fördelarna överväger de potentiella riskerna.
Fertilitet
Djurstudier tyder inte på några direkta eller indirekta skadliga effekter när det gäller fertilitet.
Trafik
Inga studier har utförts avseende effekten av Nimenrix på förmågan att framföra fordon och använda maskiner. Vissa av de effekter som nämns under avsnitt Biverkningar "Biverkningar" kan dock påverka förmågan att framföra fordon eller använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerheten för Nimenrix presenteras i nedanstående tabell och är baserad på data från två kliniska studier enligt följande:
-
En poolad analys av data från 9 621 försökspersoner som fick en engångsdos av Nimenrix. Detta antal inkluderade 3 079 småbarn (12 månader till 23 månader), 909 barn mellan 2 och 5 års ålder, 990 barn mellan 6 och 10 års ålder, 2 317 ungdomar (11 till 17 år) och 2 326 vuxna (18 till 55 år).
-
Data från en studie på spädbarn i åldern 6 till 12 veckor vid tidpunkten för den första dosen (studie MenACWY−TT-083) i vilken 1 052 försökspersoner fick minst en dos av en primärvaccinationsserie med 2 eller 3 doser av Nimenrix och 1 008 fick en påfyllnadsdos vid ungefär 12 månaders ålder.
Säkerhetsdata har också utvärderats i en separat studie där en engångsdos av Nimenrix administrerades till 274 personer från 56 års ålder och uppåt.
Lokala och generella biverkningar
Hos barn i åldersgrupperna 6–12 veckor och 12–14 månader som fick två doser Nimenrix med två månaders mellanrum var både den första och den andra dosen förknippade med likartad lokal och systemisk reaktogenicitet.
Den lokala och generella biverkningsprofilen för en påfyllnadsdos (booster) av Nimenrix som gavs till individer från 12 månader upp till 30 års ålder efter primärvaccination med Nimenrix eller andra konjugerade eller rena polysackaridvacciner mot meningokocker motsvarade den lokala och generella biverkningsprofilen efter primärvaccination med Nimenrix, med undantag för gastrointestinala symtom (diarré, kräkningar och illamående), som var mycket vanliga bland individer från 6 år och uppåt.
Tabell över biverkningar
Rapporterade biverkningar har kategoriserats efter frekvens enligt följande:
Mycket vanliga: (≥1/10)
Vanliga:(≥1/100, <1/10)
Mindre vanliga: (≥1/1 000, <1/100)
Sällsynta: (≥1/10 000, <1/1 000)
Mycket sällsynta: (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Tabell 1 visar de biverkningar som rapporterats från studierna på personer från 6 veckors ålder upp till 55 år och från erfarenheter efter marknadsföring. Biverkningar rapporterade hos personer i åldern >55 år var likartade dem som observerats hos yngre vuxna.
Tabell 1: Tabell över biverkningar efter organsystem
|
Organsystem |
Frekvens |
Biverkningar |
|
Blodet och lymfsystemet |
Ingen känd frekvens*** |
Lymfadenopati |
|
Metabolism och nutrition |
Mycket vanliga |
Aptitförlust |
|
Psykiska störningar |
Mycket vanliga |
Irritabilitet |
|
Mindre vanliga |
Sömnlöshet Gråt |
|
|
Centrala och perifera nervsystemet |
Mycket vanliga |
Dåsighet Huvudvärk |
|
Mindre vanliga |
Hypestesi Yrsel |
|
|
Sällsynta |
Feberkramper |
|
|
Magtarmkanalen |
Vanliga |
Diarré Kräkning Illamående* |
|
Hud och subkutan vävnad |
Mindre vanliga |
Klåda Urtikaria Utslag** |
|
Muskuloskeletala systemet och bindväv |
Mindre vanliga |
Myalgi Smärta i armar och ben |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mycket vanliga |
Feber Svullnad vid injektionsstället Smärta vid injektionsstället Rodnad vid injektionsstället Trötthet |
|
Vanliga |
Hematom vid injektionsstället* |
|
|
Mindre vanliga |
Sjukdomskänsla Induration vid injektionsstället Klåda vid injektionsstället Värme vid injektionsstället Anestesi vid injektionsstället |
|
|
|
Ingen känd frekvens*** |
Omfattade svullnad av extremitet vid injektionsstället, ofta förknippad med rodnad, ibland omfattande närliggande led eller svullnad av hela den injicerade extremiteten. |
*Illamående och hematom vid injektionsstället förekom med frekvensen Mindre vanliga hos spädbarn.
**Utslag förekom med frekvensen Vanliga hos spädbarn.
***Biverkning identifierad efter marknadsföring.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Inga fall av överdosering har rapporterats.
Farmakodynamik
Verkningsmekanism
Antikapsulära meningokockantikroppar skyddar mot meningokocksjukdom via komplementmedierad bakteriedödande aktivitet. Nimenrix inducerar produktion av baktericida antikroppar mot kapsulära polysackarider av Neisseria meningitidis grupp A, C, W-135 och Y enligt mätning med test som bygger på antingen rSBA eller hSBA.
Immunogenicitet hos spädbarn
I studie MenACWY-TT-083 administrerades den första dosen vid 6 till 12 veckors ålder, den andra dosen efter ett intervall på 2 månader och den tredje (påfyllnadsdos) dosen administrerades vid cirka 12 månaders ålder. DTaP-HBV-IPV/Hib- och ett 10-valent pneumokockvaccin gavs samtidigt. Nimenrix uppnådde rSBA- och hSBA-titrar mot de fyra meningokockgrupperna såsom visas i tabell 2. Responsen mot grupp C var jämförbar (non-inferior) med den som uppnåddes av de godkända MenC-CRM- och MenC-TT-vaccinerna, uttryckt som procentandel med rSBA-titer ≥8 1 månad efter den andra dosen.
Data från denna studie stöder extrapolering av immunogenicitetsdata och dosering till spädbarn från 12 veckors till under 6 månaders ålder.
Tabell 2: rSBA- och hSBA-titrar efter två doser Nimenrix (eller MenC-CRM eller MenC-TT) givna med två månaders mellanrum med den första dosen administrerad till spädbarn i åldern 6-12 veckor och efter en påfyllnad vid 12 månaders ålder (studie MenACWY-TT-083)
|
Meningo kock-grupp |
Vaccin grupp |
Tidpunkt |
rSBA* |
|
||||
|
N |
≥8 |
GMT |
N |
≥8 |
GMT |
|||
|
(95 % CI) |
(95 % CI) |
(95 % CI) |
(95 % CI) |
|||||
|
A |
Nimenrix |
Efter dos 2(1) |
456 |
97,4 % (95,4; 98,6) |
203 (182; 227) |
202 |
96,5 % (93,0; 98,6) |
157 (131; 188) |
|
Efter påfyllnad (1) |
462 |
99,6 % (98,4; 99,9) |
1561 (1412; 1725) |
214 |
99,5 % (97,4;100) |
1007 (836;1214) |
||
|
C |
Nimenrix |
Efter dos 2(1) |
456 |
98,7 % (97,2; 99,5) |
612 (540; 693) |
218 |
98,6 % (96,0; 99,7) |
1308 (1052; 1627) |
|
Efter påfyllnad (1) |
463 |
99,8 % (98,8; 100) |
1177 (1059; 1308) |
221 |
99,5 % (97,5; 100) |
4992 (4086; 6100) |
||
|
MenC-CRM- vaccin |
Efter dos 2(1) |
455 |
99,6 % (98,4; 99,9) |
958 (850; 1079) |
202 |
100 % (98,2; 100) |
3188 (2646; 3841) |
|
|
Efter påfyllnad(1) |
446 |
98,4 % (96,8; 99,4) |
1051 (920; 1202) |
216 |
100 % (98,3; 100) |
5438 (4412; 6702) |
||
|
MenC-TT-vaccin |
Efter dos 2(1) |
457 |
100 % (99,2; 100) |
1188 (1080; 1307) |
226 |
100 % (98,4; 100) |
2626 (2219; 3109) |
|
|
Efter påfyllnad (1) |
459 |
100 % (99,2; 100) |
1960 (1776; 2163) |
219 |
100 % (98,3; 100) |
5542 (4765; 6446) |
||
|
W |
Nimenrix |
Efter dos 2(1) |
455 |
99,1 % (97,8; 99,8) |
1605 (1383; 1862) |
217 |
100 % (98,3; 100) |
753 (644; 882) |
|
Efter påfyllnad (1) |
462 |
99,8 % (98,8; 100) |
2777 (2485; 3104) |
218 |
100 % (98,3; 100) |
5123 (4504; 5826) |
||
|
Y |
Nimenrix |
Efter dos 2(1) |
456 |
98,2 % (96,6; 99,2) |
483 (419; 558) |
214 |
97,7 % (94,6; 99,2) |
328 (276; 390) |
|
Efter påfyllnad (1) |
462 |
99,4 % (99,1; 99,9) |
881 (787; 986) |
217 |
100 % (98,3; 100) |
2954 (2498; 3493) |
||
Immunogenicitetsanalysen utfördes på den primära ATP-kohorten (according-to-protocol).
* rSBA-analys utförd vid Public Health England (PHE) laboratorier i Storbritannien
** hSBA-analys utförd vid GSK laboratorier
(1) blodprovstagning 21 till 48 dagar efter vaccination
I studie MenACWY-TT-087 fick spädbarn antingen en enda primärdos vid 6 månader följt av en påfyllnadsdos vid 15‑18 månader (DTaP-IPV/Hib och 10-valent konjugerat pneumokockvaccin gavs samtidigt vid båda vaccinationstillfällena), eller tre primärdoser vid 2, 4 och 6 månader följt av en påfyllnadsdos vid 15‑18 månader. En enda primärdos administrerad vid 6 månaders ålder framkallade robusta rSBA-titrar mot de fyra meningokockgrupperna, mätt som procentandelen individer med rSBA-titrar på ≥8, som var jämförbara med responsen efter den sista dosen i en primärvaccinationsserie med tre doser. En påfyllnadsdos gav robust behandlingsrespons, jämförbar mellan de två doseringsgrupperna, mot alla fyra meningokockgrupperna. Resultaten visas i tabell 3.
Tabell 3: rSBA- och hSBA-titrar efter en enstaka dos Nimenrix hos spädbarn vid 6 månader och före och efter en påfyllnad vid 15-18 månaders ålder (studie MenACWY-TT-087)
|
Meningo-kock grupp |
Tidpunkt |
rSBA* |
hSBA** |
|||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95% CI) |
GMT (95% CI) |
|||
|
A |
Efter dos 1(1) |
163 |
98,8 % (95,6; 99,9) |
1333 (1035; 1716) |
59 |
98,3 % (90,9; 100) |
271 (206; 355) |
|
|
Före påfyllnad |
131 |
81,7 % (74; 87,9) |
125 (84,4; 186) |
71 |
66,2 % (54; 77) |
20,8 (13,5; 32,2) |
||
|
Efter påfyllnad(1) |
139 |
99,3 % (96,1; 100) |
2762 (2310; 3303) |
83 |
100 % (95,7; 100) |
1416
|
||
|
C |
Efter dos 1(1) |
163 |
99,4 % (96,6; 100) |
592 (482; 726) |
66 |
100 % (94,6; 100) |
523 (382; 717) |
|
|
Före påfyllnad |
131 |
65,6 % (56,9; 73,7) |
27,4 (20,6; 36,6) |
78 |
96,2 % (89,2; 99,2) |
151 (109; 210) |
||
|
Efter påfyllnad(1) |
139 |
99,3 % (96,1; 100) |
2525 (2102; 3033) |
92 |
100 % (96,1; 100) |
13360 (10953; 16296) |
||
|
W |
Efter dos 1(1) |
163 |
93,9 % (89; 97) |
1256 (917; 1720) |
47 |
87,2 % (74,3; 95,2) |
137 (78,4; 238) |
|
|
Före påfyllnad |
131 |
77,9 % (69,8; 84,6) |
63,3 (45,6; 87,9) |
53 |
100 % (93,3; 100) |
429 (328; 559) |
||
|
Efter påfyllnad(1) |
139 |
100 % (97,4; 100) |
3145 (2637; 3750) |
59 |
100 % (93,9; 100) |
9016 (7045; 11537) |
||
|
Y |
Före dos 1(1) |
163 |
98,8 % (95,6; 99,9) |
1470 (1187; 1821) |
52 |
92,3 % (81,5; 97,9) |
195 (118; 323) |
|
|
Före påfyllnad |
131 |
88,5 % (81,8; 93,4) |
106 (76,4; 148) |
61 |
98,4 % (91,2; 100) |
389 (292; 518) |
||
|
Efter påfyllnad(1) |
139 |
100 % (97,4; 100) |
2749 (2301; 3283) |
69 |
100 % (94,8; 100) |
5978 (4747; 7528) |
||
Immunogenicitetsanalysen utfördes på den primära ATP-kohorten.
* rSBA-analys utförd vid PHE laboratorier i Storbritannien
** hSBA-analys utförd vid Neomed i Kanada
(1) blodprovstagning 1 månad efter vaccination
Mätning av hSBA-titrar var en sekundär endpoint i studie MenACWY-TT-087. Även om likartad respons mot grupp A och C observerades med båda doseringsmetoderna, gav en primär engångsdos till spädbarn vid 6 månaders ålder lägre hSBA-titrar mot W-135 och Y, mätt som andelen individer med hSBA-titrar ≥8 [87,2 % (95 % CI: 74,3; 95,2) respektive 92,3 % (95 % CI: 81,5; 97,9)], jämfört med tre primärdoser vid 2, 4 och 6 månaders ålder [100 % [95 % CI: 96,6; 100) respektive 100 % (95 % CI: 97,1; 100)] (se avsnitt Varningar och försiktighet). Efter en påfyllnadsdos var hSBA-titrar mot alla fyra meningokockgrupperna jämförbara för de två doseringsmetoderna. Resultaten visas i tabell 3.
Immunogenicitet hos småbarn i åldern 12‑23 månader
I de kliniska studierna MenACWY-TT-039 och MenACWY-TT-040, uppnådde en enstaka dos Nimenrix SBA-titrar mot de fyra meningokockgrupperna, med grupp C rSBA-titrar som var jämförbara med de som uppnåddes av ett godkänt MenC-CRM-vaccin, uttryckt som procentandelen av försökspersoner med rSBA-titer ≥8. I studie MenACWY-TT-039 mättes även hSBA som en sekundär endpoint. Resultaten visas i tabell 4.
Tabell 4: SBA*-titrar efter en enstaka dos Nimenrix (eller MenC-CRM) hos småbarn i åldern 12‑23 månader (studie MenACWY-TT-039/040)
|
Meningo-kock grupp |
Vaccingrupp |
Studie MenACWY-TT-039(1) |
Studie MenACWY-TT-040(2) |
|||||||
|
rSBA* |
hSBA* |
rSBA* |
||||||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
||
|
A |
Nimenrix |
354 |
99,7 % (98,4; 100) |
2205 (2008; 2422) |
338 |
77,2 % (72,4; 81,6) |
19,0 (16,4; 22,1) |
183 |
98,4 % (95,3; 99,7) |
3170 (2577; 3899) |
|
C |
Nimenrix |
354 |
99,7 % (98,4; 100) |
478 (437; 522) |
341 |
98,5 % (96,6; 99,5) |
196 (175; 219) |
183 |
97,3 % (93,7; 99,1) |
829 (672; 1021) |
|
MenC-CRM- vaccin |
121 |
97,5 % (92,9; 99,5) |
212 (170; 265) |
116 |
81,9 % (73,7; 88,4) |
40,3 (29,5; 55,1) |
114 |
98,2 % (93,8; 99,8) |
691 (521; 918) |
|
|
W-135 |
Nimenrix |
354 |
100 % (99,0; 100) |
2682 (2453; 2932) |
336 |
87,5 % (83,5; 90,8) |
48,9 (41,2; 58,0) |
186 |
98,4 % (95,4; 99,7) |
4022 (3269; 4949) |
|
Y |
Nimenrix |
354 |
100 % (99,0; 100) |
2729 (2473; 3013) |
329 |
79,3 % (74,5; 83,6) |
30,9 (25,8; 37,1) |
185 |
97,3 % (93,8; 99,1) |
3168 (2522; 3979) |
Immunogenicitetsanalysen utfördes på ATP-kohorten.
(1) blodprovstagning 42 till 56 dagar efter vaccination
(2) blodprovstagning 30 till 42 dagar efter vaccination
*SBA-analyser utförda vid GSK laboratorier
Långsiktig immunogenicitet hos småbarn
Studie MenACWY-TT-104 utvärderade immunogeniciteten efter 1 månad och svarets varaktighet i upp till 5 år efter 1 eller 2 doser Nimenrix (givna med 2 månaders mellanrum) hos småbarn i åldern 12 till 14 månader. En månad efter en eller två doser uppnådde Nimenrix rSBA-titrar mot alla fyra meningokockgrupper som var likartade vad gäller procentandelen försökspersoner med rSBA-titer ≥ 8 och GMT. hSBA-titrar mättes som ett sekundärt effektmått. En månad efter dos ett eller två uppnådde Nimenrix hSBA-titrar mot grupp W-135 och Y som var högre vad gäller procentandelen försökspersoner med hSBA-titer ≥ 8 när två doser gavs jämfört med när en dos gavs (se avsnitt Varningar och försiktighet). Nimenrix uppnådde hSBA-titrar mot grupp A och C som var likartade vad gäller procentandelen försökspersoner med hSBA-titer ≥ 8 när två doser gavs jämfört med när en dos gavs. Vid år 5 observerades endast en liten skillnad i antikropparnas varaktighet mellan en och två doser vad gäller procentandelen försökspersoner med hSBA-titrar ≥ 8 mot alla grupper. Antikropparnas varaktighet observerades vid år 5 mot grupp C, W-135 och Y. Efter en och två doser var procentandelen försökspersoner med hSBA-titrar ≥ 8 60,7 % respektive 67,8 % för grupp C, 58,9 % respektive 63,6 % för grupp W‑135 och 61,5 % respektive 54,2 % för grupp Y. 27,9 % respektive 17,9 % av försökspersonerna som fick en eller två doser hade hSBA-titrar ≥ 8 för grupp A. Resultaten visas i tabell 5.
Tabell 5: rSBA- och hSBA-titrar efter en eller två doser Nimenrix med den första dosen administrerad till småbarn i åldern 12-14 månader och varaktighet upp till 5 år (studie MenACWY-TT-104)
|
Meningo-kock grupp |
Nimenrix dosgrupp |
Tidpunkt(1) |
rSBA* |
hSBA** |
||||
|---|---|---|---|---|---|---|---|---|
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
|||
|
A |
1 dos |
Efter dos 1 |
180 |
97,8 % (94,4; 99,4) |
1437 (1118; 1847) |
74 |
95,9 % (88,6; 99,2) |
118 (86,8; 161) |
|
År 1 |
167 |
63,5 % (55,7; 70,8) |
62,7 (42,6; 92,2) |
70 |
35,1 % (25,9; 49,5) |
6,1 (4,1; 8,9) |
||
|
År 3 |
147 |
46,9 % (38,7; 55,3) |
29,7 (19,8; 44,5) |
55 |
36,4 % (23,8; 50,4) |
5,8 (3,8; 8,9) |
||
|
År 5 |
133 |
58,6 % (49,8; 67,1) |
46,8 (30,7; 71,5) |
61 |
27,9 % (17,1; 40,8) |
4,4 (3,1; 6,2) |
||
|
2 doser |
Efter dos 1 |
158 |
96,8 % (92,8; 99,0) |
1275 (970; 1675) |
66 |
97,0 % (89,5; 99,6) |
133 (98,1; 180) |
|
|
Efter dos 2 |
150 |
98,0 % (94,3; 99,6) |
1176 (922; 1501) |
66 |
97,0 % (89,5; 99,6) |
170 (126; 230) |
||
|
År 1 |
143 |
70,6 % (62,4; 77,9) |
76,6 (50,7; 115,7) |
62 |
35,5 % (23,7; 48,7) |
6,4 (4,2; 10,0) |
||
|
År 3 |
121 |
54,5 % (45,2; 63,6) |
28,5 (18,7; 43,6) |
50 |
36,0 % (22,9; 50,8) |
5,4 (3,6; 8,0) |
||
|
År 5 |
117 |
65,8 % (56,5; 74,3) |
69,9 (44,7; 109,3) |
56 |
17,9 % (8,9; 30,4) |
3,1 (2,4; 4,0) |
||
|
C |
1 dos |
Efter dos 1 |
179 |
95,0 % (90,7; 97,7) |
452 (346; 592) |
78 |
98,7 % (93,1; 100) |
152 (105; 220) |
|
År 1 |
167 |
49,1 % (41,3; 56,9) |
16,2 (12,4; 21,1) |
71 |
81,7 % (70,7; 89,9) |
35,2 (22,5; 55,2) |
||
|
År 3 |
147 |
35,4 % (27,7; 43,7) |
9,8 (7,6; 12,7) |
61 |
65,6 % (52,3; 77,3) |
23,6 (13,9; 40,2) |
||
|
År 5 |
132 |
20,5 % (13,9; 28,3) |
6,6 (5,3; 8,2) |
61 |
60,7 % (47,3; 72,9) |
18,1 (10,9; 30,0) |
||
|
2 doser |
Efter dos 1 |
157 |
95,5 % (91,0; 98,2) |
369 (281; 485) |
70 |
95,7 % (88,0; 99,1) |
161 (110; 236) |
|
|
Efter dos 2 |
150 |
98,7 % (95,3; 99,8) |
639 (522; 783) |
69 |
100 % (94,8; 100) |
1753 (1278; 2404) |
||
|
År 1 |
143 |
55,2 % (46,7; 63,6) |
21,2 (15,6; 28,9) |
63 |
93,7 % (84,5; 98,2) |
73,4 (47,5; 113,4) |
||
|
År 3 |
121 |
33,9 % (25,5; 43,0) |
11,5 (8,4; 15,8) |
56 |
67,9 % (54,0; 79,7) |
27,0 (15,6; 46,8) |
||
|
År 5 |
116 |
28,4 % (20,5; 37,6) |
8,5 (6,4; 11,2) |
59 |
67,8 % (54,4; 79,4) |
29,4 (16,3; 52,9) |
||
|
W-135 |
1 dos |
Efter dos 1 |
180 |
95,0 % (90,8; 97,7) |
2120 (1601; 2808) |
72 |
62,5 % (50,3; 73,6) |
27,5 (16,1; 46,8) |
|
År 1 |
167 |
65,3 % (57,5; 72,5) |
57,2 (39,9; 82,0) |
72 |
95,8 % (88,3; 99,1) |
209,0 (149,9; 291,4) |
||
|
År 3 |
147 |
59,2 % (50,8; 67,2) |
42,5 (29,2; 61,8) |
67 |
71,6 % (59,3; 82,0) |
30,5 (18,7; 49,6) |
||
|
År 5 |
133 |
44,4 % (35,8; 53,2) |
25,0 (16,7; 37,6) |
56 |
58,9 % (45,0; 71,9) |
20,8 (11,6; 37,1) |
||
|
2 doser |
Efter dos 1 |
158 |
94,9 % (90,3; 97,8) |
2030 (1511; 2728) |
61 |
68,9 % (55,7; 80,1) |
26,2 (16,0; 43,0) |
|
|
Efter dos 2 |
150 |
100 % (97,6; 100) |
3533 (2914; 4283) |
70 |
97,1 % (90,1; 99,7) |
757 (550; 1041) |
||
|
År 1 |
143 |
77,6 % (69,9; 84,2) |
123 (82,7; 183) |
65 |
98,5 % (91,7; 100,0) |
232,6 (168,3; 321,4) |
||
|
År 3 |
121 |
72,7 % (63,9; 80,4) |
92,9 (59,9; 144) |
54 |
87,0 % (75,1; 94,6) |
55,5 (35,3; 87,1) |
||
|
År 5 |
117 |
50,4 % (41,0; 59,8) |
37,1 (23,3; 59,0) |
44 |
63,6 % (47,8; 77,6) |
19,5 (10,7; 35,2) |
||
|
Y |
1 dos |
Efter dos 1 |
180 |
92,8 % (88,0; 96,1) |
952 (705; 1285) |
71 |
67,6 % (55,5; 78,2) |
41,2 (23,7; 71,5) |
|
År 1 |
167 |
73,1 % (65,7; 79,6) |
76,8 (54,2; 109,0) |
62 |
91,9 % (82,2; 97,3) |
144 (97,2; 214,5) |
||
|
År 3 |
147 |
61,9 % (53,5; 69,8) |
58,0 (39,1; 86,0) |
64 |
53,1 % (40,2; 65,7) |
17,3 (10,1; 29,6) |
||
|
År 5 |
133 |
47,4 % (38,7; 56,2) |
36,5 (23,6; 56,2) |
65 |
61,5 % (48,6; 73,3) |
24,3 (14,3; 41,1) |
||
|
2 doser |
Efter dos 1 |
157 |
93,6 % (88,6; 96,9) |
933 (692; 1258) |
56 |
64,3 % (50,4; 76,6) |
31,9 (17,6; 57,9) |
|
|
Efter dos 2 |
150 |
99,3 % (96,3; 100) |
1134 (944; 1360) |
64 |
95,3 % (86,9; 99,0) |
513 (339; 775) |
||
|
År 1 |
143 |
79,7 % (72,2; 86,0) |
112,3 (77,5; 162,8) |
58 |
87,9 % (76,7; 95,0) |
143,9 (88,5; 233,8) |
||
|
År 3 |
121 |
68,6 % (59,5; 76,7) |
75,1 (48,7; 115,9) |
52 |
61,5 % (47,0; 74,7) |
24,1 (13,3; 43,8) |
||
|
År 5 |
117 |
58,1 % (48,6; 67,2) |
55,8 (35,7; 87,5) |
48 |
54,2 % (39,2; 68,6) |
16,8 (9,0; 31,3) |
||
Immunogenicitetsanalysen utfördes på ATP-kohorten.
(1) blodprovstagning 21 till 48 dagar efter vaccination
* rSBA-analys utförd vid PHE laboratorier
** hSBA-analys utförd vid GSK laboratorier
rSBA- och hSBA-titrar fastställdes under en period på 10 år hos barn som initialt vaccinerats med en dos Nimenrix eller MenC-CRM vid 12 till 23 månaders ålder i studie MenACWY-TT-027. Varaktigheten av SBA-titrar utvärderades i två förlängningsstudier: MenACWY-TT-032 (upp till 5 år) och MenACWY-TT-100 (upp till 10 år). Studie MenACWY-TT-100 utvärderade även responsen på en enstaka påfyllnadsdos av Nimenrix administrerad 10 år efter den initiala vaccinationen med Nimenrix eller MenC-CRM. Resultaten visas i tabell 6 (se avsnitt Varningar och försiktighet).
Tabell 6: rSBA- och hSBA-titrar efter en enstaka dos Nimenrix (eller MenC-CRM) hos småbarn i åldern 12‑23 månader, varaktighet upp till 10 år, och efter påfyllnad administrerad 10 år efter initial vaccination (studie MenACWY-TT-027/032/100)
|
Meningo-kock grupp |
Vaccin-grupp |
Tidpunkt |
rSBA* |
hSBA** |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
|||
|
A |
Nimenrix |
Månad 1(1) |
222 |
100 %
|
3707
|
217 |
91,2 %
|
59,0
|
|
År 4(2) |
45 |
64,4 % (48,8; 78,1) |
35,1 (19,4; 63,4) |
44 |
52,3 % (36,7; 67,5) |
8,8 (5,4; 14,2) |
||
|
År 5(2) |
49 |
73,5 % (58,9; 85,1) |
37,4 (22,1; 63,2) |
45 |
35,6 % (21,9; 51,2) |
5,2 (3,4; 7,8) |
||
|
År 10(3)
|
62 |
66,1 % (53,0; 77,7) |
28,9 (16,4; 51,0) |
59 |
25,4 % (15,0; 38,4) |
4,2 (3,0; 5,9) |
||
|
(Efter påfyllnad) (3,4) |
62 |
98,4 %
|
5122
|
62 |
100 %
|
1534
|
||
|
C |
Nimenrix |
Månad 1(1) |
220 |
100 %
|
879
|
221 |
99,1 %
|
190
|
|
År 4(2) |
45 |
97,8 % (88,2; 99,9) |
110 (62,7; 192) |
45 |
97,8 % (88,2; 99,9) |
370 (214; 640) |
||
|
År 5(2) |
49 |
77,6 % (63,4; 88,2) |
48,9 (28,5; 84,0) |
48 |
91,7 % (80,0; 97,7) |
216 (124; 379) |
||
|
År 10(3)
|
62 |
82,3 % (70,5; 90,8) |
128 (71,1; 231) |
60 |
91,7 % (81,6; 97,2) |
349 (197; 619) |
||
|
(Efter påfyllnad) (3,4) |
62 |
100 %
|
7164
|
59 |
100 %
|
33960
|
||
|
MenC-CRM vaccin |
Månad 1(1) |
68 |
98,5 %
|
415
|
68 |
72,1 %
|
21,2
|
|
|
År 4(2) |
10 |
80,0 % (44,4; 97,5) |
137 (22,6; 832) |
10 |
70,0 % (34,8; 93,3) |
91,9 (9,8; 859) |
||
|
År 5(2) |
11 |
63,6 % (30,8; 89,1) |
26,5 (6,5; 107) |
11 |
90,9 % (58,7; 99,8) |
109 (21,2; 557) |
||
|
År 10(3)
|
16 |
87,5 % (61,7; 98,4) |
86,7
|
15 |
93,3 % (68,1; 99,8) |
117 (40,0; 344) |
||
|
(Efter påfyllnad) (3,4) |
16 |
100 %
|
5793
|
15 |
100 %
|
42559
|
||
|
W-135 |
Nimenrix |
Månad 1(1) |
222 |
100 %
|
5395
|
177 |
79,7 %
|
38,8
|
|
År 4(2) |
45 |
60,0 % (44,3; 74,3) |
50,8 (24,0; 108) |
45 |
84,4 % (70,5; 93,5) |
76,9 (44,0; 134) |
||
|
År 5(2) |
49 |
34,7 % (21,7; 49,6) |
18,2 (9,3; 35,3) |
46 |
82,6 % (68,6; 92,2) |
59,7 (35,1; 101) |
||
|
År 10(3)
|
62 |
30,6 % (19,6; 43,7) |
15,8 (9,1; 27,6) |
52 |
44,2 % (30,5; 58,7) |
7,7 (4,9; 12,2) |
||
|
(Efter påfyllnad) (3,4) |
62 |
100 %
|
25911
|
62 |
100 %
|
11925
|
||
|
Y |
Nimenrix |
Månad 1(1) |
222 |
100 %
|
2824
|
201 |
66,7 %
|
24,4
|
|
År 4(2) |
45 |
62,2 % (46,5; 76,2) |
44,9 (22,6; 89,3) |
441 |
87,8 % (73,8; 95,9) |
74,6 (44,5; 125) |
||
|
År 5(2) |
49 |
42,9 % (28,8; 57,8) |
20,6 (10,9; 39,2) |
45 |
80,0 % (65,4; 90,4) |
70,6 (38,7; 129) |
||
|
År 10(3)
|
62 |
45,2 % (32,5; 58,3) |
27,4 (14,7; 51,0) |
56 |
42,9 % (29,7; 56,8) |
9,1 (5,5; 15,1) |
||
|
(Efter påfyllnad) (3,4) |
62 |
98,4 %
|
7661
|
61 |
100 %
|
12154
|
||
Immunogenicitetsanalysen utfördes på ATP-kohorterna för tidpunkterna 1 månad och 5 år efter vaccination och ATP-kohorten för en påfyllnadsdos. Försökspersoner med suboptimal respons på meningokockgrupp C (definierat som SBA-titer under det fördefinierade analyströskelvärdet) skulle få en ytterligare dos MenC-vaccin före år 6. Dessa försökspersoner uteslöts från analysen år 4 och 5 men inkluderades i analysen år 10.
(1) Studie MenACWY-TT-027
(2) Studie MenACWY-TT-032
(3) Studie MenACWY-TT-100
(4) Blodprovstagning 1 månad efter en påfyllnadsdos år 10.
* rSBA-analys utförd vid GSK laboratorier för tidpunkten 1 månad efter primär vaccination och vid PHE laboratorier i Storbritannien för efterföljande tidpunkter för provtagning.
** hSBA-analys utförd vid GSK laboratorier och vid Neomed i Kanada för tidpunkterna i studie MenACWY-TT-100.
Varaktighet av respons efter en påfyllnadsdos
Studie MenACWY-TT-102 utvärderade varaktigheten av SBA-titrar upp till 6 år efter en påfyllnadsdos av Nimenrix eller MenC-CRM197 administrerad i studie MenACWY-TT-048 hos barn som initialt fått samma vaccin vid 12 till 23 månaders ålders i studie MenACWY-TT-039. En enstaka påfyllnadsdos administrerades 4 år efter initial vaccination. Resultaten visas i tabell 7 (se avsnitt Varningar och försiktighet).
Tabell 7: rSBA- och hSBA-titrar efter en enstaka dos Nimenrix (eller MenC-CRM) hos småbarn i åldern 12-23 månader, varaktighet vid 4 år och respons efter påfyllnad administrerad 4 år efter initial vaccination, och varaktighet upp till 6 år efter påfyllnad (studie MenACWY-TT-039/048/102)
|
Meningo-kock grupp |
Vaccin-grupp |
Tidpunkt |
rSBA* |
hSBA** |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
|||
|
A |
Nimenrix |
Månad 1(1) |
354 |
99,7 % (98,4; 100) |
2205 (2008; 2422) |
338 |
77,2 % (72,4; 81,6) |
19,0 (16,4; 22,1) |
|
År 4(2) (Före Nimenrix-påfyllnad) |
212 |
74,5 % (68,1; 80,2) |
112 (80,3; 156) |
187 |
28,9 % (22,5; 35,9) |
4,8 (3,9; 5,9) |
||
|
(Efter påfyllnad)(2,3) |
214 |
100 % (98,3; 100) |
7173 (6389; 8054) |
202 |
99,5 % (97,3; 100) |
1343 (1119; 1612) |
||
|
5 år efter påfyllnad(4) |
137 |
89,8 % (83,4; 94,3) |
229 (163; 322) |
135 |
53,3 % (44,6; 62,0) |
13,2 (9,6; 18,3) |
||
|
6 år efter påfyllnad(4) |
134 |
92,5 % (86,7; 96,4) |
297 (214; 413) |
130 |
58,5 % (49,5; 67,0) |
14,4 (10,5; 19,7) |
||
|
C |
Nimenrix |
Månad 1(1) |
354 |
99,7 % (98,4; 100) |
478 (437; 522) |
341 |
98,5 % (96,6; 99,5) |
196
|
|
År 4(2) (Före Nimenrix-påfyllnad) |
213 |
39,9 % (33,3; 46,8) |
12,1 (9,6; 15,2) |
200 |
73,0 % (66,3; 79,0) |
31,2 (23,0; 42,2) |
||
|
(Efter påfyllnad)(2,3) |
215 |
100 % (98,3; 100) |
4512 (3936; 5172) |
209 |
100 %
|
15831 (13626; 18394) |
||
|
5 år efter påfyllnad(4) |
137 |
80,3 % (72,6; 86,6) |
66,0 (48,1; 90,5) |
136 |
99,3 % (96,0; 100) |
337 (261; 435) |
||
|
6 år efter påfyllnad(4) |
134 |
71,6 % (63,2; 79,1) |
39,6 (28,6; 54,6) |
130 |
97,7 % (93,4; 99,5) |
259 (195; 345) |
||
|
MenC-CRM-vaccin |
Månad 1(1) |
121 |
97,5 % (92,9; 99,5) |
212 (170; 265) |
116 |
81,9 % (73,7; 88,4) |
40,3 (29,5; 55,1) |
|
|
År 4(2) (Före MenC-CRM197-påfyllnad) |
43 |
37,2 % (23,0; 53,3) |
14,3 (7,7; 26,5) |
31 |
48,4 % (30,2; 66,9) |
11,9 (5,1; 27,6) |
||
|
(Efter påfyllnad)(2,3) |
43 |
100 % (91,8; 100) |
3718 (2596; 5326) |
33 |
100 % (89,4; 100) |
8646 (5887; 12699) |
||
|
5 år efter påfyllnad(4) |
23 |
78,3 % (56,3; 92,5) |
47,3 (19,0; 118) |
23 |
100 % (85,2; 100) |
241 (139; 420) |
||
|
6 år efter påfyllnad(4) |
23 |
65,2 % (42,7; 83,6) |
33,0 (14,7; 74,2) |
23 |
95,7 % (78,1; 99,9) |
169 (94,1; 305) |
||
|
W-135 |
Nimenrix |
Månad 1(1) |
354 |
100 % (99,0; 100) |
2682 (2453; 2932) |
336 |
87,5 % (83,5; 90,8) |
48,9 (41,2; 58,0) |
|
År 4(2) (Före Nimenrix-påfyllnad) |
213 |
48,8 % (41,9; 55,7) |
30,2 (21,9; 41,5) |
158 |
81,6 % (74,7; 87,3) |
48,3 (36,5; 63,9) |
||
|
(Efter påfyllnad)(2,3) |
215 |
100 % (98,3; 100) |
10950 (9531; 12579) |
192 |
100 % (98,1; 100) |
14411 (12972 ; 16010) |
||
|
5 år efter påfyllnad(4) |
137 |
88,3 % (81,7; 93,2) |
184 (130; 261) |
136 |
100 % (97,3; 100) |
327 (276; 388) |
||
|
6 år efter påfyllnad(4) |
134 |
85,8 % (78,7; 91,2) |
172 (118; 251) |
133 |
98,5 % (94,7; 99,8) |
314 (255; 388) |
||
|
Y |
Nimenrix |
Månad 1(1) |
354 |
100 % (99,0; 100) |
2729 (2473; 3013) |
329 |
79,3 % (74,5; 83,6) |
30,9 (25,8; 37,1) |
|
År 4(2) (Före Nimenrix-påfyllnad) |
213 |
58,2 % (51,3; 64,9) |
37,3 (27,6; 50,4) |
123 |
65,9 % (56,8; 74,2) |
30,2 (20,2; 45,0) |
||
|
(Efter påfyllnad)(2,3) |
215 |
100 % (98,3; 100) |
4585 (4129; 5093) |
173 |
100 % (97,9; 100) |
6776 (5961; 7701) |
||
|
5 år efter påfyllnad(4) |
137 |
92,7 % (87,0; 96,4) |
265 (191; 368) |
137 |
97,8 % (93,7; 99,5) |
399 (321; 495) |
||
|
6 år efter påfyllnad(4) |
134 |
94,0 % (88,6; 97,4) |
260 (189; 359) |
131 |
97,7 % (93,5; 99,5) |
316 (253; 394) |
||
Immunogenicitetsanalysen utfördes på ATP-kohorten för varje tidpunkt.
(1) Studie MenACWY-TT-039
(2) Studie MenACWY-TT-048
(3) Blodprovstagning 1 månad efter en påfyllnadsdos år 4.
(4) Studie MenACWY-TT-102
* rSBA-analys utförd vid GSK laboratorier för tidpunkten 1 månad efter primär vaccination och vid PHE laboratorier i Storbritannien för efterföljande tidpunkter för provtagning.
** hSBA-analys utförd vid GSK laboratorier och vid Neomed i Kanada för tidpunkterna i studie MenACWY-TT-102.
Immunogenicitet hos barn i åldern 2‑10 år
I studie MenACWY-TT-081 var en enstaka dos Nimenrix jämförbar (non-inferior) med ett annat godkänt MenC-CRM-vaccin vad gäller vaccinrespons mot grupp C [94,8 % (95 % CI: 91,4; 97,1) respektive 95,7 % (95 % CI: 89,2; 98,8)]. GMT var lägre för Nimenrix-gruppen [2795 (95 % CI: 2393; 3263)] jämfört med MenC-CRM-vaccinet [5292 (95 % CI: 3815; 7340)].
I studie MenACWY-TT-038 var en enstaka dos Nimenrix jämförbar (non-inferior) med det godkända ACWY‑PS-vaccinet vad gäller vaccinrespons mot de fyra meningokockgrupperna såsom visas i tabell 8.
Tabell 8: rSBA*-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos barn i åldern 2‑10 år (studie MenACWY-TT-038)
|
Meningo-kock grupp |
Nimenrix(1) |
ACWY-PS-vaccin(1) |
||||
|
N |
VR (95 % CI) |
GMT (95 % CI) |
N |
VR (95 % CI) |
GMT (95 % CI) |
|
|
A |
594 |
89,1 % (86,3; 91,5) |
6343 (5998; 6708) |
192 |
64,6 % (57,4; 71,3) |
2283 (2023; 2577) |
|
C |
691 |
96,1 % (94,4; 97,4) |
4813 (4342; 5335) |
234 |
89,7 % (85,1; 93,3) |
1317 (1043; 1663) |
|
W-135 |
691 |
97,4 % (95,9; 98,4) |
11543 (10873; 12255) |
236 |
82,6 % (77,2; 87,2) |
2158 (1815; 2565) |
|
Y |
723 |
92,7 % (90,5; 94,5) |
10825 (10233; 11452) |
240 |
68,8 % (62,5; 74,6) |
2613 (2237; 3052) |
Immunogenicitetsanalysen utfördes på ATP-kohorten.
(1) Blodprovstagning 1 månad efter vaccination
VR: vaccinrespons definierades som andel försökspersoner med
-
rSBA-titer ≥32 för initialt seronegativa försökspersoner (dvs rSBA-titer <8 före vaccination)
-
minst en 4-faldig ökning av rSBA-titern efter jämfört med före vaccination för initialt seropositiva försökspersoner (dvs rSBA-titer ≥8 före vaccination)
* rSBA-analys utförd vid GSK laboratorier
Varaktigheten av SBA-titrar utvärderades hos barn som initialt vaccinerats i studie MenACWY-TT-081 såsom visas i tabell 9 (se avsnitt Varningar och försiktighet).
Tabell 9: rSBA- och hSBA-titrar upp till 44 månader efter Nimenrix (eller MenC-CRM) hos barn i åldern 2‑10 år vid tidpunkten för vaccination (studie MenACWY-TT-088)
|
Meningo-kock grupp |
Vaccin-grupp |
Tidpunkt (månader) |
rSBA* |
hSBA** |
||||
|
N |
≥8 (95%CI) |
GMT (95%CI) |
N |
≥8 (95%CI) |
GMT (95%CI) |
|||
|
A |
Nimenrix |
32 |
193 |
86,5 % (80,9; 91,0) |
196 (144; 267) |
90 |
25,6 % (16,9; 35,8) |
4,6 (3,3; 6,3) |
|
44 |
189 |
85,7 % (79,9; 90,4) |
307 (224; 423) |
89 |
25,8 % (17,1; 36,2) |
4,8 (3,4; 6,7) |
||
|
C |
Nimenrix |
32 |
192 |
64,6 % (57,4; 71,3) |
34,8 (26,0; 46,4) |
90 |
95,6 % (89,0; 98,8) |
75.9 (53,4; 108) |
|
44 |
189 |
37,0 % (30,1; 44,3) |
14,5 (10,9; 19,2) |
82 |
76,8 % (66,2; 85,4) |
36,4 (23,1; 57,2) |
||
|
MenC-CRM-vaccin |
32 |
69 |
76,8 % (65,1; 86,1) |
86,5 (47,3; 158) |
33 |
90,9 % (75,7; 98,1) |
82,2 (34,6; 196) |
|
|
44 |
66 |
45,5 % (33,1; 58,2) |
31,0 (16,6; 58,0) |
31 |
64,5 % (45,4; 80,8) |
38,8 (13,3; 113) |
||
|
W-135 |
Nimenrix |
32 |
193 |
77,2 % (70,6; 82,9) |
214 (149; 307) |
86 |
84,9 % (75,5; 91,7) |
69,9 (48,2; 101) |
|
44 |
189 |
68,3 % (61,1; 74,8) |
103 (72,5; 148) |
87 |
80,5 % (70,6; 88,2) |
64,3 (42,7; 96,8) |
||
|
Y |
Nimenrix |
32 |
193 |
81,3 % (75,1; 86,6) |
227 (165; 314) |
91 |
81,3 % (71,8; 88,7) |
79,2 (52,5; 119) |
|
44 |
189 |
62,4 % (55,1; 69,4) |
78,9 (54,6; 114) |
76 |
82,9 % (72,5; 90,6) |
127 (78,0; 206) |
||
Immunogenicitetsanalysen utfördes på ATP-kohorten avseende varaktighet anpassat efter varje tidpunkt.
* rSBA-analys utförd vid PHE laboratorier i Storbritannien
** hSBA-analys utförd vid GSK laboratorier
Varaktigheten av hSBA-titrar utvärderades 1 år efter vaccination hos barn i åldern 6‑10 år som initialt vaccinerats i studie MenACWY-TT-027 (tabell 10) (se avsnitt Varningar och försiktighet).
Tabell 10: hSBA*-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos barn i åldern 6-10 år och varaktighet 1 år efter vaccination (studie MenACWY-TT-027/028)
|
Meningo-kock grupp |
Vaccin-grupp |
1 månad efter vaccination (studie MenACWY-TT-027) |
1 års varaktighet (studie MenACWY-TT-028) |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
||
|
A |
Nimenrix |
105 |
80,0 % (71,1; 87,2) |
53,4 (37,3; 76,2) |
104 |
16,3 % (9,8; 24,9) |
3,5 (2,7; 4,4) |
|
ACWY-PS-vaccin |
35 |
25,7 % (12,5; 43,3) |
4,1 (2,6; 6,5) |
35 |
5,7 % (0.7; 19,2) |
2,5 (1,9; 3,3) |
|
|
C |
Nimenrix |
101 |
89,1 % (81,3; 94,4) |
156 (99,3; 244) |
105 |
95,2 % (89,2; 98,4) |
129 (95,4; 176) |
|
ACWY-PS-vaccin |
38 |
39,5 % (24,0; 56,6) |
13,1 (5,4; 32,0) |
31 |
32,3 % (16,7; 51,4) |
7,7 (3,5; 17,3) |
|
|
W-135 |
Nimenrix |
103 |
95,1 % (89,0; 98,4) |
133 (99,9; 178) |
103 |
100 % (96,5; 100) |
257 (218;302) |
|
ACWY-PS-vaccin |
35 |
34,3 % (19,1; 52,2) |
5,8 (3,3; 9,9) |
31 |
12,9 % (3,6; 29,8) |
3,4 (2,0; 5,8) |
|
|
Y |
Nimenrix |
89 |
83,1 % (73,7; 90,2) |
95,1 (62,4; 145) |
106 |
99.1 % (94,9; 100) |
265 (213;330) |
|
ACWY-PS-vaccin |
32 |
43,8 % (26,4; 62,3) |
12,5 (5,6; 27,7) |
36 |
33,3 % (18,6; 51,0) |
9,3 (4,3; 19,9) |
|
Immunogenicitetsanalysen utfördes på ATP-kohorten för varaktighet vid 1 år.
hSBA-analys utfördes inte för barn i åldern 2 till <6 år (vid tidpunkten för vaccination).
* hSBA-analys utförd vid GSK laboratorier
SBA-titrar fastställdes under en period på 10 år hos barn som initialt vaccinerats med en dos Nimenrix eller ACWY-PS vid 2 till 10 års ålder i studie MenACWY-TT-027. Varaktigheten av SBA-titrar utvärderades i två förlängningsstudier: MenACWY-TT-032 (upp till 5 år) och MenACWY-TT-100 (upp till 10 år). Studie MenACWY-TT-100 utvärderade även responsen på en enstaka påfyllnadsdos av Nimenrix administrerad 10 år efter den initiala vaccinationen med Nimenrix eller ACWY-PS. Resultaten visas i tabell 11 (se avsnitt Varningar och försiktighet).
Tabell 11: rSBA- och hSBA-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos barn i åldern 2-10 år, varaktighet upp till 10 år, och efter påfyllnad administrerad 10 år efter initial vaccination (studie MenACWY-TT-027/032/100)
|
Meningo-kock grupp |
Vaccin- grupp |
Tidpunkt |
rSBA* |
hSBA** |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
|||
|
A |
Nimenrix |
Månad 1(1) |
225 |
100 %
|
7301
|
111(5) |
81,1 %
|
57,0
|
|
År 5(2) |
98 |
90,8 %
|
141
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
98 |
79,6 %
|
107
|
90 |
41,1 %
|
6,5
|
||
|
År 10(3)
|
73 |
89,0 %
|
96,3
|
62 |
33,9 % (22,3; 47,0) |
4,5 (3,3; 6,2) |
||
|
(Efter påfyllnad)(3,4) |
74 |
95,9 %
|
4626
|
73 |
100 %
|
1213
|
||
|
ACWY-PS-
|
Månad 1(1) |
75 |
100 %
|
2033
|
35(5) |
25,7 %
|
4,1
|
|
|
År 5(2) |
13 |
15,4 %
|
4,7
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
24 |
12,5 %
|
5,8
|
21 |
33,3 %
|
5,9
|
||
|
År 10(3)
|
17 |
23,5 %
|
8,0
|
17 |
29,4 % (10,3; 56,0) |
6,2 (2,4; 15,7) |
||
|
(Efter påfyllnad)(3,4) |
17 |
100 %
|
6414
|
17 |
100 %
|
211
|
||
|
C |
Nimenrix |
Månad 1(1) |
225 |
100 %
|
2435
|
107(5) |
89,7 %
|
155
|
|
År 5(2) |
98 |
90,8 %
|
79,7
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
98 |
82,7 %
|
193
|
97 |
93,8 %
|
427
|
||
|
År 10(3)
|
74 |
85,1 %
|
181
|
73 |
91,8 % (83,0; 96,9) |
222 (129; 380) |
||
|
(Efter påfyllnad)(3,4) |
74 |
100 %
|
4020
|
71 |
100 %
|
15544
|
||
|
ACWY-PS-
|
Månad 1(1) |
74 |
100 %
|
750
|
38(5) |
39,5 %
|
13,1
|
|
|
År 5(2) |
13 |
100 %
|
128
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
24 |
79,2 %
|
98,7
|
24 |
100 %
|
235
|
||
|
År 10(3) (Före påfyllnad) |
17 |
76,5 %
|
96,2
|
17 |
100 % (80,5; 100) |
99,1 (35,8; 274) |
||
|
(Efter påfyllnad)(3,4) |
17 |
100 %
|
15101 (7099; 32122) |
17 |
94,1 %
|
44794
|
||
|
W-135 |
Nimenrix |
Månad 1(1) |
225 |
100 %
|
11777
|
107(5) |
95,3 %
|
134
|
|
År 5(2) |
98 |
78,6 %
|
209
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
98 |
73,5 %
|
265
|
92 |
81,5 %
|
62,5
|
||
|
År 10(3)
|
74 |
68,9 %
|
206
|
59 |
61,0 % (47,4; 73,5) |
17,5 (10,5; 29,2) |
||
|
(Efter påfyllnad)(3,4) |
74 |
100 %
|
27944
|
74 |
100 %
|
6965
|
||
|
ACWY-PS-
|
Månad 1(1) |
75 |
100 %
|
2186
|
35(5) |
34,3 %
|
5,8
|
|
|
År 5(2) |
13 |
0 %
|
4,0
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
24 |
12,5 %
|
7,6
|
23 |
30,4 %
|
7,0
|
||
|
År 10(3)
|
17 |
23,5 %
|
15,4
|
15 |
26,7 % (7,8; 55,1) |
4,1 (2,0; 8,5) |
||
|
(Efter påfyllnad)(3,4) |
17 |
94,1 %
|
10463
|
15 |
100 %
|
200
|
||
|
Y |
Nimenrix |
Månad 1(1) |
225 |
100 %
|
6641
|
94(5) |
83,0 %
|
93,7
|
|
År 5(2) |
98 |
78,6 %
|
143
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
98 |
71,4 %
|
136
|
89 |
65,2 %
|
40,3
|
||
|
År 10(3)
|
74 |
67,6 % (55,7; 78,0) |
98,5 (54,3; 179) |
65 |
72,3 % (59,8; 82,7) |
35,7 (21,0; 60,6) |
||
|
(Efter påfyllnad)(3,4) |
74 |
100 %
|
7530
|
74 |
100 %
|
11127
|
||
|
ACWY-PS-
|
Månad 1(1) |
75 |
100 %
|
1410
|
32(5) |
43,8 %
|
12,5
|
|
|
År 5(2) |
13 |
7,7 %
|
5,5
|
n/a(6) |
-- |
-- |
||
|
År 6(3) |
24 |
20,8 %
|
11,6
|
24 |
25,0 %
|
7,3
|
||
|
År 10(3)
|
17 |
17,6 % (3,8; 43,4) |
10,2 (3,5; 30,2) |
14 |
35,7 % (12,8; 64,9) |
7,8 (2,5; 24,4) |
||
|
(Efter påfyllnad)(3,4) |
17 |
100 %
|
6959
|
17 |
100 %
|
454
|
||
Immunogenicitetsanalysen utfördes på ATP-kohorten för varje tidpunkt. Försökspersoner med suboptimal respons på meningokockgrupp C (definierat som SBA-titer under det fördefinierade analyströskelvärdet) skulle få en ytterligare dos MenC-vaccin före år 6. Dessa försökspersoner uteslöts ur analysen år 5 men inkluderades i analysen år 6 och 10.
(1) Studie MenACWY-TT-027
(2) Studie MenACWY-TT-032
(3) Studie MenACWY-TT-100
(4) Blodprovstagning 1 månad efter en påfyllnadsdos år 10.
(5) Inkluderar barn i åldern 6 till <11 år. hSBA-analys utfördes inte för barn i åldern 2 till <6 år (vid tidpunkten för vaccination).
(6) Enligt protokollet för studie MenACWY-TT-032 mättes inte hSBA för denna åldersgrupp vid år 5.
* rSBA-analys utförd vid GSK laboratorier för tidpunkten 1 månad efter primär vaccination och vid PHE laboratorier i Storbritannien för efterföljande tidpunkter för provtagning.
** hSBA-analys utförd vid GSK laboratorier och vid Neomed i Kanada för tidpunkterna i studie MenACWY-TT-100.
Immunogenicitet hos ungdomar i åldern 11‑17 år och vuxna i åldern ≥18 år
I två kliniska studier som utfördes bland ungdomar i åldern 11‑17 år (studie MenACWY-TT-036) och vuxna i åldern 18‑55 år (studie MenACWY-TT-035) gavs antingen en dos Nimenrix eller en dos av ACWY-PS-vaccinet.
Nimenrix var immunologiskt jämförbart (non-inferior) med ACWY-PS-vaccinet vad gäller vaccinrespons såsom visas i tabell 12.
Tabell 12: rSBA*-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos ungdomar i åldern 11‑17 år och vuxna i åldern 18-55 år (studie MenACWY-TT-035/036)
|
Meningo-kock grupp |
Vaccin- grupp |
Studie MenACWY-TT-036 (11-17 år)(1) |
Studie MenACWY-TT-035 (18-55 år)(1) |
||||
|
N |
VR (95 % CI) |
GMT (95 % CI) |
N |
VR (95 % CI) |
GMT (95 % CI) |
||
|
A |
Nimenrix |
553 |
85,4 % (82,1; 88,2) |
5928 (5557; 6324) |
743 |
80,1 % (77,0; 82,9) |
3625 (3372; 3897) |
|
ACWY-PS-vaccin |
191 |
77,5 % (70,9; 83,2) |
2947 (2612; 3326) |
252 |
69,8 % (63,8; 75,4) |
2127 (1909; 2370) |
|
|
C |
Nimenrix |
642 |
97,4 % (95,8; 98,5) |
13110 (11939; 14395) |
849 |
91,5 % (89,4; 93,3) |
8866 (8011; 9812) |
|
ACWY-PS-vaccin |
211 |
96,7 % (93,3; 98,7) |
8222 (6807; 9930) |
288 |
92,0 % (88,3; 94,9) |
7371 (6297; 8628) |
|
|
W-135 |
Nimenrix |
639 |
96,4 % (94,6; 97,7) |
8247 (7639; 8903) |
860 |
90,2 % (88,1; 92,1) |
5136 (4699; 5614) |
|
ACWY-PS-vaccin |
216 |
87,5 % (82,3; 91,6) |
2633 (2299; 3014) |
283 |
85,5 % (80,9; 89,4) |
2461 (2081; 2911) |
|
|
Y |
Nimenrix |
657 |
93,8 % (91,6; 95,5) |
14086 (13168; 15069) |
862 |
87,0 % (84,6; 89,2) |
7711 (7100; 8374) |
|
ACWY-PS-vaccin |
219 |
78,5 % (72,5; 83,8) |
5066 (4463; 5751) |
288 |
78,8 % (73,6; 83,4) |
4314 (3782; 4921) |
|
Immunogenicitetsanalysen utfördes på ATP-kohorterna.
(1) Blodprovstagning 1 månad efter vaccination
VR: vaccinrespons definierades som andel försökspersoner med:
-
rSBA-titrar ≥32 för initialt seronegativa försökspersoner (dvs rSBA-titer <8 före vaccination)
-
minst en 4-faldig ökning av rSBA-titrar efter jämfört med före vaccination för initialt seropositiva försökspersoner (dvs rSBA-titer ≥8 före vaccination)
* rSBA-analys utförd vid GSK laboratorier
rSBA-titrar fastställdes under en period på 10 år hos försökspersoner som initialt vaccinerats med en dos Nimenrix eller ACWY-PS vid 11 till 17 års ålder i studie MenACWY-TT-036. Varaktigheten av rSBA-titrar utvärderades i två förlängningsstudier: MenACWY-TT-043 (upp till 5 år) och MenACWY-TT-101 (upp till 10 år). Studie MenACWY-TT-101 utvärderade även responsen på en enstaka påfyllnadsdos av Nimenrix administrerad 10 år efter den initiala vaccinationen med Nimenrix eller ACWY-PS. Resultaten visas i tabell 13.
Tabell 13: rSBA*-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos ungdomar i åldern 11‑17 år, varaktighet upp till 10 år, och efter påfyllnad administrerad 10 år efter initial vaccination (studie MenACWY-TT-036/043/101)
|
Meningo-kock grupp |
Tidpunkt |
Nimenrix |
ACWY-PS-vaccin |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
||
|
A |
Månad 1(1) |
674 |
100 %
|
5929
|
224 |
99,6 %
|
2947 (2612; 3326) |
|
År 3(2) |
449 |
92,9 % (90,1; 95,1) |
448 (381; 527) |
150 |
82,7 % (75,6; 88,4) |
206 (147; 288) |
|
|
År 5(2) |
236 |
97,5 % (94,5; 99,1) |
644 (531; 781) |
86 |
93,0 % (85,4; 97,4) |
296 (202; 433) |
|
|
År 10(3)
|
162 |
85,2 % (78,8; 90,3) |
248 (181; 340) |
51 |
80,4 % (66,9; 90,2) |
143 (80,5; 253) |
|
|
(Efter påfyllnad)
|
162 |
100 %
|
3760
|
51 |
100 %
|
2956
|
|
|
C |
Månad 1(1) |
673 |
100 %
|
13110
|
224 |
100 %
|
8222
|
|
År 3(2) |
449 |
91,1 % (88,1; 93,6) |
371 (309; 446) |
150 |
86,0 % (79,4; 91,1) |
390 (262; 580) |
|
|
År 5(2) |
236 |
88,6 % (83,8; 92,3) |
249 (194; 318) |
85 |
87,1 % (78,0; 93,4) |
366 (224; 599) |
|
|
År 10(3)
|
162 |
90,1 % (84,5; 94,2) |
244 (182; 329) |
51 |
82,4 % (69,1; 91,6) |
177 (86,1; 365) |
|
|
(Efter påfyllnad)
|
162 |
100 %
|
8698
|
51 |
100 %
|
3879
|
|
|
W-135 |
Månad 1(1) |
678 |
99,9 %
|
8247
|
224 |
100 %
|
2633
|
|
År 3(2) |
449 |
82,0 % (78,1; 85,4) |
338 (268; 426) |
150 |
30,0 % (22,8; 38,0) |
16,0 (10,9; 23,6) |
|
|
År 5(2) |
236 |
86,0 % (80,9; 90,2) |
437 (324; 588) |
86 |
34,9 % (24,9; 45,9) |
19,7 (11,8; 32,9) |
|
|
År 10(3)
|
162 |
71,6 % (64,0; 78,4) |
146 (97,6; 217) |
51 |
43,1 % (29,3; 57,8) |
16,4 (9,2; 29,4) |
|
|
(Efter påfyllnad)
|
162 |
100 %
|
11243
|
51 |
100 %
|
3674
|
|
|
Y |
Månad 1(1) |
677 |
100 %
|
14087
|
224 |
100 %
|
5066
|
|
År 3(2) |
449 |
93,1 % (90,3; 95,3) |
740 (620; 884) |
150 |
58,0 % (49,7; 66,0) |
69,6 (44,6; 109) |
|
|
År 5(2) |
236 |
96,6 % (93,4; 98,5) |
1000 (824; 1214) |
86 |
66,3 % (55,3; 76,1) |
125 (71,2; 219) |
|
|
År 10(3)
|
162 |
90,7 % (85,2; 94,7) |
447 (333; 599) |
51 |
49,0 % (34,8; 63,4) |
32,9 (17,1; 63,3) |
|
|
(Efter påfyllnad)
|
162 |
100 %
|
7585
|
51 |
98,0 %
|
3296
|
|
Immunogenicitetsanalysen utfördes på ATP-kohorten för varje tidpunkt.
(1) Studie MenACWY-TT-036
(2) Studie MenACWY-TT-043
(3) Studie MenACWY-TT-101
(4) Blodprovstagning 1 månad efter en påfyllnadsdos år 10.
* rSBA-analys utförd vid GSK laboratorier för tidpunkten 1 månad efter primär vaccination och vid PHE laboratorier i Storbritannien för efterföljande tidpunkter för provtagning.
hSBA-varaktigheten utvärderades upp till 5 år efter vaccination hos ungdomar och vuxna som initialt vaccinerats i studie MenACWY-TT-052 såsom visas i tabell 14 (se avsnitt Varningar och försiktighet).
Tabell 14: hSBA*-titrar efter en enstaka dos Nimenrix hos ungdomar och vuxna i åldern 11‑25 år och varaktighet upp till 5 år efter vaccination (studie MenACWY-TT-052/059)
|
Meningokock grupp |
Tidpunkt |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
|
A |
Månad 1(1) |
356 |
82,0 % (77,6; 85,9) |
58,7 (48,6; 70,9) |
|
År 1(2) |
350 |
29,1 % (24,4; 34,2) |
5,4 (4,5; 6,4) |
|
|
År 5(2) |
141 |
48,9 % (40,4; 57,5) |
8,9 (6,8; 11,8) |
|
|
C |
Månad 1(1) |
359 |
96,1 % (93,5; 97,9) |
532 (424; 668) |
|
År 1(2) |
336 |
94,9 % (92,0; 97,0) |
172 (142; 207) |
|
|
År 5(2) |
140 |
92,9 % (87,3; 96,5) |
94,6 (65,9; 136) |
|
|
W-135 |
Månad 1(1) |
334 |
91,0 % (87,4; 93,9) |
117 (96,8; 141) |
|
År 1(2) |
327 |
98,5 % (96,5; 99,5) |
197 (173; 225) |
|
|
År 5(2) |
138 |
87,0 % (80,2; 92,1) |
103 (76,3; 140) |
|
|
Y |
Månad 1(1) |
364 |
95,1 % (92,3; 97,0) |
246 (208; 291) |
|
År 1(2) |
356 |
97,8 % (95,6; 99,0) |
272 (237; 311) |
|
|
År 5(2) |
142 |
94,4 % (89,2; 97,5) |
225 (174; 290) |
Immunogenicitetsanalysen utfördes på ATP-kohorten avseende varaktighet anpassat efter varje tidpunkt.
(1) Studie MenACWY-TT-052
(2) Studie MenACWY-TT-059
* hSBA-analys utförd vid GSK laboratorier
rSBA-titrar fastställdes under en period på 10 år hos försökspersoner som initialt vaccinerats med en dos Nimenrix eller ACWY-PS vid 11 till 55 års ålder i studie MenACWY-TT-015. Varaktigheten av rSBA-titrar utvärderades i två förlängningsstudier: MenACWY-TT-020 (upp till 5 år) och MenACWY-TT-099 (upp till 10 år). Studie MenACWY-TT-099 utvärderade även responsen på en enstaka påfyllnadsdos av Nimenrix administrerad 10 år efter den initiala vaccinationen med Nimenrix eller ACWY-PS. Resultaten visas i tabell 15.
Tabell 15: rSBA*-titrar efter en enstaka dos Nimenrix (eller ACWY-PS) hos ungdomar och vuxna i åldern 11-55 år, varaktighet upp till 10 år, och efter påfyllnad administrerad 10 år efter initial vaccination (studie MenACWY-TT-015/020/099)
|
Meningo-kock grupp |
Tidpunkt |
Nimenrix |
ACWY-PS-vaccin |
||||
|
N |
≥8 (95 % CI) |
GMT (95 % CI) |
N |
≥8 (95 % CI) |
GMT (95 % CI) |
||
|
A |
Månad 1(1) |
323 |
100 %
|
4945
|
112 |
100 %
|
2190
|
|
År 4(2) |
43 |
95,3 %
|
365
|
17 |
76,5 %
|
104
|
|
|
År 5(2) |
51 |
84,3 %
|
190
|
19 |
57,9 %
|
37,0
|
|
|
År 10(3)
|
155 |
78,1 %
|
154
|
52 |
71,2 %
|
75,1
|
|
|
(Efter påfyllnad)(3,4) |
155 |
100 %
|
4060
|
52 |
100 %
|
3585
|
|
|
C |
Månad 1(1) |
341 |
99,7 %
|
10074
|
114 |
100 %
|
6546
|
|
År 4(2) |
43 |
76,7 %
|
126
|
17 |
41,2 %
|
16,7
|
|
|
År 5(2) |
51 |
72,5 %
|
78,5
|
18 |
38,9 %
|
17,3
|
|
|
År 10(3)
|
154 |
90,9 %
|
193
|
52 |
88,5 %
|
212
|
|
|
(Efter påfyllnad)(3,4) |
155 |
100 %
|
13824
|
52 |
98,1 %
|
3444
|
|
|
W-135 |
Månad 1(1) |
340 |
99,7 %
|
8577
|
114 |
100 %
|
2970
|
|
År 4(2) |
43 |
90,7 %
|
240
|
17 |
17,6 %
|
8,3
|
|
|
År 5(2) |
51 |
86,3 %
|
282
|
19 |
31,6 %
|
15,4
|
|
|
År 10(3)
|
154 |
71,4 %
|
166
|
52 |
21,2 %
|
10,9
|
|
|
(Efter påfyllnad)(3,4) |
155 |
100 %
|
23431
|
52 |
98,1 %
|
5793
|
|
|
Y |
Månad 1(1) |
340 |
100 %
|
10315
|
114 |
100 %
|
4574
|
|
År 4(2) |
43 |
86,0 %
|
443
|
17 |
47,1 %
|
30,7
|
|
|
År 5(2) |
51 |
92,2 %
|
770
|
19 |
63,2 %
|
74,1
|
|
|
År 10(3)
|
154 |
86,4 %
|
364
|
52 |
61,5 %
|
56,0
|
|
|
(Efter påfyllnad)(3,4) |
155 |
100 %
|
8958
|
52 |
100 %
|
5138
|
|
Immunogenicitetsanalysen utfördes på ATP-kohorterna för tidpunkterna 1 månad och 5 år efter vaccination och ATP‑kohorten för en påfyllnadsdos.
(1) Studie MenACWY-TT-015
(2) Studie MenACWY-TT-020
(3) Studie MenACWY-TT-099
(4) Blodprovstagning 1 månad efter en påfyllnadsdos år 10.
* rSBA-analys utförd vid GSK laboratorier för tidpunkten 1 månad efter primär vaccination och vid PHE laboratorier i Storbritannien för efterföljande tidpunkter för provtagning.
I en separat studie (MenACWY-TT-085) administrerades Nimenrix som en engångsdos till 194 libanesiska vuxna 56 år och äldre (inkluderande 133 i åldern 56-65 år och 61 i åldern >65 år). Andelen försökspersoner med rSBA-titer (mätt på GSK laboratorier) ≥128 före vaccination varierade från 45 % (grupp C) till 62 % (grupp Y). Totalt sett varierade andelen vaccinerade med rSBA-titer ≥128 från 93 % (grupp C) till 97 % (grupp Y) 1 månad efter vaccination. I subgruppen med försökspersoner i åldern >65 år varierade andelen vaccinerade med rSBA-titer ≥128 från 90 % (grupp A) till 97 % (grupp Y) 1 månad efter vaccination.
Respons på påfyllnadsdos hos personer som tidigare vaccinerats med ett konjugerat meningokockvaccin mot Neisseria meningitidis
Påfyllnadsvaccination med Nimenrix hos personer som tidigare primärvaccinerats med ett monovalent (MenC-CRM) eller fyrvalent konjugerat meningokockvaccin (MenACWY-TT) studerades hos patienter från 12 månaders ålder. Robusta anamnestiska responser på antigenet/antigenerna i primärvaccinet observerades (se tabell 6, 7, 11, 13 och 15).
Respons på Nimenrix hos personer som tidigare vaccinerats med ett rent polysackaridvaccin mot Neisseria meningitidis
I studie MenACWY-TT-021 som genomförts på försökspersoner i åldern 4,5‑34 år, jämfördes immunogeniciteten för Nimenrix administrerat 30‑42 månader efter vaccination med ett ACWY-PS-vaccin med immunogeniciteten för Nimenrix administrerat till åldersmatchade försökspersoner som inte hade vaccinerats med något meningokockvaccin under de senaste 10 åren. En immunrespons (rSBA-titer ≥8) sågs för samtliga fyra meningokockgrupper och försökspersoner oavsett tidigare vaccination mot meningokocker. Det rSBA GMT var signifikant lägre hos de försökspersoner som hade fått en dos av ACWY-PS-vaccin 30-42 månader före Nimenrix, men 100% av försökspersonerna uppnådde rSBA-titrar ≥8 för alla fyra meningokockgrupper (A, C, W-135 , Y) (se avsnitt Varningar och försiktighet).
Barn (2–17 år) med anatomisk eller funktionell aspleni
I studie MenACWY-TT-084 jämfördes immunresponsen på två doser Nimenrix som gavs med 2 månaders mellanrum till 43 studiedeltagare i åldern 2–17 år med anatomisk eller funktionell aspleni och 43 åldersmatchade deltagare med normal mjältfunktion. En månad efter den första vaccindosen och 1 månad efter den andra dosen hade ungefär samma andel av deltagarna i de två grupperna rSBA‑titrar på ≥8 och ≥128 och hSBA-titrar på ≥4 och ≥8.
Effekt av en engångsdos av Nimenrix
Under 2018 lade Nederländerna till Nimenrix i sitt nationella vaccinationsprogram som engångsdos för småbarn vid 14 månaders ålder för att ersätta konjugatvaccinet mot grupp C-meningokocker. Även en uppföljningskampanj med en engångsdos av Nimenrix för ungdomar i åldern 14–18 år inleddes under 2018, vilken blev standard under 2020 och ledde till ett nationellt vaccinationsprogram för småbarn och ungdomar. Incidensen av meningokocksjukdom som orsakas av grupperna C, W och Y minskade signifikant inom två år med 100 % (95 % CI: 14, 100) hos personer i åldern 14–18 år, 85 % (95 % CI: 32, 97) inom alla åldrar som ingick i vaccinationskohorten (direkt effekt) och 50 % (95 % CI: 28, 65) inom åldrar som inte ingick i vaccinationskohorten (indirekt effekt). Effekten av Nimenrix var primärt en minskning av grupp W-sjukdom.
Farmakokinetik
Ej relevant.
Prekliniska uppgifter
Gängse studier avseende lokal tolerans, akut- och allmän toxicitet, reproduktionseffekter, effekter på utveckling och fertilitet visade inte några särskilda risker för människa.
Innehåll
Kvalitativ och kvantitativ sammansättning
Efter beredning innehåller 1 dos (0,5 ml):
|
Neisseria meningitidis grupp A polysackarid1 |
5 mikrogram |
|
Neisseria meningitidis grupp C polysackarid1 |
5 mikrogram |
|
Neisseria meningitidis grupp W-135 polysackarid1 |
5 mikrogram |
|
Neisseria meningitidis grupp Y polysackarid1 |
5 mikrogram |
|
1konjugerat till bärarprotein av tetanustoxoid |
44 mikrogram |
Förteckning över hjälpämnen
Pulver:
Sackaros
Trometamol
Spädningsvätska:
Natriumklorid
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Miljöpåverkan
Neisseria meningitidis, serogrupp A, polysackarider
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Neisseria meningitidis, serogrupp C, polysackarider
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Neisseria meningitidis, serogrupp W-135, polysackarider
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Neisseria meningitidis, serogrupp Y, polysackarider
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
4 år
Efter beredning:
Vaccinet ska användas omedelbart efter beredning. Även om väntan inte rekommenderas har stabilitet efter beredning visats i 8 timmar vid 30 °C. Om användning inte sker inom 8 timmar ska vaccinet inte administreras.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C–8 °C).
Får inte frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Särskilda anvisningar för destruktion och övrig hantering
Anvisningar för beredning av vaccinet med spädningsvätska i förfylld spruta
Nimenrix bereds genom att all spädningsvätska i den förfyllda sprutan överförs till injektionsflaskan med pulver.
Nedanstående bild visar hur nålen fästs på sprutan. Den spruta som medföljer Nimenrix kan dock skilja sig något (utan skruvgäng) från den spruta som ses på bilden. I så fall ska nålen fästas utan att skruvas.
|
1. |
Håll sprutcylindern med en hand (undvik att hålla i sprutans kolvstång), skruva av skyddslocket genom att vrida det moturs | 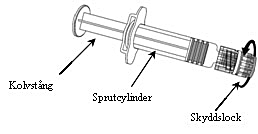
|
|
2. |
Fäst nålen på sprutan genom att skruva nålen medurs tills den låses fast (se bild). | 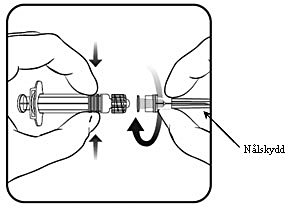
|
|
3. |
Ta bort nålskyddet som ibland kan sitta hårt. |
|
|
4. |
Tillsätt spädningsvätskan till pulvret. Skaka därefter blandningen väl tills pulvret är helt upplöst i spädningsvätskan. |
|
Det färdigberedda vaccinet är en klar, färglös lösning.
Det färdigberedda vaccinet skall inspekteras visuellt med avseende på främmande partiklar och/eller fysikaliska förändringar före administrering. Om något av detta iakttas ska vaccinet kasseras.
Vaccinet ska användas omedelbart efter beredning.
En ny nål ska användas för administrering av vaccinet.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Pulver och vätska till injektionsvätska, lösning.
Pulvret eller kakan är vit.
Spädningsvätskan är en färglös, klar vätska.





