Indikationer
Behandling och profylax av blödning hos patienter med hemofili A (medfödd brist på faktor VIII). ADVATE är indikerat för samtliga åldersgrupper.
Kontraindikationer
Överkänslighet mot det aktiva innehållsämnet eller mot något hjälpämne som anges i avsnitt Innehåll eller mot mus- eller hamsterproteiner.
Dosering
Behandling bör påbörjas i samråd med en läkare med erfarenhet av hemofilibehandling. Utrustning för återupplivning ska finnas omedelbart tillgänglig i händelse av anafylaxi.
Dosering
Dosen och substitutionsterapins längd beror på svårighetsgraden av faktor VIII-bristen, blödningens lokalisering och utbredning samt på patientens kliniska tillstånd.
Antalet enheter faktor VIII uttrycks i internationella enheter (IE), vilka relateras till WHO-standarden för faktor VIII-produkter. Faktor VIII-aktiviteten i plasma uttrycks antingen som en procentandel (relaterat till normal human plasma) eller i IE (relaterat till den internationella standarden för faktor VIII i plasma).
En internationell enhet (IE) faktor VIII-aktivitet motsvarar mängden faktor VIII i en ml normal humanplasma.
Behandling vid behov
Beräkningen av erforderlig dos faktor VIII baseras på den empiriska upptäckten att 1 IE faktor VIII per kg kroppsvikt ökar aktiviteten av faktor VIII i plasma med 2 IE/dl. Följande formel kan användas för att beräkna erforderlig dos:
Erforderlig dos (IE) = kroppsvikt (kg) x önskad ökning av faktor VIII (%) x 0,5
I händelse av följande hemorragiska händelser bör faktor VIII-aktiviteten inte understiga den givna plasmaaktivitetsnivån (i % av normal eller IE/dl) under motsvarande period. Följande tabell 1 kan användas som vägledning vid blödningsepisoder och kirurgiska ingrepp:
|
Tabell 1 Doseringsvägledning vid blödningsepisoder och kirurgiska ingrepp |
||
|
Grad av blödning / typ av kirurgiskt ingrepp |
Erforderlig faktor VIII-nivå
|
Dosintervall (timmar) /behandlingens längd (dagar) |
|---|---|---|
|
Blödning Tidig hemartros, muskelblödning eller munblödning. |
20 - 40 |
Upprepa injektionen var 12-24 timme (8-24 timme för patienter yngre än 6 år) under minst 1 dag tills blödningsepisoden (upplevd smärta) upphört eller läkning har uppnåtts. |
|
Mer omfattande hemartros, muskelblödning eller hematom. |
30 - 60 |
Upprepa injektionen var 12-24 timme (8-24 timme för patienter yngre än 6 år) i 3-4 dagar eller längre tills smärtlindring och den akuta rörelsebegränsningen hävts. |
|
Livshotande blödningar. |
60 - 100 |
Upprepa injektionen var 8-24 timme (6-12 timme för patienter yngre än 6 år) tills det kritiska tillståndet är övervunnet. |
|
Kirurgi Mindre Inklusive tandutdragning. |
30 - 60 |
Var 24 timme (12-24 timme för patienter yngre än 6 år) under minst 1 dag, tills läkning uppnåtts. |
|
Större |
80 - 100 (pre- och postoperativt) |
Upprepa injektionen var 8-24 timme (6‑24 timme för patienter yngre än 6 år) tills sårläkning inträtt, fortsätt därefter behandlingen i ytterligare minst 7 dagar för att upprätthålla en faktor VIII-aktivitet på 30 - 60 % (IE/dl). |
Dos och intervall av administreringen bör anpassas till den kliniska effekten i det enskilda fallet. Under särskilda omständigheter (t.ex. vid förekomst av inhibitor i låg titer) kan större mängder än de beräknade enligt formeln behövas.
Under pågående behandling rekommenderas bestämningar av faktor VIII-nivåer i plasma för att ge vägledning om erforderlig dos och frekvens av upprepade injektioner. Noggrann kontroll av substitutionsbehandlingen med analys av faktor VIII-aktivitet i plasma är nödvändig i händelse av större kirurgiska ingrepp. Enskilda patienter kan svara olika på behandling med faktor VIII, uppnå olika nivåer av in vivo-recovery och uppvisa olika halveringstider.
Profylax
För långtidsprofylax mot blödningar hos patienter med svår hemofili A är de vanliga doserna 20-40 IE faktor VIII per kg kroppsvikt i dosintervall på 2-3 dagar.
Pediatrisk population
Doseringen för användning vid behov är densamma för pediatriska patienter (0 till 18 år) som för vuxna patienter. För patienter under 6 år rekommenderas doser på 20 till 50 IE faktor VIII per kg kroppsvikt 3 till 4 gånger per vecka för profylaxbehandling.
Administreringssätt
ADVATE skall administreras intravenöst. Om administrering sker av annan än sjukvårdspersonal krävs nödvändig träning.
Administreringshastigheten bör bestämmas med hänsyn till patientens tillstånd, maximalt 10 ml/min.
Efter beredning är lösningen klar, färglös och fri från främmande partiklar och har ett pH värde på 6,7 till 7,3.
För anvisningar om beredning av läkemedlet före administrering, se respektive SPC.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet
Överkänslighetsreaktioner av allergityp, inklusive anafylaxi, har rapporterats med ADVATE. Produkten innehåller spår av mus- och hamsterproteiner. Om symptom på överkänslighet uppträder bör patienterna tillrådas att avbryta behandlingen omedelbart och kontakta läkare. Patienterna ska informeras om de tidiga tecknen på överkänslighet, däribland utslag, generaliserad urtikaria, trånghetskänsla i bröstet, väsande andning, hypotoni och anafylax.
I händelse av chock ska medicinsk standardbehandling för chock tillämpas.
Vid överkänslighetsreaktioner finns det mindre tid att reagera på genom att stoppa injektionen på grund av den minskade injektionsvolymen för ADVATE rekonstituerat i 2 ml sterilt vatten för injektionsvätskor. Därför rekommenderas försiktighet vid injektion av ADVATE rekonstituerat i 2 ml sterilt vatten för injektionsvätskor, speciellt för barn.
Inhibitorer
Utveckling av neutraliserande antikroppar (inhibitorer) mot faktor VIII är en känd komplikation vid behandling av patienter med hemofili A. Dessa inhibitorer är vanligtvis IgG-immunoglobuliner riktade mot den prokoagulerande effekten hos faktor VIII, och kvantifieras i Bethesda-enheter (BE) per ml plasma med den modifierade metoden. Risken att utveckla inhibitorer är relaterad till sjukdomens allvarlighetsgrad samt exponering för faktor VIII, där risken är störst inom de 20 första exponeringsdagarna. I sällsynta fall kan inhibitorer utvecklas efter mer än 100 exponeringsdagar.
Fall av återkommande inhibitorer (låg titer) har observerats efter byte från en faktor VIII produkt till en annan hos tidigare behandlade patienter med mer än 100 exponeringsdagar och med inhibitorutveckling i anamnesen. Därför rekommenderas att alla patienter noga övervakas med avseende på förekomst av inhibitorer när man byter till en annan produkt.
Hur kliniskt relevant utvecklingen av inhibitorer är beror på inhibitorns titer, där låg titer, som förekommer övergående eller är konsekvent låg, utgör en lägre risk för otillräckligt kliniskt svar än hög titer.
I allmänhet bör alla patienter som behandlas med koagulationsfaktor VIII-produkter följas noggrant med avseende på utveckling av inhibitorer genom lämpliga kliniska observationer och laboratorietester. Om förväntade faktor VIII-nivåer i plasma inte uppnås, eller om blödningar inte kontrolleras trots adekvat dos, bör test för faktor VIII-inhibitorer utföras. Hos patienter med höga halter av inhibitorer är faktor VIII-behandlingen eventuellt inte effektiv och andra behandlingsalternativ bör därför övervägas. Behandling av sådana patienter ska ske under överinseende av läkare med erfarenhet av hemofili och faktor VIII-inhibitorer.
Felaktig administrering av ADVATE
För ADVATE rekonstituerat i 2 ml sterilt vatten för injektionsvätskor kan felaktig administrering (intra‑arteriellt eller paravenöst) leda till milda, kortvariga reaktioner på injektionsstället, exempelvis blåmärken och erytem.
Kateterrelaterade komplikationer under behandlingen
Om en anordning för central venåtkomst krävs bör hänsyn tas till risken för komplikationer i relation till denna, inklusive lokala infektioner, bakteremi och trombos vid kateterstället.
Om hjälpämnen
Natrium
Detta läkemedel innehåller 10 mg natrium per injektionsflaska, motsvarande 0,5 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
Det är starkt rekommenderat att notera namn och batchnummer på produkten varje gång ADVATE administreras till en patient, för att bibehålla en koppling mellan patienten och läkemedelsbatchen.
Pediatrisk population
Informationen om varningar och försiktighet gäller både vuxna och barn.
Interaktioner
Inga interaktionsstudier har utförts med ADVATE.
Graviditet
Inga reproduktionsstudier på djur har gjorts med faktor VIII. Då hemofili A är mycket sällsynt förekommande hos kvinnor finns ingen erfarenhet av användning av faktor VIII under graviditet och amning. Därför ska faktor VIII användas under graviditet och amning endast då ett uttalat behov föreligger.
Amning
Inga reproduktionsstudier på djur har gjorts med faktor VIII. Då hemofili A är mycket sällsynt förekommande hos kvinnor finns ingen erfarenhet av användning av faktor VIII under amning. Därför ska faktor VIII användas under amning endast då ett uttalat behov föreligger.
Trafik
ADVATE har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Under kliniska studier med ADVATE som omfattade 418 patienter som exponerades för ADVATE minst en gång rapporterades totalt 93 biverkningar. De biverkningar som hade högst frekvens var utveckling av neutraliserande antikroppar mot faktor VIII (inhibitorer), huvudvärk och feber.
Överkänslighetsreaktioner eller allergiska reaktioner (som kan innefatta angioödem, brännande och stickande känsla vid infusionsstället, frossa, värmevallningar, generaliserad urtikaria, huvudvärk, utslag, hypotoni, letargi, illamående, rastlöshet, takykardi, trånghetskänsla i bröstet, pirrningar, kräkningar, väsande andning) har observerats mer sällan och kan i vissa fall utvecklas till allvarlig anafylax (inklusive chock).
Utveckling av antikroppar mot mus- och/eller hamsterprotein med relaterade överkänslighetsreaktioner kan observeras.
Neutraliserande antikroppar (inhibitorer) kan utvecklas hos patienter med hemofili A som behandlas med faktor VIII, inklusive ADVATE. Om sådana inhibitorer utvecklas visar sig detta som ett tillstånd med otillräckligt kliniskt svar. Om detta inträffar är rekommendationen att kontakta ett specialistcenter för hemofili.
Tabellöversikt över biverkningar
Tabell 2 nedan visar frekvensen av biverkningar i kliniska prövningar och enligt spontana rapporter. Tabellen är i enlighet med MedDRA:s organsystem (SOC och ”Preferred Term”).
Frekvensen definieras enligt följande konvention: mycket vanliga (≥ 1/10 ), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, <1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
Tabell 2 Frekvens av biverkningar i kliniska prövningar och enligt spontana rapporter |
||
|
MedDRA-klassificering av organsystem |
Biverkning |
Frekvensa |
|
Infektioner och infestationer |
Influensa |
Mindre vanliga |
|
Laryngit |
Mindre vanliga |
|
|
Blodet och lymfsystemet |
Inhiberande FVIII-antikroppar |
Mindre vanliga (PTP)d Mycket vanliga (PUP)d |
|
Lymfangit |
Mindre vanliga |
|
|
Immunsystemet |
Anafylaktisk reaktion |
Ingen känd frekvens |
|
Överkänslighetc |
Ingen känd frekvens |
|
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanliga |
|
Yrsel |
Mindre vanliga |
|
|
Minnessvårigheter |
Mindre vanliga |
|
|
Synkope |
Mindre vanliga |
|
|
Darrningar |
Mindre vanliga |
|
|
Migrän |
Mindre vanliga |
|
|
Förändrad smakupplevelse |
Mindre vanliga |
|
|
Ögon |
Ögoninflammation |
Mindre vanliga |
|
Hjärtat |
Palpitationer |
Mindre vanliga |
|
Blodkärl |
Hematom |
Mindre vanliga |
|
Blodvallningar |
Mindre vanliga |
|
|
Blekhet |
Mindre vanliga |
|
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné |
Mindre vanliga |
|
Magtarmkanalen |
Diarré |
Mindre vanliga |
|
Smärta i övre delen av buken |
Mindre vanliga |
|
|
Illamående |
Mindre vanliga |
|
|
Kräkningar |
Mindre vanliga |
|
|
Hud och subkutan vävnad |
Pruritus |
Mindre vanliga |
|
Eksem |
Mindre vanliga |
|
|
Hyperhidros |
Mindre vanliga |
|
|
Urtikaria |
Mindre vanliga |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Feber |
Vanliga |
|
Perifert ödem |
Mindre vanliga |
|
|
Bröstsmärta |
Mindre vanliga |
|
|
Obehag i bröstet |
Mindre vanliga |
|
|
Frossa |
Mindre vanliga |
|
|
Känna sig underlig |
Mindre vanliga |
|
|
Hematom vid kärlpunktionsstället |
Mindre vanliga |
|
|
Trötthet |
Ingen känd frekvens |
|
|
Reaktion vid injektionsstället |
Ingen känd frekvens |
|
|
Sjukdomskänsla |
Ingen känd frekvens |
|
|
Undersökningar |
Ökat antal monocyter |
Mindre vanliga |
|
Koagulationsfaktor VIII-nivån sänktb |
Mindre vanliga |
|
|
Minskad hematokrit |
Mindre vanliga |
|
|
Onormalt laboratorietest |
Mindre vanliga |
|
|
Skador och förgiftningar och behandlingskomplikationer |
Komplikationer efter behandling |
Mindre vanliga |
|
Blödning efter behandling |
Mindre vanliga |
|
|
Reaktion vid behandlingsstället vid behandling |
Mindre vanliga |
|
-
Beräknat utifrån det totala antalet patienter som fick ADVATE (418).
-
Den oväntade minskningen i koagulationsfaktor VIII-nivåer inträffade hos en patient under kontinuerlig infusion av ADVATE efter operation (postoperativt dag 10- 14). Hemostas upprätthölls konstant under denna period och både faktor VIII-nivåer i plasma och nedbrytningshastighet återgick till lämpliga nivåer vid dag 15 efter operationen. Faktor VIII inhibitor-tester som utförts efter avslutningen av den kontinuerliga infusionen och vid avslutandet av studien var negativa.
-
Biverkningarna förklaras i avsnittet nedan.
-
Frekvensen baseras på studier med alla FVIII-produkter, vilka inkluderade patienter med svår hemofili A. PTP = previously treated patients = patienter som har behandlats tidigare, PUP = previously untreated patients = patienter som inte har behandlats tidigare
Beskrivning av valda biverkningar
Biverkningar som är relaterade till rester från tillverkningsprocessen
Av de 229 patienter som undersöktes för antikroppar mot protein från kinesiska hamsteräggceller (CHO-celler) visade 3 en statistiskt signifikant uppåtgående trend av titrar, 4 visade bestående eller kortvariga toppar och en patient hade både och men inga kliniska symptom. Av de 229 behandlade patienter som undersöktes för antikroppar mot murin IgG visade 10 en statistiskt uppåtgående trend, 2 visade en bestående eller kortvarig topp och en patient hade både och. Fyra av dessa patienter rapporterade enstaka fall av urtikaria, pruritus, eksem och något förhöjda eosinofilnivåer bland upprepade exponeringar för produkten som studerats.
Överkänslighet
Överkänslighetsreaktioner av allergityp, inklusive anafylaxi, har yttrat sig genom yrsel, parestesi, utslag, rodnad, svullnad i ansiktet, urtikaria och pruritus.
Pediatrisk population
Utöver utveckling av inhibitorer hos tidigare obehandlade pediatriska patienter (PUP) och kateterrelaterade komplikationer har inga åldersspecifika skillnader i biverkningar observerats under de kliniska studierna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Inga fall av överdosering med rekombinant koagulationsfaktor VIII har rapporterats.
Farmakodynamik
Faktor VIII / von Willebrand-faktorkomplexet består av två molekyler (faktor VIII och von Willebrand-faktor) med olika fysiologiska funktioner. ADVATE innehåller rekombinant koagulationsfaktor VIII (octocog alfa), ett glykoprotein som är biologiskt ekvivalent med det faktor VIII glykoprotein som finns i human plasma.
Octocog alfa är ett glykoprotein bestående av 2332 aminosyror med en ungefärlig molekylvikt på 280 kD. Vid infusion till en hemofilipatient binds octocog alfa till endogen von Willebrand-faktor i patientens cirkulationssystem. Aktiverad faktor VIII fungerar som en co-faktor för aktiverad faktor IX, vilken påskyndar omvandlingen av faktor X till aktiverad faktor X. Aktiverad faktor X omvandlar protrombin till trombin. Trombin i sin tur omvandlar fibrinogen till fibrin och ett koagel kan bildas. Hemofili A är en könsbunden ärftlig koagulationsstörning orsakad av sänkta nivåer av faktor VIII-aktivitet och resulterar i blödningar i leder, muskler eller inre organ, antingen spontant eller till följd av oavsiktligt eller kirurgiskt trauma. Plasmanivåerna av faktor VIII kan höjas genom substitutionsterapi och därmed ge en tillfällig korrigering av faktor VIII-bristen och blödningstendensen.
Uppgifter om Immune Tolerance Induction (ITI) hos patienter med inhibitorer har samlats in. Inom en understudie till PUP-studie 060103 dokumenterades ITI-behandlingar hos 11 PUP. Retrospektiva genomgångar av journalerna har genomförts för 30 pediatriska försökspersoner som fick ITI (i studie 060703). En icke-interventionell prospektiv registrering (PASS-INT-004) dokumenterade ITI hos 44 pediatriska och vuxna försökspersoner av vilka 36 slutförde ITI-behandlingen. Uppgifter visar att immuntolerans kan uppnås.
I studien 060201 jämfördes två profylaktiska långtidsbehandlingsplaner hos 53 tidigare behandlade patienter: en individualiserad farmakokinetiskt styrd dosregimen (inom ett intervall mellan 20 och 80 IE faktor VIII per kg kroppsvikt i intervall på 72 ± 6 timmar, n=23) och en profylaktisk standarddosregimen (20 till 40 IE/kg var 48:e timme ± 6 timmar, n=30). Den farmakokinetiskt styrda dosregimen (enligt en specifik formel) var inriktad på att upprätthålla en lägsta nivå av faktor VIII på ≥ 1 % under interdosintervallet på 72 timmar. Data från denna studie visar att dessa två profylaktiska dosregimen är jämförbara när det gäller minskning av blödningsfrekvensen.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för ADVATE för alla grupper av den pediatriska populationen för hemofili A (medfödd brist på faktor VIII) för ”immuntoleransinduktion (ITI) hos patienter med hemofili A (medfödd brist på faktor VIII) som har utvecklat inhibitorer mot faktor VIII” och ”behandling och profylax mot blödning hos patienter med hemofili A (medfödd brist på faktor VIII)” (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Alla farmakokinetiska studier med ADVATE utfördes på tidigare behandlade patienter med svår till medelsvår hemofili A (baseline faktor VIII ≤ 2%). Analyserna av plasmaproverna utfördes i ett laboratorium med enstegs koagulationstest.
Totalt 195 försökspersoner med svår hemofili A (baseline faktor VIII < 1 %) tillhandahöll farmakokinetiska parametrar som inkluderades i den farmakokinetiska analysuppsättningen enligt protokoll. Kategorierna för dessa analyser för spädbarn (1 månad till <2 år), barn (2 till <5 år), äldre barn (5 till <12 år), ungdomar (12 till <18 år) och vuxna (18 år och äldre) användes för att sammanställa de farmakokinetiska parametrarna där åldern definierades som åldern vid tidpunkten för PK-infusionen.
|
Tabell 3 Sammanställning av farmakokinetiska parametrar för ADVATE per åldersgrupp med svår hemofili A (baseline faktor VIII < 1 %) |
|||||
|---|---|---|---|---|---|
|
Parameter (medelvärde ± standardavvikelse) |
Spädbarn (n=5) |
Barn (n=30) |
Äldre barn (n=18) |
Ungdomar (n=33) |
Vuxna (n=109) |
|
Total AUC (IE·h/dl) |
1362,1±311,8 |
1180,0±432,7 |
1506,6±530,0 |
1317,1±438,6 |
1538,5±519,1 |
|
Adjusted incremental recovery vid Cmax (IE/dl per IE/kg)a |
2,2±0,6 |
1,8±0,4 |
2,0±0,5 |
2,1±0,6 |
2,2±0,6 |
|
Halveringstid (h) |
9,0±1,5 |
9,6±1,7 |
11,8±3,8 |
12,1±3,2 |
12,9±4,3 |
|
Maximal plasmakoncentration efter infusion (IE/dl) |
110,5±30,2 |
90,8±19,1 |
100,5±25,6 |
107,6±27,6 |
111,3±27,1 |
|
MRT (h) |
11,0±2,8 |
12,0±2,7 |
15,1±4,7 |
15,0±5,0 |
16,2±6,1 |
|
Distributionsvolym vid steady state (dl/kg) |
0,4±0,1 |
0,5±0,1 |
0,5±0,2 |
0,6±0,2 |
0,5±0,2 |
|
Clearance (ml/kg·h) |
3,9±0,9 |
4,8±1,5 |
3,8±1,5 |
4,1±1,0 |
3,6±1,2 |
a Beräknad som (Cmax – baseline faktor VIII) delat på dosen IE/kg, där Cmax är den högsta mätningen av faktor VIII.
Säkerheten och den hemostatiska effekten för ADVATE för den pediatriska populationen liknar den hos vuxna patienter. Adjusted recovery och terminal halveringstid (t½) var ca 20% lägre hos småbarn (under 6-års ålder) än hos vuxna, vilket delvis kan bero på den kända större plasmavolymen per kg kroppsvikt hos yngre patienter.
Farmakokinetiska data för ADVATE på tidigare obehandlade patienter finns för tillfället inte tillgängliga.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, akut toxicitet, upprepad dos toxicitet, lokal toxicitet och gentoxicitet visade inte några särskilda risker för människa.
Advate 250 IE 2 ml / 500 IE 2 ml / 1000 IE 2 ml / 1500 IE 2 ml: En lokal toleransstudie på kaniner visade att ADVATE rekonstituerat med 2 ml sterilt vatten för injektionsvätskor tolereras väl efter intravenös administration. En lätt övergående rodnad på administreringsstället observerades efter intraarteriell applikation samt efter paravenös administration. Inga korrelerade negativa histopatologiska förändringar kunde emellertid observeras, vilket tyder på att detta fynd är övergående till sin natur.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje injektionsflaska innehåller nominellt 250, 500, 1000, 1500, 2000 resp. 3000 IE human koagulationsfaktor VIII (rDNA), octocog alfa. Efter beredning innehåller ADVATE omkring 50 (250 IE, 5 ml), 100 (500 IE, 5 ml), 125 (250 IE, 2 ml), 200 (1000 IE, 5 ml), 250 (500 IE, 2 ml), 300 (1500 IE, 5 ml), 400 (2000 IE, 5 ml), 500 (1000 IE, 2 ml) 600 (3000 IE 5 ml, och 750 (1500 IE, 2 ml) IE human koagulationsfaktor VIII (rDNA), octocog alfa, per ml.
Aktiviteten (IE) bestäms med Europeiska farmakopéns kromogent substratmetod. Den specifika aktiviteten hos ADVATE är cirka 4 520 ‑ 11 300 IE/mg protein.
Octocog alfa (human koagulationsfaktor VIII (rDNA)) är ett renat protein som består av 2332 aminosyror. Det är tillverkat med rekombinant DNA teknologi i ovarieceller från kinesisk hamster (CHO-celler). Tillverkad utan tillsats av några (exogena) human-eller animalderiverade proteiner i cellodlingsprocessen, reningen och den slutliga formuleringen.
Hjälpämnen med känd effekt:
Detta läkemedel innehåller 0,45 mmol natrium (10 mg) per injektionsflaska
Förteckning över hjälpämnen
Pulver
Mannitol
Natriumklorid
Histidin
Trehalos
Kalciumklorid
Trometamol
Polysorbat 80
Glutation (reducerat)
Lösningsmedel
Sterilt vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas skall detta läkemedel inte blandas med andra läkemedel eller lösningsmedel.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år.
Efter beredning bör produkten, ur mikrobiologisk synvinkel, användas omedelbart.
Kemisk och fysikalisk stabilitet vid användning har påvisats för 3 timmar vid 25°C.
Under hållbarhetstiden kan produkten förvaras i rumstemperatur (vid högst 25 °C) i upp till 6 månader. Den sista dagen i 6 månadersperioden för förvaring i rumstemperatur ska noteras på ytterkartongen. Läkemedlet får inte sättas tillbaka i kylskåp igen.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C – 8°C). Får ej frysas.
ADVATE med BAXJECT II: Förvara produkten i ytterkartongen. Ljuskänsligt.
ADVATE i BAXJECT III: Förvara det förslutna blistret i ytterkartongen. Ljuskänsligt.
För förvaringsanvisningar efter beredning, se avsnitt Hållbarhet.
Särskilda anvisningar för destruktion och övrig hantering
ADVATE skall administreras intravenöst efter beredning av produkten.
Efter beredning ska lösningen inspekteras visuellt med avseende på främmande partiklar och/eller missfärgning.
Efter beredning ska lösningen vara klar, färglös och fri från främmande partiklar.
Lösning som är grumlig eller innehåller avlagringar ska inte användas.
-
För beredning behövs en spruta med luer-lock.
-
Används inom tre timmar efter beredning.
-
Får ej ställas i kylskåp efter beredning.
-
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Beredning med BAXJECT II
-
Vid beredning använd endast vatten för injektionsvätskor och beredningshjälpmedlet som tillhandahålls i förpackningen.
-
Använd inte BAXJECT II om sterilskydd eller förpackning är skadad eller visar något tecken på åverkan.
-
Aseptisk teknik ska användas:
-
Om produkten fortfarande förvaras i kylskåp: ta ut både injektionsflaskorna med ADVATE pulver och vätska ur kylskåpet och låt dem uppnå rumstemperatur (mellan 15°C och 25°C).
-
Tvätta händerna noggrant med tvål och varmt vatten.
-
Ta bort hättorna från injektionsflaskorna med pulver och vätska.
-
Rengör propparna med injektionstorkar. Ställ flaskorna på en plan, ren yta.
-
Öppna förpackningen på BAXJECT II genom att dra av papperslocket utan att vidröra insidan (Fig. a). Tag inte ut BAXJECT II ur förpackningen. Använd inte BAXJECT II om sterilskydd eller förpackning är skadad eller visar något tecken på åverkan.
-
Vänd på förpackningen och tryck den genomskinliga plastspetsen genom vattenflaskans gummipropp. Ta tag i förpackningens kanter och dra bort förpackningen från BAXJECT II (Fig. b). Avlägsna inte den blå hättan från BAXJECT II.
-
Endast det steriliserade vatten för injektionsvätskor och det beredningshjälpmedel som bifogas i förpackningen skall användas vid beredning. Vänd på hela systemet med BAXJECT II fastsatt vid vattenflaskan så att vattenflaskan hamnar överst. Tryck den vita plastspetsen genom ADVATE-pulverflaskans gummipropp. Vattnet kommer att sugas in i ADVATE-pulverflaskan genom vakuum (Fig. c).
-
Rotera flaskan försiktigt tills allt pulver är upplöst. Se till att ADVATE-pulvret är fullständigt upplöst, annars kan inte all färdigberedd lösning passera igenom filtret. Produkten löses upp snabbt (vanligtvis på mindre än 1 minut). Efter beredning skall lösningen vara klar, färglös och fri från främmande partiklar.
Beredning med BAXJECT III
-
Använd inte om inte locket på blistret är helt förslutet
-
Om produkten fortfarande förvaras i kylskåp: ta det förslutna blistret (som innehåller injektionsflaskor med pulver och vätska ihopsatta med beredningssystemet) ur kylskåpet och låt det uppnå rumstemperatur (mellan 15 °C och 25 °C).
-
Tvätta händerna noggrant med tvål och varmt vatten.
-
Öppna förpackningen med ADVATE genom att dra av locket. Ta ut BAXJECT III ur blistret.
-
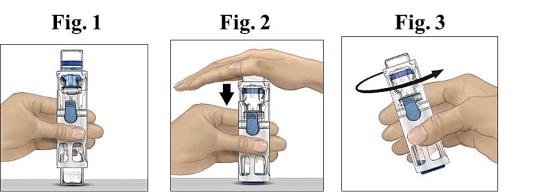
Placera ADVATE på en plan yta med vattenflaskan överst (Fig. 1). Vattenflaskan har en blå rand. Ta inte av den blå hättan förrän du uppmanas att göra det i ett senare steg.
-
Håll ADVATE i BAXJECT III med ena handen och tryck stadigt ned vattenflaskan med den andra handen tills systemet har tryckts ihop helt och vattnet rinner ner i injektionsflaskan med ADVATE (Fig. 2). Luta inte systemet förrän allt vatten har runnit ner i injektionsflaskan.
-
Kontrollera att allt vatten har överförts. Snurra flaskan försiktigt tills allt pulver har lösts upp. Se till att ADVATE pulvret är fullständigt upplöst, annars kan inte all färdigberedd lösning passera igenom filtret. Produkten löses upp snabbt (vanligtvis på mindre än 1 minut). Efter beredningen skall lösningen vara klar, färglös och fri från främmande partiklar.
Administrering:
Använd aseptisk teknik:
Parenterala läkemedel ska inspekteras avseende förekomst av partiklar före administrering när lösningen och behållaren så tillåter. Endast lösning som är klar och färglös ska användas.
-
Avlägsna den blå hättan från BAXJECT II/BAXJECT III. Dra inte in luft i sprutan. Koppla sprutan till BAXJECT II/BAXJECT III.
-
Vänd på systemet (så att flaskan med färdigberedd lösning hamnar överst). Dra in den färdigberedda lösningen i sprutan genom att sakta dra ut kolven..
-
Tag loss sprutan.
-
Koppla en "butterfly"-nål till sprutan. Injicera intravenöst. Lösningen skall administreras långsamt, i en hastighet som bestäms med hänsyn till patientens tillstånd, och får ej överskrida 10 ml per minut. Pulsen bör tas före och under administreringen av ADVATE. I händelse av en markant ökning brukar en minskning av administreringshastigheten eller ett tillfälligt avbrott av injektionen få symptomen att snabbt försvinna (se avsnitt Varningar och försiktighet och Biverkningar).
Förpackningsinformation
Pulver och vätska till injektionsvätska, lösning 1000 IE (2 ml)
Pulver: Vitt till gulvitt frystorkat pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 5879:22, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning (fri prissättning), tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 1000 IE (5 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, tillhandahålls ej
1 styck injektionsflaska (fri prissättning), tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 1500 IE (2 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 8794:71, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning (fri prissättning), tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 1500 IE (5 ml)
Pulver:vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, tillhandahålls ej
1 styck injektionsflaska (fri prissättning), tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 2000 IE
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 11710:19, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning, tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 250 IE (2 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 1505:99, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning, tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 250 IE (5 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, tillhandahålls ej
1 styck injektionsflaska (fri prissättning), tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 3000 IE
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 17541:16, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning, tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 500 IE (2 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, 2963:74, F, Övriga förskrivare: tandläkare
1 styck kombinationsförpackning, tillhandahålls ej
Pulver och vätska till injektionsvätska, lösning 500 IE (5 ml)
Pulver: vitt till gulvitt pulver. Vätska: klar och färglös vätska.
1 styck injektionsflaska, tillhandahålls ej
1 styck injektionsflaska (fri prissättning), tillhandahålls ej




