Indikationer
Ruconest är indicerat vid behandling av akuta anfall av angioödem hos vuxna, ungdomar och barn (2 år och äldre) med hereditärt angioödem (HAE) som beror på brist på C1-esterasinhibitor.
Kontraindikationer
-
Känd eller misstänkt allergi mot kaniner (se Varningar och försiktighet)
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges under Innehåll.
Dosering
Behandling med Ruconest ska inledas under vägledning och övervakning av läkare med erfarenhet av diagnos och behandling av hereditärt angioödem.
Dosering hos vuxna, ungdomar och barn från 2 år
Kroppsvikt upp till 84 kg
-
En intravenös injektion med 50 E/kg kroppsvikt.
Kroppsvikt 84 kg eller mer
-
En intravenös injektion med 4200 E (2 injektionsflaskor).
I de flesta fall räcker en dos av Ruconest för att behandla ett akut anfall av angioödem.
Vid otillräckligt kliniskt svar kan ytterligare en dos (50 E/kg kroppsvikt upp till 4200 E) administreras efter läkarens bedömning (se Farmakodynamik).
-
Hos vuxna och ungdomar kan en ytterligare dos administreras om tillräcklig respons inte observerats hos patienten efter 120 minuter.
-
Hos barn kan en ytterligare dos administreras om tillräcklig respons inte observerats hos patienten efter 60 minuter
Högst två doser ska ges inom 24 timmar.
Dosberäkning
Bestäm patientens kroppsvikt.
Kroppsvikt upp till 84 kg
-
För patienter med kroppsvikt upp till 84 kg beräknas den volym som ska administreras med nedanstående formel:
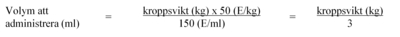
Kroppsvikt 84 kg eller mer
-
För patienter med kroppsvikt 84 kg eller mer är den volym som ska administreras 28 ml, motsvarande 4200 E (2 injektionsflaskor).
Pediatrisk population
Ruconest kan användas till pediatriska patienter (2 år och äldre) med samma dosering som för vuxna (50 E/kg kroppsvikt).
Säkerhet och effekt för Ruconest för barn yngre än 2 år har inte fastställts. Det finns inga kliniska data tillgängliga.
Äldre (≥65 år)
Informationen om patienter över 65 års ålder är begränsad.
Det finns ingen anledning till att patienter över 65 års ålder skulle svara annorlunda på Ruconest.
Nedsatt njurfunktion
Ingen dosjustering krävs för patienter med nedsatt njurfunktion eftersom konestat alfa inte utsöndras via njurarna.
Nedsatt leverfunktion
Klinisk erfarenhet av Ruconest saknas för patienter med nedsatt leverfunktion. Nedsatt leverfunktion kan förlänga plasmahalveringstiden för konestat alfa, men detta bedöms inte ge anledning till kliniska betänkligheter. Ingen rekommendation om dosjustering kan göras.
Administreringssätt
För intravenös användning.
Ruconest ska administreras av sjukvårdspersonal.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Korrekt volym färdigberedd lösning ska administreras som en långsam intravenös injektion under ca 5 minuter.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Konestat alfa erhålls från mjölk från transgena kaniner och innehåller spår av kaninprotein. Innan behandling med Ruconest inleds ska patienterna utfrågas om tidigare exponering för kaniner samt tecken och symtom som tyder på en allergisk reaktion.
Överkänslighetsreaktioner kan inte uteslutas.
Alla patienter måste övervakas noga och observeras noga under och efter hela administreringsperioden med avseende på symtom på överkänslighet. Patienter ska informeras om tidiga tecken på överkänslighetsreaktioner, inklusive nässelutslag, generell urtikaria, trånghetskänsla i bröstet, väsande andning, hypotoni och anafylaxi. Om dessa symtom uppträder efter administrering ska patienten kontakta läkare.
Vid anafylaktiska reaktioner eller anafylaktisk chock ska akutvård ges.
Korsreaktivitet mellan komjölk och kaninmjölk anses osannolik, men möjligheten till sådan korsreaktivitet hos en patient med kliniska tecken på komjölksallergi kan inte uteslutas. Patienten bör övervakas för tecken och symtom på överkänslighetsreaktioner till följd av administrering med Ruconest.
Natrium
Varje injektionsflaska Ruconest innehåller 19,5 mg natrium. Detta bör beaktas av patienter som ordinerats natriumfattig kost.
Interaktioner
Inga interaktionsstudier har utförts.
I den vetenskapliga litteraturen beskrivs interaktion mellan tPA (tissue-type plasminogen activator) och C1-INH-innehållande läkemedel. Ruconest ska inte administreras samtidigt med tPA.
Graviditet
Erfarenhet saknas av användning av Ruconest hos gravida kvinnor.
I en djurstudie observerades reproduktionstoxikologiska effekter (se Prekliniska uppgifter). Ruconest rekommenderas inte under graviditet om inte behandlande läkare bedömer att nyttan uppväger de möjliga riskerna.
Amning
Erfarenhet saknas av användning av Ruconest hos ammande kvinnor.
Ruconest rekommenderas inte under amning om inte behandlande läkare bedömer att nyttan uppväger de möjliga riskerna.
Fertilitet
Inga data finns tillgängliga om effekten av Ruconest på manlig eller kvinnlig fertilitet.
Trafik
Utifrån känd farmakologi och biverkningsprofil förväntas Ruconest inte ha någon effekt på förmågan att framföra fordon och använda maskiner. Huvudvärk, svindel och yrsel har dock rapporterats efter användning av Ruconest, vilket kan även uppträda som en följd av ett anfall av HAE. Patienter bör uppmanas att inte framföra fordon eller använda maskiner om de har huvudvärk, svindel eller yrsel.
Biverkningar
Sammanfattning av säkerhetsprofilen
Ett fall av överkänslighet observerades i kliniska studier med Ruconest. Illamående är den vanligast förekommande biverkningen som har observerats efter behandling med Ruconest.
Lista över biverkningar i tabellform
Biverkningar rapporterade i kliniska studier på patienter med HAE efter behandling av akut anfall med Ruconest visas nedan. Biverkningarna var normalt lindriga till medelsvåra. Incidensen av biverkningar var likartad för alla dosgrupper och ökade inte vid upprepade administreringar.
Frekvensen av biverkningar som listas nedan definieras enligt följande konvention:
Mycket vanliga (≥1/10)
Vanliga (≥ 1/100, <1/10)
Mindre vanliga (≥ 1/1 000, <1/100)
Sällsynta (≥1/10 000, <1/1 000)
Mycket sällsynta (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Organsystemklass |
Biverkning |
Frekvens |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Mindre vanliga |
|
Svindel |
Mindre vanliga |
|
|
Hypoestesi |
Mindre vanliga |
|
|
Yrsel |
Mindre vanliga |
|
|
Öron och balansorgan |
Svullnad av ytterörat |
Mindre vanliga |
|
Andningsvägar, bröstkorg och mediastinum |
Halsirritation |
Mindre vanliga |
|
Magtarmkanalen |
Illamående |
Vanliga |
|
Diarré |
Mindre vanliga |
|
|
Obehag i buken |
Mindre vanliga |
|
|
Oral parestesi |
Mindre vanliga |
|
|
Hud och subkutan vävnad |
Urtikaria |
Mindre vanliga |
Pediatrisk population
I det kliniska utvecklingsprogrammet behandlades 37 barn och ungdomar (i åldern 5 till 17 år) med HAE för 124 anfall av angioödem. Biverkningarnas frekvens, typ och allvarlighetsgrad hos barn och ungdomar liknade dem som förekom hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Kliniska uppgifter om överdosering saknas.
Farmakodynamik
Plasmaproteinet C1-INH är huvudregulatorn för aktivering av kontakt- och komplementsystemen in vivo. HAE-patienter har en heterozygot brist på plasmaproteinet C1-INH. Som en följd av denna brist kan dessa patienter drabbas av en okontrollerad aktivering av kontakt- och komplementsystemen, med bildning av inflammatoriska mediatorer. Detta manifesterar sig kliniskt som akuta anfall av angioödem.
Konestat alfa, en rekombinant human komplementkomponent 1 (C1)-esterasinhibitor (rhC1-INH), är en analog till human C1-INH och erhålls från mjölken från kaniner som uttrycker den gen som kodar för human C1-INH. Aminosyrasekvensen i konestat alfa är identisk med den hos endogen C1-INH.
C1-INH hämmar flera proteaser (målproteaser) i kontakt- och komplementsystemen. Effekten av konestat alfa på följande målproteaser har bestämts in vitro: aktiverat C1s, kallikrein, faktor XIIa och faktor XIa. Inhibitionskinetiken befanns vara jämförbar med den som observeras för plasmaderiverad human C1-INH.
Komplementkomponenten (proteinet) C4 är ett substrat för aktiverat C1s. Patienter med HAE har låga halter av C4 i blodet. När det gäller plasmaderiverad C1-INH uppvisar de farmakodynamiska effekterna av konestat alfa på C4 en dosberoende återställning av komplementhomeostas hos HAE-patienter vid en C1-INH-aktivitetsnivå i plasma överstigande 0,7 E/ml, vilket är normalintervallets undre gräns. Hos HAE-patienter ökar Ruconest vid dosen 50 E/kg plasmaaktiviteten av C1INH till över 0,7 E/ml i ca 2 timmar (se Farmakokinetik).
Ruconests effekt och säkerhet för behandling av akuta anfall av angioödem hos vuxna och ungdomar med HAE har utvärderats i två dubbelblindade, randomiserade, placebokontrollerade studier och fyra öppna kliniska studier. De doser som utvärderades i de kliniska studierna varierade från en injektionsflaska med 2100 E (motsvarande 18-40 E/kg) till 50 och 100 E/kg. Ruconests effekt för behandling av akuta anfall av angioödem påvisades genom signifikant kortare tid till begynnande symtomlindring och tid till symtomminimering samt få fall av behandlingssvikt. Tabellen nedan visar resultaten (primära och sekundära endpoints) för de båda randomiserade kontrollerade prövningarna:
|
Studie |
Behandling |
Tid (minuter) till begynnande symtomlindring median (95 % konfidensintervall) |
Tid (minuter) till symtomminimering median (95 % konfidensintervall) |
|
C1 1205 RCT |
100 E/kg n = 13 |
68 (62, 132) p = 0,001 |
245 (125, 270) p = 0,04 |
|
50 E/kg n = 12 |
122 (72, 136) p < 0,001 |
247 (243, 484) |
|
|
Saltlösning n = 13 |
258 (240, 495) |
1101 (970, 1494) |
|
|
C1 1304 RCT |
100 E/kg n = 16 |
62 (40, 75) p = 0,003 |
480 (243, 723) p = 0,005 |
|
Saltlösning n = 16 |
508 (70, 720) |
1440 (720, 2885) |
Resultaten från de öppna studierna överensstämde med resultaten ovan och stödjer upprepad användning av Ruconest för behandling av efterföljande anfall av angioödem.
I de randomiserade kontrollerade prövningarna uppnådde 39 av 41 patienter (95 %) behandlade med Ruconest begynnande symtomlindring inom fyra timmar. I en öppen studie uppnådde 146 av 151 anfall (97 %) behandlade med en dos av 50 E/kg begynnande symtomlindring inom fyra timmar. Ytterligare en dos på 50 E/kg administrerades vid 17 av de 168 (10 %) anfallen.
Pediatrisk population
Barn
I en öppen studie med 20 barn med HAE (i åldern 5 till 14 år) uppnåddes begynnande symtomlindring inom 4 timmar vid 64 av 67 anfall (96 %) som behandlades med en enda dos av 50 E/kg. Ytterligare en dos med 50 E/kg administrerades för 3 av 73 anfall (4 %).
Ungdomar
Tio HAE-patienter i åldern 13 till 17 år behandlades med 50 E/kg för 27 akuta anfall av angioödem och 7 HAE-patienter i åldern 16 till 17 år behandlades med 2100 E för 24 akuta anfall av angioödem.
Effekt- och säkerhetsresultaten hos barn och ungdomar överensstämde med dem hos vuxna.
Farmakokinetik
Distribution
Inga formella distributionsstudier har utförts. Distributionsvolymen för konestat alfa var ca 3 liter, vilket är jämförbart med plasmavolymen.
Metabolism och eliminering
Enligt data från djurförsök elimineras konestat alfa från blodcirkulationen av levern via receptormedierad endocytos följd av fullständig hydrolys/nedbrytning.
Efter administrering av Ruconest (50 E/kg) till asymtomatiska HAE-patienter observerades ett Cmax-värde på 1,36 E/ml. Halveringstiden för konestat alfa var ca 2 timmar.
Utsöndring
Ingen utsöndring föreligger, eftersom konestat alfa elimineras från blodcirkulationen via receptormedierad endocytos följd av fullständig hydrolys/nedbrytning i levern.
Pediatrisk population
Barn
Efter en dos av konestat alfa om 50 E/kg hade totalt 18 av 20 barn koncentrationer av funktionell C1-INH som var > 70 % av normalvärdet (den lägre gränsen av normalintervallet) vid 5 minuter och 2–4 timmar efter tidpunkten för administrering. Det aritmetiska medelvärdet för funktionell C1-INH Cmax för det första anfallet var 123 % av normalvärdet (intervall 62 % till 168 %) och AUC0-3 var 171 % av normalvärdet (intervall 95 % till 244 %).
En PK-modell för population visar att en dos på 50 E/kg kommer att ge koncentrationer av funktionell C1-INH som är > 70 % av normalvärdet hos 96,0 % av barn i åldern 2 till ≤ 13 år och hos 90,5 % av barn i åldern 2 till < 5 år.
Prekliniska uppgifter
Prekliniska uppgifter baserade på studier avseende säkerhetsfarmakologi, endostoxicitet, tvåveckors subkronisk toxicitet och lokal tolerans utförda i olika djurarter, inklusive råttor, hundar, kaniner och cynomolgusapor, visade inte några särskilda risker för människa. Ingen gentoxisk eller karcinogen potential förväntas.
Embryofetala studier på råtta och kanin: dagliga enstaka doser av vehikel eller 625 E/kg/administrering av konestat alfa administrerades intravenöst till parade råttor och kaniner. I studien med råttor förekom inga foster med missbildningar varken i konestat alfa-gruppen eller i kontrollgruppen. I en embryotoxicitetsstudie med kaniner observerades en ökning av incidensen av kardiella kärlmissbildningar hos fostren (1,12 % i behandlingsgruppen jämfört med 0,03 % hos historiska kontroller) hos djur som fick konestat alfa.
Innehåll
En injektionsflaska innehåller 2100 enheter konestat alfa, motsvarande 2100 enheter per 14 ml efter beredning, eller en koncentration av 150 enheter/ml.
Konestat alfa är en rekombinant analog till human C1-esterasinhibitor (rhC1-INH) som framställs med hjälp av rekombinant DNA-teknik i mjölken hos transgena kaniner.
En enhet konestat alfa-aktivitet definieras som motsvarigheten till den C1-esterashämmande aktivitet som finns i 1 ml poolad normal plasma.
Hjälpämne med känd effekt:
Varje injektionsflaska innehåller ungefär 19,5 mg natrium.
Förteckning över hjälpämnen
Sackaros
Natriumcitrat (E331)
Citronsyra
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet, förvaring och hantering
4 år. Förvaras vid högst 25 ºC. Förvaras i originalförpackningen. Ljuskänsligt.
Färdigberedd lösning
Kemisk och fysikalisk stabilitet vid användning har visats under 48 timmar mellan
5 ºC and 25 ºC. Ur mikrobiologisk synpunkt bör läkemedlet användas omedelbart. Om läkemedlet inte används omedelbart ansvarar användaren för förvaringstid och förvaringsbetingelser före användning. Normalt ska förvaringstiden inte vara längre än 24 timmar vid 2-8 ºC om inte beredningen har gjorts under kontrollerade och validerade aseptiska förhållanden.
Varje injektionsflaska med Ruconest är avsedd för engångsbruk.
Aseptisk teknik ska användas för beredning, sammanslagning och blandning av lösningarna.
Beredning
Varje injektionsflaska med Ruconest (2100 E) ska spädas med 14 ml vatten för injektionsvätskor. Vatten för injektionsvätskor ska tillsättas långsamt för att undvika kraftig inverkan på pulvret och sedan blandas varsamt för att minimera skumbildning i lösningen. Färdigberedd lösning innehåller 150 E/ml konestat alfa och är klar och färglös.
Den färdigberedda lösningen i varje injektionsflaska ska inspekteras visuellt. Inga partiklar och ingen missfärgning ska förekomma. Lösningar med partiklar eller missfärgning ska inte användas. Läkemedlet ska användas omedelbart.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.




