Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Indikationer
Antikonception i upp till 3 år.
Kontraindikationer
-
Graviditet (se avsnitt Graviditet)
-
Pågående eller recidiverande bäckeninflammation eller tillstånd associerade med en ökad risk för bäckeninfektioner
-
Akut cervicit eller vaginit
-
Endometrit postpartum eller infektion efter abort inom de tre senaste månaderna
-
Cervikal intraepitelial neoplasi tills den har avhjälpts
-
Malignitet i uterus eller cervix
-
Gestagen-känsliga tumörer, t.ex. bröstcancer
-
Onormal uterin blödning av okänd etiologi
-
Medfödd eller förvärvad uterin anomali inklusive myom som skulle kunna påverka insättningen och/eller retentionen av inlägget (dvs. om de missformar livmoderkaviteten)
-
Akut leversjukdom eller levertumör
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Dosering
Jaydess sätts in i livmoderkaviteten och är effektiv i upp till tre år.
Insättning
Det rekommenderas att Jaydess endast sätts in av behörig sjukvårdspersonal med tidigare erfarenhet av att sätta in intrauterina inlägg och/eller som har genomgått utbildning för insättning av Jaydess.
Före insättning ska patienten undersökas noggrant för att upptäcka eventuella kontraindikationer för insättning av ett intrauterint inlägg. Uteslut graviditet före insättning. Överväg möjligheten för ägglossning och konception före användning av denna produkt. Jaydess är inte lämpligt som postkoitalt preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet under Medicinsk undersökning/konsultation).
Tabell 1: När ska Jaydess sättas in hos fertila kvinnor
|
Börja med Jaydess |
- Jaydess ska sättas in i livmoderkaviteten inom 7 dagar efter menstruationens början. Jaydess ger då ett preventivt skydd från insättningen och inget ytterligare preventivmedel behövs. - Om insättning inom 7 dagar efter menstruationens början inte är möjlig eller om kvinnan inte har regelbundna menstruationer kan Jaydess sättas in när som helst under menstruationscykeln, förutsatt att behörig sjukvårdspersonal på ett tillförlitligt sätt kan utesluta möjligheten för graviditet. I detta fall kan dock omedelbart preventivt skydd inte garanteras. En barriärmetod bör därför användas, eller så ska patienten avstå från vaginalt samlag under de kommande 7 dagarna för att undvika graviditet. |
|
Insättning postpartum |
I tillägg till ovanstående anvisningar (Börja med Jaydess): Insättning postpartum bör skjutas upp tills livmodern återgått till normal storlek, insättning bör dock inte ske tidigare än sex veckor efter förlossningen. Om livmoderns återgång till normal storlek är väsentligt fördröjd bör man överväga att vänta tills 12 veckor efter förlossningen. |
|
Insättning efter abort i första trimestern |
Jaydess kan sättas in omedelbart efter en abort i första trimestern. I detta fall behövs inget ytterligare preventivmedel. |
|
Utbyte av Jaydess |
Jaydess kan bytas ut mot ett nytt inlägg när som helst i menstruationscykeln. I detta fall behövs inget ytterligare preventivmedel. |
|
Byte från en annan preventivmetod (t.ex. kombinerade p-piller, p-implantat) |
- Jaydess kan sättas in omedelbart om det är rimligt säkert att kvinnan inte är gravid. - Behov av ytterligare preventivmedel: Om det har gått mer än 7 dagar sedan menstruationen började ska kvinnan avstå från vaginalt samlag eller använda ytterligare preventivmedel under de kommande 7 dagarna. |
Vid besvärlig insättning och/eller om svåra smärtor eller blödningar inträffar under eller efter insättningen bör eventuell perforation övervägas och lämpliga åtgärder vidtas, som gynekologisk undersökning och ultraljud.
Efter insättning ska kvinnan undersökas på nytt efter 4 till 6 veckor för att kontrollera trådarna och säkerställa att inlägget sitter i rätt läge. Enbart en gynekologisk undersökning (inklusive kontroll av trådar) är eventuellt inte tillräckligt för att utesluta partiell perforation
.
Jaydess kan särskiljas från andra intrauterina inlägg genom en kombination av att silverringen är synlig vid ultraljud och att uttagstrådarna är bruna. Jaydess T-skelett innehåller bariumsulfat, vilket gör den synlig vid röntgenundersökning.
Uttagande/utbyte
Inlägget tas ut genom att man försiktigt drar i trådarna med en tång eller liknande instrument. Om trådarna inte syns, och inlägget vid ultraljudsundersökning visar sig vara kvar i livmoderkaviteten, kan det tas ut med en smal peang. Det kan bli nödvändigt att vidga cervikalkanalen eller göra andra kirurgiska ingrepp. Sedan Jaydess avlägsnats bör man kontrollera att inlägget är intakt.
Inlägget bör tas ut senast vid utgången av det tredje året.
Fortsatt preventivt skydd efter uttagande
-
Om kvinnan önskar fortsätta med samma preventivmetod, kan ett nytt inlägg sättas in omedelbart efter avlägsnandet av det tidigare inlägget.
-
Om kvinnan inte vill fortsätta med samma preventivmetod men vill undvika graviditet bör inlägget tas ut inom 7 dagar efter menstruationens början, förutsatt att kvinnan har regelbundna menstruationer. Om inlägget tas ut vid någon annan tidpunkt under menstruationscykeln eller om kvinnan inte har regelbunden menstruation och har haft samlag under den senaste veckan, finns risk för graviditet. För att säkerställa kontinuerligt preventivt skydd bör en barriärmetod (såsom kondom) användas minst 7 dagar innan uttagande. Efter uttagande ska den nya preventivmetoden påbörjas omedelbart (följ anvisningarna för den nya preventivmetoden).
Äldre
Jaydess har inte studerats hos kvinnor över 65 år. Det finns ingen indikation för användning av Jaydess hos postmenopausala kvinnor.
Patienter med nedsatt leverfunktion
Jaydess har inte studerats hos kvinnor med nedsatt leverfunktion. Jaydess är kontraindicerat till kvinnor med akut leversjukdom eller levertumör (se avsnitt Kontraindikationer).
Patienter med nedsatt njurfunktion
Jaydess har inte studerats hos kvinnor med nedsatt njurfunktion.
Barn och ungdomar
Det finns ingen indikation för användning av denna produkt före menarche. För uppgifter avseende säkerhet och effekt hos ungdomar, se avsnitt Farmakodynamik.
Administreringssätt
Ska insättas av behörig sjukvårdspersonal med aseptisk teknik.
Jaydess tillhandahålls i en steril förpackning, inuti en införare, som inte ska öppnas förrän den ska användas. Ska ej steriliseras på nytt. Endast avsedd för engångsbruk. Användes ej om blistret är skadat eller öppet. Insättes före utgångsdatum som anges på förpackningen och blistret efter EXP.
Ej använt läkemedel eller avfall ska kasseras i enlighet med lokalt gällande regler.
Jaydess levereras med ett patientkort i ytterförpackningen. Fyll i patientkortet och ge det till patienten efter insättningen.
Förberedelser innan insättning
-
Undersök patienten för att utesluta kontraindikationer för insättning av Jaydess (se avsnitt Kontraindikationer och Varningar och försiktighet under Medicinsk undersökning/konsultation).
-
Synliggör portio med ett spekulum och tvätta omsorgsfullt med lämplig antiseptisk lösning.
-
Vid behov, använd assistans vid insättningen.
-
Fatta tag i portio med en klotång eller annan pincett för att stabilisera uterus. Om uterus är retroflekterad kan det vara lämpligare att fatta tag i den bakre delen av cervix. För att räta ut vinkeln mellan cervix och corpus kan man dra lätt i klotången. Klotången skall hållas kvar i sitt läge och en försiktig dragning av cervix ska bibehållas när man sätter in inlägget.
-
För en uterussond genom cervikalkanalen upp till fundus för att mäta uteruskavitetens längd och bestämma dess riktning samt för att utesluta tecken på intrauterin abnormalitet (t.ex. septum, submukösa myom) eller ett tidigare insatt intrauterint preventivmedel som inte har tagits bort. Skulle svårigheter uppstå, överväg en dilatation av kanalen. Om en cervikal dilatation krävs, överväg att ge smärtstillande läkemedel och/eller en paracervikal blockad.
Insättning
|
1. Öppna den sterila förpackningen helt (bild 1). Använd därefter aseptisk teknik och sterila handskar. | ||
|
Bild 1 |
||
|
2. Skjut glidaren maximalt framåt i pilens riktning (toppläget) för att ladda insättningsröret med Jaydess (bild 2). | 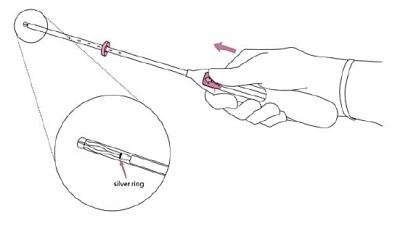
|
Bild 2 |
|
VIKTIGT! Dra inte glidaren nedåt eftersom Jaydess då kan frigöras för tidigt. Jaydess kan inte laddas på nytt efter att ha frigjorts. |
||
|
3. Medan glidaren hålls i sitt toppläge, justera den övre delen av ringen
| 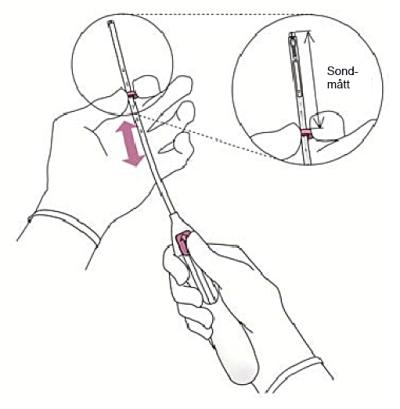
|
Bild 3 |
|
4. Medan glidaren hålls i sitt toppläge, för insättningsröret genom cervix tills ringen
| 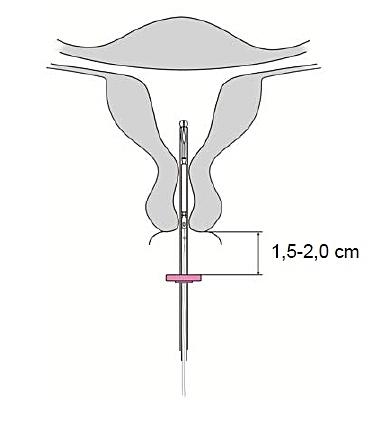
|
Bild 4 |
|
VIKTIGT! Forcera inte vid stort motstånd. Dilatera cervikalkanalen vid behov. |
||
|
5. Medan insättningsröret hålls stadigt på plats, dra glidaren till markeringen för att öppna Jaydess horisontella armar (bild 5). Vänta i 5-10 sekunder så att de horisontella armarna öppnas helt. | 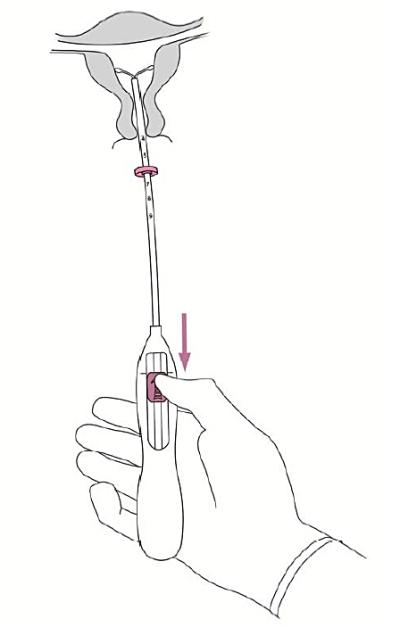
|
Bild 5 |
|
6. För försiktigt in insättningsröret mot fundus tills ringen
| 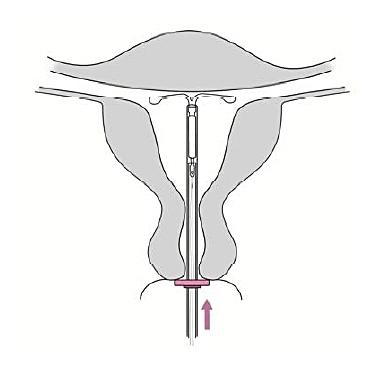
|
Bild 6 |
|
7. Håll insättningsröret stadigt på plats och frigör Jaydess genom att dra glidaren till dess bottenläge (bild 7). Medan glidaren hålls i bottenläget avlägsna försiktigt insättningsröret genom att dra ut den. Klipp av trådarna så att ca 2-3 cm är synliga utanför cervix
| 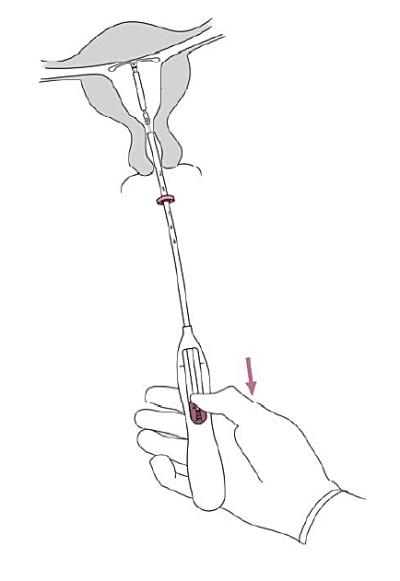
|
Bild 7 |
|
VIKTIGT! Vid misstanke om att inlägget inte befinner sig i rätt läge bör läget kontrolleras (t.ex. med ultraljud). Avlägsna inlägget om det inte befinner sig i helt rätt läge i uteruskaviteten. Ett uttaget inlägg får ej sättas in på nytt. |
||
Uttagande/utbyte
Se avsnitt Insättning och uttagande/utbyte angående uttagande/utbyte.
|
Jaydess tas ut genom att man drar i trådarna med en tång (Figur 8). En ny Jaydess kan sättas in direkt efter uttagandet. Sedan Jaydess tagits ut, bör man kontrollera att inlägget är intakt. | 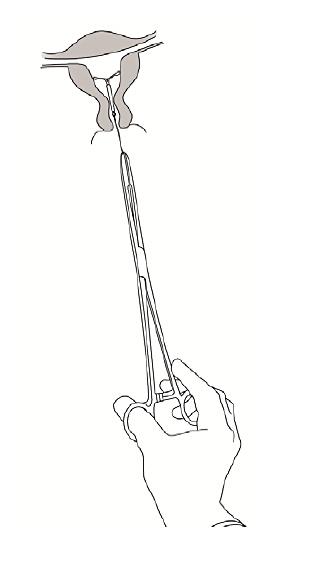
|
Bild 8 |
Varningar och försiktighet
Jaydess bör användas med försiktighet eller avlägsnas efter konsultation med specialist om något av följande tillstånd föreligger eller uppstår för första gången:
-
migrän, fokal migrän med asymmetriskt synbortfall eller andra symtom som tyder på övergående cerebral ischemi
-
mycket svår huvudvärk
-
gulsot
-
betydande stegring av blodtrycket
-
allvarlig arteriell sjukdom såsom stroke eller hjärtinfarkt
Lågdos levonorgestrel kan påverka glukostoleransen, och blodsockernivån bör följas hos diabetiker som använder Jaydess. Normalt behöver man dock inte ändra dosering hos diabetiker som använder intrauterina inlägg som innehåller levonorgestrel.
Medicinsk undersökning/konsultation
Före insättning ska kvinnan informeras om fördelarna och riskerna med Jaydess, inklusive tecken och symptom på perforation och risken för ektopisk graviditet, se nedan. En fysisk undersökning som inkluderar en gynekologisk undersökning och undersökning av brösten bör göras. Cellprov bör tas vid behov, efter utvärdering av behörig sjukvårdspersonal. Graviditet och sexuellt överförbara sjukdomar ska uteslutas. Behandling av genitala infektioner ska vara avslutad före insättning. Livmoderns läge och livmoderkavitetens storlek ska bestämmas. Det är viktigt att inlägget placeras i fundus för att åstadkomma maximal verkan och minska risken för utstötning. Instruktionerna för insättning bör följas noga.
Särskild tonvikt bör läggas på träning i korrekt införingsteknik.
Insättning och uttagning kan medföra viss smärta och blödning. Proceduren kan framkalla en vasovagal reaktion (t.ex. svimning eller krampanfall hos epileptiker).
Kvinnan bör undersökas igen 4-6 veckor efter insättningen för att kontrollera trådarna och säkerställa att inlägget sitter i rätt läge. Uppföljningsbesök rekommenderas därefter en gång om året, eller oftare om kliniskt indicerat.
Jaydess är inte lämpligt som postkoitalt antikonceptionsmedel.
Användningen av Jaydess för behandling av riklig menstruationsblödning eller som skydd mot endometriehyperplasi vid substitutionsbehandling med östrogen är inte fastställt. Därför är det inte rekommenderat som behandling av dessa tillstånd.
Ektopisk graviditet
I kliniska studier var den samlade förekomsten av ektopisk graviditet med Jaydess ca 0,11 per 100 kvinnoår. Ungefär hälften av de graviditeter som förekommer vid användning av Jaydess kommer sannolikt att vara ektopiska.
Kvinnor som överväger att låta sätta in en Jaydess bör informeras om tecken och symtom samt på risken för ektopisk graviditet. Om en kvinna blir gravid medan hon använder Jaydess ska ektopisk graviditet övervägas och utredas.
Kvinnor med anamnes på ektopisk graviditet, operation av äggledare eller bäckeninfektioner löper större risk för ektopisk graviditet. Ektopisk graviditet bör övervägas vid underlivssmärtor, särskilt i samband med utebliven menstruation eller om en kvinna med amenorré börjar blöda.
Eftersom en ektopisk graviditet kan påverka kvinnans framtida fertilitet bör fördelar och risker med att använda Jaydess övervägas noggrant, särskilt hos kvinnor som inte fött barn.
Användning hos kvinnor som inte fött barn: Till kvinnor som inte fött barn är Jaydess inte ett förstahandsval eftersom den kliniska erfarenheten är begränsad.
Effekter på blödningsmönstret under menstruation
Effekter på blödningsmönstret förväntas hos de flesta kvinnor som använder Jaydess. Ändringarna är en följd av levonorgstrels direkta verkan på endometriet och stämmer inte nödvändigtvis överens med ovarieaktivitet.
Oregelbundna blödningar och stänkblödningar är vanliga under de första månaderna av behandlingen. Därefter medför den starka hämningen av endometriet kortare och sparsammare menstruationsblödningar. Sparsamma blödningar utvecklas ofta till oligomenorré eller amenorré.
I kliniska studier utvecklades blödningar med långt intervall och/eller amenorré gradvis. Vid utgången av det tredje året utvecklade ungefär 22,3 % respektive 11,6 % av användarna blödningar med långt intervall och/eller amenorré. Graviditet bör övervägas om menstruation inte inträffar inom sex veckor efter senast påbörjad menstruation. Upprepade graviditetstest är inte nödvändiga hos kvinnor med amenorré, såvida inte andra symtom som tyder på graviditet uppträder.
Om blödningarna blir kraftigare och/eller mer oregelbundna över tid bör lämpliga diagnostiska åtgärder vidtas, eftersom oregelbundna blödningar kan vara ett symtom på polyper i endometriet, hyperplasi eller cancer och kraftig blödning kan vara ett tecken på en oupptäckt utstötning av det intrauterina inlägget.
Bäckeninfektion
Även om Jaydess och insättningsröret är sterila, kan de på grund av bakteriell kontaminering under insättningen bli ett transportmedel för mikroorganismer till de övre könsorganen. Bäckeninfektion har setts vid användning av alla intrauterina inlägg. I kliniska studier kunde bäckeninfektion ses i större utsträckning i början av användningen med Jaydess, vilket stämmer överens med publicerade data för kopparspiraler, där den högsta andelen fall av bäckeninflammation uppträder under de 3 första veckorna efter insättning, varefter andelen avtar.
Innan kvinnan väljer Jaydess bör en fullständig utredning göras av riskfaktorer som förknippas med bäckeninfektion (t.ex. flera sexuella partners, sexuellt överförbara infektioner och tidigare bäckeninflammation i anamnesen). Bäckeninfektioner kan få allvarliga konsekvenser och leda till minskad fertilitet och ökad risk för ektopisk graviditet.
Som vid andra gynekologiska och kirurgiska ingrepp kan det förekomma svår infektion eller sepsis (inkluderande sepsis orsakad av grupp A-streptokocker) efter insättning av ett intrauterint inlägg, även om detta är extremt sällsynt.
Om kvinnan upplever återkommande endometrit eller bäckeninfektioner eller om en akut infektion är allvarlig eller inte svarar på behandling, ska Jaydess tas ut.
Bakteriologiska undersökningar är indicerade och uppföljning rekommenderas, även vid lindriga infektionssymtom.
Utstötning
I kliniska studier med Jaydess var utstötningsfrekvensen låg (<4 % av insättningarna) och i samma storleksordning som setts för andra intrauterina inlägg. Blödningar eller smärtor kan vara symtom på partiell eller fullständig utstötning av Jaydess. Inlägget kan även stötas ur livmoderkaviteten utan att kvinnan märker detta och leda till förlust av det preventiva skyddet. Eftersom Jaydess minskar menstruationsblödningarna kan ökad blödningsmängd vara tecken på utstötning.
Risk för utstötning är förhöjd hos
-
Kvinnor med en anamnes på kraftig menstruationsblödning
-
Kvinnor med högre BMI än normalt vid tiden för insättning; denna risk ökar successivt med stigande BMI
Kvinnan ska informeras om eventuella tecken på utstötning och hur hon ska kontrollera Jaydess trådar och rådas att kontakta hälso- och sjukvårdspersonal om hon inte kan känna trådarna. En barriärmetod (såsom en kondom) ska användas tills Jaydess läge har bekräftats.
Partiell utstötning kan minska effekten av Jaydess.
En partiellt utstött Jaydess måste tas ut. Ett nytt inlägg kan sättas in vid tidpunkten för uttagandet, förutsatt att en graviditet har uteslutits.
Perforation
Inlägget kan, oftast under insättningen, perforera eller penetrera livmodern eller livmoderhalsen, även om det kanske inte upptäcks förrän senare. Detta kan minska effekten av Jaydess. Vid en svår insättning och/eller vid exceptionell smärta eller blödning under eller efter insättningen, bör lämpliga åtgärder vidtas omedelbart för att utesluta perforation, som t.ex. fysisk undersökning och ultraljud. Ett sådant inlägg måste tas ut; kirurgi kan bli nödvändig.
Förekomsten av perforation har undersökts hos spiralanvändare i en stor prospektiv, jämförande, icke-interventions-, kohortstudie (n=61 448 kvinnor) med en 1‑årig observationsperiod. Förekomsten av perforation var 1,3 (95 % KI: 1,1-1,6) per 1000 insättningar i hela studiekohorten; 1,4 (95 % KI: 1,1-1,8) per 1000 insättningar i kohorten med ett annat levonorgestrel- innehållande intrauterint inlägg och 1,1 (95 % KI: 0,7-1,6) per 1000 insättningar i kopparspiralkohorten.
Studien visade att både amning vid tidpunkten för insättning och insättning upp till 36 veckor efter förlossningen var associerade med en ökad risk för perforation (se tabell 2). Båda riskfaktorerna var oberoende av vilken typ av spiral som sattes in.
Tabell 2: Förekomst av perforation per 1000 insättningar för hela studiekohorten observerat under 1 år, stratifierad efter amning och tid efter förlossning vid insättning (kvinnor som fött barn)
|
Ammar vid tidpunkten för insättning |
Ammar inte vid tidpunkten för insättning |
|
|---|---|---|
|
Insättning ≤ 36 veckor efter förlossning |
5.6 (95% KI 3.9-7.9; n=6047 insättningar) |
1.7 (95% KI 0.8-3.1; n=5927 insättningar) |
|
Insättning > 36 veckor efter förlossning |
1.6 (95% KI 0.0-9.1; n=608 insättningar) |
0.7 (95% KI 0.5-1.1; n=41,910 insättningar) |
Vid förlängning av observationsperioden till 5 år i en subgrupp av denna studie (N = 39 009 kvinnor som använder ett annat levonorgestrel-innehållande intrauterint inlägg eller kopparspiral, där data fanns tillgängliga för 73 % av kvinnorna under hela den 5-åriga uppföljningsperioden), var förekomsten av perforation som observerats när som helst under hela 5-årsperioden 2,0 (95 % KI: 1,6-2,5) per 1000 insättningar. Amning vid tidpunkten för insättning och insättning upp till 36 veckor efter förlossningen bekräftades som riskfaktorer även i subgruppen som följdes upp i 5 år.
Risken för perforation kan vara ökad hos kvinnor med retroflekterad livmoder.
En förnyad undersökning efter insättning bör följa instruktionerna givna ovanför, under rubriken ”Medicinsk undersökning/konsultation”. Dessa kan anpassas efter kliniskt behov hos kvinnor med riskfaktorer för perforation.
Försvunna trådar
Om trådarna vid en uppföljande undersökning inte syns vid livmoderhalsen, måste en eventuell utstötning och graviditet uteslutas. Trådarna kan ha dragits in i livmodern eller cervikalkanalen och kan bli synliga igen under nästa menstruation. Om graviditet har uteslutits, kan trådarna vanligtvis lokaliseras genom försiktig sondering med ett lämpligt instrument. Går de inte att hitta, bör möjligheten för utstötning eller perforation övervägas. Ultraljudsundersökning kan användas för att bekräfta inläggets läge. Om ultraljudsundersökning inte går att utföra, eller om man vid ultraljudsundersökning inte lokaliserat inlägget, kan röntgen användas för att lokalisera inlägget.
Ovarialcystor/förstorade folliklar
Eftersom den preventiva effekten av Jaydess huvudsakligen beror på dess lokala effekt i uterus, sker det i allmänhet ingen förändring av den ovulatoriska funktionen, inklusive regelbunden follikelutveckling, ägglossning och follikelatresi hos kvinnor i fertil ålder. Ibland fördröjs follikelatresin och follikelutvecklingen fortsätter. Dessa förstorade folliklar kan inte skiljas kliniskt från ovarialcystor och har i kliniska studier rapporterats som biverkning hos ca 13,2% av kvinnorna som använder Jaydess. De omfattar ovarialcystor, blödande ovarialcystor och brustna ovarialcystor. De flesta av dessa folliklar är asymtomatiska, men några kan medföra underlivssmärta eller dyspareuni.
I de flesta fall försvinner de förstorade folliklarna spontant inom två till tre månader. Om så inte skulle ske, kan fortsatta ultraljudsundersökningar och andra diagnostiska/terapeutiska åtgärder vara lämpliga. I sällsynta fall kan kirurgisk intervention vara nödvändig.
Psykiska störningar
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta behörig sjukvårdspersonal vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Interaktioner
Observera: Produktresumé för andra, samtidigt använda läkemedel, ska konsulteras för att identifiera potentiella interaktioner.
Andra läkemedels effekt på Jaydess
Det kan förekomma interaktioner med läkemedel som inducerar hepatiska mikrosomala enzymer, vilket kan resultera i en ökad eller minskad clearence av könshormoner.
Ämnen som ökar clearance av levonorgestrel, t ex:
Fenytoin, barbiturater, primodon, karbamazepin, rifampicin och möjligen även oxkarbazepin, topiramat, felbamat, griseofulvin och produkter som innehåller johannesört.
Inverkan av dessa läkemedel på Jaydess preventiva effekt är inte känd, men den anses inte vara av stor betydelse på grund av inläggets lokala verkningsmekanism.
Ämnen med varierande effekt på levonorgestrels clearance:
När könshormoner administreras samtidigt som HIV-proteashämmare och icke-nukleosida hämmare av omvänt transkriptas, kan plasmakoncentrationen av progestin öka eller minska.
Substanser som minskar clearance av levonorgestrel (enzymhämmare) t ex:
Starka och måttliga CYP3A4-hämmare såsom azolantimykotika (t ex flukonazol, itrakonazol, ketokonazol, vorikonazol), verapamil, makrolider (t ex klaritromycin, erytromycin), diltiazem och grapefruktjuice kan öka plasmakoncentrationen av progestin.
Magnetisk resonanstomografi
Prekliniska undersökningar har visat att en patient kan bli skannad på ett säkert sätt efter placering av Jaydess under följande förhållanden: Statiskt magnetfält på 3-Tesla eller lägre, ett magnetfält med en maximal spatial gradient på 720 gauss/cm eller lägre. Under dessa förhållanden och med 15 min skanning var den maximala temperaturhöjningen, vid stället där Jaydess befann sig, 1,8 °C. Det kan förekomma en liten mängd skanningsartefakter, om området av intresse är i exakt samma område eller relativt nära Jaydess position.
Graviditet
Användning av Jaydess under pågående eller misstänkt graviditet är kontraindicerat, (se avsnitt Kontraindikationer Kontraindikationer). Blir kvinnan gravid vid användning av Jaydess, bör inlägget tas ut så snart som möjligt, eftersom intrauterina antikonceptionsmedel som lämnas kvar in situ ökar risken för spontan abort eller för tidig förlossning. Uttagning av Jaydess eller sondering av livmodern kan också resultera i spontan abort. Ektopisk graviditet bör uteslutas.
Om inlägget inte går att få ut och om kvinnan önskar fortsätta graviditeten, bör hon informeras om riskerna och eventuella konsekvenser för barnet i händelse av för tidig förlossning. Graviditeten bör noga övervakas. Kvinnan ska instrueras om att rapportera alla symtom som tyder på komplikationer, t.ex. smärtsamma kramper i underlivet med feber.
Dessutom kan en ökad risk för viriliserande effekter hos kvinnliga foster inte uteslutas efter intrauterin exponering för levonorgestrel. Det har förekommit enstaka fall med maskulinisering av de yttre könsorganen hos kvinnliga foster efter lokal exponering för levonorgestrel under graviditet med en hormonspiral på plats.
Amning
Generellt verkar det inte finnas någon skadlig effekt på spädbarnets tillväxt och utveckling vid användning av gestagen, efter sex veckor post partum. Ett intrauterint inlägg, som utsöndrar levonorgestrel, påverkar inte modersmjölkens kvantitet eller kvalitet. Små mängder gestagen (ca 0,1% av levonorgestreldosen) överförs till modersmjölken hos ammande kvinnor.
Fertilitet
Användningen av ett intrauterint inlägg, som frisätter levonorgestrel, ändrar inte framtida fertilitet. Efter att inlägget har avlägsnats återgår kvinnorna till sin normala fertilitet (se avsnitt Farmakodynamik).
Trafik
Jaydess har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
De flesta kvinnor upplever förändringar i menstruationens blödningsmönster efter insättning av Jaydess. Med tiden ökar frekvensen av amenorré och blödningar med långt intervall, och frekvensen av långa, oregelbundna och täta blödningar minskar. Följande blödningsmönster sågs i kliniska studier:
Tabell 3: Blödningsmönster rapporterade för Jaydess i kliniska studier
|
Jaydess |
Första 90 dagarna |
Följande 90 dagar |
Slutet av år 1 |
Slutet av år 3 |
|
Amenorré |
<1% |
3% |
6% |
12% |
|
Blödning med långt intervall |
8% |
19% |
20% |
22% |
|
Frekvent blödning |
31% |
12% |
8% |
4% |
|
Oregelbunden blödning* |
39% |
25% |
18% |
15% |
|
Förlängd blödning* |
55% |
14% |
6% |
2% |
*Kvinnor med oregelbunden blödning och förlängd blödning kan också ingå i en av de andra kategorierna (bortsett från amenorré)
Sammanfattning av biverkningar i tabellform
Frekvenserna av biverkningar som rapporterats med Jaydess sammanfattas i tabellen nedan. Inom varje frekvensområde presenteras biverkningarna efter fallande allvarlighetsgrad.
Frekvenserna definieras som:
mycket vanliga (≥ 1/10)
vanliga (≥ 1/100 till < 1/10)
mindre vanliga (≥ 1/1000 till < 1/100)
sällsynta (≥ 1/10 000 till < 1/1000)
mycket sällsynta (< 1/10 000)
|
Klassificering av organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
|---|---|---|---|
|
Psykiska störningar |
Nedstämdhet/ depression Minskad libido | ||
|
Centrala och perifera nervsystemet |
Huvudvärk |
Migrän | |
|
Blodkärl |
|
|
Yrsel |
|
Magtarmkanalen |
Buksmärta/ bäckensmärta |
Illamående | |
|
Hud och subkutan vävnad |
Akne/seborré |
Alopeci |
Hirsutism |
|
|
|
|
|
|
Reproduktions-organ och bröstkörtel |
Blödnings-störningar inklusive ökad och minskad menstruell blödning, spotting, blödning med långt intervall och amenorré Ovarialcysta* Vulvovaginit |
Infektion i övre genitalier Dysmenorré Bröstsmärtor/ obehag Utstötning av intrauterint inlägg (helt eller delvis) Flytning |
Perforation av livmodern** |
|
Undersökningar |
|
Viktökning |
|
* I kliniska studier är ovarialcystor redovisade som biverkningar om de var onormala, icke-funktionella cystor och/eller hade en diameter > 3 cm på ultraljudsundersökning.
** Denna frekvens är baserad på en stor prospektiv, jämförande, icke-interventions-, kohortstudie med kvinnor som använde ett annat levonorgestrel-innehållande intrauterint inlägg och kopparspiral. Studien visade att amning vid tiden för insättning samt insättning upp till 36 veckor efter förlossningen är oberoende riskfaktorer för perforation (se avsnitt Varningar och försiktighet, under Perforation). I kliniska studier med Jaydess, som exkluderade ammande kvinnor, var frekvensen för perforation ”sällsynt”.
Beskrivning av utvalda biverkningar
Vid användning av intrauterina inlägg, som frisätter levonorgestrel, har fall av överkänslighet inkluderande hudutslag, urtikaria och angioödem rapporterats.
Om en kvinna blir gravid med Jaydess in situ, är den relativa risken för ektopisk graviditet ökad (se avsnitt Varningar och försiktighet under Ektopisk graviditet).
Partnern kan känna utdragstrådarna vid samlag.
Följande biverkningar har rapporterats i samband med insättning eller avlägsnande av Jaydess:
Smärta och blödning vid insättning och avlägsnande, vasovagal reaktion med yrsel eller svimning relaterat till insättning. Förfarandet kan utlösa krampanfall hos patienter med epilepsi.
Fall av sepsis (inkluderande sepsis orsakad av grupp A-streptokocker) har rapporterats efter spiralinsättning (se avsnitt Varningar och försiktighet, under Bäckeninfektion).
Barn och ungdomar
En studie med 304 ungdomar visar att säkerhetsprofilen för Jaydess överensstämmer med den som har observerats hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Ej relevant.
Farmakodynamik
Farmakodynamiska effekter
Jaydess har huvudsakligen en lokal gestagen effekt i livmoderkaviteten.
Den höga koncentrationen av levonorgestrel i endometriet nedreglerar östrogen- och gestagenreceptorerna i endometriet. Detta gör endometriet relativt okänsligt för cirkulerande östradiol och en uttalad antiproliferativ effekt kan ses. Morfologiska förändringar i endometriet och en svag, lokal främmande kroppsreaktion observeras i samband med användning. Förtjockning av cervixsekretet förhindrar spermiernas passage genom cervikalkanalen. Den lokala miljön i livmoder och äggledare hämmar spermiemobiliteten och funktionen och förhindrar implantation. I kliniska studier med Jaydess sågs ägglossning hos de flesta av de studerade försökspersonerna. Bevis på ägglossning sågs hos 34 av 35 kvinnor under det första året, hos 26 av 27 kvinnor under det andra året, och hos alla 26 kvinnor under det tredje året.
Klinisk effekt och säkerhet
Den antikonceptionella effekten hos Jaydess har studerats i en klinisk studie med 1 432 kvinnor i åldrarna 18-35 varav 38,8% (556) var nullipara kvinnor och av dessa var 83,6% (465) nulligravida. Det 1-åriga Pearl Index var 0,41% (95% konfidensintervall 0,13 – 0,96) och det 3-åriga Pearl Index var 0,33 (95% konfidensintervall 0,16 – 0,60). Under ett år misslyckades det preventiva skyddet i 0,4% av fallen medan den kumulativa frekvensen under tre år uppgick till 0,9% av fallen. Detta innefattar också graviditeter orsakade av oupptäckta utsötningar och perforationer. Användningen av intrauterina inlägg som frisätter levonorgestrel påverkar inte den framtida fertiliteten. Data från ett levonorgestrel-inlägg med en högre dos visar att ca 80% av de kvinnor som önskade att bli gravida, blev det inom 12 månader efter att inlägget tagits ut.
En studie med 304 ungdomar visar att säkerhetsprofilen för Jaydess överensstämmer med den som observerats hos vuxna. Effekten förväntas vara densamma hos ungdomar under 18 år som hos användare 18 år eller äldre.
Med Jaydess är förändringarna i blödningsmönstret ett resultat av levonorgestrels direkta verkan på endometriet och avspeglar inte nödvändigtvis menstruationscykeln. Det finns ingen klar skillnad i follikelutveckling, ovulation eller östradiol- och progesteronproduktion hos kvinnor med olika blödningsmönster. Initialt kan det förekomma en ökning av spotting under de första månadernas användning till följd av hämningen av proliferationen i endometriet. Därefter ger den kraftiga endometriesuppressionen kortare och sparsammare menstruationsblödningar vid användning av Jaydess. Sparsamma blödningar utvecklas ofta till oligomenorré eller amenorré. Ovariefunktionen är ofta normal och östradiolnivåerna bibehålls, även när användaren av Jaydess har amenorré.
Farmakokinetik
Levonorgestrel frisätts lokalt i livmoderkaviteten. Frisättningskurvan in vivo kännetecknas av ett initialt kraftigt fall, som successivt minskar, och resulterar i små förändringar efter 1 år fram till slutet av den avsedda 3-åriga användningsperioden. De beräknade frisättningsfrekvenserna in vivo vid olika tidpunkter anges i tabell 4.
Tabell 4: Beräknade frisättningshastigheter in vivo baserade på observation av innehåll ex vivo.
|
Tid |
Beräknad in vivo frisättningshastighet [mikrogram/24 timmar] |
|---|---|
|
24 dagar efter insättning |
14 |
|
60 dagar efter insättning |
10 |
|
1 år efter insättning |
6 |
|
3 år efter insättning |
5 |
|
Genomsnitt över 1 år |
8 |
|
Genomsnitt över 3 år |
6 |
Absorption
Mätningar av koncentrationen i serum visar att levonorgestrel frisätts i livmodern utan fördröjning efter insättning. Mer än 90 % av frisatt levonorgestrel är systemiskt tillgängligt. Maximal serumkoncentration av levonorgestrel uppnås inom de två första veckorna efter insättning av Jaydess. Sju dagar efter insättningen blev en genomsnittlig levonorgestrelkoncentration på 162 pg/ml (5:e percentilen: 102 pg/ml - 95:e percentilen: 249 pg/ml) bestämd. Därefter avtar serumkoncentrationen med tiden för att nå en genomsnittlig koncentration av 59 pg/ml (5:e percentilen: 36 pg/ml - 95:e percentilen: 92 pg/ml) efter 3 år. Den höga lokala läkemedelsexponeringen i livmoderkaviteten leder till en stor koncentrationsgradient via endometriet till myometriet (gradienten endometriet till myometriet > 100-faldigt) och till låga koncentrationer av levonorgestrel i serum (gradienten endometriet till serum > 1000‑faldigt).
Distribution
Levonorgestrel är ospecifikt bundet till serumalbumin och specifikt till SHBG. Mindre än 2 % av cirkulerande levonorgestrel förekommer som fri steroid. Levonorgestrel binder sig med hög affinitet till SHBG. Därför medför ändringar i koncentrationen av SHBG i serum en ökning (vid högre SHBG-koncentrationer) eller en minskning (vid låga koncentrationer SHBG) av den totala levonorgestrelkoncentrationen i serum. Koncentrationen av SHBG sjönk med i genomsnitt ca 15 % under den första månaden efter insättning av Jaydess och förblev stabil under den 3-åriga användningsperioden. Den uppskattade genomsnittliga distributionsvolymen för levonorgestrel är ca. 106 liter.
Biotransformation
Levonorgestrel metaboliseras till stor del. De viktigaste metaboliseringsvägarna är reduktionen av Δ4 3 oxo-gruppen och hydroxyleringar vid positionerna 2α, 1β and 16β, följt av konjugering. CYP3A4 är det huvudsakliga enzymet som är involverat i levonorgestrels oxidativa metabolism. Tillgängliga in vitro-data tyder på att CYP-medierade biotransformationsreaktioner kan vara av mindre betydelse för levonorgestrel jämfört med reduktion och konjugering.
Elimination
Totalt clearance för levonorgestrel i plasma är ca 1,0 ml/min/kg. Endast spårmängder av levonorgestrel utsöndras i oförändrad form. Metaboliterna utsöndras i feces och urinen i ett förhållande på ca 1. Utsöndringens halveringstid är ca 1 dygn.
Linjäritet/icke-linjäritet
Farmakokinetiken för levonorgestrel är beroende på koncentrationen av SHBG, som i sin tur påverkas av östrogener och androgener. En minskning av koncentrationen av SHBG leder till en minskning av den totala koncentrationen levonorgestrel i serum, detta tyder på en icke-linjär farmakokinetik för levonorgestrel med avseende på tiden. Eftersom Jaydess huvudsakligen verkar lokalt, förväntas effekten av Jaydess inte påverkas.
Barn och ungdomar
I en ettårig fas III-studie med unga kvinnor efter menarche (genomsnittlig ålder 16,2 år, i intervallet 12-18 år) visade famakokinetiska analyser hos 283 ungdomar att beräknade LNG-koncentrationer i serum är något högre (ca. 10%) hos ungdomar jämfört med vuxna. Detta korrelerar med en generellt lägre kroppsvikt hos ungdomar. De beräknade värdena för ungdomar ligger dock inom samma intervall som för vuxna, vilket visar på stor likhet.
Inga skillnader i farmakokinetiken för levonorgestrel förväntas mellan ungdomar och vuxna efter insättning av Jaydess.
Etniska skillnader
En treårig fas III-studie med Jaydess har genomförts i Asien-Stillahavsområdet (93 % asiatiska kvinnor, 7 % andra etniska grupper). En jämförelse i denna studie av de farmakokinetiska egenskaperna hos levonorgestrel mellan den asiatiska populationen respektive den kaukasiska populationen från en annan fas III-studie visade ingen kliniskt relevant skillnad i systemisk exponering och andra farmakokinetiska parametrar. Dessutom var den dagliga frisättningshastigheten av Jaydess densamma i båda befolkningsgrupperna.
Inga skillnader i farmakokinetiken för levonorgestrel förväntas mellan kaukasiska och asiatiska kvinnor efter insättning av Jaydess.
Prekliniska uppgifter
Prekliniska data visade inga särskilda risker för människa baserat på studier av levonorgestrels säkerhetsfarmakologi, farmakokinetik och toxicitet, inklusive genotoxicitet och carcinogena potential. Studier på apa med intrauterin tillförsel av levonorgestrel under 9 till 12 månader bekräftade lokal farmakologisk aktivitet med god lokal tolerans utan tecken på systemisk toxicitet. Ingen embryotoxicitet observerades hos kanin efter intrauterin tillförsel av levonorgestrel. Säkerhetsutvärderingen för elastomer-komponenterna i hormonbehållaren, polyetenmaterialet samt silverringen i produkten, silverprofilen och kombinationen av elastomer och levonorgstrel är baserad på både en utvärdering av genetisk toxikologi generellt med in vitro- och in vivo-tester och på biokompatibilitetstester på mus, råtta, marsvin och kanin och in vitro-system har inte påvisat någon biologisk inkompatibilitet.
Innehåll
Det intrauterina inlägget innehåller 13,5 mg levonorgestrel.
För information om frisättningshastigheter, se avsnitt Farmakokinetik.
Polydimetylsiloxan elastomer, kiseldioxid kolloidal vattenfri, polyeten, bariumsulfat, järnoxid svart (E172), silver
Miljöpåverkan
Levonorgestrel
Miljörisk:
Användning av levonorgestrel har bedömts medföra hög risk för miljöpåverkan.
Nedbrytning:
Levonorgestrel är potentiellt persistent.
Bioackumulering:
Levonorgestrel har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R) = 0.0013 μg/L
Where:
A = 9.36 kg (total sold amount API in Sweden year 2021, data from IQVIA / LIF)
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 if no data is available
P = number of inhabitants in Sweden = 10 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Reference I)
D = factor for dilution of wastewater by surface water flow = 10 (ECHA default) (Reference I)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies*
Algae (green algae, Desmodesmus subspicatus):
NOEC 72 hours (growth rate) = 5.6 μg/L, ErC50 72 hours (growth rate) = 25.3 μg/L. Guideline OECD 201. (Reference II)
Crustacean (waterflea, Daphnia magna):
Chronic toxicity
NOEC 21 days (reproduction) ≥ 752 μg/L. Guideline OECD 211. (Reference III)
Fish (fathead minnow, Pimephales promelas):
Chronic toxicity
EC10 21 days (reproduction) = 0.00001 μg/L. Guideline OECD 229. (Reference IV)
Fish (zebrafish, Danio rerio):
Chronic toxicity
NOEC 126 days (reproduction) = 0.00016 μg/L. Guideline OECD 210. (Reference V)
The PNEC was calculated by division of the lowest effect level (NOEC) of the fish full life cycle study considering an appropriate assessment factor (AF). The most sensitive taxonomic group were fish, and the lowest relevant effect level was reported as EC10 = 0.00016 µg/L. The regulatory default standard AF of 10 was used, which is applicable when there are chronic aquatic toxicity studies representing the three trophic levels (algae, crustaceans, and fish).
PNEC = 0.00016 µg/L / 10 = 0.000016 µg/L
Environmental risk classification (PEC/PNEC ratio)
The risk quotient PEC/PNEC was calculated with 0.0013 µg/L / 0.000016 µg/L = 81.3.
Justification of chosen environmental risk phrase:
A risk quotient above 10 qualifies for the phrase “Use of levonorgestrel has been considered to result in high environmental risk.”
Degradation
Biotic degradation
Ready degradability:
Levonorgestrel was also studied for aerobic biodegradability in water in a manometric respiration test according to guideline OECD 301F. The test item was introduced
into the test system at a concentration of 200 mg/L as theoretically oxidizable carbon.
The study reported 0 % biodegradation of levonorgestrel in 28 days. Guideline OECD 301F. (Reference VI)
Simulation studies:
A study on transformation in aquatic/sediment systems according to test guideline OECD 308 was conducted. The transformation of [14C] levonorgestrel in sediments and natural water was assessed in two different aerobic sediment/water systems. Levonorgestrel was incubated in glass vessels containing sediment and overlaying water over 100 days.
The entire sediment sample was extracted first with acetonitrile, afterwards with acetonitrile/water, 70/30, v/v and acetonitrile/water/HCl, 70/30/5, v/v/v until the last extract contained ≤ 5% of the applied radioactivity. The samples were shaken for 5 minutes and thereafter centrifuged for 5 minutes at 2000 rpm. The supernatant was transferred into a graduated cylinder. In cases where a phase separation was observed, portions of 20 mL of Milli- Q water were added to the extracts until no separation was visible anymore. The total volume was recorded and duplicate 1 mL aliquots were measured by LSC for radioactivity.
The results of the study indicate that levonorgestrel is distributed to the sediment compartment, however, relevant amounts remained in the water phase (22 and 43 % for the fine and coarse sediment, respectively). The degradation rate was 6-7 % at the end of the incubation period. The DT50 (disappearance half-life from the water phase) for parent compound in water was estimated with 2.5 and 3.2 days for the fine and coarse sediment, respectively.
This study reported a half-life of levonorgestrel in water DT50 = 2-5-3.2 days while the DT50 in sediment/total system could not be determined and the substance is considered potentially persistent in the environment. Guideline OECD 308. (Reference VII)
Abiotic degradation
Hydrolysis:
Levonorgestrel was reported to be resistant to hydrolysis at pH 5, 7, and 9 and 25 °C. Guideline FDA TAD 3.09. (Reference VIII)
Justification of chosen degradation phrase:
Levonorgestrel established a DT50 > 120 d for the total system and is resistant to hydrolysis, which qualifies for the phrase “Levonorgestrel is potentially persistent.”
Bioaccumulation
Partitioning coefficient:
The log Dow was reported as 3.55. Guideline FDA TAD 3.02. (Reference IX)
Bioconcentration factor (BCF):
Fish (bluegill sunfish Lepomis macrochirus) were exposed in two treatment groups to 14C-labeled levonorgestrel for 28 days followed by a depuration phase of 14 days. The mean measured concentration of levonorgestrel (based on 14C analysis) was 6.1 and 42.1 ng/L for the low and high concentration, respectively, during the exposure phase. The concentration of 14C in fish tissue decreased rapidly during the exposure phase most likely due to increased metabolization and subsequent rapid excretion. The BCFss (bioconcentration factor at steady state) was 250 and 119 for group 2 and 3, respectively. Normalized to a standard lipid content of 5 % the BCFss calculated as 192 and 92 for group 2 and 3, respectively. Guideline OECD 305. (Reference X)
Other data
Justification of chosen bioaccumulation phrase:
As the log Dow was < 4 and/or BCF < 500 levonorgestrel is not considered bioaccumulative which qualifies for the phrase “Levonorgestrel has low potential for bioaccumulation.”
Excretion (metabolism)
Systemically available levonorgestrel is mainly excreted in the hydroxylated and to a lesser extent, in a conjugated form. Only a small fraction is released unchanged. (Reference XI)
References
-
Guidance on information requirements and Chemical Safety Assessment Chapter R.16: Environmental exposure assessment. V3.0, Feb. 2016.
-
Growth inhibition test of levonorgestrel (BAY 86-5028) on the green algae Desmodesmus subspicatus. Nonclinical Drug Safety, Bayer Pharma AG, study no. TOXT2082435, report no. A52865.
-
Reproduction study of levonorgestrel (ZK18206) in Daphnia magna. Nonclinical Drug Safety, Bayer Pharma AG, study no. TOXT6081124, report no. A49686.
-
Short-term reproduction tests with levonorgestrel (ZK 18206) on the fathead minnow (Pimephales promelas). Nonclinical Drug Safety, Bayer Schering Pharma AG, study no TOXT4078685, report no. A39905.
-
Zebrafish (Danio rerio) Partial life stage test, Flow through conditions. Drug Discovery, Bayer AG, study no. T103549-2, report no. R-12907.
-
Study on the biodegradability of Levonorgestrel (ZK 18206) in the manometric respiration test. Nonclinical Drug Safety, Bayer Schering Pharma AG, study no. TOXT2082138, report no. A51399.
-
Levonorgestrel (BAY 86-5028): Aerobic Transformation in Aquatic Sediment Systems. Nonclinical Drug Safety, Bayer Healthcare AG, study no.T5081646EXT, report no. A56339.
-
Levonorgestrel, ZK18206, Report on physicochemical properties, Rate of hydrolysis. General Physical Chemistry, Schering AG, study no. APC 94/158, report no. LD06EY10.
-
The octanol/water partition coefficient of levonorgestrel (ZK18206). General Physical Chemistry, Schering AG, study no. APC 93/103a, report no. LD16.
-
Bioconcentration flow-through fish test with levonorgestrel [BAY 86-5028 (14-C)], Nonclinical Drug Safety, Bayer HealthCare AG, study no. TOXT9082441, report no. A53418.
-
Stancyk, F., Roy, S.: Metabolism of levonorgestrel, norethindrone, and structurally related contraceptive steroids. Contraception 42, 67-96.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda anvisningar för destruktion
Produkten levereras i en steril förpackning som inte får öppnas förrän Jaydess ska sättas in. Varje inlägg ska hanteras under aseptiska förhållanden. Om förseglingen av det sterila kuvertet bryts ska inlägget kasseras i enlighet med lokala riktlinjer för hantering av biologiskt avfall. Likaså ska en uttagen Jaydess och införaren kasseras på samma sätt. Den yttre förpackningen och den inre blisterförpackningen kan hanteras som hushållsavfall.
Ska insättas av behörig sjukvårdspersonal med aseptisk teknik (se avsnitt Dosering och administreringssätt).
Förpackningsinformation
Intrauterint inlägg 13,5 mg
Inlägget består av en vitaktig eller svagt gul läkemedelskärna som omges av ett halvgenomskinligt membran. Den är fastsatt på ett T-format plastskelett med en silverring. Bruna uttagstrådar.
1 styck blister, 923:60, F, Övriga förskrivare: barnmorska






