Indikationer
VISTABEL används för tillfällig förbättring av:
-
måttliga till uttalade vertikala rynkor mellan ögonbrynen som uppkommer vid maximal rynkning av pannan (glabellaveck) och/eller
-
måttliga till uttalade rynkor i ögats utkanter som uppkommer vid maximalt leende (kråksparkar/skrattrynkor) och/eller
-
måttliga till uttalade pannrynkor som uppkommer vid maximalt höjda ögonbryn, då ansiktsrynkornas omfattning har en betydande psykologisk påverkan på vuxna patienter.
Kontraindikationer
VISTABEL är kontraindicerat:
-
vid känd överkänslighet mot botulinumtoxin typ A eller mot något hjälpämne
-
vid myasthenia gravis eller Eaton-Lamberts syndrom
-
vid infektion vid det planerade injektionsstället
Dosering
Dosering
Läs de specifika rekommendationerna för varje indikation som beskrivs nedan.
Botulinumtoxin-enheter är inte utbytbara från en produkt till en annan. Rekommenderade doser i Allergan-enheter skiljer sig från andra botulinumtoxin-produkter.
Äldre patienter
Det finns begränsade data från kliniska fas 3-studier med VISTABEL till patienter över 65 år (se Farmakodynamik). Ingen speciell dosjustering är nödvändig för användning hos äldre.
Pediatrisk population
Säkerhet och effekt för VISTABEL vid behandling av glabellaveck som uppkommer vid maximal rynkning av pannan och kråksparkar som uppkommer vid maximalt leende eller pannrynkor som uppkommer vid maximalt höjda ögonbryn har inte visats hos personer under 18 år. Användning av VISTABEL rekommenderas inte till personer under 18 år (se Varningar och försiktighet).
Administreringssätt
VISTABEL ska endast ges av de läkare som har särskild kompetens och kunskap om behandlingen och användning av erforderlig utrustning.
Efter beredning får VISTABEL endast användas till ett behandlingstillfälle per patient. Överbliven oanvänd produkt ska destrueras enligt beskrivningen i avsnitt Hållbarhet, förvaring och hantering. Särskilda försiktighetsåtgärder bör vidtas vid såväl beredning och administrering som vid inaktivering och destruktion av återstående oanvänd lösning (se avsnitt Varningar och försiktighet och Hållbarhet, förvaring och hantering).
Rekommenderad injektionsvolym för varje injektion i muskulatur är 0,1 ml. Se även utspädningstabell under Hållbarhet, förvaring och hantering.
För anvisningar om användning, hantering och destruktion av flaskor, se Hållbarhet, förvaring och hantering.
Försiktighet bör iakttas så att VISTABEL inte injiceras i ett blodkärl då det injiceras i de vertikala rynkorna mellan ögonbrynen som uppkommer vid maximal rynkning av pannan, (även kallade ”glabellaveck”), i rynkor i ögats utkanter som uppkommer vid maximalt leende (även kallade ”kråksparkar”) eller i pannrynkor som uppkommer vid maximalt höjda ögonbryn, se avsnitt Varningar och försiktighet.
Behandlingen skall inte ges oftare än var tredje månad.
Administreringsanvisningar för glabellaveck som uppkommer vid maximal rynkning av pannan:
Färdigberedd VISTABEL (50 enheter/1,25 ml eller 100 enheter/2,5 ml) injiceras med en steril 30 gauge-nål. 0,1 ml (4 enheter) administreras på vart och ett av de fem injektionsställena (se bild 1): två i vardera korrugatormuskeln och en i procerusmuskeln, vilket ger en totaldos på 20 enheter.
Före injektion placera tummen eller pekfingret med ett fast tryck under kanten av ögonhålan för att undvika extravasering under kanten. Nålen skall riktas uppåt och mot medellinjen under injektionen. För att minska risken för ögonlocksptos får den högsta dosen på 4 enheter för varje injektionsställe samt antalet injektionsställen inte överskridas. Dessutom ska injektioner nära levator palpebrae superior undvikas, särskilt hos patienter med stora muskler som sänker ögonbrynen (depressor supercilii). Injektioner i korrugatormuskeln ska placeras centralt i muskeln, med ett avstånd på minst 1 cm ovanför ögonbrynsbågarna.
Bild 1:
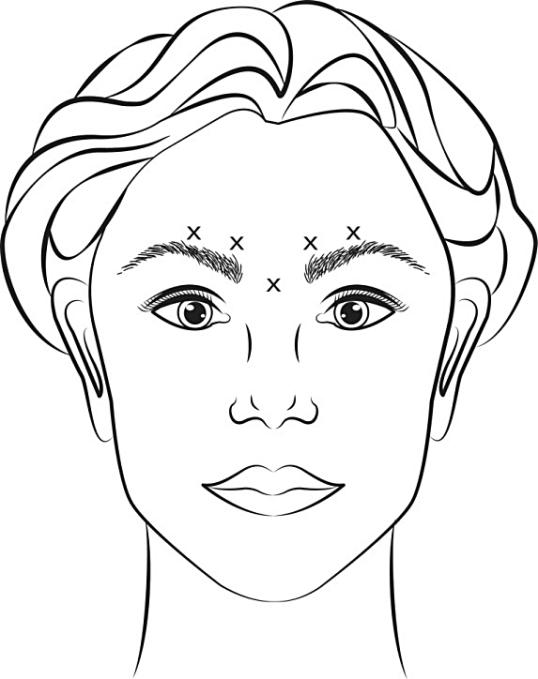
Förbättring av glabellaveck som uppkommer vid maximal rynkning av pannan sker vanligen inom en vecka efter behandlingen. Effekten har visat sig kvarstå upp till fyra månader efter injektionen.
Administreringsanvisningar för kråksparkar som uppkommer vid maximalt leende:
Färdigberedd VISTABEL (50 enheter/1,25 ml eller 100 enheter/2,5 ml) injiceras med en steril 30 gauge-nål. 0,1 ml (4 enheter) administreras på vart och ett av de tre injektionsställena (totalt 6 injektionsställen) i ögats laterala ringmuskel (m. orbicularis oculi), vilket ger en totaldos på 24 enheter i en totalvolym på 0,6 ml (12 enheter per sida).
För att minska risken för ögonlocksptos får den högsta dosen på 4 enheter för varje injektionsställe samt antalet injektionsställen inte överskridas. Dessutom ska injektionerna göras temporalt om den orbitala kanten så att ett säkerhetsavstånd från den muskel som kontrollerar höjning av ögonlocket upprättbehålls.
Injektioner ska ges med nålspetsen vinklad uppåt och riktad bort från ögat. Den första injektionen (A) ska göras cirka 1,5 till 2,0 cm temporalt om laterala kantus och precis temporalt om ögonhålans kant. Om rynkorna i kråksparksområdet befinner sig ovanför och under laterala kantus, ska injektionen placeras enligt bild 2. Om rynkorna i kråksparksområdet däremot främst befinner sig under laterala kantus ska injektionen placeras enligt bild 3.
|
Bild 2: 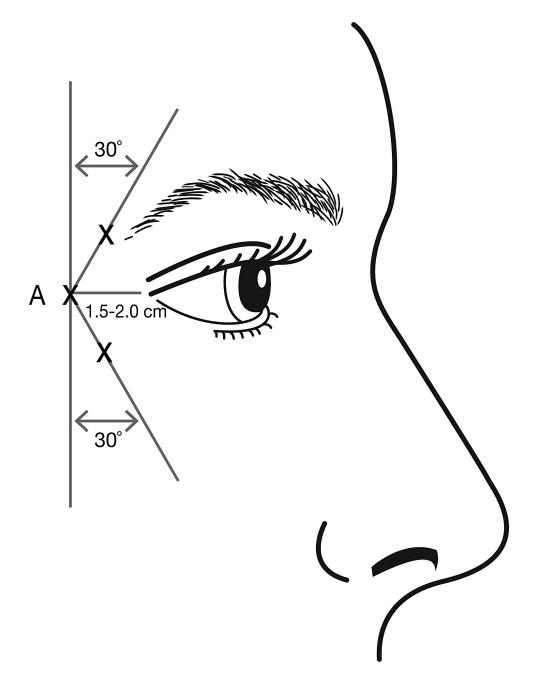
|
Bild 3: 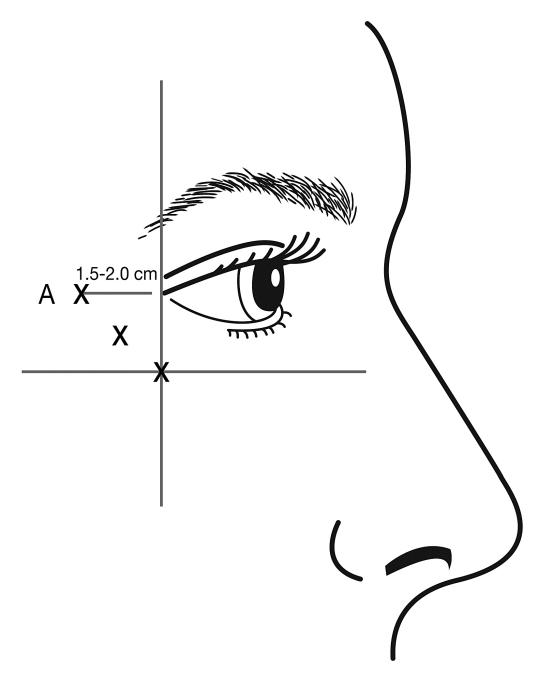
|
För samtidig behandling av glabellaveck som uppkommer vid maximal rynkning av pannan är dosen 24 enheter för kråksparkar som uppkommer vid maximalt leende och 20 enheter för glabellaveck (se Administeringsanvisningar för glabellaveck samt bild 1), vilket ger en totaldos på 44 enheter i en totalvolym på 1,1 ml.
Enligt de kliniska prövarnas bedömning sågs en förbättring av rynkdjupet i kråksparkar som uppkommer vid maximalt leende inom en vecka efter behandlingen. Medianvärdet för hur länge effekten efter injektion kvarstod var fyra månader.
Administreringsanvisningar för pannrynkor som uppkommer vid maximalt höjda ögonbryn:
Färdigberedd VISTABEL (50 enheter/1,25 ml eller 100 enheter/2,5 ml) injiceras med en steril 30 gauge-nål. 0,1 ml (4 enheter) administreras på vart och ett av de fem injektionsställena i frontalismuskeln, vilket ger en totaldos på 20 enheter i en totalvolym på 0,5 ml (se bild 4).
Den totala dosen vid behandling av pannrynkor (20 enheter) i samband med glabellaveck (20 enheter) är 40 enheter/1,0 ml.
För att lokalisera lämpliga injektionsställen i frontalismuskeln måste en bedömning göras av storleken på patientens panna i förhållande till hur frontalismuskelns aktivitet fördelas.
Följande horisontella behandlingsrader lokaliseras genom lätt palpation av pannan i vila och vid maximal höjning av ögonbrynen:
-
Övre gräns för frontalismuskelns aktivitet: cirka 1 cm ovanför det översta pannvecket.
-
Undre behandlingsrad: mittemellan den övre gränsen för frontalismuskelns aktivitet och ögonbrynet, minst 2 cm ovanför ögonbrynet.
-
Övre behandlingsrad: mittemellan den övre gränsen för frontalismuskelns aktivitet och den undre behandlingsraden
De 5 injektionerna ges i skärningspunkterna mellan de horisontella behandlingsraderna och följande vertikala orienteringspunkter:
-
På den undre behandlingsraden vid ansiktets mittlinje, och 0,5 - 1,5 cm medialt om den palperade linea temporalis; upprepa på andra sidan.
-
På den övre behandlingsraden mittemellan den laterala och den mediala punkten på den undre behandlingsraden; upprepa på andra sidan.
Bild 4:
Förbättring av pannrynkor som uppkommer vid maximal höjning av ögonbrynen sker vanligen inom en vecka efter behandlingen. Effekten har visat sig kvarstå upp till 4 månader efter injektionen.
För samtidig behandling tillsammans med glabellaveck och kråksparkar är den totala dosen 64 enheter bestående av 20 enheter för pannrynkor, 20 enheter för glabellaveck (se Administreringsanvisningar för glabellaveck samt bild 1) och 24 enheter för kråksparkar (se Administreringsanvisningar för kråksparkar samt bilderna 2 och 3).
Allmän information
Vid behandlingssvikt efter den första behandlingen, det vill säga att det inte skett betydande förbättring jämfört med utgångsläget en månad efter injektionen, bör följande åtgärder vidtagas:
-
Analys av orsakerna till misslyckandet, t.ex. injektion i fel muskler, dålig injektionsteknik, bildande av toxinneutraliserande antikroppar, otillräcklig dos
-
Förnyad bedömning av lämpligheten att behandla med botulinumtoxin typ A
Om inga oönskade sekundära effekter av den första behandlingsomgången uppstod kan en andra behandlingsomgång inledas. Det ska vara minst tre månaders mellanrum mellan de två behandlingsomgångarna.
I händelse av en otillräcklig dos vid behandling av glabellaveck som uppkommer vid maximal rynkning av pannan kan en andra behandling inledas genom att justera den totala dosen upp till 40 eller 50 enheter. Hänsyn ska tas till analys av tidigare misslyckad behandling.
Effektiviteten och säkerheten vid upprepade injektioner av VISTABEL utöver 12 månader har inte utvärderats.
Varningar och försiktighet
Särskilda försiktighetsåtgärder bör vidtas vid såväl beredning och administrering som vid inaktivering och destruktion av återstående oanvänd lösning (se avsnitt Dosering och Hållbarhet, förvaring och hantering).
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per injektionsflaska, d.v.s. är näst intill ”natriumfritt”.
Den aktuella anatomin och varje ändring av anatomin genom tidigare kirurgiska ingrepp, måste vara känd före administrering av VISTABEL och injektion i känsliga anatomiska strukturer ska undvikas.
Rekommenderad dos och administreringsfrekvens för VISTABEL bör inte överskridas.
I sällsynta fall kan en anafylaktisk reaktion förekomma efter injektion av botulinumtoxin. Adrenalin eller andra åtgärder mot anafylaktiska reaktioner ska därför finnas tillgängliga.
Patienter med okända neuromuskulära störningar kan ha en ökad risk för kliniskt signifikanta systemiska effekter inklusive svår dysfagi och andningspåverkan vid normala doser av botulinumtoxin typ A. I några av dessa fall har dysfagi varat i flera månader och krävt insättning av sondmatning (se avsnitt Kontraindikationer).
Försiktighet bör även iakttas när VISTABEL används vid behandling av patienter med amyotrofisk lateralskleros (ALS) eller med perifera neuromuskulära störningar.
Biverkningar som möjligen har ett samband med spridning av toxin från administreringsstället har rapporterats i mycket sällsynta fall med botulinumtoxin (se avsnitt Biverkningar). Patienter som behandlas med terapeutiska doser kan uppleva en påtaglig muskelsvaghet. Svälj- och andningssvårigheter är allvarliga och kan ha dödlig utgång. Injektion med VISTABEL rekommenderas inte till patienter med dysfagi och aspiration i anamnesen.
Patienter eller vårdgivare ska rådas att omedelbart söka läkarvård om sväljningssvårigheter, tal- eller andningssvårigheter uppträder.
Alltför överdriven eller onormalt hög dosering kan öka risken för antikroppsbildning. Antikroppsbildning kan leda till att behandling med botulinumtoxin typ A misslyckas även för andra indikationer.
Som vid alla typer av injektionsprocedurer har injektionen förknippats med lokal smärta, inflammation, parestesi, hypoestesi, ömhet, svullnad/ödem, erytem, lokal infektion, blödning och/eller blåmärken. Nålrelaterad smärta och/eller oro kan resultera i vasovagal respons, inklusive övergående symtomatisk hypotension och synkopé.
Försiktighet bör iakttas om VISTABEL används på ett injektionsställe med pågående inflammation eller när uttalad svaghet eller atrofi föreligger i den utvalda muskeln.
Försiktighet bör iakttas för att se till att VISTABEL inte injiceras i ett blodkärl när det injiceras i glabellavecken som uppkommer vid maximal rynkning av pannan, i kråksparkarna som uppkommer vid maximalt leende eller i pannrynkorna som uppkommer vid maximalt höjda ögonbryn, se avsnitt Dosering.
Det finns en risk för ögonlocksptos efter behandling. Se avsnitt Dosering för administreringsanvisningar om hur denna risk minimeras.
Användning av VISTABEL rekommenderas inte till individer under 18 år. Det finns begränsade data från kliniska fas 3-studier med VISTABEL till patienter över 65 år.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Teoretiskt kan effekten av botulinumtoxin potentieras av aminoglykosidantibiotika eller spektinomycin, eller andra läkemedel som interfererar med neuromuskulär överföring (t.ex. neuromuskulärt blockerande medel).
Effekten av samtidig administrering, eller administrering inom flera månader efter varandra, av olika serotyper botulinumneurotoxin är okänd. Överdriven neuromuskulär svaghet kan förvärras genom administrering av ett annat botulinumtoxin innan effekten av den tidigare dosen botulinumtoxin avklingat.
Inga särskilda tester har utförts för att ta reda på om preparatet kliniskt interagerar med andra läkemedel. Inga andra interaktioner av klinisk betydelse har rapporterats för denna indikation.
Graviditet
Det finns inte tillräckliga data över användning av botulinumtoxin typ A till gravida kvinnor. Djurstudier har visat reproduktionstoxicitet (se avsnitt Prekliniska uppgifter). Den potentiella risken för människa är okänd. Användning av VISTABEL rekommenderas inte under graviditet och till kvinnor i fertil ålder som inte använder preventivmedel.
Amning
Det finns ingen information om huruvida VISTABEL passerar över i bröstmjölk. Användning av VISTABEL under amningsperioden kan inte rekommenderas.
Fertilitet
Det finns inte tillräckliga data om effekter på fertilitet vid användning av botulinumtoxin typ A hos kvinnor i fertil ålder. Studier i han- och honråttor har visat minskad fertilitet (se Prekliniska uppgifter).
Trafik
Inga studier av effekterna på förmågan att framföra fordon och använda maskiner har utförts. VISTABEL kan dock orsaka asteni, muskelsvaghet, yrsel och synstörningar, vilket skulle kunna påverka körförmågan och användning av maskiner.
Biverkningar
a) Allmänt
I kontrollerade kliniska studier av glabellaveck som uppkommer vid maximal rynkning av pannan rapporterades biverkningar som ansågs vara relaterade till VISTABEL av kliniska prövare hos 23,5 % av patienterna (placebo: 19,2 %). Under behandlingscykel 1 i de pivotala kontrollerade kliniska studierna av kråksparkar som uppkommer vid maximalt leende, rapporterades biverkningar hos 7,6 % (som behandlades med 24 enheter enbart för kråksparkar) och hos 6,2 % (som behandlades med 44 enheter: 24 enheter för kråksparkar samtidigt som 20 enheter för glabellaveck) av patienterna jämfört med 4,5 % för placebo.
Under behandlingscykel 1 i kliniska studier av pannrynkor som uppkommer vid maximalt höjda ögonbryn, rapporterades biverkningar som ansågs vara relaterade till VISTABEL hos 20,6 % av patienterna som behandlats med 40 enheter (20 enheter i pannan och 20 enheter i glabellaområdet), och hos 14,3 % av patienterna som behandlats med 64 enheter (20 enheter i pannan med 20 enheter i glabellaområdet samt 24 enheter i kråksparksområdena), jämfört med 8,9 % av patienterna som fick placebo.
Biverkningarna kan bero på själva behandlingen, injektionstekniken eller båda delar. I allmänhet uppträder biverkningar inom de första dagarna efter en injektion och är av övergående art. De flesta biverkningar som rapporterats har varit av mild eller måttlig svårighetsgrad.
Den förväntade farmakologiska effekten av botulinumtoxin är lokal muskelsvaghet. Svaghet hos närliggande muskler och/eller muskler avlägset från injektionsstället har emellertid rapporterats. Blefaroptos, som kan ha ett samband med injektionsteknik, är förenlig med den farmakologiska verkan för VISTABEL. Som kan förväntas vid alla typer av injektioner kan själva sticket medföra smärta/en brännande eller stickande känsla, svullnad och/eller blåmärken. Feber och influensasymtom har också rapporterats efter injektion av botulinumtoxin.
b) Biverkningar - frekvens
Biverkningarna är klassificerade enligt systemorganklass och frekvens och definieras enligt följande: Mycket vanliga (≥ 1/10), Vanliga (≥1/100, <1/10), Mindre vanliga (≥1/1 000, <1/100), Sällsynta (≥1/10 000, <1/1 000), Mycket sällsynta (<1/10 000).
Glabellaveck
Följande biverkningar rapporterades i de dubbelblinda, placebokontrollerade kliniska studierna efter injektion med VISTABEL 20 enheter enbart för glabellaveck:
|
Systemorganklass |
Biverkan |
Frekvens |
|---|---|---|
|
Infektioner och infestationer |
Infektion |
Mindre vanliga |
|
Psykiska störningar |
Oro |
Mindre vanliga |
|
Centrala och perifera nervsystemet |
Huvudvärk, parestesi |
Vanliga |
|
Yrsel |
Mindre vanliga |
|
|
Ögon |
Ögonlocksptos |
Vanliga |
|
Blefarit, ögonsmärta, synrubbningar (inklusive dimsyn) |
Mindre vanliga |
|
|
Magtarmkanalen |
Illamående |
Vanliga |
|
Muntorrhet |
Mindre vanliga |
|
|
Hud och subkutan vävnad |
Erytem, stramande hud |
Vanliga |
|
Ödem (ansikte, ögonlock, kring ögonhålorna), ljuskänslighetsreaktioner, pruritus, torr hud |
Mindre vanliga |
|
|
Muskuloskeletala systemet och bindväv |
Lokal muskelförsvagning |
Vanliga |
|
Muskelryckningar, Mefisto-tecken (lateral höjning av ögonbryn) |
Mindre vanliga |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Smärta i ansiktet, ödem vid injektionsstället, ekkymos, smärta vid injektionsstället, irritation vid injektionsstället |
Vanliga |
|
Influensasymptom, asteni, feber |
Mindre vanliga |
Kråksparkar med eller utan glabellaveck
Följande biverkningar rapporterades i de dubbelblinda, placebokontrollerade kliniska studierna efter injektion med VISTABEL för kråksparkar med eller utan glabellaveck:
|
Systemorganklass |
Biverkan |
Frekvens |
|---|---|---|
|
Ögon |
Ögonlocksödem |
Mindre vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Hematom vid injektionsstället* |
Vanliga |
|
Blödning vid injektionsstället* |
Mindre vanliga |
|
|
Smärta vid injektionsstället* |
Mindre vanliga |
|
|
Parestesi vid injektionsstället |
Mindre vanliga |
*procedurrelaterade biverkningar
Pannrynkor och glabellaveck med eller utan kråksparkar
Följande biverkningar rapporterades i de dubbelblinda, placebokontrollerade kliniska studierna efter injektion med VISTABEL för samtidig behandling av pannrynkor och glabellaveck med eller utan kråksparkar:
|
Systemorganklass |
Biverkan |
Frekvens |
|---|---|---|
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanliga |
|
Ögon |
Ögonlocksptos1 |
Vanliga |
|
Hud och subkutan vävnad |
Stramande hud |
Vanliga |
|
Ögonbrynsptos2 |
Vanliga |
|
|
Muskuloskeletala systemet och bindväv |
Mefisto-tecken (lateral höjning av ögonbryn) |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Blåmärke vid injektionsstället* |
Vanliga |
|
Hematom vid injektionsstället* |
Vanliga |
|
|
Smärta vid injektionsstället* |
Mindre vanliga |
1Mediantiden till utveckling av ögonlocksptos var 9 dagar efter behandling
2Mediantiden till utveckling av ögonbrynsptos var 5 dagar efter behandling
*procedurrelaterade biverkningar
Ingen förändring av den totala säkerhetsprofilen sågs efter upprepad dosering.
c) Information tillkommen efter att läkemedlet börjat marknadsföras (ingen känd frekvens)
Följande biverkningar och medicinskt relevanta oönskade händelser har rapporterats sedan läkemedlet började marknadsföras för behandling av glabellaveck, kråksparkar och andra kliniska indikationer:
|
Systemorganklass |
Biverkan |
|---|---|
|
Immunsystemet |
Anafylaxi, angioödem, serumsjuka, urtikaria |
|
Metabolism och nutrition |
Anorexi |
|
Centrala och perifera nervsystemet |
Brakial plexopati, dysfoni, dysartri, facialispares, hypoestesi, muskelsvaghet, myasthenia gravis, perifer neuropati, parestesi, radikulopati, synkope, ansiktsförlamning |
|
Ögon |
Trångvinkelglaukom (för behandling av blefarospasm), ögonlocksptos, lagoftalmi, strabism, dimsyn, synstörningar, torra ögon, ögonlocksödem |
|
Öron och balansorgan |
Hypoakusi, tinnitus, vertigo |
|
Andningsvägar, bröstkorg och mediastinum |
Aspirationspneumoni, dyspné, bronkospasm, andningsdepression, andningsstillestånd |
|
Magtarmkanalen |
Buksmärta, diarré, muntorrhet, dysfagi, illamående och kräkningar |
|
Hud och subkutan vävnad |
Alopeci, ögonbrynsptos, psoriasisliknande dermatit, erythema multiforme, hyperhidros, madarosis, pruritus, utslag |
|
Muskuloskeletala systemet och bindväv |
Muskelsvaghet, myalgi, lokala muskelryckningar/ofrivilliga muskelsammandragningar |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Denervering/atrofi, sjukdomskänsla, pyrexi |
Biverkningar som möjligen har ett samband med spridning av toxin från administreringsstället har rapporterats i mycket sällsynta fall med botulinumtoxin (t.ex. muskelsvaghet, dysfagi, förstoppning eller aspirationspneumoni, som kan ha dödlig utgång) (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Överdosering av VISTABEL är en relativ term och är beroende av dos, injektionsställe och underliggande vävnadsegenskaper. Inga fall av systemisk toxicitet som ett resultat av oavsiktlig injektion av botulinumtoxin typ A har rapporterats. Överskridande doser kan ge lokal eller avlägsen, generell och uttalad paralys. Det har inte rapporterats några fall av intag (förtäring) av botulinumtoxin typ A.
Tecken på överdosering visar sig inte direkt efter injektionen. Om oavsiktlig injektion eller intag av preparatet skett bör patienten hållas under klinisk uppsikt i åtskilliga dagar för att upptäcka tecken och symptom på allmän svaghet eller muskelförlamning. För patienter som uppvisar symptom på botulinumtoxin typ A-förgiftning (allmän svaghet, ptos, diplopi, svårigheter att svälja och talrubbningar, eller pares av andningsmuskulaturen) bör inläggning på sjukhus övervägas.
Farmakodynamik
Botulinumtoxin typ A (Clostridium botulinum neurotoxin) blockerar perifer acetylkolinfrisättning vid presynaptiska kolinerga nervterminaler genom att klyva SNAP-25, ett protein nödvändigt för lyckad dockning och frisättning av acetylkolin från vesikler belägna inom nervändsluten. Detta leder till denervation av muskeln och således till förlamning.
Efter injektionen sker initialt en snabb bindning med hög affinitet av toxin till speciella receptorer på cellens yta. Detta följs av transport av toxinet genom plasmamembranet med hjälp av receptormedierad endocytos. Slutligen frigörs toxinet i cytosolen. Denna senare process åtföljs av progressiv blockering av acetylkolinfrisättningen. Klinisk effekt visar sig inom 2-3 dagar, med maximal effekt inom 5-6 veckor efter injektionen.
Återgång till normal impulsöverföring sker vanligen inom 12 veckor efter injektionen när nervterminalerna återigen får kontakt med muskeländplattorna.
Kliniska data:
Glabellaveck
537 patienter med måttliga till uttalade glabellaveck som uppkommer vid maximal rynkning av pannan har inkluderats i de kliniska studierna.
Injektioner med VISTABEL reducerade betydligt glabellaveckens djup i upp till fyra månader, mätt genom ansvarig prövares bedömning av glabellaveckens djup vid maximal rynkning av pannan och genom patientens egen bedömning av förändring av hans/hennes glabellaveck som uppkommer vid maximal rynkning av pannan. Inte i någon av de kliniska studierna ingick en objektiv bedömning av den psykologiska betydelsen. Trettio dagar efter injektionen uppskattade prövarna att 80 % (325/405) av patienterna som behandlats med VISTABEL hade svarat på behandlingen (inga eller svagt synliga rynkor vid maximal rynkning av pannan), jämfört med 3 % (4/132) av de patienter som fått placebo. Vid samma tidpunkt ansåg 89 % (362/405) av patienterna som behandlats med VISTABEL att det hade skett en måttlig eller större förbättring, jämfört med 7 % (9/132) av de patienter som erhållit placebo.
VISTABEL-injektioner minskade också väsentligt glabellavecken i vila. Av de 537 patienter som deltog hade 39 % (210/537) måttliga till djupa glabellaveck mellan ögonbrynen vid vila (15 % hade inga rynkor vid vila). Av dessa uppskattades 74 % (119/161) av patienterna som behandlats med VISTABEL ha svarat på behandlingen (inga eller lätta rynkor) trettio dagar efter injektionen, jämfört med 20 % (10/49) av de patienter som fått placebo.
Det finns begränsade data från kliniska fas 3-studier med VISTABEL till patienter över 65 år. Endast 6,0 % (32/537) av patienterna var över 65 år och uppnådd effekt var lägre i denna population.
Kråksparkar
1362 patienter med måttliga till uttalade kråksparkar som uppkommer vid maximalt leende, antingen enbart (N=445, studie 191622 098) eller även med måttliga till uttalande glabellaveck som uppkommer vid maximal rynkning av pannan (N=917, studie 191622 099) ingick i studien.
VISTABEL-injektioner minskade signifikant kråksparkarnas rynkdjup vid maximalt leende jämfört med placebo vid samtliga tidpunkter (p <0,001) vid upp till 5 månader. Detta mättes som andelen patienter som upplevde inga eller lätta rynkor vid maximalt leende i de pivotala studierna; fram tills dag 150 (slutet av studien) i studie 191622 098 och dag 120 (slutet av den första behandlingscykeln i studie 191622 099). Vid bedömning av såväl prövare som patienter var andelen patienter med inga eller lätta kråksparkar vid maximalt leende högre hos patienter med måttliga kråksparkar vid maximalt leende vid baslinjen jämfört med patienter med uttalade kråksparkar vid maximalt leende vid baslinjen. I tabell 1 sammanfattas resultaten vid dag 30, tidpunkten för det primära effektmåttet.
I studie 191622 104 (förlängning av studie 191622 099) fick 101 patienter som tidigare randomiserats till placebo sin första behandling med dosen 44 enheter. Patienter som behandlades med VISTABEL hade en statistiskt signifikant nytta avseende det primära effektmåttet jämfört med placebo dag 30 efter att ha fått sin första behandling. Svarsfrekvensen liknade den hos 44 enheter-gruppen dag 30 efter första behandlingen i studie 191622 099. Totalt 123 patienter fick fyra cykler med 44 enheter VISTABEL som kombinerad behandling av kråksparkar och glabellaveck.
Tabell 1. Dag 30: Prövarens och patientens bedömning av kråksparkar som uppkommer vid maximalt leende.
- Responderfrekvenser (% patienter med inga eller lätta kråksparkar)
|
Klinisk studie |
Dos |
VISTABEL |
Placebo |
VISTABEL |
Placebo |
|
Prövarens bedömning |
Patientens bedömning |
||||
|
191622-098 |
24 enheter (kråksparkar) |
66,7 %* (148/222) |
6,7 % (15/223) |
58,1 %* (129/222) |
5,4 % (12/223) |
|
191622-099 |
24 enheter (kråksparkar) |
54,9 %* (168/306) |
3,3 % (10/306) |
45,8 %* (140/306) |
3,3 % (10/306) |
|
44 enheter (24 enheter kråksparkar 20 enheter glabellaveck) |
59,0 %* (180/305) |
3,3 % (10/306) |
48,5 %* (148/305) |
3,3 % (10/306) |
|
*p < 0,001 (VISTABEL jämfört med placebo)
Förbättringar från baslinjen av patientens bedömning av kråksparkar vid maximalt leende konstaterades för VISTABEL (24 enheter och 44 enheter) jämfört med placebo, dag 30 och vid samtliga tidpunkter efter varje behandlingscykel i båda pivotala studier (p < 0,001).
Behandling med VISTABEL 24 enheter minskade signifikant kråksparkar i vila. Av de 528 patienter som behandlades hade 63 % (330/528) måttliga till påtagliga kråksparkar i vila vid baslinjen. Av dessa ansågs 58 % (192/330) av VISTABEL-behandlade patienter vara ”responders” (inga eller lätta rynkor) trettio dagar efter injektionen, jämfört med 11 % (39/352) av de patienter som fått placebo.
Förbättringar av patienternas självbedömning avseende ålder och attraktionsförmåga sågs även för VISTABEL (24 enheter och 44 enheter) jämfört med placebo. Detta mättes med hjälp av frågeformuläret FLO-11 (Facial Line Outcomes) vid den primära tidpunkten dag 30 (p<0,001) och vid alla efterföljande tidpunkter i båda pivotala studierna.
I de pivotala studierna var 3,9 % (53/1362) av patienterna äldre än 65 år. I denna åldersgrupp var andelen patienterna svarat på behandlingen, enligt prövarens bedömning, 36 % (dag 30) för VISTABEL (24 enheter och 44 enheter). Vid analys enligt åldergrupp ≤50 år och >50 år visade båda grupperna statistiskt signifikanta förbättringar jämfört med placebo. Behandlingssvaret för VISTABEL 24 enheter var enligt prövarens bedömning lägre i gruppen med patienter >50 år än de ≤50 år (42,0 % respektive 71,2 %).
Generellt är svaret på behandling för kråksparkar vid maximalt leende lägre (60 %) än vad som observerats med behandling för glabellaveck vid maximal rynkning av pannan (80 %).
Prover från 916 patienter som behandlats med VISTABEL (517 patienter som fick 24 enheter och 399 patienter som fick 44 enheter) analyserades med avseende på antikroppsbildning. Inga patienter utvecklade neutraliserande antikroppar.
Pannrynkor
822 patienter med måttliga till uttalade pannrynkor och glabellaveck som uppkommer vid maximal rynkning, antingen enbart (N=254, studie 191622-142) eller även med måttliga till uttalade kråksparkar vid maximalt leende (N=568, studie 191622-143), rekryterades och inkluderades i den primära populationen för analys av samtliga primära och sekundära effektmått. I de kliniska studierna behandlades pannrynkor i samband med glabellaveck.
Enligt både prövarens och patientens bedömningar var andelen patienter som hade inga eller lätta pannrynkor vid maximal höjning av ögonbrynen efter injektion med VISTABEL större än för patienter som behandlats med placebo vid dag 30, tidpunkten för det primära effektmåttet (tabell 2). Andelen patienter som uppnådde en förbättring motsvarande minst 1 grad för pannrynkor jämfört med baslinjen i vila, och som hade inga eller lätta övre ansiktsrynkor vid maximal rynkning anges också.
Tabell 2: Dag 30: Prövares och patienters bedömning av pannrynkor och övre ansiktsrynkor vid maximal rynkning och i vila.
|
Klinisk studie |
Effektmått |
VISTABEL |
Placebo |
VISTABEL |
Placebo |
||
|
Prövares bedömning |
Patienters bedömning |
||||||
|
Studie 191622-142 40 enheter (20 enheter pannrynkor + 20 enheter glabellaveck) |
Pannrynkor vid maximal rynkninga |
94,8 %
|
1,7 %
|
87,6 %
|
0,0 %
|
||
|
p < 0,0005 |
p < 0,0005 |
||||||
|
Pannrynkor vid vilab |
86,2 %
|
22,4 %
|
89,7 % (174/194) |
10,2 % (6/59) |
|||
|
p < 0,0001 |
p < 0,0001 |
||||||
|
Studie 191622-143 40 enheter (20 enheter pannrynkor + 20 enheter glabellaveck) |
Pannrynkor vid maximal rynkninga |
90,5 %
|
2,7 %
|
81,5 %
|
3,6 %
|
||
|
p < 0,0005 |
p < 0,0005 |
||||||
|
Pannrynkor vid vilab |
84,1 %
|
15,9 %
|
83,6 % (184/220) |
17,4 % (19/109) |
|||
|
p < 0,0001 |
p < 0,0001 |
||||||
|
Studie 191622-143 64 enheter (20 enheter pannrynkor + 20 enheter glabellaveck + 24 enheter kråksparkar) |
Pannrynkor vid maximal rynkninga |
93,6 %
|
2,7 %
|
88,9 %
|
3,6 %
|
||
|
p < 0,0005 |
p < 0,0005 |
||||||
|
Rynkor i övre delen av ansiktet vid maximal rynkningc |
56,6 %
|
0,9 %
|
i.u. |
||||
|
p < 0,0001 |
|||||||
a Andel patienter med inga eller lätta pannrynkor vid maximal höjning av ögonbrynen
b Andel patienter som uppnådde en förbättring motsvarande minst 1 grad för pannrynkor jämfört med baslinjen i vila
c Andel ”responders”, definierade som en och samma patient med inga eller lätta pannrynkor, glabellaveck och kråksparkar vid maximal rynkning av varje område av ansiktet
Injektioner med VISTABEL reducerade signifikant pannrynkornas djup vid maximal höjning av ögonbrynen jämfört med placebo i upp till 6 månader (p < 0,05): Detta mättes som andelen patienter som uppnådde inga eller lätta pannrynkor vid maximal höjning av ögonbrynen i båda de pivotala studierna; fram till dag 150 i studie 191622-142 (21,6 % behandlade med VISTABEL jämfört med 0 % behandlade med placebo) och dag 180 i studie 191622-143 (6,8 % behandlade med VISTABEL jämfört med 0 % behandlade med placebo).
Vid samtidig behandling av samtliga 3 områden i studie 191622-143 (gruppen med 64 enheter VISTABEL), gav VISTABEL-injektionerna en betydande reducering av glabellaveck i upp till 6 månader (5,5 % för VISTABEL-behandlade jämfört med 0 % för placebobehandlade), kråksparkar i upp till 6 månader (3,4 % för VISTABEL-behandlade jämfört med 0 % för placebobehandlade) och pannrynkor i upp till 6 månader (9,4 % för VISTABEL-behandlade jämfört med 0 % för placebobehandlade).
Totalt 116 och 150 patienter fick under ett år 3 cykler med 40 enheter VISTABEL (20 enheter för pannrynkor och 20 enheter för glabellaveck) respektive 64 enheter (20 enheter för pannrynkor, 20 enheter för glabellaveck och 24 enheter för kråksparkar). Svarsfrekvensen för förbättring av pannrynkor var liknande för alla behandlingscykler.
Mätt med frågeformuläret FLO-11 (Facial Lines Outcomes) sågs förbättringar i patienternas självbedömning avseende hur besvärade de var av pannrynkor, av att se äldre ut än deras riktiga ålder och attraktionsförmåga hos en signifikant (p < 0,001) större andel patienter behandlade med 40 enheter VISTABEL (20 enheter för pannrynkor och 20 enheter för glabellaveck) och 64 enheter (20 enheter för pannrynkor, 20 enheter för glabellaveck och 24 enheter för kråksparkar) jämfört med placebo vid den primära tidpunkten dag 30 i studierna 191622-142 och 191622-143.
Med hjälp av frågeformuläret FLSQ (Facial Lines Satisfaction Questionnaire) angav 78,1 % (150/192) av patienterna i studie 191622-142 och 62,7 % (138/220) i studie 191622-143 utseenderelaterade och känslomässiga förbättringar (definierat utifrån frågor om att känna sig äldre, låg självkänsla, se trött ut, känna sig olycklig, se arg ut) efter behandling med VISTABEL 40 enheter (20 enheter för pannrynkor och 20 enheter för glabellaveck) jämfört med patienter som behandlats med placebo, 19,0 % (11/58) i studie 191622-142 och 18,9 % (21/111) i studie 191622-143 vid dag 30 (p < 0,0001 i båda studierna).
Med samma frågeformulär angav 90,2 % (174/193) av patienterna i studie 191622-142 och 79,2 % (175/221, 40 enheter) och 86,4 % (203/235, 64 enheter) i studie 191622-143 att de var ”mycket nöjda”/”mestadels nöjda” med VISTABEL 40 enheter eller 64 enheter jämfört med patienter som behandlats med placebo (1,7 % [1/58], 3.6 % [4/110] i studie 191622-142 respektive studie 191622-143), vid den primära tidpunkten dag 60 med frågeformuläret FLSQ (p < 0,0001 i båda studierna).
I de pivotala studierna var 3,7 % (22/587) av patienterna äldre än 65 år. Enligt prövarens bedömning uppnåddes behandlingssvar i denna åldersgrupp hos 86,7 % (13/15) (vid 30 dagar) av patienterna som behandlats med VISTABEL jämfört med 28,6 % (2/7) för placebo. Svarsfrekvensen i denna undergrupp av patienter som behandlats med VISTABEL liknade den totala populationens, men statistisk signifikans uppnåddes ej och patientgruppen var alltför liten för att kunna göra jämförelser med placebo.
Farmakokinetik
a) Allmänna karakteristika för den aktiva substansen:
Distributionsstudier på råttor indikerar långsam muskulär diffusion av 125I-botulinum-neurotoxin-A-komplex efter injicering i gastrocnemius, följt av snabb systemisk metabolism och utsöndring via urinen. Mängden av radioaktivt märkt substans i muskeln minskade med en halveringstid på ungefär 10 timmar. Vid injektionsstället var radioaktiviteten bunden till stora proteinmolekyler, medan den i plasman var bunden till små molekyler, vilket tyder på snabb systemisk metabolism av substratet. Inom 24 timmar efter dosering hade 60 % av radioaktiviteten utsöndrats via urinen. Toxin metaboliseras förmodligen av proteaser varefter de molekylära komponenterna återvinns via normala metaboliska transportvägar.
Klassiska absorptions-, distributions-, metabolism- och eliminationsstudier (ADME) med den aktiva substansen har inte utförts på grund av produktens egenskaper.
b) Egenskaper vid användning till patient:
Troligen förekommer vid terapeutiska VISTABEL-doser endast en mindre systemisk distribution. Kliniska studier, med enkel fiber-EMG, har visat ökad elektrofysiologisk neuromuskulär aktivitet i muskler belägna långt från injektionsstället, utan att detta åtföljts av några kliniska tecken eller symptom.
Prekliniska uppgifter
I reproduktionsstudier på mus, råtta och kanin observerades embryotoxicitet vid höga doser (försenad benbildning och reduktion av fostrets kroppsvikt). Inga teratogena effekter observerades hos dessa arter. Hos råtta observerades biverkningar på hanens fertilitet samt honans östruscykel och fertilitet endast vid höga doser.
Studier avseende akut toxicitet, toxicitet efter upprepad dosering, lokal tolerans, mutagenicitet, antigenicitet och kompatibilitet med blod avslöjade inga speciella lokala eller systemiska biverkningar vid kliniskt relevanta doser.
Innehåll
Kvalitativ och kvantitativ sammansättning
Botulinumtoxin typ A1 .....................4 Allergan-enheter per 0,1 ml färdigblandad lösning.
1från Clostridium botulinum
Allergan-enheter är inte utbytbara mellan olika botulinumtoxinprodukter.
Injektionsflaska med 50 enheter.
Injektionsflaska med 100 enheter.
Förteckning över hjälpämnen
Humant albumin
Natriumklorid
Blandbarhet
Detta läkemedel skall inte blandas med andra läkemedel då blandbarhetsstudier saknas.
Miljöpåverkan
Miljöinformationen för clostridium botulinum neurotoxin typ A hemagglutininkomplex är framtagen av företaget IPSEN för Dysport®
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön. Även om biomolekyler, såsom vaccin och hormoner, är undantagna bör de ändå betraktas som biologiskt aktiva.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Efter beredning rekommenderas omedelbar användning av lösningen. Kemisk och fysikalisk stabilitet vid användning har emellertid visats i 24 timmar vid förvaring i temperaturer mellan 2 °C och 8° C.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C– 8°C).
För förvaringsanvisningar gällande det färdigberedda läkemedlet, se avsnitt Hållbarhet, förvaring och hantering.
Särskilda anvisningar för destruktion
Rekonstitution skall utföras i enlighet med god sed och med särskild hänsyn tagen till aseptik. VISTABEL ska lösas i steril normal saltlösning utan konserveringsmedel (0,9 % natriumkloridlösning för injektion). I enlighet med spädningstabellen nedan, ska den angivna mängden av steril normal saltlösning utan konserveringsmedel (0,9 % natriumkloridlösning för injektion) dras upp i en injektionsspruta för att erhålla en färdigberedd lösning med koncentrationen 4 enheter/0,1 ml.
|
Injektionsflaskans storlek |
Mängd tillsatt spädningsvätska (steril normal saltlösning utan konserveringsmedel [0,9 % natriumkloridlösning för injektion]) |
Resulterande dos (enheter per 0,1 ml) |
|
50 enheter |
1,25 ml |
4,0 enheter |
|
100 enheter |
2,5 ml |
4,0 enheter |
Mitten av gummiproppen ska rengöras med alkohol.
För att undvika denaturering av VISTABEL ska lösningen långsamt injiceras i injektionsflaskan. Snurra flaskan varsamt för att undvika att bubblor bildas. Injektionsflaskan ska kasseras om inte vakuumet drar in lösningen in i flaskan. Efter beredning ska lösningen inspekteras före användning. Endast klar, färglös eller svagt gul lösning utan några partiklar skall användas.
VISTABEL får endast användas till en enskild patient under ett enskilt behandlingstillfälle.
Rutiner för säker destruktion av injektionsflaskor, sprutor och använt material:
Omedelbart efter användning och före kassering ska all oanvänd VISTABEL-lösning i injektionsflaskan och/eller i sprutan inaktiveras med 2 ml utspädd hypokloritlösning 0,5 % eller 1 % och ska destrueras enligt lokala rutiner. Använda injektionsflaskor, sprutor och material får inte tömmas utan ska slängas i lämpliga behållare och kasseras som medicinskt bioriskavfall enligt lokala rutiner.
Rekommendationer vid en eventuell olycka vid hantering av botulinumtoxin:
Om det skulle ske en olycka vid hanteringen av produkten, såväl den vakuumtorkade produkten som den färdigberedda lösningen, måste omedelbart följande åtgärder vidtas.
-
Toxinet är mycket känsligt för värme och vissa kemiska ämnen.
-
Allt spill måste torkas upp: för den vakuumtorkade produkten, med ett absorberande material indränkt i natriumhypokloritlösning (Javelle-lösning) eller, för den beredda lösningen, med ett torrt absorberande material.
-
Förorenade ytor måste rengöras med ett absorberande material indränkt i en natriumhypokloritlösning (Javelle-lösning) och sedan torkas av.
-
Följ anvisningarna ovan om en flaska går sönder. Plocka försiktigt upp glasbitarna och torka upp produkten. Var försiktig så att du inte skär dig.
-
Om preparatet kommer på huden tvätta med en natriumhypokloritlösning och skölj sedan ordentligt med riklig mängd vatten.
-
Om preparatet kommer i ögonen skölj eller duscha ögonen ordentligt med riklig mängd vatten eller använd en lösning avsedd för ögontvätt.
-
Om injicerande läkare skadar sig (skär sig eller sticker sig), följ instruktionerna ovan och vidta lämpliga medicinska åtgärder beroende på injicerad dos.
Denna instruktion för användning, hantering och destruktion måste följas noga.
Egenskaper hos läkemedelsformen
Pulver till injektionsvätska, lösning
Vitt pulver.
VISTABEL ser ut som en tunn vit fällning och kan vara svår att se i botten på injektionsflaskan.





