1 LÄKEMEDLETS NAMN
Grafalon 20 mg/ml koncentrat till infusionsvätska, lösning.
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
En ml koncentrat innehåller 20 mg anti-humant T-lymfocyt immunoglobulin av kanin.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Koncentrat till infusionsvätska, lösning.
Klar till svagt opaliserande, färglös till svagt gul lösning.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Akut steroidresistent avstötning efter njurtransplantation
Grafalon används tillsammans med andra immunosuppressiva medel för att hämma immunsystemet och hindra organavstötning efter transplantation. Primärt används det i akuta avstötningskriser, där effekten av metylprednisolon varit otillräcklig.
Prevention av transplantat-kontra-värd-sjuka (GVHD) hos vuxna efter allogen stamcellstransplantation (SCT)
Grafalon är indicerat för att förebygga transplantat-kontra-värd-sjuka (GVHD) hos patienter med hematologiska maligniteter som får transplantat från en matchad obesläktad donator i kombination med standard profylax med cyklosporin A/metotrexat.
4.2 Dosering och administreringssätt
Grafalon bör endast ordineras av läkare med erfarenhet av immunsuppressiva läkemedel och behandlingsformer. Grafalon ska administreras under kompetent medicinsk övervakning.
Dosering
Akut steroidresistent avstötning efter njurtransplantation
0,15-0,25 ml/kg kroppsvikt (3-5 mg/kg) som i.v. infusion, vanligen 3-4 mg/kg. Behandlingstiden är vanligen 5-14 dygn beroende på transplantatets tillstånd samt terapiplanen.
Prevention av transplantat-kontra-värd-sjuka (GVHD) hos vuxna efter allogen stamcellstransplantation (SCT)
Som en del av myeloablativa konditioneringsregimer vid stamscellstransplantatio ner påbörjas administrering av den rekommenderade dosen Grafalon, 20 mg/kg/dag, vanligtvis dag -3 till dag -1 före SCT.
Pediatrisk population
Tillgängliga data finns beskrivna i avsnitt 4.8 och 5.1 men ingen doseringsrekommendation kan fastställas. Tillgänglig information tyder på att barn inte kräver annan dosering än vuxna.
Administreringssätt
Intravenös användning (efter spädning).
Grafalon är ett hypotont infusionskoncentrat, med pH 3,7 ± 0,3. Det är inte avsett för direkt injektion. Grafalon måste spädas med natriumkloridlösning 9 mg/ml (0,9 %) innan läkemedlet får administreras intravenöst till patienten. En spädning på 1:7 rekommenderas (6 ml natriumkloridlösning ska tillsättas per 1 ml Grafalon) för att garantera den osmolalitet som krävs. Högre spädning och därmed en infusionslösning med högre pH-nivå kan leda till partikelbildning. Lösningar som innehåller synliga partiklar får inte användas.
Vanlig infusionstid är 4 timmar för njurtransplanterade patienter medan infusionstider på 4 till 12 timmar rekommenderas vid stamcellstransplantation.
Vid intraoperativ administrering ska infusionen ges under ingreppets duration och innan anastomoser anläggs.
Under administrationen ska patienten övervakas noggrant med tanke på symptom på överkänslighet eller anafylaxi. Första dosen av Grafalon bör administreras med långsam infusionshastighet under de första 30 minuterna. Om patienten inte uppvisar några symptom på intolerans, kan infusionshastigheten ökas.
Som ett alternativ till infusion via en central venkateter kan en perifer stor, högflödes ven användas. Administration av metylprednisolon och/eller antihistaminer före infusionen rekommenderas i syfte att förbättra systemisk och lokal tolerans. Noggrann hygien vid injektionsområdet, minskning av infusionshastigheten och/eller byte av infusionsstället kan förbättra toleransen.
Natriumheparin får inte tillsättas till Grafalon infusionslösning då det kan orsaka grumlighet, och inte heller administreras via samma infusionsport (se avsnitt 6.2).
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne (se avsnitt 6.1).
Grafalon är kontraindicerat för patienter med bakterie‑, virus‑, svamp- eller parasitinfektioner som inte står under adekvat terapeutisk kontroll.
Grafalon är kontraindicerat hos patienter som genomgått transplantation av solida organ och som har svår trombocytopeni, d.v.s. mindre än 50 000 trombocyter per mikroliter, eftersom Grafalon kan förvärra trombocytopenin och därigenom öka blödningsrisken.
Grafalon är kontraindicerat till patienter med tidigare malignitet och som varit sjukdomsfria mindre än 5 år, med undantag av hematologiska maligniteter som kräver behandling med stamcellstransplantation.
4.4 Varningar och försiktighet
Behandlingen av patienter som står på Grafalon måste ske i utrymmen med tillgängliga laboratorie- och medicinska resurser för att genomföra akutbehandling i händelse av anafylaktisk chock. Grafalon ska administreras och övervakas av kvalificerad medicinsk personal.
Överkänslighetsreaktioner
Överkänslighetsreaktioner har rapporterats hos patienter som fått Grafalon. Om patienten däremot utvecklar anafylaktiska eller anafylaktoida reaktioner, måste den ansvariga läkaren vara beredd att åtgärda sådana symptom omedelbart och lämplig medicinsk behandling måste sättas in.
Innan Grafalon administreras första gången bör patienten undersökas för allergisk predisposition, särskilt mot kaninproteiner.
Vid misstanke om överkänslighet mot kaninproteiner, ska 0,05 ml Grafalon spädas 1:100 med fysiologisk saltlösning och injiceras intrakutant, på insidan av underarmen. En intrakutan injektion av fysiologisk saltlösning på samma ställe på den andra armen ska användas som en kontroll.
Om en betydande reaktion (t.ex. utslag och uppblossningar) uppkommer vid injektionsstället inom 15 minuter efter administreringen, utan någon reaktion vid kontrollstället, är patienten överkänslig mot kaninproteiner och därmed mot Grafalon.
Observera att tidigare eller samtidig immunsuppressiv behandling kan leda till negativa hudallergitester trots patientöverkänslighet.
Om patienten exponeras för en ny behandling med Grafalon eller med ett annat läkemedel med kaninimmunonoglobulin, så är risken att utveckla anafylaktiska reaktioner förhöjd p.g.a. möjlig sensitisering under den tidigare behandlingen.
Svår trombocytopeni
Behandlingen med Grafalon bör avbrytas eller avslutas hos patienter med solida organtransplantat som får svår trombocytopeni, (d.v.s. mindre än 50 000 trombocyter per mikroliter), då Grafalon kan förvärra trombocytopenin och öka risken för blödningar. Klinisk personal skall vara förberedd att vidta lämpliga nödåtgärder i detta fall. Vid mindre allvarlig trombocytopeni/
granulocytopeni skall Grafalon användas med försiktighet.
Leversjukdomar
Grafalon måste administreras med särskild försiktighet till patienter med leversjukdomar. Om patienten har benägenhet för koagulationsstörningar kan dessa förvärras. Noggrann kontroll av trombocyter och koagulationsparametrar rekommenderas.
Kardiovaskulära sjukdomar
Grafalon måste administreras med särskild försiktighet till patienter med känd eller misstänkt kardiovaskulär sjukdom. Hos patienter med hypotension eller hjärtsvikt kombinerat med ortostatiska symptom (t.ex. medvetslöshet, svaghet, kräkning, kväljningar) måste man överväga att bromsa eller avbryta infusionen.
Infektioner
Behandling med immunsuppressiva läkemedel ökar risken för infektioner i allmänhet. Patienter som behandlats med Grafalon har en ökad risk för infektioner förorsakade av bakterie-, virus-, svamp- och/eller parasitinfektioner. Adekvat kontroll och behandlingsåtgärder är viktiga att vidta. Hos patienter som genomgår stamcellstransplantation rekommenderas övervakning av CMV- och EBV-status samt adekvat förebyggande behandling.
Vaccination
Under behandling med Grafalon ska patienterna informeras om att vaccination med inaktiverat vaccin kan bli mindre effektivt. Vaccinationer med levande försvagade virus är kontraindicerade hos immunsupprimerade patienter.
Varning gällande smittosamma agenser
Vanliga åtgärder för att undvika infektionsspridning vid användning av läkemedel som innehåller humana komponenter omfattar bland annat val av blodgivare, screening av enskilda donationer för specifika infektionsmarkörer samt användning av effektiva tillverkningsteg som inaktiverar/avlägsnar virus. Trots dessa åtgärder kvarstår en möjlighet att infektiösa ämnen kan överföras då man använder läkemedel som tillverkats av humant ursprung. Detta gäller okända, nyupptäckta virus och andra patogener.
De åtgärders som vidtas anses vara effektiva för höljeförsedda virus som humant immun-bristvirus (HIV), hepatit B-virus och hepatit C-virus samt de icke höljeförsedda virusen hepatit A och parvovirus B19.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Inga interaktionsstudier har utförts.
Immunsuppressiva läkemedelspreparat
Förutom Grafalon, administreras rutinmässigt samtidigt också andra immunsuppressiva läkemedel. Några direkta interaktioner mellan Grafalon och kortikosteroider, purinantagonister, kalcineurininhibitorer eller mTOR-inhibitorer har inte observerats. Dock kan samtidig administration av dessa läkemedel öka risken för infektioner, trombocytopeni och anemi. Därför bör patienter som får kombinerad immunsuppressiv behandling kontrolleras noggrant och behandlingsschemat bör vid behov justeras.
Vaccinationer
Vaccinationer med levande försvagade virus är kontraindicerade för patienter som är immunsupprimerade. Antikroppssvaret på andra vacciner kan vara nedsatt (se avsnitt 4.4).
4.6 Fertilitet, graviditet och amning
Graviditet
Data från djurstudier saknas. Humana kliniska data om gravida eller ammande kvinnor saknas. Den eventuella risken för fostret är okänd. Försiktighet bör iakttas om läkemedlet ordineras till gravida kvinnor.
Amning
Humant immunoglobulin kan tränga igenom moderkaksbarriären och utsöndras i bröstmjölk. Ett beslut att behandla gravida eller ammande kvinnor skall fattas av den behandlande läkaren baserat på en risk/nytta bedömning.
Fertilitet
Information om fertilitet saknas.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Inga studier har utförts.
4.8 Biverkningar
Sammanfattning av säkerhetsprofilen
Grafalon är ett immunoglobulin med immunsuppressiva egenskaper. Läkemedlen i denna klass har en del välkända biverkningar, symptom som hänför sig till cytokinfrisättning, överkänslighetsreaktioner som anafylaxi och andra allergiska fenomen, ökad känslighet för infektioner samt förekomst av maligna sjukdomar.
Arten och förekomsten av biverkningarna som beskrivs i detta avsnitt analyserades i en integrerad säkerhetsanalys baserad på 6 kliniska prövningar med totalt 242 patienter som använde läkemedlet för att förhindra avstötning av njurtransplantat (136 patienter) eller för konditioneringsbehandling inför allogen stamcellstransplantation (106 patienter). Av patienterna som ingick i analysen upplevde 94 % minst en biverkning. Mönstret för rapporterade biverkningar återspeglar delvis vanliga komplikationer som typiskt förekommer efter njurtransplantation (urinvägsinfektion, njursvikt) respektive allogen stamcellstransplantation (pancytopeni, slemhinneinflammation).
I tabellen nedan rapporteras biverkningarna för Grafalon i enlighet med frekvens och organklassifikation. Frekvensgrupperna definieras enligt följande standard:
Mycket vanliga (≥1/10), vanliga (≥1/100 till <1/10), mindre vanliga (≥1/1 000 till <1/100).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Biverkningstabell
|
Infektioner och infestationer |
|
|
Mycket vanliga |
CMV-infektion*, urinvägsinfektion* |
|
Vanliga |
Bakteriell sepsis**, pneumoni**, pyelonefrit*, herpesinfektion, influensa, candidainfektion i munnen, bronkit, rinit, sinuit, nasofaryngit, hudinfektion |
|
Mindre vanliga |
Infektion i kateterområdet, Epstein-Barr-virusinfektion, gastrointestinal infektion, erysipelas, sårinfektion |
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
|
|
Vanliga |
Lymfoproliferativa sjukdomar* |
|
Blodet och lymfsystemet |
|
|
Mycket vanliga |
Anemi |
|
Vanliga |
Pancytopeni**, trombocytopeni, leukopeni |
|
Mindre vanliga |
Polycytemi |
|
Immunsystemet |
|
|
Vanliga |
Anafylaktisk chock**, anafylaktisk reaktion, överkänslighet |
|
Metabolism och nutrition |
|
|
Vanliga |
Hyperlipidemi |
|
Mindre vanliga |
Vätskeretention, hyperkolesterolemi |
|
Centrala och perifera nervsystemet |
|
|
Mycket vanliga |
Huvudvärk, tremor |
|
Vanliga |
Parestesi |
|
Ögon |
|
|
Vanliga |
Fotofobi |
|
Hjärtat |
|
|
Vanliga |
Takykardi |
|
Blodkärl |
|
|
Mycket vanliga |
Blodvallningar |
|
Vanliga |
Hypotension*, venocklusiv sjukdom, hypertension |
|
Mindre vanliga |
Chock**, lymfocele |
|
Andningsvägar, bröstkorg och mediastinum |
|
|
Mycket vanliga |
Dyspné |
|
Vanliga |
Hosta, näsblod |
|
Magtarmkanalen |
|
|
Mycket vanliga |
Kräkning, illamående, diarré, buksmärtor |
|
Vanliga |
Stomatit |
|
Mindre vanliga |
refluxesofagit, dyspepsi |
|
Lever och gallvägar |
|
|
Vanliga |
Hyperbilirubinemi |
|
Hud och subkutan vävnad |
|
|
Vanliga |
Erytem, klåda, utslag |
|
Mindre vanliga |
Hudutslag av läkemedel |
|
Muskuloskeletala systemet och bindväv |
|
|
Vanliga |
Myalgi, artralgi, ryggvärk, muskuloskeletal stelhet |
|
Njurar och urinvägar |
|
|
Vanliga |
Renal tubulär nekros*, hematuri |
|
Mindre vanliga |
Njursvikt**, njurnekros* |
|
Allmänna symtom och/eller symtom vid administreringsstället |
|
|
Mycket vanliga |
Feber**, frossbrytningar |
|
Vanliga |
Asteni, bröstsmärta, hypertermi, slemhinneinflammation, perifert ödem |
|
Mindre vanliga |
Ödem |
|
Undersökningar |
|
|
Vanliga |
Ökad kreatininhalt i blodet*, positivt utslag vid cytomegalovirus antigentest, ökad halt av C-reaktivt protein |
|
Mindre vanliga |
Förhöjda leverenzymvärden |
* allvarlig biverkning
** allvarlig biverkning, i enstaka fall med dödlig utgång
Beskrivning av utvalda biverkningar
Symptom som hänför sig till cytokinfrisättning
Dessa reaktioner inträffar på grund av frisättning av cytokiner och omfattar feber, frossbrytningar, huvudvärk, illamående, kräkning, takykardi och förändringar i blodcirkulationen. Dessa reaktioner kan sammanfattas under den kliniska huvudrubriken cytokinfrisättningssyndrom och de ses ofta under eller efter administrering av Grafalon. Symptomen är i allmänhet lätta att åtgärda. Profylaktisk läkemedelsbehandling kan administreras i syfte att lindra dessa symptom.
Överkänslighetsreaktioner
Reaktioner av typen blodvallningar, utslag, erytem, ödem, dyspné med eller utan bronkospasm samt hosta förekommer ofta under och efter administrering. Dessa reaktioner svarar i allmänhet väl på behandling. Administrering av lämpliga profylaktiska läkemedel kan förbättra dessa symptom. Förekomsten av anafylaxi/anafylaktisk chock kräver att infusionen avslutas omedelbart. Serumsjukdom, som förekommer om Grafalon administreras under lång tid och i låg dos, är sällan allvarlig och svarar i allmänhet väl på symptomatisk behandling.
Hematologiska förändringar
Övergående förändringar av antalet trombocyter och leukocyter, dokumenteras som trombocytopeni respektive leukopeni, är vanliga efter administration av Grafalon. Anemi är en mycket vanlig observation efter användning av Grafalon.
Infektioner
Patienter som behandlas med immunsuppressiva läkemedel har en ökad känslighet för infektioner. Under det första året efter solid organtransplantation utvecklade de flesta patienterna som fick Grafalon bakterie-, virus- eller svampinfektion. Urinvägsinfektion är en mycket vanlig bakteriell infektion, mycket vanliga virusinfektioner orsakas av CMV. Vanliga infektioner som rapporterats omfattar bakteriell sepsis, bakteriell pneumoni, pyelonefrit, herpesvirusinfektioner och candidainfektion i munhålan. EBV-infektioner, CMV-pneumoni och CMV-gastroenterit är mindre vanliga virusinfektioner. Systemisk candidainfektion är en ovanlig svampinfektion. De flesta infektioner kan i allmänhet åtgärdas med behandling. Det finns enstaka rapporter om livshotande och till och med dödliga infektioner. Korrekt övervakning samt profylaktisk behandling kan minska förekomsten av infektioner.
Maligniteter
Incidensen av maligna sjukdomar efter behandling med Grafalon är jämförbar med den som observerats med andra immunsuppressiva läkemedel. Risken för maligniteter är relateratd till total immunosuppressiv behandling. Posttransplantatoriskalymfoproliferativa sjukdomar rapporterades uteslutande bland patienter som genomgått en allogen stamcellstransplantation.
Hemolys
I sällsynta fall (mindre än 1 av 1 000 patienter) rapporterades hemolys i samband med administrering av Grafalon och var dödlig i enstaka fall.
Pediatrisk population
Tillgängliga data är begränsade. Tillgänglig information tyder på att säkerhetsprofilen för Grafalon till barn i grunden inte skiljer sig från den som ses hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via Läkemedelsverket, Box 26, 751 03 Uppsala, Webbplats:
www.lakemedelsverket.se
4.9 Överdosering
Vid överdosering rekommenderas omedelbar användning av bredspektrumantibiotika samt läkemedel mot svamp och mot virus. Behandlingen med Grafalon måste avbrytas och doseringen av eventuella samtidiga immunsuppressiva läkemedel måste justeras i enlighet med blodbilden (särskilt leukocyter och lymfocyter). Trombocyttalet måste övervakas noggrant och ersättningsbehandling skall initieras.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmkoterapeutisk grupp: Immunosuppressiva medel
ATC-kod: L04AA04
Grafalon är ett anti-T-lymfocytglobulin-preparat med immunosuppressiv effekt och hög titer. Grafalon är isolerat från serum av kaniner immuniserade med humana T-lymfocyter från Jurkat cellinje. Som polyklonala anti‑T‑cells antikroppar har Grafalon en direkt effekt på T‑cellerna som leder till uttömning av dessa.
Stamcellstransplantationsstudie
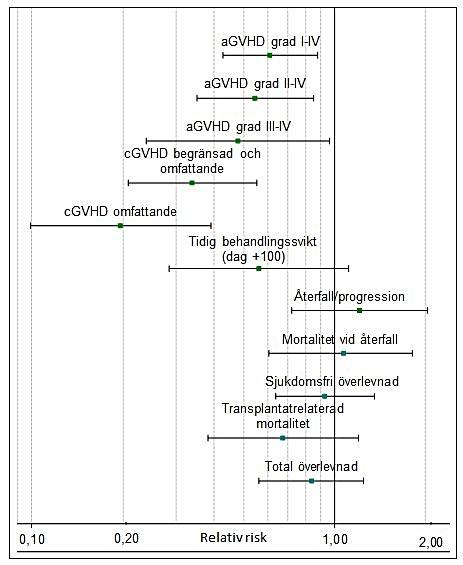
Resultat av en 2-årig uppföljning av en stamcellstransplantationsstudie med transplantat från matchade obesläktade donatorer visade att incidensen av akut transplantat-kontra-värd-sjuka (aGVHD), kronisk GVHD (cGVHD) och mortalitet på grund av GVHD minskade hos patienter som fick Grafalon i tillägg till vanlig GVHD-profylax.
Metoder:
Studien var en prospektiv, öppen, multicenterstudie som utfördes i 10 länder och på 31 mottagningar i Europa. 202 vuxna patienter med hematologiska maligniteter randomiserades centralt till behandlingsgrupper som fick cyklosporin och metotrexat med eller utan tillägg av Grafalon. 20 mg/kg Grafalon administrerades dag -3, dag -2 och dag -1 före SCT. 201 patienter som genomgick transplantation med perifert blod (n=164; 82 %) eller benmärg (n=37; 18 %) från obesläktade donatorer efter myeloablativ konditionering inkluderades i den fullständiga analysgruppen och analyserades enligt den slumpmässigt tilldelade behandlingen (Grafalon n=103, kontroll n=98). Det primära effektmåttet var tidig behandlingssvikt: Allvarlig aGVHD grad III–IV eller dödsfall inom 100 dagar efter transplantationen.
Resultat:
Tillägg av Grafalon till vanlig GVHD-profylax med cyklosporin A och metotrexat ledde till en minskad incidens av alla typer av GVHD: Akut GVHD (svårighetsgrad: I-IV, II-IV och III-IV) och kronisk GVHD (svårighetsgrad: begränsad och omfattande). Inga skillnader sågs mellan behandlingsgrupperna avseende återfall, mortalitet utan återfall och total överlevnad.
Primärt effektmått: Incidensen av tidig behandlingssvikt var 21,4 %, jämfört med 34,7 % i kontrollgruppen (justerad oddskvot 0,56, CI [0,28–1,11]; p=0,0983).
Den kumulativa incidensen av aGVHD grad III–IV var 11,7 % i gruppen som fick Grafalon jämfört med 25,5 % i kontrollgruppen (justerad riskkvot [HR] 0,48, CI [0,24-0,96]; p=0,0392). Den kumulativa incidensen av aGVHD grad II–IV var 33,0 % i gruppen som fick Grafalon jämfört med 52,0 % i kontrollgruppen (justerad HR 0,55, CI [0,35–0,85]; p=0,0077).
Den 2-åriga kumulativa incidensen av omfattande kronisk GVHD var 12,2 % jämfört med 45,0 % (justerad HR 0,196, CI [0,10–0,39]; p<0,0001).
Figur 1 Relativ risk för Grafalon jämfört med kontrollgruppen för primära och sekundära effektparametrar justerade för stamcellskälla och sjukdomsstatus (punktestimator och 95 % konfidensintervall)
Pediatrisk population
Det har publicerats flera rapporter om användningen av Grafalon till barn. Dessa rapportera speglar den breda kliniska erfarenheten av detta läkemedel hos barn och tyder på att säkerhets- och effektprofilen hos barn i grunden inte skiljer från den som ses hos vuxna.
Det råder emellertid inte konsensus avseende dosering till barn. Som hos vuxna är doseringen beroende av indikationen, administreringssättet samt kombinationen med andra immunsuppressiva läkemedel. Detta ska beaktas av läkare innan beslut om lämplig dosering till barn fattas.
5.2 Farmakokinetiska egenskaper
Grafalon ges intravenöst, och biotillgängligheten är därför 100%. Grafalon metaboliseras som andra kroppsproteiner. Inga ofysiologiska metaboliter är kända. Halveringstiden är ca 14 dagar (vid doser på 4 mg/kg drygt 7 dagar).
5.3 Prekliniska säkerhetsuppgifter
Begränsade toxikologiska studier har utförts på kanin och apa. Inga toxiska effekter kunde ses på kanin medan en lätt motorisk hämning och effekter på det hematologiska systemet observerades på apa. Försök på apa med upprepade höga doser gav upphov till anafylaktisk chock och cirkulationskollaps.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Natriumdivätefosfatdihydrat
Fosforsyra (85 %) (för justering av pH)
Vatten för injektionsvätskor
6.2 Inkompatibiliteter
Grafalon 20 mg/ml koncentrat till infusionsvätska, lösning får inte blandas med glukos, blod, blodprodukter, lösningar som innehåller lipider och natriumheparin.
6.3 Hållbarhet
3 år.
Kemisk och fysikalisk stabilitet för den spädda lösningen har påvisats i 24 timmar vid förvaring 20°C - 25°C. Ur mikrobiologisk synpunkt ska dock den spädda produkten användas omedelbart. Om den inte används omedelbart är förvaringstiden och förvaringsvillkoren fram till användning användarens ansvar.
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C–8 °C). Förvaras i originalförpackningen. Ljuskänsligt.
Förvaringsanvisningar för läkemedlet efter spädning finns i avsnitt 6.3.
Se avsnitt 4.2 för anvisningar om beredning och administration av läkemedlet.
6.5 Förpackningstyp och innehåll
Förpackning med 1 eller 10 injektionsflaskor à 5 ml lösning
Förpackning med 1 eller 10 injektionsflaskor à 10 ml lösning
6.6 Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Neovii Biotech GmbH
Am Haag 6+7
82166 Graefelfing
Tyskland
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
14214
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 17 december 1999
Förnyat godkännande: 17 december 2009
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
2022-02-21





