Indikationer
Sänkning av förhöjt intraokulärt tryck (IOP) hos vuxna patienter med öppenvinkelglaukom eller okulär hypertoni då monoterapi inte gett en tillräcklig sänkning av det intraokulära trycket (se avsnitt Farmakodynamik).
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Innehåll
Överkänslighet mot sulfonamider (se avsnitt Varningar och försiktighet)
Patienter som behandlas med monoaminoxidashämmare (MAO-hämmare) (se avsnitt Interaktioner)
Patienter som behandlas med antidepressiva medel som påverkar noradrenerg transmission (t.ex. tricykliska antidepressiva medel och mianserin) (se avsnitt Interaktioner)
Patienter med kraftigt nedsatt njurfunktion (se avsnitt Varningar och försiktighet)
Patienter med hyperkloremisk acidos
Nyfödda och barn under 2 år (se avsnitt Varningar och försiktighet)
Dosering
Dosering
Användning för vuxna, inklusive äldre
Rekommenderad dos är en droppe SIMBRINZA i det (de) påverkade ögat (ögonen) två gånger dagligen.
Glömd dos
Om en dos glöms bort, ska behandlingen fortsätta med nästa dos som planerat.
Nedsatt lever- och/eller njurfunktion
SIMBRINZA har inte studerats på patienter med nedsatt leverfunktion och försiktighet rekommenderas därför i denna population (se avsnitt Varningar och försiktighet).
SIMBRINZA har inte studerats på patienter med kraftigt nedsatt njurfunktion (kreatininclearance < 30 ml/min) eller på patienter med hyperkloremisk acidos. Eftersom brinzolamidkomponenten i SIMBRINZA och dess metabolit främst utsöndras av njurarna är SIMBRINZA kontraindicerat för sådana patienter (se avsnitt Kontraindikationer).
Pediatrisk population
Säkerhet och effekt för SIMBRINZA för barn och ungdomar i åldern 2 till 17 år har inte fastställts. Inga data finns tillgängliga.
SIMBRINZA är av säkerhetsskäl kontraindicerat hos nyfödda och barn under 2 år för sänkning av förhöjt intraokulärt tryck (IOP) vid öppenvinkelglaukom eller okulär hypertoni då monoterapi inte gett en tillräcklig sänkning av det intraockulära trycket (se avsnitt Kontraindikationer).
Administreringssätt
För okulär användning.
Patienter ska instrueras att skaka flaskan väl före användning.
Då nasolakrimal ocklusion används och ögonen sluts under 2 minuter reduceras det systemiska upptaget. Detta kan minska de systemiska biverkningarna och öka den lokala verkningen (se avsnitt Varningar och försiktighet).
För att förhindra att droppspetsen och lösningen kontamineras måste man vara noga med att inte vidröra ögonlocken, omgivande områden eller andra ytor med flaskans droppspets. Patienter ska instrueras att hålla flaskan ordentligt stängd när den inte används.
SIMBRINZA kan användas samtidigt med andra topikala ögonläkemedel för att sänka intraokulärt tryck. Om mer än ett topikalt ögonläkemedel används måste de administreras med minst fem minuters mellanrum.
Varningar och försiktighet
Läkemedlet ska inte injiceras. Patienter ska instrueras att inte svälja SIMBRINZA.
Ögoneffekter
SIMBRINZA har inte studerats på patienter med trångvinkelglaukom och rekommenderas inte för användning för dessa patienter.
Den eventuella effekten av brinzolamid på korneal endotelfunktion har inte studerats på patienter med skadad kornea (speciellt patienter med lågt antal endotelceller). Patienter som använder kontaktlinser har inte studerats specifikt, och dessa patienter ska därför följas noggrant under behandling med brinzolamid eftersom karbanhydrashämmare kan påverka korneal hydrering och användning av kontaktlinser kan öka risken för skada på kornea (för ytterligare instruktioner angående användning av kontaktlinser, se nedan under ”Bensalkoniumklorid”. Patienter med skadad kornea, som t. ex. patienter med diabetes mellitus eller korneal dystrofi, ska följas noga.
Brimonidintartrat kan ge upphov till allergiska reaktioner i ögonen. Om allergiska reaktioner observeras ska behandlingen upphöra. Fördröjda överkänslighetsreaktioner i ögonen har rapporterats med brimonidintartrat, av vilka vissa har rapporterats ha samband med en ökning av IOP.
Potentiella effekter efter avslutad behandling med SIMBRINZA har inte studerats. Varaktigheten av den IOP-sänkande effekten av SIMBRINZA har inte studerats, men den IOP-sänkande effekten av brinzolamid förväntas kvarstå i 5–7 dagar. Den IOP-sänkande effekten av brimonidin kan vara längre.
Systemiska effekter
SIMBRINZA innehåller brinzolamid, en karbanhydrashämmare av sulfonamidtyp, som även vid lokal tillförsel absorberas systemiskt. Samma typer av läkemedelsbiverkningar som gäller för sulfonamider kan uppkomma vid lokal administrering, inklusive Stevens-Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN). Vid förskrivningstillfället bör patienterna informeras om tecken och symtom samt övervakas noggrant med avseende på hudreaktioner. Om tecken på allvarliga reaktioner eller överkänslighet uppkommer ska SIMBRINZA omedelbart sättas ut.
Hjärtat
Efter administrering av SIMBRINZA observerades små sänkningar av blodtrycket hos vissa patienter. Försiktighet rekommenderas vid användning av läkemedel som t.ex. blodtryckssänkande medel och/eller hjärtglykosider samtidigt med SIMBRINZA eller för patienter med svår eller instabil och okontrollerad kardiovaskulär sjukdom (se avsnitt Interaktioner).
SIMBRINZA ska användas med försiktighet av patienter med depression, cerebral eller koronar insufficiens, Raynauds fenomen, ortostatisk hypotoni eller thromboangiitis obliterans.
Syra-/basstörningar
Syra-basstörningar har rapporterats med orala karbanhydrashämmare. SIMBRINZA innehåller brinzolamid, en karbanhydrashämmare, som även vid lokal tillförsel absorberas systemiskt. Samma typ av biverkningar som hänförs till perorala karbanhydrashämmare (dvs. syra-basstörningar) kan förekomma även vid topikal tillförsel (se avsnitt Interaktioner).
SIMBRINZA ska användas med försiktighet till patienter med risk för nedsatt njurfunktion på grund av den möjliga risken för metabolisk acidos. SIMBRINZA är kontraindicerat för patienter med kraftigt nedsatt njurfunktion (se avsnitt Kontraindikationer).
Nedsatt leverfunktion
SIMBRINZA har inte studerats på patienter med nedsatt leverfunktion. Försiktighet ska iakttas vid behandling av sådana patienter (se avsnitt Dosering).
Mental vakenhet
Perorala karbanhydrashämmare kan försämra förmågan hos äldre patienter att utföra uppgifter som kräver mental vakenhet och/eller fysisk koordination. SIMBRINZA absorberas systemiskt och därför kan detta uppstå vid topikal administration (se avsnitt Trafik).
Pediatrisk population
Säkerhet och effekt för SIMBRINZA för barn och ungdomar i åldern 2 till 17 år har inte fastställts. Symtom på överdosering av brimonidin (inklusive förlust av medvetandet, hypotension, hypotoni, bradykardi, hypotermi, cyanos och apné) har rapporterats hos nyfödda och spädbarn som fått brimonidin som ögondroppar som en del av läkemedelsbehandling av kongenitalt glaukom. SIMBRINZA är därför kontraindicerat för barn under 2 år (se avsnitt Kontraindikationer).
Behandling av barn som är 2 år och äldre (särskilt barn som är 2–7 år och/eller väger < 20 kg) rekommenderas inte på grund av risken för CNS-relaterade biverkningar (se avsnitt Överdosering).
Bensalkoniumklorid
SIMBRINZA innehåller bensalkoniumklorid som kan orsaka ögonirritation och missfärga mjuka kontaktlinser. Kontakt med mjuka kontaktlinser ska undvikas. Patienter ska instrueras att ta ut kontaktlinserna innan SIMBRINZA appliceras och att vänta minst 15 minuter innan linserna sätts in igen.
Bensalkoniumklorid har rapporterats orsaka ögonirritation och ge symptom på torra ögon och kan påverka tårfilmen och hornhinnans yta. Det ska användas med försiktighet hos patienter med torra ögon och hos patienter vars hornhinna kan riskera att skadas. Patienterna bör följas upp vid frekvent eller långvarigt bruk.
Interaktioner
Inga specifika interaktionsstudier har utförts med SIMBRINZA.
SIMBRINZA är kontraindicerat för patienter som behandlas MAO-hämmare och patienter som står på antidepressiva medel som påverkar noradrenerg transmission (t.ex. tricykliska antidepressiva medel och mianserin), (se avsnitt Kontraindikationer) Tricykliska antidepressiva medel kan avtrubba det okulära hypotensiva svaret på SIMBRINZA.
Försiktighet rekommenderas på grund av risken för en additiv eller förstärkande effekt med CNS-depressiva medel (t.ex. alkohol, barbiturater, opiater, sedativa eller anestetika).
Inga data är tillgängliga om nivån av cirkulerande katekolaminer efter administrering av SIMBRINZA. Försiktighet rekommenderas emellertid för patienter som tar läkemedel som kan påverka metabolismen och upptaget av cirkulerande aminer (t.ex. klorpromazin, metylfenidat, reserpin, serotonin-norepinefrin-återupptagshämmare).
Alfaadrenerga agonister (t.ex. brimonidintartrat), som klass, kan reducera puls och blodtryck. Efter administrering av SIMBRINZA observerades små sänkningar av blodtrycket hos vissa patienter. Försiktighet rekommenderas vid användning av läkemedel som t.ex. blodtryckssänkande medel och/eller hjärtglykosider samtidigt med SIMBRINZA.
Försiktighet rekommenderas vid insättning (eller ändring av dosen) av konkomitanta systemiska läkemedel (oavsett läkemedelsform) som kan interagera med α-adrenerga agonister eller störa deras aktivitet, dvs. agonister eller antagonister av den adrenerga receptorn (t.ex. isoprenalin, prazosin).
Brinzolamid är en karbanhydrashämmare som absorberas systemiskt även om den tillförs lokalt. Syra-basstörningar har rapporterats med orala karbanhydrashämmare. Risken för interaktioner ska beaktas hos patienter som får SIMBRINZA.
Det finns risk för en additiv effekt till de kända systemeffekterna av karbanhydrashämmare hos patienter som får perorala karbanhydrashämmare och topikalt brinzolamid. Samtidig administrering av SIMBRINZA och perorala karbanhydrashämmare rekommenderas inte.
Följande cytokrom P450-isoenzymer ansvarar för metabolismen av brinzolamid: CYP3A4 (primär), CYP2A6, CYP2B6, CYP2C8 och CYP2C9. Man kan förvänta sig att CYP3A4-hämmare som ketokonazol, itrakonazol, klotrimazol, ritonavir och troleandomycin hämmar metabolismen av brinzolamid via CYP3A4. Om CYP3A4-hämmare ges samtidigt som brinzolamid ska försiktighet iakttas. Ackumulation av brinzolamid är dock osannolik då brinzolamid huvudsakligen utsöndras renalt. Brinzolamid hämmar inte cytokrom P450-isoenzymer.
Graviditet
Det finns inga eller begränsad mängd data från användningen av SIMBRINZA hos gravida kvinnor. Efter systemisk administrering (givet oralt via sond), var Brinzolamid inte teratogent hos råttor och kaniner. Djurstudier med peroralt brimonidin visar inga direkta skadliga reproduktionstoxikologiska effekter. I djurstudier passerade brimonidin placentan och kom in i fostercirkulationen i begränsad omfattning (se avsnitt Prekliniska uppgifter). SIMBRINZA rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel.
Amning
Det är okänt om topikalt SIMBRINZA utsöndras i bröstmjölk. Tillgängliga farmakodynamiska/toxikologiska djurdata har visat att minimala nivåer av brinzolamid utsöndras i modersmjölk efter oral administrering. Brimonidin som administreras oralt utsöndras i bröstmjölk. SIMBRINZA ska inte användas av kvinnor som ammar.
Fertilitet
Icke-kliniska data visar inga effekter av brinzolamid eller brimonidin på fertilitet. Det finns inga data om effekten av topikal okulär administrering av SIMBRINZA på human fertilitet.
Trafik
SIMBRINZA har måttlig effekt på förmågan att framföra fordon och använda maskiner.
SIMBRINZA kan orsaka yrsel, trötthet och/eller dåsighet, vilket kan påverka förmågan att framföra fordon eller använda maskiner.
Tillfällig dimsyn eller andra synstörningar kan påverka förmågan att framföra fordon och använda maskiner. Om dimsyn uppträder vid instillationen ska patienten vänta med att framföra fordon eller använda maskiner tills synen klarnat.
Orala karbanhydrashämmare kan hos äldre försämra förmågan att utföra uppgifter som kräver mental vakenhet och/eller fysisk koordination (se avsnitt Varningar och försiktighet).
Biverkningar
Summering av säkerhetsprofilen
I kliniska prövningar med SIMBRINZA doserat två gånger dagligen var de vanligaste biverkningarna okulär hyperemi och okulära reaktioner av allergisk typ vilka uppkom hos cirka 6–7 % av patienterna, och dysgeusi (bitter eller ovanlig smak i munnen efter instillation) vilket uppkom hos cirka 3 % av patienterna.
Biverkningslista i tabellform
Nedanstående biverkningar har rapporterats under kliniska studier med SIMBRINZA doserat två gånger dagligen och under kliniska studier och övervakning efter godkännandet för försäljning med de enskilda komponenterna brinzolamid och brimonidin. De klassificeras enligt följande konvention: mycket vanliga (≥ 1/10); vanliga (≥ 1/100, < 1/10); mindre vanliga (≥ 1/1 000, < 1/100); sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (<1/10 000) eller ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgrupp presenteras biverkningarna i minskande allvarlighetsgrad.
|
Organsystemklass |
Biverkningar |
|
Infektioner och infestationer |
Mindre vanliga: nasofaryngit2, faryngit2, sinuit2 Ingen känd frekvens: rinit2 |
|
Blodet och lymfsystemet |
Mindre vanliga: minskat antal röda blodkroppar2, ökad halt klorid i blod2 |
|
Immunsystemet |
Mindre vanliga: överkänslighet3 |
|
Psykiska störningar |
Mindre vanliga: apati2, depression2,3, sänkt stämningsläge2, insomni1, minskad sexualdrift2, mardrömmar2, nervositet2 |
|
Centrala och perifera nervsystemet |
Vanliga: somnolens1, yrsel3, dysgeusi1 Mindre vanliga: huvudvärk1, motorisk dysfunktion2, amnesi2, nedsatt minne2, parestesi2 Mycket sällsynta: synkope3 Ingen känd frekvens: tremor2, hypoestesi2, ageusi2 |
|
Ögon |
Vanliga: ögonallergi1, keratit1, ögonsmärta1, obehag i ögonen1, dimsyn1, onormal syn3, okulär hyperemi1, konjunktival blekning3 Mindre vanliga: korneal erosion1, kornealt ödem2, blefarit1, korneala fällningar (keratitprecipitat) 1, konjunktival störning (papiller) 1, fotofobi1, fotopsi2, ögonsvullnad2, ögonlocksödem1, konjunktivalt ödem1, ögontorrhet1, utsöndring från ögat1, nedsatt synskärpa2, ökat tårflöde1, pterygium2, erytem på ögonlocket1, meibomianit2, diplopi2, bländning2, hypoestesi i ögat2, skleral pigmentering2, subkonjunktival cysta2, onormal känsel i ögat1, astenopi1 Mycket sällsynta: uveit3, mios3 Ingen känd frekvens: synstörningar2, madaros2 |
|
Öron och balansorgan |
Mindre vanliga: vertigo1, tinnitus2 |
|
Hjärtat |
Mindre vanliga: hjärt-lungproblem2, angina pectoris2, arytmi3, palpitationer2,3, oregelbundna hjärtslag2, bradykardi2,3, takykardi3 |
|
Blodkärl |
Mindre vanliga: hypotoni1 Mycket sällsynta: hypertoni3 |
|
Andningsvägar, bröstkorg och mediastinum |
Mindre vanliga: dyspné2, bronkial hyperaktivitet2, faryngolaryngeal smärta2, svalgtorrhet1, hosta2, epistaxis2, tilltäppning i övre luftvägarna2, nästäppa1, rinorré2, svalgirritation2, nästorrhet1, postnasalt dropp1, nysning2 Ingen känd frekvens: astma2 |
|
Magtarmkanalen |
Vanliga: muntorrhet1 Mindre vanliga: dyspepsi1, esofagit2, bukobehag1, diarré2, kräkning2, illamående2, frekventa tarmtömningar2, flatulens2, oral hypoestesi2, oral parestesi1 |
|
Lever och gallvägar |
Ingen känd frekvens: onormala resultat på leverfunktionstest2 |
|
Hud och subkutan vävnad |
Mindre vanliga: kontaktdermatit1, urtikaria2, utslag2, makulo-papulära utslag2, generaliserad klåda2, alopeci2, stram hud2 Ingen känd frekvens: Stevens-Johnsons syndrom (SJS)/toxisk epidermal nekrolys (TEN) (se avsnitt Varningar och försiktighet), ansiktsödem3, dermatit2,3, erytem2,3 |
|
Muskuloskeletala systemet och bindväv |
Mindre vanliga: ryggsmärta2, muskelspasmer2, myalgi2 Ingen känd frekvens: artralgi2, smärta i extremitet2 |
|
Njurar och urinvägar |
Mindre vanliga: njursmärta2 Ingen känd frekvens: pollakiuri2 |
|
Reproduktionsorgan och bröstkörtel |
Mindre vanliga: erektil dysfunktion2 |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mindre vanliga: smärta2, obehag i bröstet2, onormal känsla2, nervositet2, irritabilitet2, läkemedelsrester1 Ingen känd frekvens: bröstsmärta2, perifera ödem2,3 |
|
1 biverkning som observerats med SIMBRINZA 2 ytterligare biverkning som observerats vid monoterapi med brinzolamid 3 ytterligare biverkning som observerats vid monoterapi med brimonidin |
|
Beskrivning av utvalda biverkningar
Dysgeusi var den vanligast förekommande systemiska biverkningen förknippad med behandling med SIMBRINZA (3,4 %). Den orsakas troligen av passage av ögondropparna till nasofarynx via den nasolakrimala kanalen och anses främst bero på brinzolamidkomponenten i SIMBRINZA. Nasolakrimal ocklusion eller försiktigt slutande av ögonlocket efter instillationen kan minska förekomsten av denna biverkan (se avsnitt Dosering).
SIMBRINZA innehåller brinzolamid, som är en karbanhydrashämmare av sulfonamidtyp, vilken absorberas systemiskt. Gastrointestinala, centralnervösa, hematologiska, renala och metabola effekter förknippas vanligen med systemiska karbanhydrashämmare. Samma typ av biverkningar som hänförs till perorala karbanhydrashämmare kan förekomma även vid topikal tillförsel.
Biverkningar som brukar associeras med brimonidinkomponenten i SIMBRINZA inkluderar utvecklingen av ögonreaktioner av allergisk typ, trötthet och/eller dåsighet och muntorrhet. Användningen av brimonidin har associerats med minimala blodtryckssänkningar. Vissa patienter som doserades med SIMBRINZA fick blodtryckssänkningar liknande de som sågs vid användningen av brimonidin som monoterapi.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Vid en överdos av SIMBRINZA bör behandlingen inriktas på symtomen och vara stödjande. Fria luftvägar ska upprätthållas hos patienten.
På grund av brinzolamidkomponenten i SIMBRINZA kan elektrolytobalans, utveckling av acidos och möjligen effekter på nervsystemet uppkomma. Serumelektrolytnivåer (särskilt kalium) och pH-nivån i blodet ska mätas.
Det finns mycket begränsad information om oavsiktligt intag av brimonidinkomponenten i SIMBRINZA för vuxna. Hittills är den enda rapporterade biverkningen hypotoni. Det rapporterades att den hypotensiva episoden följdes av hypertoni som en rebound-effekt.
Perorala överdoser av andra alfa-2-agonister har rapporterats ge symtom som hypotoni, asteni, kräkning, letargi, sedering, bradykardi, arytmier, mios, apné, hypotoni, hypotermi, andningsdepression och krampanfall.
Pediatrisk population
Allvarliga biverkningar hos barn efter oavsiktligt intag av brimonidinkomponenten i SIMBRINZA har rapporterats. Patienterna fick symtom på CNS-depression, i typfallet tillfällig koma eller låg medvetandegrad, letargi, somnolens, hypotoni, bradykardi, hypotermi, blekhet, andningsdepression och apné, och måste läggas in för intensivvård med intubation när det var indicerat. Alla patienter rapporterades ha tillfrisknat helt, oftast inom 6–24 timmar.
Farmakodynamik
Verkningsmekanism
SIMBRINZA innehåller två aktiva substanser: brinzolamid och brimonidintartrat. Dessa två komponenter sänker det intraokulära trycket (IOP) hos patienter med öppenvinkelglaukom (OAG) och okulär hypertoni (OHT) genom att undertrycka bildandet av kammarvatten från strålkroppen i ögat. Även om både brinzolamid och brimonidin sänker IOP genom att undertrycka bildandet av kammarvatten, är deras verkningsmekanismer olika.
Brinzolamid verkar genom att hämma enzymet karbanhydras (CA-II) i det ciliära epitelet, vilket minskar bildandet av bikarbonatjoner med följd att transporten av natrium och vätska genom det ciliära epitelet minskar. Detta leder i sin tur till att bildandet av kammarvatten minskar. Brimonidin, en alfa-2-adrenerg agonist, hämmar enzymet adenylatcyklas och undertrycker det cAMP-beroende bildandet av kammarvatten. Dessutom leder administrering av brimonidin till en ökning av det uveosklerala utflödet.
Farmakodynamisk effekt
Klinisk effekt och säkerhet
Monoterapi
I en 6-månaders, kontrollerad klinisk studie med bidrag av olika element, på 560 patienter med öppenvinkelglaukom (inklusive pseudoexfoliation eller pigmentspridningskomponent) och/eller okulär hypertoni vilka, enligt prövarens åsikt, var otillräckligt kontrollerade med monoterapi eller redan stod på flera IOP-sänkande läkemedel, och vilka hade ett vid baslinjen genomsnittligt diurnalt IOP på 26 mmHg, var den genomsnittliga diurnala IOP-sänkande effekten av SIMBRINZA doserat två gånger dagligen cirka 8 mmHg. Statistiskt överlägsna sänkningar av genomsnittligt diurnalt IOP observerades med SIMBRINZA jämfört med brinzolamid 10 mg/ml eller brimonidin 2 mg/ml som doserades två gånger dagligen vid alla besök under hela studien (bild 1).
Bild 1 Genomsnittliga diurnal (9.00, +2 timmar, +7 timmar) IOP-förändring från baslinjen (mmHg) – Studie med bidrag av olika element
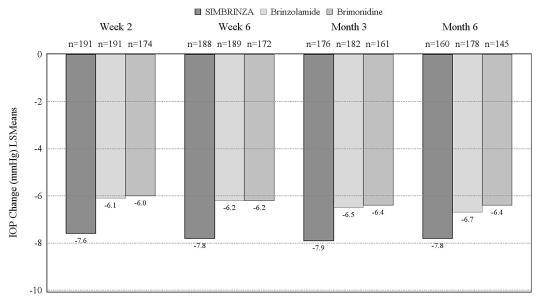
aMinstakvadratmedelvärden är erhållna från en statistisk modell som gäller för studiekliniken, skiktet för baslinje-IOP kl. 9.00, och korrelerade IOP-mätningar för en och samma patient.
Alla behandlingsdifferenser (SIMBRINZA mot enskilda komponenter) var statistiskt signifikanta med p=0,0001 eller lägre.
Genomsnittliga IOP-sänkningar från baslinjen vid varje tidpunkt vid varje besök var större med SIMBRINZA (6 till 9 mmHg) än monoterapi med antingen brinzolamid (5 till 7 mmHg) eller brimonidin (4 till 7 mmHg). Genomsnittliga procentuella IOP-sänkningar från baslinjen med SIMBRINZA varierade mellan 23 och 34 %. Procentandelarna av patienter med ett IOP-värde under 18 mmHg var större i SIMBRINZA-gruppen än i brinzolamidgruppen vid 11 av 12 mätningar till och med månad 6 och större i SIMBRINZA-gruppen än i brimonidingruppen vid alla 12 mätningar till och med månad 6. Vid tidpunkten + 2 timmar (tidpunkten som motsvarade effektmaxvärdet på morgonen) för det primära effektbesöket vid månad 3, var procentandelen patienter med ett IOP under 18 mmHg 68,8 % i SIMBRINZA-gruppen, 42,3 % i brinzolamid-gruppen och 44,0 % i brimonidin-gruppen.
I en 6-månaders, kontrollerad, klinisk non-inferiority-studie på 890 patienter med öppenvinkelglaukom (inklusive pseudoexfoliation eller pigmentspridningskomponent) och/eller okulär hypertoni vilka, enligt prövarens åsikt, var otillräckligt kontrollerade med monoterapi eller redan stod på flera IOP-sänkande läkemedel, och vilka hade ett vid baslinjen genomsnittligt diurnalt IOP på 26 till 27 mmHg, påvisades non-inferiority för SIMBRINZA jämfört med samtidig dosering av brinzolamid 10 mg/ml + brimonidin 2 mg/ml vid alla besök under hela studien med hänsyn till den genomsnittliga diurnala IOP-sänkningen från baslinjen (tabell 1).
Tabell 1 Jämförelse av förändring av genomsnittligt diurnalt IOP (mmHg) från baslinjen – non-inferiority-studie
|
Besök |
SIMBRINZA Genomsnitta |
Brinzolamid + brimonidin Genomsnitta |
Differens Genomsnitta (95 % CI) |
|
Vecka 2 |
–8,4 (n=394) |
–8,4 (n=384) |
–0,0 (–0,4; 0,3) |
|
Vecka 6 |
–8,5 (n=384) |
–8,4 (n=377) |
–0,1 (–0,4; 0,2) |
|
Månad 3 |
–8,5 (n=384) |
–8,3 (n=373) |
–0,1 (–0,5; 0,2) |
|
Månad 6 |
–8,1 (n=346) |
–8,2 (n=330) |
0,1 (–0,3; 0,4) |
|
a Minstakvadratmedelvärden är erhållna från en statistisk modell som gäller för studiekliniken, skiktet för baslinje-IOP kl. 9.00, och korrelerade IOP-mätningar för en och samma patient |
|||
Genomsnittliga IOP-sänkningar från baslinjen vid varje tidpunkt vid varje besök med SIMBRINZA eller de enskilda komponenterna som administrerades samtidigt var likartade (7 till 10 mmHg). Genomsnittliga procentuella IOP-sänkningar från baslinjen med SIMBRINZA varierade mellan 25 och 37 %. Procentandelarna patienter med ett IOP-värde under 18 mmHg var likartade mellan studiebesöken för samma tidpunkt till och med månad 6 i grupperna med SIMBRINZA och brinzolamid + brimonidin. Vid tidpunkten + 2 timmar (tidpunkten som motsvarade effektmaxvärdet på morgonen) för det primära effektbesöket vid månad 3, var procentandelen patienter med ett IOP under 18 mmHg 71,6 % i båda studiegrupperna.
Tilläggsterapi
Kliniska data för SIMBRINZA som tillägg till prostaglandinanaloger (PGA) visade överlägsen IOP-sänkande effekt av SIMBRINZA + PGA jämfört med enbart PGA. I studien CQVJ499A2401 visade SIMBRINZA + PGA (dvs travoprost, latanoprost eller bimatoprost) överlägsen IOP-sänkande effekt från baslinjen jämfört med placebo + PGA efter 6 veckors behandling, där skillnaden i modelljusterad genomsnittlig förändring från baslinjen i diurnalt IOP var -3,44 mmHg (95% Cl, -4,2, -2,7; p-värde <0,001).
Kliniska data för SIMBRINZA som tillägg till travoprost-timolol maleat ögondroppar med fast doskombination visade också överlägsen IOP-sänkande effekt av SIMBRINZA + travoprost-timolol maleat jämfört med enbart travoprost-timolol maleat. I studien CQVJ499A2402 visade SIMBRINZA + travoprost-timololmaleat ögondroppar överlägsen IOP-sänkande effekt från baslinjen jämfört med placebo + travoprost-timolol maleat efter 6 veckors behandling, där skillnaden i modelljusterad genomsnittlig förändring från baslinjen i diurnalt IOP var -2,15 mmHg (95% Cl, -2,8, -1,5; p-värde <0,001).
Säkerhetsprofilen för SIMBRINZA i tilläggsterap var liknande den som observerades med SIMBRINZA monoterapi.
Det finns inga effekt- och säkerhetsdata för tilläggsterapi längre än 6 veckor.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för SIMBRINZA, för alla grupper av den pediatriska populationen för behandling av glaukom och okulär hypertoni (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Brinzolamid absorberas genom hornhinnan efter topikal okulär administrering. Substansen absorberas även i den systemiska cirkulationen där den binds starkt till karbanhydras i röda blodceller (RBC). Plasmakoncentrationerna är mycket låga. Elimineringshalveringstiden i helblod är förlängd (> 100 dagar) hos människor på grund av bindningen till karbanhydras i RBC.
Brimonidin absorberas snabbt i ögat efter topikal administrering. Hos kaniner nåddes maximala okulära koncentrationer på mindre än en timme i de flesta fall. Maximala plasmakoncentrationer hos människa är < 1 ng/ml vilket uppnås inom < 1 timme. Plasmakoncentrationerna minskar med en halveringstid på cirka 2–3 timmar. Det sker ingen ackumulering under kronisk administrering.
I en topikal okulär klinisk studie där man jämförde den systemiska farmakokinetiken för SIMBRINZA administrerat två eller tre gånger dagligen, med brinzolamid och brimonidin, administrerat individuellt med användning av samma två doseringar, var farmakokinetiken för brinzolamid och N-desetylbrinzolamid vid steady state i helblod likartad mellan kombinationsprodukten och brinzolamid som administrerades ensamt. På samma sätt var farmakokinetiken för brimonidin från kombinationsprodukten i plasma vid steady state likartad med den som observerades för brimonidin administrerat ensamt med undantag av gruppen som behandlades med SIMBRINZA två gånger dagligen. För denna grupp var genomsnittlig AUC0–12 timmar cirka 25 % lägre än den för brimonidin ensamt som administrerades två gånger dagligen.
Distribution
Studier på kaniner visade att maximala okulära koncentrationer av brinzolamid efter topikal administrering finns i de främre vävnaderna som hornhinnan, konjunktivan, kammarvattnet och iris-strålkroppen. Retention i ögonvävnader är förlängd på grund av bindning till karbanhydras. Brinzolamid binds måttligt (cirka 60 %) till humana plasmaproteiner.
Brimonidin uppvisar affinitet för pigmenterade ögonvävnader, särskilt iris-strålkroppen, på grund av dess kända melaninbindande egenskaper. Kliniska och icke-kliniska säkerhetsdata visar emellertid att det är väl tolererat och säkert under kronisk administrering.
Metabolism
Brinzolamid metaboliseras av hepatiska cytokrom P450-isozymer, specifikt CYP3A4, CYP2A6, CYP2B6, CYP2C8 och CYP2C9. Den primära metaboliten är N-desetylbrinzolamid följt av metaboliterna N-desmetoxypropyl och O-desmetyl liksom en N-propionsyraanalog som bildas genom oxidering av N-propylsidokedjan av O-desmetylbrinzolamid. Brinzolamid och N-desetylbrinzolamid hämmar inte cytokrom P450-isoenzymer vid koncentrationer som är minst 100 gånger större än maximala systemiska nivåer.
Brimonidin metaboliseras i stor omfattning av hepatiskt aldehydoxidas med bildande av 2-oxobrimonidin, 3-oxobrimonidin och 2,3-dioxobrimonidin som de främsta metaboliterna. Oxidativ klyvning av imidazolinringen till 5-brom-6-guanidinkinoxalin har också observerats.
Eliminering
Brinzolamid elimineras främst oförändrat i urin. Hos människor stod urinärt brinzolamid och N-desetylbrinzolamid för cirka 60 respektive 6 % av dosen. Data från råttor visade viss biliär utsöndring (cirka 30 %), främst som metaboliter.
Brimonidin elimineras främst i urinen som metaboliter. Hos råttor och apor stod urinära metaboliter för 60 till 75 % av perorala eller intravenösa doser.
Linjäritet/icke-linjäritet
Farmakokinetiken för brinzolamid är till sin natur icke-linjär på grund av mättnadsbar bindning till karbanhydras i helblod och olika vävnader. Steady state-exponering ökar inte på dosproportionellt sätt.
Däremot uppvisar brimonidin linjär farmakokinetik över det kliniskt terapeutiska dosintervallet.
Farmakokinetiskt (Farmakokinetiska)/farmakodynamiskt (farmakodynamiska) förhållande(n)
SIMBRINZA är avsett för lokal verkan i ögat. Bedömning av human okulär exponering vid effektiva doser är inte genomförbar. Det farmakokinetiska/farmakodynamiska förhållandet hos människor för IOP-sänkning har inte fastställts.
Övriga särskilda populationer
Studier för att fastställa effekter av ålder, etnisk tillhörighet samt nedsatt njur- eller leverfunktion har inte utförts med SIMBRINZA. En studie av brinzolamid på japanska jämfört med icke-japanska försökspersoner visade likartad systemisk farmakokinetik mellan de två grupperna. I en studie av brinzolamid på patienter med nedsatt njurfunktion påvisades en ökning på 1,6 till 2,8 gånger i den systemiska exponeringen för brinzolamid och N-desetylbrinzolamid mellan personer med normal respektive måttligt nedsatt njurfunktion. Denna ökning i RBC-koncentrationerna av substansrelaterade material vid steady state hämmade inte aktiviteten hos RBC-karbanhydras till nivåer som associeras med systemiska biverkningar. Kombinationsprodukten rekommenderas emellertid inte för patienter med kraftigt nedsatt njurfunktion (kreatininclearance < 30 ml/min).
Cmax, AUC och elimineringshalveringstiden för brimonidin är likartade hos äldre (> 65 år) personer jämfört med unga vuxna. Effekterna av nedsatt njur- och leverfunktion på den systemiska farmakokinetiken för brimonidin har inte utvärderats. Med tanke på den låga systemiska exponeringen för brimonidin efter topikal okulär administrering, förväntas inte ändringar i plasmaexponering vara kliniskt relevanta.
Pediatrisk population
Den systemiska farmakokinetiken för brinzolamid och brimonidin, var för sig eller i kombination, har inte studerats på barn.
Prekliniska uppgifter
Brinzolamid
Gängse studier avseende säkerhetsfarmakologi, toxicitet vid enkel dosering, allmäntoxicitet, gentoxicitet och karcinogenicitet visade inte några särskilda risker för människa.
Effekter i icke-kliniska studier av reproduktions- och utvecklingstoxicitet observerades endast vid exponeringar som ansågs vara tillräckligt mycket högre än den maximala exponeringen för människa, vilket indikerar föga relevans för klinisk användning. Studier av utvecklingstoxicitet på kanin med orala doser av brinzolamid upp till 6 mg/kg/dag (261 gånger den rekommenderade dagliga kliniska dosen 23 mikrog/kg/dag) visade inga effekter på fosterutveckling trots toxiska effekter på mödrarna. Hos råttor medförde doser på 18 mg/kg/dag (783 gånger den rekommenderade dagliga kliniska dosen), men inte 6 mg/kg/dag, en lätt försämrad benbildning i skalle och bröstbenssegment hos foster. Dessa fynd associerades med metabolisk acidos med reducerad viktökning hos honorna och en viktminskning hos fostren. Dosrelaterade minskningar av fostervikterna sågs hos ungar till mödrar som gavs 2 till 18 mg/kg/dag. Under laktation var den biverkningsfria nivån hos avkomman 5 mg/kg/dag.
Brimonidin
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Innehåll
Kvalitativ och kvantitativ sammansättning
En ml suspension innehåller 10 mg brinzolamid och 2 mg brimonidintartrat motsvarande 1,3 mg brimonidin.
Hjälpämne med känd effekt:
En ml suspension innehåller 0,03 mg bensalkoniumklorid.
Förteckning över hjälpämnen
Bensalkoniumklorid Propylenglykol Karbomer 974P Borsyra Mannitol NatriumkloridTyloxapol
Saltsyra och/eller natriumhydroxid (för att justera pH)
Renat vatten
Blandbarhet
Ej relevant.
Miljöpåverkan
Brimonidin
Miljörisk:
Risk för miljöpåverkan av brimonidin kan inte uteslutas då ekotoxikologiska data saknas.
Nedbrytning:
Det kan inte uteslutas att brimonidin är persistent, då data saknas.
Bioackumulering:
Det kan inte uteslutas att brimonidin kan bioackumuleras, då data saknas.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6 * A * (100 - R) = 1.37*10-6 * 2.46 kg * 100 = 0.000337 μg/L = 0.337 ng/L
Where:
A = 2.4595 kg (total sold amount API in Sweden year 2022, data from IQVIA).
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0, if no data is available.
P = number of inhabitants in Sweden = 10 * 106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA 2008)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA 2008).
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae: no data available
Crustacean (Daphnia magna): no data available
Fish: no data available
Other ecotoxicity data: No data available
PNEC derivation:
No PNEC can be calculated since there is no environmental toxicity data available.
Environmental risk classification (PEC/PNEC ratio)
Calculation of a risk ratio is not possible, due to the lack of environmental toxicity data. Therefore, the following phrase is used: "Risk of environmental impact of brimonidin cannot be excluded, since no ecotoxicity data are available." According to the European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00), use of brimonidin is unlikely to represent a risk for the environment, because the predicted environmental concentration (PEC) at the time of registration is below the action limit 0.01 μg/L.
Degradation
Biotic degradation
Ready degradability: no data available
Justification of chosen degradation phrase:
As no data on biological degradation is available, the following phrase is used: The potential for persistence of brimonidin cannot be excluded, due to lack of data.
Bioaccumulation
Partitioning coefficient:
No data available
Justification of chosen bioaccumulation phrase:
As no information on the octanol-water partition coefficient is available, the following statement is used for fluorescein: The potential for bioaccumulation of brimonidin cannot be excluded, due to lack of data.
Excretion (metabolism)
Following administration of brimonidine tartrate gel (1 g of gel containing 5 mg of brimonidine tartrate applied to the entire face) once daily for 29 days in patients with erythema associated with rosacea, peak plasma concentration and area under the concentration-time curve (AUC) were 40 and 20%, respectively, those observed following administration of brimonidine tartrate 0.2% ophthalmic solution (1 drop in each eye every 8 hours for 24 hours). Mean peak plasma concentration and AUC were highest on day 15 in patients receiving brimonidine gel. Systemic exposure was slightly lower on day 29, indicating no further drug accumulation with brimonidine gel application.
Brimonidine is extensively metabolized by the liver.1 Urinary excretion is the major route of elimination of brimonidine and its metabolites (Medicines Complete 2017).
References
-
ECHA 2008, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment. http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm
-
MedicinesComplete © 2017 Royal Pharmaceutical Society. AHFS Drug Information. https://www.medicinescomplete.com/mc/ahfs/current/a315044.htm?q=brimonidine&t=search&ss=text&tot=2&p=1#_hit
Brinzolamid
Miljörisk:
Risk för miljöpåverkan av brinzolamid kan inte uteslutas då ekotoxikologiska data saknas.
Nedbrytning:
Det kan inte uteslutas att brinzolamid är persistent, då data saknas.
Bioackumulering:
Brinzolamid har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6 * A * (100 - R) = 1.37*10-6 * 23.7 * 100 = 0.0032 μg/L
Where:
A = 23.6637 kg brinzolamide (total sold amount API in Sweden year 2021, data from IQVIA).
R = 0 % removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0, if no data is available.
P = number of inhabitants in Sweden = 10 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA 2008)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA 2008)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae: no data available
Crustacean (Daphnia magna): no data available
Fish: no data available
Other ecotoxicity data: No data available
PNEC derivation:
No PNEC can be calculated since there is no environmental toxicity data available
Environmental risk classification (PEC/PNEC ratio)
Calculation of a risk ratio is not possible, due to the lack of environmental toxicity data. Therefore, the following phrase is used: "Risk of environmental impact of brinzolamide cannot be ruled out as ecotoxicological data are missing."
According to the European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00), use of brinzolamide is unlikely to represent a risk for the environment, because the predicted environmental concentration (PEC) at the time of registration was below the action limit 0.01 μg/L.
Degradation
Biotic degradation
Ready degradability: no data available
Justification of chosen degradation phrase:
As no data on biological degradation is available the following phrase is used: ‘The potential for persistence of brinzolamide cannot be excluded, due to lack of data.’
Bioaccumulation
Partitioning coefficient:
logKow = 0.817 (method unknown) (Alcon Technical Report No. 136:60:0900)
Justification of chosen bioaccumulation phrase:
As log Kow < 4, the following statement is used for Brinzolamide: ‘Brinzolamide has low potential for bioaccumulation.’
Excretion (metabolism)
Following topical or systemic administration, brinzolamide undergoes metabolic reactions that include N-dealkylation, O-dealkylation and oxidation of the N-propyl side chain, all CYP-450 catalyzed reactions. N-desethyl brinzolamide is the major metabolite of brinzolamide in primates and human whole blood and is the only quantifiable metabolite in human whole blood. (Alcon Technical Report No. 025:38570:0596, Alcon Technical Report No. 027:38570:0596, Alcon Technical Report No. 029:38570:0596, Alcon Technical Report No. 037:38570:0796) Studies with radioactive 14C-brinzolamide revealed that after 24 hours following an IV does, that approximately 50-60% of brinzolamide was excreted unchanged from the body and that approximately 42% remained in the blood and the carcass. (Alcon Technical Report No. 014:38570:0496)
PBT/vPvB assessment
Based on screening information, brinzolamide cannot be considered a potential PBT substance as the octanol-water partition coefficient remains significantly below the trigger level for a bioaccumulative substance.
References
-
ECHA 2008, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment. http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm
-
EMA 2006, European Medicines Agency. European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00). https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-environmental-risk-assessment-medicinal-products-human-use-first-version_en.pdf
-
Alcon Technical Report No. 136:60:0900
-
Alcon Technical Report No. 025:38570:0596
-
Alcon Technical Report No. 027:38570:0596
-
Alcon Technical Report No. 029:38570:0596
-
Alcon Technical Report No. 037:38570:0796
-
Alcon Technical Report No. 014:38570:0496
Hållbarhet, förvaring och hantering
Hållbarhet
2 år.
4 veckor efter öppnandet.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Inga särskilda anvisningar.
Egenskaper hos läkemedelsformen
Ögondroppar, suspension (ögondroppar).
Vit till benvit homogen suspension, pH cirka 6,5.
Förpackningsinformation
Ögondroppar, suspension 10 mg/ml + 2 mg/ml
Vit till benvit homogen suspension, ögondroppar
5 milliliter flaska, 194:81, F
3 x 5 milliliter flaska, 458:99, F
Följande produkter har även parallelldistribuerade förpackningar:
Ögondroppar, suspension 10 mg/ml + 2 mg/ml





