Indikationer
Mydriasert används för att:
-
framkalla pre-operativ mydriasis,
-
eller för diagnostiska syften i fall där man vet att monoterapi är otillräcklig.
Kontraindikationer
-
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i Innehåll.
-
Risk för glaukom genom blockad av kammarvinkeln: Patienter med sluten kammarvinkelglaukom (såvida inte tidigare behandling med iridektomi) och patienter med trång kammarvinkel och patienter med benägenhet för glaukom framkallat av mydriatika.
-
Barn under 12 år (se Varningar och försiktighet).
Dosering
Får endast användas av hälso- och sjukvårdspersonal.
En ögonlamell per öga som skall opereras, högst 2 timmar före operation eller undersökning (se även Farmakodynamik).
Pediatrisk population
Mydriasert är kontraindicerat för barn under 12 år (se Kontraindikationer).
Det finns inga data tillgängliga om användning hos barn mellan 12 och 18 år. Mydriasert rekommenderas inte för dessa patienter.
Administreringssätt
Klipp av den tillslutna kanten längs den punkterade linjen, öppna dospåsen och lokalisera lamellen.
Håll lamellen med steril engångspincett med jämna kanter (finns i förpackningen) utan att skada den.
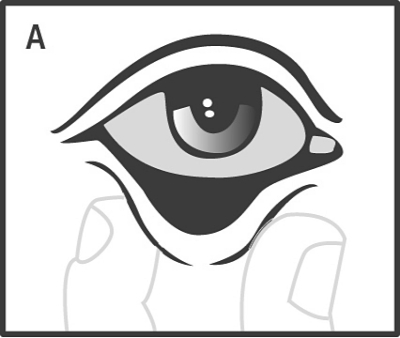
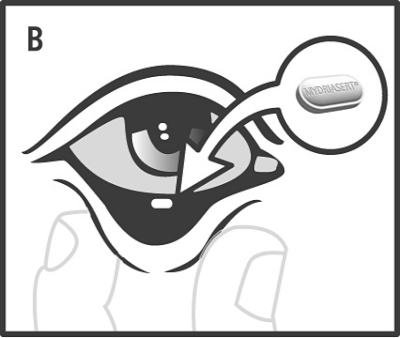
Dra ut det nedre ögonlocket genom att hålla i det med tumme och pekfinger (A), och placera ögonlamellen, med hjälp av den sterila engångspincetten, i den nedre konjunktivalsäcken (B).
Anvisningar för användning
Lämna inte kvar ögonlamellen längre än 2 timmar i den nedre konjunktivalsäcken. Läkaren kan avlägsna lamellen när framkallad mydriasis bedöms vara tillräcklig för den operation eller undersökning som skall utföras, och skall avlägsnas senast inom 30 minuter efter ingreppet.
Om patienten känner obehag, måste man säkerställa att lamellen har placerats korrekt i botten av den nedre konjunktivalsäcken.
Behandla aseptiskt. Det rekommenderas att undvika överdriven manipulering av ögonlocken.
FÖRSIKTIGHET: Avlägsnande av ögonlamell
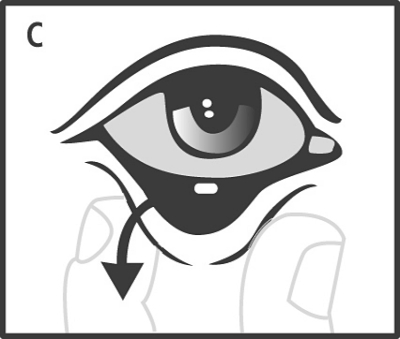
Före operation eller undersökning, och så fort den önskade graden av mydriasis har uppnåtts, måste ögonlamellen avlägsnas från den nedre konjunktivalsäcken (C) med hjälp av antingen en steril kirurgisk pincett, en steril kompress eller steril spol- eller sköljvätska medan det undre ögonlocket dras ut.
Lamellen får inte återanvändas. Kasta omedelbart bort lamellen efter användning.
| 
| 
|
Varningar och försiktighet
Varningar
Då detta läkemedel förorsakar långvariga visuella störningar bör patienten rådas att låta sig följas till läkarmottagningen (se Biverkningar).
Skydda ögat mot starkt ljus efter avslutat ingrepp/undersökning.
Okulär hyperemi kan öka absorptionen av de aktiva ämnena som finns i lamellen.
Försiktighet
Förflyttning, eller mera sällsynt, utstötning av inlägget kan inträffa. I sådana fall får lamellen inte återanvändas, utan en ny lamell måste appliceras (se Dosering).
Mydriasert får inte lämnas kvar i konjunktivalsäcken längre än 2 timmar. I fall där Mydriasert har kvarglömts har lokala biverkningar rapporterats (se Biverkningar).
På grund av ovanlig potentiell irritation av konjunktiva, bör speciell försiktighet iakttas hos patienter som lider av svårt torra ögon (användning av Mydriasert kan hos vissa patienter nödvändiggöra tillsättning av en droppe saltlösning för att ge en bättre tolerans av lamellen).
Alla pupillvidgande medel kan utlösa en akut glaukomattack genom mekanisk obstruktion av kammarvätskans avflöde hos patienter med trång iridokorneal vinkel.
Även om det inte förväntas vid användning av Mydriasert på grund av obetydlig systemisk passage av aktiva ämnen, bör det noteras att fenylefrin har sympatomimetisk aktivitet som kan påverka patienter med hypertoni, hjärtsjukdom, hypertyreoidism, ateroskleros eller prostataproblem samt alla patienter med kontraindikation mot systemisk användning av vasokonstriktoriska aminer.
Idrottsutövare och andra måste varnas för att detta läkemedel innehåller ett aktivt ämne (fenylefrin) som kan ge positiv reaktion i tester som används vid dopingkontroll.
Användning av mjuka, hydrofila kontaktlinser avrådes under behandling.
Efter placering av Mydriasert, måste man, om administrering av andra mydriatika inte går att undvika, räkna med de doserna som finns i lamellen, d.v.s. ungefär en droppe av en 10‑procentig lösning av fenylefrin och ungefär en droppe av en 0,5‑procentig lösning av tropikamid.
Pediatrisk population
Användning hos barn under 12 år är kontraindicerad. Detta pga. det vid användning av oftalmiska produkter som innehåller fenylefrin och tropikamid har rapporterats allvarliga systemiska biverkningar, såsom kardiovaskulära rubbningar (allvarlig hypertoni, hjärtrytmrubbningar och lungödem), särskilt i den pediatriska populationen. Jämfört med vuxna tycks barn under 12 år vara känsligare.
Användning hos barn i åldrarna 12 till 18 år rekommenderas inte eftersom tillräcklig klinisk erfarenhet saknas.
Interaktioner
Inga interaktionsstudier har utförts.
Graviditet
Uppgifter saknas beträffande användning av fenylefrin och tropikamid hos gravida kvinnor. Djurstudier är ofullständiga vad gäller effekter på graviditet, embryonal-/fosterutveckling, förlossning och utveckling efter födsel (se Prekliniska uppgifter).
Även om endast en obetydlig systemisk upptagning förväntas kan en låg systemisk exponering inte uteslutas.
Därför skall Mydriasert användas under graviditet endast då det är absolut nödvändigt.
Amning
Uppgifter saknas om passage av fenylefrin eller tropikamid till bröstmjölk. Emellertid är det orala upptaget av eventuellt utsöndrat fenylefrin försumbart. Å andra sidan kan spädbarn vara mycket känsliga för antikolinergika, och trots den förväntade obetydliga systemexponeringen rekommenderas inte användning av tropikamid under amning.
Mydriasert bör därför inte användas under amning.
Trafik
Mydriasert har påtaglig effekt på förmågan att framföra fordon och använda maskiner.
Patienterna bör varnas för de risker som förknippas med mydriatika och cykloplegiska medel, som kan orsaka störningar som yrsel, sömnighet och försämrad koncentration: applikation av Mydriasert orsakar invalidiserande mydriasis under flera timmar; därför måste patienten efter användning av lamellen avrådas från att framföra fordon och/eller använda maskiner medan de visuella störningarna kvarstår och/eller icke genomföra andra riskfyllda aktiviteter.
Biverkningar
Följande övergående effekter har rapporterats under kliniska prövningar och data från säkerhetsövervakning efter marknadsföring.
Biverkningarna indelas efter frekvens enligt följande: mycket vanliga (≥1/10), vanliga (≥1/100 till <1/10), mindre vanliga (≥1/1,000 till <1/100), sällsynta (≥1/10,000 till <1/1,000) och mycket sällsynta (<1/10,000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Klassificering av organsystem |
Mycket vanliga ≥1/10 |
Vanliga ≥1/100 till <1/10 |
Mindre vanliga ≥1/1,000 till <1/100 |
Sällsynta ≥1/10,000 to till <1/1,000 |
Mycket sällsynta <1/10,000 |
|
Centrala och perifera nervsystemet |
Krampanfall |
||||
|
Ögon |
Sveda; Dimsyn; Visuell obehagskänsla. |
Tårflöde; Irritation; Invalidiserande mydriasis på grund av utdragen pupilldilatation; Fotofobi; Ytlig punktatkeratit. |
Blefarit; Konjunktivit; Risk för glaukom på grund av blockad av kammarvinkeln; Intraokulär hypertension. |
Mycket sällsynta fall av kornealsår och kornealödem har observerats vid kvarglömd lamell.
Trots lokal administrering kan de mydriatika som finns i denna lamell förorsaka följande systemiska effekter vilka måste tas i beaktande:
-
ökning av blodtryck, takykardi,
-
mycket sällsynt är allvarligare händelser som problem med hjärtrytm,
-
darrningar, blekhet, huvudvärk, muntorrhet.
Pediatrisk population
-
Ögon
Periorbital pallor hos för tidigt födda patienter - ingen känd frekvens (kan inte beräknas från tillgängliga data)
-
Andningsvägar, bröstkorg och mediastinum
Lungödem - ingen känd frekvens (kan inte beräknas från tillgängliga data)
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Även om det är osannolikt till följd av en enstaka administrering av Mydriasert (i antingen pre-operativa eller diagnostiska syften), kan risk för överdosering likväl uppstå vid administrering av ytterligare mydriatiska ögondroppar.
Symtom på överdos av fenylefrin omfattar extrem trötthet, yrsel, långsam hjärtrytm och koma.
Då allvarlig toxisk reaktion på fenylefrin inträder snabbt och har kort varaktighet är behandlingen primärt stödjande. Omgående injektion av ett snabbt verkande alfa-adrenergt blockerande medel som t ex fentolamin (dos 2 till 5 mg i.v.) har rekommenderats.
Symtom på oftalmologisk överdos av tropikamid omfattar huvudvärk, snabb hjärtrytm, muntorrhet och torr hud, ovanlig sömnighet och blodvallning.
Systemiska effekter av tropikamid förväntas inte. Skulle en överdos uppstå, med lokala effekter till följd, t ex utdragen mydriasis, bör pilokarpin eller 0,25 % w/v fysostigmin appliceras.
Farmakodynamik
Mydriasert är en ögonlamell som kombinerar två syntetiska mydriatiska medel (fenylefrin som är ett alfa sympatikomimetikum, och tropikamid som är ett antikolinergikum).
Kliniska prövningar har visat att det tar mellan 45 och 90 minuter att nå en stabil och effektiv mydriasis. Maximal mydriasis (pupilldiameter på 9 mm) erhölls inom 90 till 120 minuter.
Efter att mydriasis hade nåtts kvarstod den under minst 60 minuter.
Återhämtning av pupillreflexen sågs efter 90 minuter i genomsnitt.
Farmakokinetik
Mycket låga koncentrationer av de aktiva substanserna, 1,9±3,4 µg/ml fenylefrin och 0,85±2,06 µg/ml tropikamid, återfanns i kammarvattnet hos 138 patienter som 2 timmar före kataraktoperation fick en ögonlamell applicerad. De ackumulerade mängderna av de aktiva substanserna som frigjordes inom 2 timmar från lamellen motsvarar mindre än 40 % av de doser som lamellen innehåller.
Under samma förhållanden var plasmanivåerna av fenylefrin, mätt under 6 timmar, icke detekterbara (< 0,5 nanogram/ml) hos friska frivilliga.
Prekliniska uppgifter
Säkerhetsfarmakologi, genotoxicitet och konventionella reproduktionsstudier har inte utförts med fenylefrin, tropikamid eller den fasta kombinationen.
Hos råttor resulterade administrering av fenylefrin (12,5 mg/kg, s.c.) i minskat uterint blodflöde (86, 8% reduktion på ungefär 15 minuter), vilket visar fetotoxiska och co-teratogena egenskaper.
En 14‑dagars lokal toleransstudie gjordes på kanin, med applicering av lamellen 6 timmar per dag. Denna studie visade en lätt irritation av konjunktiva i det området som var i kontakt med lamellen.
Innehåll
En ögonlamell innehåller 0,28 mg tropikamid och 5,4 mg fenylefrinhydroklorid.
Hjälpämnen: Ammoniometakrylatsampolymer (Typ A), polyakrylatdispersion 30 %, glyceroldibehenat, etylcellulosa.
Hållbarhet, förvaring och hantering
Hållbarhet
30 månader.
Efter första öppnandet av dospåsen: Användes omedelbart.
Efter första användning: Kassera lamellen omedelbart.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Särskilda anvisningar för destruktion
Klipp av den tillslutna kanten längs den punkterade linjen, öppna dospåsen och lokalisera lamellen.
Håll lamellen med steril engångspincett med jämna kanter som finns i förpackningen utan att skada den.
Dra ut det nedre ögonlocket genom att hålla i det med tumme och pekfinger (A), och placera ögonlamellen, med hjälp av den sterila engångspincetten, i den undre konjunktivalsäcken.
Endast för engångsbruk.
Användas omedelbart efter första öppnandet av dospåsen.
Kassera omedelbart lamellen efter användning.
Ej använt läkemedel och avfall skall hanteras enligt gällande anvisningar.




