Prismasol®
Kalciumkloriddihydrat/ Magnesiumkloridhexahydrat/ Glukosmonohydrat/ Mjölksyrelösning, 90 % w/w / Natriumklorid/ Kaliumklorid/ Natriumvätekarbonat
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa den igen.
-
Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
-
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information.
Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad Prismasol® är och vad det används för
2. Vad du behöver veta innan du använder Prismasol®
3. Hur du använder Prismasol®
4. Eventuella biverkningar
5. Hur Prismasol® ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad Prismasol® är och vad det används för
Prismasol innehåller de aktiva substanserna kalciumkloriddihydrat, magnesiumkloridhexahydrat, glukosmonohydrat, mjölksyrelösning 90 % w/w, natriumklorid, kaliumklorid och natriumvätekarbonat.
Prismasol används vid behandling av njursvikt som lösning vid kontinuerlig hemofiltration eller hemodiafiltration (som ersättning för den vätska som blodet förlorar då det passerar genom ett filter) och kontinuerlig hemodialys eller hemodiafiltration (blodet cirkulerar på den ena sidan av dialysmembranet medan hemodialysvätskan cirkulerar på den andra sidan av membranet).
Lösningen kan också användas vid läkemedelsförgiftning av dialyserbara eller filtrerbara substanser.
Prismasol 4 mmol/l kalium är speciellt indicerad för patienter med normokalemi (normal halt av kalium i blodet).
2. Vad du behöver veta innan du använder Prismasol®
Använd inte Prismasol 4 mmol/l kalium vid:
-
allergi mot någon av de aktiva substanserna eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6)
-
hög halt av kalium i blodet (hyperkalemi)
-
hög halt av bikarbonat i blodet (metabolisk alkalos).
Förekomst av majsantigen i Prismasol kan inte uteslutas.
Använd inte hemofiltration/dialys om:
-
du har njursvikt med uttalad hyperkatabolism (abnormt ökad katabolism) och de uremiska symptomen (symptom orsakade av hög halt av urinämne i blodet) inte kan korrigeras med hemofiltration
-
du har otillräckligt arteriellt tryck i kärlaccessen
-
du har systemisk antikoagulering (minskad koaguleringsförmåga) och det föreligger hög risk för blödning.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Prismasol.
Lösningen får endast användas av, eller under överinseende av läkare med kompetens inom behandling av njursvikt såsom hemofiltration, hemodiafiltration eller kontinuerlig hemodialys.
Före och under behandling kommer hemodynamisk status att kontrolleras, till exempel syra-bas-balans och halten av elektrolyter (salter i blodet) kommer att övervakas, inklusive all vätska du får (intravenös infusion) och som du producerar (urinproduktion), även den vätska som inte är direkt relaterad till behandlingen.
Blodsockernivån bör noggrant övervakas, särskilt om du har diabetes.
Andra läkemedel och Prismasol®
Tala med läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Blodkoncentrationen av andra läkemedel kan komma att reduceras under behandlingen. Läkaren avgör om medicineringen måste korrigeras.
Speciellt viktigt är det för läkaren att känna till om du använder:
-
Digitalispreparat (för behandling av vissa hjärtsjukdomar), eftersom digitalis ökar risken för hjärtarytmi (hjärtat slår oregelbundet eller snabbt) vid hypokalemi (låg kaliumhalt i blodet).
-
D-vitamin och läkemedel som innehåller kalcium eftersom de kan öka risken för hyperkalcemi (hög kalciumhalt i blodet).
-
Eventuella tillsatser av natriumvätekarbonat (eller annan buffertkälla) kan öka risken för metabolisk alkalos (överskott på bikarbonat i blodet).
-
När citrat används som en antikoagulant (som en skyddande tillsats i dialysutrustning) kan det sänka kalciumnivåerna i plasma.
Graviditet och amning
Om du är gravid eller ammar, tror du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Det är läkaren som avgör om du bör behandlas med Prismasol när du är gravid eller ammar.
Körförmåga och användning av maskiner
Prismasol är inte känt för att påverka körförmågan eller förmågan att använda maskiner.
3. Hur du använder Prismasol®
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Den volym Prismasol som ska användas varierar beroende på ditt kliniska tillstånd och eftersträvad vätskebalans. Doseringen är därför behandlande läkares ansvar.
Administreringssätt: För intravenöst bruk och för hemodialys.
Bruksanvisningen hittar du i avsnittet “Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal” nedan.
Om du tror att du har använt för stor mängd av Prismasol®
Din vätske-, elektrolyt- och syra-bas-balans kommer noggrant att övervakas.
Om det osannolika skulle inträffa att en överdosering sker kommer läkaren att vidta nödvändiga korrigerande åtgärder och justera dosen.
Överdosering kan resultera i:
-
för mycket vätska i blodet
-
förhöjd bikarbonatnivå i blodet (metabolisk alkalos)
-
och/eller sänkta saltnivåer i blodet (hypofosfatemi, hypokalemi).
Överdosering kan få allvarliga konsekvenser som hjärtsvikt, elektrolyt- eller syra-bas-rubbningar.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Följande biverkningar har rapporterats:
Har rapporterats: förekommer hos ett okänt antal användare
-
Förändringar av saltnivåerna i blodet (rubbad elektrolytbalans som hypofosfatemi)
-
Förhöjd halt av bikarbonat i blodplasma (metabolisk alkalos) eller sänkt halt av bikarbonat i blodplasma (metabolisk acidos)
-
Onormalt hög eller låg vätskenivå i kroppen (hyper- eller hypovolemi)
-
Onormalt hög halt av glukos i blodet (hyperglykemi)
-
Illamående
-
Kräkningar
-
Muskelkramper
-
Hypotoni (lågt blodtryck)
-
Hyperkalcemi (hög halt av kalcium i blodet).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur Prismasol® ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid lägst +4 °C.
Används före utgångsdatum som anges på etiketten och förpackningen efter Utg.dat. eller EXP. Utgångsdatumet är den sista dagen i angiven månad.
För den färdigblandade lösningen har kemisk och fysikalisk stabilitet vid användning visats för 24 timmar vid 22 °C. Om den inte används omedelbart är förvaringstiden och förvaringsvillkoren före administrering användarens ansvar och bör inte överstiga 24 timmar, inklusive tiden för behandling.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
De aktiva substanserna är:
Före blandning:
|
Kalciumkloriddihydrat |
5,145 g |
|
Magnesiumkloridhexahydrat |
2,033 g |
|
Glukos |
22,000 g |
|
(S)-mjölksyra |
5,400 g |
|
Natriumklorid |
6,450 g |
|
Natriumvätekarbonat |
3,090 g |
|
Kaliumklorid |
0,314 g |
Efter blandning
|
mmol/l |
mEq/l |
||
|---|---|---|---|
|
Kalcium |
Ca2+ |
1,75 |
3,50 |
|
Magnesium |
Mg2+ |
0,50 |
1,00 |
|
Natrium |
Na+ |
140,00 |
140,00 |
|
Klorid |
Cl- |
113,50 |
113,50 |
|
Laktat |
3,00 |
3,00 |
|
|
Vätekarbonat |
HCO3- |
32,00 |
32,00 |
|
Kalium |
K+ |
4,00 |
4,00 |
|
Glukos |
6,10 | ||
|
Teoretisk osmolaritet |
301 mOsm/l |
||
Övriga innehållsämnen är: koldioxid (E290), vatten för injektionsvätskor
pH hos den färdigblandade lösningen: 7,0–8,5.
Läkemedlets utseende och förpackningsstorlekar
Prismasol är förpackad i en tvåkammarpåse med elektrolytlösning i den mindre kammaren A och buffertlösning i den större kammaren B. Den färdigblandade lösningen erhålles genom att öppna den s.k. svetsfogen och blanda de båda lösningarna. Den färdigblandade lösningen är klar och svagt gul. Varje påse (A+B) innehåller 5000 ml ersättningslösning för hemofiltration och hemodialys. Påsen har en ytterförpackning av en transparent film.
Varje låda innehåller två påsar och en bipacksedel.
Innehavare av godkännande för försäljning
Baxter Holding B.V.
Kobaltweg 49
3542CE Utrecht
Nederländerna
Tillverkare
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), Italien
Baxter Healthcare S.A., Moneen Road, Castlebar, County Mayo, F23 XR63, Irland
Lokal företrädare
Baxter Medical AB
Box 63
164 94 Kista
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet och i Förenadekungariket (Nordirland) under namnen:
Belgien, Bulgarien, Cypern, Danmark, Estland, Finland, Frankrike, Grekland, Irland, Island, Italien, Lettland, Litauen, Luxemburg, Malta, Nederländerna, Norge, Polen, Portugal, Rumänien, Slovakien, Slovenien, Spanien, Storbritannien (Nordirland), Sverige, Tjeckien, Tyskland, Ungern, Österrike: Prismasol 4.
Denna bipacksedel ändrades senast 2023-12-11
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Prismasol 4 mmol/l kalium hemodialysvätska/hemofiltrationsvätska
Varningar och försiktighet:
Bruksanvisningen för användning och hantering av Prismasol måste följas noggrant.
Lösningarna i de två kamrarna måste blandas före användning.
Användning av kontaminerad hemofiltrations- och hemodialyslösning kan orsaka sepsis, chock och livshotande tillstånd.
Prismasol kan värmas upp till 37 °C för ökad patientkomfort. Uppvärmning av lösningen före användning ska göras före blandning endast med torr värme. Lösningar ska inte värmas upp i vatten eller i mikrovågsugn. Lösningen ska inspekteras visuellt avseende partiklar och missfärgning före administrering, när lösningen och behållaren tillåter det. Administrera endast om lösningen är klar och förseglingen är intakt.
Lösningen innehåller kalium. Lösningen ska inte användas till patienter med hyperkalemi. Kaliumhalten i serum måste övervakas före och under hemofiltration och/eller hemodialys.
Om hyperkalemi inträffar efter att behandling har inletts ska ytterligare kaliumkällor som påverkar blodkoncentrationen utvärderas. När lösningen används som ersättningslösning ska infusionshastigheten sänkas och en kontroll utföras för att bekräfta att önskad kaliumkoncentration har uppnåtts. Om hyperkalemin inte försvinner ska infusionen stoppas omedelbart.
Om hyperkalemi utvecklas när lösningen används som dialysat kan administrering av kaliumfritt dialysat vara nödvändig för att kalium ska avlägsnas snabbare.
Koncentrationen av oorganiska fosfater bör regelbundet mätas. Tillsats av oorganiska fosfater måste göras i de fall låga fosfatvärden föreligger. Fosfat upp till 1,2 mmol/l kan tillsättas lösningen. Om fosfat tillsätts i påsen ska natriumfosfat användas.
Även om inga fall av svåra överkänslighetsreaktioner mot majs finns rapporterade med Prismasol ska lösningar som innehåller glukos från hydrolyserad majsstärkelse inte användas till patienter med känd allergi mot majs eller majsprodukter.
Administreringen måste stoppas omedelbart om några tecken eller symtom på misstänkt överkänslighetsreaktion utvecklas. Lämpliga terapeutiska motåtgärder måste inledas enligt kliniska indikationer.
Eftersom lösningen innehåller glukos och laktat kan hyperglykemi utvecklas, särskilt hos patienter med diabetes. Blodsockernivåerna ska mätas regelbundet. Om hyperglykemi utvecklas kan administrering av dextrosfri ersättningslösning/dextrosfritt dialysat vara nödvändig. Andra korrigerande åtgärder kan behövas för att upprätthålla önskad glykemisk kontroll.
Prismasol innehåller vätekarbonat (bikarbonat) och laktat (en prekursor till vätekarbonat) som kan påverka patientens syra-bas-balans. Om metabolisk alkalos utvecklas eller förvärras under behandling med lösningen kan administreringshastigheten behöva sänkas eller administreringen stoppas.
Elektrolyt- och syra-bas-balansen ska övervakas noga före och under behandling, under hela proceduren.
I händelse av obalans i vätskestatus måste det kliniska tillståndet noggrant följas och vätskebalansen ska korrigeras efter behov.
Administreringssätt:
För intravenöst bruk och för hemodialys. Prismasol administreras i blodbanan före (för-spädning) eller efter hemofiltret (efter-spädning) innan den används som ersättningslösning.
Dosering:
Den volym och hastighet med vilken Prismasol ska användas varierar beroende på elektrolythalten i blodet, syra-bas-balansen och patientens övergripande kliniska tillstånd. Administreringen (dos, infusionshastighet och ackumulerad volym) av Prismasol ska fastställas av läkare.
Flödeshastigheter för ersättningslösning vid hemofiltration och hemodiafiltration:
Vuxna: 500 – 3 000 ml/tim
Flödeshastigheter för dialysvätska (dialysat) vid kontinuerlig hemodialys och kontinuerlig hemofiltration:
Vuxna: 500 – 2 500 ml/tim
Vanliga flödeshastigheter för vuxna är omkring 2 000 till 2 500 ml/tim, vilket motsvarar en vätskevolym per dygn på omkring 48 till 60 liter.
Pediatrisk population
Intervallet för flödeshastigheter för ersättningslösningen vid hemofiltration och hemodiafiltration samt för dialyslösningen (dialysatet) vid kontinuerlig hemodialys är:
Barn (från nyfödda till ungdomar upp till 18 år): 1 000 till 2 000 ml/tim/1,73 m2.
Flödeshastigheter på upp till 4 000 ml/tim/1,73 m2 kan behövas, särskilt hos yngre barn (≤ 10 kg). Den absoluta flödeshastigheten (i ml/tim) hos den pediatriska populationen ska som regel inte överskrida den maximala flödeshastigheten för vuxna.
Anvisningar för hantering:
Elektrolytlösningen (lilla kammare A) tillsätts buffertlösningen (stora kammare B) genom att svetsfogen öppnas omedelbart före användning för att erhålla en färdigblandad lösning.
Använd endast tillsammans med lämpligt system för extrakorporeal njurersättning.
Aseptiskt tillvägagångssätt ska användas vid hantering och administrering till patienten.
Använd endast om omslaget inte är skadat, alla förseglingar är intakta, svetsfogen är obruten och lösningen är klar. Tryck ordentligt på påsen för att kontrollera om det finns något läckage. Kassera lösningen omedelbart om du upptäcker något läckage eftersom steriliteten då inte kan garanteras.
Den större kammaren B är utrustad med en injektionsport för att kunna tillsätta andra nödvändiga läkemedel efter det att lösningen blandats. Det är läkarens ansvar att bedöma blandbarheten hos alla läkemedel som tillsätts Prismasollösningen genom att vara uppmärksam på eventuella färgförändringar och/eller eventuella fällningar, olösliga komplex eller kristaller. Innan ett läkemedel tillsätts, kontrollera om det är lösligt och stabilt i vatten vid pH 7,0–8,5 (samma pH som färdigblandad Prismasol). Tillsatser kan vara inkompatibla. Bruksanvisningen till läkemedlet som ska tillsättas måste konsulteras.
Töm injektionsporten på all vätska. Vänd påsen uppochned och för in läkemedlet genom injektionsporten. Blanda ordentligt. Lösningen måste administreras omedelbart. Tillsättning och blandning av tillsatser måste alltid utföras innan påsen ansluts till den extrakorporeala kretsen.
-
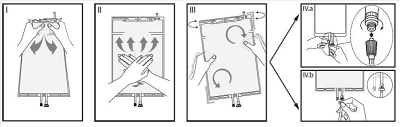
Tag bort omslaget från påsen omedelbart före användning och blanda lösningarna i de båda kamrarna. Håll den mindre kammaren med båda händerna och krama den tills en öppning skapas i den s.k. svetsfogen mellan de två kamrarna. (Se bild I nedan)
-
Tryck med båda händerna på den större kammaren tills den s.k. svetsfogen mellan de två kamrarna är helt öppen. (Se bild II nedan)
-
Säkerställ att lösningarna blandas fullständigt genom att varsamt skaka påsen. Lösningen är nu klar att användas och kan hängas upp på utrustningen. (Se bild III nedan)
-
Anslut slangen för dialys- eller ersättningsvätska till någon av de två accessportarna.
-
Om luerkopplingen används, ta bort skyddshatten genom att vrida och dra och anslut luerkopplingen (hane) på slangen för dialys- eller ersättningsvätskan till luerkopplingen (hona) på påsen genom att trycka och vrida. Se till att kopplingen sitter ordentligt och dra åt. Kopplingen är nu öppen. Kontrollera att vätskan flödar fritt. (Se bild IV.a nedan)
När slangen för dialys- eller ersättningsvätska har kopplats bort från luerkopplingen stängs kopplingen och lösningsflödet upphör. Luerporten är nålfri och kan rengöras. -
Om injektionsporten används, tag först bort skyddshatten. Injektionsporten kan rengöras. För sedan in spetsen genom gummimembranet. Kontrollera att vätskan flyter fritt. (Se bild IV.b nedan)
-
Lösningen ska användas omedelbart när omslaget har avlägsnats. Om den inte används omedelbart ska den blandade lösningen användas inom 24 timmar, inklusive behandlingstiden efter tillsättning av elektrolytlösningen till buffertlösningen.
Den färdigblandade lösningen är endast avsedd för engångsbruk. Kassera använd lösning omedelbart efter användning. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.