Indikationer
Soolantra är indicerat för topikal behandling av inflammatoriska lesioner vid rosacea (papulopustulös) hos vuxna patienter.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Dosering
En applicering per dag i upp till 4 månader. Soolantra ska appliceras dagligen under behandlingskuren. Behandlingskuren kan upprepas. Krämen kan appliceras som monoterapi eller som en del av en kombinationsbehandling (se avsnitt Farmakodynamik).
Om tillståndet inte har förbättrats efter 3 månader ska behandlingen avbrytas.
Särskilda populationer
Nedsatt njurfunktion
Ingen dosjustering krävs.
Nedsatt leverfunktion
Försiktighet skall iakttas hos patienter med gravt nedsatt leverfunktion.
Äldre patienter
Ingen dosjustering krävs för äldre patienter (se även avsnitt Biverkningar).
Pediatrisk population
Säkerhet och effekt för Soolantra för barn och ungdomar yngre än 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Endast för kutan användning.
Kutan applicering av en ärtstor mängd kräm till var och ett av ansiktets fem områden: pannan, hakan, näsan och varje kind. Krämen ska smörjas in i ett tunt lager i hela ansiktet. Ögonen, läpparna och slemhinnor ska undvikas.
Soolantra ska endast appliceras i ansiktet.
Händerna ska tvättas efter varje läkemedelsapplicering.
Kosmetika kan användas när läkemedlet har torkat.
Varningar och försiktighet
Patienter kan uppleva övergående förvärring av rosacea, som vanligtvis går över inom 1 vecka vid fortsatt behandling, detta kan förväntas som en reaktion på de döende demodexkvalstren.
Vid allvarlig försämring med en kraftig hudreaktion, ska behandlingen avbrytas.
Soolantra har inte studerats hos patienter med nedsatt njur- eller leverfunktion.
Läkemedlet innehåller:
-
cetylalkohol och stearylalkohol som kan orsaka lokala hudirritationer (till exempel kontaktdermatit),
-
metylparahydroxibensoat (E218) och propylparahydroxibensoat (E216) som kan orsaka allergiska reaktioner (möjligen fördröjda),
-
och propylenglykol som kan orsaka hudirritation.
Interaktioner
Inga interaktionsstudier har utförts (se avsnitt Farmakokinetik för Metabolism).
In-vitro-studier har visat att ivermektin primärt metaboliseras av CYP3A4. Följaktligen ska ivermektin administreras med försiktighet i kombination med kraftfulla CYP3A4-hämmare, eftersom det kan leda till betydande ökning i plasmaexponering.
Graviditet
Det finns inga eller begränsad mängd data från topikal användning av ivermektin hos gravida kvinnor. Perorala reproduktionstoxikologiska studier har visat att ivermektin är teratogent hos råttor och kaniner (se avsnitt Prekliniska uppgifter). Men på grund av den låga systemiska exponeringen efter topikal administrering av produkten vid den angivna doseringen, är säkerhetsrisken låg för humana foster. Soolantra rekommenderas inte under graviditet.
Amning
Efter peroral administrering utsöndras ivermektin i bröstmjölk i låga koncentrationer. Utsöndring i bröstmjölk efter topikal administrering har inte undersökts. Tillgängliga farmakokinetiska/toxikologiska djurdata har också visat att ivermektin utsöndras i mjölk. Risker för barnet som ammas kan inte uteslutas. Ett beslut måste fattas huruvida amningen ska avbrytas eller om kvinnan ska avbryta/avstå från behandling med Soolantra efter att man tagit hänsyn till nyttan med amning för barnet och nyttan med behandling för kvinnan.
Fertilitet
Det finns inga data om ivermektins effekt på fertiliteten hos människa. Hos råttor hade ivermektin-behandling ingen effekt på parning eller fertilitet.
Trafik
Soolantra har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste rapporterade biverkningarna är en brännande känsla i huden, hudirritation, klåda och torr hud, vilka alla förekom hos 1 % eller färre av de patienter som behandlades med läkemedlet i kliniska prövningar.
De är normalt lindriga till måttliga och avtar vanligtvis vid fortsatt behandling.
Inga betydelsefulla skillnader i säkerhetsprofilen mellan försökspersoner 18 till 65 år och försökspersoner äldre än 65 år observerades.
Tabell över biverkningar
Biverkningarna klassificeras efter organsystem och frekvens enligt följande konvention: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (≤ 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data) och rapporterades för Soolantra i kliniska studier (se tabell 1).
|
Klassificering av organsystem |
Frekvens |
Biverkning |
|---|---|---|
|
Hud och subkutan vävnad |
Vanliga |
Brännande känsla i huden |
|
Mindre vanliga |
Hudirritation, klåda, torr hud Förvärring av rosacea* |
|
|
Ingen känd frekvens |
Erytem, kontaktdermatit (allergisk eller icke allergisk), svullet ansikte |
|
|
Undersökningar |
Ingen känd frekvens |
Förhöjda transaminaser* |
|
* Biverkning rapporterad efter godkännandet för försäljning. |
||
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns inga rapporter om överdosering av Soolantra.
Vid oavsiktlig eller betydande exponering för okända mängder veterinärläkemedel som innehåller ivermektin, antingen genom peroralt intag, inhalation, injektion, eller exponering via kroppsytor, är följande biverkningar de vanligast rapporterade: utslag, ödem, huvudvärk, yrsel, kraftlöshet, illamående, kräkningar och diarré. Andra biverkningar som har rapporterats är: krampanfall, ataxi, dyspné, buksmärta, parestesi, urtikaria och kontaktdermatit.
Vid oavsiktligt intag ska understödjande behandling, om sådan krävs, inkludera parenterala vätskor och elektrolyter, andningsstöd (syrgas och mekanisk ventilation om det behövs) samt blodtryckshöjande medel om kliniskt signifikant hypotoni föreligger. Induktion av kräkningar och/eller magsköljning så snart som möjligt, följt av laxermedel och andra rutinåtgärder vid förgiftning, kan krävas för att förhindra absorption av det intagna ämnet.
Farmakodynamik
Verkningsmekanism
Ivermektin ingår i klassen avermektin. Avermektin har antiinflammatoriska effekter genom att hämma lipopolysackarid-inducerad produktion av inflammatoriska cytokiner. Antiinflammatoriska egenskaper hos ivermektion för användning på huden har observerats i djurmodeller av hudinflammation. Ivermektin dödar också parasiter, framför allt genom att selektivt och med hög affinitet binda till glutamatstyrda kloridkanaler som förekommer hos ryggradslösa organismers nerv- och muskelceller. Soolantras verkningsmekanism vid behandling av inflammatoriska lesioner vid rosacea är inte känd, men skulle kunna kopplas till ivermektins antiinflammatoriska effekter samt även till att det dödar de demodexkvalster som har rapporterats som en faktor vid hudinflammation.
Klinisk effekt och säkerhet
Soolantra vid användning en gång dagligen vid sängdags undersöktes för behandling av inflammatoriska lesioner vid rosacea i två randomiserade, dubbelblinda, vehikelkontrollerade kliniska studier med identisk studiedesign. I studierna deltog 1371 försökspersoner 18 år och äldre som behandlades en gång dagligen i 12 veckor med antingen Soolantra eller vehikel.
Totalt sett var 96 % av försökspersonerna kaukasier och 67 % var kvinnor. Med hjälp av den 5-gradiga IGA-skalan (Investigator Global Assessment) bedömdes 79 % av försökspersonerna ha måttliga besvär (IGA = 3) och 21 % svåra besvär (IGA = 4) vid baslinjen.
De två primära effektmåtten i båda kliniska studierna var lyckad behandling baserad på IGA-resultat (procentandel av försökspersonerna som bedömdes som "symtomfria" eller "nästan symtomfria" efter 12 veckor i studien) samt absolut förändring från baslinjen av antalet inflammatoriska lesioner. IGA-skalan är baserad på följande definitioner:
|
Grad |
Poäng |
Klinisk beskrivning |
|---|---|---|
|
Symtomfri |
0 |
Inga inflammatoriska lesioner, ingen rodnad |
|
Nästan symtomfri |
1 |
Mycket få små papler/pustler, mycket lindrig rodnad |
|
Lindrig |
2 |
Fåtal små papler/pustler, lindrig rodnad |
|
Måttlig |
3 |
Flera små eller stora papler/pustler, måttlig rodnad |
|
Svår |
4 |
Stort antal små och/eller stora papler/pustler, kraftig rodnad |
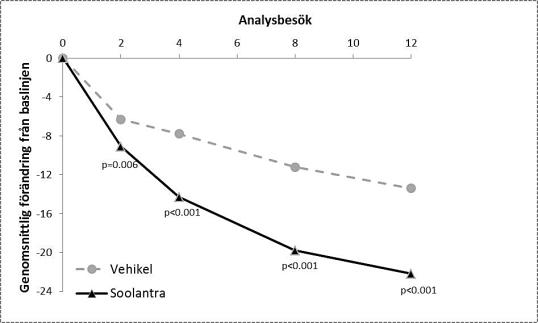
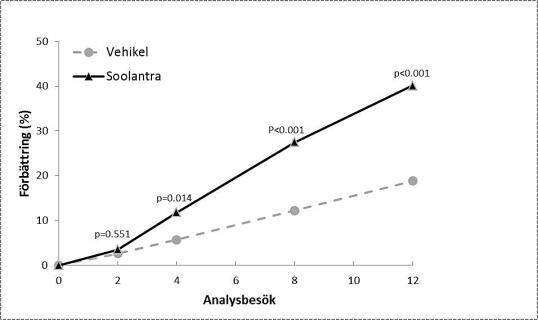
Resultaten från de båda kliniska studierna visade att Soolantra en gång dagligen i 12 veckor var statistiskt överlägset vehikelkräm med avseende på förbättrad IGA-poäng och absolut förändring av antalet inflammatoriska lesioner (p <0,001, se tabell 3 och figur 1, figur 2, figur 3 och figur 4).
Följande tabell och figurer visar effektresultaten från båda studierna.
|
Studie 1 |
Studie 2 |
|||
|---|---|---|---|---|
|
Soolantra (N = 451) |
Vehikel (N = 232) |
Soolantra (N = 459) |
Vehikel (N = 229) |
|
|
Investigator Global Assessment | ||||
|
Antal (%) försökspersoner som är symtomfria eller nästan symtomfria enligt IGA vid vecka 12 |
173 (38,4) |
27 (11,6) |
184 (40,1) |
43 (18,8) |
|
Inflammatoriska lesioner | ||||
|
Genomsnittligt antal inflammatoriska lesioner vid baslinjen |
31,0 |
30,5 |
33,3 |
32,2 |
|
Genomsnittligt antal inflammatoriska lesioner efter 12 veckor |
10,6 |
18,5 |
11,0 |
18,8 |
|
Genomsnittlig absolut förändring (% förändring) av antal inflammatoriska lesioner mellan baslinjen och vecka 12 |
-20,5 (-64,9) |
-12,0 (-41,6) |
-22,2 (-65,7) |
-13,4 (-43,4) |
|
Studie 1 |
Studie 2 |
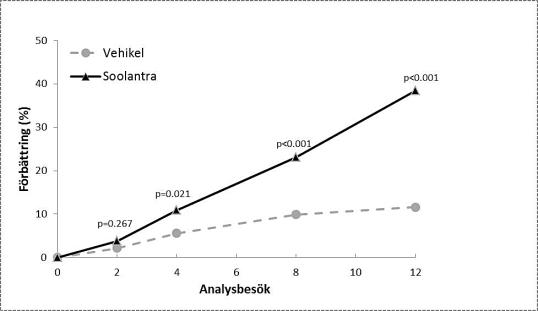
| 
|
|
Studie 3 |
Studie 4 |
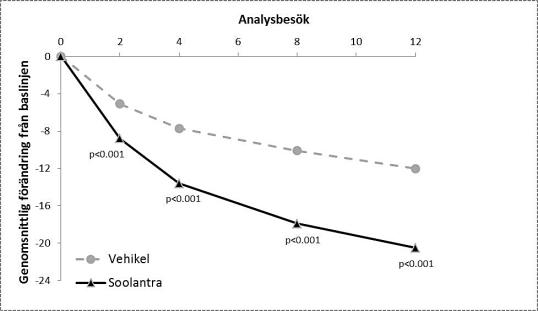
|
|
Soolantra var statistiskt överlägset vehikelkräm för de två primära effektmåtten där effekten framträdde efter 4 veckors behandling (p < 0,05).
IGA undersöktes under den 40 veckor långa förlängningen av de två kliniska studierna. Procentandelen av försökspersonerna som behandlades med Soolantra och uppnådde IGA-poäng 0 eller 1 fortsatte att öka fram till vecka 52. IGA-förbättring (IGA = 0 eller 1) vid vecka 52 var 71 % och 76 % i studie 1 respektive studie 2.
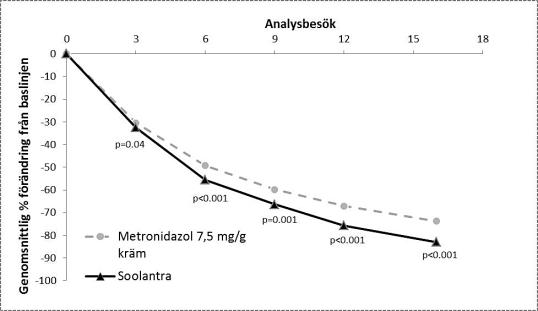
Effekt och säkerhet för läkemedlet vid behandling av inflammatoriska lesioner vid rosacea undersöktes också i en randomiserad prövar-blindad klinisk studie med aktiv kontroll. I studien deltog 962 försökspersoner 18 år och äldre som behandlades med antingen Soolantra en gång dagligen eller metronidazol 7,5 mg/g kräm två gånger dagligen i 16 veckor. I denna studie var 99,7 % av försökspersonerna kaukasier och 65,2 % var kvinnor och enligt IGA-skalan bedömdes 83,3 % av försökspersonerna ha måttliga besvär (IGA = 3) och 16,7 % svåra besvär (IGA = 4) vid baslinjen (se figur 5).
Resultaten från studien visade att Soolantra var statistiskt överlägset metronidazol 7,5 mg/g kräm för det primära effektmåttet (genomsnittlig procentuell förändring av antalet inflammatoriska lesioner) med en minskning på 83,0 % och 73,7 % från baslinjen efter 16 veckors behandling för ivermektin- respektive metronidazolgrupperna (p < 0,001). Att Soolantra var överlägset vid vecka 16 bekräftades med hjälp av IGA-förbättring och absolut förändring av antalet inflammatoriska lesioner (sekundära effektmått (p < 0,001)).
Figur 5:
Genomsnittlig förändring över tid (veckor)
I samtliga kliniska prövningar deltog omkring 300 försökspersoner 65 år och äldre som behandlades med läkemedlet. Inga betydelsefulla skillnader i effekt och säkerhetsprofil mellan äldre försökspersoner och försökspersoner 18 till 65 år observerades.
Behandling i upp till ett år visade att säkerhetsprofilen som beskrivs i avsnitt Biverkningar förblev stabil under långtidsanvändning.
Behandling med ivermektin i kombination med 40 mg doxycyklin kapsel med modifierad frisättning
I ANSWER-studien utvärderades relativ effekt av Soolantra (IVM) i kombination med doxycyklin 40 mg kapsel med modifierad frisättning (DMR) jämfört med IVM plus placebo istället för DMR (PBO) som behandling av svår rosacea. Studien var en 12 veckor lång, randomiserad prövarblindad, kontrollerad parallellgruppsstudie med 273 män och kvinnor i åldern 18 år eller äldre med 20–70 inflammatoriska lesioner (papler och pustler) i ansiktet samt IGA = 4 vid baslinjen.
Det primära effektmåttet var procentandelen förändring från baslinjen i antalet inflammatoriska lesioner vid vecka 12. En signifikant högre genomsnittlig procentuell minskning av antalet inflammatoriska lesioner observerades för IVM + DMR jämfört med IVM + PBO (medelvärde ± standardavvikelse: -80,29±21,65 % jämfört med -73,56±30,52 %; p = 0,032).
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Soolantra för alla grupper av den pediatriska populationen för papulopustulös rosacea (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Absorptionen av ivermektin från Soolantra undersöktes i en klinisk prövning med vuxna patienter med svår papulopustulös rosacea där maximal dos administrerades. Vid jämvikt (efter 2 veckors behandling) uppnåddes toppvärdet för genomsnittlig (± standardavvikelse) plasmakoncentration av ivermektin inom 10 ± 8 timmar efter administrering (Cmax: 2,1 ± 1,0 ng/ml intervall: 0,7–4,0 ng/ml) och det högsta genomsnittsvärdet (± standardavvikelse) för AUC0-24h var 36 ± 16 ng.h/ml (intervall: 14–75 ng.h/ml). Systemisk ivermektinexponering nådde en platå efter två veckors behandling (jämviktsförhållanden). Vid de längre behandlingsperioderna i fas 3-studierna var den systemiska ivermektinexponeringen ungefär densamma som efter två veckors behandling. Vid jämvikt var den systemiska ivermektinexponeringen (AUC0-24h: 36 ± 16 ng.h/ml) lägre än den som uppnåddes efter en enskild peroral dos om 6 mg ivermektin hos friska frivilliga försökspersoner (AUC0-24h: 134 ± 66 ng.h/ml).
Distribution
I en in vitro-studie visades att ivermektin är bundet till plasmaproteiner till mer än 99 % och då främst till humant serumalbumin. Ingen signifikant bindning av ivermektin till erytrocyter observerades.
Metabolism
I in vitro-studier med humana levermikrosomer och rekombinanta CYP450-enzymer visades att ivermektin främst metaboliseras av CYP3A4.
In vitro-studier visar att ivermektin inte hämmar CYP450-isoenzymerna 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 3A4, 4A11 eller 2E1. Ivermektin inducerar inte uttryck av CYP450-enzymer (1A2, 2B6, 2C9 eller 3A4) i odlade humana hepatocyter.
I en klinisk farmakokinetikstudie där maximal dos administrerades identifierades två huvudsakliga ivermektinmetaboliter och dessa studerades i kliniska fas 2-studer (3’’-O-demetylivermektin och 4a-hydroxivermektin). I likhet med ursprungsföreningen nådde metaboliterna jämviktsförhållanden efter 2 veckors behandling utan några belägg för ackumulering i upp till 12 veckor. Vidare var metaboliternas systemiska exponering (beräknad med Cmax och AUC) vid jämvikt mycket lägre än den som observerades efter peroral administrering av ivermektin.
Eliminering
Den terminala halveringstiden var i genomsnitt 6 dagar (genomsnitt: 145 timmar, intervall 92–238 timmar) hos patienter som applicerade läkemedlet på huden en gång dagligen i 28 dagar i den kliniska farmakokinetikstudie där maximal dos administrerades. Elimineringen är absorptionsberoende efter lokalbehandling med Soolantra. Ivermektins farmakokinetik har inte studerats hos patienter med nedsatt njur- eller leverfunktion.
Prekliniska uppgifter
Upprepade dos-studier i upp till 9 månader avseende allmäntoxicitet vid dermal applicering av ivermektin 10 mg/g kräm på minigrisar visade inga toxikologiska effekter eller lokal toxicitet vid systemisk exponering jämförbar med klinisk exponering.
Ivermektin var inte gentoxiskt i en uppsättning olika in vitro- och in vivo-tester. En 2 år lång karcinogenitetsstudie där ivermektin 10 mg/g kräm applicerade dermalt på möss visade inte på ökad förekomst av tumörer.
Reproduktionstoxikologiska studier efter peroral administrering av ivermektin visade teratogena effekter hos råttor (gomspalt) och kaniner (karpalflexur) vid höga doser (exponeringsmarginal till NOAEL minst 70 gånger jämförtmed klinisk exponering).
Neonatal toxicitet vid peroralt intag hos råttor var inte relaterat till exponering i livmodern utan till exponering efter födseln via modersmjölken, vilket ledde till höga halter ivermektin i hjärnan och plasma hos avkomman.
Det finns belägg för att ivermektin 10 mg/g kräm är hudirriterande, sensibiliserande och fotosensibiliserande hos marsvin, men det är inte fototoxiskt.
Miljöriskbedömning
Ivermektin är mycket toxiskt för ryggradslösa organismer och en risk har identifierats för vatten-, sediment- och jordmiljöer. Försiktighet ska iakttas för att förhindra miljöexponering, i synnerhet exponering i vattenmiljöer.
Innehåll
Ett gram kräm innehåller 10 mg ivermektin, glycerol, isopropylpalmitat, karbomer, dimetikon, dinatriumedetat, citronsyramonohydrat, 35 mg cetylalkohol, 25 mg stearylalkohol, makrogol-cetostearyleter, sorbitanstearat, 2 mg metylparahydroxibensoat (E218), 1 mg propylparahydroxibensoat (E216), fenoxietanol, 20 mg propylenglykol, oleylalkohol, natriumhydroxid, renat vatten.
Blandbarhet
Ej relevant
Hållbarhet, förvaring och hantering
Öppnad förpackning ska användas inom 6 månader.
Åtgärder ska vidtas för att förhindra eller minska miljöexponering, i synnerhet exponering i vattenmiljöer.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.