Mydriasert
tropikamid och fenylefrinhydroklorid
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa den igen.
-
Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
-
Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
-
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad Mydriasert är och vad det används för
2. Vad du behöver veta innan du använder Mydriasert
3. Hur du använder Mydriasert
4. Eventuella biverkningar
5. Hur Mydriasert ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad Mydriasert är och vad det används för
Mydriasert är en oftalmologisk produkt, vilket betyder att den endast är avsedd för behandling av ögon.
Mydriasert får endast ges av hälso- och sjukvårdspersonal.
Mydriasert kommer att placeras under ditt nedre ögonlock av vårdpersonalen. Det används för att erhålla mydriasis (utvidgning av pupillen) före ett kirurgiskt ingrepp eller en undersökning.
2. Vad du behöver veta innan du använder Mydriasert
Använd inte Mydriasert i följande fall:
-
om du är allergisk mot tropikamid eller fenylefrinhydroklorid eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6),
-
för patienter med blockerad kammarvinkel-glaukom eller som har risk för plötsligt framkallad glaukom (ökning av okulärt tryck),
-
för barn under 12 år.
Varningar och försiktighet
-
då detta läkemedel förorsakar långvariga synstörningar, måste du komma ihåg att någon måste följa dig när du skall till läkarmottagningen (se Eventuella biverkningar).
-
om du känner obehag efter placering av lamellen, informera din läkare: det är möjligt att lamellen flyttat sig eller mera sällsynt, stötts ut.
-
om du lider av kraftigt torra ögon, kan din läkare droppa saltlösning i ditt öga för att minska risken för irritation av ögat.
-
informera din läkare om du lider av högt blodtryck, ateroskleros (förtjockning av artärvägg), hjärtsjukdom, hypertyreoidism (ökad aktivitet av sköldkörteln) eller prostataproblem.
-
hos vissa personer kan mydriatika (produkter som utvidgar pupillen) utlösa en attack av akut glaukom (på grund av en plötslig ökning av trycket i ögat).
-
användning av mjuka hydrofila kontaktlinser avrådes under behandling.
Barn och ungdomar
Mydriasert ska inte användas hos barn under 12 år eftersom barn tycks vara mer känsliga för risken för allvarliga biverkningar.
Mydriasert rekommenderas inte för användning hos barn och ungdomar i åldrarna 12 till 18 år eftersom tillräcklig klinisk erfarenhet saknas.
Andra läkemedel och Mydriasert
Tala om för läkare om du använder andra läkemedel som utvidgar pupillerna (mydriatika) förutom Mydriasert, så att din läkare känner till den samlade mängden mydriatika som du får.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel, även receptfria sådana. Även om Mydriasert används lokalt i ögat kan sådan information vara viktig då olika läkemedel kan påverka varandras effekt.
Graviditet och amning
Uppgifter saknas om användning av Mydriasert eller dess aktiva substanser hos gravida kvinnor. Därför ska Mydriasert användas under graviditet endast om det är absolut nödvändigt.
Användning under amning rekommenderas inte.
Körförmåga och användning av maskiner
Kör inte bil och använd inte maskiner då Mydriasert kan förorsaka besvärliga synstörningar under några timmar (förblindad på grund av förlängd utvidgning av pupillen).
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt vaksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Mydriasert innehåller fenylefrinhydroklorid
Idrottsutövare bör varnas för att detta läkemedel innehåller ett aktivt ämne (fenylefrinhydroklorid) som kan ge positiva resultat i tester som används vid dopingkontroll.
3. Hur du använder Mydriasert
FÅR ENDAST GES AV HÄLSO- OCH SJUKVÅRDSPERSONAL.
Mydriasert är avsett för användning hos vuxna. Mydriasert får inte sväljas.
Vårdpersonalen kommer att placera en lamell under det nedre ögonlocket av det öga som skall behandlas/undersökas. Personalen kommer att avlägsna lamellen efter att pupillen har utvidgats tillräckligt, före operationen eller undersökningen. Lamellen bör inte lämnas kvar i ögat under längre tid än 2 timmar.
Om man använt för stor mängd av Mydriasert
Då endast en lamell kommer att placeras i ögat av vårdpersonal är risken att använda större mängd av Mydriasert än rekommenderat inte sannolik. Om vårdpersonalen emellertid behöver använda pupillvidgande ögondroppar i tillägg till Mydriasert, kan en risk för överdos av de aktiva substanserna i Mydriasert uppstå.
Symptom på överdos av de aktiva substanserna i Mydriasert kan omfatta extrem trötthet, svettning, yrsel, långsam hjärtrytm, koma, huvudvärk, snabb hjärtrytm, muntorrhet och torr hud, ovanlig sömnighet, blodvallning samt förlängd utvidgning av pupillerna.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Vanliga: kan förekomma hos upp till 1 av 10 personer:
-
sveda,
-
dimsyn,
-
obehagskänsla på grund av att man känner av lamellen eller att lamellen flyttat sig.
Mindre vanliga: kan förekomma hos upp till 1 av 100 personer:
-
tårflöde,
-
irritation,
-
förblindad på grund av förlängd utvidgning av pupillen,
-
inflammation i hornhinnan (ytlig punktatkeratit).
Sällsynta: kan förekomma hos upp till 1 av 1000 personer:
-
allergiska reaktioner: inflammation av ögonlock (blefarit), inflammation av bindhinnan (konjunktivit).
Mycket sällsynta: kan förekomma hos upp till 1 av 10 000 personer:
-
krampanfall.
Litet sår på ögats yta (sår på hornhinnan) och inflammation i ögats yta (svullnad av hornhinnan) har observerats när lamellen oavsiktligt lämnats kvar i ögat.
Hos vissa patienter kan Mydriasert utlösa en attack av akut glaukom (plötsligt ökat tryck i ögat): om det uppstår onormala symptom efter administrering (rodnad, smärta och synbesvär), kontakta omedelbart läkare för rådgivning.
Även om det är osannolikt kan de aktiva substanserna i Mydriasert orsaka följande biverkningar som måste beaktas:
-
ökat blodtryck, hjärtklappning,
-
mycket sällsynt är allvarliga händelser som t ex onormal hjärtrytm (hjärtarytmi),
-
darrningar, blekhet, huvudvärk, muntorrhet.
Ytterligare biverkningar hos barn
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
-
vätska eller svullnad i lungorna
-
blekhet kring ögonen hos för tidigt födda bebisar
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur Mydriasert ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på dospåsen efter EXP.
Förvaras vid högst 25 °C.
Används omedelbart efter öppnandet av dospåsen.
Använd inte Mydriasert om du ser att dospåsens öppning eller lamellen har skadats.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
-
De aktiva substanserna är tropikamid 0,28 mg och fenylefrinhydroklorid 5,4 mg för varje ögonlamell.
-
Övriga innehållsämnen är ammoniometakrylatsampolymer (typ A), polyakrylatdispersion 30 %, glyceroldibehenat och etylcellulosa.
Läkemedlets utseende och förpackningsstorlekar
Mydriasert levereras i en dospåse.
Mydriasert ser ut som en avlång, liten tablett (4,3 mm x 2,3 mm).
Varje förpackning innehåller ytterligare en påse med steril engångspincett som används för placering av Mydriasert i ögat.
Förpackningar: 1 lamell och 1 pincett, 10 lameller och 10 pincetter, 20 lameller och 20 pincetter, 50 lameller och 50 pincetter eller 100 lameller och 100 pincetter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Laboratoires THEA
12, Rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Frankrike
Tillverkare
BENAC
27A, Avenue Paul Langevin
17180 Périgny
Frankrike
Detta läkemedel har godkänts i EEA’s medlemsländer under följande namn:
|
Österrike, Belgien, Danmark, Finland, Frankrike, Tyskland, Italien, Luxemburg, Holland, Portugal, Spanien, Sverige, England |
Mydriasert |
Denna bipacksedel ändrades senast 2021-11-23
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal.
Får inte sväljas.
Före användning av produkten säkerställs att dospåsen inte skadats. Om dospåsens stängning har skadats är sterilitet inte längre garanterad, i sådana fall används en annan lamell från en intakt förpackning.
DOSERING
Mydriasert är endast avsedd för vuxna.
Hälso- eller sjukvårdspersonalen placerar en ögonlamell i den nedre konjunktivalsäcken på det ögat som skall behandlas, maximalt 2 timmar före operation eller undersökning.
Pediatrisk population
Mydriasert är kontraindicerat för barn under 12 år.
Det finns ingen data om användning hos barn mellan 12 och 18 år. Användning av Mydriasert rekommenderas inte hos dessa patienter.
ADMINSTRERINGSSÄTT
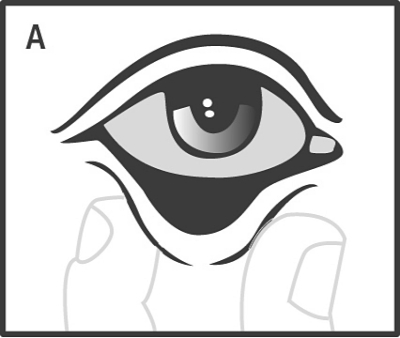
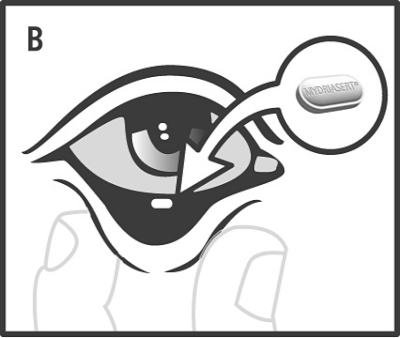
Den tillslutna kanten klipps längs den punkterade linjen, dospåsen öppnas och lamellen lokaliseras. Det nedre ögonlocket dras ut genom att hålla i det med tumme och pekfinger (A), och ögonlamellen placeras i den nedre konjunktivalsäcken med hjälp av den sterila engångspincetten i förpackningen, som skall kastas omedelbart efter användning (B).
ANVISNINGAR FÖR ANVÄNDNING
Ögonlamellen får inte lämnas kvar i den nedre konjunktivalsäcken under längre period än två timmar. Läkaren kan avlägsna lamellen när framkallad mydriasis bedöms vara tillräcklig med avseende på den operation eller undersökning som skall utföras, och senast inom 30 minuter efter att tillräcklig dilatation av pupillen har uppnåtts. Om patienten känner obehag, måste man säkerställa att lamellen har placerats korrekt i botten av den nedre konjunktivalsäcken.
FÖRSIKTIGHET: AVLÄGSNANDE AV ÖGONLAMELL
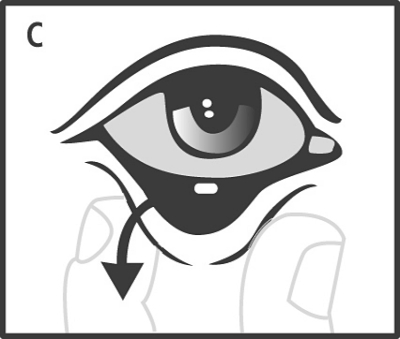
Före operation eller undersökning, och så fort den önskade graden av mydriasis har uppnåtts, måste ögonlamellen avlägsnas från den nedre konjunktivalsäcken med hjälp av antingen en steril kirurgisk pincett, en steril kompress eller steril spol- eller sköljvätska genom att det undre ögonlocket dras ut (C).
Får inte återanvändas i det andra ögat hos samma patient eller för en annan patient.
Kassera lamellen efter användning. (Se även avsnitt 3)




