Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Indikationer
Endast avsett för diagnostik.
Amyvid är ett radioaktivt läkemedel för användning vid positronemissionstomografi (PET) för avbildning av neuritiska beta amyloidplack i hjärnan hos vuxna patienter med kognitiv nedsättning, vilka utreds avseende Alzheimers sjukdom och andra orsaker till den kognitiva nedsättningen. Amyvid ska användas i kombination med klinisk bedömning.
En negativ skanning tyder på få eller inga plack, vilket inte är förenligt med diagnosen Alzheimers sjukdom. För begränsningar i tolkningen av positiv skanning, se avsnitt Varningar och försiktighet och Farmakodynamik.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
En PET-skanning med florbetapir (18F) bör endast ordineras av läkare utbildade i klinisk behandling av neurodegenerativa sjukdomar.
Amyvid-bilderna ska endast tolkas av bildgranskare som har erfarenhet av tolkning av PET-bilder med florbetapir(18F). Vid osäkerhet angående lokaliseringen av den grå substansen och gränsen mellan grå/vit substans i PET-bilden, rekommenderas att samtidigt titta på en nyligen tagen datatomografi (DT)- eller magnetisk resonans (MR)-bild av patienten, så att det blir en sammanslagen PET-DT- eller PET-MR-bild (se avsnitt Varningar och försiktighet Bildtolkning).
Dosering
Den rekommenderade aktiviteten är 370 MBq florbetapir (18F) för en vuxen som väger 70 kg. Injektionsvolymen ska vara minst 1 ml och får inte överstiga 10 ml.
Särskilda patientgrupper
Äldre
Ingen dosjustering rekommenderas på grund av ålder.
Nedsatt njur- och leverfunktion
Man måste noga överväga vilken aktivitet som ska administreras eftersom det finns en risk för ökad strålningsexponering hos dessa patienter (se avsnitt Varningar och försiktighet).
Det har inte utförts några omfattande studier av doseringsintervall och dosjustering hos normala respektive speciella patientgrupper. Farmakokinetiken av florbetabir (18F) hos patienter med nedsatt njur- eller leverfunktion har inte bestämts.
Pediatrisk population
Det inte finns någon relevant användning av Amyvid för en pediatrisk population.
Administreringssätt
Amyvid är för intravenös användning och flerdosanvändning.
Aktiviteten av florbetapir (18F) måste mätas med en aktivitetsmätare (doskalibrator) omedelbart före injektionen.
Dosen administreras som en intravenös bolusinjektion, följt av spolning med 9 mg/ml (0,9 %) natriumkloridlösning för injektion, för att hela dosen säkert ska avges.
Injektion av florbetapir (18F) genom en kort intravenös kateter (ungefär 4 cm eller kortare) minimerar risken för adsorption av den aktiva substansen i katetern.
Florbetapir (18F) måste injiceras intravenöst för att minska risken för bestrålning via lokal extravasation, samt risken för felaktiga bilder.
Bildtagning
En 10-minuters PET-avbildning ska inledas ungefär 30 50 minuter efter den intravenösa Amyvid-injektionen. Patienten ska ligga på rygg med huvudet placerat så att hjärnan, med cerebellum, centreras i PET-skannerns bildfält. Huvudrörelser kan begränsas med hjälp av tejp eller andra flexibla huvudstöd. Bildåtergivningen ska innefatta attenueringskorrektion med resulterande transaxiella pixelstorlekar på mellan 2,0 och 3,0 mm.
Varningar och försiktighet
Begränsningar
Ett positivt resultat utgör inte enbart en grund för diagnosen Alzheimers sjukdom eller andra kognitiva sjukdomar. Neuritiska plack i grå substans kan finnas hos asymtomatiska äldre och vid en del neurodegenerativa demenssjukdomar (Alzheimers sjukdom, Lewykroppsdemens, demens vid Parkinsons sjukdom).
När det gäller begränsningar i användningen till patienter med lätt kognitionsnedsättning (MCI), se avsnitt Farmakodynamik.
Hur säkert och effektivt Amyvid är för att förutsäga utvecklingen av eller undersöka behandlingssvaret vid Alzheimers har inte fastställts (se avsnitt Farmakodynamik).
En del bilder kan vara svåra att tolka på grund av bildbrus, atrofi med uttunnad kortikal linje eller oskarp bild, vilket kan leda till misstag vid tolkningen. Om lokalisationen av eller kanten på den grå/vita substansen på PET-bilden är osäker och en DT- eller MR-bild nyligen har tagits samtidigt bör bildgranskaren även undersöka den sammanslagna PET-DT- eller PET-MR-bilden för att klargöra förhållandet mellan radioaktivitet respektive grå substans på PET-bilden.
Ökat upptag har identifierats i extracerebrala strukturer såsom spottkörtlar, hud, muskler och ben i några fall (se avsnitt Farmakokinetik). Granskning av sagittala bilder och samtidigt tagna DT- eller MR-bilder kan hjälpa till att skilja occipitala ben från occipital grå substans.
Individuell nytta/riskbedömning
Strålningsexponeringen måste för varje patient kunna försvaras med den sannolika nyttan av undersökningen. Den radioaktivitet som administreras ska alltid ha så låg nivå som rimligen kan användas för att erhålla den nödvändiga diagnostiska informationen.
Nedsatt njur- och leverfunktion
För dessa patienter krävs en noggrann bedömning av nytta/riskförhållandet eftersom det finns en risk för ökad strålningsexponering. Florbetapir (18F) utsöndras huvudsakligen via det hepatobiliära systemet. Patienter med nedsatt leverfunktion löper risk för ökad strålningsexponering (se även avsnitt Dosering).
Pediatrisk population
För information om användning till pediatrisk population, se avsnitt Dosering eller 5.1.
Tolkning av Amyvid-bilder
Amyvid-bilderna ska endast tolkas av bildgranskare som har erfarenhet av tolkning av PET-bilder med florbetapir (18F). En negativ skanning indikerar lite eller inga kortikala beta-amyloidplack. En positiv skanning indikerar måttliga till rikliga plack. Bildtolkingsfel har förekommit när det gäller bestämning av mängden neuritiska beta-amyloida plack i hjärnan, inklusive falskt negativa resultat.
Bilderna ska främst granskas i transaxiell vy, vid behov även i sagittal- och frontalplanet. Bildgranskningen rekommenderas omfatta samtliga transaxiella skikt av hjärnan i svart-vit skala med skalans maximala intensitet inställd på den maximala intensiteten för samtliga hjärnpixlar.
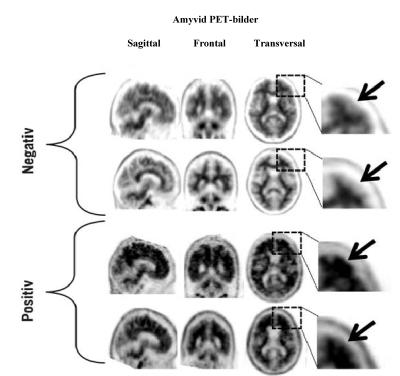
Tolkningen av bilden som negativ eller positiv bygger på en visuell jämförelse mellan aktiviteten i hjärnbarkens grå substans och aktiviteten i intilliggande vit substans (se figur 1).
Vid en negativ skanning ser man högre aktivitet i vit än i grå substans. Kontrasten mellan grått och vitt är tydlig. Vid en positiv skanning finner man antingen:
-
Två eller fler områden i hjärnan (vart och ett större än en enstaka kortikal vindling) med försämrad eller ingen kontrast mellan grått och vitt. Detta är det vanligaste utseendet vid en positiv skanning; eller
-
Ett eller fler områden med intensiv radioaktivitet i grå substans som klart överstiger aktiviteten i intilliggande vit substans.
Figur 1: Amyvid-PET-skanning som visar exempel på negativa skanningbilder (de två översta raderna) och positiva skanningbilder (de två nedersta raderna). Från vänster till höger visas PET-bilderna i sagittal-, frontal- och transversalplan. Bilden längst till höger visar en förstoring av den del av hjärnan som markerats. De två översta pilarna pekar mot normal, bevarad grå-vit kontrast där den kortikala aktiviteten är lägre än i intilliggande vit substans. De två nedre pilarna pekar mot områden med sänkt grå-vit kontrast och ökad kortikal aktivitet som kan jämföras med aktiviteten i intilliggande vit substans.
Kompletterande användning av kvantitativ information för bildtolkning
Endast bildgranskare som har erfarenhet av att använda kvantitativ information som stöd för visuell bildtolkning, inklusive rekommendationer om val av lämplig programvara som stöd för metoderna, bör använda kvantitativ PET-information om amyloida plack som komplement. Införlivande av kvantitativ information som har genererats med CE-märkt programvara för bildkvantifiering som stöd för visuell bildtolkning kan göra bildgranskarnas resultat noggrannare. Bildgranskarna ska tolka PET-skanningen och sedan göra en kvantifiering enligt tillverkarens anvisningar, inklusive kvalitetskontroller av den kvantitativa processen, samt jämföra kvantifieringen av undersökningen med typiska intervall för negativa och positiva resultat av PET-skanningar. Om kvantifieringsresultatet inte stämmer överens med den inledande visuella tolkningen:
1. Dubbelkontrollera PET-skanningens spatiala normalisering och passning med mallen för att bekräfta att regionerna av intresse (ROI) är korrekt lokaliserade, sök efter cerebrospinalvätska eller ben i ROI och bedöm den potentiella inverkan av atrofi eller ventrikulomegali på kvantifieringen.
2. Granska grunderna för att göra en visuell positiv eller negativ bedömning
a. Om den inledande visuella granskningen är positiv för amyloida plack och kvantifieringsresultatet är negativt, överväg om den positiva visuella tolkningen kan bero på retention av spårämne utanför ROI som bidrar till den genomsnittliga kvoten för kortikala standardiserade värden för upptag (SUVR standardised uptake value ratio).
b. Om den inledande visuella granskningen är negativ för amyloida plack och kvantifieringsresultatet är positivt, granska de regioner som motsvarar ROI med förhöjt SUVR-värde för att avgöra om det föreligger en förlust av grå/vit kontrast i dessa områden.
3. Granska cerebellumregionen för att bekräfta ROI-passningen och nivån av grå/vit kontrast, som ger en standard för visuell jämförelse med cortex. Överväg eventuella strukturella avvikelser som skulle kunna påverka kvantifieringen av cerebellumregionen.
4. Gör en slutlig tolkning av PET-resultatet baserat på den slutliga visuella granskningen efter att ha utfört stegen 1‑3 ovan.
Efter undersökningen
Nära kontakt med spädbarn och gravida kvinnor ska undvikas under de första 24 timmarna efter injektionen.
Natrium
Detta läkemedel innehåller upp till 37 mg natrium per dos, motsvarande 1,85 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
Etanol
Detta läkemedel innehåller 790 mg alkohol (etanol) i varje 10 ml dos, vilket motsvarar en etanolexponering av 11,3 mg/kg (hos en vuxen person vägandes 70 kg). Mängden i 10 ml av detta läkemedel motsvarar mindre än 20 ml öl eller 8 ml vin.
Mängden alkohol i detta läkemedel anses låg nog för att inte ha någon märkbar påverkan.
Interaktioner
Inga specifika interaktionsstudier in vivo har utförts.
Vid bindningsstudier in vitro har inte någon påverkan på florbetapirs (18F) bindning till beta amyloidplack påvisats, när andra vanliga läkemedel som används av AD-patienter finns närvarande.
Graviditet
Fertila kvinnor
När radiofarmaka övervägs till en fertil kvinna är det viktigt att fastställa eventuell graviditet. Alla kvinnor vars menstruation har uteblivit en gång ska betraktas som gravida tills motsatsen har bevisats. Om tveksamhet råder avseende eventuell graviditet (om en menstruation uteblivit, eller om menstruationerna är väldigt oregelbundna etc.) ska alternativa metoder där joniserande strålning inte används erbjudas patienten (om sådana finns).
Graviditet
När en gravid kvinna undersöks med radioisotoper utsätts även fostret för en strålningsdos. Under graviditet ska därför bara undersökningar som är absolut nödvändiga utföras och endast om den sannolika nyttan vida överstiger den risk som moder och foster utsätts för.
Inga studier har utförts på gravida kvinnor. Inga djurstudier för att undersöka reproduktionseffekterna av florbetapir (18F) har utförts (se avsnitt Prekliniska uppgifter).
Amning
Det är okänt om florbetapir (18F) utsöndras i bröstmjölk under amning. Innan radioaktiva läkemedel ges till en kvinna som ammar, ska möjligheten att skjuta upp administreringen av radioisotopen tills kvinnan har slutat amma övervägas. Vilka radiofarmaka som är lämpligast, med tanke på utsöndring av radioaktivitet i bröstmjölken, ska också övervägas. Om administreringen bedöms som nödvändig ska ett uppehåll göras i amningen under 24 timmar och all utpumpad mjölk kasseras.
Nära kontakt med spädbarnet bör begränsas under de första 24 timmarna efter injektion.
Fertilitet
Inga fertilitetsstudier har utförts.
Trafik
Amyvid har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Amyvids säkerhetsprofil baseras på administrering till 2105 personer i kliniska prövningar.
Lista på biverkningar i tabellform
Frekvenserna definieras som: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna kan i realiteten inträffa med lägre frekvens än vad som anges nedan, men storleken på källdatabasen tillät inte lägre frekvenskategorier än kategorin ”mindre vanliga” (≥1/1 000, <1/100).
|
Klassificering av organsystem |
Vanliga |
Mindre vanliga |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Dysgeusi |
|
Blodkärl |
|
Rodnad |
|
Magtarmkanalen |
|
Illamående |
|
Hud och subkutan vävnad |
|
Klåda Nässelutslag |
|
Allmänna symtom och/eller symtom vid administreringsstället |
|
Reaktioner på injektionsställeta Utslag vid infusionsstället |
a Reaktioner på injektionsstället inkluderar blödning på injektionsstället, irritation på injektionsstället och smärta på injektionsstället
Exponering för joniserande strålning är kopplat till cancerutveckling och en risk för medfödda defekter. Eftersom den effektiva dosen är 7 mSv när den rekommenderade radioaktiviteten om 370 MBq florbetapir (18F) administreras, är sannolikheten låg för att dessa biverkningar ska uppstå.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
På grund av den ringa mängden florbetapir (18F) i varje dos förväntas inte överdosering ge några farmakologiska effekter. Vid en strålningsöverdos ska den absorberade dosen hos patienten minskas i mesta möjliga mån genom att elimineringen av radioisotopen ur kroppen påskyndas genom frekvent miktion och defekation. Det kan underlätta att beräkna den effektiva dos som har använts.
Farmakodynamik
Verkningsmekanism
Florbetapir (18F) binder till neuritiska beta-amyloidplack. Bindningsstudier där man använt traditionella färgningsmetoder för neuropatologi post-mortem på hjärnor med AD, uppvisade statistiskt signifikanta korrelationer (p < 0,0001) mellan florbetapir (18F)-bindning in vitro och deponering av beta amyloidaggregat. In vivo bedömdes korrelationen mellan upptaget av florbetapir (18F) i kortikal grå substans och den totala beta-amyloid belastningen, för patienter i livets slutskede, med 4G8 antiamyloida antikroppar som färgar beta-amyloid, som finns i både neuritiska och diffusa plack. Bindningen in vivo till andra beta-amyloida strukturer, eller andra strukturer i hjärnan eller receptorer, är okänd.
Farmakodynamisk effekt
Vid den låga kemiska koncentration som finns i Amyvid har inte florbetapir (18F) någon detekterbar farmakologisk aktivitet.
I avslutade kliniska prövningar mättes upptaget av florbetapir (18F) på 6 fördefinierade ställen i hjärnbarken (precuneus, frontal, främre cingulum, bakre cingulum, parietal och temporal) med hjälp av standardiserade värden för upptag (SUV, standardised uptake values). Genomsnittlig kvot för kortikalt SUV (SUVR, i förhållande till cerebellum) är högre hos patienter med Alzheimers än hos friska frivilliga försökspersoner. Genomsnittliga SUVR-värden i cortex jämfört med cerebellum hos patienter med Alzheimers visar fortsatt betydande ökningar från tidpunkt noll till 30 minuter efter administreringen. Därefter sker endast små förändringar upp till 90 minuter efter administreringen. Inga skillnader i SUVR-resultat kunde noteras hos försökspersoner som fick allmänt använda AD-behandlingar jämfört med hos dem som inte fick någon AD-behandling.
Klinisk effekt
En pivotal studie av 59 patienter i livets slutskede syftade till att bedömda det diagnostiska värdet av Amyvid, genom att upptäcka kortikala neuritiska plack (inga eller små mot måttliga eller rikliga). Resultaten från PET-skanningen jämfördes med maximal mängd neuritiska plack från delar av frontala, temporala eller parietala cortex vid obduktionen inom 24 månader efter PET-skanningen. Försökspersonernas kognitiva status kunde inte mätas på ett trovärdigt sätt. För samtliga 59 försökspersoner, gjordes en blindad PET bedömning av fem nukleärmedicinska specialistläkare. För majoriteten av bedömarna var sensitiviteten 92 % (95 % KI: 78 98 %) och specificiteten 100 % (95 % KI: 80 100 %). I en studie på 47 unga (<40 år) friska frivilliga, som antogs vara fria från beta-amyloid, var alla Amyvid PET-skanningar negativa.
Amyvids sensitivitet och specificitet att upptäcka kortikala neuritiska plack, undersöktes ytterligare i två tilläggsstudier, där olika grupper av bedömare tolkade bilder från några personer som följts fram till obduktion, i den pivotala studien. Resultaten låg nära resultaten från den pivotala prövningen. Överensstämmelsen mellan bedömarna visades med Fleiss kappa-värden och låg mellan 0,75 till 0,85.
I en longitudinell studie undersöktes 142 personer (kliniskt diagnosticerade som MCI, AD eller kognitivt normala) med florbetapir (18F) PET-skanning vid studiens start, och följdes upp under 3 år, för utvärdering av sambandet mellan Amyvid-avbildning och förändring av diagnostiskt status.
Diagnostiska värden efter PET-skanning återfinns i tabellen nedan:
|
Diagnosen MCI vid studiens start N=51 |
Diagnosen klinisk AD vid studiens start N=31 |
|
|
Sensitivitet |
19/51 = 37,3% (95% CI: 24,1-51,9%) |
21/31 = 67,7% (95% CI: 51,3-84,2%) |
|
Specificitet |
Ej MCI (kognitivt normal & klinisk AD) 69/100 = 69,0% (95% CI: 59,9-78,1%) |
Ej AD (kognitivt normal & MCI) 91/120 = 75,8% (95% CI: 68,2-83,5%) |
|
Positivt sannolikhetsförhållande |
1,20 (95% CI:0,76-1,91) |
2,80 (95% CI: 1,88-4,18) |
Av patienterna som hade blivit kliniskt diagnosticerade med MCI vid studiens början, hade 9 (19%) försämrats till klinisk AD 36 månader senare. Av 17 MCI-patienter som hade en positiv PET-skanning, fick 6 (35%) diagnosen trolig klinisk AD 36 månader senare jämfört med 3 (10%) av 30 som hade en negativ skanning. Sensitiviteten för Amyvid-skanning att visa omvandling från MCI till AD var 66,7% (95% CI: 35-88%), specificiteten hos 38 personer som inte försämrades var 71,0% (95% CI: 55-83%) och den positiva sannolikhetskvoten var 2,31 (95% CI: 1.2-4.5%). Utformningen av denna studie gör det inte möjligt att uppskatta risken för progression av MCI till klinisk AD.
Kompletterande användning av kvantitativ information för bildtolkning
Genomförbarheten och tillförlitligheten vid användning av CE-märkt kvantifieringsprogramvara som komplement till klinisk kvalitativ tolkning har undersökts i två studier med tre olika kommersiellt tillgängliga programpaket. De deltagande bildgranskarna bedömde först en uppsättning med 96 PET-resultat, inklusive 46 för vilka obduktionsresultat fanns som referens, med en visuell kvalitativ granskningsmetod för att fastställa en baslinje, och ombads därefter att göra en förnyad bedömning av samma uppsättning PET-resultat med eller utan tillgång till information från ett kvantifieringsprogram. Den genomsnittliga granskningsnoggrannheten för alla deltagande bildgranskare för de PET-resultat som kunde jämföras med obduktionsresultat förbättrades från 90,1 % vid baslinjen till 93,1 % (p-värde <0,0001) utan observerad minskning av vare sig sensitivitet eller specificitet.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Amyvid, för alla grupper av den pediatriska populationen, eftersom det inte finns någon användning i den pediatriska populationen.
Farmakokinetik
Distribution
Florbetapir (18F) distribueras i kroppen inom några minuter efter injektionen och metaboliseras därefter snabbt.
Organupptag
Maximalt upptag av florbetapir (18F) i hjärnan inträffar inom några minuter efter injektionen, följt av snabb clearance i hjärnan under de första 30 minuterna efter injektionen. De organ som utsätts för störst exponering är utsöndringsorgan: gallblåsan, levern och tarmarna.
Relativt låga halter av florbetapir (18F) tas upp i cortex och cerebellum hos friska kontrollpersoner. Områdesanalyser visar att lite högre halter tas upp i caudatum, putamen och hippocampus. De högsta upptaget ske i områden som huvudsakligen består av vit substans (pons och centrum semiovale). Hos AD-patienter sker signifikant större upptag i kortikala områden och putamen, jämfört med kontrollpersoner. Hos både AD-patienter och kontrollpersoner sker ett lågt upptag i cerebellum och hippocampus och högt upptag i pons och centrum semiovale.
Den biofysiska grunden till att florbetapir (18F) lagras i den vita substansen i den levande humana hjärnan, kan inte förklaras slutgiltigt. Det antas att långsammare clearance av radiofarmaka kan bidra till upptaget i vit substans, eftersom regionalt cerebralt blodflöde i vit substans är mindre än hälften av blodflödet i cortex. Ökat upptag har identifierats i extracerebrala strukturer såsom hårbotten, spottkörtlar, muskler och skallbenet i några fall. Anledningen till upptaget är inte känd, men kan bero på ackumulering av florbetapir (18F) eller någon av dess radioaktiva metaboliter, eller på radioaktivitet i blodet.
Eliminering
Eliminering sker främst genom clearance i levern och utsöndring via gallblåsan och tarmarna. Viss ackumulering/utsöndring sker också via urinblåsan. Radioaktivitet i urinen föreligger som polära metaboliter av florbetapir (18F).
Halveringstid
Florbetapir (18F) elimineras mycket snabbt från cirkulationen efter en intravenös injektion. Mindre än 5 % av den injicerade 18F-radioaktiviteten finns kvar i blodet 20 minuter efter administreringen och mindre än 2 % finns kvar 45 minuter efter administreringen. Inom tidsfönstret för avbildning, 30 90 minuter, föreligger resterande 18F i cirkulationen i huvudsak i form av polära 18F-metaboliter. Radioaktiv halveringstid för 18F är 110 minuter.
Nedsatt njur- eller leverfunktion
Farmakokinetiken hos patienter med nedsatt njur- eller leverfunktion har inte beskrivits.
Prekliniska uppgifter
Toxikologi och säkerhetsfarmakologi hos djur
Gängse studier avseende säkerhetsfarmakologi och toxicitet vid enstaka och upprepade doser, där florbetapir [den icke-radioaktiva formen av florbetapir (18F)] användes, visade inte några särskilda risker för människa. En akutdosstudie har utförts på råtta, och NOAEL (no observable adverse effect level) bestämdes till minst 100 gånger den högsta dosen till människa. Eventuell toxicitet vid 28 dagars upprepade intravenösa injektioner av florbetapir testades på råtta och hundar. NOAEL var minst 25 gånger den högsta dosen till människa.
I ett in vitro-test av bakteriell återmutation (Ames test) ökade antalet återmuterade kolonier i 2 av de 5 stammar som exponerades för florbetapir. I en in vitro-studie av kromosomavvikelser hos odlade humana perifera lymfocyter ökade inte florbetapir procentandelen celler med strukturella avvikelser vid 3 timmars exponering med eller utan aktivering. Däremot gav 22 timmars exponering en ökning av de strukturella avvikelserna vid samtliga testade koncentrationer. I en mikrokärnstudie på råtta undersöktes eventuell gentoxicitet hos florbetapir in vivo. Florbetapir ökade inte antalet polykromatiska erytrocyter med mikrokärnor vid den högsta dos som kunde uppnås, 372 µg/kg/dag, när denna gavs två gånger dagligen under tre dagar i följd. Denna dos är ungefär 500 gånger högre än den maximala dosen till människa och den visade inga tecken på att vara mutagen.
Inga studier har utförts på djur för att undersöka florbetapirs (18F) eventuella karcinogenicitet och effekter på fertilitet eller reproduktionsförmåga på längre sikt.
Inga djurstudier av toxikologi och säkerhetsfarmakologi har utförts med florbetapir (18F).
Innehåll
Kvalitativ och kvantitativ sammansättning
Amyvid 800 MBq/ml injektionsväska, lösning
En ml injektionsvätska, lösning, innehåller 800 MBq florbetapir (18F) vid dag och tidpunkt för kalibrering (ToC).
Aktiviteten per injektionsflaska varierar mellan 800 MBq och 12 000 MBq vid ToC.
Amyvid 1900 MBq/ml injektionsvätska, lösning
En ml injektionsvätska, lösning, innehåller 1900 MBq florbetapir (18F) vid ToC.
Aktiviteten per injektionsflaska varierar mellan 1900 MBq och 28 500 MBq vid ToC.
Fluor (18F) sönderfaller till stabilt syre (18O) med en halveringstid på omkring 110 minuter genom emission av en positron (strålning 634 keV), följt av fotonisk annihilation (strålning 511 keV).
Hjälpämnen med känd effekt:
En dos innehåller upp till 790 mg etanol och 37 mg natrium.
Förteckning över hjälpämnen
Etanol, vattenfri
Natriumaskorbat
Natriumklorid
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet, förvaring och hantering
Hållbarhet
Amyvid 800 MBq/ml injektionsvätska, lösning
7,5 timmar efter ToC.
Amyvid 1900 MBq/ml injektionsvätska, lösning
10 timmar efter ToC.
Särskilda förvaringsanvisningar
Detta läkemedel kräver ingen särskild temperatur vid förvaring.
Förvaring av radiofarmaka ska ske i enlighet med nationella regelverk för radioaktiva produkter.
Särskilda anvisningar för destruktion
Allmän varning
Radiofarmaka ska endast mottagas, användas och administreras av auktoriserade personer i en klinisk miljö avsedd för ändamålet. För mottagande, förvaring, användning, förflyttning och destruktion gäller regelverk och/eller tillämpliga licenser från behöriga officiella organisationer.
Radiofarmaka ska beredas på ett sätt som uppfyller både strålskyddskrav och farmacevtiska kvalitetskrav. Lämpliga aseptiska försiktighetsåtgärder bör vidtas.
Om injektionsflaskans förslutning skadats ska den inte användas.
Administrering ska ske på ett sätt som minimerar kontamineringsrisken för läkemedlet och strålningsrisken för användarna. Tillräcklig avskärmning är ett absolut krav.
Administrering av radiofarmaka innebär risker för andra personer (även gravid sjukvårdspersonal) från extern strålning eller kontaminering av urin, kräkning etc. Nationella regler avseende strålskyddsåtgärder måste därför följas.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Förpackningsinformation
Injektionsvätska, lösning 800 enheter/ml
Klar, färglös lösning
1 x 10 milliliter flaska (fri prissättning), tillhandahålls ej
1 x 15 milliliter flaska (fri prissättning), tillhandahålls ej
Injektionsvätska, lösning 1900 enheter/ml
Klar, färglös lösning
1 x 10 milliliter flaska (fri prissättning), tillhandahålls ej
1 x 15 milliliter flaska (fri prissättning), tillhandahålls ej





