Indikationer
Influensaprofylax hos barn och ungdomar från 24 månader upp till 18 år.
Användningen av Fluenz Tetra ska baseras på officiella rekommendationer.
Kontraindikationer
-
Överkänslighet mot de aktiva substanserna, mot något hjälpämne som anges i avsnitt Innehåll (t.ex. gelatin), eller mot gentamicin (en möjlig restsubstans).
-
Svår allergisk reaktion (t.ex. anafylaxi) mot ägg eller äggproteiner (t.ex. äggalbumin).
-
Barn och ungdomar med klinisk immunbrist på grund av ett tillstånd eller på grund av immunsuppressiv behandling, såsom: akuta och kroniska leukemier, lymfom, symtomatisk HIV-infektion, brister i det cellulära immunförsvaret och höga doser kortikosteroider. Fluenz Tetra är inte kontraindicerat hos personer med asymtomatisk HIV-infektion eller personer som får lokala/inhalerade kortikosteroider eller systemiska kortikosteroider i låg dos eller hos dem som får kortikosteroider som ersättningsbehandling, t.ex. för binjurebarksvikt.
-
Barn och ungdomar under 18 år som får salicylatbehandling (på grund av sambandet mellan Reyes syndrom och salicylater och infektion med influensa av vildtyp).
Dosering
Dosering
Barn och ungdomar från 24 månaders ålder:
0,2 ml (administrering: 0,1 ml per näsborre)
För barn som inte tidigare har vaccinerats mot säsongsbunden influensa ska en andra dos ges efter ett intervall på minst 4 veckor.
Fluenz Tetra ska inte användas av spädbarn och småbarn under 24 månader av säkerhetsmässiga skäl på grund av en ökad frekvens av sjukhusinläggningar och väsande andning i denna population
(se avsnitt Biverkningar).
Administreringssätt
Immunisering måste utföras genom nasal administrering.
Fluenz Tetra får inte injiceras.
Fluenz Tetra administreras som en uppdelad dos i båda näsborrarna. Efter administrering av halva dosen i en näsborre administreras den andra halvan av dosen i den andra näsborren omedelbart eller strax därefter. Patienten kan andas normalt medan vaccinet administreras – han/hon behöver inte andas in aktivt eller dra in luft.
Se avsnitt Hållbarhet, förvaring och hantering för administreringsanvisningar.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Liksom för de flesta vacciner ska lämplig medicinsk behandling och övervakning alltid finnas tillgänglig för att hantera en anafylaktisk reaktion eller en svår överkänslighetsreaktion efter administrering av Fluenz Tetra.
Fluenz Tetra ska inte ges till barn och ungdomar med allvarlig astma eller med aktiv väsande andning eftersom dessa personer inte har studerats tillräckligt i kliniska studier.
Personer som vaccineras ska informeras om att Fluenz Tetra är ett vaccin baserat på ett levande, försvagat virus, vilket potentiellt kan överföras till personer med nedsatt immunförsvar. Vaccinerade personer ska, när så är möjligt, försöka undvika nära kontakt med personer med kraftigt nedsatt immunförsvar (t.ex. mottagare av benmärgstransplantat, vilka kräver isolering) under 1–2 veckor efter vaccinationen. I kliniska studier har det påvisats att den högsta förekomsten av utsöndring av vaccinvirus inträffade 2–3 dagar efter vaccination. Under omständigheter där kontakt med personer med kraftigt nedsatt immunförsvar inte kan undvikas ska den potentiella risken för överföring av influensavaccinvirus vägas mot risken att förvärva och överföra influensavirus av vildtyp.
Fluenz Tetra får inte injiceras under några omständigheter.
Det finns inga data angående säkerheten vid intranasal administrering av Fluenz Tetra till barn med icke åtgärdade kraniofaciala missbildningar.
Interaktioner
Fluenz Tetra ska inte administreras till barn och ungdomar som får salicylatbehandling (se avsnitt Kontraindikationer). Använd inte salicylater till barn och ungdomar under 4 veckor efter vaccination, om detta inte är medicinskt indicerat, eftersom Reyes syndrom har rapporterats efter användning av salicylater under infektion med influensa av vildtyp.
Samtidig administrering av trivalent Fluenz och levande, försvagade vacciner: mässling, påssjuka, röda hund, vattkoppor och oralt administrerat poliovirus har studerats. Inga kliniskt relevanta förändringar i immunsvaret för mässling, påssjuka, vattkoppor, oralt administrerat poliovirus eller Fluenz har observerats. Immunsvaret för röda hundvaccin förändrades dock signifikant. Denna förändring medför eventuellt ingen klinisk relevans då tvådosimmuniseringsschemat gäller för röda hundvaccin. Observationen med trivalent Fluenz är relevant för användningen av Fluenz Tetra eftersom Fluenz Tetra (vaccin mot influensa, levande, försvagat, nasalt) är identiskt med Fluenz med den enda skillnaden att en fjärde stam (en andra B-stam) har lagts till i Fluenz Tetra.
Samtidig administrering av Fluenz Tetra med inaktiverade vacciner har inte studerats.
Samtidig användning av Fluenz Tetra och antivirala ämnen som är aktiva mot influensa A -och/eller B-virus har inte utvärderats. Baserat på möjligheten att antivirala ämnen mot influensa kan minska effekten av Fluenz Tetra rekommenderas dock att vaccinet inte administreras förrän 48 timmar efter avslutad behandling med antivirala ämnen som är aktiva mot influensa. Administrering av antivirala ämnen som är aktiva mot influensa inom två veckor efter vaccinering kan påverka vaccinsvaret.
Om antivirala ämnen som är aktiva mot influensa och Fluenz Tetra administreras samtidigt ska omvaccinering övervägas baserat på klinisk bedömning.
Graviditet
Det finns en måttlig mängd data från användning av Fluenz Tetra hos gravida kvinnor. Man fann inga bevis för signifikanta biverkningar hos modern hos 138 gravida kvinnor med dokumenterat intag av trivalent Fluenz i en databas över sjukvårdsförsäkringsanspråk i USA.
I mer än 300 fallrapporter i AstraZenecas säkerhetsdatabas för vaccinadministrering till gravida kvinnor observerades inget ovanligt mönster av graviditetskomplikationer eller fosterpåverkan.
Även om djurstudier inte visar några direkta eller indirekta skadliga reproduktionstoxikologiska effekter, och data som framkommit efter det att produkten släppts på marknaden inte tyder på att det finns anledning till oro vid oavsiktlig administrering av vaccinet, rekommenderas inte Fluenz Tetra under graviditet.
Amning
Det är okänt om Fluenz Tetra utsöndras i bröstmjölk. Därför ska, eftersom vissa virus utsöndras i bröstmjölk, Fluenz Tetra inte användas under amning.
Begränsad tillgänglig data tyder på att trivalent Fluenz inte utsöndras i bröstmjölk.
Fertilitet
Det finns inga data avseende Fluenz Tetra möjliga effekter på manlig och kvinnlig fertilitet.
Trafik
Fluenz Tetra har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Erfarenheterna gällande säkerhet med trivalent Fluenz är relevant för användningen av Fluenz Tetra eftersom Fluenz Tetra (vaccin mot influensa, levande, försvagat, nasalt) är identiskt med Fluenz med den enda skillnaden att en fjärde stam (en andra B-stam) har lagts till i Fluenz Tetra.
Säkerhetsdata rörande användning av Fluenz Tetra baseras på data från kliniska studier av Fluenz Tetra med 1 382 barn och ungdomar i åldern 2 till 17 år, kliniska studier av Fluenz med över 29 000 barn och ungdomar i åldern 2 till 17 år och säkerhetsstudier efter godkännande för försäljning med över 84 000 barn och ungdomar i åldern 2 till 17 år. Ytterligare erfarenhet finns efter användning av Fluenz på marknaden.
I kliniska studier var säkerhetsprofilen för Fluenz Tetra liknande den för Fluenz. Den vanligaste biverkning som observerades i kliniska studier var nästäppa och rinnsnuva.
Lista över biverkningar
Biverkningsfrekvenserna rapporteras som:
Mycket vanliga (≥ 1/10)
Vanliga (≥ 1/100, < 1/10)
Mindre vanliga (≥ 1/1 000, < 1/100)
Sällsynta (≥ 1/10 000,< 1/1 000)
Mycket sällsynta (< 1/10 000)
Immunsystemet
Mindre vanliga: Överkänslighetsreaktioner (inklusive ansiktsödem, urtikaria och mycket sällsynta anafylaktiska reaktioner)
Metabolism och nutrition
Mycket vanliga: Minskad aptit
Centrala och perifera nervsystemet
Vanliga: Huvudvärk
Andningsvägar, bröstkorg och mediastinum
Mycket vanliga: Nästäppa/rinnsnuva
Mindre vanliga: Näsblod
Hud och subkutan vävnad
Mindre vanliga: Hudutslag
Muskuloskeletala systemet och bindväv
Vanliga: Myalgi
Allmänna symtom och/eller symtom vid administreringsstället
Mycket vanliga: Sjukdomskänsla
Vanliga: Feber
Pediatrisk population
I en aktivt kontrollerad klinisk studie (MI-CP111) observerades en ökad frekvens av sjukhusinläggningar (oavsett orsak) inom 180 dagar efter den sista vaccindosen hos spädbarn och småbarn i åldern 6-11 månader (6,1 % Fluenz kontra 2,6 % injicerbart influensavaccin). De flesta sjukhusinläggningarna var orsakade av gastrointestinala infektioner och luftvägsinfektioner som inträffade mer än 6 veckor efter vaccinationen. Frekvensen sjukhusinläggningar ökade inte hos mottagare av Fluenz i åldern 12 månader och äldre. I samma studie observerades en ökad frekvens väsande andning inom 42 dagar hos spädbarn och småbarn i åldern 6-23 månader (5,9 % Fluenz kontra 3,8 % injicerbart influensavaccin). Frekvensen väsande andning ökade inte hos mottagare av Fluenz i åldern 24 månader och äldre. Fluenz Tetra är inte avsett för användning till spädbarn och småbarn under 24 månader (se avsnitt Dosering).
Mycket sällsynta rapporter om Guillain-Barrés syndrom och förvärrade symtom på Leighs syndrom (mitokondriell encefalomyopati) har också inkommit efter det att Fluenz släppts på marknaden.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Överdosering med Fluenz Tetra är osannolikt eftersom vaccinet levereras i en förfylld sprayflaska. Administrering av en högre än rekommenderad dos av Fluenz Tetra rapporterades sällan och biverkningsprofilen var jämförbar med den som observerades med den rekommenderade dosen av Fluenz Tetra.
Farmakodynamik
Sedan 1985 har två olika linjetyper av influenza B-virus (Victoria och Yamagata) cirkulerat i världen. Fluenz Tetra är ett tetravalent vaccin som innehåller antigener för fyra influensavirusstammar: en A/(H1N1)-stam, en A/(H3N2)-stam och två B-stammar (en från vardera linjetyp). Fluenz Tetra framställs enligt samma metod som Fluenz. Influensavirusstammarna i Fluenz Tetra är (a) anpassade till kyla (cold adapted; ca), (b) temperaturkänsliga (temperature sensitive; ts) och (c) försvagade (attenuated; att). Som ett resultat därav replikeras de i nasofarynx och inducerar skyddande immunitet.
Kliniska studier
Kliniska erfarenheter med Fluenz är relevanta för Fluenz Tetra eftersom de båda vaccinen framställs enligt samma metod och har sammansättningar som överlappar varandra.
Pediatriska studier
Effekt av Fluenz
Effektdata för Fluenz i den pediatriska populationen består av 9 kontrollerade studier, omfattande över 20 000 spädbarn och småbarn, barn och ungdomar, utförda under 7 influensasäsonger. Fyra placebokontrollerade studier inkluderade omvaccination den andra säsongen. Fluenz har i 3 aktivt kontrollerade studier med injicerbart influensavaccin visats vara överlägset. Se tabell 1 och 2 för en sammanfattning av effektresultat i den pediatriska populationen.
|
Studie-nummer |
Region |
Åldersintervalla |
Antal studie-deltagareb |
Influensa-säsong |
Effekt (95 % KI)c Matchade stammar |
Effekt (95 % KI)c Alla stammar, oavsett matchning |
|---|---|---|---|---|---|---|
|
D153-P502 |
Europa |
6 till 35 M |
1 616 |
2000-2001 |
85,4 % (74,3; 92,2) |
85,9 % (76,3; 92,0) |
|
2001-2002 |
88,7 % (82,0; 93,2) |
85,8 % (78,6; 90,9) |
||||
|
D153-P504 |
Afrika, Latinamerika |
6 till 35 M |
1 886 |
2001 |
73,5 % (63,6; 81,0)d |
72,0 % (61,9; 79,8)d |
|
2002 |
73,6 % (33,3; 91,2) |
46,6 % (14,9; 67,2) |
||||
|
D153-P513 |
Asien/Oceanien |
6 till 35 M |
1 041 |
2002 |
62,2 % (43,6; 75,2) |
48,6 % (28,8; 63,3) |
|
D153-P522 |
Europa, Asien/Oceanien, Latinamerika |
11 till 24 M |
1 150 |
2002-2003 |
78,4 % (50,9; 91,3) |
63,8 % (36,2; 79,8) |
|
D153-P501 |
Asien/Oceanien |
12 till 35 M |
2 764 |
2000-2001 |
72,9 % (62,8; 80,5) |
70,1 % (60,9; 77,3) |
|
2001-2002 |
84,3 % (70,1; 92,4)e |
64,2 % (44,2; 77,3)e |
||||
|
AV006 |
USA |
15 till 71 M |
1 259 |
1996-1997 |
93,4 % (87,5; 96,5) |
93,4 % (87,5, 96,5) |
|
1997-1998 |
100 % (63,1; 100) |
87,1 % (77,7; 92,6)f |
||||
|
a M=månader b Antal studiedeltagare för effektanalys år 1. c Minskning av odlingsbekräftad influensasjukdom i förhållande till placebo. d Data presenterade för klinisk prövning D153-P504 gäller studiedeltagare som fick två doser av studievaccinet. Hos tidigare ovaccinerade studiedeltagare som fick en dos år 1 var effekten 57,7 % (95 % KI: 44,7; 67,9) respektive 56,3 % (95 % KI: 43,1; 66,7) vilket stöder behovet av två vaccindoser hos tidigare ovaccinerade barn. e Hos studiedeltagare som fick 2 doser år 1 och placebo år 2 var effekten år 2 56,2 % (95 % KI: 30,5; 72,7) respektive 44,8 % (95 % KI: 18,2; 62,9) i D153-P501, vilket stöder behovet av omvaccination den andra säsongen. f Den primära cirkulerande stammen var antigeniskt olik H3N2-stammen som var representerad i vaccinet. Effekten mot den icke-matchande A/H3N2-stammen var 85,9 % (95 % KI: 75,3; 91,9). |
||||||
|
Studienummer |
Region |
Åldersintervalla |
Antal studie deltagare |
Influensasäsong |
Förbättrad effekt (95 % KI)b Matchade stammar |
Förbättrad effekt (95 % KI)b Alla stammar, oavsett matchning |
|---|---|---|---|---|---|---|
|
MI-CP111 |
USA, Europa, Asien/ Oceanien |
6 till 59 M |
7 852 |
2004-2005 |
44,5 % (22,4; 60,6) färre fall än injicerbart |
54,9 % (45,4; 62,9)c färre fall än injicerbart |
|
D153-P514 |
Europa |
6 till 71 M |
2 085 |
2002-2003 |
52,7 % (21,6; 72,2) färre fall än injicerbart |
52,4 % (24,6; 70,5)d färre fall än injicerbart |
|
D153-P515 |
Europa |
6 till 17 Å |
2 211 |
2002-2003 |
34,7 % (3,9; 56,0) färre fall än injicerbart |
31,9 % (1,1; 53,5) färre fall än injicerbart |
|
a M=månader. Å=år. Åldersintervall enligt beskrivning i studieprotokollet. b Minskning av odlingsbekräftad influensasjukdom i förhållande till injicerbart influensavaccin. c Fluenz visade 55,7 % (39,9; 67,6) färre fall än injicerbart influensavaccin hos 3 686 spädbarn och småbarn på 6–23 månader och 54,4 % (41,8; 64,5) färre fall hos 4 166 barn på 24-59 månader. d Fluenz visade 64,4 % (1,4; 88,8) färre fall än injicerbart influensavaccin hos 476 spädbarn och småbarn på 6-23 månader och 48,2 % (12,7; 70,0) färre fall hos 1 609 barn på 24-71 månader. |
||||||
Säkerhet för Fluenz
Kroniska tillstånd
Även om säkerheten för barn och ungdomar med lindrig till måttlig astma har fastställts är data från barn med andra lungsjukdomar, kronisk kardiovaskulär eller metabolisk sjukdom eller njursjukdom begränsade.
I en studie (D153-P515) med barn i åldern 6 till 17 år med astma (trivalent Fluenz: n = 1 114, trivalent injicerbart influensavaccin: n = 1 115) förelåg inga signifikanta skillnader mellan behandlingsgrupperna gällande incidensen av astmaexacerbationer, medelfrekvensen för exspiratoriskt toppflöde, astmasymtompoäng eller poäng för uppvaknande nattetid. Incidensen för väsande andning inom 15 dagar efter vaccinationen var lägre hos personer som vaccinerades med Fluenz jämfört med personer som vaccinerades med inaktiverat vaccin (19,5 % jämfört med 23,8 %, P = 0,02).
I en studie med barn och ungdomar i åldern 9 till 17 år med lindrig till svår astma (trivalent Fluenz: n = 24, placebo: n = 24) fanns det inte någon skillnad i primärt säkerhetskriterium, förändring av förutsagd forcerad exspiratorisk volym på 1 sekund (FEV1) uppmätt före och efter vaccinationen mellan de båda behandlingsarmarna.
I studier med vuxna där en stor andel av personerna hade underliggande, kroniska medicinska tillstånd var säkerhetsprofilen för trivalent Fluenz jämförbar med den säkerhetsprofil som observerades hos personer utan dessa tillstånd.
Nedsatt immunförsvar
Hos 24 HIV-positiva barn och 25 HIV-negativa barn i åldern 1 till 7 år och hos 243 HIV-positiva barn i åldern 5 till 17 år som fick stabil antiretroviral behandling var frekvensen och tiden för utsöndringen av vaccinvirus jämförbar med den som ses hos friska individer. Inga biverkningar på mängden HIV-virus eller CD4-antal kunde identifieras efter administrering av trivalent Fluenz. Tjugo barn och ungdomar i åldern 5 till 17 år med måttligt till svårt nedsatt immunförsvar (som behandlades med kemoterapi eller strålbehandling eller som nyligen hade behandlats med kemoterapi) randomiserades 1:1 till antingen trivalent Fluenz eller placebo. Frekvensen och tiden för utsöndringen av vaccinvirus hos dessa barn med nedsatt immunförsvar var jämförbara med de som ses hos friska barn och ungdomar. Effekten av Fluenz och Fluenz Tetra för att förebygga influensa hos personer med nedsatt immunförsvar har inte utvärderats.
Immunogenicitet hos Fluenz Tetra
En randomiserad, dubbelblind, aktivt kontrollerad, multicenterstudie med non-inferiority genomfördes för att utvärdera immunogeniciteten hos Fluenz Tetra jämfört med Fluenz (aktiv kontroll) hos barn och ungdomar i åldern 2-17 år. Totalt 2 312 barn och ungdomar randomiserades utifrån plats med ett 3:1:1-förhållande till att få antingen Fluenz Tetra eller en av två olika formuleringar av jämförelsevaccinet Fluenz, båda med en B-stam som motsvarade en av de båda B-stammarna i Fluenz Tetra (en B-stam från Yamagata-linjen och en B stam från Victoria-linjen).
Immunogeniciteten utvärderades genom en jämförelse av geometriska medeltitrer (GMT) av stamspecifika hemagglutinationsinhiberande (HI) antikroppar i serum efter dosering. Fluenz Tetra visade immunologisk non-inferiority till de båda formuleringarna av Fluenz eftersom den övre gränsen för de fyra 95 % konfidensintervallen för förhållandet för stamspecifika GMT HI antikroppar var ≤ 1,5.
Studier med vuxna
Flera studier mot placebo har visat att Fluenz kan ha viss effekt hos vuxna. Någon slutsats om den kliniska nyttan med detta vaccin hos vuxna kan emellertid inte dras med tanke på att resultat som har observerats i några studier kontra injicerbart influensavaccin tyder på att Fluenz har sämre effekt.
Farmakokinetik
Ej relevant.
Prekliniska uppgifter
Gängse studier avseende allmäntoxicitet, reproduktionseffekter och effekter på utveckling, lokal tolerans samt neurovirulens visade inte några särskilda risker för människa.
Innehåll
Kvalitativ och kvantitativ sammansättning
Reassortant influensavirus* (levande, försvagat) av följande fyra stammar**:
|
A/Victoria/4897/2022 (H1N1)pdm09 ‑ liknande stam (A/Norway/31694/2022, MEDI 369815) |
107,0±0,5 FFU*** |
|
A/Darwin/9/2021 (H3N2) - liknande stam (A/Norway/16606/2021, MEDI 355293) |
107,0±0,5 FFU*** |
|
B/Austria/1359417/2021 – liknande stam (B/Austria/1359417/2021, MEDI 355292) |
107,0±0,5 FFU*** |
|
B/Phuket/3073/2013 - liknande stam (B/Phuket/3073/2013, MEDI 306444) |
107,0±0,5 FFU*** |
|
.................................................................................................................. |
per 0,2 ml dos |
* förökade i fertiliserade hönsägg från friska hönsbesättningar.
** producerade i VERO-celler genom omvänd genteknik. Denna produkt innehåller genetiskt modifierade organismer (GMO).
*** fluorescerande fokusenheter
Detta vaccin uppfyller rekommendationen från WHO (norra hemisfären) och EU:s beslut för säsongen 2023/2024.
Vaccinet kan innehålla rester av följande ämnen: äggproteiner (t.ex. äggalbumin) och gentamicin. Den högsta mängden ovalbumin är mindre än 0,024 mikrogram per dos om 0,2 ml (0,12 mikrogram per ml).
Förteckning över hjälpämnen
Sackaros
Dikaliumfosfat
Kaliumdivätefosfat
Gelatin (porcint, typ A)
Argininhydroklorid
Mononatrium-glutamatmonohydrat
Vatten för injektioner
Blandbarhet
Då blandbarhetsstudier saknas får detta vaccin inte blandas med andra läkemedel.
Miljöpåverkan
Influensavirus A/Darwin/9/2021 (H3N2)-liknande stam (A/Norway/16606/2021, MEDI 355293), levande försvagat
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Fluenz Tetra consists of our live attenuated (weakened), vaccine strains of type A/H1N1, type A/H3N2 and 2 type B virus strains. As the exact type of strain may be adjusted based on annual advice issued by the WHO (World Health Organisation), the precise combination of strains can be found in the product information.
According to the European Medicines Agency guideline (Ref. 1) on environmental risk assessments for pharmaceuticals (EMA/CHMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment.
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
In Swedish: Även om biomolekyler är undantagna från miljöriskklassificering bör det beaktas att dessa molekyler kan vara biologiskt aktiva.
As the vaccine virus strains in Fluenz Tetra are classed as genetically modified organisms under European guidance, a full assessment has been conducted according to the European Union (EU) Directive 2001/18/EC to identify and evaluate potential adverse effects on human health (other than the intended recipients) and the environment, which may result from the placing on the market of the genetically modified organism (GMO). This assessment concluded that the overall risk from Fluenz Tetra is negligible and the conclusions of this assessment are unlikely to be impacted by any annual strain updates.
This justifies the phrase:
Use of Fluenz Tetra has been considered to result in insignificant environmental impact.
In Swedish: Användning av Fluenz Tetra bedöms inte medföra någon miljöpåverkan.
References
-
Committee for Medicinal Products for Human Use (CHMP). Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. EMEA/CPMP/SWP/4447/00 corr2. 1 June 2006
Influensavirus B/Austria/1359417/2021-liknande stam (B/Austria/1359417/2021, MEDI 355292), levande försvagat
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Fluenz Tetra consists of our live attenuated (weakened), vaccine strains of type A/H1N1, type A/H3N2 and 2 type B virus strains. As the exact type of strain may be adjusted based on annual advice issued by the WHO (World Health Organisation), the precise combination of strains can be found in the product information.
According to the European Medicines Agency guideline (Ref. 1) on environmental risk assessments for pharmaceuticals (EMA/CHMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment.
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
In Swedish: Även om biomolekyler är undantagna från miljöriskklassificering bör det beaktas att dessa molekyler kan vara biologiskt aktiva.
As the vaccine virus strains in Fluenz Tetra are classed as genetically modified organisms under European guidance, a full assessment has been conducted according to the European Union (EU) Directive 2001/18/EC to identify and evaluate potential adverse effects on human health (other than the intended recipients) and the environment, which may result from the placing on the market of the genetically modified organism (GMO). This assessment concluded that the overall risk from Fluenz Tetra is negligible and the conclusions of this assessment are unlikely to be impacted by any annual strain updates.
This justifies the phrase:
Use of Fluenz Tetra has been considered to result in insignificant environmental impact.
In Swedish: Användning av Fluenz Tetra bedöms inte medföra någon miljöpåverkan.
References
-
Committee for Medicinal Products for Human Use (CHMP). Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. EMEA/CPMP/SWP/4447/00 corr2. 1 June 2006
Influensavirus B/Phuket/3073/2013-liknande stam (B/Phuket/3073/2013, MEDI 306444), levande försvagat
Miljörisk:
Användning av vacciner bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Fluenz Tetra consists of our live attenuated (weakened), vaccine strains of type A/H1N1, type A/H3N2 and 2 type B virus strains. As the exact type of strain may be adjusted based on annual advice issued by the WHO (World Health Organisation), the precise combination of strains can be found in the product information.
According to the European Medicines Agency guideline (Ref. 1) on environmental risk assessments for pharmaceuticals (EMA/CHMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment.
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Even though biomolecules are exempted from environmental risk classification it should be remembered that these molecules may be biologically active.
In Swedish: Även om biomolekyler är undantagna från miljöriskklassificering bör det beaktas att dessa molekyler kan vara biologiskt aktiva.
As the vaccine virus strains in Fluenz Tetra are classed as genetically modified organisms under European guidance, a full assessment has been conducted according to the European Union (EU) Directive 2001/18/EC to identify and evaluate potential adverse effects on human health (other than the intended recipients) and the environment, which may result from the placing on the market of the genetically modified organism (GMO). This assessment concluded that the overall risk from Fluenz Tetra is negligible and the conclusions of this assessment are unlikely to be impacted by any annual strain updates.
This justifies the phrase:
Use of Fluenz Tetra has been considered to result in insignificant environmental impact.
In Swedish: Användning av Fluenz Tetra bedöms inte medföra någon miljöpåverkan.
References
-
Committee for Medicinal Products for Human Use (CHMP). Guideline on the Environmental Risk Assessment of Medicinal Products for Human Use. EMEA/CPMP/SWP/4447/00 corr2. 1 June 2006
Hållbarhet, förvaring och hantering
Hållbarhet
18 veckor.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C-8 °C).
Får ej frysas.
Ljuskänsligt. Förvara näspipetten i ytterkartongen.
Före användning får vaccinet tas ut ur kylskåpet under en period av högst 12 timmar vid en temperatur på högst 25 °C. Stabilitetsdata indikerar att vaccinkomponenterna är stabila under 12 timmar vid förvaring vid temperaturer från 8 °C till 25 °C. Vid slutet av denna period ska Fluenz Tetra användas omedelbart eller kasseras.
Särskilda anvisningar för destruktion och övrig hantering
Administrering
Fluenz Tetra ÄR ENDAST AVSETT FÖR NASAL ANVÄNDNING.
-
FÅR INTE ANVÄNDAS MED INJEKTIONSNÅL. Får inte injiceras.
-
Använd inte Fluenz Tetra om utgångsdatumet har passerats eller om sprayflaskan verkar vara skadad, t.ex. om kolven är lös eller har lossnat från sprayflaskan eller om det finns tecken på läckage.
-
Kontrollera utseendet på vaccinet före administrering. Suspensionen ska vara färglös till blekgul, genomskinlig till lätt grumlig. Små, vita partiklar kan finnas.
-
Fluenz Tetra administreras som en uppdelad dos i båda näsborrarna.
-
Efter administrering av halva dosen i en näsborre administreras den andra halvan av dosen i den andra näsborren omedelbart eller strax därefter.
-
Patienten kan andas normalt medan vaccinet administreras -han/hon behöver inte andas in aktivt eller dra in luft.
-
I administreringsdiagrammet för Fluenz Tetra (figur 1) finns steg för steg anvisningar för administrering.
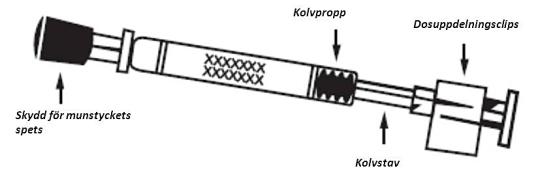
Figur 1 Administrering av Fluenz Tetra
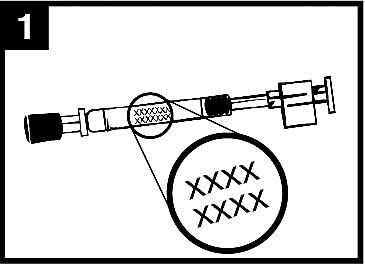
1. Kontrollera utgångsdatumet
Produkten ska inte användas efter datumet på pipettens etikett.
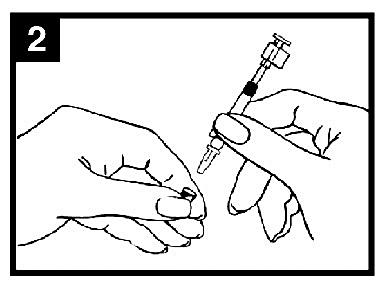
2. Förbered pipetten
Ta bort gummiskyddet från spetsen. Ta inte bort dosuppdelningsclipset i pipettens andra ände.
3. Placera pipetten
Patienten placeras i upprätt ställning och spetsen placeras precis innanför näsborrens kant för att säkerställa att Fluenz Tetra levereras i näsan.
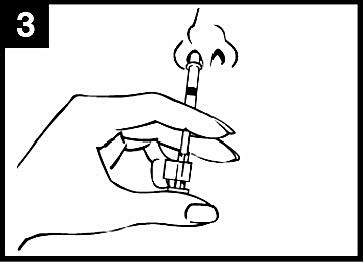
4. Tryck in kolven
Tryck in kolven med en enda rörelse så snabbt som möjligt tills dosuppdelningsclipset hindrar vidare intryckning.
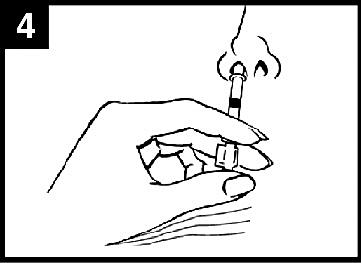
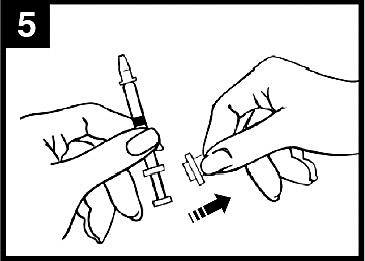
5. Ta bort dosuppdelningsclipset
För administrering i den andra näsborren, kläm ihop och ta bort dosuppdelningsclipset från kolven.
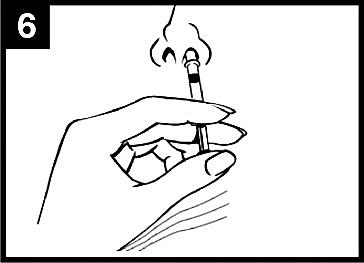
6. Spraya i den andra näsborren
Placera spetsen precis innanför kanten på den andra näsborren och tryck in kolven med en enda rörelse så snabbt som möjligt för att leverera det återstående vaccinet.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar för medicinskt avfall.
Egenskaper hos läkemedelsformen
Nässpray, suspension
Suspensionen är färglös till blekgul, genomskinlig till opalskimrande, med ett pH på cirka 7,2. Små, vita partiklar kan finnas.
Förpackningsinformation
Nässpray, suspension
(Fluenz Tetra tillhandahålls säsongsvis från oktober till och med februari.) Suspensionen är färglös till blekgul, genomskinlig till opalskimrande. Små, vita partiklar kan finnas.
1 x 0,2 milliliter spraybehållare (fri prissättning), tillhandahålls ej
10 x 0,2 milliliter spraybehållare (fri prissättning), tillhandahålls ej





