Suprecur
buserelin
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa den igen.
-
Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
-
Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomdstecken som liknar dina.
-
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska.
-
Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad Suprecur är och vad det används för
2. Vad du behöver veta innan du använder Suprecur
3. Hur du använder Suprecur
4. Eventuella biverkningar
5. Hur Suprecur ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad Suprecur är och vad det används för
Suprecur innehåller ett läkemedel som kallas för buserelin. Buserelin liknar ett naturligt förekommande hormon som frisätts av hjärnan. Det tillhör en grupp av läkemedel som kallas för ”luteiniserande hormonfrisättande hormonanaloger” (LHRH-analoger).
Suprecur används för att minska tillväxten av endometrios och för att lindra symtomen, t.ex. smärta. Suprecur används också vid förbehandling inför provrörsbefruktning (in vitro-fertilisering).
Vid endometrios verkar Suprecur genom att hämma äggstockarnas funktion, vilket leder till att produktionen av de kvinnliga könshormonerna östradiol och progesteron minskar. Endometrios, som beror på att livmoderslemhinna felaktigt finns utanför livmodern, stimuleras normalt av de kvinnliga könshormonerna östradiol och progesteron. Genom att Suprecur hämmar äggstockarna innebär behandlingen att också tillväxten av endometrios minskar. En annan effekt av att Suprecur hämmar äggstockarnas funktion är att mensen uteblir.
Vid provrörsbefruktning (in vitro-fertilisering) utnyttjas hämningen av äggstocksfunktionen för att undvika spontan ägglossning. När koncentrationen av östradiol har sjunkit till låg nivå inleds behandling med gonadotropin, ett hormon som stimulerar ägglossningen.
Buserelin som finns i Suprecur kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apoteks- eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
2. Vad du behöver veta innan du använder Suprecur
Använd inte Suprecur
-
Om du är allergisk mot buserelin eller något av övriga LHRH-analoger (t.ex. leuprolid, goserelin, triptorelin) eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
-
Om du är gravid.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Suprecur:
-
Om du har högt blodtryck. Din läkare eller sjuksköterska bör regelbundet kontrollera ditt blodtryck eftersom blodtrycket kan påverkas av Suprecur.
-
Om du har någon hjärtkärlsjukdom inklusive hjärtrytmrubbning (arytmi), eller behandlas med läkemedel mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd vid användning av Suprecur.
-
Om du har diabetes. Kontrollera dina blodsockernivåer regelbundet. Detta för att Suprecur kan påverka din metabolism och därmed dina blodsockernivåer.
-
Om du någon gång haft en depression. Du ska vara vaksam på din mentala hälsa eftersom det finns en risk att din depression kan komma tillbaka eller förvärras. Tala med din läkare om du blir nedstämd/deprimerad under tiden du tar Suprecur.
Suprecur kan orsaka en minskad bentäthet, osteoporos (försvagning av skelettet) samt en ökad risk för benbrott, särskilt om du har riskfaktorer för benskörhet såsom alkoholmissbruk, är rökare, förekomst av benskörhet i släkten eller om du under en längre tid behandlats med medel mot epilepsi eller med kortison. Risken för benbrott ökar med behandlingstidens längd. Din läkare bör mäta din bentäthet regelbundet för att vid behov kunna ordinera förebyggande åtgärder mot benskörhet.
Vid symtomlindring av endometrios
-
Innan behandling av endometrios påbörjas ska användning av p-piller avbrytas. När du använder Suprecur kan du inte bli gravid så länge hämningen av äggstocksfunktionen kvarstår. Under behandlingstiden rekommenderas att icke-hormonella preventivmedel (t.ex. kondom) används.
-
Behandling med Suprecur kommer att leda till att mensen uteblir. Det är en förväntad effekt av behandlingen. Informera din läkare om du fortsätter att få din mens under behandlingstiden.
-
Medan du behandlar dig med Suprecur förväntas du inte bli gravid. Om behandlingen avbryts, om endast för några få dagar, kan ägglossning och graviditet inträffa. Om graviditet inträffar måste behandlingen med Suprecur avbrytas omedelbart och läkare informeras.
-
En minskad bentäthet kan uppkomma (försvagning av skelettet), varför behandlingstidens längd ej bör överskrida 6 månader. Upprepade behandlingsperioder bör endast genomföras efter noggrann bedömning av behandlande läkare.
Vid förbehandling till provrörsbefruktning
-
När Suprecur används samtidigt med annan LHRH-analog finns det en ökad risk för att få överstimulerade äggstockar (hyperstimuleringssyndrom, OHSS), särskilt om du har polycystiskt ovariesyndrom (förstorade äggstockar fyllda med äggblåsor). Tecken på överstimulerade äggstockar kan vara obehag från magen, ont i magen, uppspänd mage, illamående, kräkningar, äggstockscystor, förstoring av äggstockarna, andnöd eller andfåddhet, diarré, liten urinproduktion. Koncentrering av blodet, dvs. minskad mängd vätska i blodet, vilket ger ökad koncentration av blodets komponenter. Ökad risk för blodproppsbildning. Tillstånd i äggstockarna som kan leda till svår smärta i nedre delen av magen. Allvarliga blodproppsbiverkningar kan också uppstå. Utgången kan vara dödlig. Varje stimuleringscykel ska därför noga följas av läkare för att tidigt upptäcka detta.
-
Innan behandlingen med Suprecur påbörjas rekommenderas att ett graviditetstest görs för att utesluta graviditet.
Barn och ungdomar
Eftersom det saknas information om läkemedlets säkerhet och effekt hos barn, ska Suprecur inte användas hos barn.
Andra läkemedel och Suprecur
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Suprecur kan påverka eller påverkas av vissa andra läkemedel.
Informera läkare särskilt om du använder:
-
läkemedel för diabetes. Detta på grund av att Suprecur kan minska effekten av dessa läkemedel.
-
läkemedel för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol).
-
andra läkemedel som kan öka risken för hjärtrytmrubbningar när det används tillsammans med Suprecur, t.ex. metadon (används som smärtlindrande och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (som används vid svåra psykiska sjukdomar).
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Graviditet: Suprecur ska inte användas under graviditet. Om du blir gravid ska du avbryta behandlingen och kontakta läkare.
Amning: Suprecur passerar över i modersmjölk i små mängder. Inga negativa effekter på det ammade barnet har setts, men det rekommenderas ändå att amning undviks under behandlingen med Suprecur.
Körförmåga och användning av maskiner
Suprecur kan orsaka biverkningar (såsom yrsel) som kan påverka din koncentrationsförmåga och reaktionshastighet. Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Suprecur innehåller natrium och bensalkoniumklorid
Suprecur innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per ml, d.v.s. är näst intill “natriumfritt”.
Suprecur innehåller bensalkoniumklorid
Detta läkemedel innehåller 0,1 mg bensalkoniumklorid per ml nässpray, lösning. Bensalkoniumklorid kan orsaka irritation och svullnad inuti näsan, särskilt vid längre tids användning av läkemedlet.
3. Hur du använder Suprecur
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Doseringsanvisning
Symtomlindring vid endometrios
För att snabbt uppnå effekt och för att undvika att behandling ges under en redan påbörjad graviditet, bör behandlingen alltid startas på menstruationens första eller andra dag.
Normal dygnsdos är 0,9 mg, fördelad på tre dostillfällen. En spraydos à 0,15 mg tas i vardera näsborren morgon, middag och kväll. Andra tidpunkter kan väljas under förutsättning att doseringstillfällena är jämnt fördelade över hela dygnet.
En flaska à 10 ml (= 100 doser) räcker till 2 veckors behandling (0,9 mg/dygn) och ska därefter kasseras.
Som förbehandling till provrörsbefruktning
Olika behandlingsscheman tillämpas vid provrörsbefruktning. Behandlingen kan antingen starta på menstruationens första eller andra dag eller ungefär en vecka före nästa väntade mens men i det senare fallet måste graviditet kunna uteslutas.
Normal dygnsdos är 0,6 mg, uppdelad på fyra dostillfällen. En spraydos à 0,15 mg tas i ena näsborren 4 gånger per dygn, förslagsvis vid följande tidpunkter: kl 7, kl 12, kl 17 och kl 22.
Vissa patienter behöver en högre dos. Om du är ordinerad 1,2 mg Suprecur per dygn följer du schemat ovan, men sprayar en dos i vardera näsborren vid varje doseringstillfälle.
En flaska à 10 ml (= 100 doser) räcker till 3 veckors behandling (0,6 mg/dygn), eller 1,5 vecka (1,2 mg/dygn) och ska därefter kasseras.
Om du har använt för stor mängd av Suprecur
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112) för bedömning av risken samt rådgivning.
För stora mängder av detta läkemedel kan göra att du känner orkeslöshet, huvudvärk, oro, värmevallningar, yrsel, illamående, magsmärta, svullnad (ödem) av anklar och ömhet i brösten.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, sjuksköterska eller apotekspersonal.
Bruksanvisning
Montering av nässprayen
1. Glasflaska: Skruva av locket.
2. Plastbehållare: Tag ut doseringspumpen.
a) Avlägsna skyddshättan (vit) från doseringspumpen.

2 a
b) Avlägsna därefter den halvgenomskinliga skyddshättan från pumpröret.
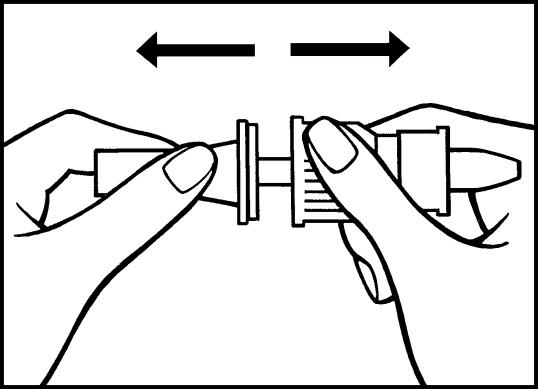
2 b
3. För ned pumröret i flaskan och skruva på doseringspumpen. Nässprayen är nu färdigmonterad.
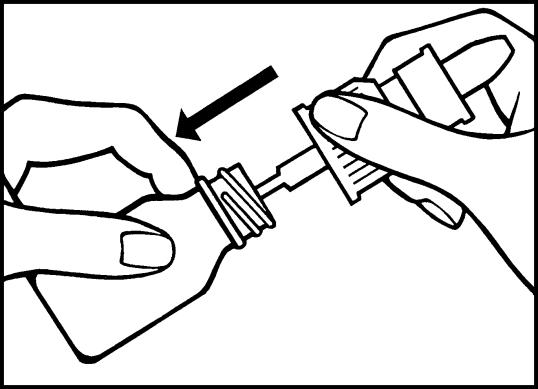
3
4. Innan sprayflaskan används för första gången, pumpa ca 5-8 gånger i luften till dess en jämn “sky” erhålls. Sprayen ska hållas upprätt. Ytterligare provsprayning är inte nödvändig utan medför endast åtgång av preparatet.
Användning
5. När sprayen ska användas hålls huvudet lätt framåtböjt och sprayen hålls lodrätt.
Dosering: Se Doseringsanvisning.

5
OBS! Se till att näsan är fri från slem vid förkylning. Preparatet ger då effekt även vid nästäppa.
Efter användning ska doseringspumpen förbli fastskruvad på glasflaskan. Sätt på den vita skyddshättan och förvara sprayen stående.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Kontakta omedelbart läkare om du får symtom såsom utslag, svälj- eller andningssvårigheter, uppsvullnad av läppar, ansikte, svalg eller tunga. Detta kan vara en allvarlig allergisk reaktion.
Rapporterade biverkningar
Vanliga (kan förekomma hos upp till 1 av 10 användare)
-
Viktökning eller viktminskning
-
Hjärtklappning
-
Huvudvärk, dåsighet, yrsel, trötthet
-
Lukt- och smakförändring
-
Illamående, kräkningar, diarré, förstoppning, smärta i magen
-
Torr hud, akne, hudutslag
-
Ökad eller minskad huvudbehåring
-
Smärta i ryggen, armar, ben och leder, muskelstelhet i axel
-
Värmekänsla i huden, svettningar
-
Irritation av nässlemhinnan, näsblod
-
Menstruationsliknande blödning, torrhet i slidan, underlivsflytningar, äggstockscystor (sjuklig blåsbildning i äggstock), bröstömhet, förändring av bröstens storlek, smärta vid samlag
-
Sömnrubbningar, minskad sexlust, nervositet, humörförändringar, depression (vid långtidsanvändning).
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
-
Påverkan på leverfunktionsvärden
-
Minnes- och koncentrationsstörningar, myrkrypningar och stickningar i huden
-
Torra ögon, synstörning (till exempel dimsyn), känsla av tryck bakom ögonen
-
Spruckna naglar, ökad eller minskad kroppsbehåring
-
Ökad törst, förändrad matlust
-
Vätskeansamling (ödem) i ansikte, armar och ben
-
Överkänslighetsreaktioner (hudrodnad, klåda, nässelutslag)
-
Mjölkutsöndring, inflammation i slidan
-
Humörförändringar, depression (vid korttidsanvändning), ångest.
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
-
Förändrade blodfettvärden
-
Öronsus, hörselstörning
-
Förhöjt blodtryck hos patienter med redan för högt blodtryck
-
Andnöd, kramp i luftrörens muskulatur
-
Allvarliga allergiska reaktioner med chock
-
Känslomässig instabilitet, ängslan.
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare)
-
Förändringar i blodbilden
-
Obehag och smärta i muskler och skelett
-
Minskad glukostolerans (kan hos diabetiker leda till försämrad diabetisk kontroll)
-
Tillväxt av godartad tumör i hypofysen
-
Försämring av allmänt välbefinnande.
Har rapporterats (förekommer hos okänt antal användare):
-
Förändringar (QT-förlängning) som kan ses på elektrokardiogram (EKG).
Biverkningarna av Suprecur är dosberoende, dvs. när Suprecur används i låga doser som vid förbehandling till provrörsbefruktning (in vitro-fertilisering) förekommer dessa biverkningar mindre frekvent och är mindre uttalade än vid behandling av endometrios.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur Suprecur ska förvaras
Förvaras vid högst 25 ºC.
Får ej frysas.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Öppnad flaska ska användas inom 5 veckor.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
-
Den aktiva substansen är buserelin. 1 g nässpray innehåller buserelinacetat motsvarande 1,5 mg buserelin. 1 dos nässpray motsvarar 0,15 mg buserelin.
-
Övriga innehållsämnen är citronsyramonohydrat, natriumcitratdihydrat, natriumklorid, bensalkoniumklorid (konserveringsmedel), vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
En förpackning innehåller 2 bruna glasflaskor à 10 ml klar lösning samt 2 doseringspumpar.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
CHEPLAPHARM Arzneimittel GmbH
Ziegelhof 24
17489 Greifswald
Tyskland
Tillverkare
Sanofi-Aventis Deutschland GmbH
Industriepark Höchst
Brüningstraße 50
65926 Frankfurt am Main
Tyskland
Denna bipacksedel ändrades senast 2021-11-18




