Indikationer
Zydelig är i kombination med rituximab avsett för behandling av vuxna patienter med kronisk lymfatisk leukemi (KLL):
-
som har fått minst en tidigare behandling (se Varningar och försiktighet) eller
-
vid första linjens behandling vid 17p-deletion eller TP53-mutation då inga andra lämpliga behandlingar är tillgängliga (se Varningar och försiktighet).
Zydelig är avsett som monoterapi för behandling av vuxna patienter med follikulärt lymfom (FL) som är refraktärt mot två tidigare behandlingslinjer (se Varningar och försiktighet).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i Förteckning över hjälpämnen.
Dosering
Behandling med Zydelig ska genomföras av en läkare som har erfarenhet av cancerterapier.
Dosering
Rekommenderad dos är 150 mg idelalisib två gånger dagligen. Behandlingen ska fortsätta till sjukdomsprogression eller oacceptabel toxicitet.
Om patienten missar en dos av Zydelig med mindre än 6 timmar från den tidpunkt då den vanligen tas, ska patienten ta den missade dosen snarast möjligt och sedan följa det vanliga doseringsschemat. Om en patient missar en dos med mer än 6 timmar, ska patienten hoppa över den missade dosen och sedan bara följa det vanliga doseringsschemat.
Dosändring
Förhöjda levertransaminaser
Behandling med Zydelig måste sättas ut i händelse av aminotransferasförhöjning av grad 3 eller 4 (alaninaminotransferas [ALAT]/aspartataminotransferas [ASAT] > 5 x övre normalgränsen [upper limit of normal, ULN]). När värdena har återgått till grad 1 eller lägre (ALAT/ASAT ≤ 3 x ULN) kan behandlingen återupptas med 100 mg två gånger dagligen.
Om händelsen inte återkommer, kan dosen ökas till 150 mg två gånger dagligen efter behandlande läkares beslut.
Om händelsen återkommer, måste behandlingen med Zydelig sättas ut till dess att värdena har återgått till grad 1 eller lägre, varefter läkaren kan överväga att återinsätta behandlingen med 100 mg två gånger dagligen (se avsnitt Varningar och försiktighet och Biverkningar).
Diarré/kolit
Behandling med Zydelig måste sättas ut i händelse av diarré/kolit av grad 3 eller 4. När diarrén/koliten har återgått till grad 1 eller lägre, kan behandlingen återupptas med 100 mg två gånger dagligen. Om diarrén/koliten inte återkommer kan dosen ökas till 150 mg två gånger dagligen efter behandlande läkares beslut (se avsnitt Biverkningar).
Pneumonit
Behandling med Zydelig måste sättas ut i händelse av misstänkt pneumonit. När pneumoniten har avklingat och om en ny behandling är lämplig, kan återupptagande av behandling med 100 mg två gånger dagligen övervägas. Behandling med Zydelig måste avbrytas permanent i händelse av måttlig eller svår symtomatisk pneumonit eller organiserande pneumoni (se avsnitt Varningar och Försiktighet och Biverkningar).
Hudutslag
Behandling med Zydelig måste sättas ut vid hudutslag av grad 3 eller 4. När hudutslaget har återgått till grad 1 eller lägre, kan behandlingen återupptas med 100 mg två gånger dagligen. Om hudutslaget inte återkommer, kan dosen ökas till 150 mg två gånger dagligen efter behandlande läkares beslut (se avsnitt Biverkningar).
Neutropeni
Uppehåll i behandlingen med Zydelig bör göras för patienten om absolut neutrofilantal (ANC) understiger 500 per mm3. ANC ska kontrolleras minst en gång i veckan tills ANC är ≥ 500 per mm3 då behandling kan återupptas med 100 mg två gånger dagligen (se avsnitt Varningar och Försiktighet).
|
ANC 1 000 till < 1 500/mm3 |
ANC 500 till < 1000/mm3 |
ANC < 500/mm3 |
|
Fortsätt med dosering av Zydelig. |
Fortsätt med dosering av Zydelig. Kontrollera ANC minst en gång i veckan. |
Avbryt dosering av Zydelig. Kontrollera ANC minst en gång i veckan tills ANC ≥ 500/mm3, därefter kan dosering av Zydelig återupptas med 100 mg två gånger dagligen. |
Särskilda populationer
Äldre
Ingen specifik dosjustering krävs för äldre patienter (i åldern ≥ 65 år) (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Ingen dosjustering krävs för patienter med lätt, måttligt eller gravt nedsatt njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering krävs vid behandlingsstart med Zydelig hos patienter med lätt eller måttligt nedsatt leverfunktion, men en ökad övervakning av biverkningar rekommenderas (se avsnitt Varningar och Försiktighet och Farmakokinetiska egenskaper).
Data är otillräckliga för att rekommendera dosering till patienter med gravt nedsatt leverfunktion. Således rekommenderas försiktighet vid administrering av Zydelig till denna population och en ökad övervakning av biverkningar rekommenderas (se avsnitt Varningar och Försiktighet och Farmakokinetiska egenskaper).
Pediatrisk population
Säkerhet och effekt för Zydelig för barn under 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Zydelig är avsett för oral användning. Patienterna ska instrueras att svälja tabletten hel. Den filmdragerade tabletten ska inte tuggas eller krossas. Den filmdragerade tabletten kan tas med eller utan föda (se avsnitt Farmakokinetiska egenskaper).
Varningar och försiktighet
Allvarliga infektioner
Behandling med Zydelig ska inte initieras hos patienter med något tecken på pågående systemisk infektion orsakad av bakterier, svamp eller virus.
Allvarliga och dödliga infektioner har förekommit med idelalisib, inklusive opportunistiska infektioner såsom Pneumocystis jirovecii-orsakad pneumoni (PJP) och cytomegalovirus (CMV). Profylax mot PJP ska därför ges till alla patienter under hela behandlingen med idelalisib och under en period på 2 till 6 månader efter behandlingsavbrott. Varaktighet av profylax efter behandling ska baseras på klinisk bedömning i vilken patientens riskfaktorer som t.ex. samtidig kortikosteroidbehandling och långvarig neutropeni kan tas med i beräkning (se avsnitt Biverkningar).
Patienterna ska kontrolleras för respiratoriska tecken och symtom under hela behandlingen. Patienterna ska uppmanas att rapportera nya respiratoriska symtom utan dröjsmål.
Regelbunden klinisk och laboratoriemässig övervakning för CMV‑infektion rekommenderas till patienter med positiv CMV‑serologi vid början av behandling med idelalisib eller med andra tecken på en tidigare CMV-infektion. Patienter med CMV‑viremi utan associerade kliniska tecken på CMV‑infektion ska övervakas noga. Hos patienter med tecken på CMV‑viremi och kliniska tecken på CMV‑infektion ska avbrott i behandling med idelalisib övervägas tills infektionen har gått tillbaka. Om fördelarna med att återuppta behandlingen bedöms överväga riskerna ska förebyggande CMV‑behandling övervägas.
Fall av progressiv multifokal leukoencefalopati (PML) har rapporterats efter användning av idelalisib vid föregående eller samtidiga immunsupprimerande behandlingar som har associerats med PML. Läkare bör överväga PML i differentialdiagnosen hos patienter med nya eller försämrade neurologiska, kognitiva eller beteendemässiga tecken eller symtom. Om PML misstänks bör lämpliga diagnostiska utvärderingar genomföras och behandlingen skjutas upp tills PML kan uteslutas. I tveksamma fall bör remittering till neurolog och lämpliga diagnostiska åtgärder för PML övervägas, inklusive magnetkameraundersökning, företrädesvis med kontrastmedel, undersökning av ryggmärgsvätska för påvisande av viralt JC DNA och upprepade neurologiska utvärderingar.
Neutropeni
Behandlingsrelaterad neutropeni av grad 3 eller 4, inklusive febril neutropeni, har förekommit hos patienter behandlade med idelalisib. Blodkroppsantal ska kontrolleras hos alla patienter minst varannan vecka under de första 6 behandlingsmånaderna med idelalisib och minst en gång i veckan hos patienter om ANC ligger under 1 000 per mm3 (se avsnitt Dosering och administreringssätt).
Levertoxicitet
Förhöjningar av ALAT och ASAT av grad 3 och 4 (> 5 x ULN) har observerats i kliniska studier av idelalisib. Det har också kommit rapporter om skada på leverceller inklusive leversvikt. Förhöjningar av levertransaminaser observerades vanligen inom de första 12 behandlingsveckorna, och var reversibla vid doseringsavbrott (se avsnitt Dosering och administreringssätt). Av de patienter som återupptog idealisib vid en lägre dos hade 26 % återfall av ALAT/ASAT-förhöjning. Uppehåll i behandling med Zydelig måste göras i händelse av grad 3 eller 4 ALAT/ASAT-förhöjning och leverfunktionen måste övervakas. Behandling kan återupptas vid en lägre dos så snart värdena har återgått till grad 1 eller lägre (ALAT/ASAT ≤ 3 x ULN).
ALAT, ASAT och totalt bilirubin måste kontrolleras hos alla patienter varannan vecka under de första 3 behandlingsmånaderna och därefter på klinisk indikation. Om förhöjningar av ALAT och/eller ASAT av grad 2 eller högre observeras, måste patienters ALAT, ASAT och totala bilirubin kontrolleras varje vecka till dess att värdena återgår till grad 1 eller lägre.
Diarré/kolit
Fall av allvarlig läkemedelsrelaterad kolit förekom relativt sent (månader) efter behandlingsstart, ibland med snabb försämring, men avklingade inom några veckor vid doseringsavbrott och insättande av symtomatisk behandling (t.ex. antiinflammatoriska läkemedel såsom enteroberedningar av budesonid).
Det finns mycket begränsad erfarenhet av behandling av patienter med en anamnes på inflammatorisk tarmsjukdom.
Pneumonit och organiserande pneumoni
Fall av pneumonit och organiserande pneumoni (vissa med dödlig utgång) har rapporterats med idelalisib. Hos patienter med allvarliga lunghändelser ska idelalisib avbrytas och patienten ska bedömas avseende en förklarande etiologi. Om antingen måttlig eller svår symtomatisk pneumonit eller organiserande pneumoni diagnostiseras ska lämplig behandling initieras och idelalisib måste avbrytas permanent.
Allvarliga hudreaktioner
Stevens-Johnsons syndrom (SJS), toxisk epidermal nekrolys (TEN) och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har inträffat med idelalisib. Fall av SJS och TEN med dödlig utgång har rapporterats när idelalisib administrerades samtidigt med andra läkemedel som förknippas med dessa syndrom. Vid misstanke om SJS, TEN eller DRESS ska behandling med idelalisib avbrytas och patienten ska bedömas och behandlas med avseende på detta. Om en diagnos av SJS, TEN eller DRESS har bekräftats ska behandling med idelalisib avbrytas permanent.
CYP3A-inducerare
Idelalisibexponeringen kan minska vid samtidig administrering av CYP3A-inducerare som rifampicin, fenytoin, johannesört (Hypericum perforatum) eller karbamazepin. Eftersom sänkt plasmakoncentration av idelalisib kan leda till minskad effekt, bör samtidig administrering av Zydelig och måttliga eller starka CYP3A-inducerare undvikas (se avsnitt Interaktioner).
CYP3A-substrat
Den primära metaboliten av idelalisib, GS-563117, är en stark CYP3A4-hämmare. Idelalisib har således potential att interagera med läkemedel som metaboliseras av CYP3A, vilket kan leda till ökade serumkoncentrationer av det andra läkemedlet (se avsnitt Interaktioner). När idelalisib administreras samtidigt med andra läkemedel, ska produktresumén för det andra läkemedlet läsas för rekommendationer om samtidig administrering med CYP3A4-hämmare. Samtidig behandling med CYP3A-substrat med allvarliga och/eller livshotande biverkningar (t.ex. alfuzosin, amiodaron, cisaprid, pimozid, kinidin, ergotamin, dihydroergotamin, quetiapin, lovastatin, simvastatin, sildenafil, midazolam, triazolam) bör undvikas och alternativa läkemedel som är mindre känsliga för CYP3A4-hämning om möjligt användas.
Nedsatt leverfunktion
Ökad övervakning av biverkningar rekommenderas hos patienter med nedsatt leverfunktion eftersom exponering förväntas öka hos den här populationen, framför allt hos patienter med gravt nedsatt leverfunktion. Inga patienter med gravt nedsatt leverfunktion ingick i kliniska studier av idelalisib. Försiktighet rekommenderas vid administrering av Zydelig till denna population.
Kronisk hepatit
Idelalisib har inte studerats på patienter med kronisk aktiv hepatit, däribland viral hepatit. Försiktighet ska iakttas vid administrering av Zydelig till patienter med aktiv hepatit.
Fertila kvinnor
Fertila kvinnor måste använda en mycket effektiv preventivmetod under behandling med idelalisib och under 1 månad efter avslutad behandling (se avsnitt Fertilitet, graviditet och amning). Kvinnor som använder hormonella preventivmedel ska även använda en barriärmetod som ett andra preventivmedel eftersom det i nuläget är okänt om idelalisib kan reducera effekten av hormonella preventivmedel.
Hjälpämnen
Zydelig innehåller azofärgämnet para-orange (E110), som kan orsaka allergiska reaktioner.
Interaktioner
Idelalisib metaboliseras huvudsakligen via aldehydoxidas och i mindre grad via CYP3A och glukuronidering (UGT1A4). Dess primära metabolit är GS-563117, som inte är farmakologiskt aktiv. Idelalisib och GS-563117 är substrat för P-gp och BCRP.
Andra läkemedels effekt på idelalisibs farmakokinetik
CYP3A-inducerare
En klinisk läkemedelsinteraktionsstudie fann att samtidig administrering av en enkeldos om 150 mg idelalisib och rifampicin (en stark CYP3A-inducerare) resulterade i att AUCinf för idelalisib minskade med ~75 %. Samtidig administrering av Zydelig och måttliga eller starka CYP3A-inducerare som rifampicin, fenytoin, johannesört och karbamazepin ska undvikas eftersom detta kan leda till minskad effekt (se Varningar och försiktighet).
CYP3A-/P-gp-hämmare
En klinisk läkemedelsinteraktionsstudie fann att samtidig administrering av en enkeldos om 400 mg idelalisib och 400 mg ketokonazol en gång dagligen (en stark CYP3A-, P-gp- och BCRP-hämmare) resulterade i att Cmax för idelalisib ökade med 26 % medan AUCinf ökade med 79 %. Ingen initial dosjustering av idelalisib anses vara nödvändig vid administrering med CYP3A-/P-gp-hämmare men en ökad övervakning av biverkningar rekommenderas.
Idelalisibs effekt på andra läkemedels farmakokinetik
CYP3A-substrat
Den primära metaboliten av idelalisib, GS-563117, är en stark CYP3A-hämmare. En klinisk läkemedelsinteraktionsstudie fann att samtidig administrering av idelalisib och midazolam (ett känsligt CYP3A-substrat) resulterade i att Cmax för midalozam ökade med ~140 % medan AUCinf ökade med ~440 % på grund av GS-563117:s hämning av CYP3A. Samtidig administrering av idelalisib och CYP3A-substrat kan öka deras systemiska exponering och öka eller förlänga deras terapeutiska aktivitet och biverkningar. In vitro var CYP3A4-hämningen irreversibel, och återgång till normal enzymaktivitet förväntas således ta flera dagar efter att administreringen av idelalisib har avbrutits.
Eventuella interaktioner mellan idelalisib och samtidigt administrerade läkemedel som är CYP3A-substrat anges i tabell 1 (ökning indikeras som ”↑”). Denna lista är inte fullständig och är endast avsedd som vägledning. I allmänhet ska produktresumén för det andra läkemedlet läsas för rekommendationer avseende samtidig administrering med CYP3A4-hämmare (se Varningar och försiktighet).
|
Läkemedel |
Idelalisibs förväntade effekt på läkemedelsnivån |
Klinisk rekommendation vid samtidig administrering med idelalisib |
|---|---|---|
|
ALFA-1-ADRENORECEPTORANTAGONISTER |
||
|
Alfuzosin |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med alfuzosin. |
|
ANALGETIKA |
||
|
Fentanyl, alfentanil, metadon, buprenorfin/naloxon |
↑ serumkoncentrationer |
Noggrann övervakning av biverkningar (t.ex. andningsdepression, sedering) rekommenderas. |
|
ANTIARYTMIKA |
||
|
Amiodaron, kinidin |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med amiodaron eller kinidin. |
|
Bepridil, disopyramid, lidokain |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas. |
|
CANCERLÄKEMEDEL |
||
|
Tyrosinkinashämmare, t.ex. dasatinib och nilotinib samt vinkristin och vinblastin |
↑ serumkoncentrationer |
Noggrann övervakning av toleransen för dessa cancerläkemedel rekommenderas. |
|
ANTIKOAGULANTIA |
||
|
Warfarin |
↑ serumkoncentrationer |
INR (international normalised ratio) bör övervakas vid samtidig administrering och efter avslutad behandling med idelalisib. |
|
ANTIEPILEPTIKA |
||
|
Karbamazepin |
↑ serumkoncentrationer |
Läkemedelsnivåer av antiepileptika ska övervakas. |
|
ANTIDEPRESSIVA |
||
|
Trazodon |
↑ serumkoncentrationer |
Noggrann dostitrering av antidepressiva och övervakning av antidepressivt svar rekommenderas. |
|
LÄKEMEDEL MOT GIKT |
||
|
Kolchicin |
↑ serumkoncentrationer |
Dosreduktioner av kolchicin kan krävas. Idelalisib bör inte administreras samtidigt med kolchicin till patienter med nedsatt njur- eller leverfunktion. |
|
ANTIHYPERTENSIVA |
||
|
Amlodipin, diltiazem, felodipin, nifedipin, nikardipin |
↑ serumkoncentrationer |
Klinisk övervakning av terapeutisk effekt och biverkningar rekommenderas. |
|
ANTIINFEKTIVA MEDEL |
||
|
Antimykotika |
||
|
Ketokonazol, itrakonazol, posakonazol, vorikonazol |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas. |
|
Antimykobakteriella medel |
||
|
Rifabutin |
↑ serumkoncentrationer |
Ökad övervakning av biverkningar som förknippas med rifabutin, t.ex. neutropeni och uveit, rekommenderas. |
|
HCV proteashämmare |
||
|
Boceprevir, telaprevir |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas. |
|
Makrolidantibiotika |
||
|
Klaritromycin, telitromycin |
↑ serumkoncentrationer |
Ingen dosjustering av klaritromycin krävs för patienter med normal njurfunktion eller lätt nedsatt njurfunktion (kreatininclearance [CrCl] 60 90 ml/min). Klinisk övervakning rekommenderas för patienter med CrCl < 90 ml/min. För patienter med CrCl < 60 ml/min, bör alternativa antibakteriella medel övervägas. Klinisk övervakning rekommenderas för telitromycin. |
|
ANTIPSYKOTIKA/NEUROLEPTIKA |
||
|
Quetiapin, pimozid |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med quetiapin eller pimozid. Alternativa läkemedel, som t.ex. olanzapin, kan övervägas. |
|
ENDOTELINRECEPTORANTAGONISTER |
||
|
Bosentan |
↑ serumkoncentrationer |
Försiktighet bör iakttas och patienterna övervakas noggrant för toxicitet som förknippas med bosentan. |
|
ERGOTALKALOIDER |
||
|
Ergotamin, dihydroergotamin |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med ergotamin eller dihydroergotamin. |
|
PREPARAT SOM STIMULERAR GASTROINTESTINAL MOTILITET |
||
|
Cisaprid |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med cisaprid. |
|
GLUKOKORTIKOIDER |
||
|
Inhalerade/nasala kortikosteroider: Budesonid, flutikason |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas. |
|
Oral budesonid |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas för ökade tecken/symtom på effekter av kortikosteroider. |
|
HMG CoA-REDUKTASHÄMMARE |
||
|
Lovastatin, simvastatin |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med lovastatin eller simvastatin. |
|
Atorvastatin |
↑ serumkoncentrationer |
Klinisk övervakning rekommenderas och en lägre startdos av atorvastatin kan övervägas. Alternativt kan byte till pravastatin, rosuvastatin eller pitavastatin övervägas. |
|
IMMUNSUPPRESSIVA MEDEL |
||
|
Ciklosporin, sirolimus, takrolimus |
↑ serumkoncentrationer |
Terapeutisk övervakning rekommenderas. |
|
INHALERAD BETAAGONIST |
||
|
Salmeterol |
↑ serumkoncentrationer |
Samtidig administrering av salmeterol och idelalisib rekommenderas inte. Kombinationen kan leda till en ökad risk för kardiovaskulära biverkningar som förknippas med salmeterol, t.ex. QT förlängning, palpitationer och sinustakykardi. |
|
FOSFODIESTERASHÄMMARE |
||
|
Sildenafil Tadalafil |
↑ serumkoncentrationer ↑ serumkoncentrationer |
Vid pulmonell arteriell hypertension: Idelalisib bör inte administreras samtidigt med sildenafil. Försiktighet bör iakttas inklusive övervägande av dosreduktion vid samtidig administrering av tadalafil och idelalisib. |
|
Sildenafil, tadalafil |
↑ serumkoncentrationer |
Vid erektil dysfunktion: Särskild försiktighet måste iakttas och dosreduktion kan övervägas vid förskrivning av sildenafil eller tadalafil och idelalisib med ökad övervakning av biverkningar. |
|
SEDATIVA/HYPNOTIKA |
||
|
Midazolam (oralt), triazolam |
↑ serumkoncentrationer |
Idelalisib bör inte administreras samtidigt med midazolam (oralt) eller triazolam. |
|
Buspiron, klorazepat, diazepam, estazolam, flurazepam, zolpidem |
↑ serumkoncentrationer |
Övervakning av koncentrationer av sedativa/hypnotika rekommenderas och dosreduktion kan övervägas. |
CYP2C8-substrat
In vitro både hämmade och inducerade idelalisib CYP2C8, men det är inte känt om detta kan omvandlas till en in vivo-effekt för CYP2C8-substrat. Försiktighet rekommenderas om Zydelig används tillsammans med läkemedel med smalt terapeutiskt index som är substrat för CYP2C8 (paklitaxel).
Substrat för inducerbara enzymer (t.ex. CYP2C9, CYP2C19, CYP2B6 och UGT)
In vitro var idelalisib en inducerare av flera enzymer, och en risk för minskad exponering och därmed minskad effekt av substrat för inducerbara enzymer som CYP2C9, CYP2C19, CYP2B6 och UGT kan inte uteslutas. Försiktighet rekommenderas om Zydelig används tillsammans med läkemedel med smalt terapeutiskt index som är substrat för dessa enzymer (warfarin, fenytoin, S-mefenytoin).
BCRP, OATP1B1, OATP1B3 och P-gp-substrat
Samtidig administrering av flera doser av idelalisib 150 mg två gånger dagligen till friska frivilliga ledde till jämförbara exponeringar för rosuvastatin (AUC 90 % CI: 87; 121) och digoxin (AUC 90 % KI: 98; 111), tyder inte på någon kliniskt relevant hämning av BCRP, OATP1B1/1B3 eller systemiskt P-gp av idelalisib. En risk för P-gp-hämning i magtarmkanalen som kan leda till ökad exponering av substrat känsliga för intestinalt P-gp, t.ex. dabigatranetexilat, kan inte uteslutas.
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Fertila kvinnor
Baserat på fynd på djur kan idelalisib orsaka fosterskada. Kvinnor ska undvika att bli gravida under behandling med Zydelig och upp till 1 månad efter avslutad behandling. Fertila kvinnor måste således använda en mycket effektiv preventivmetod under behandling med Zydelig och under 1 månad efter avslutad behandling. Det är i nuläget okänt om idelalisib kan reducera effekten av hormonella preventivmedel och därför ska kvinnor som använder hormonella preventivmedel även använda en barriärmetod som ett andra preventivmedel.
Graviditet
Det finns inga eller begränsad mängd data från användningen av idelalisib i gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se Preklinik).
Zydelig rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel.
Amning
Det är okänt om idelalisib och dess metaboliter utsöndras i bröstmjölk.
En risk för det nyfödda barnet/spädbarnet kan inte uteslutas.
Amning ska avbrytas under behandling med Zydelig.
Fertilitet
Inga humandata om effekten av idelalisib på fertilitet finns tillgängliga. Djurstudier antyder potential för skadliga effekter av idelalisib på fertilitet och fosterutveckling (se Prekliniska uppgifter).
Amning
Det är okänt om idelalisib och dess metaboliter utsöndras i bröstmjölk.
En risk för det nyfödda barnet/spädbarnet kan inte uteslutas.
Amning ska avbrytas under behandling med Zydelig.
Fertilitet
Inga humandata om effekten av idelalisib på fertilitet finns tillgängliga. Djurstudier antyder potential för skadliga effekter av idelalisib på fertilitet och fosterutveckling (se avsnitt Prekliniska uppgifter).
Trafik
Zydelig har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Bedömning av biverkningar bygger på två fas 3‑studier (studie 312‑0116 och studie 312‑0119) och sex fas 1- och fas 2‑studier. Studie 312‑0116 var en randomiserad, dubbelblind, placebokontrollerad studie i vilken 110 patienter med tidigare behandlad KLL fick idelalisib + rituximab. Dessutom gick 86 patienter från den studien, som randomiserades till att få placebo + rituximab, vidare till att få idelalisib som enda läkemedel i en förlängningsstudie (studie 312‑0117). Studie 312‑0119 var en randomiserad, kontrollerad öppen studie i vilken 173 patienter med tidigare behandlad KLL fick idelalisib + ofatumumab. Fas 1‑ och fas 2‑studierna bedömde säkerheten för idelalisib hos totalt 536 patienter med hematologiska maligniteter, varav 400 patienter fick idelalisib (alla doser) som enda läkemedel och 136 patienter fick idelalisib i kombination med en monoklonal antikropp mot CD20 (rituximab eller ofatumumab).
Biverkningar i tabellform
De biverkningar som rapporterades med idelalisib ensamt eller i kombination med monoklonala antikroppar mot CD20 (rituximab eller ofatumumab) anges i tabell 2. Biverkningarna listas efter organsystemklass, rapporterad biverkning och frekvens. Frekvenserna definieras enligt följande: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Reaktion |
Alla grader |
Grad ≥ 3 |
|---|---|---|
|
*Bestående av såväl opportunistiska infektioner som bakteriella och virala infektioner såsom pneumoni, bronkit och sepsis. **Idelalisib-inducerad lymfocytos bör inte betraktas som progressiv sjukdom i frånvaro av andra kliniska fynd (se avsnitt Farmakodynamiska egenskaper). ***Inkluderar de rapporterade biverkningarna generaliserad exfoliativ dermatit, läkemedelsutslag, hudutslag, erytematöst hudutslag, generaliserat hudutslag, makulöst utslag, makulopapulöst hudutslag, papulöst hudutslag, pruritiskt hudutslag, pustulöst utslag, vesikulärt utslag, papula, hudplack och exfoliativt hudutslag. ****Observerat efter godkännande för försäljning. |
||
|
Infektioner och infestationer |
||
|
Infektioner (inkluderande Pneumocystis jirovecii-orsakad pneumoni och CMV)* |
Mycket vanliga |
Mycket vanliga |
|
Blodet och lymfsystemet |
||
|
Neutropeni |
Mycket vanliga |
Mycket vanliga |
|
Lymfocytos** |
Mycket vanliga |
Mycket vanliga |
|
Andningsvägar, bröstkorg och mediastinum |
||
|
Pneumonit |
Vanliga |
Vanliga |
|
Organiserande pneumoni**** |
Mindre vanliga |
Mindre vanliga |
|
Magtarmkanalen |
||
|
Diarré/kolit |
Mycket vanliga |
Mycket vanliga |
|
Lever och gallvägar |
||
|
Förhöjda transaminaser |
Mycket vanliga |
Mycket vanliga |
|
Skada på leverceller |
Vanliga |
Vanliga |
|
Hud och subkutan vävnad |
||
|
Hudutslag*** |
Mycket vanliga |
Vanliga |
|
Stevens‑Johnsons syndrom/ toxisk epidermal nekrolys**** |
Sällsynta |
Sällsynta |
|
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)**** |
Ingen känd frekvens |
Ingen känd frekvens |
|
Allmänna symtom och/eller symtom vid administreringsstället |
||
|
Feber |
Mycket vanliga |
Vanliga |
|
Undersökningar |
||
|
Förhöjda triglycerider |
Mycket vanliga |
Vanliga |
Beskrivning av valda biverkningar
Infektioner (se avsnitt Varningar och försiktighet)
I kliniska studier av idelalisib observerades högre frekvenser av infektioner totalt, inkluderande infektioner av grad 3 och 4, i idelalisibarmen jämfört med kontrollarmen. Vanligast observerade var infektioner i andningsvägarna och septiska händelser. I många fall identifierades inte någon patogen men både konventionella och opportunistiska patogener, inkluderande PJP och CMV, var bland dem som identifierades. Nästan alla PJP-infektioner, inkluderande dödliga fall, inträffade i frånvaro av PJP‑profylax. Fall av PJP har förekommit efter att behandling med idelalisib avbrutits.
Hudutslag
Hudutslag var vanligen lindriga till måttliga och ledde till behandlingsavbrott hos cirka 2,1 % av patienterna. I studierna 312‑0116/0117 och 312‑0119 förekom hudutslag (rapporterat som generaliserad exfoliativ dermatit, läkemedelsutslag, hudutslag, erytematöst hudutslag, generaliserat hudutslag, makulöst utslag, makulopapulöst hudutslag, papulöst hudutslag, pruritiskt hudutslag, pustulöst utslag, vesikulära utslag, papula och hudplack) hos 31,1 % av patienterna som fick idelalisib + en monoklonal antikropp mot CD20 (rituximab eller ofatumumab) och 8,2 % som fick enbart en monoklonal antikropp mot CD20 (rituximab eller ofatumumab). Av dessa hade 5,7 % som fick idelalisib + en monoklonal antikropp mot CD20 (rituximab eller ofatumumab) och 1,5 % som fick enbart en monoklonal antikropp mot CD20 (rituximab eller ofatumumab) hudutslag av grad 3. Inga patienter hade en biverkning av grad 4. Hudutslag klingade vanligen av med behandling (t.ex. topiska och/eller perorala steroider, difenhydramin) och doseringsavbrott vid svåra fall (se avsnitt biverkningar).
Allvarliga hudreaktioner (se avsnitt Varningar och försiktighet)
Fall av SJS, TEN och DRESS har uppkommit när idelalisib administrerades samtidigt med andra läkemedel som förknippas med dessa syndrom (bendamustin, rituximab, allopurinol, amoxicillin och sulfametoxazol/trimetoprim). SJS eller TEN uppkom inom en månads behandling med läkemedelskombinationen och har haft dödlig utgång.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
I händelse av överdosering måste patienten övervakas för tecken på toxicitet (se Biverkningar). Behandling av överdosering med Zydelig består av allmänna understödjande åtgärder inklusive övervakning av vitala tecken liksom observation av patientens kliniska status.
Farmakodynamik
Verkningsmekanism
Idelalisib hämmar fosfatidylinositol-3-kinas p110δ (PI3Kδ), som är hyperaktivt vid B-cellsmaligniteter och som är viktigt för flera signalvägar som reglerar proliferation, överlevnad, homing och retention av maligna celler i lymfatisk vävnad och benmärg. Idelalisib hämmar selektivt bindning av adenosin-5´-trifosfat (ATP) till den katalytiska domänen av PI3Kδ, vilket leder till att fosforyleringen av fosfatidylinositol, en viktig lipid sekundär budbärare, hämmas och att fosforylering av Akt (proteinkinas B) förhindras.
Idelalisib inducerar apoptos och hämmar proliferation i cellinjer som härstammar från maligna B-celler och i primärtumörceller. Genom att hämma signalering via kemokinreceptorerna CXCR4 och CXCR5, som induceras av kemokinerna CXCL12 respektive CXCL13, hämmar idelalisib homing och retention av maligna B-celler i tumörens mikromiljö inklusive lymfatisk vävnad och benmärg.
Farmakodynamisk effekt
Elektrokardiografisk
Effekten av idelalisib (150 mg och 400 mg) på QT-/QTc-intervallet utvärderades i en placebokontrollerad och positivt kontrollerad (moxifloxacin 400 mg) crossover-studie på 40 friska frivilliga. Vid en dos som var 2,7 gånger den maximala rekommenderade dosen förlängde idelalisib inte QT-/QTc-intervallet (dvs. < 10 ms).
Lymfocytos
Vid insättning av idelalisib har en tillfällig ökning av lymfocyttalen (dvs. ≥ 50 % ökning från baslinjen och över det absoluta lymfocyttalet på 5 000/mikroliter) observerats. Detta uppkom hos cirka två tredjedelar av patienterna med KLL som behandlades med idelalisib som monoterapi och hos en fjärdedel av patienterna med KLL som behandlades med idelalisib som kombinationsbehandling. Debuten av isolerad lymfocytos uppkommer oftast under de första 2 veckorna med idelalisib-behandling och är ofta associerad med reduktion av lymfadenopati. Denna observerade lymfocytos är en farmakodynamisk effekt och bör inte betraktas som progressiv sjukdom i frånvaro av andra kliniska fynd.
Inga mekanistiska förklaringar har identifierats i kliniska studier för utvecklingen av resistens mot behandling med idelalisib. Ytterligare undersökning av detta ämne i aktuella studier av B‑cellsmalignitet har inte planerats.
Klinisk effekt vid kronisk lymfatisk leukemi
Idelalisib i kombination med rituximab
Studie 312-0116 var en randomiserad, dubbelblind, placebokontrollerad studie i fas 3 på 220 patienter med tidigare behandlad KLL som behövde behandling men som inte ansågs vara lämpliga för cytotoxisk kemoterapi. Patienterna randomiserades i förhållandet 1:1 till att få 8 cykler av rituximab (första cykeln vid 375 mg/m2 kroppsyta [BSA], efterföljande cykler vid 500 mg/m2 BSA) i kombination med antingen en oral placebo två gånger dagligen eller med idelalisib 150 mg två gånger dagligen fram till sjukdomsprogression eller oacceptabel toxicitet.
Medianåldern var 71 år (intervall: 47 till 92) och 78,2 % av patienterna var över 65 år; 65,5 % var män och 90,0 % var kaukasier; 64,1 % hade Rai-stadium III eller IV och 55,9 % hade Binet-stadium C. De flesta patienterna hade negativa cytogenetiska prognostiska faktorer. 43,2 % hade deletion av kromosom 17p och/eller mutation i tumörprotein 53 (TP53) och 83,6 % hade omuterade gener för den variabla delen av immunglobulinets tunga kedja (IGHV). Mediantiden från diagnos av KLL till randomisering var 8,5 år. Patienterna hade en Cumulative Illness Ratio Scale-(CIRS)-medianpoäng på 8. Medianantalet för tidigare behandlingar var 3,0. Nästan alla (95,9 %) patienter hade tidigare fått monoklonala antikroppar mot CD20. Det primära effektmåttet var progressionsfri överlevnad (progression free survival, PFS). Effektresultat sammanfattas i tabell 3 och 4. Kaplan-Meier-kurvan för PFS återfinns i figur 1.
Jämfört med rituximab + placebo gav behandling med idelalisib + rituximab statistiskt signifikanta och kliniskt meningsfulla förbättringar av fysiskt välbefinnande, socialt välbefinnande, funktionellt välbefinnande liksom av de leukemispecifika subskalorna i instrumentet Functional Assessment of Cancer Therapy: Leukaemia (FACT-LEU), och statistiskt signifikanta och kliniskt meningsfulla förbättringar av ångest, depression och vanliga aktiviteter mätt med instrumentet EuroQoL Five-Dimensions (EQ-5D).
|
Idelalisib + R |
Placebo + R |
||
|---|---|---|---|
|
|
|
N = 110 |
N = 110 |
|
KI: konfidensintervall, R: rituximab; n: antal svarande patienter, N: antal patienter per grupp, NR: ej uppnått. |
|||
|
Analyserna av PFS, total svarsfrekvens (overall response rate, ORR) och frekvens av lymfkörtelsvar (lymph node response rate, LNR) baserades på utvärdering av en oberoende granskningskommitté (IRC). |
|||
|
* ORR definierades som andelen patienter som uppnådde ett komplett svar (complete response, CR) eller partiellt svar (partial response, PR) baserat på 2013 års NCCN-kriterier (National Comprehensive Cancer Network) och Cheson (2012). |
|||
|
** LNR definierades som andelen patienter som uppnådde en ≥ 50 % minskning av summan av produkterna för de största vinkelräta diametrarna (SPD) på indexlesioner. Endast patienter som hade bedömningar både vid baslinjen och ≥ 1 utvärderbar bedömning efter baslinjen inkluderades i denna analys. |
|||
|
^ Analys av total överlevnad (overall survival, OS) omfattar data från patienter som fått placebo + R i studie 312-0116 och därefter fått idelalisib i en förlängningsstudie, baserat på intent-to-treat-analys. |
|||
|
PFS |
Median (månader) (95 % KI) |
19,4 (12,3; NR) |
6,5 (4,0; 7,3) |
|
Riskkvot (95 % KI) |
0,15 (0,09; 0,24) |
||
|
P-värde |
< 0,0001 |
||
|
ORR* |
n (%) (95 % KI) |
92 (83,6 %) (75,4; 90,0) |
17 (15,5 %) (9,3; 23,6) |
|
Oddskvot (95 % KI) |
27,76 (13,40; 57,49) |
||
|
P-värde |
< 0,0001 |
||
|
LNR** |
n/N (%) (95 % KI) |
102/106 (96,2 %) (90,6; 99,0) |
7/104 (6,7 %) (2,7; 13,4) |
|
Oddskvot (95 % KI) |
225,83 (65,56; 777,94) |
||
|
P-värde |
< 0,0001 |
||
|
OS^ |
Median (månader) (95 % KI) |
NR (NR; NR) |
20,8 (14,8; NR) |
|
Riskkvot (95 % KI) |
0,34 (0,19; 0,60) |
||
|
P-värde |
0,0001 |
||
|
Idelalisib + R |
Placebo + R |
|
|---|---|---|
|
KI: konfidensintervall, R: rituximab; N: antal patienter per grupp, NR: ej uppnått |
||
|
17p deletion/TP53-mutation |
N = 46 |
N = 49 |
|
PFS median (månader) (95 % KI) |
NR (12,3; NR) |
4,0 (3,7; 5,7) |
|
Riskkvot (95 % KI) |
0,13 (0,07; 0,27) |
|
|
ORR (95 % KI) |
84,8% (71,1; 93,7) |
12,2 % (4,6; 24,8) |
|
Omuterad IGHV |
N = 91 |
N = 93 |
|
PFS median (månader) (95 % KI) |
19,4 (13,9, NR) |
5,6 (4,0; 7,2) |
|
Riskkvot (95 % KI) |
0,14 (0,08; 0,23) |
|
|
ORR (95 % KI) |
82,4 % (73,0; 89,6) |
15,1 % (8,5; 24,0) |
|
Ålder ≥ 65 år |
N = 89 |
N = 83 |
|
PFS median (månader) (95 % KI) |
19,4(12,3; NR) |
5,7 (4,0; 7,3) |
|
Riskkvot (95 % KI) |
0,14 (0,08; 0,25) |
|
|
ORR (95 % KI) |
84,3 % (75,0; 91,1) |
16,9 % (9,5; 26,7) |
Figur 1: Kaplan-Meier-kurva för PFS från studie 312-0116 (intent-to-treat-population)
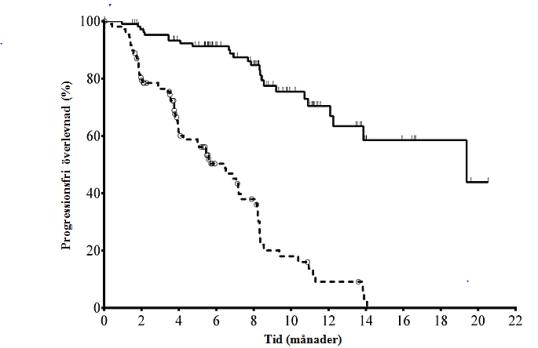
N med risk (händelser)
Idelalisib + R 110 (0) 101 (3) 93 (7) 73 (9) 59 (14) 31 (19) 20 (21) 9 (24) 7 (24) 4 (24) 1 (25) 0 (25)
Placebo + R 110 (0) 84 (21) 48 (38) 29 (46) 20 (53) 9 (63) 4 (67) 1 (69) 0 (70) 0 (70) 0 (70) 0 (70)
Heldragen linje: idelalisib + R (N = 110), streckad linje: placebo + R (N = 110)
R: rituximab; N: antal patienter per grupp
Analysen av PFS baserades på utvärdering av en IRC. För patienter i gruppen med placebo + R inkluderar sammanfattningen data fram till den första doseringen av idelalisib i en förlängningsstudie.
Studie 101‑08/99 rekryterade 64 patienter med tidigare obehandlad KLL, inklusive 5 patienter med småcelligt lymfocytärt lymfom (SLL). Patienterna fick idelalisib 150 mg två gånger dagligen och rituximab 375 mg/m2 BSA per vecka för 8 doser. ORR var 96,9 % varav 12 CR (18,8 %) och 50 PR (78,1 %), inklusive 3 CR och 6 PR hos patienter med 17p‑deletion och/eller TP53‑mutation och 2 CR och 34 PR hos patienter med omuterad IGHV. Medianduration för svar (duration of response, ‑DOR) har inte uppnåtts.
Idelalisib i kombination med ofatumumab
Studie 312‑0119 var en randomiserad, öppen multicenterstudie i fas 3, med parallella grupper på 261 patienter med tidigare behandlad KLL som hade mätbar lymfadenopati, behövde behandling och som drabbades av KLL-progression < 24 månader efter avslut av den senaste tidigare behandlingen. Patienterna randomiserades 2:1 till att få idelalisib 150 mg två gånger dagligen och 12 infusioner av ofatumumab över 24 veckor eller enbart 12 infusioner av ofatumumab över 24 veckor. Den första infusionen av ofatumumab administrerades med dosen 300 mg och gavs fortsättningsvis med en dos på antingen 1 000 mg i gruppen som fick idelalisib + ofatumumab eller med en dos på 2 000 mg i gruppen som enbart fick ofatumumab, en gång i veckan för 7 doser och därefter var 4:e vecka för 4 doser. Idelalisib togs fram till sjukdomsprogression eller oacceptabel toxicitet.
Medianåldern var 68 år (intervall: 61 till 74) och 64,0 % av patienterna var över 65 år; 71,3 % var män och 84,3 % var kaukasier; 63,6 % hade Rai‑stadium III eller IV och 58,2 % hade Binet‑stadium C. De flesta patienterna hade negativa cytogenetiska prognostiska faktorer: 39,5 % hade deletion av kromosom 17p och/eller TP53‑mutation, och 78,5 % hade omuterade gener för den variabla delen av IGHV. Mediantiden sedan diagnos var 7,7 år. Patienterna hade en CIRS‑median på 4. Medianantalet för tidigare behandlingar var 3,0. Det primära effektmåttet var PFS. Effektresultat sammanfattas i tabell 5 och 6. Kaplan‑Meier‑kurvan för PFS återfinns i figur 2.
Tabell 5: Effektresultat från studie 312‑0119
|
|
Idelalisib + ON = 174 |
OfatumumabN = 87 |
||||
|
PFS Median (månader) (95 % KI) |
16,3 (13,6; 17.8) |
8,0 (5,7; 8,2) |
||||
|
Riskkvot (95 % KI) |
0,27 (0,19; 0,39) |
|||||
|
P‑värde |
< 0,0001 |
|||||
|
ORR* n (%) (95 % KI) |
131 (75,3 %) (68,2; 81,5) |
16 (18,4 %) (10,9; 28,1) |
||||
|
Oddskvot (95 % KI) |
15,94 (7,8; 32,58) |
|||||
|
P‑värde |
< 0,0001 |
|||||
|
LNR** n/N (%) (95 % KI) |
153/164 (93,3 %) (88,3; 96,6) |
4/81 (4,9 %) (1,4; 12,2) |
||||
|
Oddskvot (95 % KI) |
486,96 (97,91; 2 424,85) |
|||||
|
P‑värde |
< 0,0001 |
|||||
|
OS Median (månader) (95 % KI) |
20,9 (20,9; NR) |
19,4 (16,9; NR) |
||||
|
Riskkvot (95 % KI) |
0,74 (0,44; 1,25) |
|||||
|
P‑värde |
0,27 |
|||||
KI: konfidensintervall; O: ofatumumab; n: antal svarande patienter; N: antal patienter per grupp, NR: ej uppnått. Analyserna av PFS, total svarsfrekvens (overall response rate, ORR) och frekvens av lymfkörtelsvar (lymph node response rate, LNR) baserades på utvärdering av en oberoende granskningskommitté (IRC).
* ORR definierades som andelen patienter som uppnådde ett komplett svar (complete response, CR) eller partiellt svar (partial response, PR) och som bibehöll sitt svar i minst 8 veckor.
** LNR definierades som andelen patienter som uppnådde en ≥ 50 % minskning av summan av produkterna för de största vinkelräta diametrarna på indexlesioner. Endast patienter som hade bedömningar både vid baslinjen och ≥ 1 utvärderbar bedömning efter baslinjen inkluderades i denna analys.
Tabell 6: Sammanfattning av PFS och svarsfrekvenser i förspecificerade subgrupper från studie 312‑0119
|
|
Idelalisib + O |
Ofatumumab |
|||||
|
17p deletion/TP53‑mutation |
N = 70 |
N = 33 |
|||||
|
PFS median (månader) (95 % KI) |
13,7 (11,0; 17,8) |
5,8 (4,5; 8,4) |
|||||
|
Riskkvot (95 % KI) |
0,32 (0,18; 0,57) |
||||||
|
ORR (95 % KI) |
72,9 % (60,9; 82,8) |
15,2 % (5,1; 31,9) |
|||||
|
Omuterad IGHV |
N = 137 |
N = 68 |
|||||
|
PFS median (månader) (95 % KI) |
14,9 (12,4; 17,8) |
7,3 (5,3; 8,1) |
|||||
|
Riskkvot (95 % KI) |
0,25 (0,17; 0,38) |
||||||
|
ORR (95 % KI) |
74,5 % (66,3; 81,5) |
13,2 % (6,2; 23,6) |
|||||
|
Ålder ≥ 65 år |
N = 107 |
N = 60 |
|||||
|
PFS median (månader) (95 % KI) |
16,4 (13,4; 17,8) |
8,0 (5,6; 8,4) |
|||||
|
Riskkvot (95 % KI) |
0,30 (0,19; 0,47) |
||||||
|
ORR (95 % KI) |
72,0 % (62,5; 80,2) |
18,3 % (9,5; 30,4) |
|||||
KI: konfidensintervall; O: ofatumumab; N: antal patienter per grupp
Figur 2: Kaplan‑Meier‑kurva för PFS från studie 312‑0119 (intent‑to‑treat‑population)
N med risk (händelser)
Idelalisib + 0 174 (0) 162 (6) 151 (13) 140 (22) 129 (31) 110 (45) 82 (57) 44 (67) 37 (70) 7 (76) 1 (76) 0 (76)
Ofatumumab 87 (0) 60 (14) 47 (21) 34 (30) 26 (34) 11 (49) 8 (51) 6 (52) 6 (52) 2 (54) 0 (54) 0 (54)
Heldragen linje: idelalisib + O (N = 174), streckad linje: Ofatumumab (N = 87)
O: ofatumumab; N: antal patienter per grupp
Klinisk effekt vid follikulärt lymfom
Säkerheten och effekten för idelalisib bedömdes i en enkelarmad, klinisk multicenterstudie (studie 101-09) utförd på 125 patienter med indolent B-cells non-Hodgkins lymfom (iNHL, inkluderande: FL, n = 72; SLL, n = 28; lymfoplasmacytärt lymfom/Waldenströms makroglobulinemi [LPL/WM], n = 10; och marginalzonslymfom [MZL], n = 15). Samtliga patienter var refraktära mot rituximab och 124 av 125 patienter var refraktära mot minst ett alkylerande medel. Etthundratolv (89,6 %) patienter var refraktära mot den senaste regimen före registrering i studien.
Av de 125 rekryterade patienterna var 80 (64 %) män, medianåldern var 64 år (intervall: 33 till 87) och 110 (89 %) var kaukasier. Patienterna fick 150 mg idelalisib oralt två gånger dagligen fram till tecken på sjukdomsprogression eller tecken på oacceptabel toxicitet.
Primärt effektmått var ORR definierat som andelen patienter som uppnådde ett CR eller PR (baserat på Revised Response Criteria for Malignant Lymphoma [Cheson]) och för patienter med Waldenströms makroglobulinemi ett mindre svar (MR) (baserat på Response Assessment for Waldenström Macroglobulinaemia [Owen]). DOR var ett sekundärt effektmått och definierades som tiden från det första dokumenterade svaret (CR, PR eller MR) till den första dokumentationen av sjukdomsprogression eller död av någon orsak. Effektresultaten sammanfattas i tabell 7.
Tabell 7: Sammanfattning av effekten i Studie 101-09 (IRC:s bedömning)
|
Karakteristika |
Total iNHL-kohort (N = 125) n (%) |
FL-subgrupp (N = 72) n (%) |
|
|
ORR * 95 % KI Svarskategori* CR PR |
72 (57,6 %) 48,4 – 66,4 13 (10,4 %) 58 (46,4 %) |
40 (55,6 %) 43,4 – 67,3 12 (16,7 %) 28 (38,9 %) |
|
|
DOR (månader) median (95 % KI) |
12,5 (7,4; 22,4) |
11,8 (6,2; 26,9) |
|
|
PFS (månader) median (95 % KI) |
11,1 (8,3; 14,0) |
11,0 (8,0; 14,0) |
|
|
OS (månader) median (95 % KI) |
48,6 (33,9; 71,7) |
61,2 (38,1; NR) |
|
KI: konfidensintervall; n: antal svarande patienter
NR: Ej uppnådd
* Svar fastställdes av en oberoende granskningskommitté (IRC) där ORR = komplett svar (CR) + partiellt svar (PR) + mindre svar (MR) hos patienter med WM.
I den totala iNHL-kohorten hade 1 patient (0,6 %) med WM det bästa totala MR-svaret.
Median‑DOR för samtliga patienter var 12,5 månader (12,5 månader för patienter med SLL och 11,8 månader för patienter med FL, 20,4 månader för patienter med LPL/WM och 18,4 månader för patienter med MZL). Av de 122 patienterna med mätbara lymfkörtlar både vid baslinjen och efter baslinjen uppnådde 71 patienter (58,2 %) en ≥ 50 % minskning av summan av produkterna av diametrarna (SPD) på indexlesioner jämfört med baslinjen. Av de 53 patienter som inte svarade hade 41 (32,8 %) stabil sjukdom, 10 (8,0 %) hade progressiv sjukdom och 2 (1,6 %) kunde inte utvärderas. Medianvärdet för OS, inklusive långtidsuppföljning för alla 125 patienter, var 48,6 månader. Medianvärdet för OS, inklusive långtidsuppföljning, för alla patienter med FL, var 61,2 månader.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för idelalisib för alla grupper av den pediatriska populationen vid behandling av mogna B-cellsneoplasier (information om pediatrisk användning finns i Dosering).
Farmakokinetik
Absorption
Efter oral administrering av en enkeldos idelalisib observerades maximala plasmakoncentrationer 2 till 4 timmar efter dosering postprandialt och efter 0,5 till 1,5 timmar efter dosering i fasta.
Efter administrering av 150 mg idelalisib två gånger dagligen var genomsnittet (intervall) för Cmax och AUC vid steady-state 1 953 (272; 3 905) ng/ml och 10 439 (2 349; 29 315) ng•h/ml för idelalisib respektive 4 039 (669; 10 897) ng/ml och 39 744 (6 002; 119 770) ng•h/ml för GS-563117. Plasmaexponeringen (Cmax och AUC) för idelalisib är ungefär dosproportionell mellan 50 mg och 100 mg och mindre än dosproportionell över 100 mg.
Effekt av föda
I förhållande till fasta resulterade administrering av en tidig kapselformulering av idelalisib med en fettrik måltid inte i någon förändring av Cmax men en ökning av medel-AUCinf på 36 %. Idelalisib kan administreras med eller utan föda.
Distribution
Idelalisib är till 93-94 % bundet till humana plasmaproteiner vid kliniskt observerade koncentrationer. Den genomsnittliga koncentrationskvoten blod/plasma var cirka 0,5. Den synbara distributionsvolymen för idelalisib (medelvärde) var cirka 96 l.
Metabolism
Idelalisib metaboliseras huvudsakligen via aldehydoxidas och i mindre grad via CYP3A och UGT1A4. Den primära och enda cirkulerande metaboliten, GS-536116, är inaktiv mot PI3Kδ.
Eliminering
Idelalisibs terminala halveringstid i elimineringsfasen var 8,2 (intervall: 1,9; 37,2) timmar och synbar clearance för idelalisib var 14,9 (intervall: 5,1; 63,8) l/h efter oral administrering av 150 mg idelalisib två gånger dagligen. Efter en oral enkeldos av 150 mg av [14C]-märkt idelalisib utsöndrades cirka 78 % och 15 % i feces respektive urin. Oförändrat idelalisib stod för 23 % av den totala radioaktivitet som återvanns i urin över 48 timmar och 12 % av den totala radioaktivitet som återvanns i feces över 144 timmar.
Interaktionsdata in vitro
In vitro-data indikerar att idelalisib inte är en hämmare av de metaboliserande enzymerna CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP3A eller UGT1A1 eller transportörerna OAT1, OAT3 eller OCT2.
GS-563117 är inte en hämmare av de metaboliserande enzymerna CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 eller UGT1A1 eller transportörerna P-gp, BCRP, OAPT1B1, OATP1B3, OAT1, OAT3 eller OCT2.
Särskilda populationer
Kön och etnicitet
Populationsfarmakokinetiska analyser tyder på att kön och etnicitet inte har någon kliniskt relevant effekt på exponeringen för idelalisib eller GS-563117.
Äldre
Populationsfarmakokinetiska analyser tyder på att ålder inte har någon kliniskt relevant effekt på exponeringen för idelalisib eller GS-563117, inklusive hos äldre patienter (65 år och äldre) jämfört med yngre patienter.
Nedsatt njurfunktion
En studie av farmakokinetik och säkerhet för idelalisib gjordes på friska frivilliga och patienter med gravt nedsatt njurfunktion (beräknad CrCl 15 till 29 ml/min). Efter en enkeldos av 150 mg observerades inga kliniskt relevanta förändringar i exponeringen för idelalisib eller GS-563117 hos patienter med gravt nedsatt njurfunktion jämfört med friska frivilliga.
Nedsatt leverfunktion
En studie av farmakokinetik och säkerhet för idelalisib gjordes på friska frivilliga och patienter med måttligt (Child-Pugh klass B) eller gravt (Child-Pugh klass C) nedsatt leverfunktion. Efter en enkeldos av 150 mg var AUC (totalt, dvs. bundet plus obundet) för idelalisib ~60 % högre vid måttlig och grav nedsättning jämfört med matchade kontroller. Efter beräkning av skillnader i proteinbindning var AUC för idelalisib (obundet) ~80 % (1,8 gånger) högre vid måttligt nedsatt leverfunktion och ~152 % (2,5 gånger) högre vid gravt nedsatt leverfunktion jämfört med matchande kontroller.
Pediatrisk population
Farmakokinetiken för idelalisib hos pediatriska patienter har inte fastställts (se Dosering).
Prekliniska uppgifter
Toxicitet vid upprepad dosering
Idelalisib framkallade förlust av lymfoid vävnad i mjälten, tymus, lymfkörtlar och tarmassocierad lymfvävnad. Generellt påverkades B-lymfocytberoende områden mer än T-lymfocytberoende områden. Hos råtta har idelalisib potentialen att hämma T-beroende antikroppssvar. Idelalisib hämmade emellertid inte det normala värdsvaret på Staphylococcus aureus och förvärrade inte cyklofosfamids benmärgshämmande effekt. Idelalisib anses inte ha en bred immunhämmande aktivitet.
Idelalisib framkallade inflammatoriska förändringar hos både råtta och hund. I studier upp till 4 veckor på råtta och hund observerades levernekros vid 7 respektive 5gånger exponeringen hos människa baserat på AUC. Förhöjningar av serumtransaminas korrelerade med levernekros hos hund men observerades inte hos råtta. Ingen nedsatt leverfunktion och inga kroniska förhöjningar av transaminaser observerades hos råtta eller hund i studier som pågick i 13 veckor och längre.
Gentoxicitet
Idelalisib inducerade inte mutationer i mikrobiell mutagenesanalys (Ames), var inte klastogent i in vitro-analys av kromosomavvikelser med användning av humana lymfocyter från perifert blod, och var inte gentoxiskt i in vivo-mikrokärntest på råtta.
Karcinogenicitet
Karcinogen potential för idealisib utvärderades i en 26 veckor lång studie på transgena RasH2-möss och en 2-årig studie på råttor. Idealisib var inte karcinogent vid upp till 1,4/7,9 gånger högre exponeringar (hane/hona) hos möss, jämfört med exponeringen hos patienter med hematogena maligniteter som fick den rekommenderade dosen på 150 mg två gånger dagligen. En dosrelaterad ökning av öcellstumörer i bukspottkörteln observerades med låg incidens hos hanråttor vid upp till 0,4 gånger human exponering vid den rekommenderade dosen; något likartat fynd observerades inte hos honråttor med en 0,62 gånger högre exponeringsmarginal.
Reproduktions- och utvecklingstoxicitet
I en studie av embryofetal utveckling på råtta observerades ökad postimplantationsförlust, missbildningar (avsaknad av kaudala kotor och i vissa fall även sakrala kotor), skelettutvecklingsvariationer och lägre fetala kroppsvikter. Missbildningar observerades vid exponeringar från 12 gånger exponeringen hos människa baserat på AUC. Effekter på embryofetal utveckling undersöktes inte i en andra art.
Degenerering av sädeskanalerna i testiklarna observerades i 2- till 13-veckorsstudier av toxicitet vid upprepad dosering på hund och råtta men inte i studier som pågick i 26 veckor och längre. I en fertilitetsstudie på hanråtta observerades minskning av bitestikel- och testikelvikt men inga ogynnsamma effekter på parnings- eller fertilitetsparametrar och ingen degenerering eller förlust vad avser spermatogenes observerades. Honråttors fertilitet påverkades inte.
Fototoxicitet
Utvärdering av risken för fototoxicitet i den embryonala murina fibroblastcellinjen BALB/c 3T3 var ofullständig för idelalisib på grund av cytotoxicitet i in vitro-analysen. Huvudmetaboliten, GS-563117, kan öka fototoxicitet när celler samtidigt utsätts för UVA-ljus. Det finns en potentiell risk att idelalisib, via sin huvudmetabolit, GS-563117, kan orsaka fotosensitivitet hos behandlade patienter.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje filmdragerad tablett innehåller 100 mg idelalisib.
Hjälpämne(n) med känd effekt: Varje tablett innehåller 0,1 mg para-orange (E110) (se Varningar och försiktighet)
Förteckning över hjälpämnen
Tablettkärna
Mikrokristallin cellulosa
Hydroxypropylcellulosa (E463)
Kroskarmellosnatrium
Natriumstärkelseglykolat
Magnesiumstearat
Filmdragering
Polyvinylalkohol (E1203)
Makrogol 3350 (E1521)
Titandioxid (E171)
Talk (E553b)
Para-orange (E110)
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
5 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Förpackningsinformation
Filmdragerad tablett 100 mg
Filmdragerad tablett. Orange, oval, filmdragerad tablett med måtten 9,7 mm x 6,0 mm, präglad med ”GSI” på den ena sidan och med ”100” på den andra sidan.
60 tablett(er) burk, 35749:-, F
Filmdragerad tablett 150 mg
Rosa, oval, filmdragerad tablett med måtten 10,0 mm x 6,8 mm, präglad med ”GSI” på den ena sidan och med ”150” på den andra sidan.
60 tablett(er) burk, 35749:-, F
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 150 mg




