Indikationer
FIRMAGON är en gonadotropinfrisättande hormon(GnRH)-antagonist indicerad:
-
för behandling av vuxna män med avancerad hormonberoende prostatacancer.
-
för behandling av högrisk lokaliserad eller lokalt avancerad hormonberoende prostatacancer i kombination med strålbehandling.
-
som neoadjuvant behandling före strålbehandling hos patienter med högrisk lokaliserad eller lokalt avancerad hormonberoende prostatacancer.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
|
Initialdos |
Underhållsdos – månatlig administrering |
|---|---|
|
240 mg administrerat som två på varandra följande subkutana injektioner om vardera 120 mg |
80 mg administrerat som en subkutan injektion |
Den första underhållsdosen ska ges en månad efter initialdosen.
FIRMAGON kan användas som neoadjuvant eller adjuvant behandling i kombination med strålbehandling vid högrisk lokaliserad eller lokalt avancerad prostatacancer.
Den terapeutiska effekten av degarelix ska övervakas via kliniska parametrar och serumnivåer av prostataspecifikt antigen (PSA). Kliniska studier har visat att testosteron (T)-nivåerna hämmas omedelbart efter administrering av initialdosen och 96% av patienterna har serumtestosteronnivåer motsvarande medicinsk kastration (T≤0,5 ng/ml) efter tre dygn och 100% efter en månad. Långtidsbehandling med underhållsdos upp till ett år visar att 97% av patienterna har bibehållen hämning av testosteronnivåerna (T≤0,5 ng/ml).
Om patientens kliniska respons inte är optimal, bör det säkerställas att serumtestosteronnivåerna är tillräckligt hämmade.
Eftersom degarelix inte åstadkommer initial höjning av testosteron-nivåerna är tillägg av antiandrogen behandling som skydd mot initial testosteronhöjning inte nödvändigt.
Särskilda grupper
Äldre samt patienter med nedsatt lever- eller njurfunktion:
Det finns inget behov av dosjustering till äldre eller till patienter med lätt eller måttligt nedsatt lever- eller njurfunktion (se avsnitt Farmakokinetik). Patienter med gravt nedsatt lever- eller njurfunktion har inte studerats och försiktighet är därför befogad (se avsnitt Varningar och försiktighet).
Pediatrisk population
Det finns ingen relevant användning av FIRMAGON till barn och ungdomar vid behandling av vuxna män med avancerad hormonberoende prostatacancer.
Administreringssätt
FIRMAGON måste färdigställas före administrering. För instruktion beträffande beredning och administrering se avsnitt Hållbarhet, förvaring och hantering.
FIRMAGON används ENDAST för subkutan administrering. Får inte administreras intravenöst.
Intramuskulär administrering har inte undersökts och rekommenderas därför inte.
FIRMAGON administreras som en subkutan injektion i bukområdet. Injektionsstället bör varieras periodiskt. Injektionerna bör ges i områden där patienten inte exponeras för tryck, t ex inte i närheten av byxlinning eller bälte och inte nära revbenen.
Varningar och försiktighet
Effekt på QT/QTc-intervall
Långvarig androgen deprivationsbehandling kan förlänga QT-intervallet. I den konfirmerande studien där FIRMAGON jämfördes med leuprorelin utfördes periodiska (månatliga) elektrokardiogram (EKG)-mätningar; båda terapierna visade QT/QTc intervall överstigande 450 msek hos ungefär 20% av patienterna, och 500 msek hos 1% av degarelixpatienterna och hos 2% av leuprorelinpatienterna (se avsnitt Farmakodynamik).
FIRMAGON har inte studerats hos patienter med korrigerat QT-intervall över 450 msek i anamnesen, hos patienter med riskfaktorer för torsade de points eller hos patienter med samtidig behandling med läkemedel som kan förlänga QT-intervallet. Balansen mellan risk och nytta bör noga övervägas inför behandling av dessa patientgrupper (se avsnitt Interaktioner och Biverkningar).
En grundlig QT-studie visade inte på någon direkt påverkan av QT/QTc-intervallet (se avsnitt Biverkningar).
Nedsatt leverfunktion
Patienter med kända eller misstänkta leverrubbningar har inte inkluderats i kliniska långtidsstudier med degarelix. Mild, övergående ökning av ALAT och ASAT har observerats; denna åtföljdes inte av bilirubinökning eller kliniska symtom. Övervakning av leverfunktion hos patienter med kända eller misstänkta leverrubbningar tillrådes under behandlingen. Farmakokinetiken hos degarelix har undersökts i en studie med en enstaka intravenös dos hos personer med lätt till måttligt nedsatt leverfunktion (se avsnitt Farmakokinetik).
Nedsatt njurfunktion
Degarelix har inte undersökts hos patienter med gravt nedsatt njurfunktion och försiktighet är därför befogad.
Överkänslighet
Degarelix har inte studerats hos patienter med svår obehandlad astma, anafylaktiska reaktioner, svår urtikaria eller angioödem i anamnesen.
Förändringar i bentäthet
I medicinsk litteratur har minskad bentäthet rapporterats hos män som har genomgått orkidektomi eller som har behandlats med en GnRH–agonist. Effekt på bentäthet kan förväntas hos män med långa perioder av testosteronsuppression. Bentäthet har inte mätts under behandling med degarelix.
Glukostolerans
Minskning i glukostolerans har observerats hos män som genomgått orkidektomi eller som har behandlats med en GnRH–agonist. Utveckling eller förvärring av diabetes kan inträffa, därför kan diabetes-patienter kräva mer frekvent övervakning av blodglukos under androgen deprivationsbehandling. Effekten av degarelix på insulin- och glukosnivåer har inte studerats.
Kardiovaskulära sjukdomar
Kardiovaskulära sjukdomar såsom stroke och myokardinfarkt har rapporterats i medicinsk litteratur hos patienter med androgen deprivationsterapi. Därför bör alla kardiovaskulära riskfaktorer tas i beaktande.
Interaktioner
Inga konventionella interaktionsstudier har utförts.
Eftersom androgen deprivationsbehandling kan förlänga QTc-intervallet bör samtidig användning av läkemedel kända för att förlänga QTc-intervallet eller inducera torsade de points såsom antiarytmiska läkemedel i klass IA (t ex kinidin, disopyramid) eller klass III (t ex amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsykotika etc utvärderas noggrant (se avsnitt Varningar och försiktighet).
Degarelix är inget substrat för humant CYP450-system och har inte visats inducera eller hämma CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 eller CYP3A4/5 i någon större omfattning in vitro. Därför är kliniskt signifikanta farmakokinetiska interaktioner i metabolismen relaterade till dessa isoenzym osannolika.
Graviditet
Det finns ingen relevant indikation för användning av FIRMAGON till kvinnor.
Amning
Det finns ingen relevant indikation för användning av FIRMAGON till kvinnor.
Fertilitet
FIRMAGON kan påverka manlig fertilitet så länge testosteronnivåerna är nedpressade
Trafik
FIRMAGON har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Emellertid är trötthet och yrsel vanliga biverkningar och kan påverka förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofil
De vanligaste biverkningarna vid behandling med degarelix i den bekräftande fas III-studien (N=409) var relaterade till förväntad fysiologisk effekt av terstosteron-hämning, och inkluderade värmevallningar och viktökning (rapporterat hos 25% respektive 7% av de patienter som fick behandling i ett år) eller reaktioner vid injektionsstället. Övergående frossa, feber eller influensaliknande symtom rapporterades uppkomma timmarna efter administrering (hos 3%, 2% respektive 1% av patienterna).
Reaktionerna vid injektionsstället var huvudsakligen smärta och erytem, och rapporterades hos 28% respektive 17% av patienterna. Mindre frekventa reaktioner var svullnad (6%), vävnadsförhårdnad (4%) och nodulus (3%). Dessa biverkningar uppträdde främst vid initialdosen medan incidensen per 100 injektioner för dessa biverkningar vid underhållsdos på 80 mg, var 3 för smärta och <1 för erytem, svullnad, vävnadsförhårdnad och nodulus. Rapporterade biverkningar var mestadels övergående, milda till måttliga och ledde till avbrott i mycket få fall (<1%). Allvarliga reaktioner vid injektionsstället såsom infektioner, abscess eller nekros som kan kräva kirurgisk behandling/dränage rapporterades mycket sällan.
Tabell över biverkningar
Frekvensen biverkningar listade nedan definieras enligt följande konvention:
mycket vanliga (≥1/10); vanliga ( ≥1/100, <1/10); mindre vanliga (≥1/1000, <1/100), sällsynta (≥1/10 000, <1/1000) och mycket sällsynta (<1/10 000). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Tabell 1: Frekvens biverkningar rapporterade hos 1259 patienter behandlade i totalt 1781 patientår (fas II- och III-studier) och från rapporter efter det läkemedlet marknadsförts
|
MedDRA-klassificering av organsystem (SOC) |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
|---|---|---|---|---|
|
Blodet och lymfsystemet |
Anemi* |
Neotropen feber |
||
|
Immunsystemet |
Överkänslighet |
Anafylaktiska reaktioner |
||
|
Metabolism och nutrition |
Viktökning* |
Hyperglykemi/diabetes mellitus, kolesterolökning, viktminskning, nedsatt aptit, förändringar av kalcium i blodet | ||
|
Psykiska störningar |
Sömnlöshet |
Depression, nedsatt libido* | ||
|
Centrala och perifera nervsystemet |
Yrsel, huvudvärk |
Mental försämring, hypoestesi | ||
|
Ögon |
Dimsyn | |||
|
Hjärtat |
Hjärtarytmi (inklusive förmaksflimmer), palpitationer, QT-förlängning* (se avsnitt Varningar och försiktighet och Interaktioner) |
Myokard -infarkt, hjärtsvikt |
||
|
Blodkärl |
Värmevallningar* |
Hypertension, vasovagal reaktion (inklusive hypotension) | ||
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné | |||
|
Magtarmkanalen |
Diarré, illamående |
Förstoppning, kräkningar, buksmärta, bukobehag, muntorrhet | ||
|
Lever och gallvägar |
Ökning av lever-transaminaser |
Ökning av bilirubin och alkalisk fosfatas | ||
|
Hud och subkutan vävnad |
Ökad svettning (inkl. nattliga svettningar)*, utslag |
Nässelfeber, knutor i huden, alopeci, klåda, erytem | ||
|
Muskuloskeletala systemet och bindväv |
Muskuloskeletal smärta och obehag |
Osteoporos/osteopeni, artralgi, muskelsvaghet, muskelryckningar, svullna/stela leder |
Rabdomyolys |
|
|
Njurar och urinvägar |
Pollakisuri, urinträngningar, dysuri, nokturi, nedsatt njurfunktion, inkontinens | |||
|
Reproduktionsorgan och bröstkörtel |
Gynekomasti*, testikelatrofi*, erektil dysfunktion* |
Testikelsmärta, bröstsmärta, bäckensmärta, genital irritation, ejakulationssvikt | ||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Reaktioner vid injektionsstället |
Frossa, feber, trötthet*, influensaliknande symtom |
Sjukdomskänsla, perifert ödem |
*Kända fysiologiska verkningar av testosteron-hämning
Beskrivning av utvalda biverkningar
Förändringar i laboratorieparametrar
Förändringar i laboratorieparametrar som observerades under ett års behandling i den bekräftande fas III-studien (N=409) var likvärdiga för degarelix och den GnRH-agonist (leuprorelin) som användes som jämförande läkemedel. Markant onormala (>3xULN) levertransaminasvärden (ALAT, ASAT och GGT) sågs efter behandling med båda läkemedlen hos 2-6% av patienterna med normala värden före behandlingen . Markant minskning av blodvärden, hematokrit (≤0,37) och hemoglobin (≤115 g/l) sågs efter behandling med båda läkemedlen hos 40% respektive 13-15% av patienter med normala värden före behandlingen. Det är okänt i vilken omfattning denna minskning i blodvärden orsakades av den bakomliggande prostatacancern och i vilken omfattning det var en följd av androgen deprivationsterapi. Markant onormala värden av kalium (≥5,8 mmol/l), kreatinin (≥177 mikromol/l) och BUN (≥10,7 mmol/l) hos patienter med normala värden före behandling sågs hos 6%, 2% och 15% av patienter behandlade med degarelix och hos 3%, 2% och 14% av patienter behandlade med leuprorelin.
Förändringar i EKG mätningar
Förändringar i EKG mätningar som observerades under ett års behandling i den bekräftande fas III-studien (N=409) var likvärdiga för degarelix och den GnRH-agonist (leuprorelin) som användes som jämförande läkemedel. Tre (<1%) av 409 patienter i degarelix-gruppen och fyra (2%) av 201 patienter i leuprorelin 7,5 mg-gruppen hade ett QTcF ≥ 500 msek. Medianförändringen i QTcF från ursprungsvärde till studiens slut var för degarelix 12,0 msek och för leuprorelin 16,7 msek.
Avsaknaden av direkt effekt av degarelix på hjärtrepolarisation (QTcF), hjärtfrekvens, AV-överledning, depolarisering av hjärta, och T-våg- eller U-våg-morfologi bekräftades i en grundlig QT-studie på friska försökspersoner (N = 80). Försökspersonerna som under 60 min fick en i.v. infusion av degarelix nådde ett genomsnittligt Cmax på 222 ng/ml. Dvs cirka 3-4 gånger det Cmax som erhålls vid prostatacancerbehandling.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen klinisk erfarenhet av effekterna vid en akut överdos med degarelix. I händelse av överdos ska patienten övervakas och om nödvändigt ska lämplig understödjande behandling ges.
Farmakodynamik
Verkningsmekanism
Degarelix är en selektiv gonadotropinfrisättande hormon(GnRH)-antagonist som binds kompetitivt och reversibelt till hypofysens GnRH-receptorer, och därigenom snabbt reducerar frisättningen av gonadotropinerna, luteiniseringshormonet (LH) och det follikelstimulerande hormonet (FSH), och därigenom fås minskning av testosteron(T)-sekretionen i testiklarna. Prostatacarcinomet som vanligen är androgenkänsligt svarar på behandling som avlägsnar androgenkällan. Till skillnad mot GnRH-agonister, inducerar GnRH-antagonister inte en initial LH-ökning med efterföljande testosteronstegring/tumörstimulering och eventuell symtomuppblossning (”flare”) efter initiering av behandlingen.
En enstaka dos om 240 mg degarelix, följt av en månatlig underhållsdos om 80 mg, orsakar en snabb minskning i koncentration av LH, FSH och följdaktligen testosteron. Serumkoncentrationen av dihydrotestoseron (DHT) avtar på samma sätt som plasmakoncentrationen av testosteron.
Degarelix är effektivt för att uppnå och bibehålla testosteronhämningen väl under medicinsk kastrationsnivå om 0,5 ng/ml. Månatlig underhållsdosering med 80 mg resulterade i bibehållen testosteronhämning hos 97% av patienterna i minst ett år. Ingen testosteronmikrosvikt visades efter förnyad injektion under degarelixbehandlingen. Mediannivåerna av testosteron efter ett års behandling var 0,087 ng/ml [interkvartilt område 0,06-0,15] N=167.
Resultat från bekräftande fas III-studie
Effekt och säkerhet med degarelix utvärderades i en öppen, randomiserad, jämförande multicenterstudie med aktiv kontroll och parallella grupper. Effekt och säkerhet undersöktes med två olika månatliga dosregimer för degarelix med en initialdos om 240 mg (40 mg/ml) följt av månatliga doser om 160 mg (40 mg/ml) eller 80 mg (20 mg/ml) subkutant, jämfört med leuprorelin 7,5 mg månatlig intramuskulär administrering hos patienter med prostatacancer som krävde androgen deprivationsbehandling. Totalt 620 patienter randomiserades till en av tre behandlingsgrupper, av vilka 504 (81%) av patienterna fullföljde studien. I den behandlingsgrupp som erhöll degarelix 240/80 mg avbröt 41 (20%) patienter studien jämfört med 32 (16%) patienter i leuprorelin-gruppen.
Av de 610 behandlade patienterna hade
-
31% lokaliserad prostatacancer
-
29% lokalt avancerad prostatacancer
-
20% metastaserande prostatacancer
-
7% okänd metastasstatus
-
13% tidigare genomförd kurativt syftande kirurgi- eller strålbehandling och ökande PSA
Demografiska utgångsvärden var likvärdiga mellan armarna. Medianåldern var 74 år (47-98 år).
Primärt mål var att visa att degarelix är effektivt för att uppnå och bibehålla testosteronhämning under 0,5 ng/ml under 12 månaders behandling.
Lägsta effektiva underhållsdos om 80 mg degarelix valdes.
Uppnående av serumtestosteron (T) ≤0,5 ng/ml
FIRMAGON är effektivt för att uppnå snabb testosteronhämning, se tabell 2.
|
Tid |
Degarelix 240/80 mg |
Leuprorelin 7,5 mg |
|---|---|---|
|
Dag 1 |
52% |
0% |
|
Dag 3 |
96% |
0% |
|
Dag 7 |
99% |
1% |
|
Dag 14 |
100% |
18% |
|
Dag 28 |
100% |
100% |
Undvikande av initial testosteronstegring:
Testosteronstegring definierades som testosteron överstigande utgångsvärdet med ≥15% inom de första 2 veckorna.
Ingen av de patienter som behandlades med degarelix fick någon initial testosteronstegring; en genomsnittlig testosteronminskning om 94% visades dag 3. De flesta leuprorelinbehandlade patienterna fick en initial testosteronstegring; en genomsnittlig testosteronökning om 65% visades dag 3. Skillnaden var statistiskt signifikant (p<0,001).
Figur 1: Förändring i procent för testosteron från utgångsvärdet per behandlingsgrupp t o m dag 28 (median med interkvartilt område).
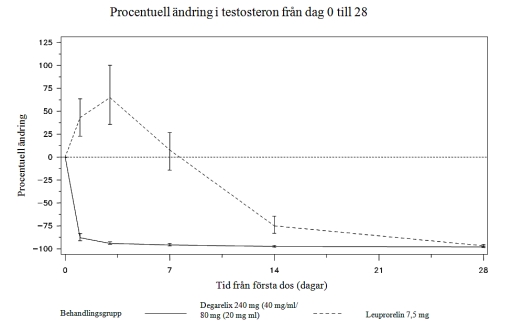
Det primära effektmåttet i studien var testosteron suppressionsnivåer efter ett års behandling med degarelix eller leuprorelin. Den kliniska fördelen med degarelix jämfört med leuprorelin plus antiandrogen i initialfasen har inte visats.
Testosteronåterhämtning
I en studie på patienter med ökande PSA efter lokal terapi (huvudsakligen radikal prostatektomi och strålning) administrerades FIRMAGON under sju månader följt av en sju månaders övervakningsperiod. Mediantid till testosteronåterhämtning (>0,5 ng/ml över kastrationsnivå) efter utsättande av behandlingen var 112 dagar (räknat från övervakningsperiodens början, dvs 28 dagar efter sista injektionen). Mediantid till testosteronnivå >1,5 ng/ml (över normal lägre gräns) var 168 dagar.
Långtidseffekt
Framgångsrik respons i studien definierades som uppnående av medicinsk kastration dag 28 och bibehållande t o m dag 364 där ingen enstaka testosteronkoncentration var högre än 0,5 ng/ml.
|
Degarelix 240/80 mg N=207 |
Leuprorelin 7,5 mg N=201 |
|
|---|---|---|
|
Antal som svarat |
202 |
194 |
|
Responsfrekvens (konfidensintervall)* |
97,2% (93,5; 98,8%) |
96,4% (92,5; 98,2%) |
* Kaplan Meier-estimat inom gruppen
Uppnående av minskning i prostataspecifikt antigen (PSA)
Tumörstorlek mättes inte direkt under det kliniska prövningsprogrammet, men det fanns en indirekt fördelaktig tumörrespons för degarelix som visades som en 95% minskning i median-PSA efter 12 månader.
Median-PSA-utgångsvärde i studien var:
-
för degarelix 240/80 mg behandlingsgrupp; 19,8 ng/ml (interkvartilt område: P25 9,4 ng/ml, P75 46,4 ng/ml)
-
för leuprorelin 7,5 mg behandlingsgrupp; 17,4 ng/ml (interkvartilt område: P25 8,4 ng/ml, P75 56,5 ng/ml)
Figur 2: Förändring i procent i PSA från utgångsvärdet per behandlingsgrupp t o m dag 56 (median med interkvartilt område).
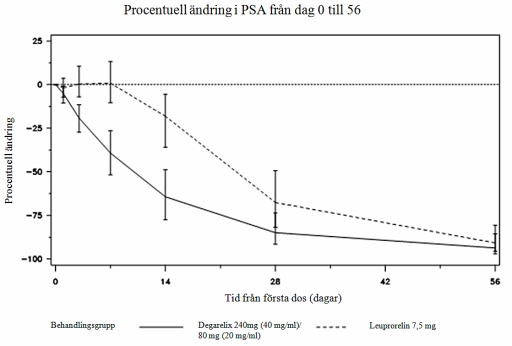
Skillnaden var statistiskt signifikant (p<0,001) vid den förspecificerade analysen dag 14 och dag 28.
Nivåerna av prostataspecifikt antigen (PSA) sänktes med 64% två veckor efter administrering av degarelix, 85% efter en månad, 95% efter tre månader och förblev hämmade (ca 97%) under ett års behandling.
Från dag 56 till dag 364 visades ingen signifikant skillnad mellan degarelix och det jämförda läkemedlet i förändring i procent från utgångsvärdet.
Effekt på prostatastorlek, sjukdomsrelaterad dödlighet och ökad överlevnad utan sjukdom.
Neoadjuvant androgen deprivationsbehandling före strålbehandling har visats påverka sänkning av prostatavolym, minskad sjukdomsrelaterad dödlighet och ökad sjukdomsfri överlevnad hos patienter med högrisk lokaliserad eller lokalt avancerad prostatacancer (RTOG 86-10, TROG 96-01, RTOG 92-02 och Mason M et al. Clinical Oncology 2013).
I en randomiserad parallell-arm, aktivt kontrollerad, öppen studie, utförd på 224 män med UICC-prostatacancer TNM-kategori T2 (b eller c) /T3/T4, N0, M0, Gleason -poäng > 7 eller prostata specifik antigen > 10ng/ml och en total prostatavolym >30. Tre månaders behandling med degarelix (240/80 mg dosregim) resulterade i en 37% minskning av prostatastorleken mätt med ultraljud via rektum (TRUS) hos patienter som behövde hormonell behandling före strålning och hos patienter som skulle genomgå medicinsk kastration. Minskningen av prostatastorlek var liknande den som uppnåddes med goserelin tillsammans med anti-androgent skydd mot symtomuppblossning (Mason M et al. Clinical Oncology 2013).
Kombination med strålbehandling
Effekten av degarelix i kombination med strålbehandling är baserad på en indirekt jämförelse med LHRH-agonisternas effektdata genom att använda klinisk surrogat-effektmått; testosteron-hämning och PSA-reduktion som visar non-inferiority gentemot LHRH-agonister och indirekt fastställer effekt.
Hos patienter med lokalt avancerad prostatacancer har flera randomiserade kliniska långtidsstudier visat på fördelen med androgen deprivationsbehandling (ADT) i kombination med strålbehandling jämfört med strålbehandling ensamt (RTOG 85–31, RTOG 86–10, EORTC 22863).
Kliniska data från en klinisk fas III-studie (EORTC 22961) på 970 patienter med lokalt avancerad prostatacancer (främst T2c-T4 med några T1c till T2b-patienter med patologisk regional lymfkörtelsjukdom) har visat att strålbehandling följt av långtidsbehandling (3 år) är att föredra framför korttidsbehandling (6 månader). Den totala totala dödligheten efter 5 år för grupper med korttidshormonbehandling respektive långtidshormonbehandling var 19,0% respektive 15,2%, med en relativ risk på 1,42 (en övre ensidig 95,71% CI = 1,79; eller tvåsidig 95,71% CI = [1,09; 1,85], p = 0,65 för non-inferiority och p = 0,0082 för post-hoc-test av skillnad mellan behandlingsgrupper). Dödligheten efter 5 år specifikt relaterad till prostatacancer i grupper med korttidshormonbehandling respektive långtidshormonbehandling var 4,78% respektive 3,2%, med en relativ risk på 1,71 (95% CI = [1,14 till 2,57], p = 0,002).
Enligt medicinska riktlinjer är den rekommenderade varaktigheten av androgen deprivationsbehandling, för T3-T4-patienter som får strålbehandling, 2-3 år.
Bevis för indikationen av högrisk lokaliserad prostatacancer baseras på ett antal publicerade studier av strålbehandling kombinerat med GnRH-analoger. Analys av kliniska data från fem publicerade studier (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 86-10 och D'Amico et al., JAMA 2004), visar på en fördel att kombinera GnRH-analog med strålbehandling.
Tydlig skillnad mellan respektive studiepopulation för indikationerna lokalt avancerad prostatacancer och högrisk lokaliserad prostatacancer var inte möjlig att påvisa i de publicerade studierna.
Effekt på QT/QTc-intervall
I den bekräftande studie som jämförde FIRMAGON med leuprorelin utfördes periodiska EKG. Båda behandlingarna visade QT/QTc-intervall som översteg 450 msek hos omkring 20% av patienterna. Från början till slutet av studien var medianförändringen för FIRMAGON 12,0 msek och för leuprorelin 16,7 msek.
Anti-degarelix antikroppar
Anti-degarelix antikroppsutveckling har observerats hos 10% av patienterna efter behandling med FIRMAGON i ett år och 29% av patienterna efter behandling med FIRMAGON i upp till 5,5 år. Det finns inget som tyder på att effekt och säkerhet med behandling med FIRMAGON påverkas av antikroppsbildning efter upp till 5,5 års behandling.
Pediatrisk population
Europeiska läkemedelsmyndigheten har frångått kravet att skicka in studieresultat för FIRMAGON för en eller flera grupper av den pediatriska populationen (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Efter subkutan administrering av 240 mg degarelix vid en koncentration om 40 mg/ml till prostatacancerpatienter i den pivotala studien CS21 var AUC0-28 dagar 635 (602-668) dag*ng/ml, Cmax var 66,0 (61,0-71,0) ng/ml och uppträdde vid tmax 40 (37-42) timmar. Genomsnittliga dalvärden var cirka 11-12 ng/ml efter initialdosen och 11-16 ng/ml efter underhållsdosering med 80 mg vid en koncentration på 20 mg/ml. Degarelix Cmax minskar plasmakoncentrationen bifasiskt med en slutgiltlig medelhalveringstid (t½) på 29 dagar för underhållsdosen. Den långa halveringstiden efter subkutan administrering är en följd av en mycket långsam frisättning av degarelix från den depå som bildas vid injektionsstället. Läkemedlets farmakokinetiska beteende påverkas av dess koncentration i injektionslösningen. Sålunda tenderar Cmax och biotillgänglighet att minska med ökande doskoncentration medan halveringstiden förlängs. Därför bör ingen annan doskoncentration än den rekommenderade användas.
Distribution
Distributionsvolymen hos friska äldre män är ungefär 1 l/kg. Plasmaproteinbindningen uppskattas vara omkring 90%.
Metabolism
Degarelix undergår sedvanlig peptidnedbrytning under lever-gall-passagen och utsöndras huvudsakligen som peptidfragment i faeces. Inga signifikanta metaboliter upptäcktes i plasmaprover efter subkutan administrering. In vitro-studier har visat att degarelix inte är ett substrat för humant CYP450-system.
Eliminering
Hos friska män utsöndras ungefär 20-30% av en enstaka intravenöst administrerad dos i urinen, vilket tyder på att ungefär 70-80% utsöndras via lever- och gallvägar. Clearance av degarelix administrerat som enstaka intravenösa doser (0,864-49,4 µg/kg) till friska äldre män visades vara 35-50 ml/h/kg.
Särskilda patientgrupper
Patienter med nedsatt njurfunktion
Inga farmakokinetiska studier har utförts på patienter med nedsatt njurfunktion. Endast omkring 20-30% av en given dos degarelix utsöndras oförändrat via njurarna. En populationsfarmakokinetisk analys av data från den bekräftande fas III-studien har visat att degarelix-clearance hos patienter med lätt eller måttligt nedsatt njurfunktion minskas med omkring 23%, därför rekommenderas inte dosjustering till patienter med lätt eller måttligt nedsatt njurfunktion. Data från patienter med gravt nedstt njurfunktion är otillräckliga och försiktighet rekommenderas därför för denna patientpopulation.
Patienter med nedsatt leverfunktion
Degarelix har undersökts i en farmakokinetisk studie hos patienter med lätt till måttligt nedsatt leverfunktion. Inga tecken på ökad exponering observerades hos personer med nedsatt leverfunktion jämfört med friska försökspersoner. Dosjustering är inte nödvändig till patienter med lätt eller måttligt nedsatt leverfunktion. Patienter med gravt nedsatt leverfunktion har inte studerats och försiktighet rekommenderas därför för denna grupp.
Prekliniska uppgifter
Reproduktionstoxicitetsstudier på djur visade att degarelix orsakade infertilitet hos handjur. Detta är relaterat till den farmakologiska effekten, och är reversibelt.
I reproduktionsstudier på honor visade degarelix förväntade effekter relaterat till de farmakologiska egenskaperna. Det orsakade en dosberoende förlängning av tid till parning och till dräktighet, minskat antal gulkroppar, ökning av antalet pre- och post-implantationsförluster, antal aborter, antal tidiga dödsfall för embryo/foster, antal för tidiga födslar samt förlängd förlossningstid.
Icke-kliniska studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet och karcinogenicitet visade inte några särskilda risker för människa. Varken in vitro- eller in vivo-studier visade några tecken på QT förlängning.
Ingen toxicitet visades på målorgan i studier på akut, subakut och kronisk toxicitet på råttor och apor efter subkutan administrering av degarelix. Läkemedelsrelaterad lokal irritation sågs hos djur när degarelix administrerades subkutant i höga doser.
Innehåll
Kvalitativ och kvantitativ sammansättning
FIRMAGON 80 mg pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller 80 mg degarelix (som acetat). Efter beredning innehåller varje ml lösning 20 mg degarelix.
FIRMAGON 120 mg pulver och vätska till injektionsvätska, lösning
Varje injektionsflaska innehåller 120 mg degarelix (som acetat). Efter beredning innehåller varje ml lösning 40 mg degarelix.
Förteckning över hjälpämnen
Pulver: Mannitol (E421)
Spädningsvätska: Vatten till injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Miljöpåverkan
Degarelix
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
PEC/PNEC ännu inte tillgängligt. Bioackumulering inte trolig (log Kow värde: 1,16 för neutral species och –0,86 för cationic species)
According to the European Medicines Agency guideline on environmental risk assessments for pharmaceuticals (EMA/CHMP/SWP/4447/00), vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment. (Ref 1)
Even though biomolecules, such as vaccines and hormones, are exempted
they should still be regarded as biologically active
Reference
1. ECHA, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment. http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_ en.htm
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Efter beredning
Kemisk och fysisk stabilitet vid användning har visats för 2 timmar vid 25ºC. Ur mikrobiologisk synvinkel bör produkten användas omedelbart, såvida inte beredningsmetoden utesluter risk för mikrobiologisk kontaminering. Om produkten inte används omedelbart är förvaringstider och förhållanden vid användning användarens ansvar.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Bruksanvisning:
Instruktionerna för beredning måste följas noga.
Användning av andra koncentrationer rekommenderas ej eftersom geldepåbildningen påverkas av koncentrationen. Den färdigberedda lösningen ska vara en klar vätska, fri från olösta partiklar.
OBSERVERA INJEKTIONSFLASKAN FÅR INTE SKAKAS
Förpackningen innehåller en injektionsflaska med pulver och en förfylld injektionsspruta med spädningsvätska som måste färdigställas för subkutan injektion.
|
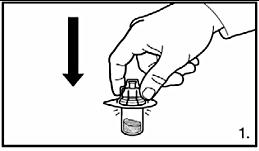
1. Ta bort skyddet från adapterförpackningen. Sätt fast adaptern på injektionsflaskan med pulver genom att pressa ner adaptern tills spetsen trycks genom gummiproppen och adaptern knäpps på plats. |
|
2. Förbered den förfyllda sprutan genom att sätta fast sprutkolven. |
|
|
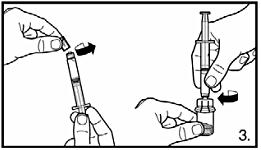
3. Ta bort skyddshatten från den förfyllda sprutan. Sätt fast sprutan på injektionsflaskan med pulver genom att skruva fast den på adaptern. Överför all spädningsvätska till injektionsflaskan med pulver. |
|
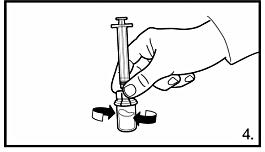
4.Med sprutan fortfarande fastsatt på adaptern, snurra försiktigt tills vätskan är klar och utan olösta partiklar. Om pulvret fäster vid glaset ovanför vätskeytan kan injektionsflaskan lutas försiktigt. För att undvika skumbildning: skaka inte flaskan. En ring med små luftbubblor på vätskans yta är acceptabelt. Beredningsprocessen tar vanligtvis några minuter men kan i vissa fall ta upp till 15 minuter. |
|
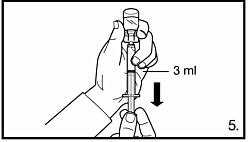
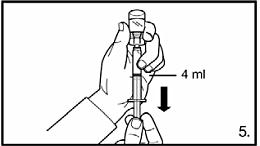
5.Vänd injektionsflaskan upp-och-ner och dra upp lösningen till markeringen på injektionssprutan. Se alltid till att dra upp exakt volym och avlägsna eventuella luftbubblor. FIRMAGON 80 mg pulver och vätska till injektionsvätska, lösning: dra upp till markeringen vid 4 ml. FIRMAGON 120 mg pulver och vätska till injektionsvätska, lösning: dra upp till markeringen vid 3 ml. |
|
6. Ta bort sprutan från adaptern och sätt fast nålen för djup subkutan injektion på sprutan. |
|
|
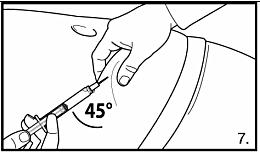
7. Utför en djup subkutan injektion. För att göra detta: Ta tag i huden på buken, lyft upp den subkutana vävnaden och stick in nålen djupt i minst 45 graders vinkel. FIRMAGON 80 mg pulver och vätska till injektionsvätska, lösning. Injicera 4 ml FIRMAGON 80 mg långsamt omedelbart efter beredningen. FIRMAGON 120 mg pulver och vätska till injektionsvätska, lösning. Injicera 3 ml FIRMAGON 120 mg långsamt omedelbart efter beredningen. |
|
8. Injektionerna bör inte ges i områden där patienten exponeras för tryck, t ex i närheten av bälte eller byxlinning eller nära revbenen. Injicera inte direkt i en ven. Dra försiktigt tillbaka kolven för att se om blod sugits upp. Om det finns blod i sprutan kan produkten inte längre användas. Avbryt processen och kassera sprutan och nålen. (Färdigställ en ny dos för patienten.) |
|
|
9. FIRMAGON 120 mg pulver och vätska till injektionsvätska, lösning
|
|
Ej använt läkemedel eller avfall ska kasseras i enlighet med lokala krav.
Egenskaper hos läkemedelsformen
Pulver och vätska till injektionsvätska, lösning.
Pulver vitt till benvitt pulver
Vätska klar, färglös lösning
Förpackningsinformation
Pulver och vätska till injektionsvätska, lösning 80 mg
Pulver: Vitt till benvitt pulver Vätska: klar färglös lösning
80 milligram injektionsflaska, 1309:-, (F)
Pulver och vätska till injektionsvätska, lösning 120 mg
Pulver: Vitt till benvitt pulver. Vätska: Klar färglös lösning
2 x 120 milligram injektionsflaska, 2342:71, (F)