Indikationer
Psoriasisartrit
Otezla, ensamt eller i kombination med sjukdomsmodifierande antireumatiska läkemedel (DMARDs), är avsett för behandling av aktiv psoriasisartrit (PsA) hos vuxna patienter som har visat otillräckligt svar eller som har varit intoleranta mot tidigare DMARD-behandling (se avsnitt Farmakodynamik).
Psoriasis
Otezla är avsett för behandling av måttlig till svår kronisk plackpsoriasis hos vuxna patienter som inte svarat på eller som har någon kontraindikation mot eller är intoleranta mot annan systemisk behandling inklusive ciklosporin, metotrexat eller psoralen och ultraviolett A-ljus (PUVA).
Behçets sjukdom
Otezla är avsett för behandling av vuxna patienter med munsår på grund av Behçets sjukdom som är aktuella för systemisk behandling.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Graviditet (se avsnitt Graviditet).
Dosering
Behandling med Otezla ska initieras av specialister med erfarenhet av diagnos och behandling av psoriasis, psoriasisartrit eller Behçets sjukdom.
Dosering
Rekommenderad dos av apremilast är 30 mg peroralt två gånger dagligen med ca 12 timmars mellanrum (morgon och kväll), utan födorestriktioner. Det behövs ett schema för initial titrering såsom visas nedan i tabell 1. Det behövs ingen förnyad titrering efter den initiala titreringen.
Tabell 1. Dostitreringsschema
|
Dag 1 |
Dag 2 |
Dag 3 |
Dag 4 |
Dag 5 |
Dag 6 och därefter |
|||||
|
FM |
FM |
EM |
FM |
EM |
FM |
EM |
FM |
EM |
FM |
EM |
|
10 mg |
10 mg |
10 mg |
10 mg |
20 mg |
20 mg |
20 mg |
20 mg |
30 mg |
30 mg |
30 mg |
Om patienten glömmer en dos ska nästa dos tas så snart som möjligt. Om det nästan är tid för nästa dos ska den glömda dosen inte tas och nästa dos tas vid vanlig tid.
I de pivotala kliniska prövningarna observerades den största förbättringen inom de första 24 veckorna av behandling för aktiv psoriasisartrit och psoriasis, och inom de första 12 veckorna av behandling för Behçets sjukdom. Om en patient inte uppvisar tecken på terapeutisk nytta efter denna tidsperiod bör behandlingen omprövas. Patientens svar på behandling bör utvärderas regelbundet.
Särskilda populationer
Äldre patienter
Det behövs ingen dosjustering för denna patientpopulation (se avsnitt Biverkningar och Farmakokinetik).
Patienter med nedsatt njurfunktion
Ingen dosjustering behövs hos patienter med lätt och måttligt nedsatt njurfunktion. Dosen av apremilast ska reduceras till 30 mg en gång dagligen hos patienter med gravt nedsatt njurfunktion (kreatininclearance på mindre än 30 ml per minut beräknat med Cockcroft-Gaults ekvation). Vid initial dostitrering i denna grupp rekommenderas att apremilast titreras genom att enbart använda det förmiddagsschema som anges i tabell 1 och att eftermiddagsdoserna hoppas över (se avsnitt Farmakokinetik).
Patienter med nedsatt leverfunktion
Ingen dosjustering är nödvändig för patienter med nedsatt leverfunktion (se avsnitt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt för apremilast för barn i åldern 0 till 17 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Otezla är avsett för oral användning. De filmdragerade tabletterna ska sväljas hela och kan tas antingen med eller utan mat.
Varningar och försiktighet
Diarré, illamående och kräkningar
Efter marknadsföring har det förekommit rapporter om svår diarré, illamående och kräkningar förknippat med apremilast. De flesta fallen inträffade inom de första behandlingsveckorna. Vissa fall krävde sjukhusinläggning. Patienter som är 65 år eller äldre kan ha en högre risk för komplikationer. Om patienten utvecklar svår diarré, illamående eller kräkningar kan det vara nödvändigt att avbryta behandlingen med apremilast.
Psykiska störningar
Apremilast är förknippat med en ökad risk för psykiska störningar som sömnlöshet och depression. Förekomst av suicidala tankar och beteenden, inklusive självmord, har observerats hos patienter med eller utan tidigare depression (se avsnitt Biverkningar). Riskerna och nyttan med att inleda eller fortsätta en behandling med apremilast ska beaktas noga om patienter redogör för tidigare eller befintliga psykiska symtom eller om samtidig behandling med andra läkemedel som kan orsaka psykiska händelser planeras. Patienter och vårdgivare ska instrueras att meddela den förskrivande läkaren om eventuella förändringar avseende beteende eller humör samt om suicidala tankar. Om patienter drabbas av nya eller försämrade psykiska symtom, eller om suicidala tankar eller självmordsförsök identifieras, bör behandlingen med apremilast avbrytas.
Gravt nedsatt njurfunktion
Dosen av Otezla ska reduceras till 30 mg en gång dagligen hos patienter med gravt nedsatt njurfunktion (se avsnitt Dosering och Farmakokinetik).
Underviktiga patienter
Patienter som är underviktiga när behandlingen påbörjas ska få sin vikt kontrollerad regelbundet. Vid oförklarlig och kliniskt signifikant viktförlust ska dessa patienter utvärderas av läkare och man bör överväga att avbryta behandlingen.
Laktosinnehåll
Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Interaktioner
Samtidig administrering av en stark inducerare av cytokrom P450 3A4 (CYP3A4)-enzym, rifampicin, resulterade i minskad systemisk exponering av apremilast, vilket kan leda till förlust av effekt av apremilast. Därför rekommenderas inte användning av starka inducerare av CYP3A4-enzym (t.ex. rifampicin, fenobarbital, karbamazepin, fenytoin och johannesört) tillsammans med apremilast. Samtidig administrering av apremilast med flera doser av rifampicin resulterade i en minskning av ytan under koncentrations-tidskurvan (AUC) och maximal serumkoncentration (Cmax) för apremilast med cirka 72 % respektive 43 %. Apremilastexponeringen minskar vid administrering tillsammans med starka inducerare av CYP3A4 (t.ex. rifampicin) och kan leda till minskat kliniskt svar.
I kliniska studier har apremilast administrerats samtidigt som topikal behandling (däribland kortikosteroider, schampo innehållande stenkolstjära och hårbottenpreparat innehållande salicylsyra) och UVB-fototerapi.
Det förekom ingen kliniskt betydelsefull interaktion mellan ketokonazol och apremilast. Apremilast kan administreras tillsammans med en potent CYP3A4-hämmare såsom ketokonazol.
Det förekom ingen farmakokinetisk interaktion mellan apremilast och metotrexat hos patienter med psoriasisartrit. Apremilast kan administreras tillsammans med metotrexat.
Det förekom ingen farmakokinetisk interaktion mellan apremilast och orala preventivmedel innehållande etinylestradiol och norgestimat. Apremilast kan administreras tillsammans med orala preventivmedel.
Graviditet
Kvinnor i fertil ålder
Graviditet ska uteslutas innan behandling påbörjas. Kvinnor i fertil ålder ska använda en effektiv preventivmetod för att förhindra graviditet under behandling.
Graviditet
Det finns begränsad mängd data från användningen av apremilast hos gravida kvinnor.
Apremilast är kontraindicerat under graviditet (se avsnitt Kontraindikationer). Effekterna av apremilast på graviditet inkluderade embryofetal förlust hos mus och apa, samt minskade fostervikter och försenad ossifikation hos mus vid doser högre än nuvarande rekommenderad högsta humana dos. Inga sådana effekter observerades när exponeringen hos djur var 1,3 gånger den kliniska exponeringen (se avsnitt Prekliniska uppgifter).
Amning
Apremilast detekterades i mjölk hos lakterande möss (se Prekliniska uppgifter). Det är okänt om apremilast eller dess metaboliter utsöndras i human bröstmjölk. En risk för det ammade barnet kan inte uteslutas och därför ska apremilast inte användas under amning.
Fertilitet
Det finns inga fertilitetsdata tillgängliga för människa. I djurstudier på mus observerades inga negativa effekter på fertiliteten hos hanar vid exponeringsnivåer på 3 gånger klinisk exponering och hos honor vid exponeringsnivåer på 1 gånger klinisk exponering. Se Prekliniska uppgifter beträffande prekliniska fertilitetsdata.
Trafik
Apremilast har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste rapporterade biverkningarna av apremilast vid PsA och psoriasis är rubbningar i mag-tarmkanalen, däribland diarré (15,7 %) och illamående (13,9 %). De övriga vanligaste rapporterade biverkningarna omfattar övre luftvägsinfektioner (8,4 %), huvudvärk (7,9 %) och spänningshuvudvärk (7,2 %) och är oftast av lindrig till måttlig svårighetsgrad.
De vanligaste rapporterade biverkningarna med apremilast vid Behçets sjukdom är diarré (41,3 %), illamående (19,2 %), huvudvärk (14,4 %), övre luftvägsinfektion (11,5 %), smärta i övre buken (8,7 %), kräkningar (8,7 %) och ryggsmärta (7,7 %) och är oftast av lindrig till måttlig svårighetsgrad.
De gastrointestinala biverkningarna inträffade vanligen inom de 2 första behandlingsveckorna och blev normalt bättre inom 4 veckor.
Det är mindre vanligt att överkänslighetsreaktioner observeras (se avsnitt Kontraindikationer).
Tabell över biverkningar
De biverkningar som observerades hos patienter som behandlades med apremilast anges nedan efter organsystem (SOC) och frekvens för alla biverkningar. Inom varje organsystem och frekvensgrupp presenteras biverkningarna efter fallande allvarlighetsgrad.
Biverkningarna bestämdes baserat på data från det kliniska utvecklingsprogrammet för apremilast och erfarenheter efter godkännandet för försäljning. Biverkningsfrekvenserna är de som rapporterades i behandlingsarmarna med apremilast i de fyra fas III-studierna på psoriasisartrit (PsA) (n=1 945) eller de två fas III-studierna på psoriasis (n=1 184), och i fas III-studien på Behçets sjukdom (n=207) (högsta frekvensen från någon av datapoolerna presenteras i tabell 2).
Frekvenserna definieras som mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000); ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 2. Sammanfattning av biverkningar vid psoriasisartrit (PsA), psoriasis och Behçets sjukdom
|
Organsystem |
Frekvens |
Biverkning |
|---|---|---|
|
Infektioner och infestationer |
Mycket vanliga |
Övre luftvägsinfektiona |
|
Vanliga |
Bronkit |
|
|
Nasofaryngit* |
||
|
Immunsystemet |
Mindre vanliga |
Överkänslighet |
|
Metabolism och nutrition |
Vanliga |
Nedsatt aptit* |
|
Psykiska störningar |
Vanliga |
Sömnlöshet |
|
Depression |
||
|
Mindre vanliga |
Suicidala tankar och beteenden |
|
|
Centrala och perifera nervsystemet |
Mycket vanliga |
Huvudvärk*,a |
|
Vanliga |
Migrän* |
|
|
Spänningshuvudvärk* |
||
|
Andningsvägar, bröstkorg och mediastinum |
Vanliga |
Hosta |
|
Magtarmkanalen |
Mycket vanliga |
Diarré* |
|
Illamående* |
||
|
Vanliga |
Kräkningar* |
|
|
Dyspepsi |
||
|
Täta tarmtömningar |
||
|
Övre buksmärta* |
||
|
Gastroesofagal refluxsjukdom |
||
|
Mindre vanliga |
Magtarmblödning |
|
|
Hud och subkutan vävnad |
Mindre vanliga |
Utslag |
|
Urtikaria |
||
|
Ingen känd frekvens |
Angioödem |
|
|
Muskuloskeletala systemet och bindväv |
Vanliga |
Ryggsmärta* |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Vanliga |
Trötthet |
|
Undersökningar |
Mindre vanliga |
Viktminskning |
*Minst en av dessa biverkningar rapporterades som allvarlig
a Frekvensen rapporterades som vanlig i PsA och psoriasis
Beskrivning av utvalda biverkningar
Psykiska störningar
I kliniska studier och efter marknadsförandet har mindre vanliga fall av suicidala tankar och beteenden rapporterats, medan fullbordat självmord har rapporterats efter marknadsförandet. Patienter och vårdgivare ska instrueras att meddela den förskrivande läkaren om eventuella suicidala tankar skulle förekomma (se avsnitt Varningar och försiktighet).
Viktförlust
Patientvikt mättes rutinmässigt i kliniska studier. Den genomsnittliga observerade viktförlusten hos patienter med PsA eller psoriasis som behandlades i upp till 52 veckor med apremilast var 1,99 kg. Totalt 14,3 % av de patienter som fick apremilast hade en observerad viktförlust på 5-10 %, medan 5,7 % av de patienter som fick apremilast hade en observerad viktförlust som var större än 10 %. Ingen av dessa patienter fick uppenbara kliniska konsekvenser till följd av viktförlust. Totalt 0,1 % av de patienter som behandlades med apremilast avbröt behandlingen på grund av biverkningen viktminskning. Den genomsnittliga observerade viktminskning hos patienter med Behçets sjukdom som behandlats med apremilast i 52 veckor var 0,52 kg. Totalt 11,8 % av patienterna som får apremilast observerade en viktminskning på mellan 5–10 % medan 3,8 % av patienterna som får apremilast observerade en viktminskning på mer än 10 %. Ingen av dessa patienter hade uppenbara kliniska följder på grund av viktminskning. Ingen av patienterna avbröt studien på grund av biverkning av viktminskning.
Se ytterligare varning i avsnitt Varningar och försiktighet för patienter som är underviktiga i början av behandlingen.
Särskilda populationer
Äldre patienter
Erfarenhet efter marknadsföring visar att äldre patienter ≥65 år kan ha en högre risk för komplikationer som svår diarré, illamående och kräkningar (se avsnitt Varningar och försiktighet).
Patienter med nedsatt leverfunktion
Säkerheten för apremilast har inte utvärderats hos patienter med PsA, psoriasis eller Behçets sjukdom med nedsatt leverfunktion.
Patienter med nedsatt njurfunktion
I de kliniska studierna hos patienter med PsA, psoriasis eller Behçets sjukdom var säkerhetsprofilen hos patienter med lätt nedsatt njurfunktion jämförbar med den hos patienter med normal njurfunktion. Säkerheten för apremilast har inte utvärderats i de kliniska studierna hos patienter med PsA, psoriasis eller Behçets sjukdom med måttligt eller gravt nedsatt leverfunktion.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Apremilast studerades hos friska försökspersoner med en högsta total daglig dos på 100 mg (som gavs som 50 mg två gånger dagligen) i 4,5 dagar utan tecken på dosbegränsande toxiciteter. Vid överdosering rekommenderas att patienten övervakas med avseende på tecken eller symtom på biverkningar och att lämplig symtomatisk behandling sätts in. Vid överdosering rekommenderas symtomatisk och stödjande vård.
Farmakodynamik
Verkningsmekanism
Apremilast, en oral småmolekylär hämmare av fosfodiesteras 4 (PDE4), verkar intracellulärt genom att modulera ett nätverk av proinflammatoriska och antiinflammatoriska mediatorer. PDE4 är ett cykliskt monofosfat (cAMP)-specifikt PDE och det PDE som dominerar i inflammatoriska celler. PDE4-hämning ökar de intracellulära cAMP-nivåerna, vilket i sin tur nedreglerar det inflammatoriska svaret genom att modulera uttrycket av TNF-α, IL-23, IL-17 och andra inflammatoriska cytokiner. Cykliskt AMP modulerar också nivåerna av antiinflammatoriska cytokiner såsom IL-10. Dessa pro- och antiinflammatoriska mediatorer har visats vara delaktiga i psoriasisartrit och psoriasis.
Farmakodynamisk effekt
I kliniska studier hos patienter med psoriasisartrit modulerade apremilast signifikant, men hämmade inte helt, plasmaproteinnivåerna av IL-1α, IL-6, IL-8, MCP-1, MIP-1β, mmP-3 och TNF-α. Efter 40 veckors behandling med apremilast sågs en minskning av plasmaproteinnivåerna av IL-17 och IL-23 och en ökning av IL-10. I kliniska studier hos patienter med psoriasis minskade apremilast epidermal tjocklek hos hud med lesion, infiltration av inflammatoriska celler och uttryck av proinflammatoriska gener, inklusive dem för inducerbart kväveoxidsyntas (iNOS), IL-12/IL-23p40, IL-17A, IL-22 och IL-8. I kliniska studier av patienter med Behçets sjukdom som behandlas med apremilast, fanns det en betydande positiv koppling mellan ändringen i plasma TNF-α och klinisk effekt, uppmätt såsom antalet munsår.
Apremilast som administrerades i doser på upp till 50 mg två gånger dagligen förlängde inte QT-intervallet hos friska försökspersoner.
Klinisk effekt och säkerhet
Psoriasisartrit
Säkerhet och effekt för apremilast utvärderades i tre randomiserade, dubbelblinda, placebokontrollerade multicenterstudier (studierna PALACE 1, PALACE 2 och PALACE 3) med likartad design på vuxna patienter med aktiv PsA (≥3 svullna leder och ≥3 ömma leder) trots tidigare behandling med småmolekylära eller biologiska DMARDs. Totalt 1 493 patienter randomiserades och behandlades med antingen placebo, apremilast 20 mg eller apremilast 30 mg som gavs oralt två gånger dagligen.
Patienterna i dessa studier hade haft en diagnostiserad PsA i minst 6 månader. I PALACE 3 krävdes även en kvalificerande psoriatisk hudlesion (minst 2 cm i diameter). Apremilast användes som monoterapi (34,8 %) eller i kombination med stabila doser av småmolekylära DMARDs (65,2 %). Patienterna fick apremilast i kombination med ett eller flera av följande läkemedel: metotrexat (MTX ≤25 mg/vecka, 54,5 %), sulfasalazin (SSZ ≤2 g/dag, 9,0 %) och leflunomid (LEF ≤20 mg/dag, 7,4 %). Samtidig behandling med biologiska DMARDs, inklusive TNF-hämmare, var inte tillåtet. Patienter med varje subtyp av PsA rekryterades i de tre studierna, inklusive symmetrisk polyartrit (62,0 %), asymmetrisk oligoartrit (26,9 %), distal interfalangeal (DIP) ledartrit (6,2 %), mutilerande artrit (2,7 %) och övervägande spondylit (2,1 %). Patienter med preexisterande entesopati (63 %) eller preexisterande daktylit (42 %) rekryterades. Totalt 76,4 % av patienterna hade tidigare behandlats med enbart småmolekylära DMARDs och 22,4 % av patienterna hade tidigare behandlats med biologiska DMARDs, vilket inkluderar 7,8 % som hade fått terapisvikt med en tidigare biologisk DMARD. Mediandurationen av PsA-sjukdom var fem år.
Baserat på studiedesignen ansågs de patienter vars ömma och svullna leder inte hade förbättrats med minst 20 % vara icke-responders vid vecka 16. Placebobehandlade patienter som ansågs vara icke-responders re-randomiserades 1:1 på ett blint sätt till att få antingen apremilast 20 mg två gånger dagligen eller 30 mg två gånger dagligen. Vid vecka 24 bytte alla återstående placebobehandlade patienter till antingen apremilast 20 eller 30 mg två gånger dagligen. Efter 52 veckors behandling kunde patienterna fortsätta med öppen behandling med apremilast 20 mg eller 30 mg under studieförlängningen av PALACE 1, PALACE 2 och PALACE 3. Den totala behandlingstiden var då upp till 5 år (260 veckor).
Det primära effektmåttet var procentandelen patienter som uppnådde ACR (American College of Rheumatology) 20-svar vid vecka 16.
Behandling med apremilast resulterade i signifikanta förbättringar av tecken och symtom på PsA enligt uppskattning med svarskriterierna för ACR 20 jämfört med placebo vid vecka 16. Andelen patienter med ACR 20/50/70 (svar i studierna PALACE 1, PALACE 2 och PALACE 3, samt sammanslagna data för studierna PALACE 1, PALACE 2 och PALACE 3) för apremilast 30 mg två gånger dagligen vid vecka 16 visas i tabell 3. ACR 20/50/70-svaren kvarstod vid vecka 24.
Hos de patienter som initialt randomiserades till behandling med apremilast 30 mg två gånger dagligen bibehölls frekvenserna av ACR 20/50/70-svar till och med vecka 52 i de sammanslagna studierna PALACE 1, PALACE 2 och PALACE 3 (figur 1).
Tabell 3. Andel patienter med ACR svar i studierna PALACE 1, PALACE 2 och PALACE 3, samt sammanslagna studier vid vecka 16
|
PALACE 1 |
PALACE 2 |
PALACE 3 |
SAMMANSLAGNA |
|||||
|---|---|---|---|---|---|---|---|---|
|
Na |
Placebo +/- DMARDs N=168 |
Apremilast 30 mg två gånger dagligen +/- DMARDs N=168 |
Placebo +/- DMARDs N=159 |
Apremilast 30 mg två gånger dagligen +/- DMARDs N=162 |
Placebo +/- DMARDs N=169 |
Apremilast 30 mg två gånger dagligen +/- DMARDs N=167 |
Placebo +/- DMARDs N=496 |
Apremilast 30 mg två gånger dagligen +/-DMARDs N=497 |
|
ACR 20a | ||||||||
|
Vecka 16 |
19,0 % |
38,1 %** |
18,9 % |
32,1 %* |
18,3 % |
40,7 %** |
18,8 % |
37,0 %** |
|
ACR 50 | ||||||||
|
Vecka 16 |
6,0 % |
16,1 %* |
5,0 % |
10,5 % |
8,3 % |
15,0 % |
6,5 % |
13,9 %** |
|
ACR 70 | ||||||||
|
Vecka 16 |
1,2 % |
4,2 % |
0,6 % |
1,2 % |
2,4 % |
3,6 % |
1,4 % |
3,0 % |
*p≤0,01 för apremilast mot placebo
**p≤0,001 för apremilast mot placebo
a N är antalet patienter som randomiserades och behandlades
Figur 1. Andel svarande som uppnådde ACR 20/50/70 till och med vecka 52 i den sammanslagna analysen av studierna PALACE 1, PALACE 2 och PALACE 3 (NRI*)
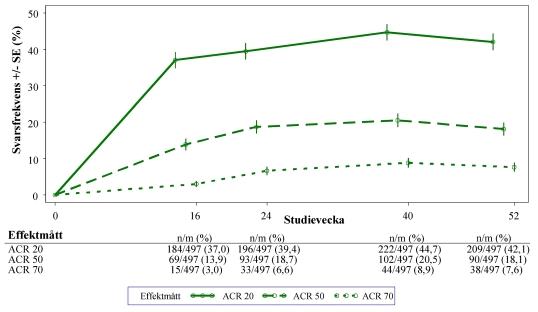
*NRI: Imputering av icke-svarande. Försökspersoner som avbröt tidigt, före tidpunkten, och försökspersoner som inte hade tillräckligt med data för ett slutgiltigt fastställande av svarsstatus vid tidpunkten räknas som icke-responders.
Av de 497 patienter som initialt randomiserades till att få apremilast 30 mg två gånger dagligen fick 375 (75 %) patienter fortfarande denna behandling vecka 52. Hos dessa patienter var ACR 20/50/70-svaren 57 %, 25 % respektive 11 % vid vecka 52. Av de 497 patienter som initialt randomiserades till att få apremilast 30 mg två gånger dagligen gick 375 (75 %) patienter med i studieförlängningen. Av dessa fick 221 patienter (59 %) fortfarande behandling vecka 260. ACR‑svaren bibehölls i de öppna studieförlängningarna i upp till 5 år.
De svar som observerades i gruppen som behandlades med apremilast var likartade hos de patienter som fick och inte fick samtidiga DMARDs, inklusive MTX. Patienter som tidigare behandlats med DMARDs eller biologiska läkemedel och som fick apremilast uppnådde ett högre ACR 20 svar vid vecka 16 än patienter som fick placebo.
Likartade ACR-svar observerades hos patienter med olika subtyper av PsA, inklusive DIP. Antalet patienter med subtyperna mutilerande artrit och övervägande spondylit var för litet för att möjliggöra meningsfull utvärdering.
I PALACE 1, PALACE 2 och PALACE 3 var förbättringar i sjukdomsaktivitetsskala (DAS) 28 C-reaktivt protein (CRP) och andelen patienter som uppnådde ett modifierat PsA-svarskriterium (PsARC) större i apremilastgruppen jämfört med placebo vid vecka 16 (nominellt p-värde p≤0,0004 respektive p-värde ≤0,0017). Dessa förbättringar kvarstod vid vecka 24. Hos patienter som kvarstod på den apremilastbehandling till vilken de hade randomiserats vid studiestart bibehölls DAS28 (CRP)-poängen och PsARC-svaret till och med vecka 52.
Vid vecka 16 och 24 sågs förbättringar i parametrar för perifer aktivitet som är karakteristisk för psoriasisartrit (t.ex. antal svullna leder, antal smärtande/ömma leder, daktylit och entesit) och i hudmanifestationer av psoriasis hos de apremilastbehandlade patienterna. Hos patienter som kvarstod på den apremilastbehandling till vilken de hade randomiserats vid studiestart bibehölls dessa förbättringar till och med vecka 52.
Det kliniska svaret bibehölls i samma parametrar för perifer aktivitet och i hudmanifestationer av psoriasis i de öppna studieförlängningarna under upp till 5 års behandling.
Fysisk funktion och hälsorelaterad livskvalitet
Apremilastbehandlade patienter visade statistiskt signifikant förbättring av fysisk funktion enligt bedömning av förändring från studiestart av funktionsnedsättningsindexet i enkäten för hälsoutvärdering (HAQ-DI) jämfört med placebo vid vecka 16 i PALACE 1, PALACE 2 och PALACE 3, samt i de sammanslagna studierna. Förbättringen av HAQ-DI-poängen kvarstod vid vecka 24.
Hos patienter som initialt randomiserades till att behandlas med apremilast 30 mg två gånger dagligen var förändringen från studiestart av HAQ-DI-poängen vid vecka 52 -0,333 i gruppen som fick apremilast 30 mg två gånger dagligen i en sammanslagen analys av den öppna fasen av studierna PALACE 1, PALACE 2 och PALACE 3.
I studierna PALACE 1, PALACE 2 och PALACE 3 visades signifikanta förbättringar av hälsorelaterad livskvalitet mätt som förändringar från studiestart i domänen för fysisk funktion (PF) i den korta hälsoenkäten version 2 (SF-36v2) och av poäng vid funktionell utvärdering av trötthet vid behandling av kronisk sjukdom (FACIT-fatigue) hos patienter som behandlades med apremilast jämfört med placebo vid vecka 16 och 24. Hos patienter som kvarstod på den apremilastbehandling till vilken de hade randomiserats vid studiestart bibehölls förbättringen av fysisk funktion och FACIT-fatigue till och med vecka 52.
Förbättringarna av den fysiska funktionen med HAQ-DI och SF36v2PF-domänen samt poäng för FACIT-fatigue bibehölls i de öppna studieförlängningarna under upp till 5 års behandling.
Psoriasis
Säkerhet och effekt för apremilast utvärderades i två randomiserade, dubbelblinda, placebokontrollerade multicenterstudier (studierna ESTEEM 1 och ESTEEM 2) som rekryterade totalt 1 257 patienter med måttlig till svår plackpsoriasis där ≥10 % av kroppsytan (BSA) var påverkad, poäng för utbredning och svårighetsgrad av psoriasis (PASI) var ≥12, läkarens statiska totala bedömning (sPGA) var ≥3 (måttlig eller svår), och de var kandidater för fototerapi eller systemisk behandling.
Dessa studier hade en likartad design till och med vecka 32. I båda studierna randomiserades patienterna 2:1 till att få apremilast 30 mg två gånger dagligen eller placebo i 16 veckor (placebokontrollerad fas) och vecka 16-32 fick alla patienter apremilast 30 mg två gånger dagligen (underhållsfas). Under den randomiserade utsättningsfasen (vecka 32-52) re-randomiserades de patienter som ursprungligen randomiserats till att få apremilast och som uppnått minst 75 % reduktion av sin PASI-poäng (PASI-75) (ESTEEM 1) eller 50 % reduktion av sin PASI-poäng (PASI-50) (ESTEEM 2) vid vecka 32 till att få antingen placebo eller apremilast 30 mg två gånger dagligen. De patienter som re-randomiserats till att få placebo och som förlorat PASI‑75-svaret (ESTEEM 1) eller förlorat 50 % av PASI-förbättringen vid vecka 32 jämfört med utgångsvärdet (ESTEEM 2) behandlades på nytt med apremilast 30 mg två gånger dagligen. De patienter som inte uppnått det avsedda PASI-svaret vid vecka 32, eller som initialt randomiserats till att få placebo, kvarstod på apremilast till vecka 52. Användning av lågpotenta topikala kortikosteroider i ansikte, armhålor och ljumskar, schampo innehållande stenkolstjära och/eller hårbottenpreparat innehållande salicylsyra tilläts i alla studierna. Vid vecka 32 tilläts dessutom försökspersoner som inte uppnådde ett PASI‑75‑svar i ESTEEM 1 eller ett PASI-50-svar i ESTEEM 2 att använda topikala psoriasisbehandlingar och/eller fototerapi förutom behandlingen med apremilast 30 mg två gånger dagligen.
Efter 52 veckors behandling kunde patienterna fortsätta med öppen behandling med apremilast 30 mg under studieförlängnigen av ESTEEM 1 och ESTEEM 2. Den totala behandlingstiden var då upp till 5 år (260 veckor).
I båda studierna var det primära effektmåttet andelen patienter som uppnådde PASI‑75 vid vecka 16. Det viktigaste sekundära effektmåttet var andelen patienter som uppnådde sPGA-poängen 0 eller 1 vid vecka 16.
Den genomsnittliga PASI-poängen vid studiestart var 19,07 (median 16,80) och andelen patienter med sPGA-poängen 3 (måttlig) och 4 (svår) vid studiestart var 70,0 % respektive 29,8 % med ett genomsnittligt BSA-engagemang på 25,19 % (median 21,0 %). Cirka 30 % av alla patienter hade tidigare fått fototerapi och 54 % hade tidigare fått konventionell systemisk och/eller biologisk behandling mot psoriasis (inklusive behandlingssvikt), där 37 % tidigare fick konventionell systemisk behandling och 30 % tidigare fick biologisk behandling. Cirka en tredjedel av patienterna hade inte tidigare fått fototerapi, konventionell systemisk eller biologisk behandling. Totalt 18 % av patienterna hade en anamnes med psoriasisartrit.
Andelen patienter som uppnådde PASI-50-, PASI-75- och PASI-90-svar, samt sPGA-poängen 0 eller 1, visas i tabell 4 nedan. Behandling med apremilast resulterade i signifikant förbättring av måttlig till svår plackpsoriasis, vilket visades med andelen patienter med PASI-75-svar vid vecka 16 jämfört med placebo. Klinisk förbättring mätt med sPGA-, PASI-50- och PASI-90-svar visades också vid vecka 16. Dessutom visade apremilast behandlingsnytta vid flera manifestationer av psoriasis, inklusive klåda, nagelsjukdom, hårbottenengagemang och livskvalitetsmått.
Tabell 4. Kliniskt svar vid vecka 16 i studierna ESTEEM 1 och ESTEEM 2 (FASa LOCFb)
|
ESTEEM 1 |
ESTEEM 2 |
|||
|---|---|---|---|---|
|
Placebo |
30 mg två gånger dagligen apremilast* |
Placebo |
30 mg två gånger dagligen apremilast* |
|
|
N |
282 |
562 |
137 |
274 |
|
PASIc 75, n (%) |
15 (5,3) |
186 (33,1) |
8 (5,8) |
79 (28,8) |
|
sPGA-poäng 0 eller 1d , n (%) |
11 (3,9) |
122 (21,7) |
6 (4,4) |
56 (20,4) |
|
PASI 50, n (%) |
48 (17,0) |
330 (58,7) |
27 (19,7) |
152 (55,5) |
|
PASI 90, n (%) |
1 (0,4) |
55 (9,8) |
2 (1,5) |
24 (8,8) |
|
Procentuell förändring BSAe (%) medelvärde ± SD |
−6,9 ± 38,95 |
−47,8 ± 38,48 |
−6,1 ± 47,57 |
−48,4 ± 40,78 |
|
Förändring av klåda VASf (mm), medelvärde ± SD |
−7,3 ± 27,08 |
−31,5 ± 32,43 |
−12,2 ± 30,94 |
−33,5 ± 35,46 |
|
Förändring av DLQIg, medelvärde ± SD |
−2,1 ± 5,69 |
−6,6 ± 6,66 |
−2,8 ± 7,22 |
−6,7 ± 6,95 |
|
Förändring av SF 36 MCSh, medelvärde ± SD |
−1,02 ± 9,161 |
2,39 ± 9,504 |
0,00 ± 10,
|
2,58 ± 10,129 |
* p <0,0001 för apremilast mot placebo, utom för PASI 90 i ESTEEM 2 och förändring av SF-36 MCS som hade p=0,0042 respektive p=0,0078.
a FAS = fullständig analysserie
b LOCF= senaste observation som överförts
c PASI = utbredning och svårighetsgrad av psoriasis
d sPGA = läkarens statiska totala bedömning
e BSA = kroppsyta
f VAS = visuell analog skala; 0 = bäst, 100 = sämst
g DLQI = dermatologiskt livskvalitetsindex; 0 = bäst, 30 = sämst
h SF 36 MCS = kort 36-punkters hälsoenkät för studie av medicinsk utfall, sammanfattning av mental komponent
Den kliniska nyttan av apremilast visades i flera subgrupper definierade med demografiska och kliniska sjukdomskarakteristika vid studiestart (inklusive duration av psoriasissjukdom och patienter med anamnes på psoriasisartrit). Den kliniska nyttan av apremilast visades också oberoende av tidigare användning av psoriasisläkemedel och svar på tidigare psoriasisbehandlingar. Likartade svarsfrekvenser observerades i alla viktklasser.
Svaret på apremilast var snabbt, med signifikant större förbättringar av tecken och symtom på psoriasis, inklusive PASI, hudbesvär/smärta och klåda, jämfört med placebo vid vecka 2. I allmänhet uppnåddes PASI-svar vid vecka 16 och bibehölls till och med vecka 32.
I båda studierna förblev den genomsnittliga, procentuella förbättringen av PASI från studiestart stabil under den randomiserade utsättningsfasen hos patienter som re-randomiserades till att få apremilast vid vecka 32 (tabell 5).
Tabell 5. Kvarstående effekt hos patienter som randomiserades till att få apremilast 30 mg två gånger dagligen vid vecka 0 och som re-randomiserades till att få apremilast 30 mg två gånger dagligen vid vecka 32 till vecka 52
|
ESTEEM 1 |
ESTEEM 2 |
||
|---|---|---|---|
|
Tidpunkt |
Patienter som uppnådde PASI-75 vid vecka 32 |
Patienter som uppnådde PASI-50 vid vecka 32 |
|
|
Procentuell förändring av PASI från studiestart, medelvärde (%) ± SDa |
Vecka 16 |
−77,7 ± 20,30 |
−69,7 ± 24,23 |
|
Vecka 32 |
−88 ± 8,30 |
−76,7 ± 13,42 |
|
|
Vecka 52 |
−80,5 ± 12,60 |
−74,4 ± 18,91 |
|
|
Förändring av DLQI från studiestart, medelvärde ± SDa |
Vecka 16 |
−8,3 ± 6,26 |
−7,8 ± 6,41 |
|
Vecka 32 |
−8,9 ± 6,68 |
−7,7 ± 5,92 |
|
|
Vecka 52 |
−7,8 ± 5,75 |
−7,5 ± 6,27 |
|
|
Andel försökspersoner med hårbottenpsoriasis, PGA (ScPGA) 0 eller 1, n/N (%)b |
Vecka 16 |
40/48 (83,3) |
21/37 (56,8) |
|
Vecka 32 |
39/48 (81,3) |
27/37 (73,0) |
|
|
Vecka 52 |
35/48 (72,9) |
20/37 (54,1) |
a Inkluderar försökspersoner som re-randomiserades till att få apremilast 30 mg två gånger dagligen vid vecka 32 med ett värde vid studiestart och ett värde efter studiestart vid den utvärderade studieveckan.
bN baseras på försökspersoner med måttlig eller svårare hårbottenpsoriasis vid studiestart, vilka re-randomiserades till att få apremilast 30 mg två gånger dagligen vid vecka 32. Patienter med saknade data räknades som icke-responders.
I studien ESTEEM 1 hade cirka 61 % av de patienter som re-randomiserades till att få apremilast vid vecka 32 ett PASI-75-svar vid vecka 52. Av de patienter med minst ett PASI-75-svar som re-randomiserades till att få placebo vid vecka 32 under en randomiserad utsättningsfas hade 11,7 % PASI-75-svar vid vecka 52. Mediantiden till förlust av PASI-75-svar hos de patienter som randomiserades till att få placebo var 5,1 veckor.
I studien ESTEEM 2 hade cirka 80,3% av de patienter som re-randomiserades till att få apremilast vid vecka 32 ett PASI-50-svar vid vecka 52. Av de patienter med minst ett PASI-50-svar som re randomiserades till att få placebo vid vecka 32 hade 24,2% PASI‑50-svar vid vecka 52. Mediantiden till förlust av 50 % av deras PASI förbättring vid vecka 32 var 12,4 veckor.
Efter randomiserad utsättning av behandling vid vecka 32 återfick cirka 70 % av patienterna i studien ESTEEM 1 och 65,6 % av patienterna i ESTEEM 2 PASI-75-svar (ESTEEM 1) eller PASI-50-svar (ESTEEM 2) efter återinsättning av apremilastbehandling. På grund av studiedesignen varierade durationen av den upprepade behandlingen från 2,6 till 22,1 veckor.
I studien ESTEEM 1 tilläts de patienter som randomiserats till att få apremilast vid studiestart och som inte uppnått ett PASI-75-svar vid vecka 32 att använda samtidiga topiska behandlingar och/eller UVB‑fototerapi mellan vecka 32 och 52. Av dessa patienter uppnådde 12 % ett PASI-75-svar vid vecka 52 med apremilast plus topisk behandling och/eller fototerapi.
I studierna ESTEEM 1 och ESTEEM 2 observerades signifikanta förbättringar (reduktioner) av nagelpsoriasis mätt som genomsnittlig procentuell förändring av svårighetsgraden av nagelpsoriasis (NAPSI) från studiestart hos patienter som fick apremilast jämfört med placebobehandlade patienter vid vecka 16 (p<0,0001 respektive p=0,0052). Ytterligare förbättringar av nagelpsoriasis observerades vid vecka 32 hos patienter som kontinuerligt behandlades med apremilast.
I studierna ESTEEM 1 och ESTEEM 2 observerades signifikanta förbättringar av hårbottenpsoriasis av minst måttlig svårighetsgrad (≥3) mätt som andelen patienter som uppnådde läkarens totala bedömning av psoriasis i hårbotten (ScPGA) fri från (0) eller minimal (1) vid vecka 16 hos patienter som fick apremilast jämfört med placebobehandlade patienter (p<0,0001 för båda studierna). Förbättringarna bibehölls i allmänhet hos patienter som re randomiserades till att få apremilast vid vecka 32 till och med vecka 52 (tabell 5).
I studierna ESTEEM 1 och ESTEEM 2 visades signifikanta förbättringar av livskvaliteten mätt med dermatologiskt livskvalitetsindex (DLQI) och SF-36v2MCS hos patienter som fick apremilast jämfört med placebobehandlade patienter (tabell 4). Förbättringarna av DLQI bibehölls till och med vecka 52 hos försökspersoner som re-randomiserades till att få apremilast vid vecka 32 (tabell 5). I studien ESTEEM 1 uppnåddes dessutom signifikanta förbättringar av arbetsbegränsningarna (WLQ-25) hos patienter som fick apremilast jämfört med placebo.
Av de 832 patienter som initialt randomiserades till att få apremilast 30 mg två gånger dagligen gick 443 patienter (53 %) med i de öppna förlängningsstudierna ESTEEM 1 och ESTEEM 2. Av dessa 115 patienter stod (26 %) fortfarande på behandling vecka 260. För patienter som stod kvar på apremilast under de öppna förlängningsstudierna ESTEEM 1 och ESTEEM 2, kvarstod generellt förbättringarna av PASI-poäng, påverkad BSA, klåda, naglar och livskvalitet i upp till 5 år.
Den långsiktiga säkerheten för apremilast 30 mg två gånger dagligen hos patienter med psoriasisartrit och psoriasis bedömdes för en total behandlingsduration på 5 år. Den långsiktiga erfarenheten i öppna förlängningsstudier med apremilast var generellt jämförbara med 52-veckorsstudierna.
Behçets sjukdom
Säkerheten och effekten av apremilast utvärderades i en fas 3, multicenter, randomiserad, placebokontrollerad studie (RELIEF) hos vuxna patienter med aktiv Behçets sjukdom med munsår. Patienterna hade tidigare behandlats med minst ett icke-biologiskt läkemedel mot Behçets sjukdom för sår i munslemhinnan och var kandidater för systemisk behandling. Samtidig behandling för Behçets sjukdom tilläts inte. Den studerade populationen uppfyllde International Study Groups (ISG) kriterier för Behçets sjukdom med en historik av hudlesioner (98,6 %), genitala sår (90,3 %), muskuloskeletala manifestationer (72,5 %), ögonmanifestationer (17,4 %), manifestationer i centrala nervsystemet (9,7 %), GI-manifestationer (9,2 %), epididymit (2,4 %) och vaskulär involvering (1,4 %). Patienter med allvarliga fall av Behçets sjukdom, definierat som de med aktiva större organkomplikationer (t.ex. meningoencefalit eller lungartäraneurysm), exkluderades.
Totalt 207 patienter med Behçets sjukdom randomiserades 1:1 till att få antingen apremilast 30 mg två gånger om dagen (n=104) eller placebo (n=103) i 12 veckor (placebokontrollerad fas) och från vecka 12 till 64, fick alla patienter apremilast 30 mg två gånger om dagen (aktiv behandlingsfas). Patienterna var i varierande åldrar, från 19 till 72 år, med en medelålder på 40 år. Den genomsnittliga varaktigheten för Behçets sjukdom var 6,84 år. Alla patienter hade en anamnes med återkommande munsår och hade minst 2 munsår vid screening och randomisering. Den genomsnittliga baslinjen för antal munsår var 4,2 och 3,9 i apremilast- respektive placebogrupperna.
Det primära effektmåttet var arean under kurvan (AUC) för antalet munsår från baslinjen t.o.m. vecka 12. Sekundära effektmått inkluderade andra åtgärder av munsår: visuell analog skala (VAS) för smärta vid munsår, andelen patienter som är fria från munsår (komplett respons), tiden till förbättring av munsår, och andelen patienter som ser förbättring av munsår vid vecka 6, och som förblir fria från munsår vid varje besök under minst 6 ytterligare veckor under den 12 veckor långa placebokontrollerade behandlingsfasen. Andra effektmått inkluderade BSAS (Behçet's Syndrome Activity Score), BDCAF (Behçet's Disease Current Activity Form), inklusive BDCAI-poäng (Behçet's Disease Current Activity Index), patientens uppfattning av sjukdomsaktivitet, läkarens övergripande uppfattning av sjukdomsaktivitet och BD QoL (Behçet's Disease Quality of Life Questionnaire).
Mätning av munsår
Apremilast 30 mg två gånger dagligen resulterade i en signifikant förbättring av munsår, som påvisats med AUC för antalet munsår från baslinje t.o.m. vecka 12 (p< 0,0001), jämfört med placebo.
Betydande förbättringar vid andra åtgärder av munsår påvisades vid vecka 12.
Tabell 6. Klinisk respons av munsår vid vecka 12 i RELIEF (ITT-population)
|
Effektmåtta |
Placebo N=103 |
Apremilast 30 mg BID N=104 |
|
AUCb för antalet munsår från baslinjen t.o.m. vecka 12 (MI) |
LS-medelvärde 222,14 |
LS-medelvärde 129,54 |
|
Förändring från baslinjen i smärtan från munsår mätt genom VASc vid vecka 12 (MMRM) |
LS-medelvärde -18,7 |
LS-medelvärde -42,7 |
|
Andelen patienter som observerade en förbättring (fri från munsår) vid vecka 6, och som förblev fria från munsår vid varje besök under minst 6 ytterligare veckor under den 12 veckor långa placebokontrollerade behandlingsfasen |
4,9 % |
29,8% |
|
Mediantid (veckor) till förbättring av munsår under den placebokontrollerade behandlingsfasen |
8,1 veckor |
2,1 veckor |
|
Andel patienter med komplett munsårrespons vid vecka 12 (NRI) |
22,3 % |
52,9% |
|
Andel patienter med partiell munsårresponsd vid vecka 12 (NRI) |
47,6 % |
76,0% |
ITT=avsikt att behandla; LS=minsta kvadrat; MI=multipel imputering; MMRM=modell för blandade effekter vid upprepade mätningar; NRI=icke-svarande imputering; BID=två gånger dagligen.
a p-värde < 0,0001 för alla apremilast kontra placebo
b AUC = area under kurvan.
c VAS=visual analog skala; 0=ingen smärta, 100=värsta tänkbara smärta.
d Partiellt munsårssvar = antal munsår minskade med ≥ 50 % efter baslinjen (explorativa analysen); nominellt p‑värde – < 0,0001
Av de 104 patienter som ursprungligen randomiserades till apremilast 30 mg två gånger om dagen, fortsatte 75 patienter (ungefär 72 %) att genomgå denna behandling vid vecka 64. En signifikant minskning av det genomsnittliga antalet munsår och smärtan på grund av munsår observerades i behandlingsgruppen som tog apremilast 30 mg två gånger om dagen jämfört med placebogruppen vid varje besök, så tidigt som vecka 1, till och med vecka 12 för antal munsår (p≤0,0015) och för smärta på grund av munsår (p≤0,0035). Bland patienter som behandlades kontinuerligt med apremilast och var kvar i studien, observerades förbättringar av munsår och minskad smärta på grund av munsår under vecka 64 (figur 2 och 3).
Bland patienter som ursprungligen randomiserades till apremilast 30 mg två gånger om dagen och som var kvar i studien, bibehölls andelen patienter med komplett och partiell munsårsrespons till vecka 64 (53,3 % och 76,0 % respektive).
Figur 2. Genomsnittligt antal munsår vid tidpunkt i vecka 64 (ITT-population; DAO)
ITT = avsikt att behandla; DAO = data som observerats.
APR 30 BID = apremilast 30 mg två gånger om dagen.
Obs! Placebo eller apremilast 30 mg två gånger om dagen indikerar den behandlingsgrupp i vilken patienter randomiserades. Patienter i placebogruppen som bytt till apremilast 30 två gånger om dagen vid vecka 12.
Uppföljningstiden var 4 veckor efter patienter fullföljde vecka 64 eller 4 veckor efter patienter avbröt behandlingen innan vecka 64.
Figur 3. Genomsnittlig förändring från baslinjen i smärta på grund av munsår på en visuell analog skala vid tidpunkt i vecka 64 (ITT-population; DAO)
APR 30 BID = apremilast två gånger dagligen; ITT = avsikt att behandla; DAO = data som observerats
Obs! Placebo eller apremilast 30 mg två gånger om dagen indikerar den behandlingsgrupp i vilken patienter randomiserades. Patienter i placebogruppen som bytt till apremilast 30 två gånger om dagen vid vecka 12.
Uppföljningstiden var 4 veckor efter patienter fullföljde vecka 64 eller 4 veckor efter patienter avbröt behandlingen innan vecka 64.
Övergripande förbättringar av Behçets sjukdom
Apremilast 30 mg två gånger dagligen, jämfört med placebo, gav en betydande minskning av total sjukdomsaktivitet, vilket bevisas av genomsnittlig förändring från baslinjen vid vecka 12 i BSAS (p<0,0001) och BDCAF (BDCAI, patientens uppfattning av sjukdomsaktivitet, och läkarens övergripande uppfattning av sjukdomsaktivitet; p‑värden ≤0,0335 för alla tre komponenter).
Bland patienter som ursprungligen randomiserades till apremilast 30 mg två gånger om dagen och som var kvar i studien, bibehölls förbättringar (genomsnittlig förändring från baslinjen) i både BSAS och BDCAF vid vecka 64.
Förbättringar i livskvalitet
Apremilast 30 mg två gånger dagligen, jämfört med placebo, gav betydande förbättring av livskvalitet (QoL) vid vecka 12, vilket bevisas av frågeformuläret för livskvalitet vid Behçets sjukdom (p=0,0003).
Bland patienter som ursprungligen randomiserades till apremilast 30 mg två gånger om dagen och som var kvar i studien, vid vecka 64 bibehölls förbättringar av livskvalitet vid Behçets sjukdom.
Farmakokinetik
Absorption
Apremilast absorberas väl med en absolut oral biotillgänglighet på cirka 73 %, och maximala plasmakoncentrationer (Cmax) uppnås efter en mediantid (tmax) på cirka 2,5 timmar. Farmakokinetiken för apremilast är linjär med en dosproportionell ökning av systemisk exponering i dosområdet 10 till 100 mg dagligen. Ackumuleringen är minimal när apremilast administreras en gång dagligen och cirka 53 % hos friska försökspersoner och 68 % hos patienter med psoriasis vid administrering två gånger dagligen. Administrering tillsammans med mat förändrar inte biotillgängligheten och därför kan apremilast administreras med eller utan mat.
Distribution
Proteinbindningen av apremilast i human plasma är cirka 68 %. Den genomsnittliga skenbara distributionsvolymen (Vd) är 87 liter, vilket tyder på extravaskulär distribution.
Metabolism
Apremilast metaboliseras i stor utsträckning via både CYP- och icke-CYP-medierade vägar inklusive oxidation, hydrolys och konjugering, vilket tyder på att hämning av en enda elimineringsväg sannolikt inte orsakar någon markant läkemedelsinteraktion. Oxidativ metabolism av apremilast medieras huvudsakligen av CYP3A4, med mindre bidrag från CYP1A2 och CYP2A6. Apremilast är den huvudsakliga cirkulerande komponenten efter oral administrering. Apremilast genomgår omfattande metabolism där endast 3 % och 7 % av den administrerade modersubstansen återfinns i urin respektive feces. Den huvudsakliga cirkulerande aktiva metaboliten är glukuronidkonjugatet av O-demetylerat apremilast (M12). I överensstämmelse med att apremilast är ett substrat till CYP3A4, minskar exponeringen av apremilast när det administreras tillsammans med rifampicin, en stark inducerare av CYP3A4.
In vitro är apremilast inte en hämmare eller inducerare av cytokrom P450-enzymer. Därför är det inte sannolikt att apremilast som administreras tillsammans med substrat till CYP-enzymer påverkar elimineringen och exponeringen av aktiva substanser som metaboliseras av CYP-enzymer.
In vitro är apremilast ett substrat och en svag hämmare av P-glykoprotein (IC50 >50 µM), men kliniskt relevanta läkemedelsinteraktioner medierade via P-gp förväntas inte förekomma.
In vitro har apremilast liten eller ingen hämmande effekt (IC50 >10 µM) på organisk anjontransportör (OAT)1 och OAT3, organisk anjontransportör (OCT)2, organisk anjontransporterande polypeptid (OATP)1B1 och OATP1B3, eller bröstcancerresistent protein (BCRP) och är inte substrat till dessa transportörer. Därför är kliniskt relevanta läkemedelsinteraktioner inte sannolika när apremilast administreras tillsammans med läkemedel som är substrat till eller hämmare av dessa transportörer.
Eliminering
Plasmaclearance av apremilast är i genomsnitt cirka 10 liter/timme hos friska försökspersoner, med en terminal elimineringshalveringstid på cirka 9 timmar. Efter oral administrering av radioaktivt märkt apremilast återfinns cirka 58 % och 39 % av radioaktiviteten i urin respektive feces, där cirka 3 % och 7 % av den radioaktiva dosen återfinns som apremilast i urin respektive feces.
Äldre patienter
Apremilast studerades hos unga och äldre friska försökspersoner. Vid exponering hos äldre försökspersoner (65 till 85 år) har apremilast cirka 13 % högre AUC och cirka 6 % högre Cmax än hos unga försökspersoner (18 till 55 år). Det finns begränsade farmakokinetiska data från försökspersoner som är äldre än 75 år i kliniska prövningar. Ingen dosjustering är nödvändig för äldre patienter.
Nedsatt njurfunktion
Det finns ingen viktig skillnad i farmakokinetiken för apremilast mellan försökspersoner med lätt eller måttligt nedsatt njurfunktion och matchande friska försökspersoner (N=8 vardera). Resultaten ger stöd för att ingen dosjustering behövs hos patienter med lätt och måttligt nedsatt njurfunktion. Apremilastdosen ska reduceras till 30 mg en gång dagligen hos patienter med gravt nedsatt njurfunktion (eGFR mindre än 30 ml/min/1,73 m2 eller CLcr <30 ml/min). Hos åtta försökspersoner med gravt nedsatt njurfunktion till vilka en engångsdos på 30 mg apremilast administrerades, ökade AUC och Cmax för apremilast med cirka 89 % respektive 42 %.
Nedsatt leverfunktion
Farmakokinetiken för apremilast och dess huvudsakliga metabolit M12 påverkas inte av måttligt eller gravt nedsatt leverfunktion. Ingen dosjustering är nödvändig för patienter med nedsatt leverfunktion.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi och allmäntoxicitet visade inte några särskilda risker för människa. Det finns inget belägg för immuntoxisk, hudirriterande eller fototoxisk potential.
Fertilitet och tidig embryoutveckling
I en studie av fertilitet hos hanmöss gav apremilast i orala doser på 1, 10, 25 och 50 mg/kg/dag inga effekter på hanarnas fertilitet; ingen observerad biverkningsnivå (NOAEL) för hanarnas fertilitet var mer än 50 mg/kg/dag (3 gånger klinisk exponering).
I en kombinerad toxicitetsstudie av fertilitet och embryofetal utveckling hos honmöss med orala doser på 10, 20, 40 och 80 mg/kg/dag observerades en förlängning av estruscyklerna och längre tid till parning vid 20 mg/kg/dag och däröver; trots detta parade sig alla möss och dräktighetsfrekvenserna påverkades inte. Ingen observerad effektnivå (NOEL) för honornas fertilitet var 10 mg/kg/dag (1,0 gånger klinisk exponering).
Embryofetal utveckling
I en kombinerad toxicitetsstudie av fertilitet och embryofetal utveckling hos honmöss med orala doser på 10, 20, 40 och 80 mg/kg/dag ökade de absoluta och/eller relativa hjärtvikterna hos moderdjuren vid 20, 40 och 80 mg/kg/dag. Ökat antal tidiga resorptioner och minskat antal ossifierade tarsalben observerades vid 20, 40 och 80 mg/kg/dag. Minskade fostervikter och försenad ossifikation av supraoccipitalbenet i skallen observerades vid 40 och 80 mg/kg/dag. Maternell och utvecklingsmässig NOEL hos mus var 10 mg/kg/dag (1,3 gånger klinisk exponering).
I en toxicitetsstudie av embryofetal utveckling hos apa resulterade orala doser på 20, 50, 200 och 1 000 mg/kg/dag i en dosrelaterad ökning av prenatal förlust (aborter) vid doser på 50 mg/kg/dag och däröver; ingen testsubstansrelaterad effekt på prenatal förlust observerades vid 20 mg/kg/dag (1,4 gånger klinisk exponering).
Pre- och postnatal utveckling
I en pre- och postnatal studie administrerades apremilast oralt till dräktiga honmöss i doser på 10, 80 och 300 mg/kg/dag från gestationsdag (GD) 6 till dag 20 av laktationen. Minskningar av maternell kroppsvikt och viktökning, samt ett dödsfall i samband med svårighet att föda ungarna, observerades vid 300 mg/kg/dag. Fysiska tecken på maternell toxicitet i samband med födande av ungar observerades hos en mus vid vardera av 80 och 300 mg/kg/dag. Ökade peri- och postnatala dödsfall hos ungarna och minskade kroppsvikter hos ungarna under de första laktationsveckorna observerades vid ≥80 mg/kg/dag (≥4,0 gånger klinisk exponering). Det förekom inga apremilastrelaterade effekter på dräktighetsduration, antal dräktiga möss i slutet av gestationsperioden, antal möss som födde en kull ungar eller några utvecklingseffekter hos ungarna efter dag 7 postnatalt. Det är sannolikt att de utvecklingseffekter hos ungarna som observerades under den första veckan av den postnatala perioden hade samband med den apremilastrelaterade toxiciteten hos ungarna (minskad vikt och livsduglighet hos ungarna) och/eller bristande modersomsorg (högre incidens av ingen mjölk i ungarnas magsäck). Alla utvecklingseffekter observerades under den första veckan av den postnatala perioden; inga apremilastrelaterade effekter sågs under de återstående perioderna före och efter avvänjning, inklusive sexuell mognad, beteende, parning, fertilitet och uterusparametrar. NOEL hos mus för maternell toxicitet och F1-generationen var 10 mg/kg/dag (1,3 gånger klinisk AUC).
Karcinogenicitetsstudier
Karcinogenicitetsstudier på mus och råtta visade inga tecken på karcinogenicitet som hade samband med behandling med apremilast.
Gentoxicitetsstudier
Apremilast är inte gentoxiskt. Apremilast inducerade inte mutationer i Ames test eller kromosomavvikelser hos odlade humana lymfocyter från perifert blod i närvaro eller frånvaro av metabolisk aktivering. Apremilast var inte klastogent i ett mikrokärntest på mus in vivo i doser på upp till 2 000 mg/kg/dag.
Övriga studier
Det finns inget belägg för immuntoxisk, hudirriterande eller fototoxisk potential.
Innehåll
Kvalitativ och kvantitativ sammansättning
Otezla 10 mg filmdragerade tabletter
Varje filmdragerad tablett innehåller 10 mg apremilast.
Hjälpämne(n) med känd effekt
Varje filmdragerad tablett innehåller 57 mg laktos (som laktosmonohydrat).
Otezla 20 mg filmdragerade tabletter
Varje filmdragerad tablett innehåller 20 mg apremilast.
Hjälpämne(n) med känd effekt
Varje filmdragerad tablett innehåller 114 mg laktos (som laktosmonohydrat).
Otezla 30 mg filmdragerade tabletter
Varje filmdragerad tablett innehåller 30 mg apremilast.
Hjälpämne(n) med känd effekt
Varje filmdragerad tablett innehåller 171 mg laktos (som laktosmonohydrat).
Förteckning över hjälpämnen
Tablettkärna
Mikrokristallin cellulosa
Laktosmonohydrat
Kroskarmellosnatrium
Magnesiumstearat
Filmdragering
Poly(vinylalkohol)
Titandioxid (E171)
Makrogol (3350)
Talk
Röd järnoxid (E172)
20 mg tabletter innehåller även gul järnoxid (E172).
30 mg tabletter innehåller även gul järnoxid (E172) och svart järnoxid (E172).
Blandbarhet
Ej relevant.
Miljöpåverkan
Apremilast
Miljörisk:
Användning av apremilast har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Apremilast bryts ned i miljön.
Bioackumulering:
Apremilast har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Assessment (ERA)
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula (FASS 2021, Ref. I):
PEC (μg/L) = (A x 109 x (100-R)) / (365 x P x V x D x 100)
Where:
A= 18.4298 kg (total sold amount API in Sweden year 2021, data provided by IQVIA).
R = 0 (maximum % removal rate due to loss by adsorption to sludge particles; No data available for unchanged apremilast)
P = number of inhabitants in Sweden = 10 x 106 (SCB Statistics Sweden Ref. II)
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default; Ref. III)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default; Ref. II)
PEC (μg/L) = (18.4298 x 109 x (100-0)) / (365 x 10 x 106 x 200 x 10 x 100)
PEC = 0.0025 μg/L
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae (Raphidocelis subcapitata) (Guideline OECD 201 study; Ref. IV)
NOEC (72 hours; inhibition of growth rate): 3.5 x 103 µg/L
Crustacean (Daphnia magna) (Guideline OECD 211 study; Ref. V)
Chronic toxicity
NOEC (21 days; mortalities, length and reproduction): 6.3 x 103 µg/L
Fish (Pimephales promelas) (Guideline OECD 210 study; Ref. VI)
Chronic toxicity
NOEC (28 days post-hatch; hatching success, survival, growth): 7.2 x 103 µg/L
Environmental risk classification (PEC/PNEC ratio)
The most sensitive species was algae (NOEC 3.5 x 103 µg/L). As three long-term toxicity tests were conducted, an assessment factor of 10 is appropriate.
PNEC = 3.5 x 103 µg/L / 10 = 3.5 x 102 µg/L
PEC/PNEC = 0.0025 µg/L/350 = 7 x 10-6
Degradation
-
Biotic degradation: (Ready degradability) (Guideline OECD 301B study; Ref. VII)
There was no significant biodegradation of apremilast. Therefore, apremilast was considered not to be readily biodegradable.
-
Transformation in freshwater sediment (Guideline OECD 308 study; Ref. VIII)
The fate of [14C]-apremilast was investigated up to 62 days under aerobic conditions after application in two freshwater sediment systems (Swiss Lake (SL) and Schoonrewoerdsewiel (SCH)).
Most of the radioactivity remained in the aqueous phase (72% in SL at 62 days; 56.1% in SCH at 62 days). Sediments were extracted five times with acidified aqueous acetonitrile to leave non-extractable residues at 62 days of 4.9% (SL) and 17.2% (SCH).
In both aquatic systems apremilast was extensively metabolised such that unchanged apremilast accounted for <1% of the applied radioactivity in both aqueous and sediment phases at 62 days. Two major metabolites (M1 and M2) were detected. The identification of these two metabolites is ongoing.
In SL, M1 increased in the water to 55.5% at 62 days but was only present in sediment at 6.2%. In water, M2 reached a maximum of 36.8% at Day 7 but in sediment was ≤1.5% at all sampling times.
In the SCH, M1 was in the range 44% to 49% from Day 4 to Day 62. In sediment M1 reached a maximum of 16.6% at 28 days. In water, M2 reached a maximum of 34.4% at 7 days. In sediment, M2 was ≤3.3% at all sampling times.
The decline (half-life) of apremilast, M1 and M2 (fitted simultaneously) are shown in the Table below. The study data have been extrapolated from the study temperature of 20°C to 12°C using the Arrhenius equation with a conversion factor of 2.123.
|
Compartment |
Swiss Lake |
Schoonrewoerdsewiel |
|---|---|---|
|
DT50 (days) |
DT50 (days) |
|
|
Apremilast | ||
|
Water |
3.2 |
1.3 |
|
Sediment | ||
|
Total system |
4.0 |
1.5 |
|
M1 | ||
|
Total system |
>2123 |
>2123 |
|
M2 | ||
|
Total system |
73.5 |
78.3 |
Hydrolysis:
Not determined
Justification of chosen degradation phrase
Degradation was determined in two freshwater sediment systems. The parent, apremilast is degraded rapidly in the environment. However, the half-lives of apremilast and metabolites M1 and M2 in the total systems were > 120 days. Therefore, the phrase ‘degraded in the environment’ should be used.
Bioaccumulation
Since the log10Pow at pH 7 was 1.77 ± 0.04, apremilast has a low potential for bioaccumulation (log10Pow < 4).
Excretion (metabolism) (Investigator’s Brochure; Ref IX)
Following dosing in healthy humans with [14C]-apremilast, 90% of the radioactive dose was recovered as up to 23 metabolites. Apremilast was primarily eliminated as metabolites formed via both CYP-mediated oxidative metabolism (and subsequent glucuronidation) and non-CYP-mediated hydrolysis, with less than 3% excreted unchanged in urine. A pharmacologically inactive glucuronide conjugate of O- demethylated apremilast was the major circulating metabolite and its urinary excretion represented approximately 34% of the total administered dose. Other minor metabolic routes included O-deethylation, N-deacetylation, hydroxylation (oxidative), hydrolysis of the imide ring, and a combination of these pathways. The O- demethylated and O-deethylated metabolites in the plasma and urine were predominantly glucuronide conjugates.
PBT/vPvB ASSESSMENT
Apremilast does not fulfil the criteria to be classified as PBT or vPvB.
REFERENCES
-
FASS, (2021). Environmental classification of pharmaceuticals at www.fass.se– Guidance for pharmaceutical companies 2012 v 3.0.
-
SCB Statistics Sweden Population Statistics. February 2022.
-
ECHA, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment
-
Migchielsen MHJ (2012a). Fresh water algal growth inhibition test with apremilast. NOTOX Project No. 498810.
-
Migchielsen MHJ (2012b). Daphnia magna, reproduction test with apremilast (flow-through). NOTOX Project No. 498809.
-
Migchielsen MHJ (2012c). Fish early-life stage toxicity test with apremilast (flow-through). NOTOX Project No. 498811.
-
Desmares-Koopmans MJE (2012a). Determination of “ready” biodegradability: carbon dioxide(CO2) evolution test (modified Sturm test) of apremilast. NOTOX Project No. 498812.
-
Brands CMJ (2013b). Aerobic degradation of apremilast in two water/sediment systems. WIL Research Project No. 500300.
-
Investigator’s Brochure Amgen Inc. Apremilast Edition: 23.0. Date: 07 May 2020.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Otezla 10 mg filmdragerade tabletter
Rosa, rombisk 10 mg filmdragerad tablett som är 8 mm lång och märkt med ”APR” på ena sidan och ”10” på den andra sidan.
Otezla 20 mg filmdragerade tabletter
Brun, rombisk 20 mg filmdragerad tablett som är 10 mm lång och märkt med ”APR” på ena sidan och ”20” på den andra sidan.
Otezla 30 mg filmdragerade tabletter
Beige, rombisk 30 mg filmdragerad tablett som är 12 mm lång och märkt med ”APR” på ena sidan och ”30” på den andra sidan.
Förpackningsinformation
Filmdragerad tablett 10 mg + 20 mg + 30 mg
10 mg: Rosa, rombisk, 8 mm lång och märkt med ”APR” och ”10”. 20 mg: Brun, rombisk, 10 mm lång och märkt med ”APR” och ”20”. 30 mg: Beige, rombisk, 12 mm lång och märkt med ”APR” och ”30”.
27 tablett(er) blister, 3632:68, (F)
Filmdragerad tablett 30 mg
30 mg: Beige, rombisk, 12 mm lång och märkt med ”APR” på ena sidan och ”30” på den andra sidan.
56 tablett(er) blister, 7481:55, (F)
168 tablett(er) blister, tillhandahålls ej
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 10 mg + 20 mg + 30 mg
Filmdragerad tablett 30 mg





