Indikationer
Oral antikonception.
Vid beslut att förskriva Midiana ska läkaren beakta den enskilda kvinnans riskfaktorer, framför allt risken för venös tromboembolism (VTE), och risken för VTE med Midiana jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet).
Kontraindikationer
Kombinerade hormonella preventivmedel ska inte användas vid något av följande tillstånd. Om något av dessa tillstånd uppkommer för första gången vid användning av kombinerade hormonella preventivmedel ska läkemedlet sättas ut omedelbart.
-
Förekomst av eller risk för venös tromboembolism (VTE)
-
Venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på t.ex. djup ventrombos (DVT) eller lungemboli (PE)
-
Känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC-resistens (inklusive Faktor V Leiden), antitrombin III-brist, protein C-brist, protein S-brist
-
Större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet)
-
Hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet)
-
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
-
Arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
-
Cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
-
Känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupusantikoagulant)
-
Migrän med fokala neurologiska symtom i anamnesen
-
Hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
-
diabetes mellitus med vaskulära symtom
-
svår hypertoni
-
svår dyslipoproteinemi
-
-
-
Aktuell eller tidigare allvarlig leversjukdom så länge leverfunktionsvärdena inte har normaliserats.
-
Grav njursvikt eller akut njursvikt.
-
Aktuella eller tidigare levertumörer (benigna eller maligna).
-
Kända eller misstänkta könshormonberoende maligna tumörer (t.ex. i könsorgan eller bröst).
-
Odiagnostiserad vaginalblödning.
-
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Innehåll.
-
Överkänslighet mot jordnötter eller soja.
Midiana är kontraindicerat vid samtidig användning med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, läkemedel som innehåller glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Interaktioner).
Dosering
Administreringssätt
Oral användning
Dosering
Hur Midiana ska tas
Tabletterna måste tas varje dag vid ungefär samma tidpunkt, vid behov med lite vätska, i den ordning som visas på blisterförpackningen. En tablett måste tas dagligen i 21 på varandra följande dagar. Varje efterföljande blisterförpackning ska påbörjas efter ett tablettuppehåll på sju dagar. Under den här tiden inträffar normalt en bortfallsblödning. Den börjar normalt 2–3 dagar efter intaget av den sista tabletten och kanske inte är slut innan nästa blisterförpackning påbörjas.
Så här påbörjas Midiana
-
Ingen tidigare användning av hormonell preventivmetod (den senaste månaden):
Tablettintaget måste påbörjas dag 1 i kvinnans normala menstruationscykel (dvs. menstruationsblödningens första dag).
-
Byte från en kombinerad hormonell preventivmetod (kombinerat p-piller, vaginalring eller depotplåster):
Kvinnan ska helst börja ta Midiana dagen efter den sista aktiva tabletten (den sista tabletten som innehåller de aktiva substanserna) med hennes tidigare kombinerade p-piller, men inte senare än dagen efter det vanliga tablettuppehållet eller intaget av placebotabletterna med hennes tidigare kombinerade p-piller. Om vaginalring eller ett depotplåster har använts, ska kvinnan helst börja ta Midiana samma dag som ringen eller plåstret tas bort, men inte senare än vid tidpunkten för när nästa applicering skulle ha skett.
-
Byte från en metod som enbart innehåller gestagen (minipiller, injektion, implantat) eller från ett intrauterint inlägg (IUS) som frisätter gestagen:
Kvinnan kan byta från minipiller vilken dag som helst (från implantat eller IUS samma dag det tas bort, från injektion vid tidpunkten för nästa injektion), men ska i samtliga dessa fall rådas att samtidigt använda en barriärmetod under tablettintagets första sju dagar.
-
Efter abort i den första trimestern:
Kvinnan kan börja omedelbart. Om hon gör det behöver hon inte använda någon ytterligare preventivmetod.
-
Efter förlossning eller abort i den andra trimestern:
Kvinnor bör rådas att starta dag 21 till 28 efter förlossning eller abort i den andra trimestern. Om kvinnan startar senare ska hon rådas att samtidigt använda en barriärmetod under de första sju dagarna. Om samlag redan ägt rum ska graviditet uteslutas innan kvinnan börjar använda kombinerade p-piller. I annat fall ska kvinnan vänta på sin första menstruationsperiod.
Ammande kvinnor, se avsnitt Graviditet.
Hantering av glömda tabletter
Om det har gått mindre än 12 timmar sedan kvinnan skulle ta en tablett är inte skyddet mot graviditet nedsatt. Kvinnan ska ta tabletten så snart hon kommer ihåg det och därefter ta övriga tabletter vid vanlig tid.
Om det har gått mer än 12 timmar sedan kvinnan skulle ha tagit en tablett kan skyddet mot graviditet vara nedsatt. Vid glömda tabletter bör kvinnan följa följande två grundregler:
-
Tablettuppehållet får aldrig vara längre än fyra dagar.
-
Sju dagars oavbrutet tablettintag krävs för att bibehålla adekvat hämning av hypotalamus-hypofys-ovarial-axeln.
Således kan följande råd ges:
-
Vecka 1
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid vanlig tid. En barriärmetod ska samtidigt användas, t.ex. kondom, de följande sju dagarna. Om samlag ägt rum de föregående sju dagarna bör en eventuell graviditet övervägas. Ju fler glömda tabletter och ju närmare det månatliga tablettuppehållet detta sker, desto större är risken för graviditet.
-
Vecka 2
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid vanlig tid. Under förutsättning att kvinnan har tagit tabletterna på rätt sätt under de sju dagar som föregått den glömda tabletten, behövs ingen extra preventivmetod. Om kvinnan har glömt mer än en tablett ska hon rådas att använda en annan preventivmetod i sju dagar.
-
Vecka 3
Risken för nedsatt skydd mot graviditet är stor på grund av det kommande tablettuppehållet på sju dagar. Genom att ändra tablettintaget kan emellertid nedsatt skydd mot graviditet fortfarande förhindras. Genom att följa ett av de två alternativen nedan behöver kvinnan inte använda någon annan preventivmetod, under förutsättning att kvinnan de sju dagar som föregått den glömda tabletten har tagit alla tabletter på rätt sätt. Om så inte är fallet ska hon följa det första av de två alternativen och använda en extra preventivmetod de följande sju dagarna.
-
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid vanlig tid. Nästa blisterförpackning ska därefter påbörjas så snart den aktuella blisterförpackningen är avslutad, dvs. det ska inte vara något uppehåll mellan blisterförpackningarna. Kvinnan får troligen ingen bortfallsblödning förrän den andra blisterförpackningen är avslutad, men kan få spotting eller genombrottsblödning de dagar hon tar tabletter.
-
Kvinnan kan också rådas att sluta ta tabletter från den aktuella blisterförpackningen. Därefter ska hon ha ett tablettuppehåll på högst sju dagar, inklusive de dagar hon har glömt tabletter, och sedan fortsätta med nästa blisterförpackning.
Om kvinnan har glömt tabletter och inte får någon bortfallsblödning under det första vanliga tablettuppehållet bör en eventuell graviditet övervägas.
Råd vid gastrointestinala besvär
Vid svåra gastrointestinala besvär (t.ex. kräkningar eller diarré) kan absorptionen bli ofullständig och ytterligare preventivmetoder bör användas.
Om kräkning inträffar inom 3-4 timmar efter intaget av en aktiv tablett ska en ny tablett (ersättningstablett) tas så snart som möjligt. Den nya tabletten bör om möjligt tas inom 12 timmar efter det normala tablettintaget. Om det går mer än 12 timmar gäller rådet om glömda tabletter som finns i avsnitt Dosering ”Hantering av glömda tabletter”. Om kvinnan inte vill ändra sitt normala schema för tablettintag, måste hon ta de/den extra tabletten/tabletterna från en annan tablettkarta.
Skjuta upp en menstruationsperiod
Om kvinnan vill skjuta upp en menstruationsperiod ska hon fortsätta med nästa blisterförpackning Midiana utan något tablettuppehåll. Förlängningen kan pågå så länge hon önskar, tills den andra blisterförpackningen är slut.
Under förlängningen kan kvinnan få genombrottsblödning eller spotting. Regelbundet intag av Midiana ska återupptas efter det vanliga tablettfria intervallet på sju dagar.
Om kvinnan vill byta menstruationsdag till en annan veckodag än den aktuella, kan hon rådas att förkorta det kommande tablettuppehållet med önskat antal dagar. Ju kortare intervallet är, desto större är risken att hon inte får någon bortfallsblödning utan får genombrottsblödning och spotting under intag från nästa blisterförpackning (på samma sätt som när en menstruation skjuts upp).
Pediatrisk population
Midiana är endast indicerat efter att menstruationerna börjat. På basis av epidemiologiska data från över 2 000 unga kvinnor under 18 år, finns det inga data som tyder på att säkerhet och effekt skulle vara annorlunda i denna unga åldersgrupp än hos kvinnor över 18 år.
Varningar och försiktighet
Varningar
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Midiana diskuteras med kvinnan.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången, ska kvinnan ta kontakt med sin läkare. Läkaren ska då besluta om användningen av Midiana avbrytas.
Vid bekräftad eller misstänkt venös eller arteriell tromboembolism ska användningen av kombinerade hormonella preventivmedel avslutas. Om antikoagulationsbehandling inleds, ska en adekvat alternativ preventivmetod sättas in på grund av teratogeniciteten av antikoagulationsbehandling (kumariner).
-
Cirkulationsrubbningar
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke-användning. Produkter som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Andra produkter som t.ex. Midiana kan ha en risk som är dubbelt så stor. Beslutet att använda en annan produkt än den med den lägsta risken för VTE ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Midiana, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE-risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
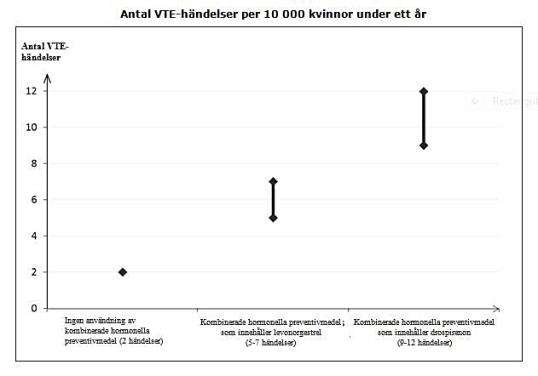
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Man uppskattar1 att av 10 000 kvinnor som använder kombinerade hormonella preventivmedel innehållande drospirenon kommer mellan 9 och 12 kvinnor att utveckla en VTE under ett år; detta kan jämföras med cirka 62 kvinnor som använder kombinerade hormonella preventivmedel som innehåller levonorgestrel.
1Dessa förekomster uppskattades från samtliga epidemiologiska studiedata med hjälp av relativa risker för de olika produkterna jämfört med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
2 Genomsnittsintervallet är på 5-7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en icke-användning som har ett genomsnittsintervall på cirka 2,3-3,6
I båda fallen är antalet VTE-händelser per år färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartum-perioden.
VTE kan vara dödligt i 1-2 % av fallen.
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Midiana är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
|
Riskfaktor |
Kommentar |
|---|---|
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
|
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada Obs: tillfällig immobilisering inklusive flygresor >4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer |
I dessa situationer är det lämpligt att göra ett uppehåll i användningen av p-plåster/p‑piller/p-ring (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. Antitrombotisk behandling bör övervägas om Midiana inte har satts ut i förväg. |
|
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller en förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Andra medicinska tillstånd som förknippas med VTE |
Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecellsjukdom. |
|
Stigande ålder |
Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6-veckorsperioden i puerperiet, måste beaktas (för information om ”Fertilitet, graviditet och amning” se avsnitt Graviditet).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
-
unilateral svullnad av ben och/eller fot eller längs en ven i benet
-
smärta eller ömhet i benet som bara känns vid stående eller gående
-
ökad värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
-
plötslig debut av oförklarlig andnöd eller snabb andning
-
plötslig hosta som kan förknippas med hemoptys
-
kraftig bröstsmärta
-
kraftig ostadighetskänsla eller yrsel
-
snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andnöd och hosta) är icke-specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Midiana är kontraindicerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
|
Riskfaktor |
Kommentar |
|---|---|
|
Stigande ålder |
Framför allt hos kvinnor över 35 år |
|
Rökning |
Kvinnor över 35 år bör rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
|
Hypertoni |
|
|
Fetma (BMI över 30 kg/m2) |
Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
|
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller en förälder i relativt unga år, t.ex. före 50 års ålder). |
Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
|
Migrän |
En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
|
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser |
Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
-
plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
-
plötsliga problem med att gå, yrsel, förlorad balans eller koordination
-
plötslig förvirring, svårigheter att tala eller förstå
-
plötsliga synproblem i ett eller båda ögonen
-
plötslig, svår eller långvarig huvudvärk utan känd orsak
-
medvetslöshet eller svimning med eller utan krampanfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
-
smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
-
obehag som strålar mot ryggen, käken, halsen, armen, magen
-
mättnadskänsla, matsmältningsbesvär eller kvävning
-
svettning, illamående, kräkningar eller yrsel
-
extrem svaghet, ångest eller andnöd
-
snabba eller oregelbundna hjärtslag.
Tumörer
En ökad risk för livmoderhalscancer har rapporterats i vissa epidemiologiska studier hos kvinnor som under lång tid använt kombinerade p-piller (> 5 år), men det råder fortsatt oenighet om i vilken utsträckning detta resultat anses bero på de förbryllande effekterna av sexuellt beteende och andra faktorer som humant papillomvirus (HPV).
En metaanalys av 54 epidemiologiska studier rapporterade att det finns en obetydligt ökad relativ risk (RR = 1,24) att få diagnosen bröstcancer hos kvinnor som för närvarande använder kombinerade p-piller. Den ökade risken minskar successivt under 10 år efter att användningen av kombinerade p-piller har upphört. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år, är det ökade antalet bröstcancerdiagnoser hos aktuella och tidigare användare av kombinerade p-piller litet i förhållande till den totala risken för bröstcancer. Dessa studier dokumenterar inte orsakssamband. Det observerade mönstret på ökad risk kan bero på en tidigare bröstcancerdiagnos hos användare av kombinerade p-piller, de biologiska effekterna av kombinerade p-piller eller en kombination av båda. Den bröstcancer som diagnostiserats hos användare tenderar att vara mindre kliniskt avancerad än den cancer som diagnostiserats hos icke-användare.
I sällsynta fall har benigna levertumörer rapporterats, och ännu mer sällan har maligna levertumörer rapporterats hos användare av kombinerade p-piller. I enstaka fall har dessa tumörer lett till livshotande intraabdominella blödningar. En levertumör bör övervägas i differentialdiagnosen vid svår smärta i övre delen av buken, vid leverförstoring eller vid tecken på intraabdominell blödning hos kvinnor som använder kombinerade p-piller.
Vid användning av högdoserade kombinerade p-piller (0,05 mg etinylestradiol) är risken för cancer i endometriet och äggstockarna lägre. Om detta även gäller kombinerade p-piller i låg dos är ännu inte fastställt.
Andra tillstånd
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Progestinkomponenten i produkten är en aldosteronantagonist med kaliumsparande egenskaper. I de flesta fall förväntas ingen ökning av kaliumnivåerna. I en klinisk studie sågs emellertid en lätt höjning, inte signifikant, av kaliumnivåerna i serum hos vissa patienter med lätt eller måttligt nedsatt njurfunktion som tog kaliumsparande läkemedel och samtidigt tog drospirenon. Således rekommenderas kontroll av kaliumnivåerna i serum under den första behandlingscykeln hos patienter med njursvikt och serumkalium i det övre referensintervallet före behandling, och särskilt vid samtidig användning av kaliumsparande läkemedel. Se även avsnitt Interaktioner.
Kvinnor med hypertriglyceridemi, eller hereditet för detta, kan löpa ökad risk att drabbas av pankreatit vid användning av kombinerade p-piller.
Även om små ökningar av blodtrycket har rapporterats hos många kvinnor som använder kombinerade p-piller, är kliniskt relevanta ökningar sällsynta. Endast i dessa sällsynta fall ska kombinerade p-piller sättas ut omedelbart. Om ett konstant förhöjt blodtryck eller en signifikant ökning av blodtrycket, vid användning av kombinerade p-piller och preexisterande hypertoni, inte svarar adekvat på blodtryckssänkande behandling, måste det kombinerade p-pillret sättas ut. Om det anses lämpligt kan det kombinerade p-pillret sättas in igen om normala blodtrycksvärden kan uppnås med blodtryckssänkande behandling.
Följande tillstånd har rapporterats uppkomma eller förvärras vid både graviditet och användning av kombinerade p-piller, men det finns inte övertygande bevis för ett samband med kombinerade p-piller: gulsot och/eller pruritus i samband med kolestas, gallstenar, porfyri, SLE (systemisk lupus erythematosus), HUS (hemolytiskt uremiskt syndrom), Sydenhamns korea, herpes gestationis, otosklerosrelaterad hörselnedsättning.
Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
Akuta eller kroniska störningar av leverfunktionen kan göra det nödvändigt att sätta ut kombinerade p-piller tills leverfunktionen åter är normal. Återfall av kolestatisk ikterus och/eller kolestasrelaterad pruritus, som tidigare uppkommit under graviditet eller vid tidigare användning av könshormoner, gör det nödvändigt att det kombinerade p-pillret sätts ut.
Även om kombinerade p-piller har effekt på den perifera insulinresistensen och glukostoleransen, finns inga bevis för att det är nödvändigt att ändra behandlingsregimen hos diabetiker som använder kombinerade p-piller i lågdos (innehållande < 0,05 mg etinylestradiol). Kvinnor med diabetes ska kontrolleras noggrant och särskilt under den första tiden med kombinerade p-piller.
Försämring av endogen depression, epilepsi, Crohns sjukdom och ulcerös kolit har rapporterats vid användning av kombinerade p-piller.
Kloasma kan förekomma i enstaka fall, speciellt hos kvinnor som haft kloasma under tidigare graviditet. Kvinnor med tendens till kloasma ska undvika exponering för solljus eller ultraviolett strålning vid användning av kombinerade p-piller.
Läkarundersökning/konsultation
Innan användning av Midiana påbörjas eller återupptas ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserat på kontraindikationerna (se avsnitt Kontraindikationer) och varningar (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Midiana jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv-infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Nedsatt effekt
Effekten av kombinerade p-piller kan vara nedsatt vid t.ex. glömda tabletter (se avsnitt Dosering), gastrointestinala besvär (se avsnitt Dosering) eller vid samtidig användning av andra läkemedel (se avsnitt Interaktioner).
Nedsatt cykelkontroll
Oregelbunden blödning (spotting eller genombrottsblödning) kan förekomma vid användning med alla kombinerade p-piller, särskilt under de första månaderna. Därför är utvärdering av oregelbunden blödning bara meningsfull efter en anpassningsperiod om cirka tre cykler.
Om de oregelbundna blödningarna kvarstår eller uppkommer efter tidigare regelbundna cyklar bör icke-hormonella orsaker övervägas och adekvata diagnostiska åtgärder vidtas för att utesluta malignitet eller graviditet. Detta kan inkludera kyrettage.
Vissa kvinnor får inte någon bortfallsblödning vid intag av placebotabletter. Om det kombinerade p-pillret har tagits i enlighet med anvisningarna i avsnitt Dosering är det osannolikt att kvinnan är gravid. Men om det kombinerade p-pillret inte har tagits enligt anvisningarna före den första uteblivna bortfallsblödningen eller om två bortfallsblödningar uteblir, måste graviditet uteslutas innan intaget av kombinerade p‑piller fortsätter.
Hjälpämnen:
Detta läkemedel innehåller 48,17 mg laktosmonohydrat per tablett. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Detta läkemedel innehåller 0,07 mg sojalecitin per tablett. Detta läkemedel ska inte administreras till patienter som är allergiska mot jordnötter eller soja.
Interaktioner
Observera! Förskrivningsinformationen för samtidig användning av andra läkemedel ska kontrolleras för att identifiera eventuella interaktioner.
Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt Kontraindikationer). Därför måste användare av Midiana byta till en alternativ preventivmetod (t.ex. minipiller eller icke-hormonella metoder) innan inledning av behandling med dessa läkemedelskombinationer. Midiana kan återinsättas 2 veckor efter avslutande av behandling med dessa läkemedelskombinationer.
Farmakokinetiska interaktioner
-
Effekter av andra läkemedel på Midiana
Interaktioner kan förekomma med läkemedel som inducerar mikrosomala enzymer, vilket kan orsaka ökat clearance av könshormoner och leda till genombrottsblödning och/eller nedsatt preventiv effekt.
Behandling
Enzyminduktion kan ses redan efter några dagar av behandling. Maximal enzyminduktion ses vanligen inom några veckor. Efter att läkemedelsbehandlingen avslutats kan enzyminduktion kvarstå i cirka 4 veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel bör tillfälligt använda en barriärmetod eller någon annan preventivmetod som tillägg till kombinerade p-piller. Barriärmetod bör användas under hela samtidiga läkemedelbehandlingen samt i ytterligare 28 dagar efter avslutad behandling. Om läkemedelsbehandlingen pågår längre än de aktiva tabletterna i p-pillerförpackningen, måste placebotabletterna kastas och nästa p-pillerförpackning påbörjas omedelbart.
Långtidsbehandling
Hos kvinnor som står på långvarig behandling med leverenzyminducerande aktiva substanser rekommenderas andra icke-hormonella preventivmetoder.
Följande interaktioner har rapporterats i litteraturen.
Läkemedel som ökar clearance av kombinerade p-piller (minskar effekten av kombinerade p-piller genom att inducera leverenzymer) t.ex.:
Barbiturater, bosentan, karbamazepin, fenytoin, primidon, rifampicin och HIV-läkemedlen ritonavir, nevirapin och efavirenz och möjligen också felbamat, griseofulvin, oxkarbazepin, topiramat och produkter som innehåller Johannesört (Hypericum perforatum).
Läkemedel som har varierande effekt på clearance av kombinerade p-piller:
Vid samtidig administrering med kombinerade p-piller kan många kombinationer av HIV/HCV-proteashämmare och icke-nukleosida omvändt transkriptashämmare öka eller minska plasmakoncentrationer av östrogen eller progestin. Den totala effekten av dessa förändringar kan i vissa fall vara kliniskt relevant.
Därför ska produktresumén för samtidiga HIV/HCV-läkemedel läsas för att identifiera potentiella interaktioner och eventuella rekommendationer om dem. Om tvekan råder, ska kvinnor som tar proteashämmare eller icke-nukleosida omvända transkriptashämmare använda en extra barriärmetod.
Substanser som minskar clearance av kombinerade p-piller (enzymhämmare):
Den kliniska relevansen av potentiella interaktioner med enzymhämmare är okänd.
Samtidig administrering av starka CYP3A4-hämmare kan öka plasmakoncentrationer av östrogen eller progestin, eller båda.
En multipel dosstudie med drospirenon (3 mg/dag) och etinylestradiol (0,02 mg/dag) visar att samtidig administration av den starka CYP3A4-hämmaren ketokonazol i 10 dagar ökar AUC (0–24 h) av drospirenon och etinylestradiol 2,7 gånger respektive 1,4 gånger.
När doser med etoricoxib 60–120 mg/dag tas samtidigt med ett kombinationspreparat som innehåller 35 mikrogram etinylestradiol ökar plasmakoncentrationen av etinylestradiol 1,4–1,6 gånger.
Effekten av Midiana på andra läkemedel
P-piller kan påverka metabolismen av vissa andra aktiva substanser. Koncentrationer i plasma och vävnader kan således antingen öka (t.ex. ciklosporin) eller minska (t.ex. lamotrigin).
Baserat på interaktionsstudier in vivo hos kvinnliga försökspersoner där omeprazol, simvastatin eller midazolam används som markör, uppvisar den kliniskt relevanta interaktionen av drospirenon i doser om 3 mg ringa benägenhet att interagera med den cytokrom P450-medierade metabolismen av andra aktiva substanser.
Kliniska data tyder på att etinylestradiol hämmar clearance av CYP1A2-substrat, vilket ger en svag (t.ex. teofyllin) till måttlig (t.ex. tizanidin) ökning av plasmakoncentrationen för dessa.
Andra typer av interaktioner
Hos patienter utan njursvikt visade samtidig användning av drospirenon och ACE-hämmare eller NSAID-preparat ingen signifikant effekt på serumkalium. Samtidig användning av Midiana med aldosteronantagonister eller kaliumsparande diuretika har dock inte studerats. I detta fall bör serumkalium kontrolleras under den första behandlingscykeln. Se även avsnitt Varningar och försiktighet.
Laboratorieprover
Användningen av steroider för antikonception kan påverka resultaten av vissa laboratorieanalyser, däribland biokemiska parametrar för lever-, sköldkörtel-, binjure- och njurfunktion, plasmanivåerna av (transport)proteiner, t.ex. kortikosteroidbindande globulin och lipid-/lipoproteinfraktioner, parametrar för kolhydratmetabolism och parametrar för koagulation och fibrinolys. Förändringarna ligger i allmänhet inom normala laboratorievärden. Drospirenon leder till en ökad aktivitet hos plasmarenin och plasmaaldosteron, inducerad av dess lätta antimineralkortikoida aktivitet.
Graviditet
Midiana är inte indicerat under graviditet.
Om kvinnan blir gravid vid användning av Midiana ska preparatet omedelbart sättas ut. Omfattande epidemiologiska studier har varken visat en ökad risk för medfödda missbildningar hos barn till kvinnor som använt kombinerade p-piller före graviditeten eller en teratogen effekt om kombinerade p-piller av misstag använts under graviditeten.
Djurstudier har visat biverkningar under graviditet och amning (se avsnitt Prekliniska uppgifter). Baserat på dessa djurdata kan biverkningar på grund av hormonell effekt av de aktiva substanserna inte uteslutas. Den allmänna erfarenheten av kombinerade p-piller under graviditet visade dock inga tecken på en faktisk biverkning hos människa.
Tillgängliga data om användningen av drospirenon/etinylestradiol under graviditet är för begränsade för att några slutsatser ska kunna dras avseende negativa effekter av drospirenon/etinylestradiol på graviditet och fostrets eller det nyfödda barnets hälsa. Hittills finns inga relevanta epidemiologiska data.
Den ökade risken för VTE under postpartum-perioden ska beaktas vid återinsättning av Midiana (se avsnitt Dosering och Varningar och försiktighet).
Amning
Amning kan påverkas av kombinerade p-piller eftersom de kan minska mängden bröstmjölk och ändra dess sammansättning. Användning av kombinerade p-piller ska generellt inte rekommenderas förrän mamman har slutat amma barnet. Små mängder av könshormonerna och/eller deras metaboliter kan utsöndras till bröstmjölk vid användning av kombinerade p-piller. Dessa mängder kan påverka barnet.
Trafik
Inga studier har utförts. Inga effekter på förmågan att köra bil och använda maskiner har observerats hos användare av kombinerade p-piller.
Biverkningar
Information om allvarliga biverkningar hos kvinnor som använder kombinerade p-piller finns i avsnitt Varningar och försiktighet.
Följande biverkningar har rapporterats vid användning av drospirenon/etinylestradiol (3 mg/0,03mg):
|
Klassificering av organsystem |
Frekvenser |
|||
|
MedDRA |
Vanliga ≥1/100, <1/10 |
Mindre vanliga >1/1 000, <1/100 |
Sällsynta ≥1/10 000, <1/1 000 |
Ingen känd frekvens (kan inte beräknas från tillgängliga data) |
|
Immunsystemet |
|
|
överkänslighet, astma |
förvärrade symtom av ärftligt eller förvärvat angioödem |
|
Psykiatriska |
deprimerat tillstånd |
ökad libido minskad libido |
| |
|
Centrala och perifera nervsystemet |
huvudvärk |
|
| |
|
Öron och balansorgan |
|
|
hypakusi | |
|
Blodkärl |
migrän |
hypertoni, hypotoni |
venös tromboembolism arteriell tromboembolism | |
|
Magtarmkanalen |
illamående |
kräkningar, diarré |
| |
|
Hud och subkutan vävnad |
|
akne, eksem, klåda, alopeci |
erythema nodosum, erythema multiforme | |
|
Reproduktionsorgan och bröstkörtel |
menstruationsstörningar, mellanblödningar, bröstsmärta, flytningar från slidan, vulvovaginal candida |
bröstförstoring, infektion i slidan |
utsöndring från brösten | |
|
Allmänna symtom och/eller symtom vid administreringsstället |
|
vätskeretention, viktökning, viktminskning |
| |
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Följande allvarliga biverkningar har rapporterats hos kvinnor som tar kombinerade p-piller, och dessa diskuteras i avsnitt Varningar och försiktighet, Varningar och försiktighet:
-
Venösa tromboemboliska sjukdomar.
-
Arteriella tromboemboliska sjukdomar.
-
Hypertoni.
-
Levertumörer.
-
Uppkomst eller försämring av besvär för vilka ett samband med kombinerade p-piller inte kan uteslutas. Crohns sjukdom, ulcerös kolit, epilepsi, uterusmyom, porfyri, systemisk lupus erythematosus, herpes gestationis, Sydenhams korea, hemolytiskt uremiskt syndrom, kolestatisk ikterus.
-
Kloasma.
-
Akuta eller kroniska störningar av leverfunktionen kan göra det nödvändigt att sätta ut kombinerade p-piller tills leverfunktionen åter är normal.
-
Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
Frekvensen för bröstcancer är något högre bland användare av kombinerade p-piller. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år är ökningen liten i förhållande till den totala risken för bröstcancer. Orsakssambandet med användning av kombinerade p-piller är inte fastställd. Ytterligare information finns i avsnitt Kontraindikationer och Varningar och försiktighet.
Interaktioner
Genombrottsblödning och/eller nedsatt preventiv effekt kan uppstå på grund av interaktioner med andra läkemedel (enzyminducerare) (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns i nuläget ingen erfarenhet av överdosering med Midiana. Baserat på allmän erfarenhet av kombinerade p-piller är de symtom som eventuellt kan förekomma i detta fall: illamående, kräkningar och bortfallsblödning. Bortfallsblödning kan även förekomma hos flickor före menarche, om de tar läkemedlet av misstag. Det finns inga antidoter och ytterligare behandling ska vara symtomatisk.
Farmakodynamik
Pearl Index för metodfel: 0,09 (övre tvåsidig 95 % konfidensgräns: 0,32).
Totalt Pearl Index (metodfel + patientfel): 0,57 (övre tvåsidig 95 % konfidensgräns: 0,90).
Verkningsmekanism
Den preventiva effekten av Midiana är baserad på interaktionen mellan olika faktorer. Den viktigaste är hämning av ägglossning och förändringar i endometriet.
Midiana är ett kombinerat p-piller med etinylestradiol och gestagenet drospirenon. Vid terapeutiska doser har drospirenon också antiandrogena och svagt antimineralkortikoida egenskaper. Det har ingen östrogen, glukokortikoid och antiglukokortikoid aktivitet. Detta innebär att drospirenon har en farmakologisk profil som ligger nära det naturliga hormonet progesteron.
Det finns indikationer från kliniska studier att svaga antimineralkortikoida egenskaper leder till en lätt antimineralkortikoid effekt.
Farmakokinetik
-
Drospirenon
Absorption
Oralt administrerat drospirenon absorberas snabbt och nästan fullständigt. Efter en engångsdos uppnås maximala serumkoncentrationer av den aktiva substansen på cirka 37 ng/ml cirka 1–2 timmar efter ett intag. Biotillgängligheten för drospirenon ligger mellan 76 och 85 %. Samtidigt intag av mat har ingen påverkan på biotillgängligheten för drospirenon.
Distribution
Efter oral administrering minskar serumnivåerna av drospirenon i två faser, med terminala halveringstider på 31 timmar. Drospirenon är bundet till serumalbumin och binder inte till könshormonbindande globulin (SHBG) eller kortikoidbindande globulin (CBG). Endast 3–5 % av de totala serumkoncentrationerna av den aktiva substansen förekommer som fri steroid. Den etinylestradiolinducerade ökningen av SHBG påverkar inte serumproteinbindningen av drospirenon. Den genomsnittliga distributionsvolymen för drospirenon är 3,7±1,2 l/kg.
Metabolism
Drospirenon metaboliseras i hög grad efter oral administrering. Huvudmetaboliterna i plasma är syraformen av drospirenon, skapad genom öppning av laktonringen, och 4,5-dihydro-drospirenon-3-sulfat, bildad genom reduktion och efterföljande sulfatisering. Drospirenon kan även genomgå oxidativ metabolism katalyserad av CYP3A4.
Drospirenon är in vitro kapabel att hämma cytokrom P450-enzymerna CYP1A1, CYP2C9, CYP2C19 och CYP3A4 svagt till måttligt.
Eliminering
Metabol clearance för drospirenon i serum är 1,5 ± 0,2 ml/min/kg. Endast spårmängder av drospirenon utsöndras i oförändrad form. Metaboliterna av drospirenon utsöndras via feces och urin med elimineringskvot på cirka 1,2 till 1,4. Halveringstiden för metabolitutsöndringen med urin och feces är cirka 40 timmar.
Steady state-tillstånd
Under en behandlingscykel är de maximala steady state-koncentrationerna för drospirenon i serum cirka 70 ng/ml och dessa nås efter cirka 8 dagars behandling. Drospirenonnivåerna i serum ackumuleras med en faktor på cirka 3 som en följd av förhållandet mellan terminal halveringstid och doseringsintervall.
Särskilda populationer
Effekt vid nedsatt njurfunktion
Steady state-serumnivåer av drospirenon hos kvinnor med nedsatt njurfunktion (kreatininclearance CLcr, 58–80 ml/min) var jämförbar med den hos kvinnor med normal njurfunktion CLcr > 80 ml/min). Serumnivåerna av drospirenon var i genomsnitt 37 % högre hos kvinnor med måttligt nedsatt njurfunktion (CLcr 30–50 ml/min) jämfört med den hos kvinnor med normal njurfunktion. Drospirenon tolererades också väl av kvinnor med lätt och måttligt nedsatt njurfunktion.
Drospirenon visade ingen signifikant effekt på kaliumkoncentrationen i serum.
Effekt vid nedsatt leverfunktion
I en singeldosstudie minskade oral clearance (CL/F) med cirka 50 % hos frivilliga med måttligt nedsatt leverfunktion jämfört med hos personer med normal leverfunktion. Den observerade minskningen av drospirenonclearance hos frivilliga med måttligt nedsatt leverfunktion konstaterades inte medföra någon väsentlig skillnad i kaliumkoncentrationerna i serum. Inte heller vid diabetes och samtidig behandling med spironolakton (två faktorer som kan predisponera en patient för hyperkalemi) observerades en ökning av kaliumkoncentrationer i serum över den övre normalgränsen. Slutsatsen är således att kombinationen etinylestradiol/drospirenon tolereras väl av patienter med lätt eller måttligt nedsatt leverfunktion (Child-Pugh B).
Etniska grupper
Farmakokinetiken vid engångs- eller flergångsdoser av etinylestradiol och drospirenon har studerats hos unga friska kaukasiska och japanska kvinnor.
-
Etinylestradiol
Absorption
Etinylestradiol absorberas snabbt och fullständigt efter intag. Efter administrering av 30 µg uppnås maximala plasmakoncentrationer på 100 pg/ml 1–2 timmar efter intag. Etinylestradiol genomgår en omfattande första passage-effekt, som visar stor inter-individuell variation. Den absoluta biotillgängligheten är cirka 45 %.
Distribution
Etinylestradiol har en distributionsvolym på 5 l/kg och bindningen till plasmaproteiner är cirka 98 %. Etinylestradiol inducerar leversyntesen av SHBG och CBG. Vid behandling med 30 µg etinylestradiol ökar plasmakoncentrationen av SHBG från 70 till cirka 350 nmol/l.
Etinylestradiol passerar i små mängder över i bröstmjölk (0,02 % av dosen).
Metabolism
Etinylestradiol genomgår betydande första passage-metabolism i magtarmkanalen och levern. Etinylestradiol metaboliseras primärt via aromatisk hydroxylering, men ett stort antal hydroxylerade och metylerade metaboliter bildas och dessa finns som fria metaboliter samt som konjugat med glukuronider och sulfat. Metabol clearance för etinylestradiol är cirka 5 ml/min/kg.
Etinylestradiol är in vitro en reversibel hämmare av CYP2C19, CYP1A1 och CYP1A2 samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Eliminering
Etinylestradiol utsöndras inte i oförändrad form i någon stor omfattning. Metaboliterna av etinylestradiol utsöndras i urin och galla i förhållandet till 4:6. Halveringstiden för metabolitutsöndringen är cirka 1 dag. Elimineringshalveringstiden är 20 timmar.
Steady state-förhållanden
Steady state-förhållanden uppnås under den andra halvan av behandlingscykeln och serumnivåerna av etinylestradiol ackumuleras med en faktor på cirka 1.4–2,1.
Prekliniska uppgifter
Hos försöksdjur var effekterna av etinylestradiol och drospirenon begränsade till dem som förknippas med den kända farmakologiska effekten. Framför allt reproduktionstoxicitetsstudierna visade embryotoxiska och fetotoxiska effekter på djur som anses vara artspecifika. Vid exponering som överstiger den hos användare av drospirenon och etinylestradiol observerades effekter på sexuell differentiering på råttfoster men inte på apor.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje tablett innehåller 0,03 mg etinylestradiol och 3 mg drospirenon.
Hjälpämnen med känd effekt:
Varje filmdragerad tablett innehåller 48,17 mg laktosmonohydrat och 0,070 mg sojalecitin.
Förteckning över hjälpämnen
Tablettkärna:
Laktosmonohydrat
Pregelatiniserad majsstärkelse
Majsstärkelse
Povidon K-25
Magnesiumstearat
Dragering:
Polyvinylalkohol
Titandioxid (E171)
Talk (E553b)
Makrogol 3350
Lecitin (soja)
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30°C. Förvaras i originalförpackningen. Ljuskänsligt.
Särskilda anvisningar för destruktion
Inga särskilda anvisningar.
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Filmdragerad tablett.
Vit eller nästan vit, rund, bikonvex filmdragerad tablett. Prägling på ena sidan: ”G63”, ingen prägling på andra sidan. Diameter: cirka 6 mm.




