Indikationer
-
Förebyggande av skelettrelaterade händelser (patologiska frakturer, ryggradskompression, strålning av eller kirurgiskt ingrepp i benvävnad eller tumörinducerad hyperkalcemi) hos vuxna patienter med avancerade benvävnadsmetastaser.
-
Behandling av vuxna patienter med tumörinducerad hyperkalcemi (TIH).
Kontraindikationer
-
Överkänslighet mot den aktiva substansen, mot andra bisfosfonater eller mot något hjälpämne som anges i avsnitt Innehåll
-
Amning (se avsnitt Graviditet)
Dosering
Zerlinda får endast förskrivas och administreras till patienter av sjukvårdspersonal som har erfarenhet av administrering av intravenösa bisfosfonater. Bipacksedeln och påminnelsekortet skall lämnas till patienter som behandlas med Zerlinda.
Dosering
Förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser
Vuxna samt äldre patienter
Den rekommenderade dosen vid förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser är 4 mg zoledronsyra var tredje till fjärde vecka.
Patienter bör också ges ett dagligt tillägg av kalcium 500 mg samt 400 IE vitamin D.
I beslutet att behandla patienter med benvävnadsmetastaser för förebyggande av skelettrelaterade händelser skall hänsyn tas till att effekten av behandlingen sätter in efter 2–3 månader.
Behandling av TIH
Vuxna samt äldre patienter
Den rekommenderade dosen vid hyperkalcemi (albuminkorrigerat serumkalcium ≥ 12,0 mg/dl eller 3,0 mmol/l) är en engångsdos av 4 mg zoledronsyra.
Nedsatt njurfunktion
TIH:
Zerlindabehandling av patienter med TIH som även har gravt nedsatt njurfunktion skall övervägas endast efter värdering av riskerna och fördelarna med behandlingen. I de kliniska studierna har patienter med serumkreatinin > 400 µmol/l eller > 4,5 mg/dl exkluderats. Ingen dosjustering är nödvändig för patienter med TIH med serumkreatinin < 400 µmol/l eller < 4,5 mg/dl (se avsnitt Varningar och försiktighet).
Förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser:
När man initierar behandling med Zerlinda hos patienter med multipelt myelom eller metastaserande skelettlesioner från solida tumörer, bör serumkreatinin och kreatininclearance (CLcr) kontrolleras. CLcr beräknas från serumkreatinin med hjälp av Cockcroft - Gaults formel. Zerlinda rekommenderas inte till de patienter som före insättning av behandling har gravt nedsatt njurfunktion, vilket för denna patientkategori definieras som CLcr < 30 ml/min. I kliniska prövningar med Zerlinda har patienter med serumkreatinin > 265 µmol/l eller > 3,0 mg/dl exkluderats från prövningarna.
Hos patienter med normal njurfunktion (definierat som CLcr > 60 ml/min), kan zoledronsyra 4 mg/100 ml lösning för infusion administreras direkt utan någon ytterligare beredning. Hos patienter med benvävnadsmetastaser som före initiering av behandling har mild till måttligt nedsatt njurfunktion, vilket för denna patientkategori definierades som CLcr 30–60 ml/min, rekommenderas reducerade Zerlinda-doser (se också avsnitt Varningar och försiktighet).
|
Kreatininclearance vid start (ml/min) |
Zerlinda rekommenderad dos* |
|
> 60 |
4,0 mg zoledronsyra |
|
50-60 |
3,5 mg* zoledronsyra |
|
40-49 |
3,3 mg* zoledronsyra |
|
30-39 |
3,0 mg* zoledronsyra |
* Doserna har kalkylerats under förutsättning att det önskade målet för AUC är 0,66 (mg•hr/l)(CLcr = 75 ml/min). Den reducerade dosen för patienter med nedsatt njurfunktion förväntas uppnå samma AUC som den som har setts hos patienter med kreatininclearance på 75 ml/min.
Efter initiering av behandling, bör serumkreatinin kontrolleras innan varje dos av Zerlinda administreras och uppehåll skall göras i behandlingen om njurfunktionen försämras. I de kliniska prövningarna definierades en försämring av njurfunktionen enligt följande:
-
För patienter med normalt serumkreatininvärde vid start (< 1,4 mg/dl eller < 124 µmol/l), en ökning med 0,5 mg/dl eller 44 µmol/l;
-
För patienter med abnormt kreatininvärde vid start (>1,4 mg/dl eller > 124 µmol/l), en ökning med 1,0 mg/dl eller 88 µmol/l.
I de kliniska studierna upptogs behandlingen med zoledronsyra när kreatininnivåerna hade återgått till inom 10 % av utgångsvärdet (se avsnitt Varningar och försiktighet). Zerlindabehandlingen skall återupptas med samma dos som gavs innan behandlingen avbröts.
Pediatrisk population
Säkerhet och effekt för zoledronsyra för barn i åldern 1 år till 17 år har inte fastställts. Tillgänglig information finns i avsnitt Farmakodynamik men ingen doseringsrekommendation kan fastställas.
Administreringssätt
Intravenöst bruk.
Zoledronsyra 4 mg/100 ml lösning för infusion skall ges som engångsdos under åtminstone 15 minuter.
Hos patienter med normal njurfunktion, definierat som CLcr > 60 ml/min skall zoledronsyra 4 mg/100 ml lösning för infusion inte spädas ytterligare.
Hos patienter med mild till måttlig nedsättning av njurfunktionen, rekommenderas reducerade doser av zoledronsyra (se avsnitt ”Dosering” ovan och avsnitt Varningar och försiktighet).
För att bereda reducerade doser till patienter med CLcr ≤ 60 ml/min vid start, se tabell 1 nedan. Avlägsna angiven volym av Zerlinda lösning från infusionspåsen och ersätt med en motsvarande volym av steril natriumkloridlösning 9 mg/ml (0,9 %) för injektion, eller 5 % glukoslösning för injektion.
Tabell 1: Beredning av reducerade doser av Zerlinda 4 mg/100 ml lösning för infusion
|
Kreatininclearance vid start (ml/min) |
Avlägsna följande mängd av Zerlinda lösning för infusion (ml) |
Ersätt med följande volym av steril natriumkloridlösning 9 mg/dl (0,9 %), eller 5 % glukoslösning för |
Justerad dos (mg zoledronsyra i 100 ml) |
|
50-60 |
12,0 |
12,0 |
3,5 |
|
40-49 |
18,0 |
18,0 |
3,3 |
|
30-39 |
25,0 |
25,0 |
3,0 |
Zerlinda 4 mg/100 ml lösning för infusion får inte blandas med andra infusionslösningar utan skall administreras som en engångs intravenös infusion i en separat infusionsslang.
Patienter måste hållas väl hydrerade före och efter administrering av Zerlinda.
Varningar och försiktighet
Allmänt
Patienter måste undersökas innan Zerlinda administreras för att säkerställa att de är tillräckligt hydrerade.
Övervätskning skall undvikas hos patienter med risk för hjärtsvikt.
Hyperkalcemirelaterade metaboliska standardparametrar, som t.ex. serumnivåerna av kalcium, fosfat och magnesium måste noga följas efter att behandling med zoledronsyra inletts. Om hypokalcemi, hypofosfatemi eller hypomagnesemi uppkommer, kan korttidsbehandling behöva insättas. Patienter med obehandlad hyperkalcemi har i allmänhet viss grad av nedsatt njurfunktion, därför bör noggrann kontroll av njurfunktionen övervägas.
Patienter som behandlas med Zerlinda bör inte behandlas samtidigt med andra läkemedel som innehåller zoledronsyra, eller någon annan bisfosfonat, eftersom effekterna vid kombination av dessa läkemedel är okända.
Njurinsufficiens
Patienter med diagnosen TIH och tecken på försämring av njurfunktionen bör noggrant utredas med hänsyn tagen till om den tänkbara fördelen uppväger den möjliga risken av behandlingen med zoledronsyra.
I beslutet att behandla patienter med benvävnadsmetastaser för att förebygga skelettrelaterade händelser skall hänsyn tas till att effekten av behandlingen sätter in efter 2–3 månader.
Zoledronsyra har satts i samband med rapporter angående minskad njurfunktion. Faktorer som kan öka risken för försämring inkluderar dehydrering och tidigare förekomst av nedsatt njurfunktion, flera behandlingscykler med zoledronsyra och andra bisfosfonater, likaså användningen av andra nefrotoxiska läkemedel. Även om risken minskar då zoledronsyra administreras i dosen 4 mg under 15 minuter, kan ändå försämring av njurfunktionen inträffa. Försämrad njurfunktion, utveckling till njursvikt och dialys har rapporterats hos patienter efter den initiala dosen eller en engångsdos av 4mg zoledronsyra. Höjning av serumkreatinin förekommer också hos några patienter vid kronisk administration av zoledronsyra vid rekommenderade doser för att förebygga skelettrelaterade händelser, även om detta förekommer mindre ofta.
Patienter bör kontrolleras med avseende på serumkreatinin före varje dos av Zerlinda. Vid start av behandling av patienter med benvävnadsmetastaser samt med samtidig mild och måttlig njurnedsättning, rekommenderas lägre doser av zoledronsyra. Hos patienter som visar prov på försämrad njurfunktion under behandlingen, skall uppehåll göras i Zerlindabehandlingen. Behandlingen med Zerlinda skall endast återupptas när serumkreatininnivåerna har återgått till inom 10 % av utgångsvärdet. Zerlindabehandlingen skall återupptas med samma dos som gavs innan behandlingen avbröts.
På grund av den möjliga påverkan på njurfunktionen av zoledronsyra samt brist på kliniska säkerhetsdata för patienter med gravt nedsatt njurfunktion (definierades i kliniska studier som serumkreatinin ≥ 400 µmol/l eller ≥ 4,5 mg/dl för patienter med TIH respektive ≥ 265 µmol/l eller ≥ 3,0 mg/dl för patienter med cancer och benvävnadsmetastaser) vid start och endast begränsade farmakokinetiska data för patienter med gravt nedsatt njurfunktion vid start (kreatininclearance < 30 ml/min) kan inte användningen av Zerlinda rekommenderas till patienter med gravt nedsattnjurfunktion.
Leverinsufficiens
Då kliniska data endast finns i begränsad omfattning vad gäller patienter med gravt nedsatt leverfunktion kan inga speciella rekommendationer ges för denna patientkategori.
Osteonekros i käken
Osteonekros i käken (ONJ) har rapporterats som mindre vanligt förekommande i kliniska prövningar hos patienter som får zoledronsyra. Erfarenhet efter marknadsintroduktion och från litteraturen indikerar en större frekvens av ONJ-rapporter baserat på tumörtyp (avancerad bröstcancer, multipelt myelom). En studie visade att ONJ förekom i högre utsträckning hos myelompatienter jämfört med andra cancerformer (se avsnitt Farmakodynamik)
Start av behandling eller en ny behandlingsomgång bör uppskjutas hos patienter med oläkta öppna mjukdelslesioner i munnen, förutom vid medicinska nödsituationer. En tandundersökning med lämplig förebyggande tandvård och en individuell nytta-riskbedömning rekommenderas innan behandling med bisfosfonater hos patienter med samtidiga riskfaktorer.
Följande riskfaktorer bör beaktas vid bedömning av en individs risk att utveckla ONJ:
- Potensen av bisfosfonaten (högre risk för potenta substanser), administreringsväg (högre risk vid parenteral administrering) och kumulativ dos av bisfosfonater.
- Cancer, komorbida tillstånd (t.ex. anemi, blödningsrubbningar, infektion), rökning.
- Samtidig behandling: kemoterapi, angiogeneshämmare (se avsnitt Interaktioner), strålbehandling mot hals och huvud, kortikosteroider.
- Tidigare tandsjukdomar, dålig munhygien, parodontal sjukdom, invasiva tandingrepp (t.ex. tandextraktion) och dåligt anpassad tandprotes.
Alla patienter bör uppmuntras att upprätthålla en god munhygien, genomgå regelbundna tandkontroller, och omedelbart rapportera eventuella orala symtom som tandrörlighet, smärta eller svullnad eller sår som inte läker eller vätskar under behandling med Zerlinda.
Under behandling bör invasiva tandingrepp utföras enbart efter noggrann avvägning och bör undvikas nära inpå zoledronsyra administrering. För patienter som utvecklar osteonekros i käken under tiden de behandlas med bisfosfonater kan tandkirurgi göra att tillståndet exacerberas. För patienter som behöver genomgå tandingrepp, finns inga data tillgängliga som ger indikation om avbruten behandling med bisfosfonater minskar risken för osteonekros i käken.
Behandlingsplanen för patienter som utvecklar ONJ bör inrättas i nära samarbete mellan behandlande läkare och en tandläkare/käkkirurg med expertis inom ONJ. Tillfälligt avbrytande av zoledronsyrabehandling bör övervägas tills tillståndet förbättras och bidragande riskfaktorer begränsas om möjligt.
Osteonekros i andra kroppsdelar
Osteonekros i den yttre hörselgången har rapporterats vid användning av bisfosfonater, främst i samband med långvarig terapi. Möjliga riskfaktorer för osteonekros i den yttre hörselgången är bland annat steroidanvändning och kemoterapi och/eller lokala riskfaktorer såsom infektion eller trauma. Risken för osteonekros i den yttre hörselgången bör övervägas hos patienter som får bisfosfonater och som uppvisar öronsymtom såsom kroniska öroninfektioner.
Dessutom har det förekommit sporadiska rapporter om osteonekros i andra kroppsdelar, inklusive höften och lårbenet, främst rapporterade hos vuxna cancerpatienter som behandlas med zoledronsyra.
Muskuloskeletal smärta
Hos patienter som har behandlats med zoledronsyra har det efter marknadsintroduktionen rapporterats om svåra skelett-och ledsmärtor och/eller muskelsmärta, vilket i enstaka fall har medfört funktionsnedsättning. Emellertid har sådana rapporter varit sällan förkommande. Tiden till symptomets uppträdande varierade från en dag till flera månader efter påbörjad behandling. De flesta patienter erhöll lindring av symptomen efter att behandlingen avbrutits. En undergrupp fick återfall av symtomen då zoledronsyra eller annan bisfosfonat återinsattes.
Atypiska femurfrakturer
Atypiska subtrokantära och diafysära femurfrakturer har rapporterats vid behandling med bisfosfonater, främst hos patienter som behandlats under lång tid mot osteoporos. Dessa tvärgående eller korta, sneda frakturer kan inträffa var som helst längs femur, från strax under den mindre trokantern till strax ovanför de suprakondylära utvidgningarna. Frakturerna inträffar efter minimalt eller inget trauma och en del patienter upplever smärta i lår eller ljumske, ofta förenat med röntgenologisk stressfraktur, veckor till månader före den kompletta femurfrakturen. Frakturerna är ofta bilaterala, därför bör motsatt femur undersökas hos patienter som behandlats med bisfosfonater och som har ådragit sig en fraktur i femurskaftet. Dålig läkning av dessa frakturer har också rapporterats. Utsättning av bisfosfonatbehandling hos patienter med misstänkt atypisk femurfraktur bör övervägas i avvaktan på utvärdering av patienten och baseras på en individuell nytta/risk-bedömning.
Patienter som behandlas med bisfosfonater bör uppmanas att rapportera smärta i lår, höft eller ljumske och varje patient med sådana symptom bör utredas med frågeställningen inkomplett femurfraktur.
Hypokalcemi
Hypokalcemi har rapporterats hos patienter som behandlats med zoledronsyra. Hjärtarytmier och neurologiska biverkningar (inklusive konvulsioner, hypestesi och tetani) har rapporterats sekundärt till följd av allvarlig hypokalcemi. Uttalad hypokalcemi som krävt sjukhusvård har rapporterats. I vissa fall kan livshotande hypokalcemi uppträda (se avsnitt Biverkningar).
Försiktighet rekommenderas när Zerlinda administreras tillsammans med läkemedel som är kända för att orsaka hypokalcemi då de kan ha en synergisk effekt vilket kan leda till allvarlig hypokalcemi (se avsnitt Interaktioner) Serumkalcium skall kontrolleras och hypokalcemi måste åtgärdas innan behandling med Zerlinda inleds. Patienter skall erhålla adekvat tillägg av kalcium och vitamin D.
Hjälpämne
Natrium
Detta läkemedel innehåller 356 mg natrium per 100 ml påse, motsvarande 17,8 % av det av WHO rekommenderade maximala dagliga intaget av 2 g natrium för en vuxen.
Interaktioner
I kliniska studier har zoledronsyra administrerats samtidigt med vanligt förekommande cytostatika, diuretika, antibiotika och analgetika utan att interaktioner av klinisk betydelse har uppträtt. Zoledronsyra uppvisar ingen märkbar bindning till plasmaproteiner och inhiberar inte humana P450-enzymer in vitro (se avsnitt Farmakokinetik), men några regelrätta kliniska interaktionsstudier har inte utförts.
Försiktighet rekommenderas då bisfosfonater ges tillsammans med aminoglykosider, calcitonin eller loopdiuretika, eftersom dessa medel kan ha en additiv effekt, vilket leder till en lägre nivå av serumkalcium under längre perioder än nödvändigt (se avsnitt Varningar och försiktighet)..
Försiktighet skall iakttas när zoledronsyra används tillsammans med andra potentiellt nefrotoxiska läkemedel. Möjligheten att hypomagnesemi kan utvecklas under behandlingen bör också uppmärksammas.
Hos patienter med multipelt myelom kan risken för nedsatt njurfunktion öka när zoledronsyra används i kombination med talidomid.
Försiktighet ska iakttas när Zerlinda administreras med antiangiogena läkemedel eftersom en ökad incidens av osteonekros i käken (ONJ) har observerats hos patienter som behandlas med dessa läkemedel samtidigt.
Graviditet
Adekvata data från behandling av gravida kvinnor med zoledronsyra saknas. Studier på djur med zoledronsyra har visat reproduktionstoxicitet (se avsnitt Prekliniska uppgifter). Risken för människa är okänd. Zerlinda skall inte användas under graviditet. Kvinnor i fertil ålder bör avrådas från att bli gravida.
Amning
Det är inte känt om zoledronsyra passerar över i bröstmjölk. Zerlinda är kontraindicerat hos ammande kvinnor (se avsnitt Kontraindikationer)
Fertilitet
Potentiella oönskade effekter av zoledronsyra på fertilitet av föräldra- och F1-generationen studerades hos råttor. Detta visade förstärkta farmakologiska effekter som ansågs vara relaterade till substansens hämning av kalciummetabolismen i skelett, vilket resulterade i periparturient hypokalcemi, som är en klasseffekt av bisfosfonater, dystoci och tidigt avslutande av studien. Dessa resultat förhindrade således att en definitiv effekt av zoledronsyra på fertilitet hos människa kunde fastställas.
Trafik
Biverkningar såsom yrsel och somnolens kan ha effekt på förmågan att framföra fordon eller använda maskiner, varför försiktighet bör iakttas när zoledronsyra används i samband med bilkörning och användning av maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Inom tre dagar efter administrering av zoledronsyra, har en akutfasreaktion ofta rapporterats, med symtom inkluderande bensmärta, feber, trötthet, artralgi, myalgi, stelhet och artrit med efterföljande svullnad i leder. Dessa symtom är vanligen övergående inom några dagar (se beskrivning av vissa biverkningar).
Följande är de viktiga identifierade riskerna med zoledronsyra inom de godkända indikationerna:
Nedsatt njurfunktion, osteonekros i käken, akutfasreaktion, hypokalcemi, förmaksflimmer, anafylaxi, och interstitiell lungsjukdom Frekvenserna för var och en av dessa identifierade risker visas i tabell 2.
Lista med biverkningar i tabellform
Följande biverkningar, uppräknade i tabell 2, har sammanställts från kliniska prövningar och rapporter efter marknadsföring huvudsakligen vid kronisk behandling med 4 mg zoledronsyra:
Tabell 2
Biverkningarna har delats in i olika frekvenser med de vanligaste först i följande kategorier: Mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
|
Blodet och lymfsystemet |
|
|
Vanliga: |
Anemi |
|
Mindre vanliga: |
Trombocytopeni, leukopeni |
|
Sällsynta: |
Pancytopeni |
|
Immunsystemet |
|
|
Mindre vanliga: |
Överkänslighetsreaktioner |
|
Sällsynta: |
Angioneorotiska ödem |
|
Psykiska störningar |
|
|
Mindre vanliga: |
Oro, sömnstörningar |
|
Sällsynta: |
Förvirring |
|
Centrala och perifera nervsystemet |
|
|
Vanliga: |
Huvudvärk |
|
Mindre vanliga: |
Yrsel, parestesi, dysgeusi, hypoestesi, hyperestesi, darrningar, somnolens |
|
Mycket sällsynta: |
Konvulsioner, hypestesi och tetani (sekundärt till hypokalcemi) |
|
Ögon |
|
|
Vanliga: |
Konjunktivitet |
|
Mindre vanliga: |
Dimsyn, sklerit och orbital inflammation |
|
Sällsynta: |
Uveit |
|
Mycket sällsynta: |
Episklerit |
|
Hjärtat |
|
|
Mindre vanliga: |
Hypertoni, hypotension, förmaksflimmer, hypotension ledande till synkope eller cirkulationskollaps |
|
Sällsynta: |
Bradykykardi, hjärtarytmi (sekundärt till hypokalcemi |
|
Andningsvägar, bröstkorg och mediastinum |
|
|
Mindre vanliga: |
Dyspné, hosta, bronkkonstriktion |
|
Sällsynta: |
Interstitiell lungsjukdom |
|
Magtarmkanalen |
|
|
Vanliga: |
Illamående, kräkningar, minskad aptit |
|
Mindre vanliga: |
Diarré, förstoppning, buksmärta, dyspepsi, stomatit, muntorrhet |
|
Hud och subkutan vävnad |
|
|
Mindre vanliga: |
Klåda, utslag (inklusive erytematösa och fläckvisa utslag), ökad svettning |
|
Muskuloskeletala systemet och bindväv |
|
|
Vanliga: |
Värk i skelettet, muskelvärk, ledvärk, generell smärta |
|
Mindre vanliga: |
Muskelspasmer, osteonekros i käken |
|
Mycket sällsynta: |
Osteonekros i den yttre hörselgången (bisfosfonat klassbiverkning) ) och i andra kroppsdelar inklusive lårben och höft |
|
Njurar och urinvägar |
|
|
Vanliga: |
Nedsatt njurfunktion |
|
Mindre vanliga: |
Akut njursvikt, hematuri, proteinuri |
|
Sällsynta: |
Förvärvat Fanconis syndrom |
|
Allmänna symtom och/eller symtom vid administreringsstället |
|
|
Vanliga: |
Feber, influensaliknande syndrom (inklusive trötthet, stelhet, sjukdomskänsla och rodnad) |
|
Mindre vanliga: |
Asteni, perifera ödem, reaktioner vid injektionsstället (inklusive smärta, irritation, svullnad, skleros), bröstsmärtor, viktökning, anafylaktisk reaktion/chock, urtikaria |
|
Sällsynta: |
Artrit och svullnad i leder som ett symtom från akutfasreaktion |
|
Undersökningar |
|
|
Mycket vanliga: |
Hypofosfatemi |
|
Vanliga: |
Ökning av blodkreatinin och blodurea, hypokalcemi |
|
Mindre vanliga: |
Hypomagnesemi, hypokalemi |
|
Sällsynta: |
Hyperkalemi, hypernatremi |
Beskrivning av vissa biverkningar
Nedsatt njurfunktion
Zoledronsyra har satts i samband med rapporter angående minskad njurfunktion. I en poolad analys av säkerhetsdata från registreringsstudierna på förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser, var frekvensen av njurrelaterade oönskade händelser med misstänkt orsakssamband (biverkningar) för zoledronsyra enligt följande: multipelt myelom (3,2 %), prostatacancer (3,1 %), bröstcancer (4,3 %), lung- och andra solida tumörer (3,2 %). Faktorer som kan öka risken för försämring av njurfunktionen inkluderar dehydrering, redan existerande nedsatt njurfunktion, upprepade behandlingscykler med zoledronsyra eller andra bisfosfonater, liksom samtidig användning av nefrotoxiska läkemedel eller användning av kortare infusionstider än rekommenderat. Försämrad njurfunktion, progress mot njursvikt samt dialys har rapporterats hos patienter efter initial dos eller engångsdos av 4 mg zoledronsyra (se avsnitt Varningar och försiktighet).
Osteonekros i käken
Fall av osteonekros i käken har rapporterats i huvudsak hos cancerpatienter som behandlats med läkemedel som hämmar benresorption, såsom zoledronsyra (se avsnitt Varningar och försiktighet). Flera av dessa patienter fick också kemoterapi och kortikosteroider och hade tecken på lokal infektion inkluderande osteomyelit. Majoriteten av rapporterna hänför sig till cancerpatienter som har genomgått tandextraktioner eller andra tandkirurgiska ingrepp.
Förmaksflimmer
I en 3-årig, randomiserad, dubbel-blind, kontrollerad studie som utvärderade effekten och säkerheten av zoledronsyra 5 mg en gång årligen jämfört med placebo vid behandling av postmenopausal osteoporos (PMO), var den totala incidensen av förmaksflimmer 2,5 % (96 av 3 862) och 1,9 % (75 av 3 852) hos patienter som fick zoledronsyra 5 mg respektive placebo. Frekvensen av förmaksflimmer rapporterat som allvarlig biverkan var 1,3 % (51 av 3 862) och 0,6 % (22 av 3 852) hos patienter som fick zoledronsyra 5 mg respektive placebo. Obalansen som observerades i denna studie har inte observerats i andra studier med zoledronsyra, inklusive de med zoledronsyra 4 mg var 3:e till 4:e vecka hos onkologipatienter. Mekanismen bakom den ökade incidensen av förmaksflimmer i denna enskilda studie är okänd.
Akutfasreaktion
Denna biverkan består av en samling av symtom som inkluderar feber, myalgi, huvudvärk, smärta i extremiteter, illamående, kräkningar, diarré, artralgi och artrit med efterföljande svullnade i leder.. Tillslagstiden är ≤ 3 dagar efter infusion av zoledronsyra och reaktionen refereras också genom användning av termerna ”influensaliknande” eller ”post-dos” symtom.
Atypiska femurfrakturer
Efter marknadsföring har följande biverkningar rapporterats (frekvens: sällsynt): Atypiska subtrokantära och diafysära femurfrakturer (bisfosfonat klassbiverkning).
Hypokalcemirelaterade biverkningar
Hypokalcemi är en viktig fastställd risk för zoledronsyra inom godkända indikationer. Baserat på en genomgång av både kliniska studier och fallrapporter efter godkännandet finns tillräckliga bevis för ett samband mellan behandling med zoledronsyra, rapporterade fall av hypokalcemi och sekundär utveckling av hjärtarytmi. Dessutom ses ett samband mellan hypokalcemi och sekundära neurologiska biverkningar såsom konvulsioner, hypestesi och tetani (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Klinisk erfarenhet av akut intoxikation med zoledronsyra saknas. Felaktig administrering av doser upp till 48 mg av zoledronsyra har rapporterats. Patienter som har fått större doser än rekommenderat (se avsnitt Dosering) måste kontrolleras noga, eftersom nedsatt njurfunktion (inklusive njursvikt) och onormala värden av serumelektrolyter (inklusive kalcium, fosfor och magnesium) har observerats. I händelse av kliniskt betydelsefull hypokalcemi bör en intravenös infusion av kalciumglukonat ges.
Farmakodynamik
Zoledronsyra tillhör kategorin bisfosfonater, och verkar huvudsakligen på benvävnad. Den hämmar den osteoklastiska benresorptionen.
Bisfosfonaternas selektiva effekt på benvävnad grundar sig på deras höga affinitet till mineraliserat ben, men den exakta molekylära mekanism som leder till hämningen av osteoklastaktiviteten är fortfarande inte klarlagd. I långtidsstudier på djur hämmar zoledronsyra benresorptionen utan att ha någon negativ inverkan på benvävnadens bildning, mineralisering eller mekaniska egenskaper.
Förutom att vara en potent hämmare av benresorptionen har zoledronsyra också flera antitumöregenskaper som kan bidraga till dess sammantagna effekt vid behandlingen av metastaserande bensjukdom. Följande egenskaper har visats i prekliniska studier:
-
In vivo: Hämning av den osteoklastiska benresorptionen, som ändrar benmärgens mikromiljö och gör att den mindre främjar tillväxt av tumörceller, antiangiogen aktivitet och antismärtaktivitet.
-
In vitro: Hämning av osteoblasttillväxt, direkt cytostatisk och proapoptotisk aktivitet på tumörceller, synergistisk cytostatisk effekt med andra cancerläkemedel, anti-adhesions-/-invasionsaktivitet.
Kliniska studieresultat vid förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser
I den första, randomiserade, dubbelblinda, placebo-kontrollerade studien jämfördes zoledronsyra 4 mg med placebo vid prevention av skelettrelaterade händelser (SRE) hos prostatacancerpatienter. Zoledronsyra 4 mg reducerade signifikant andelen patienter som drabbades av åtminstone en skelettrelaterad händelse (SRE), fördröjde mediantiden till första SRE med mer än 5 månader samt minskade den årliga incidensen av händelser per patient för skelettmorbiditetskvoten. Analys av multipla händelser visade en 36 % riskreduktion i utveckling av SRE hos gruppen med zoledronsyra 4 mg jämfört med placebogruppen. Patienter som erhöll zoledronsyra 4 mg rapporterade mindre ökning av smärta än de som erhöll placebo, och skillnaden nådde signifikans vid 3, 9, 21 och 24 månader. Färre patienter med zoledronsyra 4 mg fick patologiska frakturer. Behandlingseffekterna var mindre uttalade hos patienter med osteosklerotiska lesioner. Effektresultaten summeras i tabell 3.
I en andra studie, som inkluderade andra solida tumörer än bröstcancer och prostatacancer, reducerade zoledronsyra 4 mg signifikant andelen patienter med en SRE, fördröjde mediantiden till första SRE med mer än 2 månader samt minskade skelettmorbiditetskvoten. Analys av multipla händelser visade en 30,7 % riskreduktion i utvecklingen av SRE i gruppen med zoledronsyra 4 mg jämfört med placebogruppen. Effektresultaten summeras i tabell 4.
Tabell 3: Effektresultat (patienter med prostatacancer som får hormonbehandling)
|
Varje skelettrelaterad händelse (SRE) |
Frakturer* |
Strålbehandling av benvävnad |
||||
|
Zoledronsyra 4 mg |
Placebo |
Zoledronsyra 4 mg |
Placebo |
Zoledronsyra 4 mg |
Placebo |
|
|
N |
214 |
208 |
214 |
208 |
214 |
208 |
|
Andelen patienter med SRE (%) |
38 |
49 |
17 |
25 |
26 |
33 |
|
p-värde |
0,028 |
0,052 |
0,119 |
|||
|
Mediantid till SRE (dagar) |
488 |
321 |
NR |
NR |
NR |
640 |
|
p-värde |
0,009 |
0,020 |
0,055 |
|||
|
Skelettmorbiditets- kvot |
0,77 |
1,47 |
0,20 |
0,45 |
0,42 |
0,89 |
|
p-värde |
0,005 |
0,023 |
0,060 |
|||
|
Riskreduktion av förekomsten av multipla händelser** |
36 |
- |
NA |
NA |
NA |
NA |
|
p-värde |
0,002 |
NA |
NA |
|||
* Inklusive vertebrala och icke-vertebrala frakturer
** Redovisar alla skelettrelaterade händelser, det totala antalet såväl som tid till varje händelse
NR Ej uppnått
NA Ej tillämplig
Tabell 4: Effektresultat (solida tumörer andra än bröst- och prostatacancer)
|
Varje skelettrelaterad händelse (SRE) |
Frakturer* |
Strålbehandling av benvävnad |
||||
|
Zoledronsyra 4 mg |
Placebo |
Zoledronsyra 4 mg |
Placebo |
Zoledronsyra 4 mg |
Placebo |
|
|
N |
257 |
250 |
257 |
250 |
257 |
250 |
|
Andelen patienter med SRE (%) |
39 |
48 |
16 |
22 |
29 |
34 |
|
p-värde |
0.039 |
0,064 |
0,173 |
|||
|
Mediantid till SRE (dagar) |
236 |
155 |
NR |
NR |
424 |
307 |
|
p-värde |
0,009 |
0,020 |
0,079 |
|||
|
Skelettmorbiditetskvot |
1,74 |
2,71 |
0,39 |
0,63 |
1,24 |
1,89 |
|
p-värde |
0,012 |
0,066 |
0,099 |
|||
|
Riskreduktion av förekomsten av multipla händelser** |
30,7 |
- |
NA |
NA |
NA |
NA |
|
p-värde |
0,003 |
NA |
NA |
|||
* Inklusive vertebrala och icke-vertebrala frakturer
** Redovisar alla skelettrelaterade händelser, det totala antalet såväl som tid till varje händelse
NR Ej uppnått
NA Ej tillämplig
I en tredje randomiserad, dubbelblind fas III-studie där zoledronsyra 4 mg eller 90 mg pamidronat administrerades var 3:e till 4:e vecka jämfördes patienter med multipelt myelom eller bröstcancer med minst en benvävnadslesion. Resultaten visade att zoledronsyra 4 mg hade en jämförbar effekt med pamidronat 90 mg vid prevention av SREs. Analys av multipla händelser avslöjade en signifikant riskreduktion på 16 % hos patienter som behandlades med zoledronsyra 4 mg jämfört med patienter som erhöll pamidronat. Effektresultaten summeras i tabell 5.
Tabell 5: Effektresultat (patienter med bröstcancer och multipelt myelom)
|
Varje skelettrelaterad händelse (SRE) (+TIH) |
Frakturer* |
Strålbehandling av benvävnad |
||||
|
Zoledronsyra 4 mg |
Pam 90 mg |
Zoledronsyra 4 mg |
Pam 90 mg |
Zoledronsyra 4 mg |
Pam 90 mg |
|
|
N |
561 |
555 |
561 |
555 |
561 |
555 |
|
Andelen patienter med SRE (%) |
48 |
52 |
37 |
39 |
19 |
24 |
|
p-värde |
0,198 |
0,653 |
0,037 |
|||
|
Mediantid till SRE (dagar) |
376 |
356 |
NR |
714 |
NR |
NR |
|
p-värde |
0,151 |
0,672 |
0,026 |
|||
|
Skelettmorbiditetskvot |
1,04 |
1,39 |
0,53 |
0,60 |
0,47 |
0,71 |
|
p-värde |
0,084 |
0,614 |
0,015 |
|||
|
Riskreduktion av förekomsten av multipla händelser** |
16 |
- |
NA |
NA |
NA |
NA |
|
p-värde |
0,030 |
NA |
NA |
|||
* Inklusive vertebrala och icke-vertebrala frakturer
** Redovisar alla skelettrelaterade händelser, det totala antalet såväl som tid till varje händelse
NR Ej uppnått
NA Ej tillämplig
Zoledronsyra 4 mg studerades också i en dubbel-blind, randomiserad, placebo-kontrollerad prövning med 228 patienter med dokumenterade skelettmetastaser från bröstcancer för att värdera effekten av 4 mg zoledronsyra vid skelettrelaterade händelser (SRE)-kvoten, beräknad som det totala antalet SRE (exkluderande hyperkalcemi och justerat för tidigare fraktur), dividerat med den totala riskperioden. Patienterna erhöll antingen 4 mg zoledronsyra eller placebo var fjärde vecka under ett år. Patienterna var jämnt fördelade mellan zoledronsyra-behandlade gruppen och placebogrupperna.
SRE-kvoten (händelser/person/år) var 0,628 för zoledronsyra och 1,096 för placebo. Andelen patienter med åtminstone en SRE (förutom hyperkalcemi) var 29,8 % i den zoledronsyra-behandlade gruppen jämfört med 49,6 % i placebogruppen (p=0,003). Mediantiden till början av första SRE nåddes inte i den zoledronsyra-behandlade gruppen vid slutet av studien och denna var signifikant förlängd jämfört med i placebogruppen (p=0,007). Zoledronsyra 4 mg minskade risken för SRE med 41 % i en multipel eventanalys (relativa risken =0,59, p=0,019) jämfört med placebo.
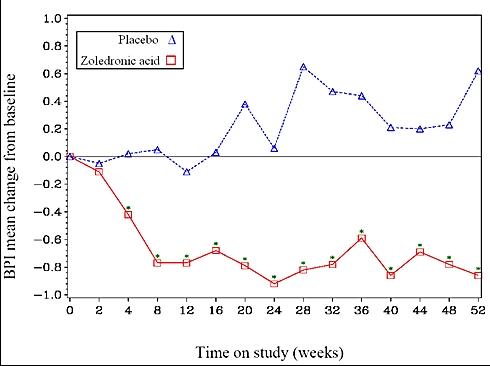
I den zoledronsyra-behandlade gruppen sågs en statistiskt signifikant förbättring i skattningen av smärta (enligt skalan Brief Pain Inventory, BPI) efter 4 veckor och vid varje efterföljande tidpunkt under studien, jämfört med i placebogruppen (figur 1). Smärtskattningen för zoledronsyra var konsekvent under startvärdet och smärtminskningen åtföljdes av en tendens till lägre skattning avseende förbrukning av smärtstillande läkemedel.
Figur 1: Medelvärde av förändringar från startvärdet i BPI-skalan. Statistiskt signifikanta skillnader är markerade (*p<0,05) för jämförelse mellan behandlingar (4 mg zoledronsyra vs. placebo)
CZOL446EUS122/SWOG -studien
Det primära målet med denna observationsstudie var att uppskatta den kumulativa förekomsten av osteonekros i käken (ONJ) vid år 3 hos cancerpatienter med benmetastaser som fick zoledronsyra. Behandling med osteoklasthämmare, annan cancerterapi och tandvård utfördes enligt klinisk praxis och nationella vårdprogram. En grundläggande tandläkarundersökning rekommenderades men var inte obligatorisk.
Bland de 3491 utvärderade patienterna bekräftades 87 fall av ONJ. Den totala uppskattade kumulativa förekomsten av bekräftad ONJ vid år 3 var 2,8% (95% KI: 2,3-3,5%). Förekomsten var 0,8% vid år 1 och 2,0% vid år 2. Vid bekräftad ONJ vid år 3 var andelen högst hos myelompatienter (4,3%) och lägst hos bröstcancerpatienter (2,4%). Fall av bekräftad ONJ var statistiskt signifikant högre hos patienter med multipelt myelom (p=0,03) än andra cancerformer tillsammans.
Kliniska testresultat vid behandling av TIH
Kliniska studier av tumörinducerad hyperkalcemi (TIH) visade att effekten av zoledronsyra karakteriseras av en minskning av kalcium i serum och av utsöndringen av kalcium i urinen. I dosfinnande fas I-studier av patienter med mild till moderat tumörinducerad hyperkalcemi (TIH), var de effektiva doser som testades i det ungefärliga intervallet 1,2–2,5 mg.
I syfte att utvärdera effekterna av 4 mg zoledronsyra kontra pamidronat (90 mg), sammanställdes resultaten av två pivotala multicenterstudier avseende patienter med TIH i en i förväg planerad analys. Det förelåg en snabbare normalisering av korrigerat serumkalcium på dag 4 för 8 mg zoledronsyra och på dag 7 för både 4 mg och 8 mg zoledronsyra. Följande frekvenser av behandlingssvar observerades:
Tabell 6: Andel med fullständigt behandlingssvar, fördelade per dag, i de kombinerade TIH-studierna
|
Dag 4 |
Dag 7 |
Dag 10 |
|
|
Zoledronsyra 4 mg (N=86) |
45,3 % (p=0,104) |
82,6 % (p=0,005)* |
88,4 % (p=0,002)* |
|
Zoledronsyra 8 mg (N=90) |
55,6 % (p=0,021)* |
83,3 % (p=0,010)* |
86,7 % (p=0,015)* |
|
Pamidronat 90 mg (N=99) |
33,3 % |
63,6 % |
69,7 % |
|
*p-värdena anges i förhållande till pamidronat. | |||
Mediantiden normokalcemi var 4 dagar. Mediantiden fram till recidiv (förnyad ökning av albuminkorrigerat serumkalcium ≥ 2,9 mmol/l) var 30 till 40 dagar för patienter som behandlats med zoledronsyra, mot 17 dagar för dem som behandlats med pamidronat 90 mg (p-värden: 0,001 för 4 mg och 0,007 för 8 mg zoledronsyra). Det förelåg inga statistiskt signifikanta skillnader mellan de båda doseringarna av zoledronsyra.
69 patienter, som efter kliniska studier fick återfall eller var behandlingsresistenta mot startbehandlingen (zoledronsyra 4 mg, 8 mg eller pamidronat 90 mg) erhöll förnyad behandling med zoledronsyra 8 mg. Andelen patienter som svarade på den andra behandlingen uppgick till 52 %. Eftersom de patienter som erhöll förnyad behandling endast behandlades med dosen 8 mg, finns det inga data tillgängliga som tillåter jämförelse med dosen 4 mg zoledronsyra.
I kliniska studier av patienter med tumörinducerad hyperkalcemi (TIH), var den totala säkerhetsprofilen bland de tre behandlingsgrupperna (zoledronsyra 4 och 8 mg samt pamidronat 90 mg) lika med avseende på typ och allvarlighetsgrad av biverkningar.
Pediatrisk population
Resultat av kliniska studier vid behandling av svår osteogenesis imperfecta hos pediatriska patienter från 1 års ålder till 17 år
Effekten av intravenös zoledronsyra vid behandling av pediatriska patienter (ålder från 1 till 17 år) med svår osteogenesis imperfecta (typ I; III och IV) jämfördes med intravenöst pamidronat i en internationell, multicenter, randomiserad, öppen studie med 74 respektive 76 patienter i varje behandlingsgrupp. Behandlingsperioden var 12 månader, vilken föregicks av 4 till 9 veckors screeningperiod där vitamin D och tillägg av elementärt kalcium gavs i åtminstone 2 veckor. I det kliniska programmet erhöll patienter i åldern 1 till < 3 år 0,025 mg/kg zoledronsyra (till en maximal engångsdos 0,35 mg) var tredje månad och patienterna från 3 till 17 år erhöll 0,05 mg/kg zoledronsyra (till en maximal engångsdos av 0,83 mg) var tredje månad. En förlängningsstudie genomfördes för att undersöka den allmänna säkerheten och njursäkerheten på lång sikt av zoledronsyra administrerat en eller två gånger per år under den förlängda 12 månaders behandlingen hos barn, vilka hade fullföljt ett års behandling med antingen zoledronsyra eller pamidronat i huvudstudien.
Studiens primära mätpunkt var procentuell ändring från startvärdet för bentäthet (BMD) i ländryggen efter 12 månaders behandling. Den estimerade effekten av behandling med avseende på BMD var jämförbar, men studiens design var inte tillräckligt robust för att med non-inferiority analys påvisa effekt med zoledronsyra. Framförallt sågs inget tydligt bevis för effekt på incidensen av frakturer eller på smärta. Biverkningar i form av frakturer i rörbenen i de nedre extremiteterna rapporterades hos ungefär 24 % (femur) och 14 % (tibia) av de zoledronsyrabehandlade patienterna jämfört med 12 % och 5 % hos de pamidronatbehandlade patienterna med svår osteogenesis imperfecta, oavsett sjukdomstyp och orsakssamband. Totala incidensen av frakturer var dock jämförbara mellan de zoledronsyrabehandlade patienterna och de pamidronatbehandlade patienterna: 43 % (32/74) jämfört med 41 % (31/76). Att tolka risken för fraktur försvåras av det faktum att frakturer är vanliga hos patienter med svår osteogenesis imperfecta, som en del av sjukdomsprocessen.
Typen av biverkningar som har observerats i denna population liknande de som tidigare setts hos vuxna med avancerade maligniteter, som involverar benvävnaden (se avsnitt Biverkningar). Biverkningarna är ordnade efter frekvenser och presenteras i tabell 7. Följande klassifikation används: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 7: Biverkningar som observerats hos barn med svår osteogenesis imperfecta1
|
Centrala och perifera nervsystemet |
||
|
Vanliga: |
Huvudvärk |
|
|
Hjärtat |
||
|
Vanliga: |
Takykardi |
|
|
Andningsvägar, bröstkorg och mediastinum |
||
|
Vanliga: |
Nasofaryngit |
|
|
Magtarmkanalen |
||
|
Mycket vanliga: |
Kräkningar, illamående |
|
|
Vanliga: |
Magsmärtor |
|
|
Muskuloskeletala systemet och bindväv | ||
|
Vanliga: |
Smärta i armar och ben, artralgi, muskuloskeletal smärta |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
||
|
Mycket vanliga: |
Pyrexi, trötthet |
|
|
Vanliga: |
Akutfasreaktion, smärta |
|
|
Undersökningar |
||
|
Mycket vanliga: |
Hypokalcemi |
|
|
Vanliga: |
Hypofosfatemi |
|
1Biverkningar med en frekvens < 5 % värderades medicinskt och det visades att dessa fall stämmer överens med den väletablerade säkerhetsprofilen för Zerlinda (se avsnitt Biverkningar)
Hos barn med svår osteogenesis imperfecta, verkar det finnas ett samband med zoledronsyra och mer uttalade risker för akutfasreaktioner, hypokalcemi och oförklarad takykardi vid jämförelse med pamidronat, men skillnaden minskar efter påföljande infusioner.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för zoledronsyra, för alla grupper av den pediatriska populationen för behandling av tumörinducerad hyperkalcemi och förebyggande av skelettrelaterade händelser hos patienter med avancerade benvävnadsmetastaser (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Engångs- och flergångsdoser, administrerade som 5- eller 15-minuters infusion av 2, 4, 8 eller 16 mg zoledronsyra, till 64 patienter med benmetastaser, genererade följande farmakokinetiska data, vilka konstaterades vara oberoende av dos.
Metabolism
Efter påbörjande av infusion med zoledronsyra ökar plasmakoncentrationen av zoledronsyra snabbt och uppnår sin topp vid slutet av infusionsperioden. Därefter följer en snabb nedgång till < 10 % av toppvärdet efter 4 timmar och < 1 % av toppvärdet efter 24 timmar. En utdragen period följer med mycket låga koncentrationer, ej överstigande 0,1 % av toppvärdet innan den andra infusionen av zoledronsyra på dag 28.
Eliminering
Intravenöst administrerad zoledronsyra elimineras i tre faser: ett snabbt bifasiskt försvinnande från systemcirkulationen, med halveringstider på ½α 0,24 respektive½β 1,87 timmar, följt av en lång eliminationsfas med en slutlig halveringstid på ½γ 146 timmar. Det skedde ingen ackumulation av zoledronsyra i plasma efter flergångsdoser av zoledronsyra givet var tjugoåttonde dag. Zoledronsyra metaboliseras inte och utsöndras i oförändrad form via njurarna. Under de första 24 timmarna återfinns 39 ± 16 % av den tillförda dosen i urinen, medan återstoden i huvudsak är bunden till benvävnad.
Från benvävnaden frisätts zoledronsyran mycket långsamt tillbaka till systemcirkulationen och elimineras via njurarna. Totalt clearance är 5,04 ± 2,5 l/timme, oberoende av dosen och utan påverkan av kön, ålder, ras och kroppsvikt. Vid ökning av infusionstiden från 5 till 15 minuter minskade koncentrationen av zoledronsyra vid slutet av infusionen med 30 %, men detta hade ingen påverkan på systemexponeringen.
Den interindividuella variabiliteten för de farmakokinetiska parametrarna är hög hos patienter, vilket också noterats för andra bisfosfonater.
Det finns inga farmakokinetiska data beträffande behandling med zoledronsyra av patienter med hyperkalcemi eller leverinsufficiens. Zoledronsyra hämmar inte humana P450-enzymer in vitro och uppvisar ingen biotransformation. I djurstudier återfanns < 3 % av den administrerade dosen i feces, vilket tyder på att leverfunktionen inte spelar någon betydande roll i zoledronsyras farmakokinetik.
Njurclearance av zoledronsyra korrelerade med kreatininclearance, där njurclearance motsvarar 75 ± 33 % av kreatininclearance, som hade ett medelvärde på 84 ± 29 ml/min (intervall 22 till 143 ml/min) hos de 64 patienter som studerades. Med populationsanalys visades att för en patient med kreatininclearance 20 ml/min (gravt nedsatt njurfunktion) eller 50 ml/min (måttlig nedsättning) motsvaras det uppskattade clearancevärdet för zoledronsyra av 37 % respektive 72 % av värdet för en patient med kreatininclearance på 84 ml/min. Endast begränsade farmakokinetiska data finns tillgängliga för patienter med grav njurinsufficiens (kreatininclearance <30 ml/min).
I en in vitro-studie uppvisade Zoledronsyra låg affinitet till de cellulära komponenterna i humant blod, med ett genomsnittligt förhållande blod-/plasmakoncetration av 0,59 inom ett koncentrationsspann av 30 ng/ml till 5000 ng/ml. Plasmaproteinbindningsgraden är låg, den obundna fraktionen sträcker sig från 60% vid 2 ng/ml till 77% vid 2000 ng/ml zoledronsyra.
Speciella populationer:
Pediatriska patienter
Begränsade farmakokinetikdata hos barn med svår osteogenesis imperfecta indikerar att farmakokinetiken av zoledronsyra hos barn i åldern 3 till 17 år liknar den hos vuxna vid liknande mg/kg dosnivåer. Ålder, kroppsvikt, kön och kreatininclearance verkar inte påverka den systemiska exponeringen av zoledronsyra.
Prekliniska uppgifter
Akuttoxicitet
Den högsta icke-letala engångsdosen vid intravenös administrering var 10 mg/kg kroppsvikt hos mus och 0,6 mg/kg hos råtta.
Subkronisk och kronisk toxicitet
Zoledronsyra tolererades väl när det administrerades subkutant till råttor och intravenöst till hundar i doser på upp till 0,02 mg/kg dagligen i 4 veckor. Administrering av 0,001 mg/kg/dag subkutant till råttor och 0,005 mg/kg intravenöst varannan till var tredje dag till hundar i upp till 52 veckor tolererades också väl.
Det vanligaste fyndet i studier med upprepad dosering var en ökning av primär spongiosa i metafysen i rörbenen på växande djur vid nästan samtliga dosnivåer. Detta fynd reflekterar substansens farmakologiska antiresorberande aktivitet.
Säkerhetsmarginalerna för påverkan på njurarna vid upprepad parenteral långtidsbehandling var små, men vid behandling med engångsdos (1,6 mg/kg) och vid upprepad dosering (0,06–0,6 mg/kg/dag), sågs inte någon njurpåverkan. Denna dosering är lika med eller högre än de terapeutiska doser som är avsedda att administreras till patienter. Långtidsbehandling med upprepade doser, omfattande de högsta doserna som är avsedda att ges till människa gav upphov till toxikologiska effekter i andra organ som mag-tarmkanalen, levern, mjälten, lungorna och vid injektionsställena.
Reproduktionstoxicitet
Zoledronsyra var teratogent på råtta vid subkutana doser ≥ 0,2 mg/kg. På kanin observerades ingen teratogenicitet eller fetotoxicitet, men däremot konstaterades maternell toxicitet. Försvårad förlossning observerades vid den lägsta dosen (0,01 mg/kg kroppsvikt) i djurförsök på råtta.
Mutagenicitet och karcinogen potential
Zoledronsyra var inte mutagent i de mutagenicitetstest som utfördes. Karcinogenicitetstest gav inga hållpunkter för någon karcinogen potential.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje infusionspåse med 100 ml lösning innehåller 4 mg zoledronsyra (som monohydrat).
En milliliter lösning innehåller 0,04 mg zoledronsyra (som monohydrat).
Hjälpämne med känd effekt:
Varje ml innehåller 3,56 mg natrium.
Förteckning över hjälpämnen
Natriumklorid
Mannitol (E421)
Natriumcitratdihydrat (E331)
Vatten för injektionsvätskor
Blandbarhet
Detta läkemedel får inte komma i kontakt med någon lösning som innehåller kalcium och det får inte blandas eller ges intravenöst med något annat läkemedel i samma infusionsslang.
Hållbarhet, förvaring och hantering
Oöppnad infusionspåse: 3 år.
Efter första öppnandet: Kemisk och fysisk stabilitet under användning har demonstrerats under 24 timmar i 2 °C–8 °C.
Ur mikrobiologisk synpunkt bör produkten användas omgående. Om användning inte sker omgående, är förvaringstider och förvaringsvillkoren innan administrering användarens ansvar och skall normalt inte överskrida 24 timmar vid 2 °C–8 °C.
Inga särskilda förvaringsanvisningar.
Ytterligare information om hantering av Zerlinda, inklusive riktlinjer för beredning av reducerade doser vid användning av infusionspåse med Zerlinda finns i avsnitt Dosering.
Aseptisk teknik måste följas under beredningen av infusionen. Avsett för engångsanvändning.
Den kylda lösningen skall sedan återfå rumstemperatur innan administrering.
Lösningen ska endast användas om den är klar och fri från missfärgning och partiklar.
Hälso- och sjukvårdspersonal tillråds att inte kassera oanvänd Zerlinda via avloppssystemet.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Förpackningsinformation
Infusionsvätska, lösning 4 mg/100 ml
Zerlinda 4 mg/100 ml är en klar och färglös lösning som levereras i en infusionspåse av plast med en yttre förpackning, samt två slangventiler med ett spetsventil-munstycke och en injektionsspets med en hatt som kan brytas av.
100 milliliter påse (fri prissättning), EF




